Селективные антагонисты рецептора iglur5 для лечения мигрени
Номер патента: 4290
Опубликовано: 26.02.2004
Авторы: Чэппелл Эми Сьюзон, Джонсон Кирк Уиллис, Филла Сандра Энн, Орнштейн Пол Лесли, Бликман Дэвид
Формула / Реферат
1. Применение 3S,4aR,6S,8aR-6-(((4-карбокси)фенил)метил)-1,2,3,4,4a,5,6,7,8,8a-декагидроизохинолин-3-карбоновой кислоты в качестве селективного антагониста рецептора iGluR5 для получения лекарственного средства для лечения мигрени.
2. Применение соединения формулы I
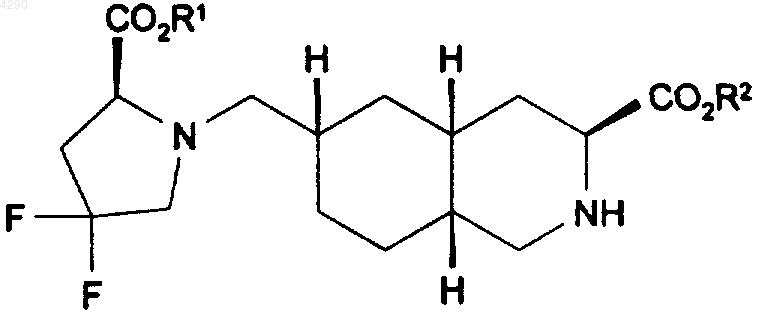
где каждый из R1 и R2 независимо представляет собой H, C1-C20алкил, или его фармацевтически приемлемой соли в качестве селективного антагониста рецептора iGluR5 для получения лекарственного средства для лечения мигрени.
3. Применение по п.2, отличающееся тем, что соединение формулы I выбрано из 3S,4aR,6S,8aR-этил 6-(((2S)-2-(этоксикарбонил)-4,4-дифторпирролидинил)метил)-1,2,3,4,4a,5,6,7,8,8a-декагидроизохинолин-3-карбоксилата или 3S,4aR,6S,8aR-6-(((2S)-2-(карбоновая кислота)-4,4-дифторпирролидинил)метил)-1,2,3,4,4a,5,6,7,8,8a-декагидроизохинолин-3-карбоновой кислоты.
4. Соединение формулы

где каждый из R1 и R2 независимо представляет собой H, C1-C20алкил или его фармацевтически приемлемая соль.
5. Соединение по п.4, отличающееся тем, что каждый из R1 и R2 независимо представляет собой H или C1-C6алкил.
6. Соединение, представляющее собой 3S,4aR,6S,8aR-этил 6-(((2S)-2-(этоксикарбонил)-4,4-дифторпирролидинил)метил)-1,2,3,4,4a,5,6,7,8,8a-декагидроизохинолин-3-карбоксилат или его фармацевтически приемлемую соль.
7. Соединение, представляющее собой 3S,4aR,6S,8aR-6-(((2S)-2-(карбоновая кислота)-4,4-дифторпирролидинил)метил)-1,2,3,4,4a,5,6,7,8,8a-декагидроизохинолин-3-карбоновую кислоту или его фармацевтически приемлемую соль.
8. Фармацевтическая композиция, включающая соединение по любому из пп.4-7 в сочетании с одним или более фармацевтически приемлемыми носителями, разбавителями или наполнителями.
9. Фармацевтическая композиция для лечения мигрени, включающая соединение по любому из пп.4-7 в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем.
10. Соединение, представляющее собой 3S,4aR,6S,8aR-этил 6-(((2S)-2-(этоксикарбонил)-4,4-дифторпирролидинил)метил)-1,2,3,4,4a,5,6,7,8,8a-декагидроизохинолин-3-карбоксилатЧманделат.
Текст
1 Известный уровень техники В центральной нервной системе (ЦНС) млекопитающих передача нервных импульсов контролируется путем взаимодействия между нейротрансмиттером, который секретируется эфферентным нейроном, и рецептором клеточной поверхности афферентного нейрона, который вызывает возбуждение данного афферентного нейрона. L-Глутамат, который является наиболее распространенным нейротрансмиттером ЦНС, опосредует большинство возбуждающих путей у млекопитающих и обозначается как возбуждающая аминокислота (ЕАА). Рецепторы, которые отвечают на глутамат, называют рецепторами возбуждающих аминокислотSci., 11, 25 (1990). Возбуждающие аминокислоты играют огромную физиологическую роль,участвуя во множестве физиологических процессов, таких как долговременная поддержка(обучения и памяти), развитие пластичности синапсов, контроль двигательной активности,дыхание, регуляция сердечно-сосудистой системы и чувствительность. Рецепторы возбуждающих аминокислот подразделяют на два общих типа. Рецепторы,которые непосредственно связаны с открытием катионных каналов в клеточной мембране нейронов, называют "ионотропными". Данный тип рецептора подразделяют, по меньшей мере, на три подтипа, которые определяют по деполяризующему действию селективных агонистов Nметил-D-аспартата (NMDA), -амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты(АМРА) и каиновой кислоты (КА). В молекулярно-биологических исследованиях установлено, что рецепторы АМРА состоят из субъединиц(GluR1-GluR4), которые могут объединяться,образуя функционирующие ионные каналы. Идентифицировано пять рецепторов каината,которые классифицируют как либо высокоаффинные (КА 1 и КА 2), либо низкоаффинные(GluR5, GluR6 и GluR7). Bleakman et al., Molecular Pharmacology, 49,4, 581, (1996). Вторым общим типом рецептора является"метаботропный" рецептор возбуждающих аминокислот, ассоциированный с G-белком или связанный с вторичным посредником. Данный второй тип связан со многими системами вторичных посредников, что ведет к усиленному гидролизу фосфоинозитидов, активации фосфолипазы D, увеличению или снижению образования цАМФ и изменению функционирования ионных каналов. Schoepp and Conn, Trends inPharmacol. Sci., 14, 13 (1993). Оба типа рецепторов появляются не только для опосредования нормальной синаптической передачи по возбуждающим путям, но участвуют также в моди 004290 2 фикации синаптических связей в онтогенезе и на протяжении всей жизни. Schoepp, Bockaert,and Sladeczek, Trends in Pharmacol. Sci., 11, 508Reviews, 15, 41 (1990). Избыточная или несоответствующая стимуляция рецепторов возбуждающих аминокислот ведет к повреждению нервных клеток или их потере в результате механизма, известного как возбуждающая токсичность. Предполагается, что данный процесс опосредует дегенерацию нейронов при множестве неврологических нарушений и состояний. Медицинские последствия такой дегенерации нейронов делают важной терапевтической целью снижение данных дегенеративных неврологических процессов. Возбуждающая токсичность возбуждающих аминокислот вовлечена в патофизиологию многих неврологических нарушений. Например,возбуждающая токсичность связана с этиологией мозговой недостаточности, являющейся следствием аортокоронарного шунтирования и трансплантации, инсульта, ишемии мозга, повреждений спинного мозга в результате травмы или воспаления, перинатальной гипоксии, остановки сердца и гипогликемического повреждения нейронов. Кроме того, возбуждающая токсичность вовлечена в хронические нейродегенеративные состояния, включая болезнь Альцгеймера, хорею Гантингтона, наследуемые атаксии,индуцированное СПИДом слабоумие, амиотрофический латеральный склероз, идиопатическую и индуцированную лекарствами болезнь Паркинсона, а также повреждение зрительного аппарата и ретинопатию. Другие неврологические нарушения, связанные с возбуждающей токсичностью и/или дисфункцией глутаматной передачи, включают спастичность мышц, включая треморы, толерантность к лекарствам и их отмене, отек мозга, конвульсивные расстройства, включая эпилепсию, депрессию, тревожность и нарушения, связанные с тревожностью,такие как синдром посттравматического стресса, отдаленная дискинезия и психоз, связанный с депрессией, шизофрения, биполярное нарушение, мании и лекарственную интоксикацию или зависимость. Кроме того, также сообщалось, что возбуждающая токсичность возбуждающих аминокислот участвует в этиологии состояний острой и хронической боли, включая тяжелую боль, некупируемую боль, невропатическую боль и посттравматическую боль. Предполагается, что применение нейропротекторного агента, такого как антагонист рецептора возбуждающих аминокислот, будет полезным для лечения или профилактики данных нарушений и/или для снижения количества неврологических повреждений, связанных с данными нарушениями. Антагонисты рецептора возбуждающих аминокислот могут также быть полезными в качестве обезболивающих агентов.Graham and Wolff (Arh. Neurol. Psychiatry, 39,737-63 (1938. Они предположили, что причиной головной боли при мигрени является вазодилятация внечерепных сосудов. В пользу данной точки зрения свидетельствуют данные о том, что алкалоиды спорыньи и суматриптан вызывают сокращение гладких мышц головных сосудов и эффективны при лечении мигрени. Суматриптан представляет собой гидрофильный агонист 5-НТ-1-подобных рецепторов серотонина и не проходит через гематоэнцефалический барьер (Humphrey, et al., Ann. NY Acad.Sci., 600, 587-600 (1990. Впоследствии было разработано несколько рядов соединений, которые, как считалось, могли использоваться для лечения мигрени, для оптимизации опосредуемой 5-НТ 1-подобной вазоконстрикторной активности суматриптана. Однако противопоказания суматриптана, включающие спазм коронарных сосудов, гипертонию и стенокардию, также являются результатом его вазоконстрикторной активности (MacIntyre, P.D., et al., British JournalJournal of Pharmacology, 161, 91-94 (1990. Хотя сосудистый механизм мигрени приобрел широкое признание, нет согласия относительно его доказанности. Например, Moskowitz показал, что наступление головных болей при мигрени не зависит от изменений диаметра сосудов (Cephalalgia, 12, 5-7, (1992. Известно,что тройничный ганглий и связанные с ним нервные пути связаны с болевой чувствительностью лица, такой как головная боль, в частности мигрень. Moskowitz предположил, что тройничные ганглии, которые иннервируют сосудистое русло в ткани головы, стимулируются неизвестными механизмами, что приводит к повышению выделения вазоактивных нейропептидов из аксонов, иннервирующих сосудистую сеть. Данные нейропептиды инициируют ряд событий,приводящих к нейрогенному воспалению мозговой оболочки, следствием чего является боль. Нейрогенное воспаление блокируется суматриптаном в дозах, сходных с теми, которые требуются для лечения острой мигрени у человека. Однако было обнаружено, что такие дозы суматриптана связаны с противопоказаниями,обусловленными сопутствующими вазоконстрикторными свойствами суматриптана (см. выше). 5-HT1D рецепторы вовлечены как посредники блокады транссудации нейрогенных белков (Neurology, 43 (suppl. 3), S16-S20 (1993. Кроме того, сообщалось, что 2, Н 3, mопиодные и соматостатиновые рецепторы могут также располагаться на волокнах сосудистой проекции тройничного ганглия и могут блокировать транссудацию нейрогенных белков 4 плазмы (Matsubara et al., Eur. J. Pharmacol., 224,145-150 (1992. Weinshank et al. сообщили, что суматриптан и некоторые алкалоиды спорыньи имеют высокое сродство к 5-HT1F рецептору серотонина, что предполагает участие 5-HT1F рецептора в развитии мигрени (WO93/14201). Опубликованная европейская патентная заявка 590789A1 и патенты Соединенных Штатов 5446051 и 5670516 раскрыли, что определенные соединения, производные декагидроизохинолина, являются антагонистами рецептора АМРА и пригодны для лечения многих различных состояний, включая боль и головную боль при мигрени. Недавно было сообщено, что все пять членов каинатного подтипа ионотропных глутаматных рецепторов экспрессируются на нейронах тройничного ганглия крыс. В частности,обнаружены высокие уровни GluR5 и КА 2 (Sahara et al., The Journal of Neuroscience, 17(17),6611 (1997. Simmons et al. сообщили, что рецептор каината подтипа GluR5 опосредует ноцицептивный ответ на формалин в крысиной модели постоянной боли (Neuropharmacology,37, 25 (1998. Кроме того, в WО 98/45270 ранее раскрыто, что антагонисты, селективные для рецептора iGluR5, пригодны для лечения боли,включая тяжелую, хроническую, некупируемую и невропатическую боль. Существенным является наблюдение о каинатных рецепторах, которые ранее не рассматривались как вовлеченные в этиологию головной боли при мигрени. В частности, селективные антагонисты рецептораiGluR5 не рассматривались ранее как пригодные для лечения мигрени. Неожиданно и в соответствии с настоящим изобретением заявители открыли, что селективные антагонисты подтипа рецептора iGluR5 эффективны в животной модели неврологического воспаления и, таким образом, могут быть полезны для лечения мигрени. Такие антагонисты могут предназначаться для необходимого длительного мягкого, безопасного и эффективного лечения мигрени без сопутствующих побочных эффектов. Тем самым это способствует лечению неврологических нарушений. Краткое изложение существа изобретения В настоящем изобретении представлено применение 3S,4aR,6S,8aR-6-4-карбокси)фенил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты в качестве селективного антагониста рецептора iGluR5 для получения лекарственного средства для лечения мигрени. В дополнительном аспекте в настоящем изобретении представлено соединение формулы I 5 где каждый из R1 и R2 независимо представляет собой Н, C1-С 20 алкил или его фармацевтически приемлемую соль. В другом варианте осуществления каждый из R1 и R2 независимо представляет собой Н илиC1-C6 алкил. Более конкретно соединение формулы I выбрано из 3S,4aR,6S,8 аR-этил 6-2S)-2(этоксикарбонил)-4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин 3-карбоксилата или 3S,4aR,6S,8aR-6-2S)-2(карбоновая кислота)-4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты. Кроме того, в настоящем изобретении представлено применение соединения формулыI или его фармацевтически приемлемой соли в качестве селективного антагониста рецептораiGluR5 для получения лекарственного средства для лечения мигрени. В другом варианте осуществления в настоящем изобретении представлено соединение,представляющее собой 3S,4aR,6S,8aR-этил 62S)-2-(этоксикарбонил)-4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилат или его фармацевтически приемлемая соль. Кроме того, в настоящем изобретении представлена фармацевтическая композиция,включающая каждое из вышеуказанных соединений в сочетании с одним или более фармацевтически приемлемыми носителями, разбавителями или наполнителями. В одном варианте осуществления указанную композицию используют для лечения мигрени. В настоящем изобретении также представлено соединение, представляющее собой 3S,4aR,6S,8aR-этил 6-2S)-2-(этоксикарбонил)4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилатманделат. Подробное описание изобретения В настоящем изобретении представлен способ лечения мигрени, который может быть продемонстрирован конкретным механизмом действия, торможением нейрогенной дуральной транссудации белка. При лечении страдающего мигренью соединением или композицией, которые являются селективным антагонистом рецептора iGluR5 относительно других возбуждаемых аминокислотами рецепторов, нейрогенная транссудация, которая опосредует мигрень,подавляется без сопутствующих побочных эффектов агентов, разработанных для оптимизации опосредуемого 5-HT1-подобного опосредуемого вазоконстрикторного действия суматриптана. Кроме того, в настоящем изобретении представлены соединения, действующие в качестве селективных антагонистов рецептораiGluR5, а также их фармацевтически приемлемые соли, пролекарства и композиции. 6 Применяемый здесь термин "фармацевтически приемлемая соль" относится к солям представленных здесь соединений, используемых при осуществлении изобретения, которые по существу нетоксичны по отношению к живым организмам. Типичные фармацевтически приемлемые соли включают те, которые получают с помощью взаимодействия соединений настоящего изобретения с фармацевтически приемлемой неорганической или органической кислотой или органическим или неорганическим основанием. Такие соли известны как аддитивные кислые соли и аддитивные основные соли. Специалисту в данной области должно быть понятно, что большинство или все соединения, используемые в настоящем изобретении,способны образовывать соли и что обычно применяют солевые формы фармацевтических средств, часто потому, что кристаллизовать и очищать их легче, чем свободные основания. Во всех случаях использования описанных здесь фармацевтических средств в виде солей рассматривается в данном описании, и часто предпочтительно, и фармацевтически приемлемые соли всех соединений включены в их названия. Кислоты, обычно применяемые для образования аддитивных кислых солей, представляют собой неорганические кислоты, такие как соляная кислота, бромисто-водородная кислота,иодисто-водородная кислота, серная кислота,фосфорная кислота и тому подобное, и органические кислоты, такие как п-толуолсульфокислота, метансульфокислота, щавелевая кислота, п-бромфенилсульфокислота, карбоновая кислота, янтарная кислота, лимонная кислота,бензойная кислота, уксусная кислота и тому подобное. Примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрогенфосфат, дигидрогенфосфат,метафосфат, пирофосфат, бромид, иодид, ацетат, пропионат, деканоат, каприлат, акрилат,формиат, гидрохлорид, дигидрохлорид, изобутират, капроат, гептаноат, пропиолат, оксалат,малонат, сукцинат, суберат, себакат, фумарат,малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, гидроксибензоат, метоксибензоат, фталат, ксилолсульфонат,фенилацетат, фенилпропионат, фенилбутират,цитрат, лактат, -гидроксибутират, гликолат,тартрат, метансульфонат, пропансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат,манделат и тому подобное. Предпочтительными фармацевтически приемлемыми аддитивными кислыми солями являются те, которые образуются с неорганическими кислотами, такими как соляная кислота и бромисто-водородная кислота, и те, которые образуются с органическими кислотами, такими как малеиновая кислота и метансульфокислота. 7 Аддитивные основные соли включают те,которые образуются из неорганических оснований, таких как гидроксиды аммония, щелочных или щелочно-земельных металлов, карбонаты,бикарбонаты и тому подобное. Таким образом,такие основания, пригодные для получения солей данного изобретения, включают гидроксид натрия, гидроксид калия, гидроксид аммония,карбонат калия, карбонат натрия, бикарбонат натрия, бикарбонат калия, гидроксид кальция,карбонат кальция и тому подобное. Особенно предпочтительны соли, образуемые калием и натрием. Следует понимать, что конкретный противоион, образующий часть любой соли данного изобретения, обычно не имеет решающего значения, в той мере, насколько соль в целом фармакологически приемлема и насколько противоион не привносит нежелательных качеств в соль как целое. Применяемый здесь термин "стереоизомер" относится к соединению, построенному из тех же самых атомов, соединенных теми же самыми связями, но имеющему различающиеся трехмерные структуры, которые не являются взаимозаменяемыми. Трехмерные структуры называют конфигурациями. Применяемый здесь термин "энантиомер" относится к двум стереоизомерам, молекулы которых не являются взаимоналагаемыми зеркальными отражениями друг друга. Термин "хиральный центр" относится к атому углерода, к которому присоединены четыре различные группы. Применяемый здесь термин "диастереомеры" относится к стереоизомерам, которые не являются энантиомерами. Кроме того, два диастереомера, которые имеют различную конфигурацию лишь по одному хиральному центру, обозначаются здесь как "эпимеры". Термины "рацемат", "рацемическая смесь" или "рацемическая модификация" относятся к смеси равных частей энантиомеров. Применяемый здесь термин "энантиомерное обогащение" относится к повышенному количеству одного энантиомера по сравнению с другим. Удобным способом выражения полученного энантиомерного обогащения является концепция энантиомерного избытка или "ее",который находят с помощью следующего уравнения: где Е 1 представляет собой количество первого энантиомера, а Е 2 представляет собой количество второго энантиомера. Таким образом, если исходное соотношение двух энантиомеров равно 50:50, как это имеет место в рацемической смеси, то при энантиомерном обогащении, достаточном для получения конечного отношения 50:30, "ее" в отношении первого энантиомера составляет 25%. Однако, если конечное отношение равно 90:10, то "ее" в отношении первого энантиомера составляет 80%. Предпочтительно, 004290 8 чтобы "ее" был больше 90%, наиболее предпочтительно, чтобы "ее" был больше 95%, и особенно наиболее предпочтительно, чтобы "ее" был больше 99%. Энантиомерное обогащение может быть легко определено специалистом с помощью стандартных способов и процедур,таких как газовая или высокоэффективная жидкостная хроматография с применением хиральной колонки. Выбор подходящей хиральной колонки, элюента и условий, необходимых для достижения разделения пары энантиомеров,также являются хорошо известными специалисту. Кроме того, энантиомеры соединений формулы I могут быть растворены специалистом с применением стандартных способов, хорошо известных в данной области техники, таких как описанные J. Jacques, et al., "Enantiomers, Racemates, and Resolution", John Wiley and Sons, Inc.,1981. Соединения настоящего изобретения имеют один или больше хиральных центров и могут существовать во множестве стереоизомерных конфигураций. Вследствие данных хиральных центров соединения настоящего изобретения существуют в виде рацематов, смесей энантиомеров и в виде отдельных энантиомеров, а также в виде диастереомеров и смесей диастереомеров. Все такие рацематы, энантиомеры и диастереомеры входят в объем настоящего изобретения. Применяемые здесь термины "R" и "S" применяются как обычно в органической химии для обозначения конкретной конфигурации хирального центра. Термин "R" (rectus) относится к такой конфигурации хирального центра, когда отношение старшинства групп по часовой стрелке (от старшей ко второй самой младшей) рассматривается вдоль связи в сторону самой младшей по старшинству группе. Термин "S"(sinister) относится к такой конфигурации хирального центра, когда отношение старшинства групп против часовой стрелки (от старшей ко второй самой младшей) рассматривается вдоль связи в сторону самой младшей по старшинству группе. Старшинство групп основывается на их атомном номере (в порядке снижения атомного номера). Частичный перечень старшинства и обсуждение стереохимии содержатся в "Nomenclature of Organic Compounds: Principles andPractice", (J. H. Fletcher, et al., eds., 1974) на стр. 103-120. Конкретные стереоизомеры и энантиомеры соединений формулы (I) могут быть получены специалистом с помощью известных способов и процессов, таких как раскрытые Eliel and Wilen,"Stereochemistry of Organic Compounds", Johnand Wilen, "Enantiomers, Racemates, and Resolutions", John WileySons, Inc., 1981. Например,конкретные стереоизомеры и энантиомеры могут быть получены с помощью стереоспецифи 9 ческих синтезов с применением энантиомерно и геометрически чистых или энантиомерно или геометрически обогащенных исходных материалов. Кроме того, конкретные стереоизомеры и энантиомеры могут быть растворены и выделены с помощью таких способов, как хроматография на хиральных неподвижных фазах, ферментативное разделение или фракционная перекристаллизация аддитивных солей, образуемых реактивами, применяемыми для данной цели. Специалисту также должно быть понятно,что все соединения, пригодные для способов настоящего изобретения, пригодны и для составления пролекарств. Применяемый здесь термин "пролекарство" относится к метаболически подвижному сложноэфирному или диэфирному производному функциональных кислотных соединений (лекарств), представленных или используемых в способах настоящего изобретения. При введении больному пролекарство подвергается ферментативному и/или химическому гидролитическому расщеплению таким образом, что выделяется исходная карбоновая кислота (лекарство) или, в виде частного случая,исходная дикарбоновая кислота. Во всех случаях подразумевается использование описанных здесь соединений в виде пролекарств, которое часто является предпочтительным, и таким образом пролекарства всех применяемых здесь соединений включаются в наименования соединений. Применяемый здесь термин "C1-C4 алкил" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из от 1 до 4 атомов углерода, и включает, но не ограничивается метилом, этилом, н-пропилом,изопропилом, н-бутилом, изобутилом и тому подобное. Применяемый здесь термин "C1-C6 алкил" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из от 1 до 6 атомов углерода, и включает, но не ограничивается метилом, этилом, н-пропилом,изопропилом, н-бутилом, изобутилом, третбутилом, н-пентилом, н-гексилом и тому подобное. Применяемый здесь термин "C1-C10 алкил" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из от 1 до 10 атомов углерода, и включает, но не ограничивается метилом, этилом, пропилом,изопропилом, н-бутилом, изобутилом, третичным бутилом, пентилом, изопентилом, гексилом, 2,3-диметил-2-бутилом, гептилом, 2,2 диметил-3-пентилом, 2-метил-2-гексилом, октилом, 4-метил-3-гептилом и тому подобное. Применяемый здесь термин "C1-C20 алкил" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из от 1 до 20 атомов углерода, и включает, но не ограничивается метилом, этилом, пропилом,изопропилом, бутилом, изобутилом, трет 004290 10 бутилом, пентилом, изопентилом, гексилом, 3 метилпентилом, 2-этилбутилом, н-гептилом, ноктилом, н-нонилом, н-децилом, н-ундецилом,н-додецилом, н-тридецилом, н-тетрадецилом, нпентадецилом, н-гексадецилом, н-гептадецилом,н-нонадецилом, н-эйкозилом и тому подобное. Применяемые здесь термины "Me", "Et","Pr", "iPr", "Bu" и "t-Bu" относятся к метилу,этилу, пропилу, изопропилу, бутилу и третбутилу соответственно. Применяемый здесь термин "C2-C6 алкенил" относится к линейной или разветвленной,одновалентной, ненасыщенной цепи, имеющей от двух до шести углеродных атомов. Типичные С 2-С 6 алкенильные группы включают этенил(также известный как винил), 1-метилэтенил, 1 метил-1-пропенил, 1-бутенил, 1-гексенил, 2 метил-2-пропенил, 1-пропенил, 2-пропенил, 2 бутенил, 2-пентенил и тому подобное. Применяемый здесь термин "арил" относится к одновалентной карбоциклической группе, содержащей одно или более слитных или неслитных фенильных колец, и включает, например, фенил, 1- или 2-нафтил, 1,2-дигидронафтил, 1,2,3,4-тетрагидронафтил и тому подобное. Применяемый здесь термин "C1-C6 алкиларил" относится к линейной или разветвленной,одновалентной, насыщенной алифатической цепи из от 1 до 6 атомов углерода, которая содержит арильную группу, присоединенную к алифатической цепи. В термин "C1-С 6 алкиларил" включены следующие соединения: и тому подобное. Применяемый здесь термин "(С 3-С 10)циклоалкил" относится к насыщенной углеводородной кольцевой структуре, содержащей от трех до десяти атомов углерода. Типичные С 3-С 10 циклоалкильные группы включают циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и тому подобное. Следует понимать, что "(С 3-С 8)циклоалкил" и "(С 4-С 6)циклоалкил" входят в понятие термина "(С 3-С 10)циклоалкил". Применяемый здесь термин "С 1-С 6 алкил(С 3-С 10)циклоалкил" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из от 1 до 6 атомов углерода, которая содержит (С 3-С 10)циклоалкил, присоединенный к алифатической цепи. В термин и тому подобное. Применяемый здесь термин "С 1-С 6 алкилморфолин" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из от 1 до 6 атомов углерода,которая содержит морфолин, присоединенный к алифатической цепи. В объем термина "С 1-С 6 алкилморфолин" включены следующие: и тому подобное. Применяемый здесь термин "N,N-С 1-С 6 диалкиламин" относится к атому азота, замещенному двумя линейными или разветвленными, одновалентными, насыщенными алифатическими цепями из 1-6 атомов углерода. В термин "N,N-С 1-С 6 диалкиламин" включены N(СН 3)2, -N(СН 2 СН 3)2, -N(СН 2 СH2 СН 3)2, N(СH2 СН 2 СН 2 СН 3)2 и тому подобное. Применяемый здесь термин "С 1-С 6 алкилN,N-С 1-С 6 диалкиламин" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из 1-6 атомов углерода,которая содержит N,N-С 1-С 6 диалкиламин, присоединенный к алифатической цепи. В термин и тому подобное. Применяемый здесь термин "С 1-С 6 алкилпирролидин" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из 1-6 атомов углерода, которая содержит пирролидин, присоединенный к алифатической цепи. В объем термина "С 1-С 6 алкилпирролидин" включены следующие соединения: и тому подобное. Применяемый здесь термин "С 1-С 6 алкилпиперидин" относится к линейной или разветвленной, одновалентной, насыщенной алифатической цепи из 1-6 атомов углерода, которая содержит пиперидин, присоединенный к и тому подобное. Обозначение относится к связи, которая выступает над плоскостью страницы. Обозначение " " относится к связи, которая находится за плоскостью страницы. Применяемый здесь термин "iGluR5" относится к подтипу 5 каинатного ионотропного глутаматного рецептора более широкого класса рецепторов возбуждающих аминокислот. Применяемый здесь термин "мигрень" относится к расстройству нервной системы, характеризующемуся повторяющимися приступами головной боли (которые не обусловлены структурными аномалиями мозга, такие как вызываемые опухолью или инсультом), желудочно-кишечными нарушениями и, возможно, неврологическими симптомами, такими как нарушения зрения. Характерные головные боли при мигрени обычно длятся один день и обычно сопровождаются тошнотой, рвотой и светобоязнью. Мигрень является "хроническим" состоянием. Применяемый здесь термин "хроническое" обозначает состояние с медленным прогрессированием и с долгой продолжительностью. Как таковое, хроническое состояние лечат после установления его диагноза, и лечение продолжают на протяжении хода болезни. Наоборот, термин "острый" обозначает резкое обострение заболевания или приступ с короткой продолжительностью, сопровождаемое периодом ремиссии. Таким образом, при лечении мигрени рассматриваются как острые обострения заболевания, так и хронические состояния,при остром обострении заболевания соединение вводят при проявлении симптомов и прекращают вводить при исчезновении симптомов. Как описано выше, хроническое состояние лечат на протяжении хода болезни. Применяемый здесь термин "пациент" относится к млекопитающему, такому как мышь, 13 песчанка, морская свинка, крыса, собака или человек, ясно, однако, что предпочтительным пациентом является человек. Понятно, что применяемый здесь термин"селективный антагонист рецептора iGluR5" включает те антагонисты рецептора возбуждающих аминокислот, которые селективно связываются с подтипом каинатного рецептораAMPA. Предпочтительно, чтобы селективный антагонист iGluR5 для использования в соответствии со способом настоящего изобретения обладал связывающим сродством по меньшей мере в 10 раз большим к iGluR5, чем к iGluR2, более предпочтительно, по меньшей мере, в 100 раз большим, кроме того, понятно, что любой селективный антагонист iGluR5, как ясно специалисту, включается в объем способов настоящего изобретения. Такие селективные антагонисты рецептора iGluR5 легко доступны или могут быть легко получены специалистом, с использованием известных процедур. Примеры селективных антагонистов рецептора iGluR5 включают, но не ограничиваются соединениями, предлагаемыми в WO 98/45270, полный объем которой включен здесь в качестве ссылки. Понятно также, что селективные антагонисты рецептора iGluR5 могут находиться в виде фармацевтически приемлемых солей, и соли,как таковые, следовательно, включаются в объем настоящего изобретения. Применяемые здесь каждый из терминов"лечение" или "лечить" предназначен для обозначения облегчения симптомов, устранения причины, вызывающей симптомы либо временно, либо на постоянной основе, и для профилактики, замедления появления или регрессирования развития или тяжести результирующих симптомов конкретного заболевания. Как таковые, способы данного изобретения охватывают как лечебное, так и профилактическое назначение. Применяемый здесь термин "эффективное количество" относится к количеству или дозе соединения, которое при введении больному в виде однократной или многократной дозы обеспечивает желаемый эффект у пациента, при диагносцировании или лечении заболевания. Эффективное количество может быть легко определено диагностом-специалистом в данной области с помощью известных способов и с помощью результатов обследования, полученных при аналогичных обстоятельствах. При определении эффективного количества или дозы вводимого соединения диагност должен учесть ряд факторов, включая, но не ограничиваясь этим, вид млекопитающего; его размер, возраст и общее состояние здоровья; степень поражения или тяжесть поражения мигренью; индивидуальную восприимчивость пациента; конкретное вводимое соединение; способ введения; харак 004290 14 теристики биологической доступности вводимого препарата; выбранную схему дозировки; использование сопутствующих лекарств и имеющие отношение другие обстоятельства. Обычная дневная доза должна содержать от приблизительно 0,01 до приблизительно 100 мг/кг каждого соединения, применяемого в настоящем способе лечения, предпочтительно,чтобы дневные дозы содержали от приблизительно 0,05 до приблизительно 50 мг/кг, более предпочтительно от приблизительно 0,1 до приблизительно 25 мг/кг. Селективные антагонисты iGluR5 для использования в соответствии со способами настоящего изобретения могут представлять собой отдельное соединение или сочетание соединений, способное функционировать в качестве селективного антагониста рецептора iGluR5. Например, это может быть сочетание соединения, способного функционировать в качестве антагониста рецептора iGluR5 и одного или более других глутаматных рецепторов, в сочетании с одним или более соединениями, способными блокировать его действие на рецепторiGluR2. Понятно, однако, что селективный антагонист iGluR5 для использования в способах настоящего изобретения предпочтительно является одиночным соединением. Предпочтительным путем введения соединений, применяемых в настоящем изобретении,является пероральное введение одиночного соединения или сочетания соединений, способных действовать в качестве селективного антагониста рецептора iGluR5. Пероральное введение,однако, не является единственным путем введения и даже не является единственным предпочтительным путем. Другие предпочтительные пути введения включают внутрикожный, чрескожный, внутривенный, внутримышечный,интраназальный, трансбуккальный или ректальный пути. Когда селективный антагонист рецептора iGluR5 вводят в виде сочетания соединений, одно из соединений можно вводить одним путем, таким как пероральный, а другое можно вводить внутрикожным, чрескожным, внутривенным, внутримышечным, интраназальным,трансбуккальным или ректальным путем, в зависимости от конкретных обстоятельств. Путь введения может варьироваться любым образом,ограничиваясь физическими свойствами соединений и удобством для больного и лечащего врача. Соединения, применяемые в настоящем изобретении, можно вводить в виде фармацевтических композиций и, следовательно, фармацевтические композиции, включающие указанные соединения, являются важными вариантами осуществления настоящего изобретения. Такие композиции могут иметь любую физическую форму, которая является фармацевтически приемлемой, но фармацевтические композиции,вводимые перорально, являются особенно пред 15 почтительными. Такие фармацевтические композиции содержат эффективное количество селективного антагониста рецептора iGluR5, причем эффективное количество относится к суточной дозе вводимого соединения. Каждая единица дозы может содержать суточную дозу данного соединения или может содержать часть суточной дозы, такую как половина или одна треть дозы. Количество каждого соединения,содержащегося в каждой единице дозы, зависит от свойств конкретного соединения, выбранного для терапии, и других факторов, таких как показания, по которым его назначают. Фармацевтические композиции настоящего изобретения могут быть составлены так, чтобы обеспечить быстрое, пролонгированное или отсроченное высвобождение активного ингредиента после введения пациенту при применении хорошо известных процедур. Композиции предпочтительно составляют в дозированной лекарственной форме, причем каждая доза содержит приблизительно от 1 до приблизительно 500 мг каждого соединения индивидуально или в единице дозированной лекарственной формы, более предпочтительно от приблизительно 5 до приблизительно 300 мг(например, 25 мг). Термин "дозированная лекарственная форма" относится к физически дискретной единице, подходящей в качестве единиц дозировки для пациента, причем каждая единица содержит предварительно определенное количество активного материала, по расчетам вызывающее желаемый терапевтический эффект, в сочетании с подходящим фармацевтическим носителем, разбавителем или наполнителем. Инертные ингредиенты и способ составления фармацевтических композиций являются традиционными. Здесь могут быть применены обычные способы составления, используемые в фармакологической науке. Могут быть применены все из обычных типов композиций, включая таблетки, жевательные таблетки, капсулы,растворы, парентеральные растворы, интраназальные спреи или порошки, пастилки, суппозитории, кожные пластыри и суспензии. В целом,композиции содержат от приблизительно 0,5 до приблизительно 50% соединений в сумме в зависимости от желаемых доз и типа применяемой композиции. Количество соединения, однако, наилучшим образом определяется как "эффективное количество", что обозначает количество каждого соединения, которое обеспечивает желаемую дозу у пациента, нуждающегося в таком лечении. Активность соединений, применяемых в настоящем изобретении, не зависит от природы композиции, следовательно, композиции выбирают и составляют исключительно из удобства и экономии. Капсулы получают путем смешивания соединения с подходящим разбавителем и заполнения надлежащего количества смеси в капсу 004290 16 лы. Обычные разбавители включают инертные порошкообразные вещества, такие как крахмалы, порошкообразная целлюлоза, особенно кристаллическая и микрокристаллическая целлюлоза, сахара, такие как фруктоза, маннит и сахароза, мука зерновых и сходные съедобные порошки. Таблетки получают путем прямого сжатия,с помощью влажного гранулирования или с помощью сухого гранулирования. В их состав обычно включают разбавители, связующие агенты, смазывающие средства и разрыхлители,наряду с соединением. Обычные разбавители включают, например, различные типы крахмала,лактозу, маннит, каолин, фосфат или сульфат кальция, неорганические соли, такие как хлористый натрий, и порошкообразный сахар. Пригодны также производные порошковой целлюлозы. Типичными связующими агентами таблетки являются такие вещества, как крахмал,желатин и сахара, такие как лактоза, фруктоза,глюкоза и тому подобное. Удобны также природные и искусственные смолы, включая камедь, альгинаты, метилцеллюлозу, поливинилпирролидин и тому подобное. В качестве связующих агентов также могут служить полиэтиленгликоль, этилцеллюлоза и воски. Таблетки часто покрывают сахарами в качестве корригента и герметика. Соединения могут быть также составлены в виде жевательных таблеток с помощью применения в составах больших количеств соединений с приятным вкусом, таких как маннит, что является хорошо известной практикой. В настоящее время также часто используют быстрорастворимые композиции на основе таблеток для того, чтобы обеспечить возможность применения нужной дозы, и для избежания трудностей при проглатывании твердых препаратов, что вызывает неудобства у некоторых больных. В таблеточных составах часто необходимо смазывающее средство для предохранения таблетки и сохранения стоматологических штампов. Смазывающее средство выбирают из таких снижающих трение твердых веществ как тальк,стеарат магния и кальция, стеариновая кислота и гидрогенизированные растительные масла. Разрыхлители таблеток представляют собой вещества, которые набухают при увлажнении, разрушают таблетку и высвобождают соединение. Они включают крахмалы, глины,целлюлозы, альгины и смолы. Более конкретно,могут быть использованы, например, кукурузный и картофельный крахмалы, метилцеллюлоза, агар, бентонит, древесная целлюлоза, порошкообразная природная губка, катионообменные смолы, альгиновая кислота, гуаровая смола, мякоть цитрусовых, карбоксиметилцеллюлоза, а также лаурилсульфат натрия. Часто используют композиции для всасывания в тонком кишечнике для защиты активного ингредиента от сильно кислого содержимого желудка. Такие композиции получают путем покрытия твердой лекарственной формы пленкой из полимера, который не растворим в кислой среде и растворим в основной среде. Примерами пленок являются фталат ацетилцеллюлозы, поливинилацетофталат, фталат гидроксипропилметилцеллюлозы и ацетосукцинат гидроксипропилметилцеллюлозы. Если желательно вводить соединение в виде суппозитория, могут быть использованы обычные подходы. Кокосовое масло представляет собой традиционную основу для суппозиториев, которая может быть модифицирована добавлением восков для небольшого повышения точки плавления. Широко применяются также смешиваемые с водой основы для суппозиториев, включающие, в частности, полиэтиленгликоли различной молекулярной массы. Недавно стали популярными трансдермальные пластыри. Обычно они включают смолистую композицию, в которой лекарства должны быть растворены или частично растворены, которые приводят в контакт с кожей при помощи пленки,которая защищает композицию. В последнее время появились многие пациенты, применяющие данный способ. Могут быть использованы также другие,более сложные композиции на основе пластырей,особенно те из них, которые имеют мембрану с многочисленными порами, через которые лекарства всасываются за счет осмотического эффекта. В следующей таблице представлен иллюстративный перечень композиций, которые могут быть использованы для соединений, применяемых в настоящем изобретении. Далее представлены иллюстрации изобретения, которые не должны рассматриваться как ограничивающие настоящее изобретение. Композиция 1. Твердые желатиновые капсулы получают с применением следующих ингредиентов: Активный ингредиент Крахмал, сухой Стеарат магния Всего Указанные выше ингредиенты смешивают и помещают в твердые желатиновые капсулы в количестве 460 мг. Композиция 2. Таблетку получают с использованием следующих ингредиентов: Активный ингредиент Целлюлоза микрокристаллическая Двуокись кремния, взвесь Стеариновая кислота Всего 18 Компоненты смешивают и прессуют для получения таблеток массой 665 мг каждая. Композиция 3. Получают аэрозольный раствор, содержащий следующие компоненты: Активный ингредиент Этанол Газ-вытеснитель 22 (хлордифторметан) Всего Активное соединение смешивают с этанолом, смесь добавляют к части Propellant 22, охлажденного до -30 С, и переносят в устройство для наполнения. Затем необходимое количество подается в контейнер из нержавеющей стали и разводят оставшимся газом-вытеснителем. После этого контейнер оснащают клапанными коробками. Композиция 4. Таблетки, каждая из которых содержит 60 мг активного ингредиента, получают следующим образом: Активный ингредиент Крахмал Микрокристаллическая целлюлоза Поливинилпирролидон Натрийкарбоксиметилкрахмал Стеарат магния Тальк Всего Активный ингредиент, крахмал и целлюлозу пропускают через сито No. 45 меш США и тщательно перемешивают. С полученными порошками смешивают раствор поливинилпирролидона, после чего пропускают через сито No. 14 меш США. Полученные таким образом гранулы сушат при 50 С и пропускают через сито No. 18 меш США. После этого к гранулам добавляют предварительно пропущенные через сито No. 60 меш США натрийкарбоксиметилкрахмал, стеарат магния и тальк, и после смешивания прессуют в машине для таблетирования для получения таблеток массой 150 мг каждая. Композиция 5. Капсулы, каждая из которых содержит 80 мг лекарства, получают следующим образом: Активный ингредиент Крахмал Микрокристаллическая целлюлоза Стеарат магния Всего Активный ингредиент, целлюлозу, крахмал и стеарат магния перемешивают, пропускают через сито No. 45 и наполняют ими твердые желатиновые капсулы в количестве по 200 мг. Композиция 6. Суппозитории, каждый из которых содержит 225 мг активного ингредиента, могут быть получены следующим образом: Активный ингредиент Глицериды насыщенных жирных кислот Всего Активный ингредиент пропускают через сито No. 60 меш США и суспендируют в глицеридах насыщенных жирных кислот, предварительно расплавленных с помощью минимально необходимого нагревания. Смесь затем выливают в отливочную форму суппозитория с номинальной емкостью 2 мл и дают ей охладиться. Композиция 7. Суспензии, каждая из которых содержит 50 мг лекарства на дозу 5 мл, получают следующим образом: Активный ингредиент Натрийкарбоксиметилцеллюлоза Сироп Раствор бензойной кислоты Отдушка Краситель Очищенная вода до суммарного объема Лекарство пропускают через сито No. 45 меш США и смешивают с натрийкарбоксиметилцеллюлозой и сиропом для образования однородной мази. Раствор бензойной кислоты,отдушку и краситель разводят некоторым количеством воды и добавляют при перемешивании. После этого добавляют воду в количестве, достаточном для получения требуемого объема. Композиция 8. Композиция для внутривенного введения может быть получена следующим образом: Активный ингредиент Маннит 5 н Гидроксид натрия Очищенная вода до суммарного объема Специалисту понятно, что приведенные выше процедуры могут быть применены к способу лечения мигрени, включающему введение пациенту эффективного количества соединения,которое обладает активностью селективного антагониста рецептора iGluR5. Подавление дуральной транссудации нейронального белка является характерным механизмом способа данного изобретения. В соответствии с дополнительными условиями способа соединения, проявляющие такое подавление,также проявляли бы селективное связывание и ингибирование рецептора iGluR5. Ниже описаны набор соединений, примененных для иллюстрации принципа настоящего изобретения, и фармакологические тесты, используемые для 20 демонстрации механистической эффективности изобретения. Полагают, что имеющиеся здесь соединения III, IV(а) и IV(b) представляют собой новые соединения и как таковые не были ранее описаны в качестве селективных антагонистов рецептора iGluR5 и о которых не сообщалось как об эффективных в лечении мигрени. Следовательно, соединения III, IV(а) и IV(b) представлены в качестве дополнительных вариантов осуществлений настоящего изобретения. Следующие примеры иллюстрируют способы настоящего изобретения. Реактивы и исходные материалы легко доступны специалисту. Данные примеры предназначены лишь для иллюстрации и их не следует толковать как ограничивающие объем изобретения каким-либо образом. Применяемые здесь термины имеют указанные значения: "в.в." обозначает внутривенно; "п.о." обозначает перорально; "в.б." обозначает внутрибрюшинно; "эквив." обозначает эквиваленты; "г" обозначает граммы; "мг" обозначает миллиграммы; "л" обозначает литры;"мл" обозначает миллилитры; "мкл" обозначает микролитры; "моль" обозначает моли; "ммоль" обозначает миллимоли; "psi" обозначает фунты на квадратный дюйм; "мм рт.ст." обозначает миллиметры ртутного столба; "мин" обозначает минуты; "ч" обозначает часы; "C" обозначает градусы Цельсия; "ТСХ" обозначает тонкослойную хроматографию; "ВЭЖХ" обозначает высокоэффективную жидкостную хроматографию; "Rt" обозначает время удержания; обозначает часть на миллион ниже области тетраметилсилана; "ТГФ" обозначает тетрагидрофуран; "ДМФ" обозначает"МТВЕ" обозначает метиловый эфир трет-бутила;"Кi" обозначает константу диссоциации комплекса фермент-антагонист и служит в качестве показателя связывания лиганда; "ID50" и "ID100" обозначают дозы вводимого лекарственного агента, которые вызывают соответственно 50 и 100% снижение физиологического ответа. Пример 1. Соединение I. 3S,4aR,6S,8aR-6-4-Карбокси)фенил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновая кислота. 1: хиральный Специалисту должно быть очевидно, что соединение I представляет собой антагонист рецептора возбуждающих аминокислот, селективный в отношении подтипа iGluR5 рецептора. Соединение I может быть легко получено спе 21 циалистом, следуя признанным общим процедурам, описанным в патенте США 5446051, и более конкретно - как недавно опубликовано в международной патентной заявке WO 98/45270,опубликованной 15 октября 1998 г. Соединение II. 3S,4aR,6S,8aR-6-1 Н-Тетразoл-5-ил)метил)oкси)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновая кислота. 1: хиральный Специалисту должно быть очевидно, что соединение II представляет собой антагонист рецептора возбуждающих аминокислот, селективный в отношении подтипа iGluR5 рецептора. Соединение II может быть легко получено и выделено специалистом, следуя известным общим процедурам, описанным в патенте США 5670516 (см. пример 11, соединение 7), и более конкретно - как недавно опубликовано в международной патентной заявке WO 98/45270,опубликованной 15 октября 1998 г. Соединение III. 1: хиральный Соединение III представляет собой новое соединение, действующее в качестве селективного антагониста рецептора iGluR5. СоединениеIII может быть легко получено; желаемый энантиомер может быть оптически выделен, а фармацевтические композиции, включающие соединение III, могут быть легко составлены в соответствии с общими способами, по существу как описано для примера 8, соединение 8 патента США 5670516, полное содержание которого включено здесь в качестве ссылки. Соединение IV(b). 3S,4aR,6S,8aR-Этил 62S)-2-(этоксикарбонил)-4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилат. А. Получение 3S,4aR,6S,8aR-этил 6-4 метилфенил)сульфонилокси)метил)-2-метоксикарбонил-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилата. К раствору 15,0 г (50,1 ммоль) гидроксиметильного промежуточного продукта (см. Col. 11-12, схемы II патента США 5356902, полное содержание которого включено здесь в качестве ссылки), охлажденному до 0 С в CH2Cl2 22 Реакционную смесь нагревали до комнатной температуры и перемешивали 16 ч, после чего подвергали распределению между СН 2 Сl2 и 10% водным NaHSO4. Водный слой экстрагировали СН 2 Сl2 и объединенные органические соединения сушили над MgSO4, фильтровали и концентрировали под вакуумом. Колоночная хроматография (10-50% EtOAc/гек-сан) обеспечивала выход 20,1 г (89%) указанного желаемого промежуточного соединения в виде бесцветного масла: МС(m/е): 451,5 (М+) Вычислено для C22H31NO7S 0,1 СН 2 Сl2: ожидаемое: С, 57,45; Н, 6,81; N, 3,03. Обнаружено: С, 57,76; Н, 6,93; N, 3,35. 13 С ЯМР (ДМСО-d6):171,4, 144,8, 132,4,130,1, 127,6, 74,6, 60,4, 53,1, 52,4, 44,1, 34,6, 31,8,31,0, 29,8, 28,8, 24,9, 23,3, 21,0, 14,0. В. Получение 3S,4aR,6S,8aR-этил 63S,5S)-5-(этоксикарбонил)-3-гидроксипирролидинил)метил)-2-метоксикарбонил-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилата. Смесь этилового эфира транс-4-гидроксиL-пролина (6,5 г, 33,1 ммоль), соединения описанной выше стадии А (10,0 г, 22,0 ммоль) и карбоната калия (4,6 г, 33,1 ммоль) нагревали с обратным холодильником в ацетонитриле (22 мл) в течение 60 ч. Реакционную смесь охлаждали до комнатной температуры и подвергали распределению между CH2Cl2 и водой. Водный слой экстрагировали дважды СН 2 Сl2, и объединенные органические соединения сушили надEtOAc/гексан и затем 5% МеОН/СН 2 Сl2) обеспечивала выход 9,2 г (95%) желаемого указанного промежуточного соединения в виде бесцветного масла:MC(m/e): 441,3 (М+) Вычислено для C22H36N2O7S: ожидаемое: С, 59,98; Н, 8,24; N, 6,36. Обнаружено: С, 60,17; Н, 8,23; N, 6,42. С. Получение 3S,4aR,6S,8 аR-этил 6-5S)5-(этоксикарбонил)-3-оксопирролидинил)метил 2-метоксикарбонил-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилата. К раствору ДМСО (2,3 мл, 32,5 ммоль),охлажденному до -78 С в СН 2 Сl2 (25 мл), по каплям добавляли оксалилхлорид (1,4 мл, 16,3 ммоль). Реакционную смесь перемешивали в течение 5 мин, после чего добавляли соединение описанной выше стадии В (6,0 г, 13,6 ммоль), растворенное в 20 мл CH2Cl2. После перемешивания в течение 45 мин при -78 С добавляли триэтиламин (9,5 мл, 32,5 ммоль). Реакционную смесь нагревали до комнатной температуры в течение приблизительно 2 ч и гасили добавлением 10% водного NaHSO4. Водный слой экстрагировали CH2Cl2 и объединенные органические соединения сушили над MgSO4,фильтровали и концентрировали под вакуумом. Колоночная хроматография (25-50% EtOAc/ге 23 ксан) обеспечивала выход 4,6 г (78%) указанного желаемого соединения в виде бесцветного масла: МС(m/е): 439,1 (M+)D. Получение 3S,4aR,6S,8 аR-этил 6-2S)2-(этоксикарбонил)-4,4-дифторпирролидинил) метил)-2-метоксикарбонил-1,2,3,4,4 а,5,6,7,8,8 адекагидроизохинолин-3-карбоксилата. К смеси соединения описанной выше стадии С (4,62 г, 10,5 ммоль), охлажденной до -78 С вCH2Cl2 (50 мл), охлажденной до -78 С, по каплям добавляли диэтиламиносератрифторид (3,5 мл, 26,3 ммоль). Реакционной смеси давали нагреться до комнатной температуры, перемешивали еще в течение 48 ч, после чего гасили добавлением МеОН. После концентрирования под вакуумом остаток подвергали распределению между СH2 Сl2 и насыщенным водным NаНСО 3. Водный слой экстрагировали CH2Cl2 и объединенные органические соединения сушили над MgSO4, фильтровали и концентрировали под вакуумом. Колоночная хроматография (25-50% EtOAc/гексан) обеспечивала выход 3,3 г (68%) указанного желаемого промежуточного соединения в виде бесцветного масла: МС(mе): 461,2 (М+) Вычислено для С 22 Н 34F2O6: ожидаемое; C,57,38; H, 7,44; N, 6,08. Обнаружено: С, 57,28; Н,7,52; N, 6,13. Е. Получение 3S,4aR,6S,8 аR-этил 6-2S)2-(этоксикарбонил)-4,4-дифторпирролидинил) метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилата (соединения IV(b. Раствор соединения описанной выше стадии D (3,3 г, 7,10 ммоль) растворяли в CH2Cl2(40 мл), охлаждали до 0 С, и к нему добавляли триметилсилилиодид (3,0 мл, 21,3 ммоль). Реакционной смеси давали нагреться до комнатной температуры, перемешивали еще в течение 4 ч,после чего гасили добавлением насыщенного водного NаНСО 3 (50 мл). Водный слой экстрагировали CH2Cl2 и объединенные органические соединения промывали 1 н раствором тиосульфата натрия, сушили над MgSO4, фильтровали и концентрировали под вакуумом. Вещество хроматографировали (2%МеОН/СН 2 Сl2), растворяли в 20 мл Et2O и к нему добавляли 50 мл раствора HCl/Et2O. Растворитель удаляли под вакуумом, что обеспечивало выход 2,6 г (76%) указанного конечного соединения в виде белого твердого вещества: МС(m/е): 403,4 (М+) Вычислено для C20H32Cl2F2N2O4: ожидаемое: С, 50,53; Н, 7,21; N, 5,89. Обнаружено: С,50,90; Н, 7,41; N, 5,84. 13 С ЯМР (D2 О):170,3, 167,7, 125,1 (т, JC-F=249,1 Гц), 65,9, 65,0, 64,1, 63,4, 60,1 (т, JC-F=33,9 Гц), 57,6,52,8, 42,9, 37,2 (т, JC-F=26,4 Гц), 34,5, 31,7, 31,3, 30,5,28,4, 26,9, 24,3, 13,6. Соединение IV(а). 3S,4aR,6S,8aR-6-2S)2-(карбоновая кислота)-4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновая кислота. Раствор 3S,4aR,6S,8 аR-этил 6-2S)-2(этоксикарбонил)-4,4-дифторпирролидинил)метил)-2-метоксикарбонил-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилата (3,3 г, 7,10 ммоль), соединения описанной выше стадии D,растворенного в 5 н НСl (15 мл), нагревали при 90 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Полученную сырую пену растворяли в воде (75 мл) и перемешивали в присутствии ионообменной смолы Dowex 50 Х 8(100-200) (10 г) в течение 2 ч. Смолу фильтровали, промывали последовательно 1:1 ТГФ/Н 2O и водой, после чего перемешивали в присутствии смеси 10% пиридин/Н 2 О в течение 2 ч. После фильтрации смолу промывали водой, и фильтрат концентрировали под вакуумом для получения указанного соединения (0,6 г, 97%) в виде белой пены: МС(m/е): 347,2 (М+) Вычислено для C16H24F2N2O4 0,1 Н 2 О: ожидаемое: С, 55,19; Н, 7,01; N, 8,05. Обнаружено: С, 54,81; Н, 6,82; N, 8,13. 13 С ЯМР (D2O):175,1, 171,1, 125,6 (т, JC-F=249,4 Гц), 67,9, 63,0, 59,3 (т, JC-F=34,0 Гц), 54,5, 42,5, 37,5 (т,JC-F=24,9 Гц), 34,3, 32,7, 32,4, 30,6, 28,2, 27,0, 24,3. Пример 2. Для установления того, что подтип рецептора iGluR5 опосредует транссудацию нейрогенного белка, что является функциональной характеристикой мигрени, прежде всего с помощью стандартных способов измеряют сродство связывания набора соединений с рецептором iGluR5. Например, активность соединений,действующих в качестве антагонистов рецептора iGluR5, может быть определена с помощью анализа радиолигандного связывания с клонированным и экспрессированным рецепторомChannels 3; 41-49) и с помощью электрофизиологической записи токов при фиксированном потенциале на целых клетках свежевыделенных нейронов ганглия заднего корешка (Bleakman etal., 1996, Mol. Pharmacol. 49; 581-585). Далее может быть определена избирательность соединений, действующих на подтип рецептораiGluR5, путем сравнения антагонистической активности на рецепторе iGluR5 с антагонистической активностью на других АМРА и каинатных рецепторах. Способы, пригодные для подобных сравнительных исследований, включают: изучение рецептор-лигандного связывания и электрофизиологическую запись при фиксированном потенциале на целых клетках функциональной активности рецепторов GluR1, GluR2,GluR3 и GluR4 человека (Fletcher et al., 1995, Recept. Channels 3; 21-31); изучение рецептор 25 лигандного связывания и электрофизиологическую запись при фиксированном потенциале на целых клетках функциональной активности рецепторов GluR6 человека (Ноо et al., Recept.Channels 2; 327-338); и электрофизиологическую запись при фиксированном потенциале на целых клетках функциональной активности рецепторов АМРА в свежевыделенных нейронах Пуркинье мозжечка (Bleakman et al., 1996, Mol.Pharmacol. 49; 581-585) и других тканях, экспрессирующих рецепторы АМРА (Fletcher andLodge, 1996, Pharmacol. Ther. 70; 65-89). Профили сродства связывания антагонистов с iGluR5 Были использованы линии клеток(НЕК 293), стабильно трансфецированных рецепторами iGluR человека. На клетках, экспрессирующих iGluR1, iGluR2, iGluR3 и iGluR4, определяли вытеснение 3[H]AMPA возрастающими концентрациями антагониста, а вытеснение 3[Н]каината (КА) измеряли на клетках, экспрессирующих iGluR5, iGluR6, iGluR7 и КА 2. Определяемая связывающая активность антагонистов(Ki) в мкМ была измерена для соединений I-IV. В качестве показателя селективности также определяли отношение сродства связывания с рецептором подтипа iGluR2 АМРА к сродству связывания с рецептором каината подтипа iGluR5. Предлагаемые в настоящем изобретении соединения проявляли сродство связывания к iGluR5,превышающее таковое к iGluR2 по меньшей мере в 10 раз, более предпочтительно по меньшей мере в 100 раз. Пример 3. Для определения способности каждого соединения из набора подавлять транссудацию белка, представляющую собой характерный функциональный показатель нейронального механизма мигрени, была использована следующая модель на животном. Результаты, полученные с помощью данной модели для набора соединений, суммированы в табл. I (см. ниже). Животная модель дуральной транссудации белка Крыс линии Harlan Sprague-Dawley (225325 г) или морских свинок от Charles RiverLaboratories (225-325 г) анестезировали внутрибрюшинным введением пентобарбитала натрия(65 мг/кг или 45 мг/кг, соответственно) и помещали в камеру для стереотаксиса (David KopfInstruments) с установкой ограничителя резца 3,5 мм для крыс или -4,0 мм для морских свинок. После проведения срединного сагиттального надреза кожи черепа в черепе высверливали две пары билатеральных отверстий (6 мм назад,2,0 и 4,0 мм вбок у крыс; 4 мм назад, 3,2 и 5,2 мм вбок у морских свинок, все координаты отнесены к темени). Через отверстия в оба полушария погружали стимулирующие электроды из нержавеющей стали, покрытые, за исключением кончиков, изоляцией, на глубину 9 мм (крысы) или 10,5 мм (морские свинки) от твердой оболочки. 26 Обнажали бедренную вену и внутривенно(в.в.) вводили дозу изучаемого соединения при объеме дозы 1 мл/кг, или, в другом варианте,тестируемое соединение вводили перорально(п.о.) через желудочный зонд в объеме 2,0 мл/кг. Приблизительно через 7 мин после в.в. инъекции также внутривенно вводили флуоресцентный краситель Evans Blue в дозе 50 мг/кг. EvansBlue образовывал комплексы с белками крови и служил в качестве маркера транссудации белка. Ровно через 10 мин после введения тестируемого соединения левый тройничный ганглий стимулировали в течение 3 мин при силе тока 1,0 мА (5 Гц, длительность 4 мс) с помощью потенциостата/гальваностата модели 273 (EGGPrinceton Applied Research). Через 15 мин после стимуляции животных забивали и обескровливали с помощью 20 мл физиологического раствора. Верхнюю часть черепа удаляли для облегчения сбора мембран твердой оболочки. Образцы мембран, отобранных с обоих полушарий, промывали водой и распластывали на стеклах для микроскопии. После высушивания ткани заливали раствором 70% глицерин/вода. Для количественного определения красителя Evans Blue в каждом образце применяли флуоресцентный микроскоп (Zeiss), снабженный дифракционным монохроматором и спектрофотометром. Применяли длину возбуждения приблизительно 535 нм, и определяли интенсивность испускания при 600 нм. Микроскоп был снабжен моторизованной платформой и подсоединен к персональному компьютеру. Это облегчало контролируемое с помощью компьютера передвижение платформы с измерением флуоресценции в 25 точках (шаги по 500 мм) каждого образца твердой оболочки. С помощью компьютера по результатам измерений определяли среднее и стандартное отклонение. Транссудация, вызванная электрической стимуляцией тройничного ганглия, носила ипсилатеральный характер (т.е. происходила только на той стороне твердой оболочки, на которой производили стимуляцию тройничного ганглия). Это позволило применять другую (нестимулированную) половину твердой оболочки в качестве контроля. Вычисляли отношение показателя транссудации в твердой оболочке стимулированной стороны к показателю транссудации в нестимулированной стороне. У контрольных животных, получавших только физраствор, отношение равнялось приблизительно 2,0 у крыс и приблизительно 1,8 у морских свинок. Напротив, соединение, которое эффективно предотвращало транссудацию в твердую оболочку стимулированной стороны, должно было давать отношение приблизительно 1,0. Для каждого из набора соединений были получены кривые доза-ответ, и была примерно вычислена доза, которая тормозила транссудацию на 50% (ID50) или 100% (ID100). Соответст 27 вующие величины ID50 и/или ID100 для каждого из соединений набора, примененных в настоящем изобретении, суммированы в таблице ниже. Подавление дуральной транссудации белка, нг/кг Соединение Путь введения ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение 3S,4aR,6S,8aR-6-4 карбокси)фенил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты в качестве селективного антагониста рецептораiGluR5 для получения лекарственного средства для лечения мигрени. 2. Применение соединения формулы I где каждый из R1 и R2 независимо представляет собой Н, C1-C20 алкил, или его фармацевтически приемлемой соли в качестве селективного антагониста рецептора iGluR5 для получения лекарственного средства для лечения мигрени. 3. Применение по п.2, отличающееся тем, что соединение формулы I выбрано из 3S,4aR,6S,8aRэтил 6-2S)-2-(этоксикарбонил)-4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилата или 3S,4aR,6S,8aR-6-2S)2-(карбоновая кислота)-4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8a-декагидроизохинолин-3-карбоновой кислоты. где каждый из R1 и R2 независимо представляет собой Н, C1-C20 алкил или его фармацевтически приемлемая соль. 5. Соединение по п.4, отличающееся тем,что каждый из R1 и R2 независимо представляет собой Н или C1-C6 алкил. 6. Соединение, представляющее собой 3S,4aR,6S,8aR-этил 6-2S)-2-(этоксикарбонил)4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилат или его фармацевтически приемлемую соль. 7. Соединение, представляющее собой 3S,4aR,6S,8aR-6-2S)-2-(карбоновая кислота)4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновую кислоту или его фармацевтически приемлемую соль. 8. Фармацевтическая композиция, включающая соединение по любому из пп.4-7 в сочетании с одним или более фармацевтически приемлемыми носителями, разбавителями или наполнителями. 9. Фармацевтическая композиция для лечения мигрени, включающая соединение по любому из пп.4-7 в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем. 10. Соединение, представляющее собой 3S,4aR,6S,8aR-этил 6-2S)-2-(этоксикарбонил)4,4-дифторпирролидинил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоксилатманделат.
МПК / Метки
МПК: A61P 25/06, C07D 401/06, A61K 31/00
Метки: селективные, антагонисты, iglur5, лечения, рецептора, мигрени
Код ссылки
<a href="https://eas.patents.su/15-4290-selektivnye-antagonisty-receptora-iglur5-dlya-lecheniya-migreni.html" rel="bookmark" title="База патентов Евразийского Союза">Селективные антагонисты рецептора iglur5 для лечения мигрени</a>
Предыдущий патент: Способ изготовления плоских деревянных палочек
Следующий патент: Новые соединения 3-имино-1,2-дитиола, способ их получения и фармацевтические композиции, их содержащие
Случайный патент: Набор для ингаляции с ингаляционным порошком, содержащим тиотропий












