Производные [6,7-дигидро-5h-имидазо[1,2-&alpha]имидазол-3-сульфониламино]-пропионамида
Номер патента: 8443
Опубликовано: 29.06.2007
Авторы: Лемьё Рене Марк, Ким Чин Ми, Келли Теренсе Алфред
Формула / Реферат
1. Соединение формулы I
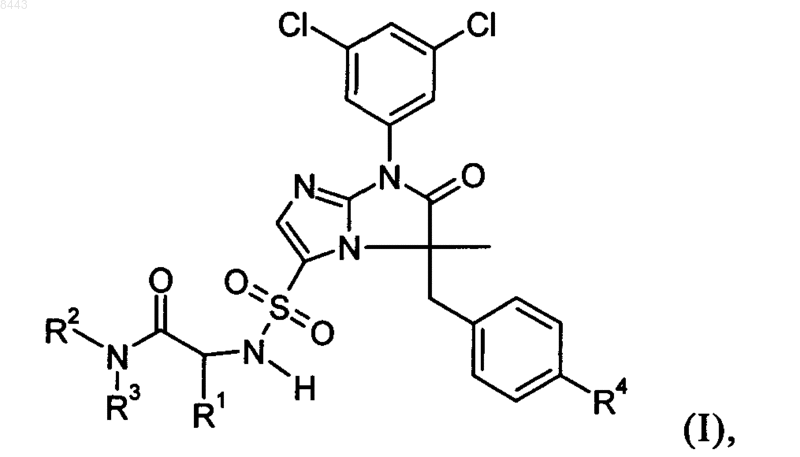
где R1 представляет собой линейный или разветвленный алкил с 1-3 атомами углерода, который является необязательно моно- или дизамещенным группами, независимо выбранными из группы, состоящей из
(i) оксо и
(ii) морфолино;
R2 и R3, каждый независимо, выбран из группы, состоящей из
(А) водорода и
(Б) линейного или разветвленного алкила с 1-4 атомами углерода, где алкильная группа является моно- или дизамещенной группами, независимо выбранными из группы, состоящей из
(i) CONH2 и
(ii) ОН,
или R2 и R3 вместе с атомом азота между ними образуют пиперазиновое кольцо; и
R4 представляет собой
(A) циано,
(Б) пиримидин, который является моно- или дизамещенным NH2 или
(B) трифторметокси;
или его фармацевтически приемлемая соль.
2. Соединение формулы I по п.1, где
R1 представляет собой метильную группу;
R2 и R3, каждый независимо, выбран из группы, состоящей из
(А) водорода и
(Б) линейного или разветвленного алкила с 1-4 атомами углерода, который является моно- или дизамещенным группами, независимо выбранными из группы, состоящей из
(i) CONH2 и
(ii) ОН; и
R4 представляет собой
(А) циано или
(Б) трифторметокси;
или его фармацевтически приемлемая соль.
3. Соединение формулы I по п.1 или 2, где
R1 представляет собой метильную группу;
R2 и R3, каждый независимо, выбран из группы, состоящей из
(А) водорода и
(Б) линейного или разветвленного алкила с 1-4 атомами углерода, который является моно- или дизамещенным группами, независимо выбранными из группы, состоящей из
(i) CONH2 и
(ii) ОН; и
R4 представляет собой трифторметокси;
или его фармацевтически приемлемая соль.
4. Соединение формулы I по пп.1, 2 или 3, имеющее абсолютную стереохимию, представленную формулой I*
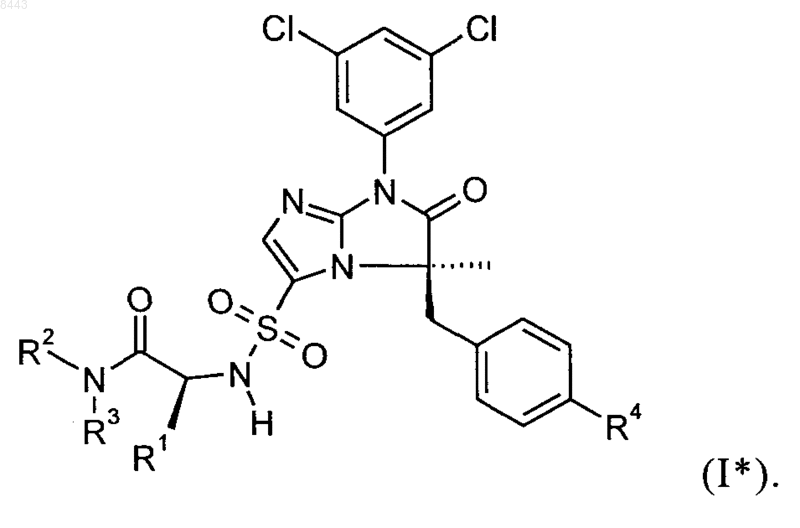
5. Соединение по пп.1, 2, 3 или 4, выбранные из группы, состоящей из
(а) (S)-2-[(R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо-6,7-дигидро-5H-имидазо[1,2-a]имидазол-3-сульфониламино]пропионамида;
(б) (S)-2-[(R)-7-(3,5-дихлорфенил)-5-метил-6-оксо-5-(4-трифторметоксибензил)-6,7-дигидро-5H-имидазо[1,2-a]имидазол-3-сульфониламино]-N-(2-гидрокси-2-метилпропил)пропионамида;
(в) (S)-2-[(R)-7-(3,5-дихлорфенил)-5-метил-6-оксо-5-(4-трифторметоксибензил)-6,7-дигидро-5H-имидазо[1,2-a]имидазол-3-сульфониламино]пропионамида и
(г) (S)-N-карбамоилметил-2-[(R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо-6,7-дигидро-5H-имидазо[1,2-a]имидазол-3-сульфониламино]пропионамида;
или их фармацевтически приемлемые соли.
6. Фармацевтическая композиция, включающая соединение по пп.1-4 или 5 и по крайней мере один фармацевтически приемлемый носитель, разбавитель или эксципиент.
7. Применение соединения по пп.1-4 или 5 в качестве лекарственного средства.
8. Применение соединения по пп.1-4 или 5 для получения фармацевтической композиции для лечения воспаления или воспалительного состояния у пациента.
9. Применение по п.8, где излечиваемым состоянием является взрослый респираторный дистрессовый синдром, шок, кислородная токсичность, синдром множественных повреждений органов, вторичный к септицемии, синдром множественных повреждений органов, вторичный к травме, реперфузионное повреждение ткани, обусловленное сердечно-легочным байпассом, инфаркт миокарды или применение с тромболитическими агентами, острый гломерулонефрит, васкулит, реакционный артрит, дерматоз с острыми воспалительными компонентами, инсульт, термическая травма, гемодиализ, лейкаферез, язвенный колит, некротический энтероколит и синдром, связанный с переносом гранулоцитов.
10. Применение по п.8, где излечиваемым состоянием является псориаз, отторжение трансплантата органа/ткани, реакции хозяина против трансплантата или аутоиммунные заболевания, включающие синдром Raynaud, аутоиммунный тироидит, дерматит, рассеянный склероз, ревматоидный артрит, инсулин-зависимый сахарный диабет, ювеит, воспалительное заболевание кишечника, болезнь Крона, язвенный колит и системная красная волчанка.
11. Применение по п.8, где излечиваемым состоянием является астма.
12. Применение по п.8, где излечиваемым состоянием являются токсичные действия цитокиновой терапии.
13. Способ получения соединения формулы I по п.1, который включает реакцию соединения формулы IX
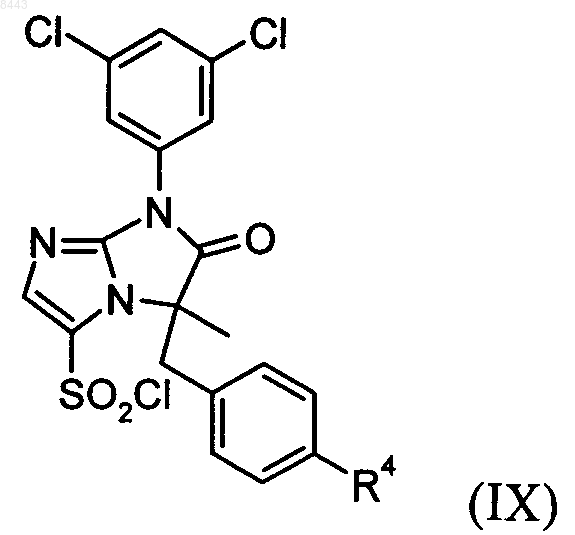
где R4 является таким, как определено в п.1, с соединением формулы X
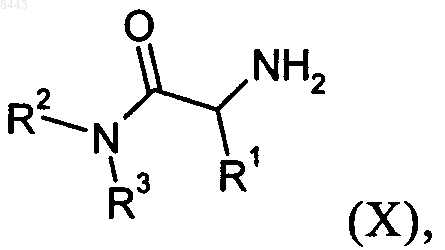
где R1, R2 и R3 являются такими, как определено в п.1, с получением соединения формулы I.
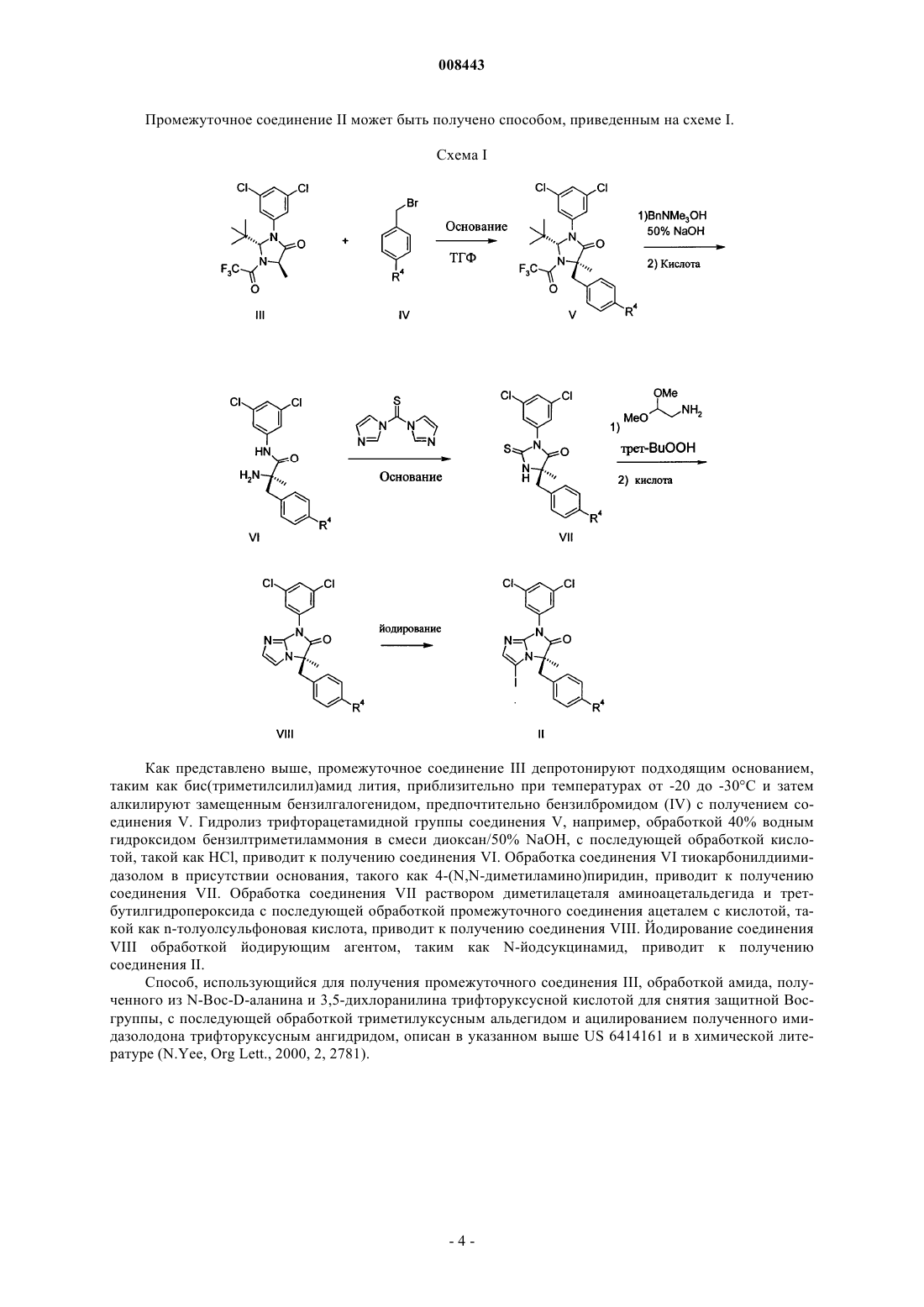
14. Способ по п.13, в котором соединение формулы IX получено способом, включающим реакцию соединения формулы II

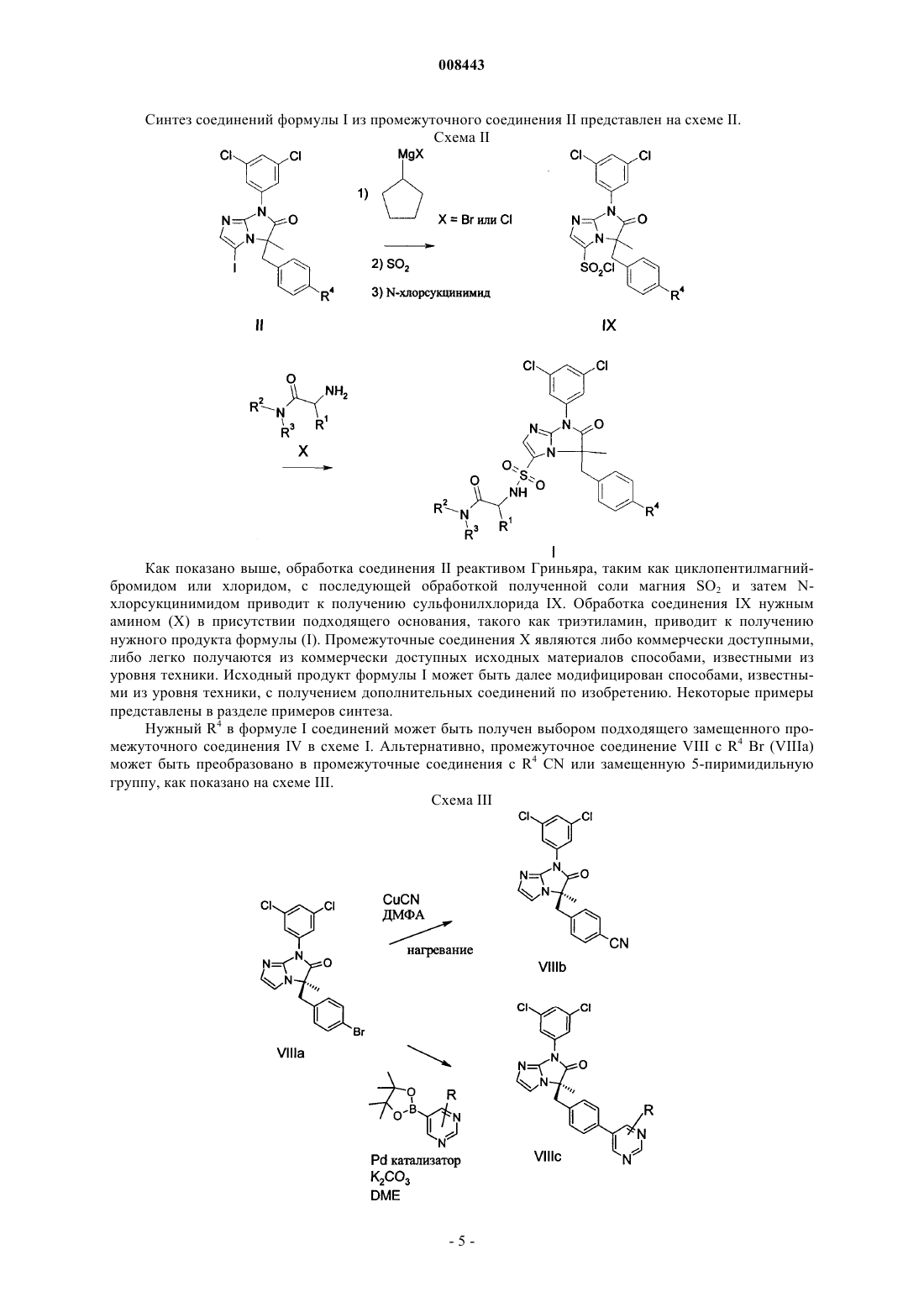
где R4 является таким, как определено в п.13, с реактивом Гриньяра, с последующей обработкой SO2 и N-хлорсукцинимидом с получением соединения формулы IX.
Текст
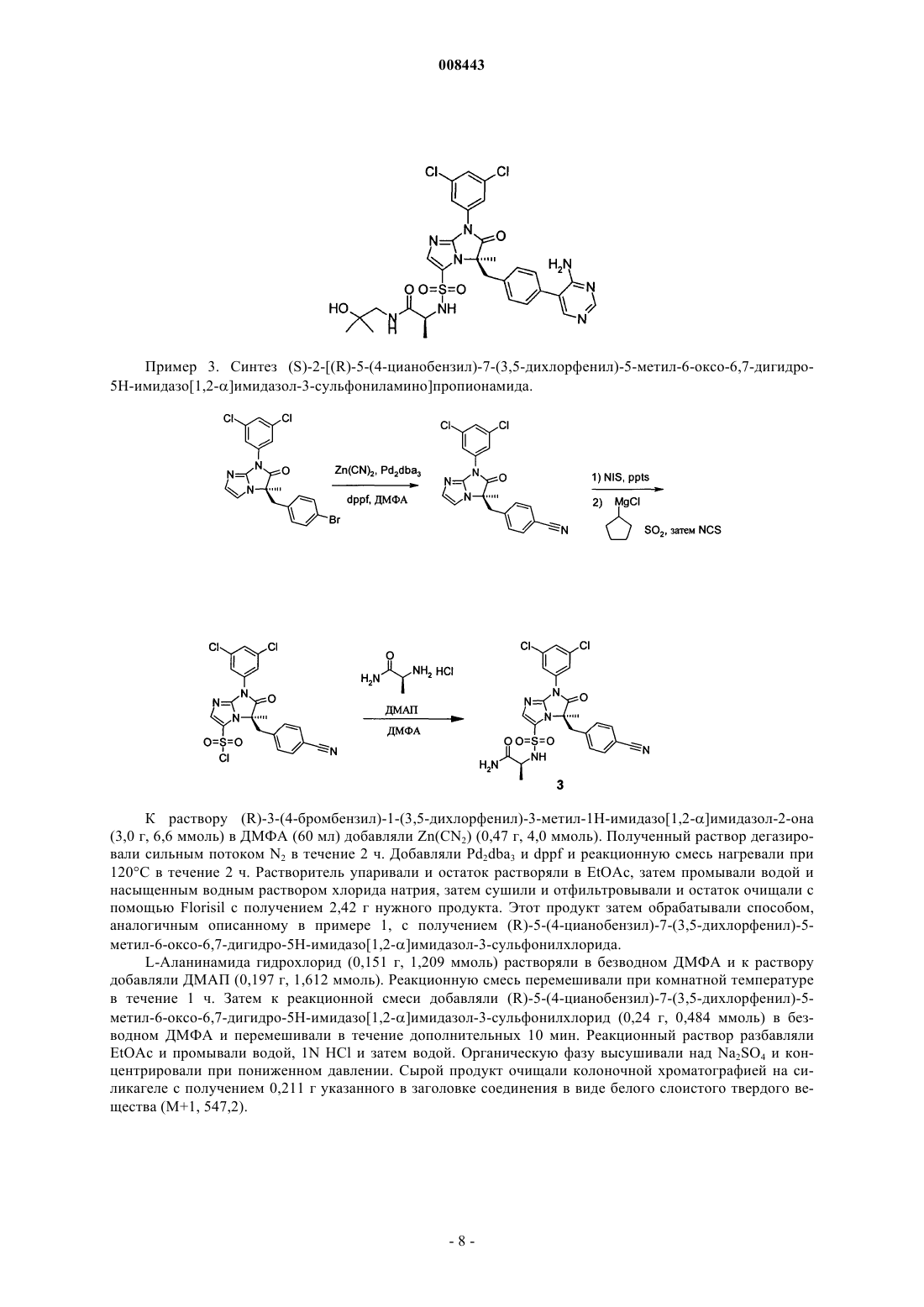
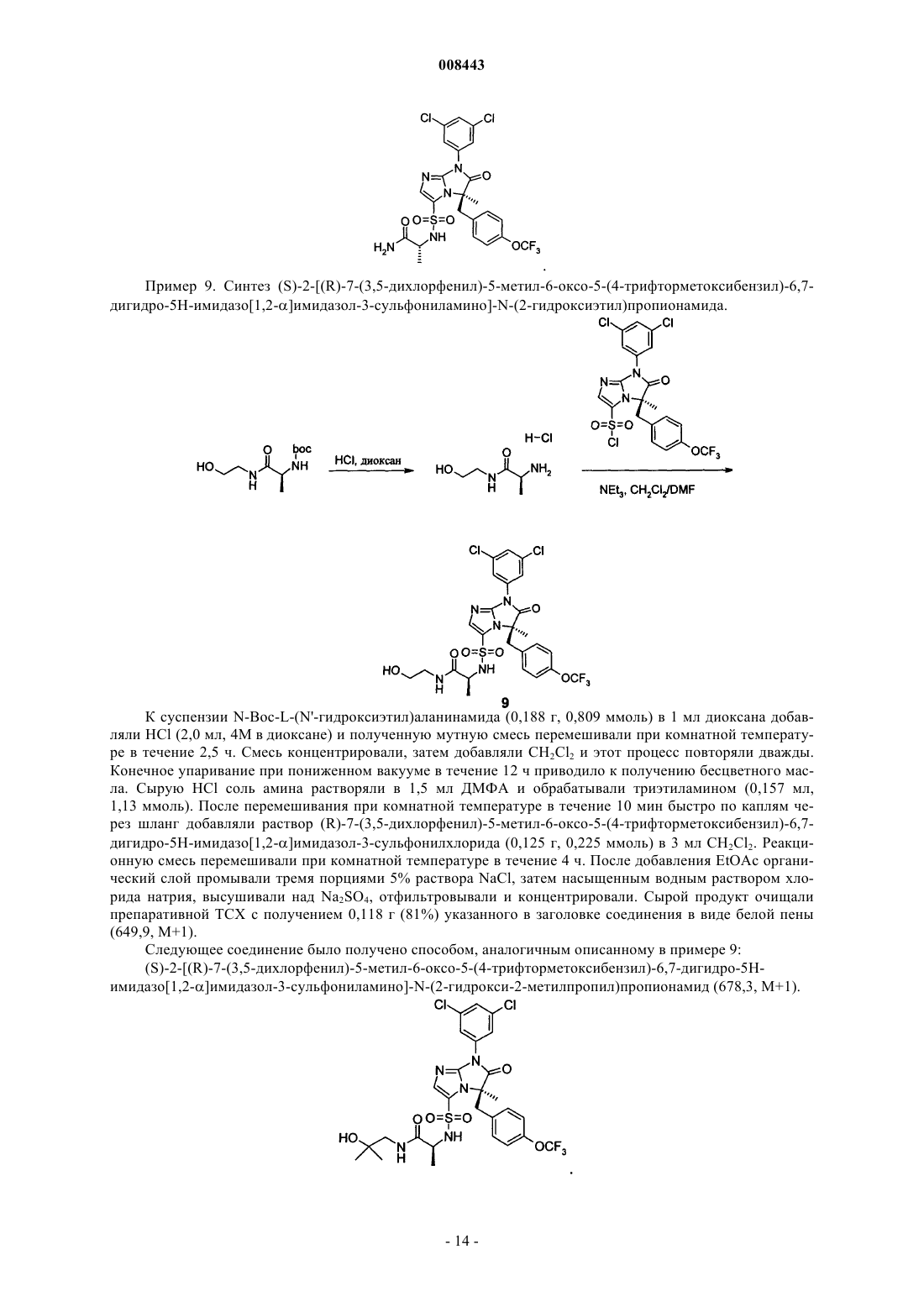
008443 Область техники, к которой относится изобретение Настоящее изобретение относится в основном к классу производных [6,7-дигидро-5H-имидазо[1,2]имидазол-3-сульфониламино]пропионамида, синтезу этих соединений, их применению для лечения воспалительного заболевания и фармацевтическим композициям, включающим такие соединения. Уровень техники Исследования последней декады помогли изучить молекулярные события, сопровождающие клеточные взаимодействия в организме, особенно события, вовлеченные в движение и активацию клеток иммунной системы. См. обзор Springer, Т. Nature, 1990, 346, 425-434. Белки поверхностей клеток и особенно молекулы адгезии клеток ("САМ") и "лейкоинтегрины", включая LFA-1, МАС-1 и gp150,95 (называемые по номенклатуре WHO CD18/CD11a, CD18/CD11b и CD18/CD11c соответственно) соответственно составляли предмет фармацевтического исследования и разработки с целью вмешательства в процессы излияния лейкоцитов к участкам повреждения и движения лейкоцитов к другим мишеням. Например,в настоящее время предполагается, что до излияния лейкоцитов, которые являются обязательным компонентом воспалительной реакции, происходит активация интегринов, в основном экспрессируемых в лейкоцитах и затем следует тесное лиганд/рецепторное взаимодействие между интегринами (например,LFA-1) и одной или несколькими различными межклеточными адгезионными молекулами (ICAM), обозначенными ICAM-1, ICAM-2, ICAM-3 или ICAM-4, которые экспрессируются на поверхностях эндотелиальных клеток кровеносных сосудов и в других лейкоцитах. Взаимодействие САМ с лейкоинтегринами является важной стадией нормального функционирования иммунной системы. Иммунные процессы,такие как выработка антигенов, медиируемая Т-клетками цитотоксичность и излияние лейкоцитов, требуют клеточной адгезии, медиируемой взаимодействием ICAM с лейкоинтегринами. См. обзор Kishimoto, Т.k.; Rothlein; R.R. Adv. Pharmacol. 1994, 25, 117-138 и Diamond, M.; Springer, Т. Current Biology,1994, 4, 506-517. Была выявлена группа пациентов с недостатком требуемой экспрессии лейкоинтегринов, состоянием, названным "дефицит адгезии лейкоцитов" (Anderson, D.С; et al., Fed. Proc. 1985, 44, 2671-2677 иAnderson, D.С; et al., J. Infect. Dis. 1985,152, 668-689). Эти пациенты были неспособны выработать нормальный воспалительный и/или иммунный ответ(ответы) из-за неспособности их клеток адгезировать с клеточными субстратами. Эти данные показали, что иммунные реакции снижаются при неспособности лимфоцитов адгезировать нормальным образом из-за недостатка функциональных адгезионных молекулCD18 семейства. Ввиду того факта, что LAD пациенты с недостатком CD18 не могут вырабатывать воспалительный ответ, предполагается, что антагонизм CD18 взаимодействий CD11/ICAM будет также ингибировать воспалительную реакцию. Было показано, что антагонизм взаимодействия САМ и лейкоинтегринов может быть реализован агентами, направленными против любого компонента. Конкретно, блокирование САМ, такого как, например, ICAM-1, или лейкоинтегринов, таких как, например, LFA-1, антителами, направленными против одной или обеих этих молекул, эффективно ингибирует воспалительные реакции. Модели воспаления invitro и иммунный ответ, ингибируемый антителами к САМ или лейкоинтегринами, включают вызываемую антигеном или митогеном пролиферацию лимфоцитов, гомотипическую агрегацию лимфоцитов,медиируемый Т-клетками цитолиз и антиген-специфическую индуцированную толерантность. Релевантность исследований in vitro подтверждается исследованиями in vivo с антителами, направленными против ICAM-1 или LFA-1. Например, антитела, направленные против LFA-1, могут предотвращать отторжение тироидного трансплантата и продлевать жизнь у мыши с пересаженным сердцем (Gorski, A.; Immunology Today, 1994, 15, 251-255). Что более важно, антитела, направленные против ICAM-1, показали эффективность in vivo в качестве противовоспалительных агентов в заболеваниях человека, таких как отторжение трансплантата почки и ревматоидный артрит (Rothlein, R.R.; Scharschmidt, L., in: Adhesionmolecules; Wegner, C.D., Ed.; 1994, 1-8, Cosimi, С.В.; et al., J. Immunol. 1990, 144, 4604-4612 и Kavanaugh,А.; et al., Arthritis Rheum. 1994, 37, 992-1004) и антитела, направленные против LFA-1, показали иммуноподавляющее действие при трансплантации костного мозга и при предотвращении раннего отторжения трансплантата почки (Fischer, А.; и et al., Lancet, 1989, 2, 1058-1060 и Le Mauff, В.; et al., Transplantation,1991, 52, 291-295). Также было показано, что рекомбинантная растворимая форма ICAM-1 может выступать в качестве ингибитора взаимодействия ICAM-1 с LFA-1. Растворимый IСAM-1 выступает в качестве прямого антагониста взаимодействий CD18, CD11/ICAM-1 в клетках и проявляет ингибирующую активность в моделях in vitro иммунной реакции, такой как смешанная лимфоцитная реакция человека, цитотоксические Тклеточные реакции и Т-клеточная пролиферация у пациентов, больных диабетом, в реакциях островков клеток (Becker, J.С; et al., J. Immunol. 1993, 151, 7224 и Roep, В.О.; и др., Lancet, 1994, 343, 1590). Таким образом, в уровне техники было показано, что большие молекулы белков, которые антагонизируют связывание САМ с лейкоинтегринами, имеют терапевтический потенциал для снижения воспалительных и иммунологических реакций, часто связанных с патогенезом многих аутоиммунных или воспалительных заболеваний. Однако белки имеют существенные недостатки в качестве терапевтических агентов, включая неспособность вводиться орально и возможную иммунореакционность, что ограничивает применение этих молекул для постоянного введения. Кроме того, лечение белками обычно является-1 008443 дорогим. Следовательно, небольшие молекулы с аналогичной способностью больших молекул белков прямо и селективно антагонизировать связывание САМ с лейкоинтегринами будут являться предпочтительными терапевтическими агентами. Некоторые небольшие молекулы, которые участвуют во взаимодействии САМ и лейкоинтегринов,были описаны в уровне техники. Например, US 6355664 и соответствующий WO 98/39303 раскрывают класс небольших молекул с гидантоиновым ядром, которые являются ингибиторами взаимодействияLFA-1 и ICAM-1. Ближайшим аналогом настоящего изобретения является WO 01/07440 А 1, который раскрывает соединения, которые имеют 6,7-дигидро-5H-имидазо[1,2- ]имидазольное ядро. Хотя соединения, которые конкретно описаны в WO 01/07440 А 1, имеют более высокое ингибирующее действие при взаимодействии САМ и лейкоинтегринов по сравнению с гидантоинами из US 6355664 и соответствующего WO 9839303, все-таки они не являются идеальными терапевтическими агентами из-за того, что скорость их метаболизма неприемлемо высока. Следовательно, целью настоящего изобретения является обнаружение небольших молекул, которые не только обладают хорошей ингибирующей активностью в отношении взаимодействия САМ и лейкоинтегринов, но также метаболируют со скоростью, которая не является слишком высокой. Раскрытие изобретения Изобретение включает подмножество или выбранный ряд 6,7-дигидро-5H-имидазо[1,2-] имидазолов, которые конкретно не описаны в WO 01/07440 А 1. Неожиданно соединения, включенные в изобретение, не только проявили хорошую ингибирующую активность в отношении взаимодействия САМ и лейкоинтегринов, но и метаболируют гораздо медленнее, чем соединения, конкретно описанные в WO 01/07440 А 1. Соединения по изобретению решают проблему слишком быстрого метаболизма. Осуществление изобретения Изобретение включает соединения формулы I где R1 представляет собой линейный или разветвленный алкил с 1-3 атомами углерода, который необязательно является моно- или дизамещенным группами, независимо выбранными из группы, состоящей из(Б) линейного или разветвленного алкила с 1-4 атомами углерода, где алкильная группа является моно- или дизамещенной группами, независимо выбранными из группы, состоящей из(ii) ОН,или R2 и R3 вместе с атомом азота между ними образуют пиперазиновое кольцо; и(B) трифторметокси. Предпочтительными соединениями по изобретению являются соединения формулы I,где R1 представляет собой метильную группу;(Б) линейного или разветвленного алкила с 1-4 атомами углерода, который является моно- или дизамещенным группами, независимо выбранными из группы, состоящей из(Б) трифторметокси. Более предпочтительными являются соединения формулы I, гдеR1 представляет собой метильную группу;(B) линейного или разветвленного алкила с 1-4 атомами углерода, который является моно- или дизамещенным группами, независимо выбранными из группы, состоящей изR4 представляет собой трифторметокси. Предполагается, что соединения формулы I имеют по крайней мере два хиральных центра. В окончательном предпочтительном варианте осуществления изобретение включает соединения формулы I с абсолютной стереохимией, представленные далее в формуле I Особенно предпочтительными являются соединения формулы I, выбранные из группы, состоящей из(BIRT2630 ХХ),(S)-2-[(R)-7-(3,5-дихлорфенил)-5-метил-6-оксо-5-(4-трифторметоксибензил)-6,7-дигидро-5Hимидазо[1,2-]имидазол-3-сульфониламино]пропионамида и (BIRT2584XX),(S)-N-карбамоилметил-2-[(R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо-6,7-дигидро 5H-имидазо[1,2-]имидазол-3-сульфониламино]пропионамида; (BIRT2578XX). Настоящее изобретение также включает фармацевтически приемлемые соли соединений формулы I. Настоящее изобретение также включает фармацевтические композиции, включающие соединение формулы I и по крайней мере один фармацевтически приемлемый носитель, разбавитель или эксципиент. Настоящее изобретение также включает соединения формулы I для применения в качестве лекарственных средств и применение соединений формулы I для получения фармацевтических композиций для лечения воспаления или воспалительного состояния пациента. Здесь описаны конкретные примеры воспалительного состояния, которое можно лечить. Общие методики синтеза Соединения по изобретению могут быть получены обычными способами, описанными далее. Обычно, за протеканием реакции при необходимости можно наблюдать с помощью тонкослойной хроматографии (ТСХ). При необходимости, промежуточные соединения и продукты могут быть очищены с помощью хроматографии на силикагеле и/или перекристаллизацией и охарактеризованы одним или несколькими из следующих методов: ЯМР, масс-спектроскопия и точка плавления. Исходные материалы и реагенты являются либо коммерчески доступными, либо могут быть получены любым средним специалистом в данной области техники способами, описанными в химической литературе. Соединения формулы I могут быть получены из промежуточного соединения II. Синтез промежуточного соединения II описан Wu et al., в заявках US 09/604312 и Frutos et al., US 6441183, обе из которых приведены здесь в качестве ссылки.-3 008443 Промежуточное соединение II может быть получено способом, приведенным на схеме I. Схема I Как представлено выше, промежуточное соединение III депротонируют подходящим основанием,таким как бис(триметилсилил)амид лития, приблизительно при температурах от -20 до -30 С и затем алкилируют замещенным бензилгалогенидом, предпочтительно бензилбромидом (IV) с получением соединения V. Гидролиз трифторацетамидной группы соединения V, например, обработкой 40% водным гидроксидом бензилтриметиламмония в смеси диоксан/50% NaOH, с последующей обработкой кислотой, такой как HCl, приводит к получению соединения VI. Обработка соединения VI тиокарбонилдиимидазолом в присутствии основания, такого как 4-(N,N-диметиламино)пиридин, приводит к получению соединения VII. Обработка соединения VII раствором диметилацеталя аминоацетальдегида и третбутилгидропероксида с последующей обработкой промежуточного соединения ацеталем с кислотой, такой как n-толуолсульфоновая кислота, приводит к получению соединения VIII. Йодирование соединенияVIII обработкой йодирующим агентом, таким как N-йодсукцинамид, приводит к получению соединения II. Способ, использующийся для получения промежуточного соединения III, обработкой амида, полученного из N-Boc-D-аланина и 3,5-дихлоранилина трифторуксусной кислотой для снятия защитной Восгруппы, с последующей обработкой триметилуксусным альдегидом и ацилированием полученного имидазолодона трифторуксусным ангидридом, описан в указанном выше US 6414161 и в химической литературе (N.Yee, Org Lett., 2000, 2, 2781).-4 008443 Синтез соединений формулы I из промежуточного соединения II представлен на схеме II. Схема II Как показано выше, обработка соединения II реактивом Гриньяра, таким как циклопентилмагнийбромидом или хлоридом, с последующей обработкой полученной соли магния SO2 и затем Nхлорсукцинимидом приводит к получению сульфонилхлорида IX. Обработка соединения IX нужным амином (X) в присутствии подходящего основания, такого как триэтиламин, приводит к получению нужного продукта формулы (I). Промежуточные соединения X являются либо коммерчески доступными,либо легко получаются из коммерчески доступных исходных материалов способами, известными из уровня техники. Исходный продукт формулы I может быть далее модифицирован способами, известными из уровня техники, с получением дополнительных соединений по изобретению. Некоторые примеры представлены в разделе примеров синтеза. Нужный R4 в формуле I соединений может быть получен выбором подходящего замещенного промежуточного соединения IV в схеме I. Альтернативно, промежуточное соединение VIII с R4 Br (VIIIa) может быть преобразовано в промежуточные соединения с R4 CN или замещенную 5-пиримидильную группу, как показано на схеме III. Схема III-5 008443 Как указано выше, арилбромид VIIIa обрабатывают цианидом, предпочтительно CuCN и нагревают в подходящем растворителе, таком как ДМФА, с получением цианопромежуточного соединения VIIIb. Обработка соединения VIIIa пиримидинборонатом, таким как 5-(4,4,5,5-тетраметил[1,3,2] диоксаборолан-2-ил)пиримидином в присутствии палладиевого катализатора, такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)СН 2 Сl2 (PdCl2(dppf)CH2Cl2) и основания, такого как карбонат калия, в подходящем растворителе (реакция Suzuki), например, диметоксиэтане, с получением пиримидинового промежуточного соединения VIIIc. Промежуточные соединения VIIIb и VIIIc затем могут быть превращены в нужные соединения формулы I способами, описанными на схемах I и II. Реакция Suzuki для превращения R4=Br в R4=необязательно замещенный пиримидин также может осуществляться на соединении формулы I. Реакция Suzuki также может осуществляться в обратном направлении. Бромид VIIIa (или соединение формулы I с R4=Br) может быть превращен в боронат, например, обработкой бис(пинаколято)дибороном в присутствии палладиевого катализатора, такого как PdCl2(dppf), и затем реакцией с нужным пиримидилбромидом. Настоящее изобретение далее описано с помощью следующих примеров синтеза. Примеры синтеза Пример 1. Синтез (R)-5-(4-бромбензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо-6,7-дигидро-5Hимидазо[1,2-]имидазол-3-сульфонилхлорида. Раствор (R)-3-(4-бромбензил)-1-(3,5-дихлорфенил)-3-метил-1H-имидазо[1,2-]имидазол-2-она в ТГФ (0,12 М) обрабатывали N-йодсукцинимидом (1,05 экв.) и n-толуолсульфонатом пиридиния (0,1 экв.). Смесь перемешивали при комнатной температуре в течение 17 ч, затем разбавляли EtOAc и промывали 10% раствором Na2S2O3 и водой. Объединенные водные слои экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия, высушивали над Na2SO4,отфильтровывали и концентрировали. Сырое масло очищали хроматографией на силикагеле с получением нужного йодида. Раствор указанного выше йодида в ТГФ (0,12 М) охлаждали до -40 С по мере добавления по каплям циклопентилмагнийхлорида (1,05 экв.) в течение 10 мин. После перемешивания при -40 С в течение 1 ч добавляли SO2 (газ) посредством введения иглы над поверхностью реакционной смеси в течение 1,5 мин. Светло-желтую смесь нагревали до -20 С в течение 1 ч и затем перемешивали при комнатной температуре в течение 1 ч. Через смесь барботировали N2 (газ) в течение 20 мин, затем концентрировали и выдерживали при высоком вакууме в течение 12 ч. Полученную желтую пену растворяли в ТГФ (0,1 М) и охлаждали до -20 С по мере добавления по каплям раствора N-хлорсукцинимида (1,2 экв.) в ТГФ (0,3 М) в течение 5 мин. После перемешивания при -20 С в течение 1 ч смесь выливали на лед и экстрагировали двумя порциями EtOAc. Объединенные органические слои промывали охлажденным льдом насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали. Очистка хроматографией на силикагеле приводила к получению (R)-5-(4-бромбензил)-7-(3,5-дихлорфенил)5-метил-6-оксо-6,7-дигидро-5H-имидазо[1,2-]имидазол-3-сульфонилхлорида в виде твердого вещества. К суспензии гидрохлоридной соли (S)-2-амино-N-(2-гидроксиэтил)пропионамида (0,53 г, 3,2 ммоль,3 экв.) в 10 мл ДМФА добавляли ДМАП (4 экв.) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. К этому раствору добавляли (R)-5-(4-бромбензил)-7-(3,5-дихлорфенил)-5-метил 6-оксо-6,7-дигидро-5H-имидазо[1,2-]имидазол-3-сульфонилхлорид (0,580 мг, 1,06 ммоль) в 2 мл ДМФА при комнатной температуре. После перемешивания при комнатной температуре в течение 15 мин смесь растворяли в EtOAc и промывали водой, разб. HCl, насыщенным NaHCO3 и насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали. Очистка сырого продукта хроматографией на силикагеле приводила к получению 0,305 мг нужного продукта. СмесьN2 в течение 15 мин. Добавляли PdCl2(dppf) (0,039 г, 0,047 ммоль) и реакционную смесь нагревали при 80 С в течение 36 ч. После охлаждения до комнатной температуры смесь концентрировали и остаток разбавляли 150 мл EtOAc, промывали водой и насыщенным водным раствором хлорида натрия, высушивали над MgSO4 и концентрировали. Остаток очищали хроматографией на силикагеле с получением 0,204 г (62%) бороната. Смесь указанного выше бороната (0,204 г, 0,295 ммоль), 5-бром-2-аминопиримидина (0,078 г,0,443 ммоль) и K2CO3 (0,122 г, 0,885 ммоль) в 8 мл диметоксиэтана и 1,2 мл воды насыщали N2 в течение 20 мин. Добавляли PdCl2(dppf) (0,025 г, 0,030 ммоль) и реакционную смесь нагревали при 80 С в течение 2 ч. После охлаждения до комнатной температуры смесь разбавляли EtOAc, промывали водой и насыщенным водным раствором хлорида натрия и концентрировали. Остаток очищали хроматографией на силикагеле и препаративной ТСХ с получением 0,062 г (32%) указанного в заголовке соединения(660,4, М+1). Следующее соединение получали методом, аналогичным описанному в примере 2:(3,0 г, 6,6 ммоль) в ДМФА (60 мл) добавляли Zn(CN2) (0,47 г, 4,0 ммоль). Полученный раствор дегазировали сильным потоком N2 в течение 2 ч. Добавляли Pd2dba3 и dppf и реакционную смесь нагревали при 120 С в течение 2 ч. Растворитель упаривали и остаток растворяли в EtOAc, затем промывали водой и насыщенным водным раствором хлорида натрия, затем сушили и отфильтровывали и остаток очищали с помощью Florisil с получением 2,42 г нужного продукта. Этот продукт затем обрабатывали способом,аналогичным описанному в примере 1, с получением (R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5 метил-6-оксо-6,7-дигидро-5 Н-имидазо[1,2-]имидазол-3-сульфонилхлорида.L-Аланинамида гидрохлорид (0,151 г, 1,209 ммоль) растворяли в безводном ДМФА и к раствору добавляли ДМАП (0,197 г, 1,612 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем к реакционной смеси добавляли (R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5 метил-6-оксо-6,7-дигидро-5H-имидазо[1,2-]имидазол-3-сульфонилхлорид (0,24 г, 0,484 ммоль) в безводном ДМФА и перемешивали в течение дополнительных 10 мин. Реакционный раствор разбавлялиEtOAc и промывали водой, 1N НСl и затем водой. Органическую фазу высушивали над Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией на силикагеле с получением 0,211 г указанного в заголовке соединения в виде белого слоистого твердого вещества (М+1, 547,2).(10 мл) и к раствору добавляли ДМАП (0,79 г, 6,46 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и к реакционной смеси добавляли (R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо-6,7-дигидро-5H-имидазо[1,2-]имидазол-3-сульфонилхлорид (0,80 г, 1,61 ммоль) в ДМФА. Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 10 мин. Реакционную смесь промывали водой (х 3), 1N HCl и насыщенным NaHCO3. Органическую фазу высушивали над Na2SO4 и концентрировали. Сырой продукт очищали колоночной хроматографией на силикагеле, используя CH2Cl2-МеОН (98:2) в качестве элюента, с получением 0,94 г сульфонамида третбутилового эфира. Полученный продукт обрабатывали трифторуксусной кислотой (5 мл) в CH2Cl2 (10 мл) при комнатной температуре в течение 3 ч. Реакционный раствор разбавляли CH2Cl2 и промывали водой. Органическую фазу высушивали над Na2SO4 и затем концентрировали с получением 0,67 г (S)-2[(R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо-6,7-дигидро-5H-имидазо[1,2-]имидазол-3 сульфониламино]пропановой кислоты в виде белой пены. Полученную выше карбоновую кислоту (0,05 г, 0,091 ммоль) растворяли в безводном ДМФА (2 мл) и к реакционному раствору добавляли бензотриазол-1-илокситрис(пирролидино)фосфонийгексафторфосфат (РуВОР) (0,071 г, 0,137 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и к смеси добавляли гидрохлорид глицинамида (0,015 г, 0,137 ммоль), а затем N,N-диизопропилэтиламин (0,039 мл, 0,227 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 15 мин. Смесь затем разбавляли EtOAc (10 мл) и промывали водой (2 раза), 1N HCl, насыщенным NaHCO3 и затем водой (1 раз). Органическую фазу высушивали над Na2SO4 и концентрировали. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле, используя CH2Cl2-МеОН (95:5) в качестве элюента, с получением 0,043 г указанного в заголовке соединения в виде белой пены (М+1, 604,2). Следующее соединение было получено способами, аналогичными описанным в указанном выше примере:(S)-2-[(R)-5-(4-Цианобензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо-6,7-дигидро-5 Н-имидазо[1,2-] имидазол-3-сульфониламино]пропановую кислоту (см. пример 14) (0,05 г, 0,091 ммоль) растворяли безводном ДМФА (2 мл) и к реакционному раствору добавляли TBTU (0,044 г, 0,137 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и к смеси добавляли гидрохлорид Dаланинамида (0,017 г, 0,137 ммоль), затем N,N-диизопропилэтиламин (0,039 мл, 0,227 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 15 мин. Смесь затем разбавляли EtOAc (10 мл) и промывали водой, 1N HCl, насыщенным NaHCO3 и затем водой. Органическую фазу высушивали над Na2SO4 и концентрировали. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле с получением 0,035 г указанного в заголовке соединения в виде белой пены (М+1, 618,2). Пример 6. Смесь L-Boc-аланина (0,40 г, 2,11 ммоль), этаноламина (0,15 мл, 2,54 ммоль) и HOBt (0,29 г, 2,11 ммоль) в безводном CH3CN (9 мл) охлаждали до 0 С и к реакционной смеси добавляли гидрохлорид 1(3-диметиламинопропил)-3-этилкарбодиимида (EDC) (0,49 г, 2,54 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 19 ч. Реакционную смесь разбавляли EtOAc и промывали 5% лимонной кислотой. Водный слой экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным NaHCO3 и насыщенным водным раствором хлорида натрия. Органическую фазу высушивали над Na2SO4 и концентрировали с получением 0,38 г соответствующего продукта в виде бесцветного масла. Указанный выше спирт (0,34 г, 1,45 ммоль) растворяли в CH2Cl2 (3 мл) и к раствору добавляли 4NHCl в диоксане (3 мл). Реакционный раствор перемешивали при комнатной температуре в течение 2 ч и затем концентрировали с получением гидрохлорида (S)-2-амино-N-(2-гидроксиэтил)пропионамида. К раствору указанной выше соли амина (0,043 г, 0,254 ммоль) в безводном ДМФА добавляли ДМАП (0,037 г, 0,303 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. К реакционной смеси затем добавляли (R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо 6,7-дигидро-5H-имидазо[1,2-]имидазол-3-сульфонилхлорид (0,036 г, 0,073 ммоль) и перемешивали в течение дополнительных 2 ч. Реакционную смесь разбавляли EtOAc и промывали 1N HCl и насыщеннымNaHCO3. Органическую фазу высушивали над Na2SO4 и концентрировали. Остаток очищали препаративной тонкослойной хроматографией на силикагеле с получением 0,035 г указанного в заголовке соединения в виде белой пены (М+1, 591,1). К смеси 1-бензилового эфира (S)-2-трет-бутоксикарбониламинопентандионовой кислоты (4,5 г, 13,4 ммоль), морфолина (1,29 мл, 14,8 ммоль), HOBt (1,89 г, 14,0 ммоль) в CH2Cl2 (18 мл) при 0 С медленно добавляли раствор ДЦК (2,89 г, 14,0 ммоль) в CH2Cl2 (18 мл). Полученную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Полученный осадок отфильтровывали и затем фильтрат разбавляли CH2Cl2. Раствор промывали насыщенным NaHCO3, 1N HCl и затем насыщенным водным раствором хлорида натрия. Органический слой высушивали над Na2SO4 и затем отфильтровывали. Упаривание растворителя приводило к получению нужного амида (5,42 г) в виде белого твердого вещества. Смесь указанного выше амида (6,17 г, 152 ммоль) и 10% Pd/C (0,52 г) в EtOAc (50 мл) гидрировали при атмосферном давлении в течение 24 ч. Смесь отфильтровывали и концентрировали с получением(S)-2-тpeт-бутоксикарбониламино-5-морфолин-4-ил-5-оксопентановой кислоты (3,12 г) в виде пены, которую использовали без дополнительной очистки. Газообразный аммиак барботировали через раствор полученной выше карбоновой кислоты (3,12 г,9,86 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфата (HATU) (5,25 г, 13,8 ммоль) в ДМФА (30 мл) при перемешивании в течение 20 мин. К полученной желтой суспензии шприцем добавляли N-диизопропилэтиламин (5,15 мл, 29,5 ммоль). Смесь перемешивали в атмосфере азота в течение ночи. Реакционную смесь отфильтровывали и концентрировали в вакууме. Полученный остаток растворяли в CH2Cl2, промывали насыщенным NaHCO3, 1N HCl и затем насыщенным водным раствором хлорида натрия. Органический слой высушивали над Na2SO4, отфильтровывали и концентрировали. Полученный остаток перекристаллизовывали из EtOAc с получением амида (1,16 г) в виде белого твердого вещества. Защитную Воc-группу удаляли HCl в EtOAc и полученный гидрохлорид амида (S)-2-амино-5 морфолин-4-ил-5-оксопентановой кислоты собирали вакуумной фильтрацией и использовали без дополнительной очистки. К перемешиваемому раствору (R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5-метил-6 оксо-6,7-дигидро-5H-имидазо[1,2-]имидазол-3-сульфонилхлорида (76 мг, 0,13 ммоль) в ДМФА (4 мл) добавляли N,N-диизопропилэтиламин (60 мкл, 0,39 ммоль) и гидрохлорид амина (100 мг, 0,4 ммоль). После перемешивания в течение ночи ДМФА удаляли в вакууме и полученный остаток хроматографировали на силикагеле. Продукт затем очищали полупрепаративной ВЭЖХ с получением 32 мг указанного в заголовке соединения в виде белого твердого вещества (М+1, 674,04).(2S,5R)-2-трет-бутил-3-(3,5-дихлорфенил)-5-метил-1-(2,2,2-трифторацетил)имидазолидин-4-она (10,0 г, 25,17 ммоль) в 60 мл ТГФ при -20 С медленно по каплям добавляли бис(триметилсилил)амид лития (LiHMDS) (38,0 мл, 1M в ТГФ) в течение 25 мин. После перемешивания при -20 С в течение 20 мин по каплям добавляли в течение 20 мин раствор 4-трифторметоксибензилбромида (6,04 мл, 37,76 ммоль) в 30 мл ТГФ. Смесь перемешивали при -20 С в течение 45 мин, нагревали до -5 С в течение 1 ч и затем выливали в 50 мл охлажденного льдом насыщенного раствора NH4Cl. Полученную смесь экстрагировали EtOAc. Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали. Сырой продукт обрабатывали гексаном с получением 12,5 г (87%) (2R,5R)-2-трет-бутил-3(3,5-дихлорфенил)-5-метил-1-(2,2,2-трифторацетил)-5-(4-трифторметоксибензил)имидазолидин-4-она в виде белого твердого вещества. К раствору указанного выше имидазолидинона (6,0 г, 10,5 ммоль) в 40 мл диоксана добавляли 40% водный гидроксид бензилтриметиламмония (6,59 г, 15,75 ммоль) при комнатной температуре. Пока смесь нагревали до 40 С, медленно по каплям добавляли 50% водный гидроксид натрия (1,68 г, 21,0 ммоль) в течение 5 мин. Смесь перемешивали при 40 С в течение 18 ч, затем медленно по каплям добавляли раствор 6,4 г конц. HCl в 3,3 мл воды в течение 10 мин. Смесь нагревали до 50 С и перемешивали в течение дополнительных 5 ч, затем охлаждали до комнатной температуры и концентрировали. К остатку добавляли 50 мл толуола и двухфазную смесь тщательно перемешивали при добавлении медленно по каплям 50% водного гидроксида натрия (3,0 г) (рН водной фазы 10). Водный слой экстрагировали толуолом и объединенные органические фазы промывали водой и насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали с получением 4,24 г (R)-2-аминоN-(3,5-дихлорфенил)-2-метил-3-(4-трифторметоксифенил)пропионамида в виде светло-коричневого масла. К раствору указанного выше пропионамида (4,24 г, 10,41 ммоль) в 30 мл ТГФ добавляли тиокарбонилдиимидазол (2,81 г, 15,77 ммоль) и 4-диметиламинопиридин (ДМАП) (0,127 г, 1,04 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 17 ч, охлаждали до комнатной температуры и концентрировали. Оранжевый маслянистый остаток растворяли в 50 мл толуола и медленно по каплям обрабатывали 20 мл 5% водного раствора HCl. После перемешивания смеси в течение 10 мин водный слой отделяли и экстрагировали толуолом. Объединенные органические фазы промывали водой и насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали с получением 4,48 г (R)-3-(3,5-дихлорфенил)-5-метил-2-тиоксо-5-(4-трифторметоксибензил)- 12008443 имидазолидин-4-она в виде оранжевой пены. К раствору указанного выше тиогидантоина (4,47 г, 9,95 ммоль) и диметилацеталя аминоацетальдегида (6,50 мл, 59,7 ммоль) в 20 мл МеОН по каплям добавляли 7,69 мл (59,7 ммоль, 70% в воде) раствора трет-бутилгидропероксида в течение 25 мин. В процессе добавления и в течение следующего 1 ч наружную температуру смеси поддерживали ниже 20 С с помощью ледяной водной бани. Смесь перемешивали при комнатной температуре в течение 86 ч и медленно по каплям добавляли 25 мл насыщенного раствора NaHSO3, поддерживая наружную температуру ниже 20 С с помощью ледяной водной бани. Полученную мутную белую смесь концентрировали. К остатку добавляли EtOAc и эту смесь концентрировали снова. Маслянистый остаток разделяли между EtOAc и водой и водную фазу отделяли и экстрагировалиEtOAc. Объединенные органические слои промывали водой и насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали с получением 5,21 г (R)-3-(3,5 дихлорфенил)-2-[(Е)-2,2-диметоксиэтилимино]-5-метил-5-(4-трифторметоксибензил)имидазолидин-4 она в виде желтого масла. Раствор указанного выше сырого ацеталя (5,20 г, 9,95 ммоль) в 30 мл ацетона обрабатывали nтолуолсульфоновой кислоты (1,89 г, 9,96 ммоль). Смесь нагревали при кипении с обратным холодильником в течение 2 ч, затем охлаждали до комнатной температуры и концентрировали. Полученное темное оранжевое масло растворяли в 40 мл EtOAc и осторожно обрабатывали раствором 2,3 г NaHCO3 в 23 мл воды. После прекращения выделения газа водную фазу отделяли и экстрагировали двумя порциямиEtOAc. Объединенные органические слои промывали насыщенным раствором NaHCO3, двумя порциями воды и насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали. Маслянистый остаток очищали хроматографией на силикагеле с получением 1,58 г(R)-1-(3,5-дихлорфенил)-3-метил-3-(4-трифторметоксибензил)-1H-имидазо[1,2-]имидазол-2-она (пример 1) (1,54 г, 3,38 ммоль) в 30 мл ТГФ обрабатывали N-йодсукцинимидом (0,846 г, 3,76 ммоль) и n-толуолсульфонатом пиридиния (0,086 г, 3,76 ммоль). Смесь перемешивали при комнатной температуре в течение 17 ч, затем разбавляли EtOAc и промывали 10% раствором Na2S2O3 и водой. Объединенные водные слои экстрагировали 10 мл EtOAc. Объединенные органические фазы промывали 25 мл насыщенного водного раствора хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали. Сырое оранжевое масло очищали хроматографией на силикагеле с получением 1,27 г(65%) (R)-1-(3,5-дихлорфенил)-5-йод-3-метил-3-(4-трифторметоксибензил)-1H-имидазо[1,2-]имидазол 2-она в виде беловатого масла (582,0, М+1). Раствор указанного выше йодида (1,24 г, 2,13 ммоль) в 16 мл ТГФ охлаждали при -40 С при добавлении по каплям циклопентилмагнийхлорида (1,17 мл, 2M в диэтиловом эфире) в течение 10 мин. После перемешивания при -40 С в течение 1 ч, добавляли SO2 (г) путем помещения кончика иглы над поверхностью реакционной смеси в течение 1,5 мин. Светло-желтую смесь нагревали до -20 С в течение 1 ч и затем перемешивали при комнатной температуре в течение 1 ч. N2 (газ) барботировали через смесь в течение 20 мин, затем концентрировали и упаривали при высоком вакууме в течение 12 ч. Полученную желтую пену растворяли в 16 мл ТГФ и охлаждали при -20 С при добавлении по каплям раствора Nхлорсукцинимида (0,341 г, 2,56 ммоль) в 8 мл ТГФ в течение 5 мин. После перемешивания при -20 С в течение 1 ч, смесь выливали на лед и экстрагировали двумя порциями EtOAc. Объединенные органические слои промывали охлажденным льдом насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали. Очистка хроматографией на силикагеле приводила к получению 0,975 г (83%) (R)-7-(3,5-дихлорфенил)-5-метил-6-оксо-5-(4-трифторметоксибензил)-6,7 дигидро-5H-имидазо[1,2-]имидазол-3-сульфонилхлорида в виде масла (554,2, М+1). Раствор HCl соли L-аланинамида (0,097 г, 0,782 ммоль) в 6,5 мл ДМФА обрабатывали триэтиламином (0,163 мл, 1,17 ммоль) при комнатной температуре. После перемешивания в течение 10 мин быстро по каплям добавляли раствор указанного выше сульфонилхлорида (0,217 г, 0,391 ммоль) в 1 мл CH2Cl2 и мутную смесь перемешивали при комнатной температуре в течение 5 ч. Затем добавляли EtOAc, органический слой промывали водой, затем насыщенным водным раствором хлорида натрия, высушивали надNa2SO4, отфильтровывали и концентрировали. Сырой продукт очищали хроматографией на силикагеле с получением 0,193 г (81%) указанного в заголовке соединения в виде белого твердого вещества (606,3,М+1). Следующее соединение было получено способом, аналогичным описанному в примере 8: К суспензии N-Вос-L-(N'-гидроксиэтил)аланинамида (0,188 г, 0,809 ммоль) в 1 мл диоксана добавляли HCl (2,0 мл, 4M в диоксане) и полученную мутную смесь перемешивали при комнатной температуре в течение 2,5 ч. Смесь концентрировали, затем добавляли CH2Cl2 и этот процесс повторяли дважды. Конечное упаривание при пониженном вакууме в течение 12 ч приводило к получению бесцветного масла. Сырую HCl соль амина растворяли в 1,5 мл ДМФА и обрабатывали триэтиламином (0,157 мл,1,13 ммоль). После перемешивания при комнатной температуре в течение 10 мин быстро по каплям через шланг добавляли раствор (R)-7-(3,5-дихлорфенил)-5-метил-6-оксо-5-(4-трифторметоксибензил)-6,7 дигидро-5H-имидазо[1,2-]имидазол-3-сульфонилхлорида (0,125 г, 0,225 ммоль) в 3 мл CH2Cl2. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. После добавления EtOAc органический слой промывали тремя порциями 5% раствора NaCl, затем насыщенным водным раствором хлорида натрия, высушивали над Na2SO4, отфильтровывали и концентрировали. Сырой продукт очищали препаративной ТСХ с получением 0,118 г (81%) указанного в заголовке соединения в виде белой пены(649,9, М+1). Следующее соединение было получено способом, аналогичным описанному в примере 9:- 14008443 Описание биологических свойств Биологические свойства некоторых соединений формулы I исследовали с помощью описанной далее экспериментальной методики. Анализ для определения ингибирования связывания LFA-1 с ICAM-1. Цель анализа. Эта методика анализа разработана для исследования прямого антагонизма взаимодействия САМ,ICAM-1 с лейкоинтегрином CD18/CD11a (LFA-1) тестируемым соединением. Описание методики анализа.LFA-1 подвергали иммунной очистке с помощью TS2/4 антител из 20 г человеческих JY или SKW3 клеток, используя ранее описанную методику (Dustin, M.J.; et al., J. Immunol. 1992, 148, 2654-2660).LFA-1 очищали из SKW3 лизатов иммуноаффинной хроматографией на TS2/4 LFA-1 mAb сефарозе и элюировали при рН 11,5 в присутствии 2 мМ MgCl2 и 1% октилглюкозидом. После собирания и нейтрализации фракций с TS2/4 колонки, образцы объединяли и предварительно очищали с помощью белка G на агарозе. Конструировали растворимую форму ICAM-1, экспрессировали, очищали и охарактеризовывали как описано ранее (Marlin, S.; et al., Nature, 1990, 344, 70-72 и см. Arruda, А.; et al., Antimicrob. АгентыChemother. 1992, 36, 1186-1192). Кратко, изолейцин 454, который расположен на предполагаемой связи между доменом 5 эктодомена и трансмембранным доменом, поворачивали к стоп-кодону стандартным олигонуклеотиднаправленным мутагенезом. Это конструирование приводило к получению молекулы,идентичной по первым 453 аминокислотам мембраносвязанному ICAM-1. Вектор экспрессии создавали с помощью дигидрофолатного гена редуктазы хомяка, неомицин-резистентного маркера, и конструирование кодирующей области sICAM-1 описано выше, с промотером, сдвоенными сигналами и сигналом полиаденилирования ранней области SV40. Рекомбинантную плазмиду трансфецировали в СНО DUX клетки с помощью стандартных способов с использованием фосфата кальция. Клетки пропускали в выбранную среду (G418) и колонии, секретирующие sICAM-1, амплифицировали с помощью метотрексата.sICAM-1 очищали из несывороточной среды обычными неаффинными хроматографическими методами,включая ионообменную хроматографию и хроматографию в зависимости от размера. За связыванием LFA-1 с ICAM-1 наблюдали при первом инкубировании sICAM-1 в 40 мкг/мл в фосфатной буферной соляной среде Dulbecco с кальцием и магнием, дополнительно 2 мМ MgCl2 и 0,1 мМ PMSF (промывочного буфера) в 96-ячеейчной плашке в течение 30 мин при комнатной температуре. Плашки затем блокировали добавлением 2% (вес/об.) бычьего сывороточного альбумина в промывочном буфере при 37 С в течение 1 ч. Блокирующий раствор удаляли из ячеек и тестируемые соединения разбавляли и затем добавляли приблизительно 25 нг иммуноаффинно очищенного LFA-1. LFA-1 инкубировали в присутствии тестируемого соединения и ICAM-1 при 37 С в течение 1 ч. Ячейки промывали 3 раза промывочным буфером. Связавшийся LFA-1 определяли добавлением поликлонального антитела, направленного против пептида, соответствующего цитоплазматическому остатку CD18 при разбавлении 1:100 промывочным буфером и 1% BSA и инкубировали в течение 45 мин при 37 С. Ячейки промывали 3 раза промывочным буфером и связавшиеся поликлональные антитела определяли при добавлении разбавленной 1:4000 пероксидазы лошади, конъюгированной с козьим иммуноглобулином,направленным против крысиного иммуноглобулина. Этот реагент инкубировали в течение 20 мин при 37 С, ячейки промывали, как описано выше, и добавляли субстрат для пероксидазы лошади в каждую ячейку для выработки количественного колориметрического сигнала, пропорционального количествуLFА-1, связавшегося с sICAM-1. Растворимый ICAM-1 (60 мкг/мл) использовали в качестве положительного контроля для ингибирования взаимодействия LFA-1/ICAM-1. Недостаточное добавление LFA-1 в анализ на связывание использовали в качестве базового контроля в тех же образцах. Для всех тестируемых соединений строили зависимости сигнала от дозы. Все соединения, полученные в приведенных выше примерах, тестировали в этом анализе и все соединения имеют Kd10 мкМ. Анализ для определения метаболизма микросомальными ферментами печени человека. Цель анализа. Эта методика анализа разработана для измерения метаболизма in vitro тестируемых соединений микросомальными ферментами печени человека. Полученные данные анализировали для определения времени полужизни (t, мин) для тестируемых соединений. Описание методики анализа. Анализ осуществляли в 50 мМ буфера с фосфатом калия, рН 7,4, и 2,5 мМ NADPH. Тестируемые образцы растворяли в ацетонитриле до конечной концентрации для анализа 1-10 мкМ. Микросомы печени человека разбавляли в буфере для испытания до конечной концентрации для анализа 1 мг белка/мл. Объем 25 мкл раствора соединения и 50 мкл суспензии микросом добавляли к 825 мкл буфера для испытания. Состав инкубировали в течение 5 мин при 37 С в водяной бане. Реакцию инициировали добавлением 100 мкл NADPH. Объемы 80 мкл отбирали из инкубируемой смеси через 0, 3, 6, 10, 15, 20, 40 и 60 мин после начала реакции и добавляли к 160 мкл ацетонитрила. Образцы встряхивали в течение 20 с и затем центрифугировали в течение 3 мин при 3000 об./мин. Объем 200 мкл супернатанта переносили на- 15008443 0,25 мм фильтры из стеклянного волокна и центрифугировали в течение 5 мин при 3000 об./мин. Инъекционные объемы 10 мкл обычно добавляли на Zorbax SB C8 ВЭЖХ колонку с муравьиной кислотой в воде или ацетонитриле при скорости потока 1,5 мл/мин. Процент потери исходного соединения рассчитывали из площади в каждой точке времени для определения времени полужизни. Соединения, полученные в приведенные выше примерах, тестировали в этом анализе и как правило имели t50 мин. Описание терапевтического применения Новые небольшие молекулы формулы I по изобретению ингибируют ICAM-1/LFA-1 зависимую гомотипичную агрегацию лимфоцитов человека и слияние лимфоцитов человека с ICAM-1. Эти соединения терапевтически полезны для модулирования активации/пролиферации иммунных клеток, например,в качестве конкурентных ингибиторов реакций связывания внеклеточных лигандов/рецепторов, включая САМ и лейкоинтегрины. Являясь более специфичными, соединения по изобретению могут использоваться для лечения некоторых воспалительных состояний, включая состояния, вызванные реакцией неспецифической иммунной системы у млекопитающего (например, взрослый респираторный дистрессовый синдром, шок, кислородная токсичность, синдром множественных повреждений органов, вторичный к септицемии, синдром множественных повреждений органов, вторичный к травме, реперфузионное повреждение ткани, обусловленное сердечно-легочным байпассом, инфаркт миокарды или применение с тромболитическими агентами, острый гломерулонефрит, васкулит, реакционный артрит, дерматоз с острыми воспалительными компонентами, инсульт, термическая травма, гемодиализ, лейкаферез, язвенный колит, некротический энтероколит и синдром, связанный с переносом гранулоцитов) и состояния, вызванные реакцией специфической иммунной системы у млекопитающего (например, псориаз, отторжение трансплантата органа/ткани, реакции хозяина против трансплантата и аутоиммунные заболевания,включающие синдром Raynaud, аутоиммунный тироидит, дерматит, рассеянный склероз, ревматоидный артрит, инсулинзависимый сахарный диабет, ювеит, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит, и системная красная волчанка). Соединения по изобретению могут также использоваться для лечения астмы или в качестве дополнительного средства для снижения токсичности при цитокиновой терапии для лечения рака. Вообще, эти соединения могут использоваться для лечения заболеваний, которые обычно лечатся стероидной терапией. Так, другим вариантом осуществления изобретения является способ лечения или профилактики описанных выше состояний с помощью введения терапевтического или профилактического количества одного или нескольких соединений формулы I. В соответствии со способом по изобретению, новые соединения формулы I могут вводиться в профилактических или терапевтических целях отдельно или с другими иммуноподавляющими или противовоспалительными агентами. При профилактическом введении иммуноподавляющее соединение(соединения) являются активными против любой воспалительной реакции или симптома (например,до, одновременно или сразу после пересадки органа или ткани, но для лечения любого симптома отторжения органа). Профилактическое введение соединения формулы I служит для предотвращения или устранения любой соответствующей воспалительной реакции (такой как, например, отторжение трансплантируемого органа или ткани и т.д.). Терапевтическое введение соединения формулы I служит для устранения любого острого воспаления (такого как, например, отторжение трансплантируемого органа или ткани). Так, в соответствии с изобретением соединение формулы I может вводиться до начала воспаления (для устранения возможного воспаления) или после начала воспаления. Новые соединения формулы I в соответствии с изобретением могут вводиться в одной или раздельных дозах орально, парентерально или местно. Подходящая оральная дозировка соединения формулы I может составлять в области от 0,1 мг до 10 г в день. В парентеральных составах подходящая дозированная форма может содержать от 0,1 до 250 мг указанных соединений, тогда как для местного введения предпочтительными являются составы, содержащие от 0,01 до 1% активного ингредиента. Ясно, однако,что вводимая дозировка для пациентов может изменяться и дозировка для любого конкретного пациента будет зависеть от назначения врача, который использует в качестве критерия для фиксированной подходящей дозировки размер и состояние пациента, а также реакцию пациента на лекарственное средство. Когда соединения настоящего изобретения вводятся орально, они могут вводиться в качестве лекарственного средства в форме фармацевтических составов, которые содержат их в смеси с подходящими фармацевтическими носителями. Такими носителями могут быть инертные органические или неорганические носители, подходящие для орального введения. Примерами таких носителей являются вода,желатин, тальк, крахмал, стеарат магния, гуммиарабик, растительные масла, полиалкиленгликоли, вазелин и им подобные. Фармацевтические составы могут быть получены обычным способом и конечными дозированными формами могут быть твердые дозированные формы, например, таблетки, драже, капсулы и им подобные,или жидкие дозированные формы, например, растворы, суспензии, эмульсии и им подобные. Фармацевтические составы могут подвергаться обычным фармацевтическим действиям, таким как стерилизация. Кроме того, фармацевтические составы могут содержать обычные адъюванты, такие как консерванты,стабилизаторы, эмульсификаторы, отдушки, увлажняющие агенты, буферы, соли для изменения осмоти- 16008443 ческого давления и им подобные. Твердые носители, которые могут использоваться, включают, например, крахмал, лактозу, маннит, метилцеллюлозу, микрокристаллическую целлюлозу, тальк, оксид кремния, диосновный фосфат кальция и высокомолекулярные полимеры (такие как полиэтиленгликоль). Для парентерального применения соединение формулы I может вводиться в водном или неводном растворе, суспензии или эмульсии в фармацевтически приемлемом масле или смеси жидкостей, которые могут содержать бактериостатические агенты, антиоксиданты, консерванты, буферы или другие растворы для придания раствору изотоничтости в крови, загустители, суспендирующие агенты или другие фармацевтически приемлемые добавки. Добавки такого типа включают, например, тартратные, цитратные и ацетатные буферы, этанол, пропиленгликоль, полиэтиленгликоль, сложные наполнители (такие как EDTA), антиоксиданты (такие как бисульфит натрия, метабисульфит натрия и аскорбиновая кислота), высокомолекулярные полимеры (такие как жидкие оксиды полиэтилена) для регулирования вязкости и сорбитные ангидридные производные полиэтилена. Также при необходимости могут добавляться консерванты, такие как бензойная кислота, метил- или пропилпарабен, хлорид бензалкония и другие соединения четвертичного аммония. Соединения данного изобретения могут также вводиться в виде растворов для назального применения и могут содержать кроме соединений настоящего изобретения подходящие буферы, регуляторы тоничности, микробные консерванты, антиоксиданты и агенты, повышающие вязкость, в водном носителе. Примерами агентов, используемых для повышения вязкости, являются поливиниловый спирт, производные целлюлозы, поливинилпирролидон, полисорбаты или глицерин. Добавляемые микробные консерванты могут включать хлорид бензалкония, тримеросал, хлорбутанол или фенилэтиловый спирт. Кроме того, соединения по изобретению могут наноситься местно или с помощью свечей. Составы. Соединения формулы I могут быть объединены в составы для терапевтического введения рядом способов. Описания некоторых иллюстрирующих составов приведены ниже. Пример А. Капсулы или таблетки. Соединение формулы I измельчали в порошковую смесь с предварительно смешанными эксципиентами, определенными выше, за исключением лубриканта. Лубрикант затем примешивают и полученную смесь спрессовывают в таблетки или заполняют в твердые желатиновые капсулы. Пример Б. Парентеральные растворы. Эксципиенты смешивали и затем добавляли к одному из соединений формулы I в объеме, необходимом для растворения. Перемешивание продолжали до получения чистого раствора. Раствор затем отфильтровывали в подходящие сосуды или ампулы и стерилизовали в автоклаве. Пример В. Суспензия. Эксципиенты смешивали с водой и затем добавляли одно из соединений формулы I и перемешивание продолжали до получения гомогенной суспензии. Суспензию затем переносили в подходящие сосу- 17008443 ды или ампулы. Пример Г. Местный состав. Подходящие количества Tefose 63, Labrafil M 1944 CS, парафинового масла и воды смешивали и нагревали при 75 С до расплавления всех ингредиентов. Смесь затем охлаждали до 50 С, продолжая перемешивание. Добавляли метилпарабен и пропилпарабен при перемешивании и смесь охлаждали до температуры окружающей среды. К смеси добавляли соединение формулы I и хорошо перемешивали. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I где R1 представляет собой линейный или разветвленный алкил с 1-3 атомами углерода, который является необязательно моно- или дизамещенным группами, независимо выбранными из группы, состоящей из(Б) линейного или разветвленного алкила с 1-4 атомами углерода, где алкильная группа является моно- или дизамещенной группами, независимо выбранными из группы, состоящей из(ii) ОН,или R2 и R3 вместе с атомом азота между ними образуют пиперазиновое кольцо; и(B) трифторметокси; или его фармацевтически приемлемая соль. 2. Соединение формулы I по п.1, гдеR1 представляет собой метильную группу;(Б) линейного или разветвленного алкила с 1-4 атомами углерода, который является моно- или дизамещенным группами, независимо выбранными из группы, состоящей из(Б) трифторметокси; или его фармацевтически приемлемая соль. 3. Соединение формулы I по п.1 или 2, гдеR1 представляет собой метильную группу;(Б) линейного или разветвленного алкила с 1-4 атомами углерода, который является моно- или дизамещенным группами, независимо выбранными из группы, состоящей изR4 представляет собой трифторметокси; или его фармацевтически приемлемая соль. 4. Соединение формулы I по пп.1, 2 или 3, имеющее абсолютную стереохимию, представленную формулой I(S)-N-карбамоилметил-2-[(R)-5-(4-цианобензил)-7-(3,5-дихлорфенил)-5-метил-6-оксо-6,7 дигидро-5H-имидазо[1,2-]имидазол-3-сульфониламино]пропионамида; или их фармацевтически приемлемые соли. 6. Фармацевтическая композиция, включающая соединение по пп.1-4 или 5 и по крайней мере один фармацевтически приемлемый носитель, разбавитель или эксципиент. 7. Применение соединения по пп.1-4 или 5 в качестве лекарственного средства. 8. Применение соединения по пп.1-4 или 5 для получения фармацевтической композиции для лечения воспаления или воспалительного состояния у пациента. 9. Применение по п.8, где излечиваемым состоянием является взрослый респираторный дистрессовый синдром, шок, кислородная токсичность, синдром множественных повреждений органов, вторичный к септицемии, синдром множественных повреждений органов, вторичный к травме, реперфузионное повреждение ткани, обусловленное сердечно-легочным байпассом, инфаркт миокарды или применение с тромболитическими агентами, острый гломерулонефрит, васкулит, реакционный артрит, дерматоз с острыми воспалительными компонентами, инсульт, термическая травма, гемодиализ, лейкаферез, язвенный колит, некротический энтероколит и синдром, связанный с переносом гранулоцитов. 10. Применение по п.8, где излечиваемым состоянием является псориаз, отторжение трансплантата органа/ткани, реакции хозяина против трансплантата или аутоиммунные заболевания, включающие синдром Raynaud, аутоиммунный тироидит, дерматит, рассеянный склероз, ревматоидный артрит, инсулинзависимый сахарный диабет, ювеит, воспалительное заболевание кишечника, болезнь Крона, язвенный колит и системная красная волчанка. 11. Применение по п.8, где излечиваемым состоянием является астма. 12. Применение по п.8, где излечиваемым состоянием являются токсичные действия цитокиновой терапии. 13. Способ получения соединения формулы I по п.1, который включает реакцию соединения формулы IX где R1, R2 и R3 являются такими, как определено в п.1, с получением соединения формулы I. 14. Способ по п.13, в котором соединение формулы IX получено способом, включающим реакцию соединения формулы II где R4 является таким, как определено в п.13, с реактивом Гриньяра, с последующей обработкой SO2 и Nхлорсукцинимидом с получением соединения формулы IX.
МПК / Метки
МПК: A61P 37/00, A61K 31/4164, C07D 487/04, C07D 235/00
Метки: производные, 6,7-дигидро-5h-имидазо[1,2-&alpha]имидазол-3-сульфониламино]-пропионамида
Код ссылки
<a href="https://eas.patents.su/21-8443-proizvodnye-67-digidro-5h-imidazo12-alphaimidazol-3-sulfonilamino-propionamida.html" rel="bookmark" title="База патентов Евразийского Союза">Производные [6,7-дигидро-5h-имидазо[1,2-&alpha]имидазол-3-сульфониламино]-пропионамида</a>