Конденсированные соединения азола и их применение в качестве гипогликаемических агентов
Номер патента: 4676
Опубликовано: 24.06.2004
Авторы: Гийом Жеральд, Бенжан Каролина, Левенс Найджел, Ренар Пьер, Бутэн Жан Альбер, Дакке Катрин, Блан-Дельма Элоди, Ю Саид, Лесёр Даньель, Депрё Патрик
Формула / Реферат
1. Соединения формулы (I)
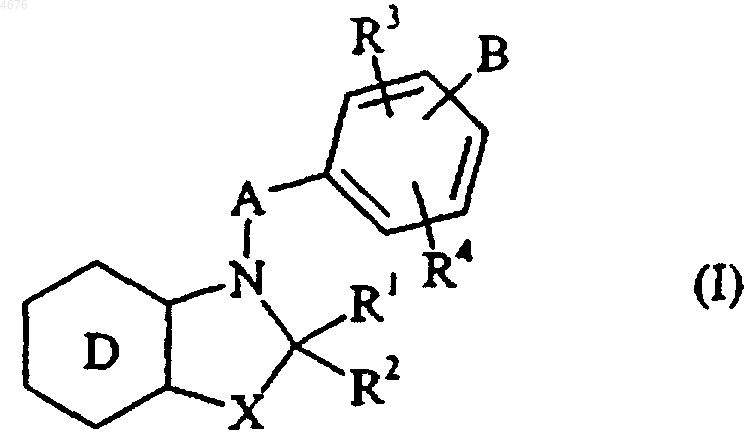
в которой X представляет собой атом кислорода или серы, или группу CH2, или 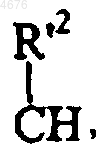
(в которой R'2 совместно с R2 образует дополнительную связь),
R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (C1-C6)алкильную группу, арильную группу, арил-(C1-C6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, арилоксигруппу, арил-(C1-C6)алкоксигруппу, в которой алкоксиостаток может быть линейным или разветвленным, линейную или разветвленную (C1-C6)алкоксигруппу, гидроксигруппу, аминогруппу, линейную или разветвленную (C1-C6)алкиламиногруппу или диалкиламиногруппу, в которых алкильные остатки являются линейными или разветвленными C1-C6,
или R1 и R2 совместно образуют оксо-, тиоксо- или иминогруппу,
возможно, что R2 образует совместно с R'2 дополнительную связь,
A представляет собой (C1-C6)алкиленовую цепочку, в которой группа CH2 может быть заменена на гетероатом, выбираемый из кислорода и серы, на группу NRa (в которой Ra представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу) или на фениленовую или нафтиленовую группу,
B представляет собой линейную или разветвленную (C1-C6)алкильную группу или линейную или разветвленную (C2-C6)алкенильную группу, эти группы замещены группой R5, группой формулы (II)
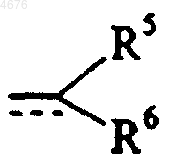 (II)
(II)
или группой формулы (III)
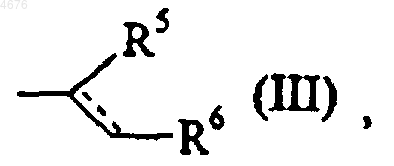
в этих группах
обозначение --- обозначает, что связь является одинарной или двойной,
R5 представляет 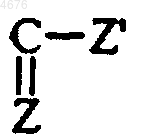 группу, в которой Z представляет собой атом кислорода или серы, а Z' представляет собой группу OR или NRR', а
группу, в которой Z представляет собой атом кислорода или серы, а Z' представляет собой группу OR или NRR', а
R6 представляет группу 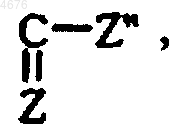 в которой Z" представляет собой группу Z' или R (в которой R и R', которые могут быть одинаковыми или различными, каждый представляет собой группу R" или -C(Me)2COOR", в которых R" представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу, линейную или разветвленную (C2-C6)алкенильную группу, линейную или разветвленную (C2-C6)алкинильную группу, арильную группу, арил-(C1-C6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, арил-(C2-C6)алкенильную группу, в которой алкенильный остаток может быть линейным или разветвленным, арил-(C2-C6)алкинильную группу, в которой алкинильный остаток может быть линейным или разветвленным, гетероарильную группу, гетероарил-(C1-C6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, гетероарил-(C2-C6)алкенильную группу, в которой алкенильный остаток может быть линейным или разветвленным, гетероарил-(C2-C6)алкинильную группу, в которой алкинильный остаток может быть линейным или разветвленным, (C3-C8)циклоалкильную группу, (C3-C8)циклоалкил-(C1-C6)алкильную группу, в которых алкил остаток может быть линейным или разветвленным, или линейную или разветвленную (C1-C6)полигалоалкильную группу),
в которой Z" представляет собой группу Z' или R (в которой R и R', которые могут быть одинаковыми или различными, каждый представляет собой группу R" или -C(Me)2COOR", в которых R" представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу, линейную или разветвленную (C2-C6)алкенильную группу, линейную или разветвленную (C2-C6)алкинильную группу, арильную группу, арил-(C1-C6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, арил-(C2-C6)алкенильную группу, в которой алкенильный остаток может быть линейным или разветвленным, арил-(C2-C6)алкинильную группу, в которой алкинильный остаток может быть линейным или разветвленным, гетероарильную группу, гетероарил-(C1-C6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, гетероарил-(C2-C6)алкенильную группу, в которой алкенильный остаток может быть линейным или разветвленным, гетероарил-(C2-C6)алкинильную группу, в которой алкинильный остаток может быть линейным или разветвленным, (C3-C8)циклоалкильную группу, (C3-C8)циклоалкил-(C1-C6)алкильную группу, в которых алкил остаток может быть линейным или разветвленным, или линейную или разветвленную (C1-C6)полигалоалкильную группу),
R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, атом галогена или группу R, OR или NRR' (в которых R и R' имеют значения, указанные здесь ранее), или R3 и R4 совместно с атомами углерода, которые их несут, в случае, если их несут два смежных атома углерода, образуют кольцо, которое имеет от 5 до 6 членов кольца и которое может содержать гетероатом, выбираемый из кислорода, серы и азота,
D представляет собой бензольное ядро, в этом случае X не может представлять 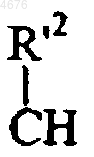 группу, как указано здесь ранее, или
группу, как указано здесь ранее, или
D представляет собой пиридиновое, пиразиновое, пиримидиновое или пиридазиновое ядро,
эти ядра замещены от 1 до 3 одинаковыми или различными группами, выбираемыми из R, OR, S(O)nR, 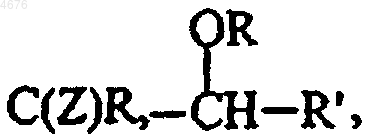 C(Z)OR, NRR', C(Z)NRR',
C(Z)OR, NRR', C(Z)NRR', 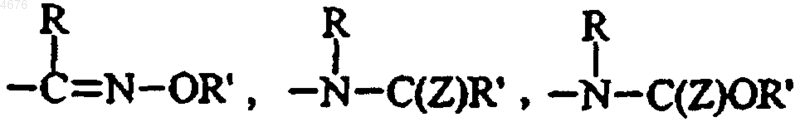 (в этих группах R, R' и Z имеют значения, указанные здесь ранее, а n представляет собой 0, 1 или 2), циано, нитро и атомов галогенов, причем
(в этих группах R, R' и Z имеют значения, указанные здесь ранее, а n представляет собой 0, 1 или 2), циано, нитро и атомов галогенов, причем
если A представляет собой группу CH2, B не может представлять собой линейный или разветвленный (C1-C6)алкил, замещенный группой 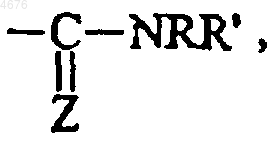
если группы A и B находятся в орто-положении по отношению к одному из бензольных ядер, которые их несут, B не может представлять собой линейную или разветвленную (C2-C6)алкиленовую группу, замещенную группой 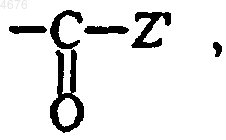
если A представляет собой группу 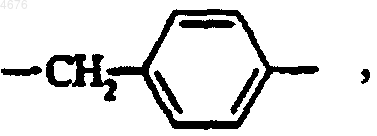 B не может представлять собой группу-CH2-COOH,
B не может представлять собой группу-CH2-COOH,
арил следует понимать как фенильную, нафтильную или бифенильную группу, которые могут быть частично гидрогенированы,
гетероарил следует понимать как любую моно- или бициклическую ароматическую группу, содержащую от 5 до 10 членов кольца, которая может быть частично гидрогенирована на одном из колец в случае бициклических гетероарилов и которая содержит от 1 до 3 гетероатомов, выбираемых из кислорода, азота и серы,
причем арильная и гетероарильная группы, определенные таким образом, могут быть замещены от 1 до 3 группами, выбираемыми из линейного или разветвленного (C1-C6)алкила, линейного или разветвленного (C1-C6)алкокси, карбокси, формила, NRbRc (в которой Rb и Rc, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (C1-C6)алкильную группу, арильную группу или гетероарильную группу), сложного эфира, амидо, нитро, циано, O-C(Me)2COOR" (в которой R" имеет значение, указанное здесь ранее) и атомов галогенов,
их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, в которой R1 и R2 образуют оксогруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, в которой R3 и R4 одновременно представляют собой атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, в которой A представляет собой алкиленовую группу, в которой группа CH2 может быть заменена гетероатомом, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, в которой A представляет собой этиленоксигруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формуыы (I) по п.1, в которой A представляет собой алкиленовую группу, в которой группа CH2 может быть замещена на фениленовую или нафтиленовую группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по п.1, в которой X представляет собой атом кислорода или атом серы, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, в которой X представляет собой группу CHR'2 и D представляет собой пиридиновое ядро, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по п.1, в которой B представляет собой алкильную или алкенильную группу, эти группы замещены группой формулы (II), их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по п.1, в которой B представляет собой алкильную или алкенильную группу, эти группы замещены группой R5, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по п.1, в которой D представляет собой незамещенное бензольное ядро, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Соединения формулы (I) по п.1, в которой D представляет собой бензольное ядро, замещенное арилкарбонильной группой, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
13. Соединения формулы (I) по п.1, в которой D представляет собой пиридиновое ядро, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
14. Соединения формулы (I) по п.1, в которой D представляет собой пиразиновое, пиримидиновое или пиридазиновое ядро, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
15. Соединения формулы (I) по п.1, которые представляют собой
диэтил 2-{4-[2-(2-оксо-1,3-бензоксазол-3(2H)-ил)этокси]бензилиден}малонат,
диэтил 2-{4-[2-(2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензилиден}малонат и
диэтил 2-{4-[3-(2-оксо-1,3-бензотиазол-3(2H)-ил)пропокси]бензилиден} малонат,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
16. Соединения формулы (I) по п.1, которые представляют собой
диэтил 2-{4-[2-(2-оксо-1,3-бензоксазол-3(2H)-ил)этокси]бензил}малонат,
3-этокси-3-оксо-2-{4-[2-(2-оксо-1,3-бензоксазол-3(2H)-ил)этокси]бензил}пропановую кислоту,
2-{4-[2-(2-оксо-1,3-бензоксазол-3(2H)-ил)этокси]бензил}малоновую кислоту,
диэтил 2-{4-[2-(2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(2-оксо-1,3-бензотиазол-3(2H)-ил)-этокси]бензил}малонат,
3-метокси-3-оксо-2-{4-[2-(2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}пропановую кислоту,
3-этокси-3-оксо-2-{4-[2-(2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}пропановую кислоту и
2-{4-[2-(2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малоновую кислоту,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
17. Соединения формулы (I) по п.1, которые представляют собой
диметил 2-{4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-бензоил-2-оксо-1,3-бензоксазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-(2-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-([1,1'-бифенил]-4-илкарбонил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-(1-нафтоил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-(3-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(2-оксо-6-(3-пиридилкарбонил)-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-(4-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
2-{4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малоновую кислоту,
диметил 2-{4-[2-(6-(2-нафтоил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-(4-метоксибензоил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
2-{4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}-3-метокси-3-оксопропановую кислоту и
метил 2-{4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}-3-(метиламино)-3-оксопропаноат,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
18. Соединения формулы (I) по п.1, которые представляют собой
диметил 2-{4-[2-(6-бензил-2-оксо-4,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-бензил-2-оксо-1,3-бензоксазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-(2-хлоробензил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-(3-хлоробензил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-(1-нафтилметил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат и
диметил метил 2-{4-[2-(6-(4-хлоробензил)-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
19. Соединения формулы (I) по п.1, которые представляют собой
диметил 2-{4-[2-(2-оксо[1,3]оксазоло[4,5-b]пирид-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(1H-пирроло[2,3-b]пирид-1-ил)этокси]бензил}малонат и
2-{4-[2-(1H-пирроло[2,3-b]пирид-1-ил)этокси]бензил}малоновую кислоту,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
20. Соединения формулы (I) по п.1, которые представляют собой
диметил 2-{4-[2-(6-[гидрокси(фенил)метил]-2-оксо-1,3-бензоксазол-3(2H)-ил)этокси]бензил}малонат и
диметил 2-{4-[2-(6-[гидрокси(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
21. Соединения формулы (I) по п.1, которые представляют собой
диметил 2-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-{4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
диметил 2-(4-[2-(6-[(3-хлорофенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат и
диметил 2-{4-[2-(6-[[1,1'-бифенил]-4-ил(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]бензил}малонат,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
22. Соединения формулы (I) по п.1, которые представляют собой
3-{4-[3-(2-оксо-1,3-бензоксазол-3(2H)-ил)пропил]фенил}-2-пропеновую кислоту,
3-{4-[3-(2-оксо-1,3-бензоксазол-3(2H)-ил)пропил]фенил}-2-пропановую кислоту,
3-{4-[3-(2-оксо-1,3-бензотиазол-3(2H)-ил)пропил]фенил}-2-пропеновую кислоту,
3-{4-[3-(2-оксо-1,3-бензотиазол-3(2H)-ил)пропил]фенил}-2-пропановую кислоту,
метил 3-{4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропаноат,
метил 3-{4-[2-(6-бензоил-2-оксо-1,3-бензоксазол-3(2H)-ил)этокси]фенил}пропаноат,
метил 3-{4-[2-(6-бензил-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропаноат,
метил 3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропаноат и
3-{4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропановую кислоту,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
23. Способ получения соединений формулы (I), который отличается тем, что в качестве исходного материала применяют соединение формулы (IV)

в которой R1, R2, X и D имеют значения, указанные для формулы (I),
которое конденсируют в основной среде с соединением формулы (V)
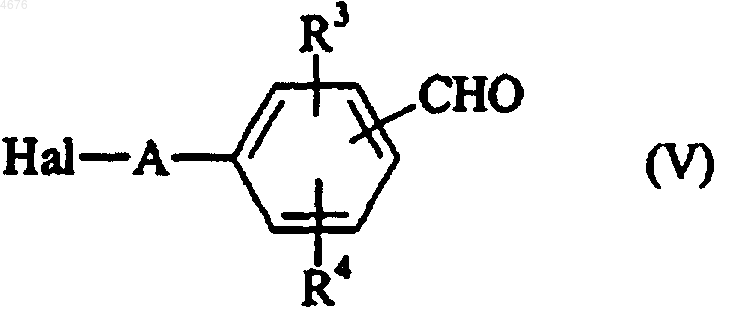
в которой Hal представляет собой атом галогена и A, R3 и R4 имеют значения, указанные для формулы (I),
с получением соединения формулы (VI)
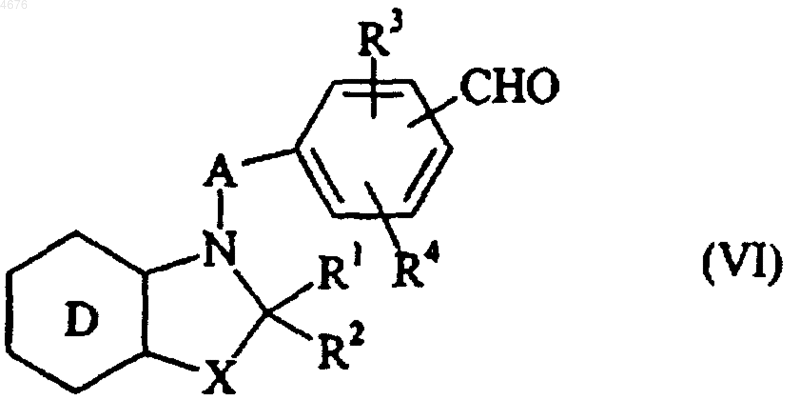
в которой A, D, X, R1, R2, R3 и R4 имеют значения, указанные здесь ранее,
которое конденсируют в основной среде с соединением формулы (VII)
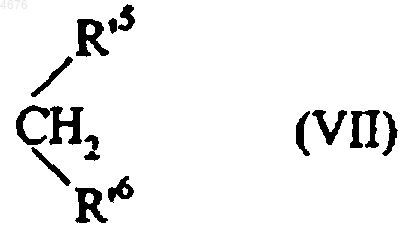
в которой R'5 и R'6 могут иметь любое из значений, приведенных здесь ранее для R5 и R6, за исключением группы COOH,
с получением соединения формулы (I/a), частного случая соединений формулы (I)
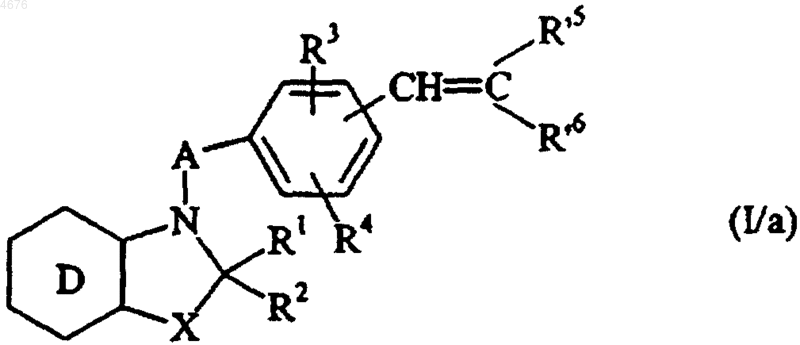
в которой D, A, X, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,
которое гидрогенируют в присутствии катализатора, такого как палладий-на-углероде, например, с получением соединения формулы (I/b), частного случая соединений формулы (I)

в которой D, A, X, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,
(для соединений формул (I/a) и (I/b) возможно получение непосредственно при помощи прямой конденсации соединения формулы (IV) с соединением формулы (V')
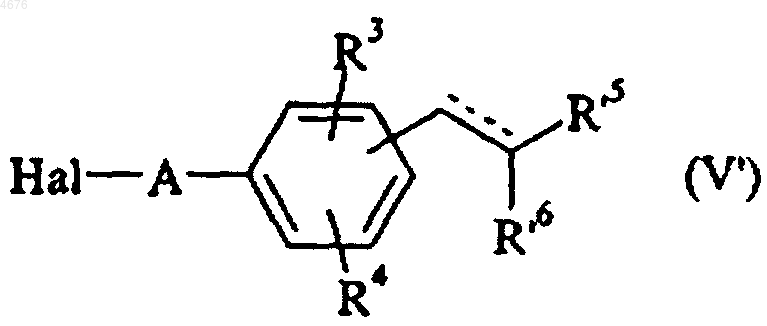
в которой Hal представляет собой атом галогена и A, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее),
или это соединение формулы (VI) конденсируют при условиях реакции Хоммера-Эммонса с соответствующим фосфоновым соединением формулы (VIII)
Hal-CH2-B' (VIII),
в которой Hal представляет собой атом галогена и B' представляет собой линейную или разветвленную (C1-C5)алкильную группу или линейную или разветвленную (C2-C5)алкенильную группу, эти группы замещены группой R'5, группой формулы (II')
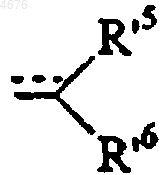
или группой формулы (III')
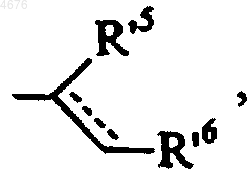
в которой группы R'5 и R'6 и обозначение --- имеют значения, указанные здесь ранее,
с получением соединения формулы (I/c), частного случая соединений формулы (I)
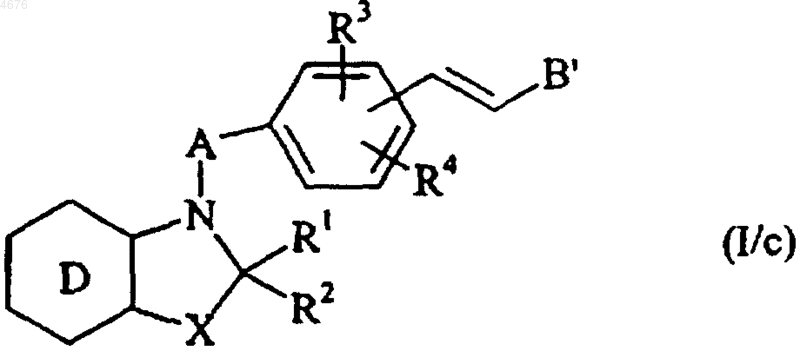
в которой D, X, A, B', R1, R2, R3 и R4 имеют значения, указанные здесь ранее,
которое можно подвергать каталитической гидрогенации в присутствии палладия, например, с получением соединения формулы (I/d), частного случая соединений формулы (I)

в которой D, A, X, B', R1, R2, R3 и R4 имеют значения, указанные здесь ранее,
или это соединение формулы (VI) переводят в соответствующий хлорид кислоты, который конденсируют, в присутствии соединения палладия или олова, например, с соединением формулы (IX)
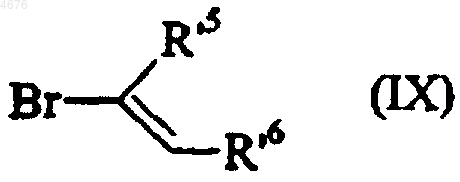
в которой R'5 и R'6 имеют значения, указанные здесь ранее,
с получением соединения формулы (X)
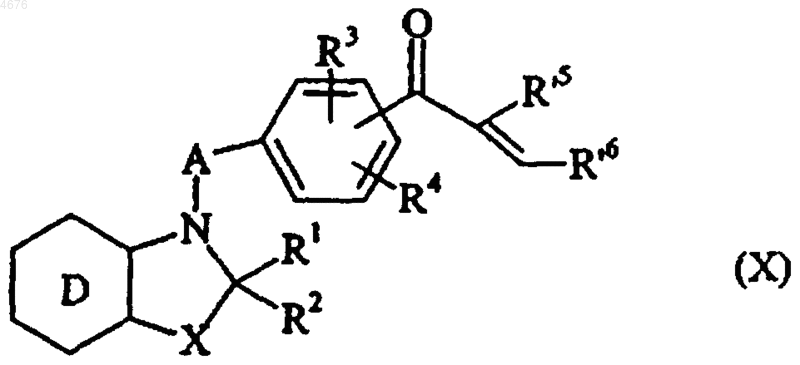
в которой D, X, A, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,
которое подвергают действию восстановителя, такого как Et3SiH, например, с получением соединения формулы (I/e), частного случая соединений формулы (I)
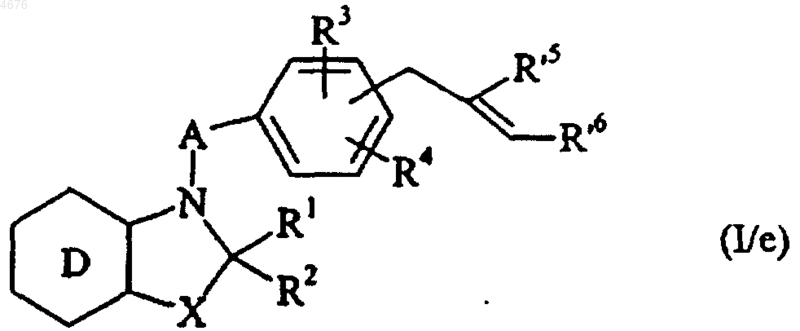
в которой D, X, A, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,
причем соединения формулы (I/a), (I/b), (I/c), (I/d) или (I/e), в которых R'5 и R'6 представляют собой сложноэфирные группы, могут быть полностью или частично гидролизированы с получением соответствующих гемдикарбоксилированных или хемикарбоксилированных соединений формулы (I/f), частного случая соединений формулы (I)
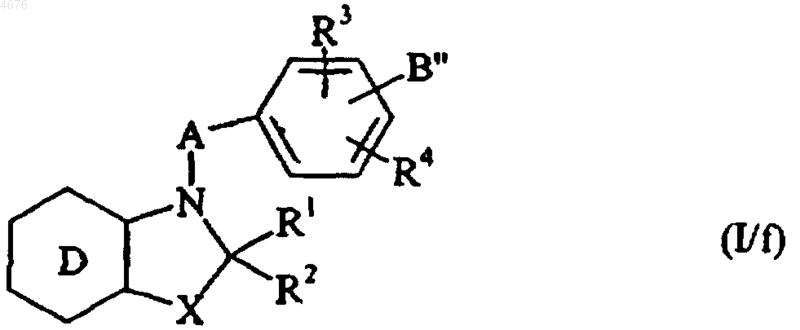
в которой D, X, A, R1, R2, R3 и R4 имеют значения, указанные здесь ранее, и B" представляет собой группу, как указано здесь ранее для B, в которой R5 и/или R6 представляет(ют) собой группу COOH,
(для соединений формулы (I/f), в которой B" представляет собой группу -CH=CH-COOH, возможно получение непосредственно из соединения формулы (VI) при помощи конденсации малоновой кислоты при декарбоксилирующих условиях и восстановление их с получением соединений формулы (I/f) в которой B" представляет собой группу -CH2-CH2-COOH),
соединения формул с (I/a) по (I/f) составляют совокупность соединений по изобретению, эти соединения можно очищать согласно традиционной методике разделения, переводить, при желании, в аддитивные соли и фармацевтически приемлемой кислотой или основанием и необязательно разделять на их изомеры согласно традиционной методике разделения.
24. Фармацевтические композиции, включающие в качестве активного ингредиента по меньшей мере одно соединение формулы (I) по любому из пп. с 1 по 22 или его фармацевтически приемлемую аддитивную соль с кислотой или основанием, отдельно или в сочетании с одним или более фармацевтически приемлемыми эксципиентами.
25. Фармацевтические композиции по п.24 для применения для получения лекарственного препарата для лечения и/или профилактики гипергликаемии, дислипидаемии и, более конкретно, при лечении инсулиннезависимого диабета типа II, сопротивляемости инсулину, непереносимости глюкозы, нарушений, связанных с синдромом X, заболевания коронарной артерии и других сердечно-сосудистых заболеваний, почечных нарушений, ретинопатии, нарушений, связанных с активацией эндотелиальных клеток, псориаза, полицистического синдрома яичников, слабоумия, остеопороза, кишечных воспалительных нарушений, миотонической дистрофии, панкреатита, артериосклероза, ксантомы, а также при лечении или профилактике диабета типа I, ожирения, регулировании аппетита, анорексии, булимии, нервной анорексии, а также раковых патологий, и в частности, гормонзависимых раков, таких как рак молочной железы или рак толстой кишки, а также как ингибиторов ангиогенеза.
Текст
1 Настоящее изобретение относится к новым гетероциклическим соединениям, к способу их получения и к фармацевтическим соединениям,их содержащим. Соединения, описанные в настоящем изобретении являются новыми и имеют фармакологические свойства, которые представляют особый интерес: они являются отличными гипогликаемическими и гиполипидаемическими агентами. Лечение инсулиннезависимого диабета типа II остается неудовлетворительным, несмотря на введение на рынок большого количества оральных гипогликаемических соединений, разработанных для усиления секреции инсулина и способствования его действию в периферийных тканях-мишенях. За последние десять лет класс соединений,имеющих тиазолидиндионовую структуру (US 5 089 514, US 5 306 726), проявил выдающуюся противодиабетическую активность благодаря способствованию чувствительности к инсулину в периферийных тканях-мишенях (скелетные мышцы, печень, жировая ткань) животных моделей, имеющих инсулиннезависимый диабет типа II. Эти соединения также понижают уровни инсулина и уровни липидов у этих же животных моделей, и включают дифференциациюin vitro преадипоцитных линий клеток в адипоцитные линии клеток (A. Hiragun и др, J. Cell.Physiol., 1988, 134, 124-130; R.F. Kleitzen и др.,Mol. Pharmacol., 1992, 41, 393-398). Обработка преадипоцитных линий клеток тиазолидиндион розиглитазоном приводит к экспрессии специфических генов липижного метаболизма, таких как аР 2 и адипзин, а также экспрессии транспортеров глюкозы GLUT1 и GLUT4, допуская,что действие тиазолидиндионов, которое наблюдается in vivo, может опосредоваться через жировую ткань. Это специфическое действие достигается при помощи стимуляции факторов ядерной транскрипции: пероксисомного пролифераторно-активируемоего гамма-рецептора(PPAR 2). Такие соединения способны восстанавливать чувствительность к инсулину в периферийных тканях, таких как жировая ткань или скелетная мускулатура (I.E. Gerich, New Engl.Med., 19, 321, 1231-1245). Соединения, которые имеют тиазолидиндионовую структуру (троглитазон, розиглитазон) проявили обеспокоивающие побочные эффекты у людей, включая проблемы с печенью(Script 2470, 1999, 8 е сент., 25). Большое количество гипогликаемиков имеют существенные побочные эффекты (гепатические, сердечные, гематопоэтические), которые ограничивают их долговременное применение при лечении инсулиннезависимого диабета типа II. Разработка новых терапевтиков, которые являются менее токсичными и активны долгое время, является абсолютно необходимой для этой патологии. Более того, гиперлипидае 004676 2 мия часто наблюдается у диабетиков (Diabеtеs Саrе, 1995, 18 (дополнение 1), 86/8/93). Связь гиперлипидаемии и гипергликаемии повышает риск сердечно-сосудистого заболевания у диабетиков. Гипергликаемия, гиперлипидаемия и ожирение стали патологиями современного мира, которые примечательны принятием пищи в больших количествах и хронической нехваткой физических упражнений. Повышение частоты этих патологий требует разработки новых терапевтических агентов, которые являются активными при таких нарушениях: соединения, имеющие отличную гипогликаемическую и гиполипидаемическую активность при избежании побочных эффектов,которые наблюдались у тиазолидиндионов, соответственно они являются очень выигрышными при лечении и/или профилактике этих патологий, и особенно показаны при лечении инсулиннезависимого диабета типа II для снижения периферийной сопротивляемости инсулину и для нормализации контроля над глюкозой. Дополнительно к тому факту, что они новы, соединения по настоящему изобретению соответствуют вышеперечисленным фармакологическим критериям и являются отличными гипогликаемическими и гииполипидаемическими агентами. Более конкретно, настоящее изобретение относится к соединениям формулы (I) в которой Х представляет собой атом кислорода или, в которой серы, или группу СН 2 илиR'2 совместно с R2 образует дополнительную связь),R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную(C1-С 6)алкильную группу, арильную группу,арил(С 1-С 6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, арилоксигруппу, арил(С 1-С 6) алкоксигруппу, в которой алкоксиостаток может быть линейным или разветвленным, линейную или разветвленную (С 1-С 6)алкоксигруппу, гидроксигруппу, аминогруппу, линейную или разветвленную (C1-С 6)алкиламиногруппу или диалкиламиногруппу, в которых алкильные остатки являются линейными или разветвленными С 1-С 6, или R1 и R2 совместно образуют оксо-,тиоксо- или иминогруппу, возможно, что R2 образует совместно с R'2 дополнительную связь,А представляет собой (С 1-С 6)алкиленовую цепочку, в которой группа СН 2 может быть заменена на гетероатом, выбираемый из кислорода и серы, на группу NRa (в которой Ra пред 3 ставляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу),или на фениленовую или нафтиленовую группу,В представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или линейную или разветвленную (С 2-С 6)алкенильную группу, эти группы замещены группой R5, группой формулы (II) или группой формулы (III) в этих группахобозначает, что связь является одинарной или двойной,группу, в которой ZR5 представляет представляет собой атом кислорода или серы, аZ' представляет собой группу OR или NRR' в которой а R6 представляет группуZ" представляет собой группу Z' или R (в которой R и R', которые могут быть одинаковыми или различными, каждый представляет собой группу R" или -C(Me)2COOR", в которых R" представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 2-С 6) алкенильную группу, линейную или разветвленную (С 2-С 6)алкинильную группу, арильную группу, арил(С 1-С 6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, арил(С 2-С 6)алкенильную группу, в которой алкенильный остаток может быть линейным или разветвленным, арил(С 2 С 6)алкинильную группу, в которой алкинильный остаток может быть линейным или разветвленным, гетероарильную группу, гетероарил(С 1 С 6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, гетероарил(С 2-С 6)алкенильную группу, в которой алкенильный остаток может быть линейным или разветвленным, гетероарил-(С 2 С 6)алкинильную группу, в которой алкинильный остаток может быть линейным или разветвленным, (С 3-С 8)циклоалкильную группу, (С 3 С 8)циклоалкил(С 1-С 6)алкильную группу, в которых алкилостаток может быть линейным или разветвленным, или линейную или разветвленную (С 1-С 6)полигалоалкильную группу),R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, атом галогена или группу R, OR или NRR' (в которых R и R' имеют значения,указанные здесь ранее), или R3 и R4 совместно с атомами углерода, которые их несут, в случае,если их несут два смежных атома углерода, образуют кольцо, которое имеет от 5 до 6 членов кольца, и которое может содержать гетероатом,выбираемый из кислорода, серы и азота,D представляет собой 4 бензольное ядро, в этом случае Х не может группу, как указано здесь рапредставлять нее,или D представляет собой пиридиновое,пиразиновое, пиримидиновое или пиридазиновое ядро,эти ядра замещены от 1 до 3 одинаковыми или различными группами, выбираемыми из R,OR, S(O)nR, C(Z)R,C(Z)NRR',группах R, R' и Z имеют значения, указанные здесь ранее, а n представляет собой 0,1 или 2),циано, нитро и атомов галогенов, причем: если А представляет собой группу СН 2, В не может представлять собой линейный или разветвленный (С 1-С 6)алкил, замещенный группой если группы А и В находятся в орто положении по отношению к одному из бензольных ядер, которые их несут, В не может представлять собой линейную или разветвленную (С 2 С 6)алкиленовую группу, замещенную группой если В не может представлять собой группу-СН 2-СООН,арил следует понимать как фенильную,нафтильную или бифенильную группу, которые могут быть частично гидрогенизированы,гетероарил следует понимать как любую моно- или бициклическую ароматическую группу, содержащую от 5 до 10 членов кольца,которая может быть частично гидрогенизирована на одном из колец в случае бициклических гетероарилов, и которая содержит от 1 до 3 гетероатомов, выбираемых из кислорода, азота и серы,причем арильная и гетероарильная группы,определенные таким образом, могут быть замещены от 1 до 3 группами, выбираемыми из линейного или разветвленного (С 1-С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси,карбокси, формила, NRbRc (в которой Rb и Rc,которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (C1-С 6)алкильную группу, арильную группу или гетероарильную группу), сложного эфира, амидо, нитро, циано, O-C(Me)2COOR" (в которой R" имеет значение, указанное здесь ранее) и атомов галогенов,к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот можно упомянуть, без привнесения какихлибо ограничений, соляную, бромистоводород 5 ную, серную, фосфоновую, уксусную, трифтороуксусную, молочную, пирувовую, малоновую, сукциновую, глутаровую, фумаровую,виннокаменную, малеиновую, лимонную, аскорбиновую, метансульфоновую, камфоровую,оксалиловую кислоту, пр. Среди фармацевтически приемлемых оснований можно упомянуть, без привнесения каких-либо ограничений, гидроксид натрия,гидроксид калия, триэтиламин, трет-бутиламин,пр. Предпочтительными соединениями по изобретению являются соединения формулы (I) в которой R1 и R2 совместно образуют оксогруппу. Предпочтительной группой для R3 и R4 является атом водорода. Предпочтительно, А представляет собой алкиленовую цепочку, в которой группа СН 2 может быть замещена гетероатомом. Более конкретно, изобретение относится к соединениям формулы (I), в которой А представляет собой этиленоксигруппу. Предпочтительными группами D являются бензоловое ядро и пиридиновое ядро. Предпочтительными группами D являются бензоловое ядро и пиридиновое ядро, эти группы замещены или не замещены, предпочтительно в положении 6, и более конкретно группой(такой как, например, группа NHCOPh) Х предпочтительно представляет собой атом кислорода или атом серы, или если D представляет собой пиридиновое ядро, группуCHR'2. Предпочтительными группами В являются такие: алкильная или алкенильная группы, замещенные группой формулы (II) и, более конкретно, алкильные группы, замещенные группой формулы (II), такие как, например,в которой m предгруппа ставляет собой 1 или 2, и R и R', которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или алкильную группу, такую как метил или этил, например, 004676, в которой m предгруппа ставляет собой 1 или 2, R предпочтительно представляет собой атом водорода или алкильную группу, такую как метил или этил, например, и R' преимущественно представляет собой арильную группу, такую как, например, необязательно замещенный фенил,в которой m или группа представляет собой 1 или 2,и R и R', которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или алкильную группу, такую как метил или этил, например,алкильные или алкенильные группы, замещенные группой R5, и более конкретно, алкильные группы, замещенные группой R5, такие как, например, группа -(СН 2)p-СООR, в которой р представляет собой 1, 2 или 3 и R представляет собой атом водорода или алкильную группу,такую как метил или этил, например, или арил,такой, как фенил, например. Еще более конкретно, изобретение относится к следующим соединениям формулы (I): диэтил 2-4-[2-(2-оксо-1,3-бензоксазол 3(2 Н)-ил)этокси]бензилиденмалонат,диэтил 2-4-[2-(2-оксо-1,3-бензоксазол 3(2 Н)-ил)этокси]бензилмалонат,3-этокси-3-оксо-2-4-[2-(2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензилпропановая кислота,2-4-[2-(2-оксо-1,3-бензоксазол-3(2 Н)-ил) этокси]бензилмалоновая кислота,диэтил 2-4-[2-(2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилиденмалонат,диметил 2-4-[2-(2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилиденмалонат,диэтил 2-4-[2-(2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалонат,3-метокси-3-оксо-2-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилпропановая кислота,3-этокси-3-оксо-2-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилпропановая кислота,2-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалоновая кислота,диэтил 2-4-[3-(2-оксо-1,3-бензотиазол 3(2 Н)-ил)пропокси]бензилиденмалонат,трет-бутил метил 2-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиденпропандиоат,трет-бутил метил 2-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиден-малонат,диметил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил-малонат, 7 диметил 2-4-[2-(6-бензил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил-малонат,диметил 2-4-[2-(6-бензоил-2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензилиден-малонат,диметил 2-4-[2-(6-бензоил-2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензил-малонат,диметил 2-4-[2-(6-бензил-2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензил малонат,3-4-[2-(2-оксо-1,3-бензоксазол-3(2 Н)-ил) этокси]фенил-2-пропеновая кислота,3-4-[2-(2-оксо-1,3-бензоксазол-3(2 Н)-ил) этокси]фенил-2-пропановая кислота,3-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]фенил-2-пропеновая кислота,3-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]фенил-2-пропановая кислота,диметил 2-4-[2-(2-оксо[1,3]оксазоло[4,5b]пирид-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(1 Н-пирроло[2,3-b]пирид 1-ил)этокси]бензилмалонат,метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-пропаноат,диметил 2-4-[2-(6-[гидрокси(фенил)метил]-2-оксо-1,3-бензоксазол-3(2 Н)-ил)-этокси] бензилмалонат,метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]фенилпропаноат,диметил 2-(4-[2-(6-[гидрокси(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)-этокси] бензилмалонат,диметил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат,диметил 2-4-[2-(6-(2-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат,диметил 2-4-[2-(6-([1,1'-бифенил]-4-илкарбонил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат,диметил 2-4-[2-(6-([1,1'-бифенил]-4-илметил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилмалонат,диметил 2-4-[2-(6-(1-нафтоил)-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(6-(3-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(6-(2-хлоробензил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-(4-[2-(6-(3-хлоробензил)-2-оксо 1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(6-(1-нафтилметил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(2-оксо-6-(3-пиридилкарбонил)-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат, 004676(метоксиимино)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалонат,3-метокси-3-оксо-2-4-[2-(1 Н-пирроло[2,3b]пирид-1-ил)этокси]бензилпропановая кислота,диметил 2-4-[2-(6-(бензоиламино)-2-оксо 1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат,метил 3-4-[2-(6-бензил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат,метил 3-4-[2-(6-[(метоксиимино)(фенил) метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенилпропаноат,3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропановая кислота,2-4-[2-(1 Н-пирроло[2,3-6]пирид-1-ил) этокси]бензилмалоновая кислота,метил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил-3-(метиламино)-3-оксопропаноат,диметил 2-4-[2-(6-(анилинокарбонил)-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-(4-[2-(6-бензоил-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этил]аминобензил)малонат,диметил 2-4-[2-(2-оксо-6-[2-фенилэтенил]-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат. Энантиомеры, диастереоизомеры, а также фармацевтически приемлемые аддитивные соли настоящих соединений кислотой или основанием образуют неотъемлемую часть изобретения. Настоящее изобретение относится также к способу получения соединений формулы (I),который отличается тем, что в качестве исходного материала применяют соединение формулы (IV): 9 в которой R1, R2, Х и D имеют значения, указанные для формулы (I), которое конденсируют в основной среде с соединением формулы (V): 10 ную группу, эти группы замещены группой R'5,группой формулы (II'): или группой формулы (III'): в которой Hal представляет собой атом галогена и А, R3 и R4 имеют значения, указанные для формулы (I),с получением соединения формулы (VI): в которой R'5 и R'6 могут иметь любое из значений, приведенных здесь ранее для R5 и R6, за исключением группы СООН,с получением соединения формулы (I/a),частного случая соединений формулы (I):(I/b), частного случая соединений формулы (I): в которой D, А, X, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,(для соединений формул (I/a) и (I/b) возможно получение непосредственно при помощи прямой конденсации соединения формулы (IV) с соединением формулы (V): в которой Hal представляет собой атом галогена и A, R3, R4, R'5 и R'6 имеют значения,указанные здесь ранее),или это соединение формулы (VI) конденсируют, при условиях реакции ХоммераЭммонса, с соответствующим фосфоновым соединением формулы (VIII):(VIII) в которой Hal представляет собой атом галогена и В' представляет собой линейную или разветвленную (С 1-С 5)алкильную группу или линейную или разветвленную (С 2-С 5)алкениль в которой группы R'5 и R'6 и обозначение имеют значения, указанные здесь ранее,с получением соединения формулы (I/c),частного случая соединений формулы (I): в которой D, X, А, В', R1, R2, R3 и R4 имеют значения, указанные здесь ранее,которое можно подвергать каталитической гидрогенации в присутствии палладия, например, с получением соединения формулы (I/d),частного случая соединений формулы (I): в которой D, А, X, В', R1, R2, R3 и R4 имеют значения, указанные здесь ранее,или это соединение формулы (VI) переводят в соответствующий хлорид кислоты, который конденсируют, в присутствии соединения палладия или олова например, с соединением формулы (IX): в которой D, X, A, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,которое подвергают действию восстановителя, такого как Et3SiH, например, с получением соединения формулы (I/е), частного случая соединений формулы (I):(I/e), в которых R'5 и R'6 представляют собой сложноэфирные группы, могут быть полностью или частично гидролизированы с получением соответствующих гемдикарбоксилированных 11 или хемикарбоксилированных соединений формулы (I/f), частного случая соединений формулы (I): в которой D, X, A, R1, R2, R3 и R4 имеют значения, указанные здесь ранее и В" представляет собой группу, как указано здесь ранее для В, в которой R5 и/или R6 представляет(ют) собой группу СООН,(для соединений формулы (I/f), в которой В" представляет собой группу -СН=СН-СООН,возможно получение непосредственно из соединения формулы (VI) при помощи конденсации малоновой кислоты при декарбоксилирующих условиях и восстановление их с получением соединений формулы (I/f) в которой В" представляет собой группу -СН 2-СН 2-СООН),соединения формул с (I/a) по (I/f) составляют совокупность соединений по изобретению,эти соединения можно очищать согласно традиционной методике разделения, переводить, при желании, в аддитивные соли и фармацевтически приемлемой кислотой или основанием, и необязательно разделять на их изомеры согласно традиционной методике разделения. Соединения формулы (IV) и (V) являются коммерчески доступными, или их легко может получить специалист в данной области техники при помощи традиционных химических реакций или химических реакций, описанных в литературе. Соединения по настоящему изобретению имеют очень ценные фармакологические свойства. Соединения проявляют особенно отличную активность при снижении уровней глюкозы в крови. Как результат таких качеств, они могут применяться терапевтически при лечении и/или профилактике гипергликаемии и, более конкретно, при лечении инсулиннезависимого диабета типа (II), непереносимости глюкозы, нарушений, связанных с синдромом Х (включая повышенное кровяное давление, ожирение, сопротивляемость инсулину, атеросклероз, гиперлипидаемию), заболевания коронарной артерии и других сердечно-сосудистых заболеваний(включая повышенное артериальное давление,сердечную недостаточность, венозную недостаточность), почечные нарушения (включая гломерулонефрит, гломерулосклероз, нефротический синдром, гипертензивный нефросклероз),ретинопатии, нарушений, связанных с активацией эндотелиальных клеток, псориаза, полициклического синдрома яичников, слабоумия,диабетических осложнений и остеопороза. Их можно применять в качестве ингибиторов редуктазы альдозы для улучшения когнитивных функций при слабоумии и осложнениях 12 диабета, кишечных воспалительных нарушениях, миотонической дистрофии, панкреатита,артериосклероза, ксантомы. Действие этих соединений также рекомендовано при лечении и/или профилактике других заболеваний, включая диабет типа I, гипертриглицеридаемия, синдром X, сопротивляемость инсулину, дислипидаемия у диабетиков, гиперлипидаемия, гиперхолестеролаемия, повышенное артериальное давление, сердечная недостаточность, а также сердечно-сосудистое заболевание, особенно атеросклероз. Соединения также показаны для применения при регуляции аппетита, особенно при регуляции приема пищи у субъектов, страдающих нарушениями, такими, как ожирение, анорексия, булимия и нервная анорексия. Соединения,соответственно, могут применяться при профилактике или лечении гиперхолестеролаемии,ожирения с преимущественными эффектами гиперлипидаемии, гипергликаемии, остеопороза, непереносимости глюкозы, сопротивляемости инсулину или нарушений, при которых сопротивляемость инсулину является вторичным физиопатологическим механизмом. Применение этих соединений позволяет снижение общего холестерола, веса тела, сопротивляемости лептину, глюкозы плазмы, триглицеридов, LDL,VLDL, а также свободных жирных кислот плазмы. Соединения можно применять в связи с ингибиторами редуктазы HMG СоА, фибратами,никотиновой кислотой, холестирамином, колестиполомили пробуколом и их можно применять совместно или в разное время для синергического воздействия на пациента, который подвергается лечению. Более того, они проявляют активность при раковых патологиях, и особенно, при гормонзависимых раках, таких как рак молочной железы, или рак толстой кишки, а также имеют ингибирующее воздействие на процессы ангиогенеза, вовлеченные в такие патологии. Среди фармацевтических композиций по изобретению можно упомянуть более конкретно такие, которые пригодны для орального, парентерального, назального, на- или чрескожного,реактального, наязычного, глазного или респираторного приема, и, в особенности, таблетки или драже, подъязычные таблетки, саше, пакетики, желатиновые капсулы, глазированные таблетки, пастилки, суппозитории, кремы, мази,кожные гели и питьевые или инъекционные ампулы. Дозировка варьируется в зависимости от пола, возраста и веса пациента, графика приема,природы терапевтического показания либо любых связанных лечений, и колеблется от 0,1 мг до 1 г за 24 ч, в один или более приемов. Примеры, которые следуют дальше, иллюстрируют изобретение и не ограничивают его никоим образом. Следующие получения дают 13 промежуточные продукты синтеза для применения в получении по изобретению. Получение 1. 4-[2-(2-Оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензальдегид. Стадия А. 4-(2-Хлороэтокси)бензальдегид. Растворяют 4-гидроксибензальдегид (0,082 моль) в диметилформамиде (100 мл) и добавляют карбонат калия (0,164 моль) и 1-бромо-2 хлороэтан (0,246 моль). Магнитно перемешивают на протяжении пяти дней при комнатной температуре, затем реакционную смесь гидролизируют в 500 мл воды и подщелачивают при помощи 3 г катышков гидроксида натрия. Дважды экстрагируют 50 мл эфира каждый раз. Органическую фазу сушат над сульфатом магния,и эфир удаляют при помощи выпаривания при сниженным давлением. Получившееся масло очищают при помощи мгновенной хроматографии, используя смесь 9/1 циклогексана/эфира в качестве элюанта. Затем смесь растворителей удаляют при помощи выпаривания при сниженным давлением и кристаллизируют получившееся желтое масло и хранят его в эксикаторе. Точка плавления: 38-40 С. Стадия В. 4-[2-(2-Оксо-1,3-бензоксазол 3(2 Н)-ил)этокси]бензальдегид. Растворяют бензоксазолинон (0,024 моль) в диметилформамиде и добавляют карбонат калия (0,047 моль). Нагревают с обратным холодильником на протяжении 20 мин и затем добавляют соединение, полученное на Стадии А(0,021 моль). Магнитно перемешивают с обратным холодильником на протяжении 80 мин. Реакционную смесь гидролизируют в 150 мл воды, полученный осадок отфильтровывают отсосом и его рекристаллизируют из смеси 5/5 циклогексана/толуола. Точка плавления: 112113 С. Получение 2. 4-[2-(2-Оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензальдегид. Способ такой же, как в получении 1, с заменой бензоксазолинона на бензотиазолинон. Точка плавления: 118-120 С. Получение 3. 4-[3-(2-Оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]бензальдегид. Способ такой же, как в получении 1, с заменой 1-бромо-2-хлороэтана на 1-бромо-3 хлоропропан на стадии А и бензоксазолинона на бензотиазолинон на стадии В. Получение 4. 4-[2-(6-Бензоил-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензальдегид. Стадия А. 6-Бензоилбензотиазолинон. Измельчают в ступе бензотиазолинон (10 г) и бензойную кислоту (9,7 г). Вводят полученное в колбу и добавляют полифосфорную кислоту (100 г). Нагревают при 140 С на протяжении 4 часов с механическим перемешиванием. Гидролизируют реакционную смесь во льду. Получившийся остаток удаляют при помощи фильтрации, его промывают эфиром и рекристаллизируют из смеси 4/6 циклогексана/толуола. Точка плавления: 190 С. 14 Стадия В. 4-[2-(6-Бензоил-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензальдегид. Способ такой же, как на стадии В получения 1, с заменой бензоксазолинона на соединение, полученное на стадии А. Точка плавления: 135-139 С. Получение 5. 4-[2-(6-Бензоил-2-оксо-1,3 бензоксазол-3(2 Н)-ил)этокси]бензальдегид. Способ такой же, как в получении 4, исходя из бензоксазолинона. Точка плавления: 105108 С. Получение 6. 4-[2-(2-Оксо[1,3]оксазоло[4,5-b]пирид-3(2 Н)-ил)этокси]бензальдегид. Способ такой же, как в получении 1, с заменой бензоксазолинона на [1,3]оксазоло[4,5-b] пирид-2(3 Н)-он. Получение 7. 4-[2-(1 Н-Пирроло[2,3-b]пирид-1-ил)этокси]бензальдегид. Способ такой же, как в получении 1, с заменой бензоксазолинона на 1 Н-пирроло[2,3b]пиридин. Получение 8. 4-[2-(1 Н-Пирроло[3,2-с]пирид-1-ил)этокси]бензальдегид. Способ такой же, как в получении 1, с заменой бензоксазолинона на 1 Н-пирроло[3,2-с] пиридин. Пример 1. Диэтил 2-4-[2-(2-оксо-1,3 бензоксазол-3(2 Н)-ил)этокси]бензилиденмалонат. Растворяют соединение, полученное в получении 1 (1,20 г) в толуоле (80 мл) и затем добавляют пиперидин (0,02 мл), ледяную уксусную кислоту (0,05 мл) и диэтил малонат (0,70 мл). Нагревают при кипении на протяжении 5 дней с удалением воды при помощи азеотропической дистилляции, используя аппарат ДинаСтарка. Дают охладиться и затем удаляют толуол при помощи выпаривания при сниженном давлении. Проводят мгновенную хроматографию, используя дихлорометан в качестве элюанта с целью очистки получившегося масла. Дихлорометан удаляют при помощи выпаривания при сниженном давлении. Кристаллизируют масло из эфира, удаляют получившееся твердое вещество при помощи фильтрации и его рекристаллизируют из смеси 5/5 циклогексана/толуола. Точка плавления: 98-100 С. Пример 2. Диэтил 2-4-[2-(2-оксо-1,3 бензоксазол-3(1 Н)-ил)этокси]бензилмалонат. Растворяют соединение, полученное в примере 1 (6,7 г) в смеси диоксана/абсолютного этанола (100 мл/20 мл) и добавляют палладийна-углероде (0,5 г). Магнитно перемешивают при комнатной температуре в атмосфере водорода на протяжении 76 ч. Удаляют палладий-науглероде при помощи фильтрации и смесь растворителей удаляют при помощи выпаривания при сниженном давлении. Кристаллизируют получившееся масло при помощи растирания в изопропиловом эфире. Полученный осадок рекристаллизируют из смеси 9/1 циклогексана/толуола. Точка плавления: 68-70 С.(0,7 мл). Магнитно перемешивают на протяжении 18 ч при комнатной температуре. Удаляют смесь абсолютного этанола/тетрагидрофурана при помощи выпаривания при сниженном давлении. Отбирают полученный остаток в воду и дважды экстрагируют по 50 мл эфира каждый раз. Водную фазу окисляют при помощи 6 Н раствора соляной кислоты до получения рН 1, затем дважды экстрагируют по 50 мл эфира каждый раз. Органическую фазу сушат над сульфатом магния, и эфир удаляют при помощи выпаривания при сниженном давлении. Масло. Пример 4. 2-4-[2-(2-оксо-1,3-бензоксазол 3(2 Н-ил)этокси]бензилмалоновая кислота. Растворяют соединение, полученное в примере 2 (1,5 г), в тетрагадрофуране (20 мл). К реакционной смеси добавляют 2 Н гидроксид натрия (8 мл), охлаждают до 0 С, используя ледяную баню. Магнитно перемешивают при комнатной температуре на протяжении 72 ч. Удаляют тетрагидрофуран при помощи выпаривания при сниженном давлении. Полученный остаток отбирают в 6 Н раствор соляной кислоты до рН 1 и дважды экстрагируют по 50 мл эфира каждый раз. Органическую фазу сушат над сульфатом магния, и эфир удаляют при помощи выпаривания при сниженном давлении. Кристаллизируют получившееся масло из изопропиловфого эфира и полученный осадок рекристаллизируют из циклогексана. Точка плавления: 118-120 С. Пример 5. Диэтил 2-4-[2-(2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 2. Точка плавления: 113-114 С. Пример 6. Диметил 2-4-[2-(2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилиден]малонат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 2 и с заменой диэтил малоната на диметил малонат. Точка плавления: 144-146 С Пример 7. Диэтил 2-4-[2-(2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилмалонат. Способ такой же, как в примере 2, исходя из соединения, полученного в примере 5. Масло. Пример 8. Диметил 2-4-[2-(2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилмалонат. Растворяют соединение, полученное в примере 6 (3 г), в смеси метанола/диоксана (50 мл/50 мл) и добавляют палладий-на-углероде(0,75 г). Оставляют при комнатной температуре в атмосфере водорода на протяжении 5 ч при магнитном перемешивании. Удаляют палладийна-углероде при помощи фильтрации и удаляют смесь метанола/диоксана при помощи выпаривания при сниженном давлении. Кристаллизируют получившееся масло из изопропилового эфира. Точка плавления: 67-70 С. Пример 9. 3-Метокси-3-оксо-2-4-[2-(2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил] пропановая кислота. Растворяют соединение, полученное в примере 8 (0,5 г) в метаноле (30 мл) и добавляют гидрохлорид калия (0,07 г), который перед этим растворяют в метаноле. Оставляют на одну неделю при комнатной температуре при магнитном перемешивании. Удаляют метанол при помощи выпаривания при сниженном давлении и окисляют полученный остаток при помощи 6 Н раствора соляной кислоты до получения рН 1. Дважды экстрагируют по 30 мл эфира каждый раз и затем органическую фазу выпаривают при сниженном давлении после сушки над сульфатом магния. Осаждают полученный остаток в эфире и осадок, который образовался, отфильтровывают. Точка плавления: 30-35 С. Пример 10. 3-Этокси-3-оксо-2-4-[2-(2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил] пропановая кислота. Растворяют соединение, полученное в примере 7 (0,85 г) в абсолютном этаноле (20 мл) и охлаждают реакционную смесь, применяя ледяную баню. Добавляют гидроксид калия (0,10 г) и магнитно перемешивают на протяжении 90 ч при комнатной температуре. Удаляют абсолютный этанол при помощи выпаривания при сниженном давлении. Остаток отбирают в 20 мл воды и дважды экстрагируют по 30 мл эфира каждый раз. Водную фазу подкисляют раствором соляной кислоты до получения рН 1. Дважды экстрагируют по 30 мл эфира каждый раз. Органическую фазу сушат над сульфатом магния и эфир удаляют при помощи выпаривания при сниженном давлении. Масло. Пример 11. 2-4-[2-(2-Оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалоновая кислота. Растворяют соединение, полученное в примере 7 (1 г), в смеси абсолютного этанола/тетрагидрофурана (13 мл/2 мл). Добавляют 2 Н гидроксид натрия (2,5 мл) к реакционной смеси, которая была охлаждена до 0 С, применяя ледяную баню. Магнитно перемешивают при комнатной температуре на протяжении 48 ч. Удаляют при помощи выпаривания при сниженном давлении смесь абсолютного этанола/тетрагидрофурана. Полученный остаток отбирают раствором соляной кислоты до рН 1 и дважды экстрагируют по 50 мл этилацетата каждый раз. Органическую фазу сушат над сульфатом магния, и этилацетат удаляют при помощи выпаривания при сниженном давлении. 17 Фильтруют отсасыванием и полученный осадок промывают эфиром, и затем его рекристаллизируют из ацетонитрила. Точка плавления: 179181 С. Пример 12. Диэтил 2-4-[3-(2-оксо-1,3 бензотиазол-3(2 Н)-ил)пропокси]бензилиден малонат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 3. Пример 13. Диэтил 2-4-[3-(2-оксо-1,3 бензотиазол-3(2 Н)-ил)пропокси]бензилмалонат. Способ такой же, как в примере 2, исходя из соединения, полученного в примере 12. Пример 14. 2-4-[3-(2-Оксо-1,3 бензотиазол-3(2 Н)-ил)пропокси]бензил малоновая кислота. Способ такой же, как в примере 4, исходя из соединения, полученного в примере 13. Пример 15. трет-Бутил метил 2-4-[2-(2 оксо-1,3-бензотиазол-3(1 Н)-ил)этокси]бензилиденпропандиоат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 2 и с заменой диэтил малоната на трет-бутил метилмалонат. Пример 16. трет-Бутил метил 2-4-[2-(2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат. Способ такой же, как в примере 2, исходя из соединения, полученного в примере 15. Масло. Пример 17. Диметил 2-4-[2-(6-бензоил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 4 и с заменой диэтил малоната на диметил малонат. Точка плавления: 167-170 С. Пример 18. Диметил 2-4-[2-(6-бензоил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат. Растворяют соединение, полученное в примере 17 (3,7 г) в смеси метанола/тетрагидрофурана/диоксана (10 мл/30 мл/30 мл) и добавляют палладий-на-углероде (0,9 г). Магнитно перемешивают в атмосфере водорода при комнатной температуре на протяжении 24 ч. Удаляют палладий-на-углероде при помощи фильтрации и смесь растворителей удаляют при помощи выпаривания при сниженном давлении. Полученный продукт рекристаллизируют из изопропилового эфира. Точка плавления: 6567 С. Пример 19. Диметил 2-4-[2-(6-бензил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат. Растворяют соединение, полученное в примере 18 (0,7 г), в трифтороуксусной кислоте(1,6 мл) и затем добавляют триэтилсилан (0,5 мл). Оставляют при комнатной температуре на протяжении 2 дней при магнитном перемешивании. Гидролизируют реакционную смесь и 18 затем дважды экстрагируют по 30 мл эфира каждый раз. Органическую фазу сушат над сульфатом магния и выпаривают ее при сниженном давлении. Проводят мгновенную хроматографию полученного остатка, используя 8/2 циклогексан/этилацетат в качестве элюанта. Точка плавления: 78-81 С. Пример 20. Диметил 2-4-[2-(6-бензоил-2 оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 5, и с заменой диэтил малоната на диметил малонат. Точка плавления: 173-176 С. Пример 21. Диметил 2-4-[2-(6-бензоил-2 оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензил малонат. Способ такой же, как в примере 18, исходя из соединения, полученного в примере 20. Пример 22. Диметил 2-4-[2-(6-бензил-2 оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензил малонат. Способ такой же, как в примере 19, исходя из соединения, полученного в примере 21. Точка плавления: 73-75 С. Пример 23. 3-4-[2-(2-Оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]фенил-2-пропеновая кислота. Растворяют соединение, полученное в получении 1 (1 г), в смеси толуол-диоксан (10 мл/20 мл). Добавляют малоновую кислоту (0,92 г) и -пиколин (0,87 мл). Смесь перемешивают магнито на масляной бане при 70-80 С на протяжении 72 ч. Удаляют смесь толуол-диоксан при помощи выпаривания при сниженном давлении. Получившееся масло отбирают в водный 0,1 Н раствор карбоната натрия и дважды экстрагируют по 50 мл этилацетата каждый раз. Водную фазу окисляют при помощи 6 Н раствора соляной кислоты до получения рН 1, и осадок, который образовался, фильтруют отсасыванием. Последний промывают петролейным эфиром и его рекристаллизируют из смеси 4/6 циклогексана/толуола. Точка плавления: 199200 С. Пример 24. 3-4-[2-(2-Оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]фенил-2-пропановая кислота. Растворяют соединение, полученное в примере 23 (0,45 г), в смеси метанол-диоксан(10 мл/20 мл) и добавляют палладий-науглероде (0,14 г). Магнитно перемешивают смесь при комнатной температуре в атмосфере водорода на протяжении 16 ч. Удаляют палладий-на-углероде при помощи фильтрации и удаляют смесь метанол-диоксан при помощи выпаривания при сниженном давлении. Оставшееся масло осаждают в эфире, получившийся остаток удаляют при помощи фильтрации и его рекристаллизируют из смеси 5/5 циклогексана/толуола. Точка плавления: 147-148 С. 19 Пример 25: 3-4-[2-(2-Оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-пропеновая кислота. Способ такой же, как в примере 23, исходя из соединения, полученного в получении 2, но,после окисления водной фазы до рН 1, используя 6 Н раствор соляной кислоты, дважды экстрагируют по 50 мл этилацетата каждый раз. Органическую фазу сушат над сульфатом магния и удаляют этил ацетат при помощи выпаривания при сниженном давлении. Получившийся твердый осадок отфильтровывают отсасыванием,его промывают эфиром и рекристаллизируют из смеси 8/2 циклогексана/толуола. Точка плавления: 199-201 С. Пример 26: 3-4-[2-(2-Оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-пропановая кислота. Способ такой же, как в примере 24 исходя из соединения, полученного в примере 25, но,после выпаривания растворителей при сниженном давлении, получившийся твердый осадок отфильтровывают отсасыванием эфиром и рекристаллизируют из смеси 7/3 циклогексана/толуола. Точка плавления: 168-170 С. Пример 27. Диметил 2-4-[2-(2-оксо[1,3] оксазоло[4,5-b]пирид-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 6, и с заменой диэтил малоната на диметил малонат. Пример 28. Диметил 2-4-[2-(2-оксо[1,3] оксазоло[4,5-b]пирид-3(2 Н)-ил)этокси]бензил малонат. Способ такой же, как в примере 18, исходя из соединения, полученного в примере 27. Масло. Пример 29. Диметил 2-4-[2-(1 Н-пирроло[2,3-b]пирид-1-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 7, и с заменой диэтил малоната на диметил малонат. Пример 30. Диметил 2-4-[2-(1 Н-пирроло[2,3-b]пирид-1-ил)этокси]бензилмалонат. Способ такой же, как в примере 18, исходя из соединения, полученного в примере 29. Масло. Пример 31. Метил 3-4-[2-(6-бензоил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил 2-пропеноат. В атмосфере азота 1,8 эквивалентов гидрида натрия растворяют в THF, затем добавляют по каплям 1,4 эквивалента метил фосфоноацетата при 0 С. Реакционную смесь перемешивают на протяжении от 15 до 20 мин и затем добавляют 1 эквивалент соединения, полученного в получении 4. Через 24 ч смесь подвергают гидролизу при помощи 100 мл воды и фильтруют, и полученный осадок рекристаллизируют из метанола с получением заглавного продукта. Точка плавления: 144-146 С. 20 Пример 32. Метил 3-4-[2-(6-бензоил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил пропаноат. Соединение, полученное в примере 31,растворяют в смеси метанола/диоксана и затем добавляют каталитическое количество палладия-на-углероде. Реакцию перемешивают при комнатной температуре в атмосфере водорода на протяжении от 6 до 15 ч. Углерод затем отфильтровывают, и растворители удаляют при помощи выпаривания in vacuо. Полученный остаток рекристаллизируют из метанола с получением заглавного продукта. Точка плавления: 74-77 С. Пример 33. Диметил 2-4-[2-(6-[гидрокси(фенил)метил]-2-оксо-1,3-бензоксазол-3(2 Н)-ил) этокси]бензилмалонат. Соединение, полученное в примере 21,растворяют в метаноле и добавляют 0,25 эквивалента борогидрида натрия. Реакционную смесь перемешивают при комнатной температуре на протяжении 24 ч, затем метанол выпаривают in vacua и полученный остаток очищают при помощи мгновенной хроматографии, используя смесь этилацетата/циклогексана в качестве элюанта. Заглавное соединение, полученное таким образом, рекристаллизируют из изопропилового эфира. Точка плавления: 84-87 С. Пример 34. Метил 3-4-[2-(6-бензоил-2 оксо-1,3-бензоксазол-3(1 Н)-ил)этокси]-фенил 2-пропеноат. Способ такой же, как в примере 31, с заменой соединения, полученного в получении 4, на соединение, полученное в получении 5. Точка плавления: 170-173 С. Пример 35. Метил 3-4-[2-(6-бензоил-2 оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]фенил пропаноат. Способ такой же, как в примере 32, исходя из соединения, полученного в примере 34. Точка плавления: 100-103 С. Пример 36. Диметил 2-4-[2-(6-[гидрокси(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]бензилмалонат. Способ такой же, как в примере 33, исходя из соединения, полученного в примере 18. Точка плавления: 153-156 С. Пример 37. Диметил 2-4-[2-(6-(2 хлоробензоил)-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]бензилиденмалонат. Стадия А. 6-(2-Хлоробензоил)-1,3-бензотиазол-2(3H)-он. Способ такой же, как на стадии А получения 4, с заменой бензойной кислоты на 2 хлоробензойную кислоту. Стадия В. Диметил 2-4-[2-(6-(2-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилиденмалонат. Соединение, полученное на стадии А растворяют в DMF и добавляют 2 эквивалента карбоната калия. После перемешивания на протяжении 20 мин при 80 С, добавляют 1,2 эквива 21 лента диметил 2-[4-(2-хлороэтокси)бензилиден] малоната и реакцию нагревают на протяжении 12 ч. Реакционную смесь затем гидролизируют в воде и фильтруют, и полученный осадок рекристаллизируют из метанола с получением заглавного продукта. Точка плавления: 145-149 С. Пример 38. Диметил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалонат. Соединение, полученное в примере 18,растворяют в минимуме метанола и затем последовательно добавляют 4 эквивалента Oметилгидроксиламина, заранее растворенного в нескольких миллилитрах воды, и 4,5 эквивалента пиридина. Реакционную смесь нагревают с обратным холодильником на протяжении 24 ч и затем гидролизируют в воде и фильтруют; полученный осадок рекристаллизируют из метанола. Точка плавления: 68-72 С. Пример 39. Диметил 2-4-[2-(2-оксо-6-(3 пиридилкарбонил)-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилиденмалонат. Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на никотиновую кислоту на стадии А. Растворителем при рекристаллизации является абсолютный этанол. Точка плавления: 130-134 С. Пример 40. Диметил 2-4-[2-(6-(2-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат. Соединение, полученное в примере 37,растворяют в смеси растворителей метанол/ ТНF/диоксан и затем добавляют каталитическое количество палладия-на-углероде и реакцию перемешивают при комнатной температуре в атмосфере водорода. Палладий-на-углероде затем отфильтровывают и растворители удаляют при помощи выпаривания при сниженном давлении. Полученный остаток отбирают в изопропиловый эфир и магнитно перемешивают. Полученный осадок отфильтровывают и рекристаллизируют из метанола. Точка плавления: 104-108 С. Пример 41. Диметил 2-4-[2-(6-(3-хлоробензоил)-2-оксо-1,2-бензотиазол-3(2 Н)-ил) этокси]бензилиденмалонат. Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на 3-хлоробензойную кислоту на стадии А. Точка плавления: 234-238 С. Пример 42. Диметил 2-4-[2-(6-([1,1'бифенил]-4-илкарбонил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на [1,1'бифенил]-4-карбоновую кислоту на стадии А. Точка плавления: 168 С. Пример 43. Диметил 2-4-[2-(6-(4-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиден)малонат. 22 Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на 4 хлоробензойную кислоту на стадии А. Точка плавления: 234-238 С. Пример 44. Диметил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалонат. Способ такой же, как в примере 38, с заменой O-метилгидроксиламина на гидрохлорид гидроксиламина. Точка плавления: 161-162 С. Пример 45. Диметил 2-4-[2-(6-([1,1'бифенил]-4-илкарбонил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 42. Точка плавления: 95-96 С. Пример 46. Диметил 2-4-[2-(6-бутирил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на масляную кислоту на стадии А. Растворитель при рекристаллизации представляет собой смесь этилацетата/циклогексана. Точка плавления: 154-155 С. Пример 47. Диметил 2-4-[2-(6-(1-нафтоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилиденмалонат. Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на нафтойную кислоту на стадии А. Точка плавления: 143144 С. Пример 48. Диметил 2-4-[2-(6-([1,1'бифенил]-4-илметил)-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалонат. Соединение, полученное в примере 45,растворяют в от 15 до 20 эквивалентах трифтороуксусной кислоты и добавляют 2,5 эквивалента триэтилсилана. Реакционную смесь перемешивают при комнатной температуре на протяжении от 24 до 72 ч и затем гидролизируют водой и экстрагируют эфиром. Органические фазы собирают, сушат над сульфатом магния и выпаривают in vacuо, и полученный остаток рекристаллизируют из этилацетата с получением заглавного продукта. Точка плавления: 122 С. Пример 49. Диметил 2-4-[2-(6-(1-нафтоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 47. Растворитель при рекристаллизации представляет собой изопропиловый эфир. Точка плавления: 62-63 С. Пример 50. Диметил 2-4-[2-(6-(3-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 41. Растворитель при рекристаллизации представляет собой изопропиловый эфир. Точка плавления: 90-94 С. 23 Пример 51. Диметил 2-4-[2-(6-(2-хлоробензил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил)малонат. Способ такой же, как в примере 48, исходя из соединения, полученного в примере 40. Растворитель при рекристаллизации представляет собой петролейный эфир. Точка плавления: 92-96 С. Пример 52: Диметил 2-4-[2-(6-(3-хлоробензил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат. Способ такой же, как в примере 48, исходя из соединения, полученного в примере 50. Растворитель при рекристаллизации представляет собой петролейный эфир. Точка плавления: 82-86 С. Пример 53. Диметил 2-4-[2-(6-бутирил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 46. Очистку проводят на кремнеземе. Точка плавления: 74-75 С. Пример 54. Диметил 2-4-[2-(6-(1-нафтилметил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилмалонат. Способ такой же, как в примере 48, исходя из соединения, полученного в примере 49. Растворитель при рекристаллизации представляет собой толуол. Точка плавления: 120-122 С. Пример 55. Диметил 2-4-[2-(6-бутил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил) малонат. Способ такой же, как в примере 48, исходя из соединения, полученного в примере 53. Растворитель при рекристаллизации представляет собой гексан. Точка плавления: 73-74 С. Пример 56. Диметил 2-4-[2-(2-оксо-6-(3 пиридилкарбонил)-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 39. Очистку проводят на кремнеземе. Точка плавления: 129-134 С. Пример 57. Диметил 2-4-[2-(6-(4-хлоробензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 43. Очистку проводят на кремнеземе. Точка плавления: 80-85 С. Пример 58. 2-(4-[2-(6-Бензоил-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилмалоновая кислота. Способ такой же, как в примере 11, исходя из соединения, полученного в примере 18. Пример 59. Диметил 2-4-[2-(6-(4-метоксибензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилиденмалонат. 24 Способ такой же, как в примере 37, с заменой 2-хлоробензойную кислоту на 4-метоксибензойную кислоту на стадии А. Растворитель при рекристаллизации представляет собой этилацетат. Точка плавления: 144-145 С. Пример 60. Диметил 2-4-[2-(6-(2-нафтоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 70. Растворитель при рекристаллизации представляет собой гексан. Точка плавления: 87 С. Пример 61. Диметил 2-4-[2-(6-(4 метоксибензоил)-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 59. Точка плавления: 114-117 С. Пример 62. Диметил 2-4-[2-(6-(4 хлоробензил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат. Способ такой же, как в примере 48, исходя из соединения, полученного в примере 57. Очистку проводят на кремнеземе. Точка плавления: 40-45 С. Пример 63: 2-4-[2-(6-Бензоил-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензил-3-метокси-3-оксопропановая кислота. Способ такой же, как в примере 9, исходя из соединения, полученного в примере 18. Пример 64. Диметил 2-4-[2-(6-[(2-хлорофенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 68, исходя из соединения, полученного в примере 37. Растворитель при рекристаллизации представляет собой метанол. Точка плавления: разложение при 142146 С. Пример 65. Диметил 2-4-[2-(6-[(3-хлорофенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат. Способ такой же, как в примере 38, исходя из соединения, полученного в примере 50. Точка плавления: разложение при 121125 С. Пример 66. Диметил 2-4-[2-(6-(4-метоксибензил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат. Способ такой же, как в примере 48, исходя из соединения, полученного в примере 61. Растворитель при рекристаллизации представляет собой метанол. Точка плавления: 112-113 С. Пример 67. Диметил 2-4-[2-(6-(2-нафтилметил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилмалонат. Способ такой же, как в примере 48, исходя из соединения, полученного в примере 60. 25 Растворитель при рекристаллизации представляет собой метанол. Точка плавления: 104-105 С. Пример 68. Диметил 2-4-[2-(6-[(3-хлорофенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилиденмалонат. Соединение, полученное в примере 41 растворяют в минимуме метанола, и затем последовательно добавляют 4 эквивалента Oметилгидроксиламина, заранее растворенного в нескольких миллилитрах воды, и 4,5 эквивалента пиридина. Реакционную смесь нагревают с обратным холодильником на протяжении 24 ч и затем гидролизируют в воде и фильтруют; полученный осадок рекристаллизируют из ацетонитрила. Точка плавления: разложение при 7882 С затем 200 С. Пример 69. Диметил 2-4-[2-(6-[(4-хлорофенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 68, исходя из соединения, полученного в примере 43. Точка плавления: разложение при 118121 С затем 158-162 С. Пример 70. Диметил 2-4-[2-(6-(2-нафтоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилиденмалонат. Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на 2-нафтойную кислоту на стадии А. Растворитель при рекристаллизации представляет собой этилацетат. Точка плавления: 164 С. Пример 71. Диметил 2-4-[2-(6-1,1'бифенил]-4-ил(метоксиимино)метил]-2-оксо 1,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат. Способ такой же, как в примере 38, исходя из соединения, полученного в примере 45. Точка плавления: 63-64 С. Пример 72. Диметил 2-4-[2-(6-1,1'бифенил]-4-ил(метоксиимино)метил]-2-оксо 1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиден малонат. Способ такой же, как в примере 68, исходя из соединения, полученного в примере 42. Растворитель при рекристаллизации представляет собой метанол. Точка плавления: разложение при 131132 С. Пример 73. Диметил 2-4-[2-(6-[(2-хлорофенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)-окси]бензилмалонат. Способ такой же, как в примере 38, исходя из соединения, полученного в примере 40. Точка плавления: разложение при 92-95 С. Пример 74. 3-Метокси-3-оксо-2-4-[2-(1 Н)пирроло[2,3-b]пирид-1-ил)этокси]бензнл пропановая кислота. Соединение, полученное в примере 30,растворяют в 5 мл метанола и 3 мл THF. Смесь охлаждают до 0 С и добавляют по каплям 0,44 26 мл 2 М раствора гидроксида натрия. После перемешивания на протяжении 1 ч 30 мин при комнатной температуре растворители удаляют при помощи выпаривания при сниженном давлении и полученный остаток отбирают в воду и экстрагируют этилацетатом. Водную фазу подкисляют 2 М раствором соляной кислоты и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния, фильтруют, и выпаривают при сниженном давлении. Полученный остаток отбирают в минимум этилацетата и осаждают пентаном с получением заглавного продукта после фильтрации. Точка плавления: 120-122 С. Пример 75. Диметил 2-4-[2-(6-(бензоиламино)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 76. Точка плавления: 90-94 С. Пример 76. Диметил 2-4-[2-(6-(бензоиламино)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилиден)малонат. Способ такой же, как в примере 37. Точка плавления: 186-190 С. Пример 77. 3-4-[2-(6-Бензил-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]фенилпропановая кислота. Соединение, полученное в примере 78,растворяют в смеси метанола/THF и добавляют по каплям 1,2 эквивалента гидроксида натрия. Реакционную смесь перемешивают при комнатной температуре на протяжении 24 ч и затем выпаривают, полученный остаток отбирают в воду и дважды экстрагируют эфиром, и водную фазу окисляют 6 Н раствором соляной кислоты. Полученный осадок отфильтровывают и рекристаллизируют из метанола с получением заглавного продукта. Точка плавления: 158-163 С. Пример 78. Метил 3-4-[2-(6-бензил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил] пропаноат. Способ такой же, как в примере 48, исходя из соединения, полученного в примере 32. Растворитель при рекристаллизации представляет собой метанол. Точка плавления: 71-75 С. Пример 79. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропаноат. Способ такой же, как в примере 38, исходя из соединения, полученного в примере 32. Пример 80. 3-4-[2-(6-Бензоил-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]фенилпропановая кислота. Способ такой же, как в примере 77, исходя из соединения, полученного в примере 32. Растворитель при рекристаллизации представляет собой смесь толуола/циклогексана. Точка плавления: 169-173 С. Пример 81. 2-4-[2-(1 Н-Пирроло[2,3-b] пирид-1-ил)этокси]бензилмалоновая кислота. 27 Соединение, полученное в примере 30 (274 мг), растворяют в 5 мл метанола, 2,5 мл THF и 5 мл воды. Добавляют 2 М раствор гидроксида натрия (1,8 мл) и реакционную смесь перемешивают на протяжении 4 дней при комнатной температуре. Растворители затем выпаривают при сниженном давлении, и полученный остаток отбирают в воду и экстрагируют этилацетатом. Водную фазу охлаждают до 0 С и окисляют 2 М раствором соляной кислоты, и получившееся твердое вещество отфильтровывают. Точка плавления: 182-184 С. Пример 82. Метил 2-4-[2-(6-бензоил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил 3-(метиламино)-3-оксопропаноат. Соединение, полученное в примере 63 растворяют безводном дихлорометане и затем добавляют 1,5 эквивалента тионилхлорида и смесь нагревают с обратным холодильником на протяжении 1 ч 30 мин. Реакционную смесь затем охлаждают, применяя ледяную баню, и добавляют 1,2 эквивалента метиламина через верх конденсатора. Реакционную смесь перемешивают на протяжении одного часа и затем экстрагируют дихлорометаном. Органические фазы промывают раствором карбоната натрия и водой, и затем фильтруют, сушат над сульфатом магния и выпаривают при сниженном давлении. Полученный остаток очищают при помощи мгновенной хроматографии, используя смесь этилацетата/циклогексана в качестве элюанта. Полученный заглавный продукт рекристаллизируют из смеси толуол/циклогексан. Точка плавления: 162-164 С. Пример 83. Диметил 2-4-[2-(6-(анилинокарбонил-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 84. Точка плавления: 104-109 С. Пример 84. Диметил 2-4-[2-(6-(анилинокарбонил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилиденмалонат. Способ такой же, как в примере 37. Точка плавления: 102-105 С. Пример 85. Диметил 2-4-[2-(2-оксо-6-[2 фенилэтенил]-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилиденмалонат. Стадия А. 6-Нитро-1,3-бензотиазол-2(3 Н)он. 0,1 моль бензотиазолинона растворяют в 100 мл уксусного ангидрида и раствор охлаждают до -10 С. Затем добавляют по каплям 10 мл азотной кислоты, и реакцию перемешивают на протяжении 2 ч. Полученный осадок отфильтровывают и промывают водой, и затем очищают при помощи хроматографии (элюант СН 2 Сl2, затем AcOEt) с получением заглавного продукта, который рекристаллизируют из этанола. Точка плавления: 248-253 С. 28 Стадия В. 6-Амино-1,3-бензотиазол-2(3H)он. Соединение, полученное на стадии А(0,036 моль), растворяют в 90 мл метанола, и затем последовательно добавляют 2,5 г палладия-на-углероде и 18 г формата аммония и смесь нагревают с обратным холодильником на протяжении 18 ч. Добавляют 40 мл диоксана и нагревание с обратным холодильником продолжают на протяжении 24 ч. Палладий-науглероде затем отфильтровывают. Реакционную смесь концентрируют, полученный осадок отфильтровывают, и фильтрат выпаривают при сниженном давлении. Полученный остаток отбирают в 1 Н раствор соляной кислоты и экстрагируют дважды по 50 мл этилацетата каждый раз. Водную фазу подщелачивают при помощи 10% раствора карбоната калия и экстрагируют дважды по 50 мл этилацетата каждый раз. Органическую фазу сушат и затем выпаривают при сниженном давлении, и полученный осадок рекристаллизируют из ацетонитрила. Точка плавления: 220-224 С Стадия С. 6-(2-Фенилэтенил)-1,3-бензотиазол-2(3H)-он. Соединение, полученное на стадии В (1 г),растворяют в HBF4 (10 мл) и смесь охлаждают до 0 С. Затем добавляют 0,44 г NaNO2, заранее растворенного в воде, и реакцию перемешивают при 0 С на протяжении 1 ч. Полученный осадок отфильтровывают и промывают эфиром, измельчают с ВF3 (4,5 ммоль) и ацетатом палладия(0,2 ммоль), и затем помещают в атмосферу азота перед добавлением 15,1 мл безводного диоксана. Реакционную смесь перемешивают на протяжении 5 ч при комнатной температуре и затем проводят гидролиз с 50 мл воды и дважды проводят экстракцию по 30 мл эфира каждый раз. Органическую фазу сушат над MgSO4 и затем выпаривают при сниженном давлении. Полученный осадок промывают изопропиловым эфиром и рекристаллизируют из метанола. Точка плавления: 179 С. Стадия D. Диметил 2-4-[2-(2-оксо-6-[2 фенилэтенил]-1,3-бензотиазол-3(2 Н)-ил)-этокси]бензилиденмалонат. Способ такой же, как на стадии В примера 37, исходя из соединения, полученного на стадии С. Точка плавления: 90 С. Пример 86. Диметил 2-(4-[2-(2-оксо-1,3 бензотиазол-3(2 Н)-ил)этил]аминобензилиден) малонат. Способ такой же, как на стадии В примера 37, исходя из тиазолинона, и с заменой диметил 2-4-[2-хлороэтокси]бензилиденмалоната на диметил 2-4-[(2-хлороэтил)амино]бензилиден малонат. Пример 87. Диметил 2-(4-[2-(6-бензоил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этил]амино)бензилиден)малонат. 29 Способ такой же, как на стадии В примера 37, исходя из соединения, полученного на стадии А получения 4, и с заменой диметил 2-4[2-хлороэтокси]-бензилиденмалоната на диметил 2-4-[(2-хлороэтил)амино]бензилиденмалонат. Пример 88. Диметил 2-(4-[2-(6-бензоил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этил]аминобензил)малонат. Способ такой же, как в примере 40, исходя из соединения, полученного в примере 87. Пример 89: Диметил 2-4-[2-(2-оксо-6-[2 фенилэтенил]-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилмалонат. Способ такой же, как на стадии В примера 37, исходя из соединения, полученного в примере 85, с заменой диметил 2-[4-(2-хлороэтокси) бензилиден]малоната на диметил 2-[4-(2-хлороэтокси)бензил]малонат. Точка плавления: 103107 С. Пример 90. Диметил 2-4-[2-(6-(3-метилбензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилиденмалонат. Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на 3 метилбензойную кислоту на стадии А. Точка плавления: 153-154 С. Пример 91. Этил 2-бензоил-3-4-[2-(6 бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-пропеноат. Смесь, состоящую из 5 г соединения, полученного в получении 4, 2,14 мл этилбензоилацетата, 0,05 эквивалента пиридина, и 0,15 мл ледяной уксусной кислоты в 200 мл безводного толуола, нагревают с обратным холодильником на протяжении 40 ч, образовавшуюся при этом воду удаляют при помощи азеотропической дистилляции, применяя аппарат Дина-Старка. Реакционную смесь затем фильтруют и фильтрат выпаривают при сниженном давлении. Заглавный продукт очищают при помощи хроматографии (элюант AcOEt/циклогексан: 3/7), отбирают в диизопропиловый эфир и рекристаллизируют из толуола. Точка плавления: 189190 С. Пример 92. Этил 2-4-[2-(6-бензоил-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил 3 оксо-3-фенилпропаноат. Соединение, полученное в примере 91,растворяют в 45 мл смеси ЕtOН 95/диоксана/THF (1/4/4) и затем помещают in vacuo в атмосфере водорода. Реакционную смесь перемешивают на протяжении 4 ч 30 мин и затем фильтруют, и фильтрат выпаривают при сниженном давлении. Заглавный продукт очищают при помощи хроматографии 30 Способ такой же, как в примере 1, исходя из соединения, полученного в получении 8, и с заменой диэтил малоната на диметил малонат. Пример 94. Диметил 2-4-[2-(1 Н-пирроло[3,2-с]пирид-1-ил)этокси]бензилмалонат. Способ такой же, как в примере 18, исходя из соединения, полученного в примере 93. Пример 95. 3-Метокси-3-оксо-2-4-[2-(1 Нпирроло[3,2-с]пирид-1-ил)этокси)бензилпропановая кислота. Способ такой же, как в примере 74, исходя из соединения, полученного в примере 94. Пример 96. 2-4-[2-(1 Н-Пирроло[3,2-с]пирид-1-ил)этокси]бензилмалоновая кислота. Способ такой же, как в примере 81, исходя из соединения, полученного в примере 94. Пример 97. Метил 2-4-[2-(6-бензил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил-3[2-(метиламино)фенил]-3-оксопропаноат. Способ такой же, как в примере 37, с заменой 2-хлоробензойной кислоты на бензойную кислоту на стадии А и с заменой диметил 2-[4(2-хлороэтокси)-бензилиден]малоната на метил 2-[4-(2-хлороэтокси)бензил]-3-[2-(метиламино)фенил]-3-оксопропаноат на стадии В. Пример 98. Метил 3-4-[2-(1 Н-пирроло[2,3-b]пирид-1-ил)этокси]фенилпропаноат. Способ такой же, как в примере 32, исходя из соединения, полученного в примере 98. Фармакологическое изучение Пример А. Изучение острой токсичности. Острую токсичность оценивали после орального введения группам, каждая из которых включала 8 мышей (262 г). Животных наблюдали через одинаковые интервалы в течение первого дня и ежедневно на протяжении двух недель, которые следовали за обработкой. Оценивали LD50 (дозу, которая вызывала смерть 50% животных) и показали низкую токсичность соединений по изобретению. Пример В. Эффективность на генетических моделях. Мутации у лабораторных животных, а также различные чувствительности к режимам диеты дали возможность разработать животные модели, которые имели инсулин-независимый диабет и гиперлипидаемию, связанные с ожирением и со сопротивляемостью инсулину. Генетические модели мышей (ob/ob) (Diabetes, 1982, 31 (1), 1-6) и крысы Зукера (fa/fa) были выведены различными лабораториями с целью понимания физиологии этих заболеваний и проверки эффективности новых противодиабетических соединений (Diabetes, 1983, 32, 830838). 31 Противодиабетическое и гиполипидаемическое действие на мышей ob/ob В тестах in vivo использовались женские особи мышей ob/ob (Harlan) возрастом 10 недель. Животных содержали при цикле светатемноты в 12 ч при 25 С. Мышь имела базальную гипергликаемию в 2 г/л. Животных произвольным образом отбирали во время их гипергликаемии с образованием групп по шесть особей. Соединения тестировали внутриполостным путем и растворяли в смеси диметилсульфоксида (10%) и солютола (15%) для введения по 10 мг/кг в объеме 2,5 мл/кг 1% НЕС дважды в день на протяжении четырех дней. Контрольные группы получали растворители при тех же условиях, что и обрабатываемые группы. Активность продуктов оценивали,измеряя гликаемию через 24 ч после последнего введения, и ежедневно измеряя вес тела. Соединения по изобретению показывают очень хорошую способность снижать гликаемию, которую можно сравнить с эффектами,полученными с розиглитазоном, который применяли в качестве сравнительного вещества, но с незначительным варьированием веса тела, в то время, как при тех же условиях розиглитазон дает существенное повышение в +4% за четыре дня. Более того, во время тестов in vivo не наблюдалось побочных эффектов. В качестве примера, соединение по примеру 18 существенно снижает гликаемию на 43% при введении по 30 мг/кг per os, и на 45% при введении i.p. по 10 мг/кг. Пример С. Фармацевтическая композиция. 1000 таблеток, каждая из которых содержит дозу в 5 мг диметил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]бензил малоната (пример 18) 5 г Пшеничный крахмал 20 г Кукурузный крахмал 20 г Лактоза 30 г Стеарат магния 2 г Кремнезем 1 г Гидроксипропилцеллюлоза 2 г в которой Х представляет собой атом кислорода(в которой или серы, или группу СН 2, илиR'2 совместно с R2 образует дополнительную связь),R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную(C1-С 6)алкильную группу, арильную группу,арил-(С 1-С 6)алкильную группу, в которой алкильный остаток может быть линейным или 32 разветвленным, арилоксигруппу, арил-(С 1-С 6) алкоксигруппу, в которой алкоксиостаток может быть линейным или разветвленным, линейную или разветвленную (С 1-С 6)алкоксигруппу, гидроксигруппу, аминогруппу, линейную или разветвленную (C1-С 6)алкиламиногруппу или диалкиламиногруппу, в которых алкильные остатки являются линейными или разветвленнымиC1-C6,или R1 и R2 совместно образуют оксо-, тиоксо- или иминогруппу,возможно, что R2 образует совместно с R'2 дополнительную связь,А представляет собой (С 1-С 6)алкиленовую цепочку, в которой группа СН 2 может быть заменена на гетероатом, выбираемый из кислорода и серы, на группу NRa (в которой Ra представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу) или на фениленовую или нафтиленовую группу,В представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или линейную или разветвленную (С 2-С 6)алкенильную группу, эти группы замещены группой R5, группой формулы (II)(II) или группой формулы (III) в этих группах обозначениеобозначает, что связь является одинарной или двойной,группу, в которой ZR5 представляет представляет собой атом кислорода или серы, аZ' представляет собой группу OR или NRR', а в которой Z"R6 представляет группу представляет собой группу Z' или R (в которойR и R', которые могут быть одинаковыми или различными, каждый представляет собой группу R" или -C(Me)2COOR", в которых R" представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,линейную или разветвленную (С 2-С 6)алкенильную группу, линейную или разветвленную (С 2 С 6)алкинильную группу, арильную группу,арил-(С 1-С 6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, арил-(С 2-С 6)алкенильную группу, в которой алкенильный остаток может быть линейным или разветвленным, арил-(С 2-С 6) алкинильную группу, в которой алкинильный остаток может быть линейным или разветвленным, гетероарильную группу, гетероарил-(С 1 С 6)алкильную группу, в которой алкильный остаток может быть линейным или разветвленным, гетероарил-(С 2-С 6)алкенильную группу, в которой алкенильный остаток может быть линейным или разветвленным, гетероарил-(С 2 33 С 6)алкинильную группу, в которой алкинильный остаток может быть линейным или разветвленным, (С 3-С 8)циклоалкильную группу, (С 3 С 8)циклоалкил-(С 1-С 6)алкильную группу, в которых алкил остаток может быть линейным или разветвленным, или линейную или разветвленную (С 1-С 6)полигалоалкильную группу),R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, атом галогена или группу R, OR или NRR' (в которых R и R' имеют значения,указанные здесь ранее), или R3 и R4 совместно с атомами углерода, которые их несут, в случае,если их несут два смежных атома углерода, образуют кольцо, которое имеет от 5 до 6 членов кольца и которое может содержать гетероатом,выбираемый из кислорода, серы и азота,D представляет собой бензольное ядро, в группу,этом случае Х не может представлять как указано здесь ранее, илиD представляет собой пиридиновое, пиразиновое, пиримидиновое или пиридазиновое ядро,эти ядра замещены от 1 до 3 одинаковыми или различными группами, выбираемыми из R,OR, S(O)nR,(в этих группах R, R' и Z имеют значения, указанные здесь ранее, а n представляет собой 0, 1 или 2), циано, нитро и атомов галогенов, причем если А представляет собой группу СН 2, В не может представлять собой линейный или разветвленный (С 1-С 6)алкил, замещенный группой если группы А и В находятся в ортоположении по отношению к одному из бензольных ядер, которые их несут, В не может представлять собой линейную или разветвленную В не может представлять собой группу-СН 2-СООН,арил следует понимать как фенильную,нафтильную или бифенильную группу, которые могут быть частично гидрогенированы,гетероарил следует понимать как любую моно- или бициклическую ароматическую группу, содержащую от 5 до 10 членов кольца,которая может быть частично гидрогенирована на одном из колец в случае бициклических гетероарилов и которая содержит от 1 до 3 гетероатомов, выбираемых из кислорода, азота и серы,причем арильная и гетероарильная группы,определенные таким образом, могут быть замещены от 1 до 3 группами, выбираемыми из линейного или разветвленного (С 1-С 6)алкила, ли 34 нейного или разветвленного (С 1-С 6)алкокси,карбокси, формила, NRbRc (в которой Rb и Rc,которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (C1-С 6)алкильную группу, арильную группу или гетероарильную группу), сложного эфира, амидо, нитро, циано, O-C(Me)2COOR" (в которой R" имеет значение, указанное здесь ранее) и атомов галогенов,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1, в которой R1 и R2 образуют оксогруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, в которой R3 и R4 одновременно представляют собой атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, в которой А представляет собой алкиленовую группу,в которой группа СН 2 может быть заменена гетероатомом, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, в которой А представляет собой этиленоксигруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, в которой А представляет собой алкиленовую группу,в которой группа СН 2 может быть замещена на фениленовую или нафтиленовую группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по п.1, в которой Х представляет собой атом кислорода или атом серы, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по п.1, в которой Х представляет собой группу CHR'2 и D представляет собой пиридиновое ядро, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) по п.1, в которой В представляет собой алкильную или алкенильную группу, эти группы замещены группой формулы (II), их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по п.1, в которой В представляет собой алкильную или алкенильную группу, эти группы замещены группойR5, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) по п.1, в которой D представляет собой незамещенное бензольное ядро, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 12. Соединения формулы (I) по п.1, в которой D представляет собой бензольное ядро, замещенное арилкарбонильной группой, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 13. Соединения формулы (I) по п.1, в которой D представляет собой пиридиновое ядро, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 14. Соединения формулы (I) по п.1, в которой D представляет собой пиразиновое, пиримидиновое или пиридазиновое ядро, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 15. Соединения формулы (I) по п.1, которые представляют собой диэтил 2-4-[2-(2-оксо-1,3-бензоксазол 3(2 Н)-ил)этокси]бензилиденмалонат,диэтил 2-4-[2-(2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилиденмалонат и диэтил 2-4-[3-(2-оксо-1,3-бензотиазол 3(2 Н)-ил)пропокси]бензилиденмалонат,а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 16. Соединения формулы (I) по п.1, которые представляют собой диэтил 2-4-[2-(2-оксо-1,3-бензоксазол 3(2 Н)-ил)этокси]бензилмалонат,3-этокси-3-оксо-2-4-[2-(2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензилпропановую кислоту,2-4-[2-(2-оксо-1,3-бензоксазол-3(2 Н)-ил) этокси]бензилмалоновую кислоту,диэтил 2-4-[2-(2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(2-оксо-1,3-бензотиазол 3(2H)-ил)-этокси]бензилмалонат,3-метокси-3-оксо-2-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилпропановую кислоту,3-этокси-3-оксо-2-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензилпропановую кислоту и 2-4-[2-(2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]бензилмалоновую кислоту,а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 17. Соединения формулы (I) по п.1, которые представляют собой диметил 2-4-[2-(6-бензоил-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилмалонат, 004676 36 диметил 2-4-[2-(6-бензоил-2-оксо-1,3 бензоксазол-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(6-(2-хлоробензоил)-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(6-([1,1'-бифенил]-4-илкарбонил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат,диметил 2-4-[2-(6-(1-нафтоил)-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(6-(3-хлоробензоил)-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(2-оксо-6-(3-пиридилкарбонил)-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(6-(4-хлоробензоил)-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалоновую кислоту,диметил 2-4-[2-(6-(2-нафтоил)-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(6-(4-метоксибензоил)-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензил-3-метокси-3-оксопропановую кислоту и метил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил-3-(метиламино)-3-оксопропаноат,а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 18. Соединения формулы (I) по п.1, которые представляют собой диметил 2-4-[2-(6-бензил-2-оксо-4,3-бензотиазол-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(6-бензил-2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(6-(2-хлоробензил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(6-(3-хлоробензил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,диметил 2-4-[2-(6-(1-нафтилметил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат и диметил метил 2-4-[2-(6-(4-хлоробензил)2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил малонат,а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 19. Соединения формулы (I) по п.1, которые представляют собой диметил 2-4-[2-(2-оксо[1,3]оксазоло[4,5b]пирид-3(2 Н)-ил)этокси]бензилмалонат,диметил 2-4-[2-(1 Н-пирроло[2,3-b]пирид 1-ил)этокси]бензилмалонат и 2-4-[2-(1 Н-пирроло[2,3-b]пирид-1-ил) этокси]бензилмалоновую кислоту, 37 а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 20. Соединения формулы (I) по п.1, которые представляют собой диметил 2-4-[2-(6-[гидрокси(фенил)метил]-2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси] бензилмалонат и диметил 2-4-[2-(6-[гидрокси(фенил) метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензилмалонат,а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 21. Соединения формулы (I) по п.1, которые представляют собой диметил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат,диметил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]бензилмалонат,диметил 2-(4-[2-(6-[(3-хлорофенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]бензилмалонат и диметил 2-4-[2-(6-1,1'-бифенил]-4-ил(метоксиимино)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]бензилмалонат,а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 22. Соединения формулы (I) по п.1, которые представляют собой 3-4-[3-(2-оксо-1,3-бензоксазол-3(2 Н)-ил) пропил]фенил-2-пропеновую кислоту,3-4-[3-(2-оксо-1,3-бензоксазол-3(2 Н)-ил) пропил]фенил-2-пропановую кислоту,3-4-[3-(2-оксо-1,3-бензотиазол-3(2 Н)-ил) пропил]фенил-2-пропеновую кислоту,3-4-[3-(2-оксо-1,3-бензотиазол-3(2 Н)-ил) пропил]фенил-2-пропановую кислоту,метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат,метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензоксазол-3(2 Н)-ил)этокси]фенилпропаноат,метил 3-4-[2-(6-бензил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат,метил 3-4-[2-(6-[(метоксиимино)(фенил) метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенилпропаноат и 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропановую кислоту,а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 23. Способ получения соединений формулы (I), который отличается тем, что в качестве исходного материала применяют соединение формулы (IV) в которой R1, R2, Х и D имеют значения, указанные для формулы (I),которое конденсируют в основной среде с соединением формулы (V) в которой Hal представляет собой атом галогена и A, R3 и R4 имеют значения, указанные для формулы (I),с получением соединения формулы (VI) в которой R'5 и R'6 могут иметь любое из значений, приведенных здесь ранее для R5 и R6, за исключением группы СООН,с получением соединения формулы (I/a),частного случая соединений формулы (I)(I/b), частного случая соединений формулы (I) в которой D, А, X, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,(для соединений формул (I/a) и (I/b) возможно получение непосредственно при помощи прямой конденсации соединения формулы (IV) с соединением формулы (V) в которой Hal представляет собой атом галогена и A, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее),или это соединение формулы (VI) конденсируют при условиях реакции ХоммераЭммонса с соответствующим фосфоновым соединением формулы (VIII)(VIII),Наl-СН 2-В' в которой Hal представляет собой атом галогена и В' представляет собой линейную или разветвленную (С 1-С 5)алкильную группу или линейную или разветвленную (С 2-С 5)алкенильную группу,эти группы замещены группой R'5, группой формулы (II') 40 единений формулы (I/f), частного случая соединений формулы (I) или группой формулы (III') в которой группы R'5 и R'6 и обозначение имеют значения, указанные здесь ранее,с получением соединения формулы (I/c),частного случая соединений формулы (I) в которой D, X, А, В', R1, R2, R3 и R4 имеют значения, указанные здесь ранее,которое можно подвергать каталитической гидрогенации в присутствии палладия, например, с получением соединения формулы (I/d),частного случая соединений формулы (I) в которой D, А, X, В', R1, R2, R3 и R4 имеют значения, указанные здесь ранее,или это соединение формулы (VI) переводят в соответствующий хлорид кислоты, который конденсируют, в присутствии соединения палладия или олова, например, с соединением формулы (IX) в которой R'5 и R'6 имеют значения, указанные здесь ранее,с получением соединения формулы (X) в которой D, X, A, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,которое подвергают действию восстановителя, такого как Et3SiH, например, с получением соединения формулы (I/е), частного случая соединений формулы (I) в которой D, X, A, R1, R2, R3, R4, R'5 и R'6 имеют значения, указанные здесь ранее,причем соединения формулы (I/a), (I/b),(I/c), (I/d) или (I/е), в которых R'5 и R'6 представляют собой сложноэфирные группы, могут быть полностью или частично гидролизированы с получением соответствующих гемдикарбоксилированных или хемикарбоксилированных со в которой D, X, A, R1, R2, R3 и R4 имеют значения, указанные здесь ранее, и В" представляет собой группу, как указано здесь ранее для В, в которой R5 и/или R6 представляет(ют) собой группу СООН,(для соединений формулы (I/f), в которой В" представляет собой группу -СН=СН-СООН,возможно получение непосредственно из соединения формулы (VI) при помощи конденсации малоновой кислоты при декарбоксилирующих условиях и восстановление их с получением соединений формулы (I/f) в которой В" представляет собой группу -СН 2-СН 2-СООН),соединения формул с (I/a) по (I/f) составляют совокупность соединений по изобретению,эти соединения можно очищать согласно традиционной методике разделения, переводить, при желании, в аддитивные соли и фармацевтически приемлемой кислотой или основанием и необязательно разделять на их изомеры согласно традиционной методике разделения. 24. Фармацевтические композиции, включающие в качестве активного ингредиента по меньшей мере одно соединение формулы (I) по любому из пп. с 1 по 22 или его фармацевтически приемлемую аддитивную соль с кислотой или основанием, отдельно или в сочетании с одним или более фармацевтически приемлемыми эксципиентами. 25. Фармацевтические композиции по п.24 для применения для получения лекарственного препарата для лечения и/или профилактики гипергликаемии, дислипидаемии и, более конкретно, при лечении инсулиннезависимого диабета типа II, сопротивляемости инсулину, непереносимости глюкозы, нарушений, связанных с синдромом X, заболевания коронарной артерии и других сердечно-сосудистых заболеваний,почечных нарушений, ретинопатии, нарушений,связанных с активацией эндотелиальных клеток,псориаза, полицистического синдрома яичников, слабоумия, остеопороза, кишечных воспалительных нарушений, миотонической дистрофии, панкреатита, артериосклероза, ксантомы, а также при лечении или профилактике диабета типа I, ожирения, регулировании аппетита, анорексии, булимии, нервной анорексии, а также раковых патологий, и в частности, гормонзависимых раков, таких как рак молочной железы или рак толстой кишки, а также как ингибиторов ангиогенеза.
МПК / Метки
МПК: A61P 3/10, A61K 31/423, C07D 263/58
Метки: гипогликаемических, применение, азола, соединения, агентов, качестве, конденсированные
Код ссылки
<a href="https://eas.patents.su/21-4676-kondensirovannye-soedineniya-azola-i-ih-primenenie-v-kachestve-gipoglikaemicheskih-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные соединения азола и их применение в качестве гипогликаемических агентов</a>
Предыдущий патент: Способ получения замещенных [1,4]диазепино[6,7,1-hi]индол-4-онов
Следующий патент: Способ профилактики хронической сердечной недостаточности у больных туберкулезом легких
Случайный патент: Способ изготовления изоляционного остекления

























