Трициклическое индазольное соединение, способ его получения и содержащая его фармацевтическая композиция
Номер патента: 21417
Опубликовано: 30.06.2015
Авторы: Каццолла Никола, Фурлотти Гвидо, Мангано Джорджина, Гарроне Беатриче, Магаро' Габриеле, Ализи Мария Алессандра
Формула / Реферат
1. Трициклическое индазольное соединение общей формулы (I)
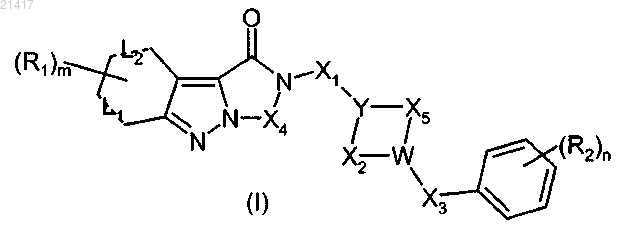
где Y обозначает СН или N;
W обозначает СН или N;
при условии, что по крайней мере один из Y и W является атомом азота;
Х1 и Х3 могут независимо обозначать s-связь, двухвалентную алкильную цепь, содержащую от 1 до 5 атомов углерода, карбонильную группу, двухвалентную алканоильную цепь типа -CO-(СН2)1-4- или -(СН2)1-4-СО-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими C1-3алкильными группами, одной или несколькими C1-3алкоксигруппами;
Х4 может быть двухвалентной алкильной цепью, содержащей от 1 до 5 атомов углерода, двухвалентной алканоильной цепью типа -CO-(CH2)1-4- или -(СН2)1-4-СО-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими C1-3алкильными группами, одной или несколькими C1-3алкоксигруппами;
Х2 и Х5 могут независимо обозначать s-связь или двухвалентную алкильную цепь, содержащую от 1 до 4 атомов углерода, где атомы водорода указанной алкильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими C1-3алкильными группами, одной или несколькими C1-3алкоксигруппами и по крайней мере один из Х2 и Х5 отличен от s-связи;
L1 и L2 могут независимо обозначать s-связь или p-связь;
R1 может независимо обозначать Н, ОН, атом галогена, CN, C1-3алкил, C1-3алкокси, NRiRii, CF3, CONRiiiRiv;
R2 может независимо обозначать Н, ОН, атом галогена, CN, C1-3алкил, C1-3алкокси, C1-3гидроксиалкил, C1-3аминоалкил, NRiRii, CF3, CONRiiiRiv;
m и n могут независимо принимать значения от 1 до 3;
Ri, Rii, Riii, Riv независимо могут обозначать Н или C1-3алкил;
и его аддитивные соли с фармацевтически приемлемыми органическими и неорганическими кислотами.
2. Соединение по п.1, отличающееся тем, что X1 может обозначать карбонильную группу, двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -СО-(СН2)1-3- или -(СН2)1-3-СО-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими C1-3алкильными группами.
3. Соединение по п.1 или 2, отличающееся тем, что Х3 может обозначать s-связь, двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -СО-(СН2)1-2-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими C1-3алкильными группами.
4. Соединение по любому из предшествующих пунктов, отличающееся тем, что Х4 может обозначать двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -СО-(СН2)1-2- или -(СН2)1-2-CO-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими C1-3алкильными группами.
5. Соединение по любому из предшествующих пунктов, отличающееся тем, что Х2 и Х5 могут обозначать двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, где атомы водорода указанной алкильной цепи и алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими С1-3алкильными группами.
6. Соединение по любому из предшествующих пунктов, отличающееся тем, что L1 и L2 могут оба обозначать s-связь или могут оба обозначать p-связь.
7. Соединение по любому из предшествующих пунктов, отличающееся тем, что R1 может независимо обозначать Н, ОН, F, Cl, CN, C1-3алкильную группу, C1-3алкоксигруппу, группу NRiRii, CF3 и группу CONRiiiRiv.
8. Соединение по любому из предшествующих пунктов, отличающееся тем, что R2 может независимо обозначать Н, ОН, F, Cl, CN, C1-3алкил, C1-3алкокси, C1-3гидроксиалкил, C1-3аминоалкил, NRiRii, CF3 и CONRiiiRiv.
9. Соединение по любому из предшествующих пунктов, отличающееся тем, что фармацевтически приемлемая органическая или неорганическая кислота выбрана из группы, которая включает щавелевую, малеиновую, метансульфоновую, паратолуолсульфоновую, янтарную, лимонную, винную, молочную, хлористо-водородную, фосфорную и серную кислоты.
10. Способ получения трициклического индазольного соединения формулы (I), определенного в любом из предшествующих пп.1-9, отличающийся тем, что он включает (1b) конденсацию амидного производного формулы (IV)
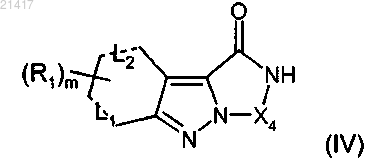
где R1, L1, L2, X4 и m имеют значения, определенные в любом из предшествующих пп.1-8,
с производным формулы (V)
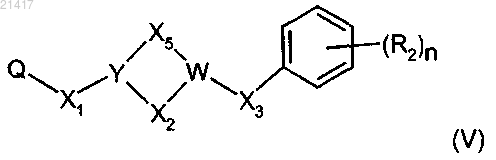
где R2, X1, Х2, Х3, Х5, W, Y и n имеют значения, определенные в любом из предшествующих пп.1-8, и
Q обозначает уходящую группу, которая выбрана из группы, включающей атом галогена, мезилатную группу (CH3SO3-) и тозилатную группу (p-MePhSO3-),
с образованием трициклического индазольного соединения общей формулы (I).
11. Способ получения трициклического индазольного соединения формулы (I), определенного в любом из предшествующих пп.1-9, отличающийся тем, что он включает (1а) конденсацию амина формулы (II)
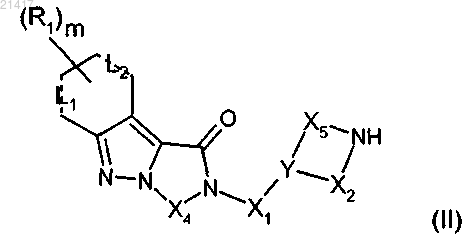
где X1, Х2, Х4, Х5, Y, L1, L2, R1 и m имеют значения, определенные в любом из предшествующих пп.1-8,
с производным формулы (III)
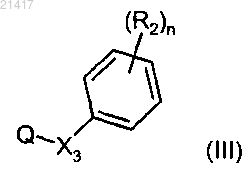
где Х3, R2 и n имеют значения, определенные в любом из предшествующих пп.1-8;
Q обозначает уходящую группу, которая выбрана из группы, включающей атом галогена, мезилатную группу (CH3SO3-) и тозилатную группу (p-MePhSO3-),
с образованием трициклического индазольного производного общей формулы (I).
12. Промежуточное соединение формулы (II)
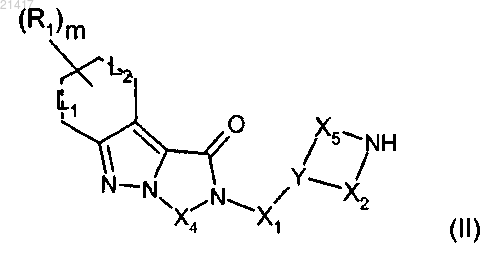
где X1, X2, X4, X5, Y, L1, L2, R1 и m имеют значения, определенные в любом из предшествующих пп.1-8.
13. Промежуточное соединение формулы (IV)
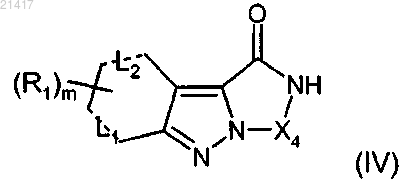
где R1, X4 и m имеют значения, определенные в любом из предшествующих пп.1-8;
L1 и L2 обозначают s-связь,
при условии, что когда R1 обозначает Н, то Х4 отличен от СН2СН2.
14. Фармацевтическая композиция для лечения патологического состояния, выбранного из группы, включающей расстройства центральной нервной системы, расстройства функций гладких мышц либо желудочно-кишечной системы, либо сердечно-сосудистой системы, и глазные патологии, содержащая эффективное количество по меньшей мере одного трициклического индазольного соединения формулы (I)
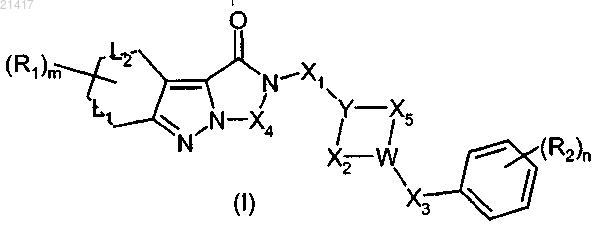
где Y, W, X1, X2, X3, X4, X5, L1, L2, R1, R2, m и n имеют значения, определенные в любом из предшествующих пп.1-8,
или его соли с фармацевтически приемлемей органической или неорганической кислотой и по крайней мере один фармацевтически приемлемый эксципиент.
15. Применение трициклического индазольного соединения формулы (I)
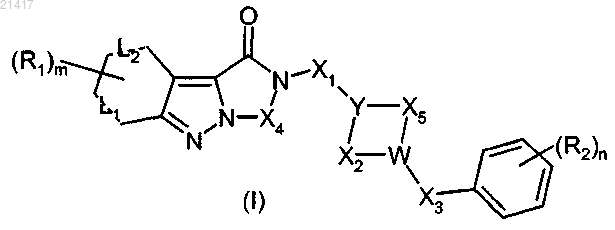
где Y, W, X1, Х2, Х3, Х4, Х5, L1, L2, R1, R2, m и n имеют значения, определенные в любом из предшествующих пп.1-8,
или его соли с фармацевтически приемлемой органической или неорганической кислотой для приготовления лекарственного средства для лечения патологического состояния, выбранного из группы, которая включает расстройства центральной нервной системы, такие как нарушения сна, шизофрения и тревога, расстройства функций гладких мышц либо желудочно-кишечной системы, такие как синдром раздраженного кишечника (IBS), хронический запор, диарея и функциональная диспепсия, либо сердечно-сосудистой системы, такие как гипертензия, ишемия миокарда, церебральная ишемия, мигрень, тромбоз и агрегация тромбоцитов, и глазные патологии, такие как глаукома.
Текст
ТРИЦИКЛИЧЕСКОЕ ИНДАЗОЛЬНОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ Трициклическое индазольное соединение и его фармацевтически приемлемые кислотноаддитивные соли, их применение, способ их получения, промежуточные продукты для их получения и содержащая их фармацевтическая композиция. Трициклическое индазольное соединение имеет следующую общую формулу (I), где R1, R2, L1, L2, X1, X2, X3, X4, X5, Y, W, m и n имеют значения, указанные в описании изобретения(71)(73) Заявитель и патентовладелец: АЦЬЕНДЕ КИМИКЕ РЬЮНИТЕ АНДЖЕЛИНИ ФРАНЧЕСКО А.К.Р.А.Ф. С.П.А. (IT) Область техники, к которой относится изобретение Настоящее изобретение относится к новым трициклическим индазольным соединениям, способам их получения и промежуточным продуктам, необходимым для их получения, к содержащей их фармацевтической композиции и к их применению. В частности, настоящее изобретение относится к новым трициклическим индазольным соединениям, обладающим избирательной аффинностью к рецепторам 5-НТ 2 А, пригодным при лечении некоторых патологий, в которые вовлекаются рецепторы 5-НТ 2 А, например при лечении некоторых расстройств центральной нервной системы, а также при лечении расстройств функций гладких мышц, как желудочно-кишечной системы, так и сердечно-сосудистой системы. Активность указанных рецепторов важна также при регулировании внутриглазного давления и, следовательно, при лечении глаукомы. Уровень техники 2 А рецептор серотонина (5-НТ 2 А) является рецептором, сопряженным с белком G, который имеется у многих видов, и широко распространен в теле человека. Процесс передачи сигнала, возникающего в результате активации рецептора, не полностью понятен. Известно, что активация указанного рецептора посредством активации сопряженного с ним белка G приводит к активации различных ферментов, таких как фосфолипаза С (с последующим гидролизом дифосфата фосфатидилинозитола и получением трифосфата инозитола) или фосфолипаза А 2 (которая приводит к высвобождению арахидоновой кислоты). Кроме того, ответная реакция рецептора приводит к потоку ионов кальция (Са 2+) в клетку и к активации функциональных белков, таких как протеинкиназа С. Рецептор присутствует в центральной нервной системе, в клетках гладких мышц сердечно-сосудистой и желудочно-кишечной системы и в тромбоцитах. В международной патентной публикации WO 2008061688 описываются 2-алкильные производные индазола, обладающие избирательной активностью по отношению к рецепторам 5-НТ 2, а что касается различных подтипов рецептора, то соединения обладают преимущественным сродством к рецепторам 5 НТ 2 А, по сравнению с рецепторами 5-HT2C. Известны другие соединения, обладающие предпочтительной активностью по отношению к рецептору 5-НТ 2 А, такие как, например, пимавансерин (АСР-103), который проходит стадию III клинических испытаний для лечения психоза у пациентов с болезнью Паркинсона, и эпливансерин (SR46349), и волинансерин (М 100907), оба из которых проходят стадию III клинических испытаний для лечения инсомнии. Рецептор 5-НТ 2 А вовлекается в некоторые расстройства центральной нервной системы, такие как,например, нарушения сна (Рора D. et al., J. Neurosci. 2005, 25(49): 11231-11238), шизофрения (Kapur S. etal., Am. J. Psychiatry. 1996, 153: 466-476) и страх (Van Oekelen D. et al., Life Sci. 2003, 72(22): 2429-2449),а также расстройства функций гладких мышц либо желудочно-кишечной системы (Briejer M.R. et al.,Neurogastroenterol. Motil. 1997, 9(4): 231-237), либо сердечно-сосудистой системы (Nagatomo Т. et al.,Pharmacol. Ther. 2004, 104(1): 59-81). Кроме того, соединения, обладающие избирательной аффинностью к рецептору 5-НТ 2 А, могут быть эффективны для регулирования внутриглазного давления и, как следствие, эффективны при лечении таких патологий, как глаукома (Jesse A. May et al., J. Pharmacol. Exp. Ther. 2003, 306(1): 301-309). В международной патентной публикации WO 2006050803 раскрываются би- и трициклические индазольные соединения и их соли для селективной борьбы с вредными растениями при выращивании полезных растений или для регулирования роста растений. Сущность изобретения Авторы настоящего изобретения неожиданно обнаружили новые трициклические индазоламидные соединения, обладающие избирательной аффинностью к рецептору 5-НТ 2 А. Кроме того, авторы настоящего изобретения неожиданно обнаружили, что новые трициклические индазоламидные соединения обладают значительно меньшей избирательной аффинностью по отношению к рецепторам 5-НТ 2 С, по сравнению с рецепторами 5-НТ 2 А. Указанная биологическая активность разительно отличается от биологической активности известных трициклических индазольных соединений, например, от соединений, которые приведены в вышеуказанной международной патентной публикации WO 2006050803. Кроме того, соединения по настоящему изобретению имеют структуру, которая заметно отличается от структуры известных соединений, обладающих предпочтительной аффинностью к рецептору 5-НТ 2 А. Новые трициклические индазольные соединения по настоящему изобретению могут быть пригодны при лечении некоторых патологий, в которые вовлечен рецептор 5-НТ 2 А, например, при лечении некоторых расстройств центральной нервной системы, таких как, например, нарушения сна, шизофрения и тревога, а также расстройств функций гладких мышц либо желудочно-кишечной системы, таких как синдром раздраженного кишечника (IBS), хронический запор, диарея и функциональная диспепсия, либо сердечно-сосудистой системы, таких как гипертензия, ишемия миокарда, церебральная ишемия, мигрень,тромбоз и агрегация тромбоцитов. Активность указанного рецептора важна также при регулировании внутриглазного давления и, как следствие, при лечении глаукомы. Таким образом, первый аспект настоящего изобретения касается трициклического индазольного соединения общей формулы (I): где Y обозначает СН или N;W обозначает СН или N; при условии, что по крайней мере один из Y и W является атомом азота;X1 и Х 3 могут независимо обозначать -связь, двухвалентную алкильную цепь, содержащую от 1 до 5 атомов углерода, карбонильную группу, двухвалентную алканоильную цепь типа -CO-(CH2)1-4- или-(СН 2)1-4-CO-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими C1-3 алкильными группами, одной или несколькими C1-3 алкоксигруппами; Х 4 может быть двухвалентной алкильной цепью, содержащей от 1 до 5 атомов углерода, карбонильной группой, двухвалентной алканоильной цепью типа -СО-(СН 2)1-4- или -(СН 2)1-4-СО-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими С 1-3 алкильными группами, одной или несколькими C1-3 алкоксигруппами; Х 2 и Х 5 могут независимо обозначать -связь или двухвалентную алкильную цепь, содержащую от 1 до 4 атомов углерода, где атомы водорода указанной алкильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими C1-3 алкильными группами, одной или несколькими C1-3 алкоксигруппами;L1 и L2 могут независимо обозначать -связь или -связь;R1 может независимо обозначать Н, ОН, атом галогена, CN, C1-3 алкил, C1-3 алкокси, NRiRii, NO2, CF3,CONRiiiRiv, SO2Rv, OCF3, N(Rvi)SO2Rvii, C(NRviii)N(RixRx), N(Rxi)С(O)Rxii;R2 может независимо обозначать Н, ОН, атом галогена, CN, C1-3 алкил, C1-3 алкокси, C1C1-3 аминоалкил, NRiRii, NO2, CF3, CONRiiiRiv, SO2Rv, OCF3, N(Rvi)SO2Rvii,3 гидроксиалкил,viiim и n могут независимо принимать значения от 1 до 3;Ri, Rii, Riii, Riv, Rv, Rvi, Rvii, Rviii, Rix, Rx, Rxi, Rxii независимо могут обозначать Н или C1-3 алкил; и его аддитивных солей с фармацевтически приемлемыми органическими и неорганическими кислотами. Типичными примерами фармацевтически приемлемых кислот являются щавелевая, малеиновая, метансульфоновая, паратолуолсульфоновая, янтарная, лимонная, винная, молочная, хлористо-водородная,фосфорная и серная кислоты. В соответствии с предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) X1 может обозначать карбонильную группу, двухвалентную алкильную цепь,содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -СО-(СН 2)1-2- или-(СН 2)1-2-СО-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими С 1-3 алкильными группами. В соответствии с еще более предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) X1 может обозначать -СО-, -СН 2- или -(СН 2)3-. В соответствии с предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) Х 3 может обозначать -связь, двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -СО-(СН 2)1-2-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими C1-3 алкильными группами. В соответствии с еще более предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) Х 3 может обозначать -связь, -(СН 2)2-, -СО-СН 2- или -CH2CF2-. В соответствии с предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) X4 может обозначать двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -CO-(CH2)1-2- или -(СН 2)1-2-CO-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими C1-3 алкильными группами. В соответствии с еще более предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) Х 4 может обозначать -(СН 2)2-, -(СН 2)3-, -СН 2-СО- или -СО-СН 2-. В соответствии с предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) Х 2 и Х 5 могут обозначать двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, где атомы водорода указанной алкильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими С 1-3 алкильными группами. В соответствии с еще более предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) Х 2 может обозначать -(СН 2)2- или -(СН 2)3-, а Х 5 может обозначать -СН 2 или -(СН 2)2-. В соответствии с предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) L1 и L2 могут оба обозначать -связь или -связь. В соответствии с предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) R1 может независимо обозначать Н, ОН, F, Cl, CN, C1-3 алкильную группу,C1-3 алкоксигруппу, группу NRiRii, NO2, CF3, группу CONRiiiRiv, SO2v и OCF3. В соответствии с еще более предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) R1 может независимо обозначать Н, ОН, F, CN, CF3 и CONH2. В соответствии с предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) R2 может независимо обозначать Н, ОН, F, Cl, CN, С 1-3 алкил, C1-3 алкокси,C1-3 гидроксиалкил, C1-3 аминоалкил, NRiRii, NO2, CF3, CONRiiiRiv, SO2Rv, OCF3. В соответствии с еще более предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) R2 может независимо обозначать Н, ОН, F, CH2OH, CH2NH2, CONH2. В соответствии с предпочтительным вариантом осуществления настоящего изобретения в вышеприведенной формуле (I) m принимает значение 1, a n может быть равно 1 или 2. Второй аспект настоящего изобретения касается способа получения (i) трициклического индазольного соединения общей формулы (I) и необязательно (ii) его кислотно-аддитивной соли с фармацевтически приемлемыми неорганическими и органическими кислотами. Таким образом, способ по настоящему изобретению в соответствии с первым вариантом его осуществления отличается тем, что он включает (1b) конденсацию амидного производного формулы (IV) где R1, L1, L2, X4 и m имеют значения, указанные выше при рассмотрении соединения формулы (I),с производным формулы (V) где R2, X1, Х 2, Х 3, Х 5, W, Y и n имеют значения, указанные выше при рассмотрении соединения формулы (I), иQ обозначает уходящую группу, которая выбрана из группы, включающей атом галогена, мезилатную группу (CH3SO3-) и тозилатную группу (р-MePhSO3-), с образованием трициклического индазольного соединения общей формулы (I). Предпочтительно Q обозначает атом хлора, атом брома или мезилатную группу. Кроме того, способ по настоящему изобретению, когда W обозначает атом азота, отличается тем,что он включает (1 а) конденсацию амина формулы (II) где X1, Х 2, X4, X5, Y, L1, L2, R1 и m имеют значения, указанные выше при рассмотрении соединения формулы (I),с производным формулы (III) где Х 3, R2 и n имеют значения, указанные выше при рассмотрении соединения формулы (I), иQ обозначает уходящую группу, которая выбрана из группы, включающей атом галогена, мезилатную группу (CH3SO3-) и тозилатную группу (p-MePhSO3-),-3 021417 с образованием трициклического индазольного производного общей формулы (I). Предпочтительно Q обозначает атом брома или мезилатную группу. Если необходимо, трициклическое индазольное производное общей формулы (I) вводят во взаимодействие с фармацевтически приемлемой органической или неорганической кислотой с образованием его кислотно-аддитивной соли. Стадию конденсации (1b) можно провести обычными способами в присутствии основания. Например, амидное производное формулы (IV) взаимодействует с соединением формулы (V), в котором Q предпочтительно обозначает атом хлора, атом брома или мезилатную группу, в присутствии основания. Типичным примером основания является гидрид натрия. Стадию конденсации (1b), преимущественно, проводят в присутствии растворителя при температуре в диапазоне от -20C до температуры кипения растворителя и в течение времени в диапазоне от 0,5 до 48 ч. Предпочтительно температура составляет от 0C до температуры кипения растворителя. Предпочтительно время реакции составляет от 1 до 24 ч. Как правило, в качестве растворителя используют полярный апротонный растворитель. Примерами подходящих полярных апротонных растворителей являются N,N-диметилформамид или тетрагидрофуран. Стадию конденсации (1 а) также можно провести обычными способами, предпочтительно, в присутствии основания. Например, производное амина формулы (II) может взаимодействовать с соединением формулы (III), в котором Q предпочтительно обозначает атом брома или мезилатную группу, преимущественно, в присутствии основания. Типичными примерами оснований являются карбонат или бикарбонат калия, натрия или цезия. Стадию конденсации (1 а), преимущественно, проводят в присутствии растворителя при температуре от комнатной температуры (20C) до 160C и в течение времени от 1 до 72 ч. Предпочтительно температура реакции составляет от комнатной температуры (20C) до 100C. Предпочтительно время реакции составляет от 12 до 48 ч. Как правило, в качестве растворителя используют протонный или апротонный растворитель. Примерами подходящих полярных протонных растворителей являются спирты, такие как этанол. Примерами подходящих полярных апротонных растворителей являются ацетон или N,N-диметилформамид. Соединение, полученное либо на стадии конденсации (1b), либо на стадии конденсации (1 а), может быть очищено обычными способами, такими как флэш-хроматография и кристаллизация. Трициклическое индазольное производное общей формулы (I), полученное либо на стадии конденсации (1b), либо на стадии конденсации (1 а), можно ввести во взаимодействие с фармацевтически приемлемой органической или неорганической кислотой с образованием его кислотно-аддитивной соли. Получение кислотно-аддитивной соли трициклического индазольного соединения общей формулы(I) с фармацевтически приемлемой органической или неорганической кислотой можно провести, используя обычные методики. Например, его можно провести, вначале растворив соединение формулы (I) в растворителе, а затем обрабатывая полученный таким образом раствор органическим или водным раствором представляющей интерес кислоты. Типичными примерами растворителей являются этанол, изопропанол, этилацетат и диэтиловый эфир. Полученную соль затем можно отделить, используя обычные методики и, если возможно, очистить кристаллизацией. Некоторые промежуточные соединения формулы (II) и (IV) являются новыми и, таким образом, они составляют еще один аспект настоящего изобретения. Таким образом, в соответствии с еще одним аспектом настоящее изобретение касается промежуточных соединений формулы (II) где X1, Х 2, X4, X5, Y, L1, L2, R1 и m имеют значения, указанные выше при рассмотрении соединения формулы (I). В соответствии с еще одним аспектом настоящее изобретение касается промежуточных соединений формулы (IV) где R1, L1, L2, X4 и m имеют значения, указанные выше при рассмотрении соединения формулы (I),при условии, что когда R1 обозначает Н, a L1 и L2 обозначают -связь, то Х 4 отличен от СН 2 СН 2 или СН 2 СН 2 СН 2, и когда R1 обозначает Н, a L1 и L2 обозначают -связь, то Х 4 отличен от СН 2 СН 2. Амин формулы (II), а также трициклические производные формулы (IV) могут быть получены обычными способами, например, как описано на схеме 1. Схема 1 На первой стадии синтеза показано алкилирование сложноэфирного производного индазолкарбоновой кислоты формулы (VI) с помощью алкилирующего агента формулы (VII), где Q1 обозначает уходящую группу, выбранную из группы, которая включает атом галогена, мезилатную группу (CH3SO3-) и тозилатную группу (p-MePhSO3-), a P1 обозначает защитную группу для концевых аминогрупп, выбранную из группы, которая включает 9-флуоренилметилкарбамат (Fmoc), трет-бутилкарбамат (Boc) и Nбензилиденамин. Предпочтительно Q1 обозначает атом хлора, атом брома или мезилатную группу. Затем защитную группу P1 удаляют и образовавшийся первичный амин внутримолекулярно взаимодействует со сложноэфирной группой с образованием циклического амина формулы (IV). Последний алкилируют по реакции с алкилирующим агентом формулы (IX), где Q2 обозначает уходящую группу, выбранную из группы, которая включает атом галогена, мезилатную группу (CH3SO3-) и тозилатную группу (p-MePhSO3-), а Р 2 обозначает защитную группу для концевых аминогрупп, выбранную из группы, которая включает 9-флуоренилметилкарбамат (Fmoc) и трет-бутилкарбамат (Boc). Предпочтительно Q2 обозначает атом хлора, атом брома или мезилатную группу. Затем защитную группу Р 2 удаляют с образованием производного амина формулы (II). Соединения, примеры которых приведены в следующей табл. 1, могут быть получены по приведенной выше схеме синтеза. Типичными примерами патологических состояний, на которые благотворное воздействие может оказать лечение с использованием нового трициклического индазольного соединения формулы (I), обладающего избирательной аффинностью к рецептору 5-НТ 2 А, являются некоторые расстройства центральной нервной системы, такие как, например, нарушения сна (Рора D. et al., J. Neurosci. 2005, 25(49): 1123111238), шизофрения (Kapur S. et al., Am. J. Psychiatry. 1996, 153: 466-476) и тревога (Van Oekelen D. et al.,-6 021417Life Sci. 2003, 72 (22): 2429-2449), а также расстройства функций гладких мышц либо желудочнокишечной системы (Briejer M.R. et al., Neurogastroenterol. Motil. 1997, 9(4): 231-237), либо сердечнососудистой системы (Nagatomo T. et al., Pharmacol. Ther. 2004, 104(1): 59-81). Кроме того, указанная фармацевтическая композиция может быть эффективна для регулирования внутриглазного давления и, как следствие, эффективна при лечении таких патологий, как глаукома (May J.A. et al., J. Pharmacol. Exp.Ther. 2003, 306(1): 301-309). Другой аспект настоящего изобретения касается применения описанного выше трициклического индазольного соединения (I) или его соли с фармацевтически приемлемой органической или неорганической кислотой, для получения лекарственного средства для лечения патологического состояния, выбранного из группы, которая включает расстройства центральной нервной системы, расстройства функций гладких мышц либо желудочно-кишечной системы, либо сердечно-сосудистой системы и глазные патологии. В частности, настоящее изобретение касается применения описанного выше трициклического индазольного соединения общей формулы (I) или его соли с фармацевтически приемлемой органической или неорганической кислотой, для получения лекарственного средства для лечения расстройства центральной нервной системы, выбранного из группы, которая включает нарушения сна, шизофрению и тревогу. Настоящее изобретение касается также применения описанного выше трициклического индазольного соединения общей формулы (I) или его соли с фармацевтически приемлемой органической или неорганической кислотой, для получения лекарственного средства для лечения расстройства функций гладких мышц желудочно-кишечной системы, выбранного из группы, которая включает синдром раздраженного кишечника (IBS), хронический запор, диарею и функциональную диспепсию. Настоящее изобретение касается также применения описанного выше трициклического индазольного соединения общей формулы (I) или его соли с фармацевтически приемлемой органической или неорганической кислотой, для получения лекарственного средства для лечения расстройства функций гладких мышц сердечно-сосудистой системы, выбранного из группы, которая включает гипертензию,ишемию миокарда, церебральную ишемию, мигрень, тромбоз и агрегацию тромбоцитов. Настоящее изобретение касается также применения описанного выше трициклического индазольного соединения общей формулы (I) или его соли с фармацевтически приемлемой органической или неорганической кислотой, для получения лекарственного средства для лечения глаукомы. Настоящее изобретение касается также способа лечения патологического состояния, выбранного из группы, включающей расстройства центральной нервной системы, расстройства функций гладких мышц либо желудочно-кишечной системы, либо сердечно-сосудистой системы и глазные патологии, включающего введение нуждающемуся в этом пациенту терапевтически эффективного количества по меньшей мере одного описанного выше трициклического индазольного соединения формулы (I) или его соли с фармацевтически приемлемой органической или неорганической кислотой. В частности, расстройствами центральной нервной системы, которые можно лечить по способу настоящего изобретения, являются нарушения сна, шизофрения и тревога. Расстройствами функций гладких мышц желудочно-кишечной системы, которые можно лечить по способу настоящего изобретения, являются синдром раздраженного кишечника (IBS), хронический запор, диарея и функциональная диспепсия. Расстройствами функций гладких мышц сердечно-сосудистой системы, которые можно лечить по способу настоящего изобретения, являются гипертензия, ишемия миокарда, церебральная ишемия, мигрень, тромбоз и агрегация тромбоцитов. Глазные патологии, которые можно лечить по способу настоящего изобретения, включают глаукому. Дальнейший аспект настоящего изобретения касается фармацевтической композиции, содержащей эффективное количество по меньшей мере одного описанного выше трициклического индазольного соединения формулы (I) или его соли с фармацевтически приемлемой органической или неорганической кислотой и по крайней мере один фармацевтически приемлемый эксципиент. Фармацевтическую композицию по настоящему изобретению предпочтительно получают в виде подходящих дозированных форм, содержащих эффективное количество по меньшей мере одного описанного выше трициклического индазольного соединения формулы (I) или его соли с фармацевтически приемлемой органической или неорганической кислотой и по крайней мере один фармацевтически приемлемый эксципиент. Таким образом, дальнейший аспект настоящего изобретения касается применения вышеуказанной фармацевтической композиции для лечения патологического состояния, выбранного из группы, которая включает расстройства центральной нервной системы, такие как нарушения сна, шизофрения и тревога,для лечения расстройств функций гладких мышц либо желудочно-кишечной системы, таких как синдром раздраженного кишечника (IBS), хронический запор, диарея и функциональная диспепсия, либо сердечно-сосудистой системы, таких как гипертензия, ишемия миокарда, церебральная ишемия, мигрень, тромбоз и агрегация тромбоцитов, и для лечения глазных патологий, таких как глаукома. Примерами подходящих дозированных форм являются таблетки, капсулы, покрытые оболочкой таблетки, гранулы, растворы и сиропы для перорального введения; растворы, помада и мазь для местного введения; медицинские пластыри для трансдермального введения; суппозитории для ректального введения и стерильные растворы для инъекций. Другими подходящими дозированными формами являются дозированные формы с замедленным высвобождением и дозированные формы на основе липосом для перорального введения, для инъекций или трансдермального введения. Дозированные формы могут также содержать другие традиционные ингредиенты, такие как консерванты, стабилизаторы, поверхностно-активные вещества, буферные добавки, соли для регулирования осмотического давления, эмульгаторы, подсластители, красители, ароматизаторы и т.п. Если имеются специальные терапевтические требования, то фармацевтическая композиция по настоящему изобретению может содержать другие фармакологически активные ингредиенты, одновременное введение которых приносит пользу. Количество трициклического индазольного соединения формулы (I) или его фармацевтически приемлемой кислотно-аддитивной соли в фармацевтической композиции по настоящему изобретению может изменяться в широких пределах, в зависимости от известных факторов, например, типа патологии, тяжести заболевания, массы тела пациента, дозированной формы, выбранного пути введения, количества введений в сутки и эффективности выбранного трициклического соединения формулы (I). Тем не менее,специалист легко и обычным образом сможет определить оптимальное количество. Как правило, количество трициклического индазольного соединения формулы (I) или его фармацевтически приемлемой кислотно-аддитивной соли в фармацевтической композиции по настоящему изобретению будет таким, чтобы гарантировать дозировку в диапазоне от 0,0001 до 100 мг/кг/день. Предпочтительно дозировка составляет от 0,001 до 50 мг/кг/день и еще более предпочтительно от 0,01 до 10 мг/кг/день. Дозированные формы фармацевтической композиции по настоящему изобретению могут быть получены с помощью методов, известных химику-фармацевту, которые включают смешивание, гранулирование, прессование, растворение, стерилизацию и т.п. Приведенное ниже описание предназначено для дальнейшей иллюстрации настоящего изобретения и его не ограничивает. Краткое описание чертежа На чертеже приведен график, показывающий воздействие исследуемых соединений после внутрибрюшинного введения при проведении теста по исследованию судорожных движений головой у мышей,согласно методике теста С, описание которой приведено ниже. По оси Y отложено количество судорожных движений головой после внутрибрюшинного введения соединений, приведенных по оси X. Экспериментальная часть. 1H-ЯМР-спектроскопия: a) Varian Gemini 200 (200 МГц), b) Brucker 300 Avance (300 МГц); внутренний стандарт = триметилсилан. [(с) - синглет; (д) = дублет; (т) = триплет; (кв.) = квартет; (квт) = квинтет; (скт) = секстет; (спт) = септет; (уш.с) = уширенный синглет; (уш.д) = уширенный дублет; (дд) = дублет дублетов; (дт) = дублет триплетов; (тт) = триплет триплетов; (м) = мультиплет; J = константа взаимодействия;= химический сдвиг (в м.д.)]. Пример 1. 2-(1-[2-(4-Фторфенил)этил]пиперидин-4-илметил)-3,4-дигидропиразино[1,2-b]индаэол-1(2 Н)-она гидрохлорид. 1 а) Метил 2-(2-хлорэтил)-2 Н-индазол-3-карбоксилат. 1-Бром-2-хлорэтан (70 мл; 0,84 моль) при перемешивании медленно добавляют к суспензии метилового эфира 1 Н(2 Н)-индазол-3-карбоновой кислоты (20 г; 0,084 моль), карбонат цезия (24,4 г; 0,177 моль) в ацетонитриле (600 мл) при комнатной температуре. Реакционную смесь оставляют перемешиваться при той же температуре в течение 3 дней, а затем твердые вещества удаляют фильтрованием. Растворитель упаривают при пониженном давлении. Полученное сырое соединение очищают флэшхроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат в соотношении 8:2. Указанным образом получают приблизительно 10 г метил 2-(2-хлорэтил)-2 Н-индазол-3 карбоксилата. 1H-ЯМР (300 МГц, CDCl3) : 3,9-4,1 (м, 5 Н); 5,24 (т, J=6,0 Гц; 2 Н); 7,2-7,4 (м, 2 Н); 7,79 (д; J=9,0 Гц; 1 Н); 8,02 (д; J=9,0 Гц; 1 Н). 1b) Метил 2-(2-азидоэтил)-2 Н-индазол-3-карбоксилат. При энергичном перемешивании при комнатной температуре добавляют азид натрия (8,8 г, 0,135 моль) к раствору метил 2-(2-азидоэтил)-2 Н-индазол-3-карбоксилата (9 г, 0,038 моль) в диметилсульфоксиде (ДМСО) (100 мл). Затем реакционную смесь охлаждают до комнатной температуры, разбавляют водой (100 мл) и несколько раз экстрагируют этилацетатом (3100 мл). Органические фазы объединяют, промывают водой(325 мл), затем насыщенным раствором NaCl (30 мл) и, в конце концов, сушат над безводным Na2SO4. Растворитель упаривают при пониженном давлении и получают приблизительно 6 г метил 2-(2 азидоэтил)-2 Н-индазол-3-карбоксилата, который используют для проведения следующей реакции, не проводя дальнейших стадий очистки. 1H-ЯМР (300 МГц, CDCl3) : 3,87 (т, J=6,0 Гц; 2 Н); 4,04 (с, 3H); 5,11 (т, J=6,0 Гц; 2 Н); 7,2-7,4 (м,2 Н); 7,80 (т, J=9,0 Гц; 1 Н); 8,01 (д; J=9,0 Гц; 1 Н). 1c) 3,4-Дигидропиразино[1,2-b]индазол-1(2 Н)-он. Суспензию, содержащую метил 2-(2-азидоэтил)-2 Н-индазол-3-карбоксилат (6 г, 0,024 моль), 10%ный палладий на активированном угле (0,5 г, 0,5 ммоль) в 5N растворе хлористого водорода в этаноле(100 мл) помещают в аппарат Парра и гидрируют в атмосфере водорода при комнатной температуре в течение 24 ч. По окончании реакции суспензию фильтруют через целит и растворитель удаляют испарением при пониженном давлении. Полученный указанным образом сырой продукт растворяют в абсолютном этаноле (250 мл), добавляют триэтиламин (12 мл, 0,12 моль) и при перемешивании кипятят с обратным холодильником в течение 48 ч. Реакцию прекращают, удаляя растворитель испарением при пониженном давлении. Остаток разбавляют водой (100 мл) и экстрагируют дихлорметаном (DCM) (3150 мл). Органические фазы объединяют, промывают насыщенным раствором NaCl (50 мл) и сушат над безводным Na2SO4. Получают приблизительно 3 г продукта. Его очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат в соотношении 8:2. Указанным образом получают 1,5 г 3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она. 1H-ЯМР (300 МГц, CDCl3) : 3,6-3,8 (м, 2 Н); 4,64 (т, J=6,0 Гц; 2 Н); 7,26 (т, J=9,0 Гц; 1 Н); 7,36 (т,J=9,0 Гц; 1 Н); 7,75 (д, J=9,0 Гц; 1 Н); 7,98 (д; J=9,0 Гц; 1 Н). 1d) трет-Бутил 4-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)-ил)метил]пиперидин-1 карбоксилат. 60%-ный NaH (0,72 г, 0,018 моль) добавляют к раствору 3,4-дигидропиразино[1,2-b]индазол-1(2 Н)она (2,7 г, 0,015 моль) в диметилформамиде (ДМФА) (50 мл) и перемешивают при комнатной температуре. Реакционную смесь продолжают перемешивать при той же температуре в атмосфере азота в течение 2 ч 30 мин; затем медленно добавляют раствор трет-бутил 4[(метилсульфонил)окси]метилпиперидин-1-карбоксилата (4,4 г, 0,015 моль) в ДМФА (25 мл). По окончании добавления смесь нагревают до 150C в течение 6 ч. Реакцию прекращают, охлаждая смесь до комнатной температуры и удаляя растворитель при пониженном давлении. Остаток растворяют в дихлорметане и затем фильтруют через слой силикагеля. Растворитель удаляют упариванием при пониженном давлении и получают 3,5 г трет-бутил 4-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)ил)метил]пиперидин-1-карбоксилата, который используют для проведения следующей реакции, не проводя дальнейших стадий очистки. 1(ушир.т, J=13,2 Гц; 2 Н); 3,4-3,6 (м, 2 Н), 3,89 (т, J=6,6 Гц, 2 Н); 4,0-4,3 (м, 2 Н); 4,69 (т, J=6,6 Гц; 2 Н); 7,27,4 (м, 2 Н); 7,75 (д, J=8,7 Гц; 1 Н); 8,16 (д, J=8,7 Гц; 1 Н). 1 е) 2-(Пиперидин-4-илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она гидрохлорид. Раствор,содержащий трет-бутил 4-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)ил)метил]пиперидин-1-карбоксилата (3,5 г, 0,009 моль), этилацетат (20 мл) и 3 М раствор хлористого водорода в этаноле (10 мл) перемешивают при комнатной температуре в течение 2 ч. Реакцию прерывают, отфильтровав образовавшиеся твердые вещества, которые промывают этилацетатом. Указанным образом получают 1,5 г гидрохлорида 2-(пиперидин-4-илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)она, который используют для проведения следующей реакции, не проводя дальнейших стадий очистки. 1 Н-ЯМР (300 МГц, DMSO-d6+D2O) : 1,38 (ушир.кв., J=9,0 Гц; 2 Н); 1,81 (ушир.д, J=12,0 Гц; 2 Н); 1,9-2,1 (м, 1 Н); 2,80 (ушир.т, J=9,0 Гц; 2 Н); 3,25 (ушир.д, J=12,0 Гц; 2 Н); 3,42 (д, J=6,0 Гц; 2 Н); 3,81 (т,J=6,0 Гц; 2 Н); 4,74 (т, J=6 Гц; 2 Н); 7,27 (т, J=9,0 Гц; 1 Н); 7,36 (т, J=9,0 Гц; 1 Н); 7,75 (д, J=9,0 Гц; 1 Н); 8,00(д, J=9,0 Гц; 1 Н). 1f) 2-(1-[2-(4-Фторфенил)этил]перидии-4-илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она гидрохлорид. Раствор, содержащий гидрохлорид 2-(пиперидин-4-илметил)-3,4-дигидропиразино[1,2-b]индазол 1(2 Н)-она (528 мг, 1,64 ммоль), карбонат калия (610 мг, 4,4 ммоль), 4-фторфенэтилбромид (450 мг, 2,2 ммоль) в этаноле (10 мл) кипятят с обратным холодильником при перемешивании в течение 24 ч. Реакцию прерывают, охлаждая смесь до комнатной температуры, и концентрируют, удаляя растворитель при пониженном давлении. Остаток растворяют в DCM (30 мл) и последовательно промывают насыщенным раствором NaHCO3 (220 мл), водой (215 мл) и насыщенным раствором NaCl (10 мл). Затем органическую фазу сушат над Na2SO4 и растворитель удаляют упариванием при пониженном давлении. Твердый сырой продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 9:1. Очищенный продукт растворяют в смеси диэтиловый эфир:этанол в соотношении 10:1 (10 мл) и при комнатной температуре обрабатывают 3 М раствором хлористого водорода в этаноле (0,33 мл). Полученное твердое вещество отфильтровывают и кристаллизуют из смеси изопропанол:диизопропиловый эфир в соотношении 3:7. Указанным образом получают 250 мг гидрохлорида 2-(1-[2-(4-фторфенил)этил]перидии-4-илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)она. 1 Н-ЯМР (300 МГц, DMSO-d6) : 1,49-1,78 (м, 2 Н); 1,81-2,10 (м, 3H); 2,76-2,99 (м, 2 Н); 3,00-3,12 (м,2 Н); 3,17-3,40 (м, 2 Н); 3,47 (д, J=6, 61 Гц; 2 Н); 3,51-3,67 (м, 2 Н); 3,93 (т, J=6,11 Гц; 2 Н); 4,75 (т, J=6,11 Гц; 2 Н); 7,11-7,42 (м, 6 Н); 7,76 (дт, J=8,59 Гц; J=0,99 Гц; 1 Н); 8,01 (дт, J=8,26 Гц; J=1,16 Гц; 1 Н), 10,51(ушир.с, 1 Н). Пример 2. 2-(1-[2-(4-Фторфенил)этил]пиперидин-3-илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-он. 2 а) трет-Бутил-2-бромэтилкарбамат. Триэтиламин (2,02 г, 0,020 моль) по каплям при перемешивании добавляют к раствору 2 бромэтанамина (2,04 г, 0,010 моль) и трет-бутоксикарбонильного ангидрида (1,74 г, 0,010 моль) в дихлорметане (50 мл), поддерживая температуру на уровне 0C. Реакционную смесь перемешивают при 0C в течение 15 мин, а затем в течение 8 ч при комнатной температуре. Смесь промывают водой (250 мл) и органическую фазу сушат над Na2SO4. После удаления растворителя испарением при пониженном давлении, остаток очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат в соотношении 8:2. Указанным образом получают 1,79 г трет-бутил-2 бромэтилкарбамата. Указанное твердое вещество используют для проведения следующей реакции, не проводя дальнейших стадий очистки. 1H-ЯМР (200 МГц, CDCl3) : 1,41 (с, 9 Н); 3,24-3,59 (м, 4 Н); 4,95 (ушир.с, 1 Н). 2b) Метил 2-[2-(трет-бутоксикарбониламино)этил]-2 Н-индазол-3-карбоксилат. Карбонат цезия (19,5 г, 0,06 моль) добавляют при перемешивании к раствору метил 1 Н-индазол-3 карбоксилата (3,5 г, 0,02 моль) и трет-бутил-2-бромэтилкарбамата (8,9 г, 0,04 моль) в ДМФА (30 мл) при комнатной температуре. Смесь энергично перемешивают при комнатной температуре в течение 48 ч,добавляют воду (50 мл), а затем 1 М раствор HCl до тех пор, пока величина рН не достигнет значения 6. Водную фазу экстрагируют этилацетатом (350 мл), органические фазы объединяют, промывают насыщенным раствором NaCl (10 мл), а затем сушат над Na2SO4. После удаления растворителя упариванием при пониженном давлении остаток очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат в соотношении 6:4. Указанным образом получают 2,87 г метил 2-[2-(трет-бутоксикарбониламино)этил]-2 Н-индазол-3-карбоксилата, который используют для проведения следующей реакции, не проводя дальнейших стадий очистки. 1H-ЯМР (200 МГц, CDCl3) : 1,36 (с, 9 Н); 3,74 (кв., 2 Н, J=5,5 Гц); 4,03 (с, 3H); 4,89-5,07 (ушир.с,1 Н); 5,03 (т, 2 Н, J=5,5 Гц); 7,23-7,42 (м, 2 Н); 7,79 (дт, 1 Н, J=7,5 Гц; J=1,6 Гц); 8,02 (дт, 1 Н, J=7,5 Гц; J=1,6 Гц). 2 с) 3,4-Дигидропиразино[1,2-b]индазол-1(2 Н)-он. 1,25 М раствор HCl в этаноле (48 мл, 0,06 моль) при перемешивании при комнатной температуре медленно добавляют к раствору метил 2-[2-(трет-бутоксикарбониламино)этил]-2 Н-индазол-3 карбоксилата (6,38 г, 0,02 моль) в этилацетате (50 мл). Полученную смесь перемешивают при комнатной температуре в течение 2 ч. Растворитель упаривают при пониженном давлении, остаток обрабатывают этилацетатом (20 мл) при комнатной температуре и отфильтровывают. Полученное твердое вещество растворяют в метаноле (10 мл) и к полученному раствору добавляют карбонат цезия (13,0 г, 0,04 моль) при перемешивании и при комнатной температуре. Смесь оставляют перемешиваться на 16 ч при комнатной температуре, затем растворитель упаривают при пониженном давлении. Остаток переносят в воду (50 мл) и водную фазу несколько раз экстрагируют этилацетатом (550 мл). Органические фазы объединяют, сушат над Na2SO4 и после упаривания растворителя при пониженном давлении получают 4 г сырого продукта. Сырой продукт затем очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат в соотношении 8:2. Указанным образом получают 3,4 г 3,4 дигидропиразино[1,2-b]индазол-1(2 Н)-она. 1H-ЯМР (200 МГц, CDCl3) : 3,93 (дт, 2 Н, J=6,7 Гц; J=1,7 Гц); 4,72 (т, 2 Н, J=6,7 Гц); 6,35 (ушир.с,1 Н); 7,27-7,46 (м, 2 Н); 7,78 (дт, 1 Н, J=8,4 Гц; J=1,4 Гц); 8,16 (дт, 1 Н, J=8,4 Гц; J=1,4 Гц). 2d) трет-Бутил 3-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)-ил)метил]пиперидин-1 карбоксилат. Указанный продукт получают по способу, описанному в примере 1d), однако в качестве реагента используют трет-бутил 3-[(метилсульфонил)окси]метилпиперидин-1-карбоксилат. Указанным образом получают 3,8 г трет-бутил 3-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)-ил)метил]пиперидин-1 карбоксилата. 1 2 е) 2-(1-[2-(4-Фторфенил)этил]пиперидин-3-илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)он. 1,25 М раствор HCl в этаноле (4,8 мл, 0,006 моль) при перемешивании при комнатной температуре добавляют к раствору трет-бутил 3-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)ил)метил]пиперидин-1-карбоксилата (0,77 г, 0,002 моль) в этилацетате (7 мл). Полученную смесь перемешивают при комнатной температуре в течение 2 ч, затем растворитель удаляют испарением при пониженном давлении. Полученный остаток растворяют в этилацетате (5 мл) и фильтруют. Твердый продукт растворяют в смеси 1-(2-бромэтил)-4-фторбензола (0,81 г, 0,004 моль) в безводном ДМФА (10 мл). К полученному раствору при перемешивании при комнатной температуре добавляют карбонат цезия (1,95 г, 0,006 моль). Смесь энергично перемешивают при комнатной температуре в течение 48 ч, а затем добавляют воду (20 мл) и этилацетат (25 мл). Водную фазу экстрагируют несколько раз этилацетатом (320 мл), органические фазы объединяют и сушат над Na2SO4. Растворитель упаривают при пониженном давлении и остаток очищают флэш-хроматографией на силикагеле,используя в качестве элюента смесь гексан:этилацетат в соотношении 7:3. Указанным образом получают 170 мг 2-(1-[2-(4-фторфенил)этил]пиперидин-3-илметил)-3,4 дигидропиразино[1,2-b]индазол-1(2 Н)-он. 1H-ЯМР (300 МГц, DMSO-d6) : 8,00 (д, J=8,48 Гц; 1 Н), 7,75 (д, J=8,77 Гц; 1 Н); 7,31-7,41 (м, 1 Н); 7,18-7,30 (м, 3H); 6,99-7,11 (м, 2 Н); 4,70 (т, J=6,14 Гц; 2 Н), 3,88 (т, J=6,14 Гц; 2 Н), 3,32-3,56 (м, 2 Н); 2,632,86 (м, 4 Н); 2,39-2,47 (м, 2 Н); 1,79-2,11 (м, 3H); 1,67 (д, J=10,23 Гц; 2 Н); 1,35-1,53 (м, 1 Н); 1,03 (д, J=9,35 Гц; 1 Н). Пример 5. 2-(1-[2-(2-Фторфенил)этил]пиперидин-3-илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она гидрохлорид. Указанный продукт получают по способу, описанному в примере 2 е), однако в качестве реагента используют 1-(2-бромэтил)-2-фторбензол. Требуемый продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 9:1. Указанным образом получают 350 мг гидрохлорида 2-(1-[2-(2-фторфенил)этил]пиперидин-3 илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она. 1H-ЯМР (300 МГц, DMSO-d6) : 10,81 (ушир.с, 1 Н); 8,00 (дт, J=1,16; 8,26 Гц; 1 Н); 7,76 (д, J=8,59 Гц; 1 Н); 7,09-7,42 (м, 6 Н); 4,71-4,81 (м, 2 Н); 3,93 (т, J=6,28 Гц; 2 Н); 3,48-3,70 (м, 3H); 3,06-3,46 (м, 5 Н); 2,673,00 (м, 2 Н); 2,36-2,47 (м, 1 Н); 1,66-2,05 (м, 3H); 1,05-1,39 (м, 1 Н). Пример 8. 2-(1-[2-(2-Фторфенил)этил]пиперидин-4-илметил)-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-он. Указанный продукт получают по способу, описанному в примере 2 е), однако в качестве реагентов используют трет-бутил 4-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)-ил)метил]пиперидин-1 карбоксилат (получают по примеру 1d) и 1-(2-бромэтил)-2-фторбензол. Требуемый продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 95:5. Указанным образом получают 160 мг 2-(1-[2-(2-фторфенил)этил]пиперидин-4-илметил)-3,4 дигидропиразино[1,2-b]индазол-1(2 Н)-он. 1H-ЯМР (300 МГц, DMSO-d6) : 8,00 (д, J=8,18 Гц; 1 Н); 7,74 (д, J=8,48 Гц; 1 Н); 7,17-7,41 (м, 4 Н); 7,05-7,16 (м, 2 Н); 4,70 (т, J=6,30 Гц, 2 Н); 3,90 (т, J=6, 30 Гц; 2 Н); 3,41 (д, J=7,02 Гц; 2 Н); 2,91 (д, J=10,52 Гц; 2 Н); 2,76 (т, J=7,50 Гц; 2 Н), 1,86-2,06 (м, 2 Н); 1,55-1,83 (м, 3H); 1,12-1,37 (м, 2 Н). Пример 10. 2-(1-[2-(4-Фторфенил)этил]пиперидин-3-илметил)-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2b]индазол-1-она дигидрохлорид. 10 а) трет-Бутил-3-бромпропилкарбамат. Указанный продукт получают по способу, описанному в примере 2 а), используя в качестве реагента 3-бромпропан-1-амин. Продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат в соотношении 95:5. Указанным образом получают 1,77 г трет-бутил-3 бромпропилкарбамата. 1H-ЯМР (200 МГц, CDCl3) : 1,41 (с, 9 Н); 2,02 (квинтет, 2 Н, J=6,5 Гц); 3,24 (т, 2 Н, J=6,5 Гц); 3,41 (т,2 Н, J=6,5); 4,7 (ушир.с, 1 Н). 10b) Метил 2-[3-(трет-бутоксикарбониламин)пропил]-2 Н-индазол-3-карбоксилат. Указанный продукт получают по способу, описанному в примере 2b), используя в качестве реагента трет-бутил-3-бромпропилкарбамат. Продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат в соотношении 7:3. Указанным образом получают 3,13 г метил 2-[3-(трет-бутоксикарбониламин)пропил]-2 Н-индазол-3 карбоксилата. 1 8,01 (дт, 1 Н, J=7,3 Гц; J=1,3 Гц). 10 с) 2,3,4,5-Тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1-он. Указанный продукт получают по способу, описанному в примере 2 с), используя в качестве реагента метил 2-[3-(трет-бутоксикарбониламин)пропил]-2 Н-индазол-3-карбоксилат. Указанный продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь пентан:диэтиловый эфир в соотношении 95:5. Таким образом, получают 3,5 г 2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1 он. 1H-ЯМР (200 МГц, CDCl3) : 2,42 (квинтет, 2 Н, J=6,6 Гц); 3,43 (кв., 2 Н, J=6,6 Гц); 4,82 (т, 2 Н, J=6,6 Гц); 6,38 (ушир.с, 1 Н); 7,20-7,45 (м, 2 Н); 7,74 (дт, 1 Н, J=8,4 Гц; J=1,2 Гц); 8,06 (дт, 1 Н, J=8,4 Гц; J=1,4 Гц). 10d) трет-Бутил 3-[(1-оксо-4,5-дигидро-1 Н-[1,4]диазепино[1,2-b]индазол-2(3H)ил)метил]пиперидин-1-карбоксилат. Указанный продукт получают по способу, описанному в примере 1d), однако в качестве реагентов используют 2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1-он и трет-бутил 3[(метилсульфонил)окси]метилпиперидин-1-карбоксилат. Указанным образом получают 3,6 г третбутил 3-[(1-оксо-4,5-дигидро-1 Н-[1,4]диазепино[1,2-b]индазол-2(3H)-ил)метил]пиперидин-1 карбоксилата. 1H-ЯМР (200 МГц, CDCl3) : 1,15-1,40 (м, 1 Н); 1,44 (с, 3H); 1,50-2,10 (м, 4 Н); 2,45 (квинтет, 2 Н,J=6,7 Гц); 2,55-2,95 (м, 2 Н); 3,40-3,70 (м, 1 Н); 3,45 (т, 2 Н, J=6,7 Гц); 3,80-4,15 (м, 3H); 4,77 (т, 2 Н, J=6,7 Гц); 7,15-7,40 (м, 2 Н); 7,72 (дт, 1 Н, J=8,6 Гц; J=1,0 Гц); 7,94 (дт, 1 Н, J=8,3 Гц; J=1,2 Гц). 10 е) 2-(1-[2-(4-Фторфенил)этил]пиперидин-3-илметил)-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2b]индазол-1-она дигидрохлорид. Указанный продукт получают по способу, описанному в примере 2 е), используя в качестве реагента трет-бутил 3-[(1-оксо-4,5-дигидро-1 Н-[1,4]диазепино[1,2-b]индазол-2(3H)-ил)метил]пиперидин-1 карбоксилат. Полученный амин очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 9:1. Очищенный продукт растворяют в смеси диэтиловый эфир:этанол в соотношении 10:1 (10 мл) и обрабатывают при комнатной температуре 3 М раствором HCl в этаноле (0,33 мл). Образовавшееся твердое вещество отфильтровывают и кристаллизуют из смеси изопропанол:диизопропиловый эфир в соотношении 8:2. Указанным образом получают 188 мг дигидрохлорида 2-(1-[2-(4-фторфенил)этил]пиперидин-3-илметил)-2,3,4,5-тетрагидро-1 Н[1,4]диазепино[1,2-b]индазол-1-она. 1H-ЯМР (300 МГц, DMSO-d6) : 11,24 (ушир.с, 1 Н); 10,96 (ушир.с, 1 Н); 7,79-7,86 (м, 1 Н); 7,70 (д,J=8,59 Гц; 1 Н); 7,25-7,41 (м, 3H); 7,01-7,25 (м, 3H); 4,64-4,88 (м, 2 Н); 3,00-3,85 (м, 10 Н); 2,67-2,97 (м, 2 Н); 2,53-2,65 (м, 1 Н); 2,24-2,43 (м, 1 Н); 1,80-2,04 (м, 3H); 1,14-1,39 (м, 1 Н). Пример 13. 2-(1-[2-(2-Фторфенил)этил]пиперидин-3-илметил)-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2b]индазол-1-она дигидрохлорид. Указанный продукт получают по способу, описанному в примере 10 е), используя в качестве реагента 1-(2-бромэтил)-2-фторбензол. Полученный амин очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 9:1. Конечный продукт кристаллизуют из смеси изопропанол:диизопропиловый эфир в соотношении 8:2. Указанным образом получают 163 мг дигидрохлорида 2-(1-[2-(2-фторфенил)этил]пиперидин-3-илметил)-2,3,4,5-тетрагидро-1 Н[1,4]диазепино[1,2-b]индазол-1-она. 1(д, J=8,92 Гц; 1 Н); 7,25-7,45 (м, 3H); 7,11-7,24 (м, 3H); 4,59-4,91 (м, 2 Н); 3,04-3,86 (м, 10 Н); 2,68-3,04 (м,2 Н); 2,54-2,63 (м, 1 Н); 2,21-2,44 (м, 1 Н); 1,79-2,05 (м, 3H); 1,15-1,37 (м, 1 Н). Пример 16. 2-(1-[2-(4-Фторфенил)этил]пиперидин-4-илметил)-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2b]индазол-1-она гидрохлорид. 16 а) трет-Бутил 4-[(1-оксо-4,5-дигидро-1 Н-[1,4]диазепино[1,2-b]индазол-2(3H)ил)метил]пиперидин-1-карбоксилат. Указанный продукт получают по способу, описанному в примере 1d), используя в качестве реагента 2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1-он. Продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь пентан:диэтиловый эфир в соотношении 95:5. Указанным образом получают 3,40 г трет-бутил 4-[(1-оксо-4,5-дигидро-1 Н-[1,4]диазепино[1,2-b]индазол-2(3H)ил)метил]пиперидин-1-карбоксилата. 1 Н-ЯМР (200 МГц, CDCl3) : 2,41 (с, 3H); 7,26 (д, 2 Н, J=8,1 Гц); 7,45 (д, 2 Н, J=8,1 Гц); 7,57 (д, 1 Н,J=13,6 Гц); 7,99 (д, 1 Н, J=13,6 Гц). 16b) 2-(1-[2-(4-Фторфенил)этил]пиперидин-4-илметил)-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2b]индазол-1-она гидрохлорид. Указанный продукт получают по способу, описанному в примере 10 е), используя в качестве реагента трет-бутил 4-[(1-оксо-4,5-дигидро-1 Н-[1,4]диазепино[1,2-b]индазол-2(3H)-ил)метил]пиперидин-1- 12021417 карбоксилат. Полученный амин очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 95:5. Конечный продукт кристаллизуют из смеси изопропанол:диизопропиловый эфир в соотношении 4:6. Указанным образом получают 167 мг гидрохлорида 2-(1-[2-(4-фторфенил)этил]пиперидин-4-илметил)-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2b]индазол-1-она. 1 Н-ЯМР (300 МГц, DMSO-d6) : 10,63 (ущир.с, 1 Н); 7,82 (д, J=8,59 Гц; 1 Н), 7,70 (д, J=8,92 Гц; 1 Н); 7,25-7,40 (м, 3H); 7,10-7,25 (м, 3H); 4,72 (т, J=6,94 Гц; 2 Н); 3,45-3,70 (м, 4 Н); 3,43 (т, J=6,44 Гц; 2 Н); 2,753,35 (м, 7 Н); 2,37 (кв., J=6,69 Гц; 2 Н); 1,85-2,10 (м, 3H); 1,50-1,85 (м, 2 Н). Пример 17. 2-(1-[2-(4-Фторфенил)этил]пиперидин-4-илметил)-3,4,7,8,9,10-эзагидропиразино[1,2-b]индазол 1(2 Н)-она гидрохлорид. 17 а) трет-Бутил 4-[(1-оксо-3,4,7,8,9,10-эзагидропиразино[1,2-b]индазол-2(1 Н)-ил)метил]пиперидин 1-карбоксилат. Указанный продукт получают по способу, описанному в примере 1d), используя в качестве реагента 3,4,7,8,9,10-эзагидропиразино[1,2-b]индазол-1-он. Сырой продукт используют для проведения следующей реакции, не проводя дальнейших стадий очистки. 1H-ЯМР (300 МГц, DMSO-d6) : 4,17-4,28 (м, 2 Н); 3,92 (д, J=12,86 Гц; 2 Н); 3,66-3,77 (м, 2 Н); 3,263,35 (м, 2 Н); 2,59-2,72 (м, 4 Н); 2,55 (т, J=5,85 Гц, 2 Н); 1,77-1,93 (м, 1 Н); 1,53-1,76 (м, 6 Н); 1,39 (с, 9 Н); 1,02 (дд, 2 Н). 17b) 2-(1-[2-(4-Фторфенил)этил]пиперидин-4-илметил)-3,4,7,8,9,10-эзагидропиразино[1,2b]индазол-1(2 Н)-она гидрохлорид. Указанный продукт получают по способу, описанному в примере 2 е), используя в качестве реагента трет-бутил 4-[(1-оксо-3,4,7,8,9,10-эзагидропиразино[1,2-b]индазол-2(1 Н)-ил)метил]пиперидин-1 карбоксилат. Продукт очищают кристаллизацией из смеси изопропанол:диизопропиловый эфир. Указанным образом получают 0,2 г гидрохлорида 2-(1-[2-(4-фторфенил)этил]пиперидин-4 илметил)-3,4,7,8,9,10-эзагидропиразино[1,2-b]индазол-1(2 Н)-она. 1H-ЯМР (300 МГц, DMSO-d6) : 10,47 (ушир.с, 1 Н); 7,26-7,40 (м, 2 Н); 7,10-7,23 (м, 2 Н); 4,19-4,32 (м,2 Н); 3,73 (т, J=5, 95 Гц, 2 Н); 3,46-3,59 (м, 2 Н); 3,35 (д, J=6,61 Гц; 2 Н); 3,12-3,27 (м, 2 Н); 2,98-3,11 (м, 2 Н); 2,11-2,96 (м, 2 Н); 2,65 (т, J=5,78 Гц; 2 Н); 2,56 (т, J=5,78 Гц; 2 Н); 1,44-2,05 (м, 9 Н). Пример 20. 2-[(1-Фенэтилпиперидин-4-ил)метил]-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она гидрохлорид. Указанный продукт получают по способу, описанному в примере 10 е), используя в качестве реагентов трет-бутил 4-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)-ил)метил]пиперидин-1-карбоксилат(пример 1d) и фенэтилбромид. Полученный амин очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 85:15. Конечный продукт кристаллизуют из смеси изопропанол:диизопропиловый эфир в соотношении 3:7. Указанным образом получают 121 мг гидрохлорида 2-[(1-фенэтилпиперидин-4-ил)метил]-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)она. 1H-ЯМР (300 МГц, DMSO-d6) : 10,84 (ушир.с, 1 Н); 8,01 (д, J=8,26 Гц; 1 Н); 7,76 (д, J=8,59 Гц; 1 Н); 7,13-7,44 (м, 7 Н); 4,75 (т, J=6,11 Гц; 2 Н); 3,94 (т, J=6,11 Гц; 2 Н), 3,51-3,67 (м, 2 Н); 3,47 (д, J=6,94 Гц; 2 Н); 3,01-3,39 (м, 6 Н); 2,78-3,02 (м, 2 Н); 1,81-2,28 (м, 3H); 1,53-1,79 (м, 2 Н). Пример 22. 2-[(1-Фенэтилпиперидин-4-ил)метил]-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1-он. Указанный продукт получают по способу, описанному в примере 2 е), используя в качестве реагентов трет-бутил 4-[(1-оксо-4,5-дигидро-1 Н-[1,4]диазепино[1,2-b]индазол-2(3H)-ил)метил]пиперидин-1 карбоксилат (пример 16 а) и фенэтилбромид. Продукт очищают флэш-хроматографией на силикагеле,используя в качестве элюента смесь хлороформ:метанол в соотношении 95:5. Указанным образом получают 223 мг 2-[(1-фенэтилпиперидин-4-ил)метил]-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1 она. 1H-ЯМР (300 МГц, DMSO-d6) : 7,82 (д, J=8,18 Гц; 1 Н); 7,69 (д, J=8,48 Гц; 1 Н); 7,07-7,40 (м, 7 Н); 4,68 (т, J=7,02 Гц; 2 Н); 3,34-3,55 (м, 4 Н); 2,94 (д, J=11,40 Гц; 2 Н); 2,65-2,79 (м, 2 Н); 2,33 (квинтет, J=6,65 Гц; 2 Н); 1,97 (т, J=10,82 Гц; 2 Н); 1,59-1,83 (м, 3H); 1,15-1,37 (м, 2 Н). Пример 25. 2-[1-(Фенилацетил)пиперидин-4-ил]метил-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-он. Указанный продукт получают по способу, описанному в примере 2 е), используя в качестве реагентов трет-бутил 4-[(1-оксо-3,4-дигидропиразино[1,2-b]индазол-2(1 Н)-ил)метил]пиперидин-1-карбоксилат(пример 1d) и бензолацетилхлорид. Продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 9:1. Указанным образом получают 104 мг 2[1-(фенилацетил)пиперидин-4-ил]метил-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она. 1J=13,7 Гц; J=7,5 Гц); 3,73 (с, 2 Н); 3,75-4,05 (м, 2 Н); 3,84 (т, 2 Н, J=6,3 Гц); 3,86 (д, 2 Н, J=6,3 Гц); 4,67 (т,2 Н, J=6,3 Гц); 7,10-7,45 (м, 7 Н); 7,76 (дт, 1 Н, J=8,3 Гц; J=1,1 Гц); 8,14 (дт, 1 Н, J=8,2 Гц; J=1,1 Гц). Пример 26. 2-[1-(Фенилацетил)пиперидин-4-ил]метил-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1 он. Указанный продукт получают по способу, описанному в примере 2 е), используя в качестве реагентов трет-бутил 4-[(1-оксо-4,5-дигидро-1 Н-[1,4]диазепино[1,2-b]индазол-2(3H)-ил)метил]пиперидин-1 карбоксилат (пример 16 а) и бензолацетилхлорид. Продукт очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 9:1. Указанным образом получают 141 мг 2-[1-(фенилацетил)пиперидин-4-ил]метил-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2b]индазол-1-она. 1(тд, 1 Н, J=12,5 Гц; J=2,2 Гц); 2,98 (тд, 1 Н, J=12,5 Гц; J=2,2 Гц); 3,25-3,45 (м, 4 Н); 3,50-3,70 (м, 1 Н); 3,75 (с,2 Н); 3,89 (ушир.д, 2 Н, J=14,2 Гц); 4,50-4,80 (м, 2 Н); 4,67 (т, 2 Н, J=7,1 Гц); 7,10-7,45 (м, 7 Н); 7,72 (дт, 1 Н,J=8,6 Гц; J=1,1 Гц); 7,93 (дт, 1 Н, J=8,2 Гц; J=1,1 Гц). Пример 28. 2-[3-(4-Фенилпиперидин-1-ил)пропил]-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она гидрохлорид. 28 а) 1-(3-Хлорпропил)-4-фенилпиперидин. Твердый карбонат цезия (195 г, 0,6 ммоль) при перемешивании при комнатной температуре добавляют к раствору 4-фенилпиперидина (32 г, 0,2 моль) и 1-бром-3-хлорпропана (40 мл, 0,4 ммоль) в безводном ДМФА (300 мл). Смесь перемешивают при той же температуре в течение 12 ч. Чтобы остановить реакцию, добавляют воду (1000 мл) и этилацетат (500 мл). После разделения фаз водную фазу несколько раз экстрагируют этилацетатом (3500 мл). Органические фазы объединяют, последовательно промывают водой (100 мл) и насыщенным раствором NaCl (100 мл), а затем сушат над безводным Na2SO4. Растворитель упаривают при пониженном давлении, а остаток очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексан:этилацетат в соотношении 1:1. Указанным образом получают 29,5 г 1-(3-хлорпропил)-4-фенилпиперидина в виде бесцветного масла. 1H-ЯМР (200 МГц, CDCl3) : 1,75-1,90 (м, 2 Н); 1,90-2,15 (м, 6 Н); 2,35-2,65 (м, 3H); 3,02 (ушир.д, 2 Н,J=6,4 Гц); 3,64 (т, 2 Н, J=6,4 Гц); 7,05-7,45 (м, 5 Н). 28b) 2-[3-(4-Фенилпиперидин-1-ил)пропил]-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она гидрохлорид. Раствор 3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она (375 мг, 2,0 ммоль) в смеси тетрагидрофуран:диметилформамид (ДМФА) в соотношении 1:1 (4 мл) при комнатной температуре в атмосфере аргона добавляют по каплям к суспензии 55%-ного NaH в минеральном масле (104 мг, 2,4 ммоль) в безводном тетрагидрофуране (ТГФ). Смесь продолжают перемешивать при той же температуре в инертной атмосфере в течение 1 ч; затем медленно добавляют раствор 1-(3-хлорпропил)-4-фенилпиперидина (4,4 г,0,015 моль) в ДМФА (25 мл). По окончании добавления смесь кипятят с обратным холодильником в течение 6 ч. Реакцию прерывают, охладив смесь до комнатной температуры и добавив этилацетат (10 мл). После этого смесь фильтруют через слой силикагеля, после чего растворитель удаляют испарением при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол в соотношении 9:1. Очищенный продукт растворяют в смеси диэтиловый эфир:этанол в соотношении 10:1 (10 мл) и обрабатывают при комнатной температуре 3 М раствором HCl в этаноле (0,33 мл). Образовавшееся твердое вещество отфильтровывают и кристаллизуют из смеси изопропанол:диизопропиловый эфир в соотношении 1:1. Указанным образом получают 197 мг гидрохлорида 2-[3-(4-фенилпиперидин-1-ил)пропил]-3,4-дигидропиразино[1,2-b]индазол-1(2 Н)-она. 1H-ЯМР (300 МГц, DMSO-d6) : 10,88 (ушир.с, 1 Н); 8,02 (дт, J=1,16 Гц; J=8,26 Гц; 1 Н); 7,77 (дт,J=0,93 Гц; J=8,55 Гц; 1 Н); 7,18-7,42 (м, 7 Н); 4,74-4,81 (м, 2 Н); 3,89-4,03 (м, 2 Н); 3,65 (т, J=6,44 Гц; 2 Н); 3,57 (д, J=11,72 Гц; 2 Н); 2,92-3,18 (м, 4 Н); 2,70-2,87 (м, 1 Н); 2,01-2,26 (м, 4 Н); 1,94 (д, J=12,55 Гц; 2 Н). Пример 31. 2-[3-(4-Фенилпиперидин-1-ил)пропил]-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1-она гидрохлорид. Указанный продукт получают по способу, описанному в примере 28b), используя в качестве реагента 2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1-он (пример 10 с). Полученный амин очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:этанол в соотношении 85:15. Конечный продукт очищают кристаллизацией из смеси изопропанол:диизопропиловый эфир в соотношении 1:1. Указанным образом получают 317 мг гидрохлорида 2-[3-(4-фенилпиперидин-1 ил)пропил]-2,3,4,5-тетрагидро-1 Н-[1,4]диазепино[1,2-b]индазол-1-она. 1 Н-ЯМР (300 МГц, DMSO-d6) : 10,94 (ушир.с, 1 Н); 7,84 (дт, J=1,11 Гц; J=8,34 Гц; 1 Н); 7,71 (дт,J=0,97 Гц; J=8,63 Гц; 1 Н); 7,29-7,40 (м, 3H); 7,16-7,29 (м, 4 Н); 4,73 (т, J=7,02 Гц; 2 Н); 3,55-3,73 (м, 5 Н); 3,44 (т, J=6,36 Гц; 2 Н); 2,97-3,21 (м, 4 Н); 2,83 (тт, J=3,63 Гц; J=12,14 Гц; 1 Н); 2,42 (квинтет, J=6,65 Гц; 2 Н); 2,04-2,26 (м, 4 Н); 1,96 (д, J=13,87 Гц; 2 Н). Фармакология. Фармакологические свойства соединений формулы (I) по настоящему изобретению оценивают по методикам, описанным в приведенных ниже разделах, посвященных тестам А, В и С. Тест A (in vitro). Аффинность соединений формулы (I) по настоящему изобретению к рекомбинантному рецептору серотонина 5-HT2A человека демонстрируют, используя стандартную методику, приведенную Bonhausproducts: comparison with 5-HT2A and 5-HT2C receptors", Br. J. Pharmacol. 115: 622-628. В частности, связывание с рецептором серотонина 5-HT2A человека проводят, используя в качестве стандартного вещества мембранный препарат из устойчивой рекомбинантной клеточной линии CHO-K1,экспрессирующей рецептор 5-HT2A человека. Исследования по замещению проводят, используя в качестве радиолиганда [3 Н]-кетансерин с концентрацией 0,5 нМ. Указанную концентрацию выбирают на основании исследований по насыщению,которые позволяют получить величину Bmax, равную 0,51 пмоль/мг белка, и величину Kd, равную 0,2 нМ. Неспецифическое связывание измеряют в присутствии 1 мкМ миансерина. Анализ проводят в буферном растворе 50 мМ Tris-HCl (рН 7,4 при 37C) с инкубацией в течение 1 ч при 25C. Тестируемые соединения растворяют в ДМСО, затем разбавляют буферным раствором (конечная концентрация ДМСО 0,01%) и наносят на 96-луночные планшеты. Соединения тестируют, проводя две серии экспериментов с построением кривой зависимости от концентрации по 8 точкам (в логарифмической шкале в пределах от 10-12 до 10-5 М). В качестве соединения сравнения используют кетансерин. После инкубирования мембраны отфильтровывают на стекловолоконных фильтрах (GF/B)(Unifilter, Packard), обработанных 0,5%-ным полиэтиленимином. Затем фильтры промывают буферным раствором и сушат в сушильном шкафу в течение 30 мин при 45C. В каждую лунку добавляют жидкость для сцинтилляции и по крайней мере по истечении 16 ч радиоактивность измеряют в течение 1 мин с помощью TopCount (Packard). Значения IC50 для каждого соединения рассчитывают, используя нелинейный регрессионный анализ(Ki) and the concentration of inhibitor which causes 50 percent inhibition (150) of an enzyme reaction". Biochem. Pharmacol. 22: 3099-3108. Величины аффинности отдельных соединений формулы (I) по настоящему изобретению для рецептора 5-HT2A приведены в табл. 2, где аффинность выше для больших значений pKi. Таблица 2 Тест В (in vitro). Аффинность соединений формулы (I) по настоящему изобретению к рецептору серотонина 5-НТ 2 С демонстрируют, используя стандартную методику, приведенную Wolf W.A. и Schutz J.S. (1997) в документе "The serotonin 5-HT2C receptor is а prominent serotonin receptor in basal ganglia: evidence from functional studies on serotonin-mediated phosphoinositide hydrolysis". J. Neurochem. 69: 1449-1458. В частности, связывание с рецептором серотонина 5-HT2C человека проводят, используя в качестве стандартного вещества мембранный препарат из устойчивой рекомбинантной клеточной линии СНО-K1,экспрессирующей рецептор 5-НТ 2 С человека. Исследования по замещению проводят, используя в качестве радиолиганда [3 Н]-месулергин с кон- 15021417 центрацией 1 нМ. Указанную концентрацию выбирают на основании исследований по насыщению, которые позволяют получить величину Bmax, равную 4,9 пмоль/мг белка, и величину Kd, равную 1,1 нМ. Неспецифическое связывание измеряют в присутствии 1 мкМ миансерина. Анализ проводят в буферном растворе 50 мМ Tris-HCl (рН 7,4 при 37C), содержащем 0,1% аскорбиновой кислоты, 10 мкМ паргилина с инкубацией в течение 1 ч при 25C. Тестируемые соединения растворяют в ДМСО, затем разбавляют буферным раствором (конечная концентрация ДМСО 0,01%) и наносят на 96-луночные планшеты. Соединения тестируют, проводя две серии экспериментов с построением кривой зависимости от концентрации по 8 точкам (в логарифмической шкале в пределах от 10-12 до 10-5 М). В качестве соединения сравнения используют SB 242084. SB 242084 представляет собой селективный антагонист рецептора серотонина 5-HT2C, который изготавливает и продает компания Sigma-Aldrich, и имеет следующую структурную формулу: После инкубирования мембраны отфильтровывают на стекловолоконных фильтрах (GF/B)(Unifilter, Packard), обработанных 0,5%-ным полиэтиленимином. Затем фильтры промывают буферным раствором и сушат в сушильном шкафу в течение 30 мин при 45C. В каждую лунку добавляют жидкость для сцинтилляции и, по крайней мере, по истечении 16 ч радиоактивность измеряют в течение 1 мин с помощью TopCount (Packard). Значения IC50 для каждого соединения рассчитывают, используя нелинейный регрессионный анализ(Ki) and the concentration of inhibitor which causes 50 percent inhibition (150) of an enzyme reaction." Biochem. Pharmacol. 22: 3099-3108. Величины аффинности отдельных соединений формулы (I) по настоящему изобретению для рецепторов 5-HT2C рекомбинантных клеток человека приведены в табл. 3, где аффинность выше для больших значений pKi. Таблица 3 Сравнение между величинами для аффинности, приведенными выше в табл. 2 и 3, показывает, что соединения по настоящему изобретению имеют большую избирательную активность к рецепторам 5 НТ 2 а, по сравнению с рецепторами 5-HT2C. Тест С (in vivo). Взаимодействия соединений формулы (I) по настоящему изобретению с серотонинергической системой исследуют в соответствии с моделью "судорожного движения головой" у мышей, согласно стандартной методике, описанной Sztanke K., Fidecka S., Kedzierska E., Karczmarzyk Z., Pihlaja K., Matosiuk D."Судорожные движения головой" представляют собой характерные покачивания головой, которые у животных вызывает повышение концентрации серотонина в центральной нервной системе. Для проведения теста на "судорожное движение головой" берут самцов мышей CD-1 массой 25-30 г. Молекулы суспендируют в 0,5%-ном водном растворе метилцеллюлозы (МТС), и тестируемые соединения вводят животным внутрибрюшинно с дозой 5 мг/кг (10 мл/кг массы тела). Контрольные животные тем же путем получают лишь носитель (МТС). Судорожные движения головой, которые рассматривают как специфическую модель поведения для активации серотонинергических нейронов, индуцируют внутрибрюшинным введением 5-гидрокситриптофана (5-НТР), предшественника серотонина (5-НТ), растворенного в 0,5%-ном растворе МТС, который вводят в количестве 300 мг/кг через 30 мин после введения лекарственного средства. Количество судорожных движений головой, которое является параметром для оценки серотонинергического ответа, определяют по истечении от 24 до 26 мин после введения 5-НТР. Величины ингибирования, полученные при исследовании "судорожного движения головой" с использованием тестируемых соединений, представлены на чертеже и в приведенной ниже табл. 4. Таблица 4 В частности, как показано на чертеже, соединения по настоящему изобретению приводят к снижению количества судорожных движений головой в диапазоне от 32 до 70%, по сравнению с группой, получавшей носитель, демонстрируя тем самым, способность антагонизировать серотонинергические эффекты, вызванные введением 5-НТР. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Трициклическое индазольное соединение общей формулы (I) где Y обозначает СН или N;W обозначает СН или N; при условии, что по крайней мере один из Y и W является атомом азота; Х 1 и Х 3 могут независимо обозначать -связь, двухвалентную алкильную цепь, содержащую от 1 до 5 атомов углерода, карбонильную группу, двухвалентную алканоильную цепь типа -CO-(СН 2)1-4- или-(СН 2)1-4-СО-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими C1-3 алкильными группами, одной или несколькими C1-3 алкоксигруппами; Х 4 может быть двухвалентной алкильной цепью, содержащей от 1 до 5 атомов углерода, двухвалентной алканоильной цепью типа -CO-(CH2)1-4- или -(СН 2)1-4-СО-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими C1-3 алкильными группами, одной или несколькимиC1-3 алкоксигруппами; Х 2 и Х 5 могут независимо обозначать -связь или двухвалентную алкильную цепь, содержащую от 1 до 4 атомов углерода, где атомы водорода указанной алкильной цепи необязательно могут быть замещены одним или несколькими атомами галогена, одной или несколькими C1-3 алкильными группами, одной или несколькими C1-3 алкоксигруппами и по крайней мере один из Х 2 и Х 5 отличен от -связи;L1 и L2 могут независимо обозначать -связь или -связь;R1 может независимо обозначать Н, ОН, атом галогена, CN, C1-3 алкил, C1-3 алкокси, NRiRii, CF3,CONRiiiRiv;R2 может независимо обозначать Н, ОН, атом галогена, CN, C1-3 алкил, C1-3 алкокси,C1-3 гидроксиалкил, C1-3 аминоалкил, NRiRii, CF3, CONRiiiRiv;m и n могут независимо принимать значения от 1 до 3;Ri, Rii, Riii, Riv независимо могут обозначать Н или C1-3 алкил; и его аддитивные соли с фармацевтически приемлемыми органическими и неорганическими кислотами. 2. Соединение по п.1, отличающееся тем, что X1 может обозначать карбонильную группу, двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -СО-(СН 2)1-3- или -(СН 2)1-3-СО-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими C1-3 алкильными группами. 3. Соединение по п.1 или 2, отличающееся тем, что Х 3 может обозначать -связь, двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -СО(СН 2)1-2-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими C1-3 алкильными группами. 4. Соединение по любому из предшествующих пунктов, отличающееся тем, что Х 4 может обозначать двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, двухвалентную алканоильную цепь типа -СО-(СН 2)1-2- или -(СН 2)1-2-CO-, где атомы водорода указанной алкильной или алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими C1-3 алкильными группами. 5. Соединение по любому из предшествующих пунктов, отличающееся тем, что Х 2 и Х 5 могут обозначать двухвалентную алкильную цепь, содержащую от 1 до 3 атомов углерода, где атомы водорода указанной алкильной цепи и алканоильной цепи необязательно могут быть замещены одним или несколькими атомами галогена или одной или несколькими С 1-3 алкильными группами. 6. Соединение по любому из предшествующих пунктов, отличающееся тем, что L1 и L2 могут оба обозначать -связь или могут оба обозначать -связь. 7. Соединение по любому из предшествующих пунктов, отличающееся тем, что R1 может независимо обозначать Н, ОН, F, Cl, CN, C1-3 алкильную группу, C1-3 алкоксигруппу, группу NRiRii, CF3 и группуCONRiiiRiv. 8. Соединение по любому из предшествующих пунктов, отличающееся тем, что R2 может независимо обозначать Н, ОН, F, Cl, CN, C1-3 алкил, C1-3 алкокси, C1-3 гидроксиалкил, C1-3 аминоалкил, NRiRii, CF3 и CONRiiiRiv. 9. Соединение по любому из предшествующих пунктов, отличающееся тем, что фармацевтически приемлемая органическая или неорганическая кислота выбрана из группы, которая включает щавелевую,малеиновую, метансульфоновую, паратолуолсульфоновую, янтарную, лимонную, винную, молочную,хлористо-водородную, фосфорную и серную кислоты. 10. Способ получения трициклического индазольного соединения формулы (I), определенного в любом из предшествующих пп.1-9, отличающийся тем, что он включает (1b) конденсацию амидного производного формулы (IV) где R1, L1, L2, X4 и m имеют значения, определенные в любом из предшествующих пп.1-8,с производным формулы (V) где R2, X1, Х 2, Х 3, Х 5, W, Y и n имеют значения, определенные в любом из предшествующих пп.1-8,иQ обозначает уходящую группу, которая выбрана из группы, включающей атом галогена, мезилатную группу (CH3SO3-) и тозилатную группу (p-MePhSO3-),с образованием трициклического индазольного соединения общей формулы (I). 11. Способ получения трициклического индазольного соединения формулы (I), определенного в любом из предшествующих пп.1-9, отличающийся тем, что он включает (1 а) конденсацию амина формулы (II) где X1, Х 2, Х 4, Х 5, Y, L1, L2, R1 и m имеют значения, определенные в любом из предшествующих пп.1-8,с производным формулы (III) где Х 3, R2 и n имеют значения, определенные в любом из предшествующих пп.1-8;Q обозначает уходящую группу, которая выбрана из группы, включающей атом галогена, мезилатную группу (CH3SO3-) и тозилатную группу (p-MePhSO3-),с образованием трициклического индазольного производного общей формулы (I). 12. Промежуточное соединение формулы (II) где X1, X2, X4, X5, Y, L1, L2, R1 и m имеют значения, определенные в любом из предшествующих пп.1-8. 13. Промежуточное соединение формулы (IV) где R1, X4 и m имеют значения, определенные в любом из предшествующих пп.1-8;L1 и L2 обозначают -связь,при условии, что когда R1 обозначает Н, то Х 4 отличен от СН 2 СН 2. 14. Фармацевтическая композиция для лечения патологического состояния, выбранного из группы,включающей расстройства центральной нервной системы, расстройства функций гладких мышц либо желудочно-кишечной системы, либо сердечно-сосудистой системы, и глазные патологии, содержащая эффективное количество по меньшей мере одного трициклического индазольного соединения формулы где Y, W, X1, X2, X3, X4, X5, L1, L2, R1, R2, m и n имеют значения, определенные в любом из предшествующих пп.1-8,или его соли с фармацевтически приемлемей органической или неорганической кислотой и по крайней мере один фармацевтически приемлемый эксципиент. 15. Применение трициклического индазольного соединения формулы (I) где Y, W, X1, Х 2, Х 3, Х 4, Х 5, L1, L2, R1, R2, m и n имеют значения, определенные в любом из предшествующих пп.1-8,или его соли с фармацевтически приемлемой органической или неорганической кислотой для приготовления лекарственного средства для лечения патологического состояния, выбранного из группы,которая включает расстройства центральной нервной системы, такие как нарушения сна, шизофрения и тревога, расстройства функций гладких мышц либо желудочно-кишечной системы, такие как синдром раздраженного кишечника (IBS), хронический запор, диарея и функциональная диспепсия, либо сердечно-сосудистой системы, такие как гипертензия, ишемия миокарда, церебральная ишемия, мигрень, тромбоз и агрегация тромбоцитов, и глазные патологии, такие как глаукома.
МПК / Метки
МПК: A61K 31/5517, A61P 7/02, A61P 1/00, C07D 487/04, A61P 9/12, A61P 25/06, A61K 31/4985, A61P 25/22, A61P 25/18
Метки: содержащая, композиция, способ, индазольное, соединение, получения, трициклическое, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/21-21417-triciklicheskoe-indazolnoe-soedinenie-sposob-ego-polucheniya-i-soderzhashhaya-ego-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклическое индазольное соединение, способ его получения и содержащая его фармацевтическая композиция</a>
Предыдущий патент: Вибрационная машина для изготовления прессованных изделий путем уплотнения
Следующий патент: Гетероарил-циклогексил-тетраазабензо[e]азулены в качестве антагонистов рецептора вазопрессина v1a
Случайный патент: Способ локации радиоузла и средства локации радиоузла