Соединение 3-аминокарбазола, фармацевтическая композиция, его содержащая, и способ их получения
Номер патента: 19068
Опубликовано: 30.12.2013
Авторы: Колетта Изабелла, Ализи Мария Алессандра, Фурлотти Гвидо, Мангано Джорджина, Мауджери Катерина, Гульельмотти Анджело, Каццолла Никола, Драгоне Патриция, Гарофало Барбара
Формула / Реферат
1. Соединение 3-аминокарбазола, отличающееся тем, что имеет общую формулу (I), приведенную ниже
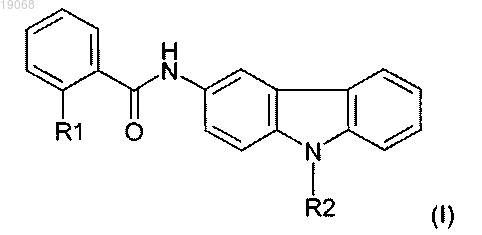
в которой R1 представляет собой атом галогена, метильную группу или тригалогенметильную группу, нитрогруппу или цианогруппу;
R2 представляет собой линейную или разветвленную гидроксиалкильную группу, содержащую от 1 до 8 атомов углерода, или линейную или разветвленную карбонилалкильную группу, содержащую от 1 до 8 атомов углерода,
его фармацевтически приемлемая соль или его сложный эфир.
2. Соединение 3-аминокарбазола по п.1, отличающееся тем, что R1 представляет собой атом фтора или хлора либо трифторметильную или трихлорметильную группу, a R2 представляет собой линейную или разветвленную гидроксиалкильную группу, содержащую от 1 до 6 атомов углерода, или линейную или разветвленную карбонилалкильную группу, содержащую от 1 до 4 атомов углерода.
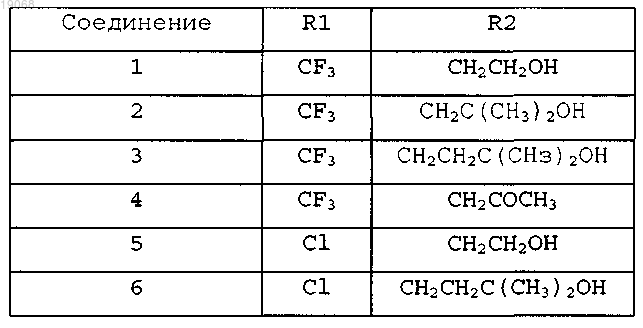
3. Соединение 3-аминокарбазола по п.1, отличающееся тем, что определение для R1 и R2 дано в таблице
4. Фармацевтическая композиция для лечения или предотвращения воспалительных процессов, боли, жара, новообразований, болезни Альцгеймера и атеросклероза, отличающаяся тем, что содержит терапевтически эффективное количество соединения 3-аминокарбазола по любому из пп.1-3, его фармацевтически приемлемой соли или его сложного эфира, вместе по крайней мере с одним фармацевтически приемлемым инертным носителем.
5. Способ получения соединения 3-аминокарбазола по любому из пп.1-3, отличающийся тем, что он включает в себя нижеследующие стадии:
а) реакцию амина формулы (II)
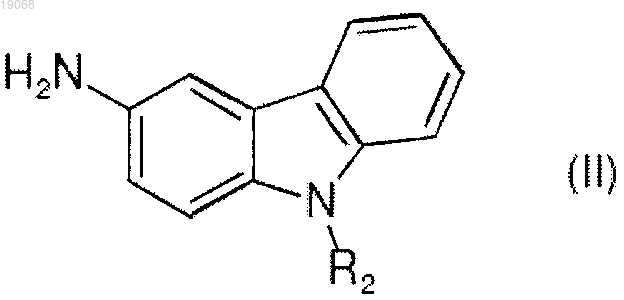
в которой R2 определен в любом из пп.1-3,
с соединением формулы (III)
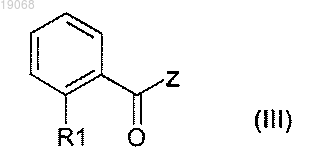
в которой R1 определен в любом из пп.1-3;
Z выбирают из группы, содержащей Cl, Br, ОН, OR и OC(O)R,
где R представляет собой линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода,
чтобы получить соединение 3-аминокарбазола формулы (I)

где R1 и R2 определены ранее, и
b) необязательное образование фармацевтически приемлемой соли соединения формулы (I), полученного выше.
6. Применение соединения 3-аминокарбазола по любому из пп.1-3, его фармацевтически приемлемой соли или его сложного эфира для получения лекарственного средства для профилактического или терапевтического лечения расстройств, выбираемых из группы, содержащей воспалительные процессы, боль, жар, новообразования, болезнь Альцгеймера и атеросклероз.
7. Применение соединения 3-аминокарбазола по п.6, отличающееся тем, что указанные воспалительные процессы выбирают из группы, содержащей отек, эритему, суставной воспалительный процесс, ревматоидный артрит и артроз.
8. Применение соединения 3-аминокарбазола по п.6, отличающееся тем, что указанные новообразования выбирают из группы, содержащей колоректальную и легочную карциному и аденокарциному.
9. Способ лечения или предотвращения воспалительных процессов, боли, жара, новообразований, болезни Альцгеймера и атеросклероза у млекопитающих, включающий введение терапевтически эффективного количества соединения 3-аминокарбазола по любому из пп.1-3, его фармацевтически приемлемой соли или его сложного эфира больному, нуждающемуся в этом.
Текст
Настоящее изобретение относится к новым бензоилпроизводным 3-аминокарбазола, а также к фармацевтической композиции, их содержащей, к способу их получения и к применению этих соединений для получения лекарственных средств, применимых при лечении или предотвращении расстройств, связанных с продуцированием простагландина Е 2 (PGE2), например воспалительных процессов, боли, жара, новообразований, болезни Альцгеймера и атеросклероза.(71)(73) Заявитель и патентовладелец: АЦЬЕНДЕ КИМИКЕ РЬЮНИТЕ АНДЖЕЛИНИ ФРАНЧЕСКО Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям 3-аминокарбазола, к фармацевтической композиции их содержащих, к способу их получения и к применению таких соединений для получения лекарственного средства, которое применимо при лечении расстройств, связанных с продуцированием простагландина Е 2 (PGE2), например воспалительных процессов, боли, жара, новообразований, болезни Альцгеймера и атеросклероза. Более подробно, настоящее изобретение относится к новым бензоильным производным 3 аминокарбазола, которые применимы для лечения или предотвращения расстройств, связанных с продуцированием простагландина Е 2 (PGE2), например воспалительных процессов, боли, жара, новообразований, болезни Альцгеймера и атеросклероза. Известный уровень техники Значение простагландина Е 2 (PGE2) обусловлено тем, что он вместе с другими простаноидами, продуцируемыми метаболически из арахидоновой кислоты, играет роль биорегуляторов и медиаторов воспаления. Простаноиды представляют собой класс соединений, включающий простагландины, тромбоксаны и простациклины. Простаноиды представляют собой липидные медиаторы, которые действуют как местные гормоны на клетки, соседние с участком их высвобождения. Простаноиды продуцируются главным образом из арахидоновой кислоты посредством ферментативного окисления, активируемого циклооксигеназой. Циклооксигеназы (простагландин G/H синтазы) катализируют последовательное образованиеPGG2 и PGH2 из арахидоновой кислоты. Затем PGH2 с помощью особых ферментов преобразуется в разнообразные простаноиды. Таким способом образуются простагландин D2 (PGD2), простагландин Е 2(PGE2), простагландин F2 (PGF2), простагландин I2 (PGI2) и тромбоксан А 2 (ТХА 2). Простаноиды не аккумулируются, кроме как в семенной жидкости. После различных стимулирующих воздействий (воспалительных, иммунологических, гормональных, ультрафиолетовым светом, опухолевыми агентами, а также посредством механического перемешивания) они синтезируются и высвобождаются во внеклеточное пространство, откуда они поступают в плазму, мочу и другие биологические жидкости. Простаноиды играют важную роль в защитных механизмах функционирования органов и целостности всего организма. Это продемонстрировано цитопротекторной функцией желудочно-кишечного тракта, регуляцией почечной функции и капиллярного кровообращения, регуляцией агрегации тромбоцитов и свертывания крови, участием в дифференцировке иммунных клеток и в заживлении ран, в метаболизме костной ткани и овуляции. В частности, следует подчеркнуть вазопротекторное действие PGI2, которое существенно для поддержания сосудистого тонуса и предотвращения тромбоэмболии и атеросклероза на эндотелиальном уровне; и противовоспалительное и антипролиферативное действие PGD2, метаболит которого 15d-PGJ2 способен запускать противовоспалительные воздействия посредством активации ядерных рецепторовChem. 2000, 275(36): 28028-28032). Таким образом, простаноиды представляют собой биорегуляторы, но также и важные медиаторы воспалительного процесса и других патологий. В частности, PGE2, присутствующий в избытке на участках воспаления и ответственный за различные наблюдаемые патологические формы острого или хронического воспалительного процесса, например отека, образования эритемы, боли воспалительного характера, суставного воспалительного процесса и жара. Фактически, PGE2 представляют собой мощные противовоспалительные и альгогенные (болевые) агенты. Анти-PGE2 антитела обладают противовоспалительной активностью. Животные, не имеющие PGE2 рецепторов, обнаруживают сниженную ответную реакцию на воспалительные раздражителиIP and EP(3) in endotoxin-induced enhancement of pain perception", Biochem. Pharmacol. 2001, 62(2): 157160) и отсутствие ответной реакции в виде лихорадочного состояния на пирогенные стимулирующие воздействия (Ushikubi et al., "Impaired febrile response in mice lacking the prostaglandin E receptor subtype ЕР 3", Nature 1998, 395:281-284). Нестероидные противовоспалительные лекарственные средства (НСПВС) (NSAIDs) и селективные СОХ-2 лекарственные средства, в настоящее время находящиеся в употреблении, уменьшают симптомы,обусловленные воспалительным процессом, путем неселективного ингибирования продуцирования эйкозаноидов (PGE2, PGD2, PGF2, PGI2 и ТХА 2) вследствие их ингибирующего воздействия на циклооксигеназы 1 и 2 (Fitzgerald and Patrono, 2001). В частности, селективные лекарственные средства СОХ-2, в настоящее время имеющиеся на рынке,понижали желудочно-кишечную токсичность по сравнению с нестероидными противовоспалительными лекарственными средствами (NSAIDs). Однако указанные селективные лекарственные средства СОХ-2 снижают продуцирование васкулярного простациклина (PGI2, который производится преимущественно из СОХ-2), меняя стандартное равновесие между протромботическими и антитромботическими эйкозаноидами в пользу протромботических (ТХА 2, которые получаются преимущественно из СОХ-1), и приводят к повышенному риску тромботических сердечно-сосудистых заболеваний (S. Malhotra, MD, DM;N. Shafiq, MD; P. Pandhi, MD Medscape General Medicine 6(1), 2004; D. Mukherjee and E.J. Topol Cardiovascular risk and COX-2 ingibiors, Arthritis Res. Ther. 2003, 5:8-11-2002). Различные соединения 3-аминокарбазола исследовали на их способность селективно связываться с человеческим Y5 рецептором и модулировать его активность. Эта способность делает их применимыми при лечебном воздействии на аппетит и метаболические расстройства, например ожирение, нейрогенную булимию, психическую анорексию, расстройства сна, морфинозависимость и эпилептические припадки(WO 01/07409 А 1, WO 02/051806, WO 02/096902 и US 6399631). Заявка на патент WO 2006/122680 описывает применение ряда соединений 3-аминокарбазола для лечения расстройств, связанных с продуцированием простагландина Е 2 (PGE2). В дополнение, заявка на патент WO 2007/014687 описывает ряд новых соединений 3-аминокарбазола и их применение для лечения расстройств, связанных с продуцированием простагландина Е 2 (PGE2). Сущность изобретения В настоящее время с удивлением было обнаружено, что некоторые новые соединения 3 аминокарбазола, кроме способности селективного ингибирования продуцирования простагландина Е 2(PGE2), неожиданно демонстрировали улучшенные биодоступность и фармакокинетические характеристики. Эти соединения способны уменьшать продуцирование PGE2 и, таким образом, активны при всех патологических состояниях, при которых PGE2 действует как медиатор, например, воспалительных процессов, боли, жара, новообразований, болезни Альцгеймера и атеросклероза. В дополнение, эти соединения демонстрировали удивительно высокую метаболическую стабильность, высокую абсорбцию in vitro и высокую биодоступность. Типичными примерами таких воспалительных процессов являются отек, эритема, суставной воспалительный процесс, ревматоидный артрит и артроз. Типичными примерами таких новообразований являются колоректальная и легочная карцинома и аденокарцинома. Соединения по настоящему изобретению селективно ингибируют синтез PGE2. Эта селективность обладает тем преимуществом, что при ингибировании сильного медиатора воспалительного процесса,боли и жара, продуцирование других простаноидов, одновременно получаемых в метаболическом каскаде, таких как PGF2, TXA2, PGI2 и PGD2, остается неизменным. Таким образом, остаются неизменными все защитные механизмы функционирования органов и целостности организма, которые характерны для активности других простаноидов. Аналогично общепринятым нестероидным противовоспалительным лекарственным средствам соединения по настоящему изобретению обладают противовоспалительными, жаропонижающими и болеутоляющими свойствами и, таким образом, являются активными при таких патологиях, как воспалительный процесс, боль, жар, ревматоидный артрит и артроз. В дополнение, так как участие PGE2 в новообразованиях, болезни Альцгеймера и атеросклерозе известно из литературы, соединения по настоящему изобретению также применимы при предотвращении и лечении этих патологий. Преимущественно эти соединения, однако, обнаруживают небольшое количество побочных эффектов по сравнению с NSAIDs и селективными СОХ-2 лекарственными средствами, которые при ингибировании циклооксигеназы не делают различия между простаноидами. В частности, эти соединения применимы как при лечении, так и при предотвращении воспалительных процессов. В частности, соединения по настоящему изобретению демонстрируют пониженную желудочнокишечную, почечную и сосудистую токсичность. Подробное описание изобретения Согласно первому аспекту настоящее изобретение относится к соединению 3-аминокарбазола,имеющему общую формулу (I) где R1 представляет собой атом галогена, метильную группу или тригалогенметильную группу,нитрогруппу, цианогруппу или трифлатную группу;R2 представляет собой линейную или разветвленную гидроксиалкильную группу, содержащую от 1 до 8 атомов углерода, или линейную или разветвленную карбонилалкильную группу, содержащую от 1 до 8 атомов углерода,или к его фармацевтически приемлемой соли, его полиморфной кристаллической форме, его сте-2 019068 реоизомеру или его энантиомеру. В частности, настоящее изобретение относится к соединениям 3-аминокарбазола общей формулы(I), в которой R1 представляет собой атом фтора или хлора либо трифторметильную или трихлорметильную группу; a R2 представляет собой линейную или разветвленную гидроксиалкильную группу, содержащую от 1 до 6 атомов углерода, или линейную или разветвленную карбонилалкильную группу, содержащую от 1 до 4 атомов углерода. Для целей настоящего изобретения термином "гидроксиалкил" обозначают алкильную группу, содержащую от 1 до 3 гидроксильных групп (-OH), связанных с одним или несколькими атомами углерода,а термином "карбонилалкил" обозначают алкильную группу, содержащую от 1 до 3 оксигрупп (=O), связанных с одним или несколькими атомами углерода. Согласно предпочтительному аспекту настоящее изобретение относится к соединениям 3 аминокарбазола общей формулы (I), в которой определения для R1 и R2 обозначены в табл. 1. Таблица 1 Формула (I), описанная ранее, включает в себя соединения, в которых фенильная группа имеет,кроме заместителя R1, один или несколько заместителей, таких как, например, атом галогена, алкильная группа, содержащая от 1 до 3 атомов углерода, трифторметильная группа, нитрогруппа, трифлатная группа (CF3SO3-), алкилкарбоксильная группа, содержащая от 1 до 3 атомов углерода (-(CH2)nCOOH),амидная группа (-CONH2), метилсульфоксигруппа (SO2CH3), N-метилсульфонамидная группа(-SO2NHCH3) или метансульфонамидная группа (NHSO2CH3). Как известно специалистам в данной области техники, фармацевтически приемлемыми солями соединений общей формулы (I) могут быть основно-аддитивные соли. Примерами пригодных фармацевтически приемлемых оснований являются основания, образованные щелочными металлами и щелочноземельными металлами, такими как Na+, K+, Mg, Са, и органические основания, такие как трометамин, холин и лизин. Соединения общей формулы (I) по настоящему изобретению могут иметь несколько кристаллических структур или форм или могут находиться в аморфной форме. Соединения, которые обладают такими свойствами, обычно называют полиморфы. Различные полиморфы этого соединения могут проявлять разные химические, физические и спектроскопические свойства. В дополнение, при некоторых заместителях соединения общей формулы (I) по настоящему изобретению могут содержать один или несколько асимметричных атомов углерода и, таким образом, могут находиться в виде стереоизомеров и энантиомеров. Таким образом, соединения по настоящему изобретению также включают в себя фармацевтически приемлемые соли, полиморфные кристаллические формы, стереоизомеры и энантиомеры соединения,представляемого формулой (I), описанного в формуле изобретения. Согласно второму аспекту настоящее изобретение относится к фармацевтической композиции, отличающейся тем, что она содержит терапевтически эффективную дозу соединения 3-аминокарбазола указанной выше общей формулы (I) или его фармацевтически приемлемую соль вместе по крайней мере с одним фармацевтически приемлемым инертным носителем. Предпочтительно, когда фармацевтические композиции по настоящему изобретению получают в пригодных лекарственных формах. Примерами пригодных лекарственных форм являются таблетки, капсулы, таблетки в оболочке, гранулы, растворы и сиропы для орального введения; кремы, мази и антисептические пластыри для местного введения; суппозитории для ректального введения и стерильные растворы для введения путем инъекции или аэрозольного введения, или глазного введения. Преимущественно эти лекарственные формы составляют таким образом, чтобы обеспечить контролируемое на протяжении времени высвобождение соединения указанной выше общей формулы (I) или его фармацевтически приемлемой соли. В частности, в зависимости от типа терапии требуемое время высвобождения может быть очень коротким, стандартным или длительным. Лекарственные формы могут также содержать другие общепринятые ингредиенты, например консерванты, стабилизаторы, поверхностно-активные вещества, буферы, соли для регуляции осмотического давления, эмульгаторы, подсластители, красители, корригенты и т.п. В дополнение, при необходимости, при отдельных видах терапии, фармацевтическая композиция по настоящему изобретению может содержать также другие фармакологически активные ингредиенты,одновременное введение которых оказывается полезным. Преимущественно фармацевтическая композиция по настоящему изобретению может содержать пролекарство соединения формулы (I). Пролекарство соединения формулы (I) представляет собой вещество, по существу, в неактивной форме, которое при введении живому существу подвергается метаболизму, преобразуясь в соединение формулы (I). Как известно специалистам в данной области, пролекарство соединений общей формулы (I) может представлять собой сложноэфирные производные, получаемые взаимодействием гидроксигруппы заместителя R2 с такой кислотой, как монокарбоновая кислота,бикарбоновая кислота, жирная кислота, аминокислота, (алкил)фосфорная кислота или (алкил)тиофосфорная кислота. Примерами пригодных пролекарств являются эфир уксусной кислоты, эфир пропионовой кислоты,эфир янтарной кислоты, эфир стеариновой кислоты, эфир пальмитиновой кислоты, эфир глицина, эфир лейцина, эфир лизина, эфир фосфорной кислоты, эфир метилфосфорной кислоты, эфир метилтиофосфорной кислоты и эфир фосфоновой кислоты. Применимые примеры пригодных пролекарств описаны,например, в работе Stella V.J. et al., "Prodrug strategies to overcome poor water solubility", Advance DrugDelivery Reviews 59 (2007), 677-694. Композиция по настоящему изобретению может также содержать фармацевтически приемлемые соли, полиморфные кристаллические формы, стереоизомеры и энантиомеры пролекарства соединения, представляемого формулой (I), описанного в формуле изобретения. Количество соединения по настоящему изобретению в фармацевтической композиции может варьировать внутри широкого диапазона, являясь функцией известных факторов, например типа заболевания,подвергаемого лечению, тяжести заболевания, массы тела пациента, лекарственной формы, выбранного пути введения, числа ежедневных введений и эффективности выбранного соединения. Однако оптимальное количество может быть легко определено общепринятым способом специалистом в данной области техники. Как правило, количество соединения по настоящему изобретению в фармацевтической композиции будет таким, чтобы обеспечить уровень введения между 0,0001 и 100 мг/кг/день и даже более предпочтительно между 0,01 и 10 мг/кг/день. Лекарственные формы фармацевтической композиции по настоящему изобретению могут быть получены, следуя методам, хорошо известным фармацевтам, которые включают в себя смешение, гранулирование, таблетирование, растворение, стерилизацию и т.п. Третий аспект настоящего изобретения относится к способу лечения или предотвращения воспалительных процессов, боли, жара, новообразований, болезни Альцгеймера и атеросклероза у млекопитающих. Способ включает в себя введение терапевтически эффективного количества соединения 3 аминокарбазола указанной выше общей формулы (I), его фармацевтически приемлемой соли, его полиморфной кристаллической формы, его стереоизомера или его энантиомера субъекту, в этом нуждающемуся. Предпочтительно, когда воспалительный процесс выбирают из группы, содержащей отек, эритему,суставной воспалительный процесс, ревматоидный артрит и артроз, и новообразование выбирают из группы, содержащей колоректальную или легочную карциному и аденокарциному. 3-Аминокарбазолы вышеуказанной общей формулы (I) можно получить по известным методикам,например посредством взаимодействия кислоты или ее реакционноспособного производного с выбранным амином (заявка на патент WO 02/096902 A1, WO 02/051806, Med. Chem. 2002, vol. 45, p. 3509-3523). Типичными примерами реакционноспособных производных являются ацилгалогениды, ангидриды или сложные эфиры. Таким образом, согласно четвертому аспекту настоящее изобретение относится к способу получения 3-аминокарбазола вышеуказанной общей формулы (I), отличающемуся тем, что он содержит нижеследующие стадии: а) реакцию амина формулы (II)R представляет собой линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода,-4 019068b) необязательное образование фармацевтически приемлемой соли, полиморфной кристаллической формы, стереоизомера или энантиомера соединения формулы (I), таким образом полученного. Обычно, стадию (а) осуществляют в присутствии пригодного разбавителя при температуре, находящейся внутри диапазона между 0 и 140 С в течение времени, находящегося в диапазоне между 0,5 и 24 ч. Предпочтительно, когда реакционная температура находится в диапазоне между 15 и 40 С. Преимущественно время реакции находится в диапазоне от 2 до 18 ч. Предпочтительно, когда разбавитель является апротонным, полярным или неполярным. Даже более предпочтительно, когда он представляет собой полярный апротонный разбавитель. Примерами пригодных полярных апротонных разбавителей являются диметилформамид и дихлорметан. В варианте осуществления изобретения, где Z представляет собой Cl или Br, реакцию преимущественно осуществляют в присутствии пригодного органического или неорганического акцептора кислоты. Примерами пригодных органических акцепторов являются диизопропилэтилендиамин, триэтиленамин,пиридин и диметиламинопиридин. Примерами пригодных неорганических акцепторов являются карбонаты или бикарбонаты щелочных металлов. В варианте осуществления изобретения, в котором Z представляет собой OH, реакцию предпочтительно осуществляют в присутствии пригодного связующего вещества, например дициклогексилкарбодиимида (также закрепленного на полистирольном носителе) или карбонилдиимидазола. Последующие примеры приведены для более подробной иллюстрации изобретения, не вносящие,однако, дополнительных ограничений. Пример 1. Получение соединения 1.a) 2-(3-Нитро-9 Н-карбазол-9-ил)этанол. К раствору 2-(9 Н-карбазол-9-ил)этанола (25 г; 0,12 моль) в ледяной уксусной кислоте (374 мл) на протяжении 30 мин при энергичном перемешивании по каплям добавляли раствор, содержащий азотную кислоту (6,8 мл; 0,17 моль) в ледяной уксусной кислоте (20 мл). Через 5 мин после завершения добавления выпадал зеленый осадок. Реакционную смесь медленно вливали в H2O и лед (1 л), перемешивали 1 ч,фильтровали и в заключение промывали H2O. Отделенное твердое вещество поглощали сначала Н 2 О(500 мл) и затем 10% раствором карбоната натрия, чтобы получить рН 7, и, в заключение, отфильтровывали. Полученное твердое вещество кристаллизовали из (1:1) раствора ацетон/чистый этанол, чтобы получить 20 г 2-(3-нитро-9 Н-карбазол-9-ил)этанол. 1b) 2-(3-Амино-9 Н-карбазол-9-ил)этанол гидрохлорид. Продукт, полученный согласно описанному на предыдущей стадии а), (10 г; 0,04 моль) растворяли в тетрагидрофуране (550 мл). Затем добавляли дигидрат хлорида двухвалентного олова (87 г; 0,4 моль). Полученную таким образом смесь 16 ч кипятили с обратным холодильником. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем растворитель удаляли при пониженном давлении. Остаток поглощали Н 2 О и дихлорметаном и энергично перемешивали. Доводили pH до 7,5, добавляя насыщенный раствор бикарбоната натрия. Смесь фильтровали через целит и фильтрат переносили в делительную воронку. Органическую фазу отделяли и сушили над Na2SO4. Растворитель удаляли выпариванием при пониженном давлении, полученный таким образом остаток (9 г) растворяли в этаноле и преобразовывали в соответствующий гидрохлорид, добавляя спиртовой 5 М раствор хлористого водорода. Осажденное твердое вещество отфильтровывали, чтобы получить 2-(3-амино 9 Н-карбазол-9-ил)этанол гидрохлорид (9 г). 1 Н ЯМР (300 МГц, ДМСО-d6)10,41 (шир.с, 3H), 8,17 (д, J=7,76 Гц, 1 Н), 8,12 (д, J=1,98 Гц, 1 Н),7,73 (д, J=8,75 Гц, 1 Н), 7,66 (д, J=8,26 Гц, 1 Н), 7,38-7,56 (м, 2 Н), 7,23 (т, J=7,27 Гц, 1 Н), 4,70 (шир.с, 1 Н),4,47 (т, J=5,53 Гц, 2 Н), 3,78 (т, J=5,45 Гц, 2 Н). с) N-[9-(2-гидроксиэтил)-9 Н-карбазол-3-ил]-2-(трифторметил)бензамид. Продукт, полученный, как описано на предыдущей стадии b), (26 г; 0,1 моль) суспендировали в дихлорметане (300 мл). Затем, к раствору добавляли триэтиламин (28 мл; 0,2 моль) и 2 трифторметилбензоилхлорид (15,6 мл; 0,11 моль). Полученную таким образом смесь перемешивали при комнатной температуре 16 ч. Растворитель выпаривали при пониженном давлении, остаток поглощали 2 н. раствором NaOH(200 мл) и получающийся раствор 2 ч кипятили с обратным холодильником. Полученную таким образом суспензию вливали в воду и продукт отфильтровывали и кристаллизовали из смеси изопропиловый эфир/изопропанол (1:1). Таким образом был получен N-[9-(2-гидроксиэтил)-9 Н-карбазол-3-ил]-2-(трифторметил)бензамидa) 1-(9 Н-Карбазол-9-ил)-2-метилпропан-2-ол. К раствору, содержащему карбазол (20 г; 0,12 моль) в ДМСО (300 мл), добавляли 50% раствор гидроксида натрия (300 мл), бензилтриметиламмонийхлорида (5,5 г; 0,024 моль) и по каплям добавляли 2 хлор-2-метилпропан-2-ол (39,1 г; 0,36 моль). Полученную таким образом смесь перемешивали при комнатной температуре 16 ч. Смесь вливали в Н 2 О со льдом (3 л), перемешивали 1 ч и фильтровали; полученное таким образом твердое вещество кристаллизовали из (9:1) смеси гексан/этилацетат, чтобы получить 1-(9 Н-карбазол-9-ил)-2-метилпропан-2-ол (15 г). 1 Н ЯМР (300 МГц, ДМСО-d6)8,07-8,15 (м, 2 Н), 7,68 (д, J=8,33 Гц, 2 Н), 7,40 (ддд, J=1,24, 7,13, 8,29 Гц, 2 Н), 7,13-7,20 (м, 2 Н), 4,64 (с, 1 Н), 4,26 (с, 2 Н), 1,21 (с, 6 Н).b) 1-(3-Нитро-9 Н-карбазол-9-ил)-2-метилпропан-2-ол. К раствору в ледяной уксусной кислоте (400 мл) продукта (21 г; 0,088 моль), полученного, как описано на предыдущий стадии а), при энергичном перемешивании на протяжении 30 мин по каплям добавляли раствор, содержащий азотную кислоту (5 мл; 0,123 моль) в ледяной уксусной кислоте (15 мл; 0,263 моль). Через 5 мин после завершения добавления выделялся зеленый осадок. Реакционную смесь медленно вливали в Н 2 О со льдом (1 л), перемешивали 1 ч, фильтровали и, в заключение, промывалиH2O. Отделенное твердое вещество поглощали сначала H2O (500 мл) и затем 10% раствором карбоната натрия до получения величины рН 7 и, в заключение, отфильтровывали. Полученное твердое вещество кристаллизовали из (8:2) смеси этилацетат/этанол, чтобы получить 1(3-нитро-9 Н-карбазол-9-ил)-2-метилпропан-2-ол (19 г). 1 Н ЯМР (300 МГц, ДМСО-d6)9,15 (д, J=2,05 Гц, 1 Н), 8,38 (д, J=7,31 Гц, 1 Н), 8,30 (дд, J=2,48, 9,21 Гц, 1 Н), 7,87 (д, J=9,06 Гц, 1 Н), 7,81 (д, J=8,48 Гц, 1 Н), 7,54 (ддд, J=1,17, 7,16, 8,33 Гц, 1H), 7,31 (тд,J=0,88, 7,60 Гц, 1H), 4,73 (с, 1H), 4,37 (с, 2H), 1,21 (с, 6H).c) 1-(3-Амино-9 Н-карбазол-9-ил)-2-метилпропан-2-ол гидрохлорид. Продукт (7,9 г; 0,028 моль), полученный, как описано на предыдущей стадии b), растворяли в тетрагидрофуране (350 мл). Затем добавляли дигидрат хлорида двухвалентного олова (62,8 г; 0,28 моль). Смесь, полученную таким образом, кипятили 16 ч с обратным холодильником. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем при пониженном давлении удаляли растворитель. Остаток поглощали Н 2 О и дихлорметаном и подвергали энергичному перемешиванию. Доводили до рН 7,5, добавляя насыщенный раствор бикарбоната натрия, смесь фильтровали через целит и фильтрат переносили в делительную воронку. Органическую фазу отделяли и сушили над Na2SO4. Растворитель удаляли выпариванием при пониженном давлении, полученный таким образом остаток (9 г) растворяли в этаноле и преобразовывали в соответствующий гидрохлорид, добавляя спиртовой 5 М раствор хлористого водорода. Полученное твердое вещество кристаллизовали из (8:2) смеси изопропанол/вода, чтобы получить 1-(3-амино-9 Н-карбазол-9-ил)-2-метилпропан-2-ол гидрохлорид (6 г). 1d) N-[9-(2-гидрокси-2-метилпропил)-9 Н-карбазол-3-ил]-2-(трифторметил)бензамид. Продукт (3,3 г; 0,011 моль), полученный, как описано на предыдущей стадии с), суспендировали в дихлорметане (30 мл). Затем к раствору добавляли триэтиламин (3 мл; 0,022 моль) и 2 трифторметилбензоилхлорид (1,7 мл; 0,012 моль). Смесь, полученную таким образом, перемешивали при комнатной температуре 16 ч. Растворитель выпаривали при пониженном давлении, остаток поглощали 2 н. раствором NaOH(20 мл) и получившийся раствор кипятили 2 ч с обратным холодильником. Суспензию, полученную таким образом, вливали в воду и продукт отфильтровывали, сушили и кристаллизовали из (1:1) смеси изопропиловый эфир/изопропанол. Таким образом получалиm.p. (температура плавления): 179-181C. Элементный анализ для C24H21F3N2O2a) Этил 3-(9 Н-карбазол-9-ил)пропаноат. К раствору, содержащему карбазол (20 г; 0,12 моль) в ДМФА (130 мл), порциями добавляли гидрид натрия (50% суспензия) (6,7 г; 0,14 моль). Полученную таким образом суспензию 30 мин перемешивали при комнатной температуре и затем нагревали до 60C. По каплям добавляли раствор, содержащий этил 3-бромпропаноат (17,9 мл; 0,14 моль) в ДМФА (20 мл), и смесь перемешивали 16 ч. Смесь вливали в H2O (0,5 л) и фильтровали. Полученное твердое вещество очищали флэшхроматографией на кремнеземе, используя (8:2) смесь гексан/этилацетат в качестве элюента, чтобы получить 16 г этил 3-(9 Н-карбазол-9-ил)пропаноата. Этот продукт без дополнительной очистки использовали в следующей реакции.b) 4-(9 Н-Карбазол-9-ил)-2-метилбутан-2-ол. К раствору в тетрагидрофуране (200 мл) продукта (15,2 г; 0,057 моль), полученного на предыдущей стадии а), добавляли 3 М раствор метилмагнийиодида в диэтиловом эфире (57 мл; 0,171 моль). Смесь,полученную таким образом, перемешивали при комнатной температуре 16 ч. Затем к смеси добавляли 1 М раствор NH4Cl (500 мл). Получающуюся смесь переносили в делительную воронку и экстрагировали этилацетатом. Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Полученный остаток кристаллизовали из смеси (8:2) гексан/этилацетат, чтобы получить 4-(9 Нкарбазол-9-ил)-2-метилбутан-2-ол (9 г). Этот продукт использовали в следующей реакции без дополнительной очистки.c) 2-Метил-4-(3-нитро-9 Н-карбазол-9-ил)бутан-2-ол. Продукт (7,2 г; 0,028 моль), полученный на предыдущей стадии b), подвергали реакции, действуя аналогично описанному в примере 1 а). Полученный продукт кристаллизовали из этилацетата, чтобы получить 2-метил-4-(3-нитро-9 Н-карбазол-9-ил)бутан-2-ол (6 г). 1 Н ЯМР (300 МГц, ДМСО-d6)9,17 (д, J=2,34 Гц, 1H), 8,41 (д, J=7,60 Гц, 1H), 8,36 (дд, J=2,34, 9,35 Гц, 1H), 7,73 (д, J=9,35 Гц, 1H), 7,66-7,71 (м, 1H), 7,56-7,64 (м, 1H), 7,31-7,38 (м, 1H), 4,62 (с, 1H), 4,484,58 (м, 2H), 1,79-1,89 (м, 2H), 1,24 (с, 6H).d) 4-(3-Амино-9 Н-карбазол-9-ил)-2-метилбутан-2-ол гидрохлорид. К суспензии продукта (5,9 г; 0,020 моль), полученного на предыдущей стадии с), в 95 этаноле(80 мл) добавляли 10% Pd/C (0,5 г; 0,0005 моль) и смесь в течение 4 ч подвергали гидрированию в гидрогенизаторе Парра (30 psi(фунт/кв.дюйм. Реакционную смесь фильтровали, раствор упаривали при пониженном давлении и полученный продукт растворяли в этилацетате и преобразовывали в соответствующий гидрохлорид, добавляя спиртовой 5 М раствор хлористого водорода. Твердое вещество, полученное таким образом, кристаллизовали из смеси (1:1) изопропиловый эфир/изопропанол, чтобы получить 4-(3-амино-9 Н-карбазол-9-ил)-2-метилбутан-2-ол гидрохлорид (5,5 г). 1H ЯМР (300 МГц, ДМСО-d6)10,34 (шир.с, 3H), 8,19 (д, J=7,60 Гц, 1H), 8,13 (д, J=1,98 Гц, 1H),7,68 (д, J=8,92 Гц, 1H), 7,62 (д, J=8,20 Гц, 1H), 7,44-7,58 (м, 2H), 7,25 (т, J=6,94 Гц, 1H), 4,08-4,83 (м, 3H),1,73-1,88 (м, 2H), 1,23 (с, 6H). е) N-[9-(3-гидрокси-3-метилбутил)-9 Н-карбазол-3-ил]-2-трифторметилбензамид. Продукт (3,9 г; 0,013 моль), полученный согласно описанному на предыдущей стадии d), подвергали реакции, действуя аналогично описанному в примере 1 с). Полученное твердое вещество кристаллизовали из этанола, чтобы получить N-[9-(3-гидрокси-3 метилбутил)-9 Н-карбазол-3-ил]-2-(трифторметил)бензамид (2,3 г).R1=CF3, R2=CH2COCH3. а) Этил 9 Н-карбазол-9-илацетат. К раствору, содержащему карбазол (20 г; 0.12 моль) в ДМФА (130 мл), порциями добавляли гидрид натрия (50% суспензия) (6,9 г; 0,14 моль). Суспензию, полученную таким образом, 30 мин перемешивали при комнатной температуре и затем нагревали до 60C. По каплям добавляли раствор, содержащий этил 2-бромацетат (24 г; 0,14 моль) в ДМФА (20 мл), и полученную смесь перемешивали 16 ч. Смесь вливали в H2O (0,5 л) и фильтровали. Полученное твердое вещество кристаллизовали из гексана, чтобы получить этил 9 Н-карбазол-9-илацетат (20 г). 1 Н ЯМР (300 МГц, ДМСО-d6)8,15 (д, J=7,60 Гц, 2H), 7,54 (д, J=8,20 Гц, 2H), 7,43 (тд, J=1,02, 7,67 Гц, 2H), 7,17-7,27 (м, 2H), 5,33 (с, 2H), 4,14 (кв., J=7,02 Гц, 2H), 1,20 (т, J=7,16 Гц, 3H).b) 1-(9 Н-Карбазол-9-ил)ацетон. К раствору в тетрагидрофуране (130 мл) продукта (14,1 г; 0,056 моль), полученного на предыдущей стадии а), добавляли 3 М раствор метилмагнийиодида в диэтиловом эфире (28 мл; 0,084 моль). Смесь,полученную таким образом, перемешивали при комнатной температуре 16 ч. Затем к смеси добавляли 1 М раствор NH4Cl (100 мл). Полученную смесь переносили в делительную воронку и экстрагировали этилацетатом. Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на кремнеземе, используя в качестве элюента смесь (95:5) гексан/этилацетат, чтобы получить 1-(9 Н-карбазол-9-ил)ацетон (8 г). Этот продукт использовали без дополнительной очистки в следующей реакции. 1c) 1-(3-Нитро-9 Н-карбазол-9-ил)ацетон. Продукт (5 г; 0,022 моль), полученный на предыдущей стадии b), подвергали реакции, действуя аналогично описанному в примере 1 а). Полученный остаток очищали флэш-хроматографией на кремнеземе, используя в качестве элюента смесь 8:2 гексан/этилацетат, чтобы получить 1-(3-нитро-9 Нкарбазол-9-ил)ацетон (4,5 г). Этот продукт использовали без дополнительной очистки в следующей реакции. 1d) 1-(3-Амино-9 Н-карбазол-9-ил)ацетон гидрохлорид. К суспензии продукта (1,3 г; 0,005 моль), полученного на предыдущей стадии с), в 95 этаноле (80 мл) добавляли 10% Pd/C (0,5 г; 0,0005 моль) и смесь подвергали гидрированию в гидрогенизаторе Парра(30 psi(фунт/кв.дюйм в течение 4 ч. Реакционную смесь фильтровали и раствор упаривали при пониженном давлении. Полученный продукт растворяли в этилацетате и преобразовывали в соответствующий гидрохлорид, добавляя спиртовой 5 М раствор хлористого водорода. Осажденное твердое вещество отфильтровывали, чтобы получить 1-(3-амино-9 Н-карбазол-9-ил)ацетон гидрохлорид (1,1 г). 1e) N-[9-(2-Оксопропил)-9 Н-карбазол-3-ил]-2-(трифторметил)бензамид. Продукт (1,1 г; 0,004 моль), полученный на предыдущей стадии d), подвергали реакции, действуя аналогично описанному в примере 1 с). Полученное твердое вещество кристаллизовали из смеси (1:1) изопропиловый эфир/изопропанол,чтобы получить N-[9-(2-оксопропил)-9 Н-карбазол-3-ил]-2-(трифторметил)бензамид (1,2 г).R1=Cl, R2=CH2CH2OH. а) 2-Хлор-N-[9-(2-гидроксиэтил)-9 Н-карбазол-3-ил]бензамид. Продукт (6,4 г; 0,028 моль), полученный, как описано в примере 1b), суспендировали в дихлорметане (70 мл). Затем к раствору добавляли триэтиламин (7,9 мл; 0,2 моль) и 2-хлорбензоилхлорид (3,95 мл; 0,031 моль). Смесь, полученную таким образом, перемешивали при комнатной температуре 16 ч. Растворитель выпаривали при пониженном давлении, остаток поглощали 2 н. раствором NaOHR1= Cl, R2=CH2CH2C(CH3)2OH. а) 2-Хлор-N-[9-(3-гидрокси-3-метилбутил)-9 Н-карбазол-3-ил]бензамид. Продукт (1,1 г, 0,0037 моль), полученный, как описано в примере 3d), подвергали взаимодействию с 2-хлорбензоилхлоридом (0,52 мл; 0,0041 моль), действуя аналогично описанному в примере 1 с). Полученное твердое вещество кристаллизовали из этилацетата, чтобы получить 2-хлор-N-[9-(3 гидрокси-3-метилбутил)-9 Н-карбазол-3-ил]бензамид (0,63 г).H ЯМР (300 МГц, ДМСО-d6)10,48 (с, 1H), 8,57 (д, J=1,98 Гц, 1H), 8,09 (д, J=7,60 Гц, 1H), 7,417,73 (м, 8H), 7,19 (т, J=7,43 Гц, 1H), 4,55 (с, 1H), 4,37-4,51 (м, 2H), 1,73-1,88 (м, 2H), 1,23 (с, 6H). Пример 7. Получение сравнительного соединения А. Сравнительное соединение А аналогично соединению 1 заявки на патент WO 2006/122680 и было получено, как описано в указанной заявке на патент. Пример 8. Получение сравнительного соединения В. Сравнительное соединение В аналогично соединению 6 заявки на патент WO 2007/014687 и было получено, как описано в указанной заявке на патент. Пример 9. Получение сравнительного соединения С. Сравнительное соединение С аналогично соединению 13 заявки на патент WO 2007/014687 и было получено, как описано в указанный заявке на патент. Пример 10. Тест на активность in vitro. Этот тест позволяет оценить ингибирующую способность продуцирования PGE2 и селективность по отношению к продуцированию PGF2. Была использована клеточная линия А 549 легочной аденокарциномы человека, которая особенно чувствительна к стимуляции противовоспалительными цитокинами, например IL-1, и в ответ на эту стимуляцию особенно активна в продуцировании и высвобождении двух простаноидов: PGE2 и PGF2(Thoren S. Jakobsson P.-J., 2000). Клетки стимулировали с помощью IL-1 (1 нг/мл) и одновременно 22 ч обрабатывали тестируемым соединением в соответствующей культуральной среде (DMEM - модифицированная Дульбекко среда Игла), дополненной 5% фетальной телячьей сывороткой и L-глутамином (4 мМ конечная концентрация) в инкубаторе при 37C, и 5% концентрации CO2. После инкубации количество PGE2 и PGF2, продуцируемых и высвобождаемых в надосадочную жидкость, оценивали, используя EIA кит (производимый и продаваемый фирмой Cayman Chemicals, AnnArbor, Ml, USA). Используемое сравнительное соединение представляло собой индометацин в концентрации 10 нМ(Sigma-Aldrich), представляющий собой нестероидное противовоспалительное лекарственное средство,которое в равной мере ингибирует и PGE2, и PGF2. Результаты, выраженные в виде величин IC50, т.е. в виде концентрации соединения, при которой продуцирование PGE2 и PGF2 ингибируют на 50%, относительно простимулированных клеток, не обработанных данным соединением, приведены в табл. 2. Пассивность или сниженная активность соединения в отношении биосинтеза PGF2 указывает на селективность его действия по отношению к продуцированию PGE2 и, таким образом, указывает на селективное ингибирование mPGES-1. Таблица 2 Пример 11. Тест на активность in vivo. Тестируемое соединение оценивали на модели индуцируемой уксусной кислотой болевой судорожной активности у мышей (Stock J.L. et al., J. Clin. Inv. 2001, 107: 325-331). Этот тест позволяет оценить антиноцицептивную активность соединений по изобретению на модели боли воспалительного характера. Для теста использовали самок мышей CD-1, с массой тела 25-30 г. Животных обрабатывали внутрибрюшинно тестируемым соединением (0,1-10 мг/кг), суспендированным в метилцеллюлозе (МТС). Контрольных животных обрабатывали аналогичным образом, используя только носитель (МТС). Через полчаса после обработки животным производили внутрибрюшинную инъекцию уксусной кислоты (0,7% об./об. в физиологическом растворе, 16 мкл/г массы тела), чтобы вызвать боль воспалительного характера и проверить воздействие тестируемого соединения на ноцицептивную ответную реакцию. Сразу после введения уксусной кислоты и в течение следующих 20 мин измеряли число болевых судорог, что служит параметром оценки ноцицептивной ответной реакции. Как показано в табл. 3, через 20 мин после введения уксусной кислоты соединение по изобретению дозозависимо индуцировало снижение числа болевых судорог по сравнению с животными, обработанными только МТС. Таблица 3 Пример 12. Тест на метаболическую стабильность в печеночных микросомах человека и крысы. Этот тест дает возможность оценить метаболическую стабильность соединений по изобретению и сравнительных соединений у крыс и человека. Тестируемые соединения инкубировали в печеночных микросомах человека (донорский пул,Xenotech) и в печеночных микросомах крыс от Sprague-Dawley (донорский пул, Xenotech). Измерения при сравнении тестируемых соединений производили таким образом, чтобы иметь оценку метаболической стабильности у разных биологических видов, используя анализы ВЭЖХ/МС/МС на 4000 QTrap масс-спектрометре, применяемом к биосистемам. Анализируемые соединения в конечной концентрации 0 и 1 мкМ помещали в суспензию, содержащую пул микросом с конечной концентрацией 0,5 мг/мл в конечном объеме 200 мкл, в 96-луночных планшетах. Тест стандартизировали фосфатным буфером (75 мМ, pH 7,4) и регенерирующей системойNADP+: 1,3 мМ). Эталонные соединения, варфарин, пропранолол и тестостерон (Sigma) инкубировали в виде смеси и обрабатывали аналогично тестируемым соединениям. Образцы инкубировали при 37C в инкубаторе с увлажнением. Во время 0 и через 60 мин добавляли 100 мкл ацетонитрила, содержащего внутренний стандарт (0,2 мкМ метопролола и 0,4 мкМ диклофенака), чтобы остановить реакцию. Перед анализом образцы центрифугировали. Анализ ВЭЖХ/МС/МС осуществляли, используя источник электрораспылительной ионизации, при регистрации положительных ионов и SRM (мониторинге выбранной реакции). Хроматографические условия требовали применение колонки XDB-C18 (2,150 мм,Agilent) и (5-91%) градиента ацетонитрила в воде, содержащей 0,1% муравьиной кислоты (общее время опыта равно 6 мин). Скорость течения составляла 0,5 мл/мин. Площади пиков тестируемых соединений интегрировали и результаты выражали в виде соотношения: площадь анализируемого вещества/площадь внутреннего стандарта (PAR). Для каждого времени анализировали два образца и вычисляли среднюю величину. Долю величины остающегося соединения вычисляли как:% неметаболизированного соединения=100(среднее PART конечное/среднее PART0). Результаты для соединений 1-6 приведены в табл. 4 вместе с результатами для сравнительных соединений А, В и С и для эталонных соединений. Соединения по настоящему изобретению демонстрируют улучшенную метаболическую стабильность по сравнению со сравнительными соединениями. Таблица 4 Пример 13. Тест на абсорбцию in vitro. Этот тест дает возможность оценить количество соединений по изобретению и сравнительных соединений, абсорбированных кишечным барьером, используя клеточную линию Сасо-2, в качестве in vitro модели кишечного барьера. Тест на проницаемость на клетках Сасо-2 представляет систему in vitro, апробированную для предсказания и оценки кишечной абсорбции лекарственного средства in vivo. Когда клетки Сасо-2 культивируют на пористом фильтре в течение приблизительно 21 дня, они проявляют способность к дифференцировке в энтероциты. Практически, на протяжении этого периода, клетки Сасо-2 претерпевают самопроизвольные морфологические и биохимические изменения, которые приводят к образованию поляризованного клеточного монослоя. Этот монослой на апикальной поверхности имеет хорошо различимую "щеточную каемку" и образует "плотные соединения" между клетками, таким образом, представляя пригодную модель для анализа кишечной проницаемости лекарственных средств. Нижеследующие материалы использовали для осуществления этого теста:Lucifer yellow (Луцифер желтый) (Sigma) Сбалансированный солевой раствор Хэнка (среда Хэнка) (HBSS) (Invitrogen) Радиоактивный стандартный образец (Perkin Elmer) Клетки Сасо-2 (АТСС) (Американская коллекция типовых культур) Мультиоконные планшеты Сасо-2 (Millipore) ВЭЖХ/МС/МС, осуществляемый на 4000 QTrap массспектрометре, применимом для биосистем Ацетонитрил, содержащий, в качестве внутреннего стандарта,0,2 мкМ метопролола. Тестируемые соединения разбавляли из 10 мМ стокового раствора в среде Хэнка (HBSS) до конечной концентрации, составляющей 10 мкМ. Система была представлена непрерывным клеточным монослоем, культивируемым в течение 21-28 дней. Эталонные соединения (Луцифер желтый, атенолол, пропранолол и дигоксин) включали в каждый тест для контроля качества и для сравнения с тестируемыми соединениями. Каждое соединение тестировали при pH 7,4 с тройным повтором в двух направлениях, от апикального к базолатеральному сектору (АВ) и от базолатерального к апикальному сектору (ВА). Образцы, собранные в заданное время, анализировали с помощью ВЭЖХ/МС/МС, используя источник электрораспылительной ионизации с регистрацией положительных ионов и SRM (мониторинг выбранной реакции). Хроматографические условия предполагали применение колонки XDB-C18(общее время опыта равно 6,5 мин), скорость течения составляла 0,5 мл/мин. В качестве внутреннего стандарта использовали метопролол. Данные по концентрации использовали для вычисления величин кажущейся проницаемости (Рарр),вычисляли также среднее и стандартное отклонение Рарр. Отношение потоков вычисляли как Рарр(ВА)/Рарр(АВ). Процент выделения продукта вычисляли как:(количество в принимающем секторе+количество в донорном секторе)/номинальное количество Площадь пиков тестируемых соединений интегрировали и результаты выражали как соотношение: площадь определяемого при анализе вещества/площадь внутреннего стандарта; корректировали на фактор разбавления, используемый во время получения образца. Коэффициенты кажущейся проницаемости вычисляли, используя нижеследующую формулу: в которой VA - объем в принимающей ячейке (0,25 мл для теста от АВ; 0,075 мл для теста от ВА); Площадь - площадь поверхности мембраны (0,11 см 2); Время - общее время транспорта (3600 с); Полученные величины классифицировали на основе нижеследующего критерия оценки: низкий Рарр 210-6 см/с; средний 210-6 см/сРарр 2010-6 см/с; высокий Papp20l0-6 см/с. Результаты для соединений 1-6 приведены в табл. 5, вместе с результатами для сравнительных соединений А, В и С, и для эталонных соединений. Соединения по настоящему изобретению демонстрировали улучшенное ожидание абсорбции относительно сравнительных соединений. Таблица 5 Пример 14. Тест на биодоступность in vivo. Этот тест позволяет оценить биодоступность in vivo соединений по изобретению, таким образом,давая возможность оценить и сравнить фармакокинетический профиль тестируемых соединений. Тесты осуществляли, используя кассетный метод, а именно орально вводя одновременно несколько продуктов одному и тому же животному, при дозе 5 мг/кг. Продукты суспендировали в метилцеллюлозе(МТС). У обработанных животных с помощью катетера последовательно осуществляли забор образцов крови с помощью автоматической системы отбора проб. Плазменные концентрации продуктов измеряли с помощью ВЭЖХ/МС/МС. Профили плазменных концентраций по времени позволяли оценить относительную биодоступность тестируемых продуктов в терминах скорости (tmax и Cmax) и биологического вида (AUC). Наклон кривой у точки конечной порции также дает возможность относительной оценки скорости элиминирования соединений из плазмы - чем медленнее скорость, тем меньше наклон. Для каждой комбинации соединений обрабатывали троих животных. Отбирали соединение, которое имело более высокие Cmax и AUC, и ожидаемое tmax, по сравнению с другими, так как оно демонстрировало хорошую скорость абсорбции in vivo. Используемый сравнительный продукт представлял собой соединение С, которое демонстрировало ограниченную абсорбцию, тогда как соединения 1, 2 и 3 по настоящему изобретению демонстрировали вполне хорошие характеристики биодоступности. В табл. 6 приведены полученные результаты. Результаты выражали как Cmax, т.е. максимальную достигаемую концентрацию лекарственного средства в плазме; Tmax, т.е. время, необходимое для достижения максимальной концентрации лекарственного средства в плазме; AUC0-7, т.е. площадь под кривой зависимости плазменных концентраций лекарственного средства от времени, которую измеряют первые семь часов после введения. Таблица 6 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение 3-аминокарбазола, отличающееся тем, что имеет общую формулу (I), приведенную ниже в которой R1 представляет собой атом галогена, метильную группу или тригалогенметильную группу, нитрогруппу или цианогруппу;R2 представляет собой линейную или разветвленную гидроксиалкильную группу, содержащую от 1 до 8 атомов углерода, или линейную или разветвленную карбонилалкильную группу, содержащую от 1 до 8 атомов углерода,его фармацевтически приемлемая соль или его сложный эфир. 2. Соединение 3-аминокарбазола по п.1, отличающееся тем, что R1 представляет собой атом фтора или хлора либо трифторметильную или трихлорметильную группу, a R2 представляет собой линейную или разветвленную гидроксиалкильную группу, содержащую от 1 до 6 атомов углерода, или линейную или разветвленную карбонилалкильную группу, содержащую от 1 до 4 атомов углерода. 3. Соединение 3-аминокарбазола по п.1, отличающееся тем, что определение для R1 и R2 дано в таблице 4. Фармацевтическая композиция для лечения или предотвращения воспалительных процессов, боли, жара, новообразований, болезни Альцгеймера и атеросклероза, отличающаяся тем, что содержит терапевтически эффективное количество соединения 3-аминокарбазола по любому из пп.1-3, его фармацевтически приемлемой соли или его сложного эфира вместе по крайней мере с одним фармацевтически приемлемым инертным носителем. 5. Способ получения соединения 3-аминокарбазола по любому из пп.1-3, отличающийся тем, что он включает в себя нижеследующие стадии: а) реакцию амина формулы (II)Z выбирают из группы, содержащей Cl, Br, ОН, OR и OC(O)R,где R представляет собой линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода,чтобы получить соединение 3-аминокарбазола формулы (I)b) необязательное образование фармацевтически приемлемой соли соединения формулы (I), полученного выше. 6. Применение соединения 3-аминокарбазола по любому из пп.1-3, его фармацевтически приемлемой соли или его сложного эфира для получения лекарственного средства для профилактического или терапевтического лечения расстройств, выбираемых из группы, содержащей воспалительные процессы,боль, жар, новообразования, болезнь Альцгеймера и атеросклероз. 7. Применение соединения 3-аминокарбазола по п.6, отличающееся тем, что указанные воспалительные процессы выбирают из группы, содержащей отек, эритему, суставной воспалительный процесс,ревматоидный артрит и артроз. 8. Применение соединения 3-аминокарбазола по п.6, отличающееся тем, что указанные новообразования выбирают из группы, содержащей колоректальную и легочную карциному и аденокарциному. 9. Способ лечения или предотвращения воспалительных процессов, боли, жара, новообразований,болезни Альцгеймера и атеросклероза у млекопитающих, включающий введение терапевтически эффективного количества соединения 3-аминокарбазола по любому из пп.1-3, его фармацевтически приемлемой соли или его сложного эфира больному, нуждающемуся в этом.
МПК / Метки
МПК: A61K 31/403, A61P 29/00, C07D 209/88
Метки: 3-аминокарбазола, получения, фармацевтическая, соединение, содержащая, способ, композиция
Код ссылки
<a href="https://eas.patents.su/15-19068-soedinenie-3-aminokarbazola-farmacevticheskaya-kompoziciya-ego-soderzhashhaya-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Соединение 3-аминокарбазола, фармацевтическая композиция, его содержащая, и способ их получения</a>
Предыдущий патент: Соединения 1,5-дифенилпирролидин-2-она как лиганды св-1
Случайный патент: Способ и устройство для обработки жидкости