Гетероциклические соединения, содержащие тетрагидропиридиновые или пиперидиновые группы, в качестве антагонистов рецепторов кортикотропин-рилизинг-фактора
Номер патента: 5289
Опубликовано: 30.12.2004
Авторы: Окубо Такетоси, Кумагаи Тосихито, Камео Казуя, Наказато Ацуро
Формула / Реферат
1. Тетрагидропиридино- или пиперидиногетероциклическое производное, представленное формулой [I]
A-Het [I],
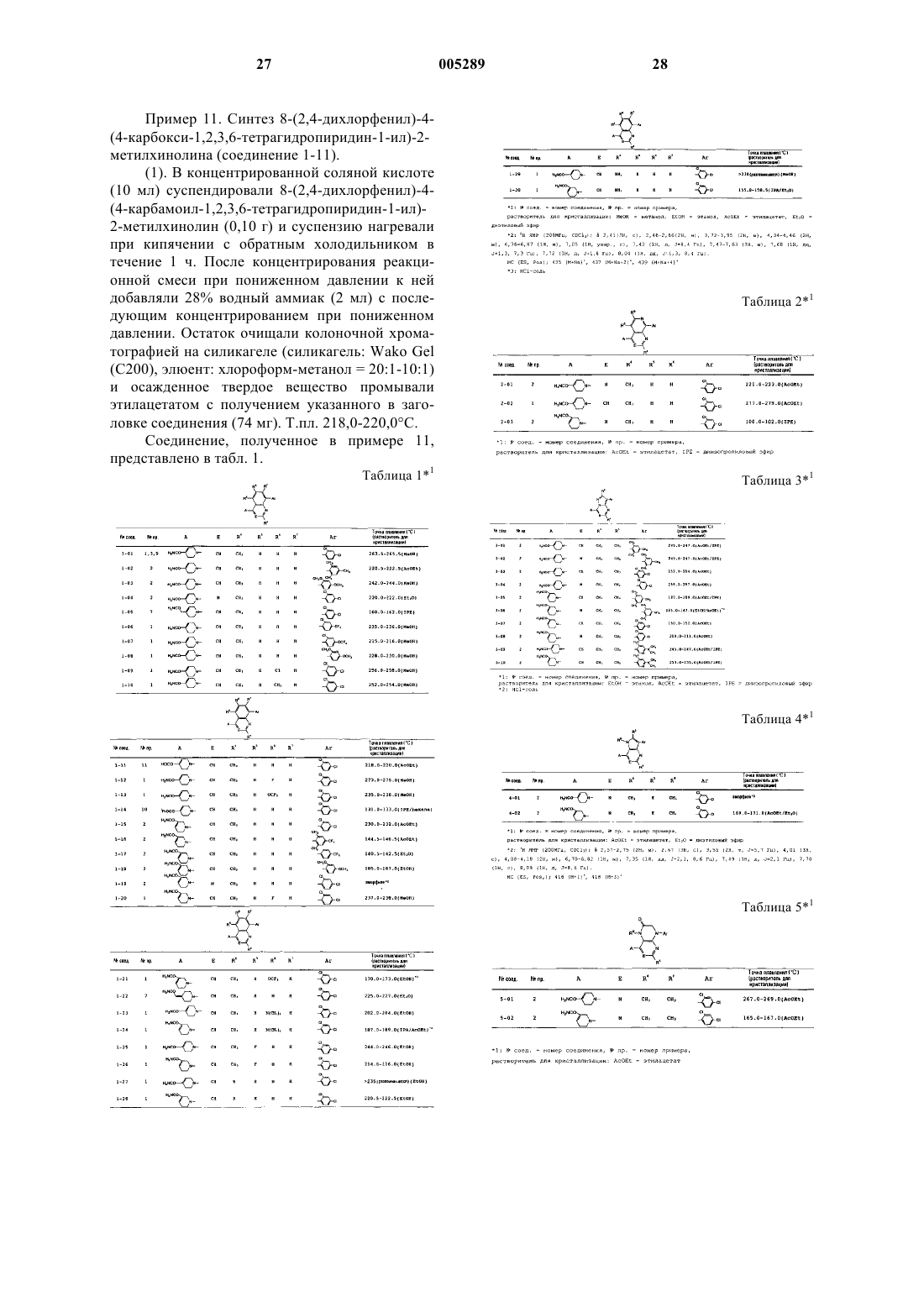
где A обозначает группу, представленную следующими формулами [II] или [III]:
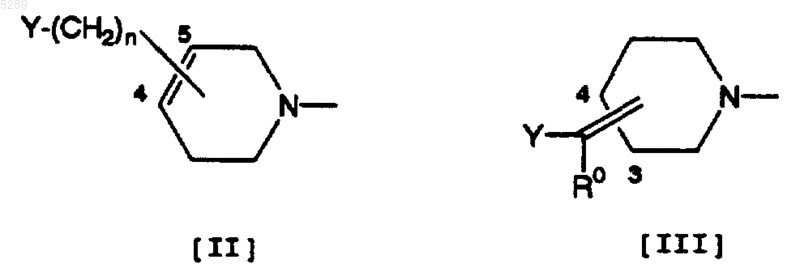
где группа Y-(CH2)n- формулы [II] находится в положении 4 или 5 и группа Y-C(R0)= формулы [III] находится в положении 3 или 4,
R0 обозначает атом водорода, C1-5алкильную группу, C3-8циклоалкильную группу или C3-8циклоалкил-C1-5алкильную группу,
n равно целому числу 0-5 и
Y обозначает цианогруппу, группу, представленную формулой -CONR1(R2) (где каждый из R1 и R2, которые могут быть одинаковыми или различными, обозначает атом водорода, C1-5алкильную группу, C3-8циклоалкильную группу, C3-8циклоалкил-C1-5алкильную группу, C1-5алкокси-C1-5алкильную группу, C3-8циклоалкилокси-C1-5алкильную группу или фенильную группу, или R1 и R2, взятые вместе с соседним атомом азота, представляют 5-8-членную насыщенную гетероциклическую группу, представленную формулой
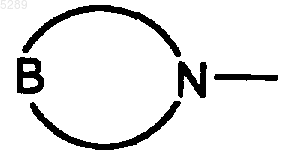
(где B обозначает CH2, NH, N-C1-5алкил, N-C3-8циклоалкил, N-C1-5алкил-C3-8циклоалкил, O или S)), или группу, представленную формулой -CO2R3 (где R3 обозначает атом водорода, C1-5алкильную группу, C3-8циклоалкильную группу, C3-8циклоалкил-C1-5алкильную группу, C1-5алкокси-C1-5алкильную группу, C3-8циклоалкилокси-C1-5алкильную группу или фенильную группу), и
Het обозначает любую из гетероциклических групп, представленных следующими формулами от формы (01) до формы (20):

где E обозначает CH или N,
R4 обозначает атом водорода, C1-5алкильную группу, C3-8циклоалкильную группу, C3-8циклоалкил-C1-5алкильную группу, гидроксильную группу, C1-5алкоксигруппу, C3-8циклоалкилоксигруппу или группу, представленную формулой -N(R10)R11 (где каждый из R10 и R11, которые могут быть одинаковыми или различными, обозначает атом водорода, C1-5алкильную группу, C3-8циклоалкильную группу или C3-8циклоалкил-C1-5алкильную группу),
каждый из R5, R6, R7 и R8, которые могут быть одинаковыми или различными, обозначает атом водорода, атом галогена, C1-5алкильную группу, C3-8циклоалкильную группу, C3-8циклоалкил-C1-5алкильную группу, гидроксильную группу, C1-5алкоксигруппу, C3-8циклоалкилоксигруппу или группу, представленную формулой -N(R12)R13 (где каждый из R12 и R13, которые могут быть одинаковыми или различными, обозначает атом водорода, C1-5алкильную группу, C3-8циклоалкильную группу или C3-8циклоалкил-C1-5алкильную группу), группу, представленную формулой -CO2R14 (где R14 обозначает атом водорода, C1-5алкильную группу, C3-8циклоалкильную группу, C3-8циклоалкил-C1-5алкильную группу, C1-5алкокси-C1-5алкильную группу, C3-8циклоалкилокси-C1-5алкильную группу или фенильную группу), цианогруппу, нитрогруппу, C1-5алкилтиогруппу, трифторметильную группу или трифторметоксигруппу,
R9 обозначает атом водорода, C1-5алкильную группу, C2-5алкалкенильную группу, C2-5алкинильную группу, C3-8циклоалкильную группу или C3-8циклоалкил-C1-5алкильную группу и
Ar обозначает арильную или гетероарильную группу, незамещенную или замещенную 1-3 заместителями, которые могут быть одинаковыми или различными и выбраны из атомов галогена, C1-5алкильных групп, C1-5алкоксигрупп, C1-5алкилтиогрупп, трифторметильной группы, трифторметоксигруппы и групп, представленных формулой -N(R15)R16 (где каждый из R15 и R16, которые могут быть одинаковыми или различными, обозначает атом водорода или C1-5алкильную группу); или его фармацевтически приемлемая соль или её гидрат.
2. Тетрагидропиридиногетероциклическое производное по п.1, которое имеет формулу [IV]
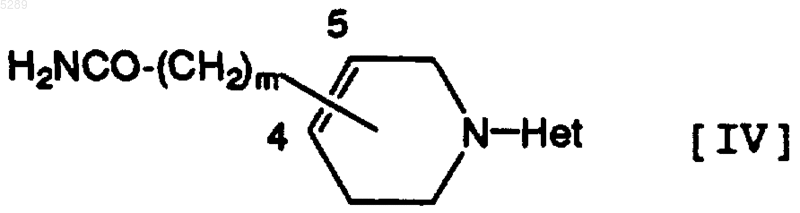
где Het имеет определенное выше значение и m равно 0 или 1, его фармацевтически приемлемая соль или её гидрат.
3. Тетрагидропиридиногетероциклическое производное по п.2, которое имеет формулу [V]
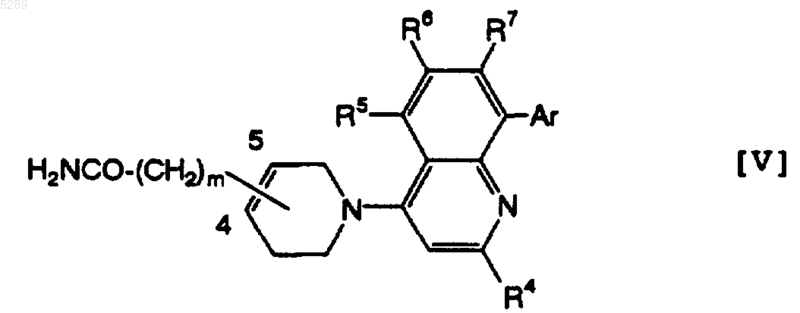
где R4, R5, R6, R7, Ar и m имеют определенные выше значения, его фармацевтически приемлемая соль или её гидрат.
4. Тетрагидропиридиногетероциклическое производное по п.3, где m в формуле (V) равно 0, его фармацевтически приемлемая соль или её гидрат.
5. Тетрагидропиридиногетероциклическое производное по п.4, которое имеет формулу [VI]
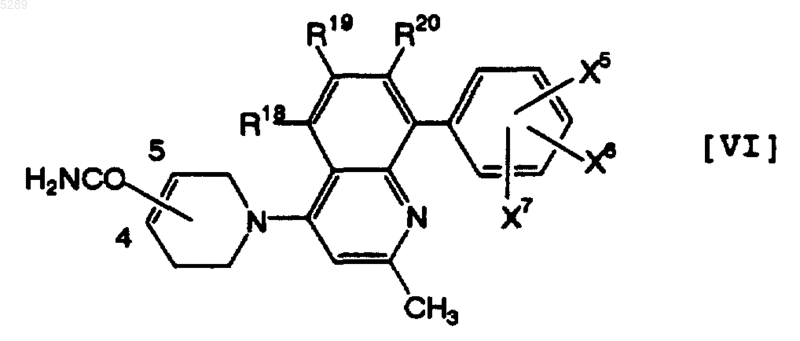
где каждый из R18, R19 и R20, которые могут быть одинаковыми или различными, обозначает атом водорода, метильную группу, атом фтора или атом хлора и каждый из X5, X6 и X7, которые могут быть одинаковыми или различными, обозначает атом водорода, метильную группу, атом хлора, трифторметильную группу или трифторметоксигруппу, его фармацевтически приемлемая соль или её гидрат.
6. Тетрагидропиридиногетероциклическое производное по п.5, которое имеет формулу [VII]

где R18, R19 и R20 имеют определенные выше значения и каждый из X8 и X9, которые могут быть одинаковыми или различными, обозначает атом хлора, трифторметильную группу или трифторметоксигруппу, его фармацевтически приемлемая соль или её гидрат.
7. Тетрагидропиридиногетероциклическое производное по п.6, которое имеет формулу [VIII]
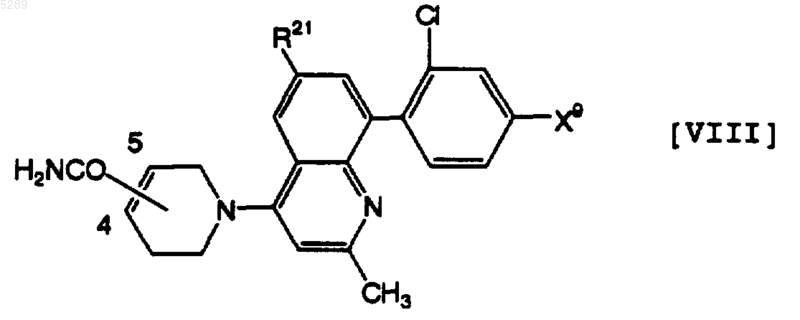
где X9 имеет определенное выше значение и R21 обозначает атом водорода, атом хлора или метильную группу, его фармацевтически приемлемая соль или её гидрат.
8. Тетрагидропиридиногетероциклическое производное по п.2, которое имеет формулу [IX]
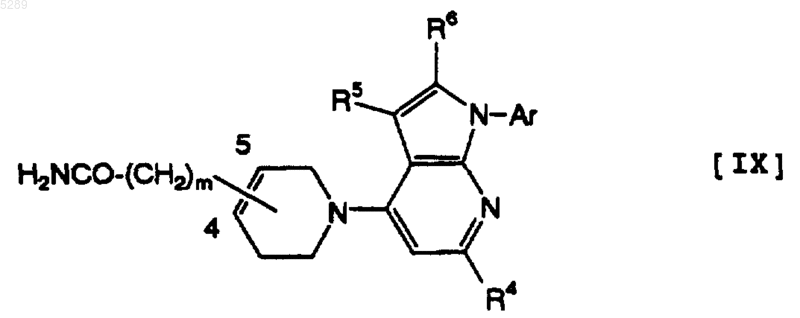
где R4, R5, R6, Ar и m имеют определенные выше значения.
9. Тетрагидропиридиногетероциклическое производное или его фармацевтически приемлемая соль или её гидрат по п.8, где m в формуле [IX] равно 0, его фармацевтически приемлемая соль или её гидрат.
10. Тетрагидропиридиногетероциклическое производное по п.9, которое имеет формулу [X]
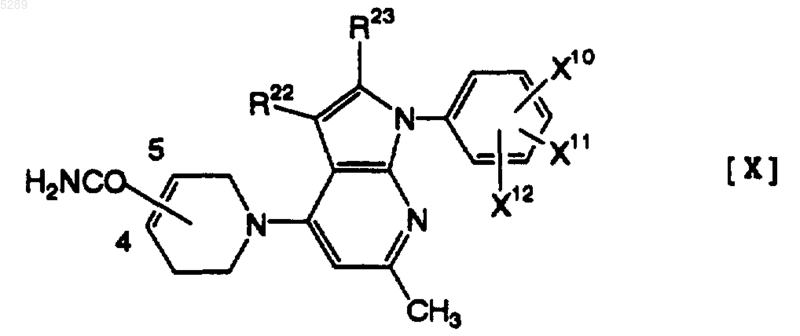
где каждый из R22 и R23, которые могут быть одинаковыми или различными, обозначает атом водорода или метильную группу и каждый из X10, X11 и X12, которые могут быть одинаковыми или различными, обозначает атом водорода, атом хлора, атом брома, метоксигруппу, метилтиогруппу или трифторметильную группу, его фармацевтически приемлемая соль или её гидрат.
11. Тетрагидропиридиногетероциклическое производное по п.9, которое имеет формулу [XI]
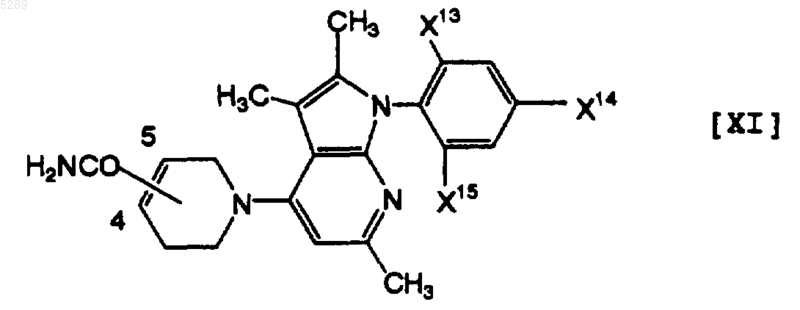
где X13 обозначает атом хлора или атом брома, X14 обозначает атом хлора, атом брома или трифторметильную группу и X15 обозначает атом водорода, атом хлора, атом брома, метоксигруппу, метилтиогруппу или трифторметильную группу, его фармацевтически приемлемая соль или её гидрат.
12. Антагонист против рецепторов КРФ, содержащий тетрагидропиридиногетероциклическое производное, его фармацевтически приемлемую соль или её гидрат, по любому из пп.1-11 в качестве активного ингредиента.
13. Применение тетрагидропиридиногетероциклического производного, его фармацевтически приемлемой соли или её гидрата по любому из пп.1-11 в качестве антагониста против рецепторов кортикотропин-рилизинг-фактора.
Текст
1 Область техники Данное изобретение относится к терапевтическому средству для лечения заболеваний, в которых, как полагают, участвует кортикотропин-рилизинг-фактор (КРФ) (фактор, способствующий высвобождению адренокортикотропного гормона), таких как депрессия, тревожность,болезнь Альцгеймера, болезнь Паркинсона, хорея Хантингтона, нарушение питания, гипертензия, желудочные заболевания, лекарственная зависимость, инфаркт мозга, ишемия мозга, отек мозга, наружная головная рана, воспаление, связанные с иммунитетом заболевания, алопеция и тому подобное. Предпосылки изобретения КРФ представляет собой гормон, содержащий 41 аминокислоту (Science, 213, 13941397, 1981 и J. Neurosci., 7, 88-100, 1987), и предполагается, что КРФ играет центральную роль в биологических реакциях против стрессовEndocrinol., 132, 723-729, 1994; и Neuroendocrinol. 61, 445-452, 1995). Для КРФ имеются два пути: путь, посредством которого КРФ действует на периферическую иммунную систему или симпатическую нервную систему через гипоталамо-гипофизарно-надпочечниковую систему, и путь, посредством которого КРФ действует в качестве нейромедиатора (нейротрансмиттера) в центральной нервной системе (в CorticotropinNeuropeptide, pp. 29-52, 1990). Интравентрикулярное введение КРФ в гипофизэктомированных крыс и нормальных крыс вызывает подобный тревожности синдром у обоих типов крысrev., 15, 71-100, 1990). То есть предполагается участие КРФ в гипоталамо-гипофизарнонадпочечниковой системе и пути, посредством которого КРФ действует в качестве нейромедиатора в центральной нервной системе. В обзоре Owens и Nemeroff в 1991 г. суммированы заболевания, в которых участвует КРФ (Pharmacol. Rev., 43, 425-474, 1991). А именно КРФ участвует в депрессии, тревожности, болезни Альцгеймера, болезни Паркинсона,хорее Хантингтона, нарушении питания, гипертензии, желудочных заболеваниях, лекарственной зависимости, воспалении, связанных с иммунитетом заболеваниях и тому подобное. Недавно сообщалось, что КРФ участвует также в эпилепсии, инфаркте мозга, ишемии мозга, отеке мозга и наружной головной ране (Brain Res. 545, 339-342, 1991; Ann. Neurol. 31, 48-498,1992; Dev. Brain Res. 91, 245-251, 1996 и BrainRes. 744, 166-170, 1997). Таким образом, антагонисты рецепторов КРФ могут использоваться в качестве терапевтических средств при описанных выше заболеваниях. Объектом данного изобретения является антагонист рецепторов КРФ, который является эффективным в качестве терапевтического или 2 профилактического средства при заболеваниях,в которых, как считается, участвует КРФ, таких как депрессия, тревожность, болезнь Альцгеймера, болезнь Паркинсона, хорея Хантингтона,нарушение питания, гипертензия, желудочные заболевания, лекарственная зависимость, эпилепсия, инфаркт мозга, ишемия мозга, отек мозга, наружная головная рана, воспаление, связанные с иммунитетом заболевания, алопеция и тому подобное. Описание изобретения Авторы данного изобретения серьезным образом исследовали тетрагидропиридино- или пиперидиногетероциклические производные и в результате нашли новые тетрагидропиридиноили пиперидиногетероциклические производные, имеющие высокую аффинность в отношении рецепторов КРФ, что и позволило представить данное изобретение. Данное изобретение объясняется подробно ниже. Данное изобретение относится к тетрагидропиридино- или пиперидиногетероциклическому производному, представленному следующей формулой [I]:[I] где А обозначает группу, представленную следующими формулами [II] или [III] где положением замещения радикалом Y(CH2)n-группы, представленной формулой [II],является положение 4 или 5, положением замещения радикалом Y-C(R0)=группы, представленной формулой [III], является положение 3 или 4,R0 обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу или С 3-8 циклоалкил-С 1-5 алкильную группу,n равно целому числу 0-5, иY обозначает цианогруппу, группу, представленную формулой CONR1(R2) (где каждый из R1 и R2, которые могут быть одинаковыми или различными, обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу,С 3-8 циклоалкил-С 1-5 алкильную группу, C1-5 алкокси-С 1-5 алкильную группу, С 3-8 циклоалкилокси-С 1-5 алкильную группу или фенильную группу, или R1 и R2, взятые вместе с соседним атомом азота, представляют собой 5-8-членную насыщенную гетероциклическую группу, представленную формулой-CO2R3 (где R3 обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу,С 3-8 циклоалкил-С 1-5 алкильную группу,С 1-5 алкокси-С 1-5 алкильную группу,С 3-8 циклоалкилокси-С 1-5 алкильную группу или фенильную группу), иHet обозначает любую из гетероциклических групп, представленных следующими формулами от формы (01) до формы (20): где Е обозначает СН или N,R4 обозначает атом водорода, C1-5 алкильную группу, С 3-8 циклоалкильную группу,С 3-8 циклоалкил-С 1-5 алкильную группу, гидроксильную группу, С 1-5 алкоксигруппу, С 3-8 циклоалкилоксигруппу или группу, представленную формулой N(R10)R11 (где каждый из R10 и R11, которые могут быть одинаковыми или различными, обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу или С 3-8 циклоалкил-С 1-5 алкильную группу),каждый из R5, R6, R7 и R8, которые могут быть одинаковыми или различными, обозначает атом водорода, атом галогена, C1-5 алкильную группу, С 3-8 циклоалкильную группу, С 3-8 циклоалкил-С 1-5 алкильную группу, гидроксильную группу, С 1-5 алкоксигруппу, С 3-8 циклоалкилоксигруппу или группу, представленную формулой N(R12)R13 (где каждый из R12 и R13,которые могут быть одинаковыми или различными, обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу или С 3-8 4 циклоалкил-С 1-5 алкильную группу), группу,представленную формулой CO2R14 (где R14 обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу, С 3-8 циклоалкил-С 1-5 алкильную группу, С 1-5 алкокси-С 1-5 алкильную группу, С 3-8 циклоалкилокси-С 1-5 алкильную группу или фенильную группу),цианогруппу, нитрогруппу, С 1-5 алкилтиогруппу,трифторметильную группу или трифторметоксигруппу,R9 обозначает атом водорода, С 1-5 алкильную группу, С 1-5 алкалкенильную группу,С 2-5 алкинильную группу, С 3-8 циклоалкильную группу или С 3-8 циклоалкил-С 1-5 алкильную группу, и Аr обозначает арильную или гетероарильную группу, незамещенную или замещенную 13 заместителями, которые могут быть одинаковыми или различными и выбраны из атомов галогена, C1-5 алкильных групп, С 1-5 алкоксигрупп, С 1-5 алкилтиогрупп, трифторметильной группы, трифторметоксигруппы и групп, представленных формулой -N(R15)R16 (где каждый изR15 и R16, которые могут быть одинаковыми или различными, обозначает атом водорода или С 1-5 алкильную группу); или его фармацевтически приемлемую соль или ее гидрат. Термины, используемые в данном описании, имеют следующие значения. Термин С 1-5 алкильная группа обозначает имеющую прямую или разветвленную цепь алкильную группу, состоящую из 1-5 атомов углерода, такую как метил, этил, пропил, изопропил,бутил, изобутил, трет-бутил, пентил, изопентил или тому подобное. Термин "С 2-5 алкенильная группа" обозначает имеющую прямую или разветвленную цепь алкенильную группу, состоящую из 2-5 атомов углерода, такую как винил,1-пропенил, 2-пропенил, 1-метилвинил или тому подобное. Термин "С 2-5 алкинильная группа" обозначает имеющую прямую или разветвленную цепь алкинильную группу, состоящую из 25 атомов углерода, такую как этинил, 2 пропинил или тому подобное. Термин С 3-8 циклоалкильная группа обозначает циклическую алкильную группу, состоящую из 3-8 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или тому подобное. Термин С 3-8 циклоалкилС 1-5 алкильная группа обозначает замещеннуюC1-5 алкильную группу, имеющую вышеуказанную С 3-8 циклоалкильную группу в качестве заместителя, например, циклопропилметил, циклопропилэтил, циклопентилэтил или тому подобное. Для В термин N-С 1-5 алкил обозначает группу, имеющую C1-5 алкильную группу в качестве заместителя у атома азота. Термин N-С 3-8 циклоалкил обозначает группу, имеющую С 3-8 циклоалкильную группу в качестве заместителя у атома азота. Термин N-С 1-5 алкил-С 3-8 циклоалкил обозначает группу, имеющую С 3-8 циклоалкил-С 1-5 алкильную группу в качестве заместителя у атома азота. Термин атом галогена обозначает атом фтора, атом хлора, атом брома или атом йода. Термин С 1-5 алкоксигруппа" обозначает имеющую прямую или разветвленную цепь алкоксигруппу, состоящую из 1-5 атомов углерода, такую как метокси, этокси, пропокси, изопропилокси, бутокси, изобутилокси, пентилокси, изопентилокси или тому подобное. Термин "С 3-8 циклоалкилоксигруппа" обозначает циклическую алкоксигруппу, состоящую из 3-8 атомов углерода, такую как циклопропилокси, циклобутилокси, циклопентилокси или тому подобное. Термин "С 1-5 алкокси-С 1-5 алкильная группа" обозначает замещенную С 1-5 алкильную группу,имеющую C1-5 алкоксигруппу в качестве заместителя, такую как метоксиметил, 2-этоксиэтил или тому подобное. Термин "С 3-8 циклоалкилокси-С 1-5 алкильная группа" обозначает замещенную С 1-5 алкильную группу, имеющую С 3-8 циклоалкильную группу в качестве заместителя, такую как циклопропилоксиметил, 2 циклопропилоксиэтил или тому подобное. Термин "С 1-5 алкилтиогруппа" обозначает имеющую прямую цепь или разветвленную цепь алкилтиогруппу, состоящую из 1-5 атомов углерода,такую как метилтио, этилтио, пропилтио или тому подобное. Термин "арильная группа" обозначает фенильную группу, нафтильную группу или тому подобное. Термин "гетероарильная группа" обозначает гетероциклическую группу, содержащую в кольце 1-4 атома, которые могут быть одинаковыми или различными и выбраны из азота, кислорода и серы, такую как пиридил,хинолил, индолил, бензофуранил, бензотиадиазолил, бензофуразанил, хиноксалинил или тому подобное. Таким образом, замещенная арильная или гетероарильная группа включает в себя,например, 2,4,6-триметилфенильную группу,2,4,6-трибромфенильную группу, 2,4-дибром-6 хлорфенильную группу, 2,4-дихлорфенильную группу, 2,4,6-трихлорфенильную группу, 2 метил-4-метоксифенильную группу,2,4 дибром-6-фторфенильную группу, 2,4-дибром 6-метилфенильную группу,2,4-дибром-6 метоксифенильную группу,2,4-дибром-6 метилтиофенильную группу, 2,6-дибром-4 изопропилфенильную группу, 2,6-дибром-4 трифторметилфенильную группу, 2-хлор-4 трифторметилфенильную группу, 2-хлор-4 трифторметоксифенильную группу, 6-диметиламино-4-метилпиридин-3-ильную группу, 2 хлор-6-трифторметилпиридин-3-ильную группу,2-хлор-6-трифторметоксипиридин-3-ильную группу,2-хлор-6-метоксипиридин-3-ильную группу, 2-трифторметил-6-метоксипиридин-3 ильную группу, 2-хлор-6-дифторметилпиридин 3-ильную группу, 2-метил-6-метоксипиридин-3 005289 6 ильную группу,2,6-диметоксипиридин-3 ильную группу, 5,7-диметил-2,1,3-бензотиадиазол-4-ильную группу, 5,7-диметилбензофуран-4-ильную группу, 6,8-диметилхиноксалин 5-ильную группу, 5,7-дихлор-2,1,3-бензотиадиазол-4-ильную группу, 5,7-дихлорбензофуразан-4-ильную группу и 6,6-дихлорхиноксалин-5 ильную группу. Фармацевтически приемлемая соль в данном изобретении включает в себя, например,соли с неорганической кислотой, такой как серная кислота, соляная кислота, фосфорная кислота или тому подобное; соли с органической кислотой, такой как уксусная кислота, щавелевая кислота, молочная кислота, винная кислота, фумаровая кислота, малеиновая кислота, лимонная кислота, бензолсульфоновая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота или тому подобное; и соли с ионом металла, таким как ион лития, ион натрия, ион калия,ион кальция, ион магния, ион цинка или тому подобное. Предпочтительными примерами соединения по данному изобретению являются следующие. А именно, предпочтительными являются соединения формулы [I], в которых А является группой, представленной формулой [II]. Более предпочтительными являются соединения формулы [I], в которых А является группой, представленной формулой [II], Y обозначает карбамоильную группу и n равно 0 или 1. Кроме того,предпочтительными являются соединения формулы [I], в которых Het является гетероциклической группой, представленной формой (01) или формой (12). Более предпочтительными являются соединения формулы [I], в которыхHet является гетероциклической группой, представленной формой (01) или формой (12), и Ar является фенильной группой, имеющей два или три заместителя, которые могут быть одинаковыми или различными и выбраны из атомов галогена, С 1-5 алкильных групп, С 1-5 алкоксигрупп, С 1-5 алкилтиогрупп, трифторметильной группы и трифторметоксигруппы. Еще более предпочтительными являются соединения формулы [I], в которых Het является гетероциклической группой, представленной формой (01) или формой (12), и Ar является фенильной группой, имеющей два или три заместителя,которые могут быть одинаковыми или различными и выбраны из атома хлора, трифторметильной группы и трифторметоксигруппы. Соединение формулы [I] может быть получено, например, любым из способов, показанных на следующих схемах реакций 1-7 (на следующих схемах реакций A, Het, R1, R2, R3, R4,R5, R6 и R7 имеют определенные выше значения,R17 обозначает С 1-5 алкильную группу или фенильную группу, а X4 обозначает атом хлора,атом брома, атом иода, метансульфонилоксигруппу, бензолсульфонилоксигруппу, толуол 7 сульфонилоксигруппу или трифторметансульфонилоксигруппу). Схема реакций 1 Стадия 1. Соединение (2) может быть получено галогенированием или сульфированием гидроксильной группы соединения (1). Здесь галогенирование обозначает реакцию с галогенирующим реагентом, таким как оксихлорид фосфора, пентахлорид фосфора, сульфурилхлорид, тионилхлорид, тионилбромид, оксалилхлорид или тому подобное, в присутствии или в отсутствие, например, N,N-диметиланилина или N,N-диэтиланилина, без растворителя или в инертном растворителе, таком как углеводород (например,бензол и толуол), или галогенсодержащем растворителе (например, хлороформе и дихлорметане). Сульфирование обозначает реакцию с сульфирующим реагентом, таким как метансульфонилхлорид, п-толуолсульфонилхлорид,ангидрид трифторметансульфоновой кислоты,N-фенилбис(трифторметансульфонимид) или тому подобное, в присутствии или в отсутствие основания в инертном растворителе, таком как простой эфир (например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан), углеводород (например, бензол или толуол), амид (например, N,N-диметилформамид иN-метилпирролидон), ацетонитрил, диметилсульфоксид, пиридин или смесь растворителей,выбранных из этих инертных растворителей. Здесь основание включает в себя, например,органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, 1,8 диазабицикло[5.4.0]-7-ундецен и тому подобное; и неорганические основания, такие как гидрид натрия, гидрид калия, карбонат натрия,карбонат калия, гидрокарбонат натрия, амид натрия и тому подобное. Стадия 2. Соединение (3), соединение по данному изобретению, может быть получено взаимодействием соединения (2) с соединением (4) в инертном растворителе в присутствии или в отсутствие основания. Здесь основание включает в себя, например, амины, такие как триэтиламин, диизопропилэтиламин, пиридин и тому подобное; неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия,гидрокарбонат калия, гидроксид натрия, гидроксид бария, гидрид натрия и тому подобное; алкоголяты металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия и тому подобное; амиды металлов, такие как амид натрия, диизопропиламид лития и тому подобное; и реагенты Гриньяра, такие как метилмагнийбромид и тому подобное. Инертный раство 005289 8 ритель включает в себя, например, спирты, такие как метанол, этанол, изопропиловый спирт,этиленгликоль и тому подобное; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и тому подобное; углеводороды, такие как бензол, толуол и тому подобное; амиды, такие как N,Nдиметилформамид, N-метилпирролидон и тому подобное; ацетонитрил; диметилсульфоксид; пиридин; воду и смеси растворителей, выбранных из указанных инертных растворителей. Соединение (9) по данному изобретению может быть синтезировано также в соответствии со следующей схемой реакций 2. Схема реакций 2 Стадия 3. Соединение (6) может быть получено взаимодействием соединения (2) с соединением(5) в инертном растворителе в присутствии или в отсутствие основания. Здесь основание включает в себя, например, амины, такие как триэтиламин, диизопропилэтиламин, пиридин и тому подобное; неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия,гидроксид бария, гидрид натрия и тому подобное; алкоголяты металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия и тому подобное; амиды металлов, такие как амид натрия, диизопропиламид лития и тому подобное; и реагенты Гриньяра, такие как метилмагнийбромид и тому подобное. Инертный растворитель включает в себя, например, спирты, такие как метанол, этанол, изопропиловый спирт,этиленгликоль и тому подобное; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и тому подобное; углеводороды, такие как бензол, толуол и тому подобное; амиды, такие как N,Nдиметилформамид, N-метилпирролидон и тому подобное; ацетонитрил; диметилсульфоксид; пиридин; воду и смеси растворителей, выбранных из этих инертных растворителей. Стадия 4. Соединение (6) может быть преобразовано в соединение (7) удалением ацетальной защитной группы у соединения (6) обычным гидролизом в кислых условиях (см. Theodora W. Greeneand Peter G.W. Wuts "Protective Groups in Organic Synthesis"). Стадия 5. Соединение (7) может быть преобразовано в соединение (8) взаимодействием соединения(7) в присутствии цианирующего агента, такого как цианид натрия, цианид калия, триметилсилилцианид или тому подобное, в инертном растворителе, таком как спирт (например, метанол,этанол, изопропиловый спирт и этиленгликоль),простой эфир (например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан), ацетонитрил, уксусная кислота, вода или смесь растворителей, выбранных из этих инертных растворителей; и затем реакцией продукта цианирования, например, с оксихлоридом фосфора, тионилхлоридом, метансульфонилхлоридом, п-толуолсульфонилхлоридом или трифторуксусным ангидридом в присутствии или в отсутствие органического основания, такого как пиридин, триэтиламин или диизопропилэтиламин, в инертном растворителе, таком как галогенсодержащий растворитель (например, дихлорметан и хлороформ), простой эфир (например, диэтиловый эфир, тетрагидрофуран, 1,4 диоксан и 1,2-диметоксиэтан), углеводород (например, бензол и толуол) или тому подобное. Стадия 6. Соединение (8) может быть преобразовано в соединение (9) по данному изобретению взаимодействием цианогруппы соединения (8) с использованием, например, серной кислоты, хлорида водорода и муравьиной кислоты, отдельно или в комбинации из двух или более, в инертном растворителе, таком как галогенсодержащий растворитель (например, дихлорметан и хлороформ), простой эфир (например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и 1,2 диметоксиэтан), углеводород (например, бензол и толуол), воде или смеси растворителей, выбранных из этих инертных растворителей. Кроме того, в соответствии со следующей схемой реакций 3 соединение (10) и соединение(17) по данному изобретению также могут быть получены. Схема реакций 3 Стадия 7. Соединение (7) может быть преобразовано в соединение (13) взаимодействием соединения(7) либо с соединением (11), либо с соединением (12) в инертном растворителе в присутствии или в отстутствие основания. Здесь основание включает в себя, например, гидрид натрия, гид 005289 10 рид калия, метоксид натрия, трет-бутоксид калия, н-бутиллитий, бис(триметилсилил)амид лития, амид натрия и карбонат натрия. Если необходимо, в качестве добавки могут быть использованы 18-краун-6-эфир, 15-краун-5-эфир,тетраметилэтилендиамин, гексаметилфосфорамид и тому подобное. Инертный растворитель включает в себя, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,2 диметоксиэтан и тому подобное; углеводороды,такие как бензол, толуол и тому подобное; спирты, такие как этанол, метанол и тому подобное; амиды, такие как N,N-диметилформамид, N-метилпирролидон и тому подобное; тетраметилмочевину; диметилсульфоксид; воду и смеси растворителей, выбранных из этих инертных растворителей. Стадия 8. Когда R3 соединения (13) является группой другой, чем атом водорода, соединение (13) может быть преобразовано в соединение (14) по данному изобретению обычным гидролизом сложноэфирной части в кислотных или щелочных условиях (см. Theodora W. Greene and PeterG.W. Wuts "Protective Groups in Organic Synthesis"). Стадия 9. Соединение (10) может быть получено амидированием соединения (14). Здесь амидирование означает обычное амидирование карбоксильной группы и относится к любой из следующих реакций: реакции соединения (15) со смешанным ангидридом карбоновой кислоты,полученным взаимодействием соединения (14) с эфиром галогенмуравьиной кислоты (например,этилхлорформиатом и изобутилхлорформиатом) или галогенангидридом (например, бензоилхлоридом и пивалоилхлоридом), в присутствии основания, такого как N-метилморфолин, триэтиламин или тому подобное; реакции соединения(DPPA), диэтилцианофосфат или тому подобное, и необязательно добавки, такой как 1 гидроксибензотриазол (HOBt), N-гидроксисукцинимид, 4-диметиламинопиридин или тому подобное; и реакции соединения (15) с галогенангидридом, полученным взаимодействием соединения (14) с галогенирующим реагентом,таким как тионилхлорид, оксалилхлорид, тетрабромид углерода-трифенилфосфин или тому подобное. Стадия 10. Соединение (13) может быть преобразовано в соединение (16) взаимодействием соединения (13) в присутствии кислоты или основания в инертном растворителе. Здесь кислота включает в себя, например, неорганические кислоты, такие как хлористо-водородная кислота, 11 бромисто-водородная кислота, серная кислота и тому подобное; и органические кислоты, такие как уксусная кислота, трифторуксусная кислота,п-толуолсульфоновая кислота и тому подобное. Основание включает в себя неорганические основания, такие как гидроксид натрия, гидроксид калия, карбонат калия и тому подобное. Инертный растворитель включает в себя, например,простые эфиры, такие как диэтиловый эфир,тетрагидрофуран, 1,2-диметоксиэтан и тому подобное; углеводороды, такие как бензол, толуол и тому подобное; спирты, такие как этанол,метанол и тому подобное; амиды, такие какN,N-диметилформамид, N-метилпирролидон и тому подобное; тетраметилмочевину; диметилсульфоксид; воду; ацетон и смеси растворителей, выбранных из этих инертных растворителей. Когда R3 является группой другой, чем атом водорода, применение растворителя для реакции, состоящего только из воды или смеси воды и одного или нескольких других растворителей, позволяет проводить одновременно преобразование R3 в атом водорода и преобразование соединения (13) в соединение (16). Стадия 11. Когда R3 является группой другой, чем атом водорода, R3 преобразуют в атом водорода тем же самым методом, что и на стадии 8, после чего соединение (17) по данному изобретению может быть получено посредством той же самой реакции, что и на стадии 9. Соединения (22), (23) и (24) могут быть синтезированы также в соответствии со следующей схемой реакции 4. Схема реакций 4 Стадия 12. Соединение (20) может быть получено взаимодействием соединения (18) с соединением (19) в инертном растворителе в присутствии основания. Здесь инертный растворитель включает в себя, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,2 диметоксиэтан и тому подобное; углеводороды,такие как бензол, толуол и тому подобное; спирты, такие как этанол, метанол и тому подобное; амиды, такие как N,N-диметилформамид, N-метилпирролидон и тому подобное; тетраметилмочевину; диметилсульфоксид; и смеси растворителей, выбранных из этих инертных растворителей. Основание включает в себя, например, амины, такие как триэтиламин,диизопропилэтиламин, пиридин и тому подоб 005289 12 ное; неорганические основания, такие как гидрид натрия, гидрид калия, карбонат натрия и тому подобное; алкоголяты металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид натрия и тому подобное; алкилметаллы, такие как н-бутиллитий, трет-бутиллитий, фениллитий и тому подобное; и амиды металлов, такие как литийдиизопропиламид, литий-бис(триметилсилил)амид, амид натрия и тому подобное. Стадия 13. Соединение (20) может быть преобразовано в соединение (21) восстановлением кетонной части, представленным гидридным восстановлением с использованием боргидрида натрия и гидрированием (см. Ahmed F. Abdel-Magid "Reduction in Organic Synthesis"). Стадия 14. Соединение (21) может быть преобразовано в соединение (22) взаимодействием соединения (21), например, с оксихлоридом фосфора,тионилхлоридом, метансульфонилхлоридом, птолуолсульфонилхлоридом или трифторуксусным ангидридом, в присутствии или в отсутствие органического основания, такого как пиридин, 4-диметиламинопиридин, триэтиламин,диизопропилэтиламин, 1,8-диазабицикло[5.4.0]7-ундецен или тому подобное, в инертном растворителе, таком как галогенсодержащий растворитель (например, дихлорметан и хлороформ), простой эфир (например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и 1,2 диметоксиэтан), углеводород (например, бензол и толуол) или тому подобное, или взаимодействием соединения (21), например, с серной кислотой, трифторуксусной кислотой или муравьиной кислотой в инертном растворителе, таком как галогенсодержащий растворитель (например, дихлорметан и хлороформ), простой эфир(например, бензол и толуол) или тому подобное. Стадия 15. Соединение (22) может быть преобразовано в соединение (23) по данному изобретению преобразованием сложноэфирной группы соединения (22) в карбоксильную группу тем же методом, что и на стадии 8. Стадия 16. Соединение (23) может быть преобразовано в соединение (24) по данному изобретению реакцией соединения (23) с соединением (15) тем же методом, что и на стадии 9. Соединение (29) по данному изобретению может быть синтезировано также в соответствии со следующей схемой реакций 5. Стадия 17. Соединение (26) может быть получено галогенированием или сульфонилированием гидроксильной группы соединения (25) тем же способом, который описан для стадии 1, и затем взаимодействием продукта галогенирования или сульфонилирования с соединением (5) в инертном растворителе в присутствии или в отсутствие основания. Здесь основание включает в себя, например, органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]-7-ундецен или тому подобное; и неорганические основания, такие как гидрид натрия, гидрид калия, карбонат натрия, карбонат калия, гидрокарбонат натрия,амид натрия и тому подобное. Инертный растворитель включает в себя, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан, углеводороды, такие как бензол и толуол; амиды,такие как N,N-диметилформамид, N-метилпирролидон и тому подобное; ацетонитрил; диметилсульфоксид; пиридин; и смеси растворителей, выбранных из этих инертных растворителей. Стадия 18. Соединение (26) может быть преобразовано в соединение (28) взаимодействием соединения (26) с производным арилборной кислоты(27) в инертном растворителе в присутствии основания, комплекса палладия с валентностью 0 (например, тетракис(трифенилфосфин)палладия и тетракис(трибутилфосфин)палладия) или комплекса двухвалентного палладия (например,ацетата палладия и хлорида палладия) и необязательно фосфина (например, трифенилфосфина и трибутилфосфина). Здесь основание включает в себя, например, неорганические основания,такие как карбонат натрия, гидрокарбонат натрия, карбонат калия, гидроксид бария, гидроксид натрия и тому подобное; и органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, 4-диметиламинопиридин и тому подобное. Инертный растворитель включает в себя, например, галогенсодержащие растворители, такие как дихлорметан, хлороформ и тому подобное; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4 диоксан и 1,2-диметоксиэтан, углеводороды,такие как бензол, толуол и тому подобное; 14 спирты, такие как метанол, этанол и тому подобное; воду; и смеси растворителей, выбранных из этих инертных растворителей. Стадия 19, стадия 20 и стадия 21. Соединение (29) по данному изобретению может быть получено проведением стадии 19,стадии 20 и стадии 21 таким же образом, как описано для стадии 4, стадии 5 и стадии 6 соответственно. Согласно следующей схеме реакций 6 также может быть синтезировано соединение Стадия 22. Соединение (31) может быть получено галогенированием или сульфонилированием гидроксильной группы соединения (25) тем же способом, что и на стадии 1, и затем взаимодействием продукта галогенирования или сульфонилирования с соединением (4) в инертном растворителе в присутствии или в отсутствие основания. Здесь основание включает в себя органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]-7-ундецен и тому подобное; и неорганические основания, такие как гидрид натрия,гидрид калия, карбонат натрия, карбонат калия,гидрокарбонат натрия, амид натрия и тому подобное. Инертный растворитель включает в себя, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан, углеводороды, такие как бензол, толуол и тому подобное; амиды, такие как N,N-диметилформамид, N-метилпирролидон и тому подобное; ацетонитрил; диметилсульфоксид; пиридин; и смеси растворителей,выбранных из этих инертных растворителей. Стадия 23. Соединение (32) по данному изобретению может быть получено тем же самым способом,что описан для стадии 18. В соответствии со следующей схемой реакций 7 также могут быть синтезированы соединения (33), (34) и (35) по данному изобретению. Схема реакций 7 Стадия 24. Соединения (33) и (34) по данному изобретению могут быть преобразованы друг в друга обычными способами введения защитных групп и удалением защитных групп у сложноэфирного радикала и радикала карбоновой кислоты (см.Theodora W. Greene and Peter G.W. Wuts "Protective Groups in Organic Synthesis"). Стадия 25. Соединение (34) по данному изобретению может быть преобразовано в соединение (35) по данному изобретению обычным амидированием таким же образом, как на стадии 9. Соединение(35) может быть преобразовано в соединение(34) преобразованием амидной группы соединения (35) в карбоновую кислоту обычным гидролизом (см. Theodora W. Greene and Peter G.W.Wuts "Protective Groups in Organic Synthesis"). Соединение по данному изобретению может использоваться в качестве терапевтического или профилактического средства для заболеваний, в которых, как считается, участвует КРФ. Для этой цели соединение по данному изобретению может быть приготовлено в виде таблеток, пилюль, капсул, гранул, порошков, растворов, эмульсий, суспензий, инъекционных растворов и тому подобное известными способами приготовления с добавлением известных наполнителей, связывающих веществ, разрыхлителей,рН-корректирующих агентов, растворителей и тому подобное. Соединение по данному изобретению может вводиться взрослому пациенту в дозе 0,1500 мг в день в виде одной порции или нескольких порций, перорально или парентерально. Доза может быть подходящим образом увеличена или уменьшена в зависимости от типа заболевания и возраста, массы тела и состояния пациента. Наилучший способ осуществления изобретения Данное изобретение конкретно представлено в следующих примерах и примерах исследований, но не ограничивается ими. Пример 1. Синтез 8-(2,4-дихлорфенил)-4(4-карбамоил-1,2,3,6-тетрагидропиридин-1-ил)2-метилхинолина (соединение 1-01). 60% Гидрид натрия (масляная дисперсия)(79 мг) промывали гексаном и затем суспендировали в N,N-диметилформамиде (3 мл), суспензию охлаждали на льду. К охлажденной суспензии добавляли 8-(2,4-дихлорфенил)-2-метил 4-гидроксихинолин (500 мг) одной порцией и полученную смесь перемешивали при охлаждении на льду в течение 10 мин и затем при комнатной температуре еще в течение 30 мин. К полученному таким образом раствору добавляли(703 мг) одной порцией и полученную смесь перемешивали при комнатной температуре в течение 30 мин. К полученной реакционной смеси добавляли гидрокарбонат натрия (413 мг) и гидрохлорид 4-карбамоил-1,2,3,6-тетрагидропиридина (533 мг) и полученную смесь интенсивно перемешивали при 120 С в течение 1 ч. Полученную таким образом реакционную смесь охлаждали до комнатной температуры и 16 затем разделяли хлороформом и водой. Водный слой экстрагировали хлороформом, а объединенный органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (С 200),элюент: хлороформ-метанол = 10:1), и полученные таким образом кристаллы промывали метанолом и затем тетрагидрофураном с получением указанного в заголовке соединения (156 мг). Т.пл. 263,5-265,5 С. Соединение, полученное в примере 1, и соединения, полученные в соответствии с той же самой процедурой, что и описанная в примере 1,представлены в табл. 1, 2, 7, 17 и 18. Пример 2. Синтез 8-(2,4-дихлорфенил)-4(5-карбамоил-1,2,3,6-тетрагидропиридин-1-ил)2-метилхинолина (соединение 1-15).(1). При кипячении с обратным холодильником нагревали 8-(2,4-дихлорфенил)-2-метил 4-гидроксихинолин (2,0 г) в оксихлориде фосфора (5 мл) в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и осторожно выливали в смесь воды со льдом и полученную смесь разделяли насыщенным водным раствором гидрокарбоната натрия и этилацетатом. Органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении с получением твердого вещества (2,1 г).(2). Смеси твердого вещества (200 мг), полученного в (1), гидрохлорида 5-карбамоил 1,2,3,6-тетрагидропиридина (121 мг), диизопропилэтиламина (240 мг) и смеси этанол (1 мл)вода (0,075 мл) давали реагировать в запаянной пробирке при 80 С в течение 10 дней. Реакционную смесь охлаждали до комнатной температуры, выливали в насыщенный водный раствор гидрокарбоната натрия и затем экстрагировали три раза хлороформом. Объединенный органический слой сушили над безводным сульфатом натрия, после чего фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: хлороформметанол = 10:1) и затем кристаллизовали из этилацетата с получением указанного в заголовке соединения (159 мг). Т. пл. 230,0-232,0 С. Соединение, полученное в примере 2, и соединения, полученные тем же самым способом,что описан в примере 2, представлены в табл. 1,2, 3-11, 13, 16, 19 и 20. Пример 3. Синтез 8-(2,4-дихлорфенил)-4(4-карбамоил-1,2,3,6-тетрагидропиридин-1-ил)2-метилхинолина (соединение 1-01).(1). 4-Хлор-8-(2,4-дихлорфенил)-2-метилхинолин (3,3 г), полученный тем же самым способом, что описан в примере 2, (1), и 4 пиперидонэтиленкеталь (7,5 г) в N,N-диметил 17 формамиде (50 мл) перемешивали при 120 С в течение 2 ч и затем при 150 С в течение 2 ч и полученную смесь нагревали с обратным холодильником при кипячении в течение 3,5 ч. Растворитель отгоняли при пониженном давлении,после чего к остатку добавляли воду и насыщенный водный раствор гидрокарбоната натрия и осажденное твердое вещество собирали фильтрованием. Полученное твердое вещество очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: хлороформ-метанол = 10:1) с получением 8-(2,4 дихлорфенил)-4-(1,4-диокса-8-азаспиро[4.5]дец 8-ил)-2-метилхинолина (3,2 г). Т. пл. 179,5181,5 С.(2). В смеси 1 М хлористо-водородной кислоты (30 мл) и тетрагидрофурана (15 мл) 8(2,4-дихлорфенил)-4-(1,4-диокса-8-азаспиро[4.5] дец-8-ил)-2-метилхинолин (3,2 г) перемешивали при комнатной температуре в течение 2 ч и затем при 70 С в течение 5,5 ч. Тетрагидрофуран отгоняли при пониженном давлении и остаток обрабатывали до щелочной реакции 41% водным раствором гидроксида натрия при охлаждении на льду и экстрагировали три раза этилацетатом. Органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в смеси этанол (12,5 мл) хлороформ (6 мл) и к раствору добавляли цианид калия (5,4 г). К полученной таким образом смеси добавляли уксусную кислоту (4,4 мл) при охлаждении на льду в течение 10 мин и полученную смесь перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь разделяли этилацетатом и насыщенным водным раствором гидрокарбоната натрия и органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в пиридине (15 мл) и к раствору добавляли оксихлорид фосфора (7,5 мл) при охлаждении на льду. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч и затем осторожно выливали в смесь воды со льдом. Обработанную таким образом реакционную смесь экстрагировали три раза смешанным растворителем из хлороформа и метанола и объединенный органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: гексанэтилацетат = 5:1) и затем кристаллизовали из диизопропилового эфира с получением 8-(2,4 дихлорфенил)-2-метил-4-(4-циано-1,2,3,6-тетрагидропиридин-1-ил)хинолина (1,0 г). Т.пл. 177,5-179,5 С.(1,0 г) и газообразный хлорид водорода барботировали в этот раствор при охлаждении на льду для насыщения им раствора. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч и затем перегоняли при пониженном давлении для удаления растворителя. Остаток разделяли хлороформом и насыщенным водным раствором гидрокарбоната натрия и органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: хлороформметанол = 10:1) и затем перекристаллизовывали из тетрагидрофурана с получением указанного в заголовке соединения (174 мг). Т.пл. 263,5265,5 С. Соединение, полученное в примере 3, и соединения, полученные тем же самым способом,что описан в примере 3, представлены в табл. 1 и 14. Пример 4. Синтез 4-(4-карбамоил-1,2,3,6 тетрагидропиридин-1-ил)-1-(2,4-дихлорфенил)2,3,6-триметил-1 Н-пирроло[2,3-b]пиридина (соединение 12-01).(1). 60% Гидрид натрия (масляной дисперсии) (0,97 г) промывали гексаном и затем суспендировали в N,N-диметилформамиде (10 мл),добавляли по каплям раствор 1-(2,4-дихлорфенил)-4-гидрокси-2,3,6-триметил-1 Н-пирроло[2,3-b]пиридина (6,50 г) в N,N-диметилформамиде (90 мл). Полученную смесь перемешивали при 40 С в течение 30 мин, после чего добавляли одной порцией(трифторметансульфонимид) (8,65 г) с последующим перемешиванием при комнатной температуре в течение 30 мин. К полученному таким образом раствору добавляли 4-пиперидонэтиленкеталь (16,4 г) и реакцию проводили при 90 С в течение 2 ч, при 100 С в течение 1,5 ч и затем при 120 С в течение 2,5 ч. После охлаждения реакционной смеси до комнатной температуры в нее вливали насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом и органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel 19 и тетрагидрофурана (60 мл) при комнатной температуре в течение 2,5 ч к ней добавляли 6 М соляную кислоту (30 мл) и полученную смесь перемешивали в течение ночи. После завершения реакции реакционную смесь вливали в насыщенный водный раствор гидрокарбоната натрия и экстрагировали три раза этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученные таким образом кристаллы промывали этилацетатом с получением 1-(2,4 дихлорфенил)-4-(4-оксопиперидин-1-ил)-2,3,6 триметил-1H-пирроло[2,3-b]пиридина (3,83 г).[2,3-b]пиридин (0,55 г) и к раствору добавляли цианид калия (0,91 г). К перемешиваемой смеси добавляли уксусную кислоту (0,75 мл) при охлаждении на льду в течение 15 мин с последующим перемешиванием при комнатной температуре в течение 2 ч. Реакционную смесь разделяли этилацетатом и насыщенным водным раствором гидрокарбоната натрия и органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в пиридине (6,4 мл) и добавляли к раствору оксихлорид фосфора (1,3 мл) при охлаждении на льду. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем при 60 С в течение 1 ч. Реакционную смесь осторожно выливали в смесь воды со льдом и экстрагировали три раза этилацетатом и объединенный органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: гексан-этилацетат = 4:1) с получением 4-(4 циано-1,2,3,6-тетрагидропиридин-1-ил)-1-(2,4 дихлорфенил)-2,3,6-триметил-1 Н-пирроло[2,3b]пиридина (0,33 г).[2,3-b]пиридин (0,19 г) и к раствору добавляли концентрированную серную кислоту (0,5 мл) при охлаждении на льду и полученную смесь медленно нагревали до комнатной температуры и затем перемешивали в течение ночи. Реакционную смесь разделяли этилацетатом и насыщенным водным раствором гидрокарбоната натрия и водный слой экстрагировали два раза этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия и обезвоживающий агент отфильтровывали, 005289 20 после чего фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: хлороформметанол = 30:1) и осажденные кристаллы промывали этилацетатом с получением указанного в заголовке соединения (0,10 г). Т.пл. 265,0267,0 С. Соединение, полученное в примере 4, и соединения, полученные тем же самым способом,что описан в примере 4, представлены в табл. 11 и 12. Пример 5. Синтез 4-(5-карбамоил-1,2,3,6 тетрагидропиридин-1-ил)-1-(2,4-дихлорфенил)2,3,6-триметил-1 Н-пирроло[2,3-b]пиридина (соединение 12-09).(1). После промывания два раза гексаном 60% гидрида натрия (масляной дисперсии) (79 г) и небольшого количества 35% гидрида калия(масляной дисперсии) гексаном к ним добавляли тетрагидрофуран (2,0 мл) и диэтилкарбонат(0,21 г) и полученную смесь нагревали при 80 С. Затем к смеси добавляли по каплям раствор 1-(2,4-дихлорфенил)-4-(4-оксопиперидин 1-ил)-2,3,6-триметил-1 Н-пирроло[2,3-b]пиридина (0,29 г), синтезированного по способу, описанному в примере 4, в тетрагидрофуране (2,0 мл) в течение 10 мин и полученную смесь нагревали с обратным холодильником при кипячении в течение 1,5 ч. После охлаждения реакционной смеси до комнатной температуры насыщенный водный раствор хлорида аммония вливали в эту реакционную смесь, которую затем экстрагировали три раза этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: гексан-этилацетат = 4:1) с получением 1-(2,4 дихлорфенил)-4-(3-этоксикарбонил-4-оксопиперидин-1-ил)-2,3,6-триметил-1 Н-пирроло[2,3-b] пиридина (0,14 г).(2). В этаноле (3,0 мл) растворяли 1-(2,4 дихлорфенил)-4-(3-этоксикарбонил-4-оксопиперидин-1-ил)-2,3,6-триметил-lH-пирроло[2,3-b] пиридин (0,13 г) и этот раствор охлаждали до-15 С. Затем к нему добавляли боргидрид натрия (26 мг) и полученную смесь перемешивали в течение ночи при медленном нагревании до 0 С. Насыщенный водный раствор хлорида аммония вливали в эту реакционную смесь, которую затем экстрагировали три раза этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200),элюент: хлороформ-метанол = 50:1) с получением 1-(2,4-дихлорфенил)-4-(3-этоксикарбонил-4 21 гидроксипиперидин-1-ил)-2,3,6-триметил-1 Нпирроло[2,3-b]пиридина (35 мг).(3). В метиленхлориде (1,5 мл) растворяли 1-(2,4-дихлорфенил)-4-(3-этоксикарбонил-4 гидроксипиперидин-1-ил)-2,3,6-триметил-1 Нпирроло[2,3-b]пиридин (53 мг), триэтиламин (34 мг) и небольшое количество 4-диметиламинопиридина. К раствору добавляли метансульфонилхлорид (25 мг) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. В эту реакционную смесь вливали насыщенный водный раствор гидрокарбоната натрия, и реакционную смесь затем экстрагировали три раза хлороформом. Объединенный органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в бензоле (1,0 мл) с последующим добавлением к раствору 1,8-диазабицикло[5.4.0]-7-ундецена(17 мг) и полученную смесь нагревали с обратным холодильником при кипячении в течение 1 ч. Насыщенный водный раствор хлорида аммония вливали в реакционную смесь, которую затем экстрагировали три раза этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200),элюент: гексан:этилацетат = 5:1) с получением 4-(5-этоксикарбонил-1,2,3,6-тетрагидропиридин-1-ил)-1-(2,4-дихлорфенил)-2,3,6-триметил 1 Н-пирроло[2,3-b]пиридина (27 мг).(4). В этаноле (1,0 мл) растворяли 4-(5 этоксикарбонил-1,2,3,6-тетрагидропиридин-1 ил)-1-(2,4-дихлорфенил)-2,3,6-триметил-1 Нпирроло[2,3-b]пиридин (27 мг) с последующим добавлением к раствору 1 М водного раствора гидроксида натрия (1,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 8,5 ч. Насыщенный водный раствор хлорида аммония вливали в эту реакционную смесь, которую затем экстрагировали три раза хлороформом. Объединенный органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток суспендировали в смешанном растворителе из N,N-диметилформамида (0,8 мл) и хлороформа (0,2 мл) и к суспензии добавляли моногидрат 1-гидроксибензотриазола (18 г) и гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (23 мг). После перемешивания полученной смеси при комнатной температуре в течение 40 мин добавляли несколько капель 28% водного раствора аммиака и полученную таким образом смесь перемешивали при комнатной температуре в течение 1,5 ч. В реакционную смесь влива 005289 22 ли насыщенный водный раствор гидрокарбоната натрия и эту смесь затем экстрагировали три раза этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель:Wako Gel (C200), элюент: гексан:этилацетат = 1:2) и кристаллизовали из смешанного растворителя диизопропиловый эфир-этилацетат с получением указанного в заголовке соединения(1). После суспендирования гидрохлорида 2-(N-этил-2,4-дихлоранилино)-4-метилтиазола(6,0 г) и карбоната кальция (4,6 г) в смешанном растворителе из хлороформа (90 мл) и метанола(36 мл) к суспензии добавляли бензилтриметиламмонийтрибромид (7,2 г) в виде небольших порций. Твердые вещества в реакционной смеси отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: гексанэтилацетат = 9:1) с получением 5-бром-2-(Nэтил-2,4-дихлоранилино)-4-метилтиазола (4,5 г).(1,5 мл) давали реагировать в запаянной пробирке при 120 С в течение 3 дней. Реакционную смесь разделяли водой и хлороформом и водный слой экстрагировали хлороформом, после чего объединенный органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200),элюент: хлороформ-метанол = 20:1) и затем кристаллизовали из диизопропилового эфира с получением указанного в заголовке соединения 23 комнатной температуре в течение 2 ч и затем при 70 С в течение 5,5 ч. Тетрагидрофуран отгоняли при пониженном давлении и остаток обрабатывали до щелочной реакции 41% водным раствором гидроксида натрия при охлаждении на льду и экстрагировали три раза этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (10 мл) и полученный раствор добавляли по каплям к раствору реагента Хорнера-Эммонса, который был приготовлен заранее из этилдиэтилфосфоноацетата (2,05 г) и 60% гидрида натрия (масляной суспензии) (293 мг) в тетрагидрофуране (10 мл), при охлаждении на льду в течение 20 мин. Баню со льдом удаляли и реакционную смесь перемешивали при комнатной температуре в течение 30 мин, реакцию гасили насыщенным водным раствором хлорида аммония и затем экстрагировали два раза этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия, после чего обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: гексанэтилацетат = 9:1) и затем кристаллизовали из диизопропилового эфира с получением 8-(2,4 дихлорфенил)-2-метил-4-(4-этоксикарбонилметилиденпиперидин-1-ил)хинолина (2,4 г).(2). В смешанном растворителе из 85% гидроксида калия (1,3 г) и воды (1,4 мл) - этанола (8 мл) 8-(2,4-дихлорфенил)-2-метил-4-(4 этоксикарбонилметилиденпиперидин-1-ил)хинолин (2,3 г) перемешивали при 80 С в течение 1 ч. Реакционную смесь нейтрализовали 3 М хлористо-водородной кислотой при охлаждении на льду и перемешивали при охлаждении в течение 2 ч и затем при комнатной температуре в течение 30 мин. Осажденное твердое вещество собирали фильтрованием с получением смесиN,N-диметилформамиде (2 мл) при комнатной температуре в течение 20 мин. Затем к смеси добавляли 28% водный раствор аммиака (0,075 мл) и полученную смесь перемешивали при 24 комнатной температуре в течение 3 дней. Реакционную смесь разделяли хлороформом и водой и органический слой сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток разделяли и очищали дважды колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200),элюент: хлороформ-этанол = 50:1), после чего очищенные продукты кристаллизовали из диэтилового эфира и диизопропилового эфира,соответственно, с получением указанного в заголовке соединения 1-22 (109 мг) и указанного в заголовке соединения 1-05 (43 мг) соответственно. Соединение 1-22: т.пл. 225,0-227,0 С. Соединение 1-05: т.пл. 160,0-162,0 С. Соединения, полученные в примере 7, и соединения, полученные тем же способом, что описан в примере 7, представлены в табл. 1 и 16. Пример 8. Синтез 8-(2,4-дихлорфенил)-4(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-2-метилхинолина.(1). После промывания 60% гидрида натрия (масляная дисперсия) (1,68 г) гексаном его суспендировали в N,N-диметилформамиде (20 мл). К полученной суспензии добавляли суспензию 8-бром-4-гидрокси-2-метилхинолина (10,0 г) в N,N-диметилформамиде (35 мл) при комнатной температуре в течение 10 мин с последующим перемешиванием при комнатной температуре в течение 30 мин. К полученному раствору добавляли N-фенилбис(трифторметансульфонамид) (15,0 г) в виде одной порции с последующим перемешиванием при комнатной температуре в течение 1 ч. К полученной реакционной смеси добавляли 4-пиперидонэтиленкеталь (11,0 г) и полученную смесь перемешивали при комнатной температуре в течение 24 ч и нагревали с обратным холодильником при кипячении при 60 С в течение 4 ч и затем в течение 2,5 ч. После добавления 4-пиперидонэтиленкеталя (5,5 г) полученную таким образом смесь нагревали с обратным холодильником при кипячении в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры, выливали в воду (200 мл) и затем перемешивали в течение 24 ч. Твердое осажденное вещество собирали фильтрованием и очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: гексан-этилацетат = 5:1-3:1) с получением 8 бром-4-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-2 метилхинолина (10,3 г), т.пл. 156,0-158,0 С.(6,0 г) и карбонат натрия (8,93 г) суспендировали в смешанном растворителе из деаэрированной воды (24 мл), толуола (12 мл) и этанола (12 мл) с последующим добавлением к суспензии тетракис(трифенилфосфин)палладия (1,6 г) и 25 полученную смесь нагревали с обратным холодильником при кипячении в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и разделяли этилацетатом и насыщенным водным раствором хлорида аммония. После экстракции водной фазы этилацетатом объединенную органическую фазу сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали, после чего фильтрат концентрировали при пониженном давлении и полученный остаток кристаллизовали из диизопропилового эфира. Кристаллы собирали фильтрованием и промывали небольшим количеством диизопропилового эфира с получением указанного в заголовке соединения (10,5 г). Т.пл. 179,5-181,5 С. Пример 9. Синтез 8-(2,4-дихлорфенил)-4(4-карбамоил-1,2,3,6-тетрагидропиридин-1-ил)2-метилхинолина (соединение 1-01).(1). После промывания гексаном 60% гидрид натрия (1,00 г) (масляная дисперсия) суспендировали в N-метилпирролидоне (40 мл). К полученной суспензии добавляли 8-бром-4 гидрокси-2-метилхинолин (5,0 г) в виде одной порции при комнатной температуре в течение 1 ч. К полученному раствору добавляли Nфенилбис(трифторметансульфонамид) (15,0 г) в виде одной порции с последующим перемешиванием при комнатной температуре в течение 1 ч. К полученной реакционной смеси добавляли гидрокарбонат натрия (5,3 г) и гидрохлорид 4-карбамоил-1,2,3,6-тетрагидропиридина(6,8 г) и полученную смесь перемешивали при 130 С в течение 30 мин. После охлаждения реакционной смеси до комнатной температуры к ней добавляли воду (100 мл) с последующим перемешиванием при комнатной температуре в течение 2 ч. Осажденное твердое вещество собирали фильтрованием и затем промывали водой с получением 8-бром-4-(4-карбамоил 1,2,3,6-тетрагидропиридин-1-ил)-2-метилхинолина (4,8 г). Т.пл. 225,0-227,0 С.(2). В атмосфере азота 8-бром-2-метил-4(4-карбамоил-1,2,3,6-тетрагидропиридин-1-ил) хинолин (4,7 г), 2,4-дихлорфенилборную кислоту (2,9 г) и карбонат натрия (4,5 г) суспендировали в смешанном растворителе из деаэрированной воды (14 мл), толуола (7 мл) и этанола (7 мл) с последующим добавлением к суспензии тетракис(трифенилфосфин)палладия (0,81 г) и полученную смесь нагревали при кипячении с обратным холодильником в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и перемешивали при комнатной температуре в течение 3 ч. Осажденное твердое вещество собирали фильтрованием и промывали смешанным растворителем вода-этанол (2:1) (30 мл) и затем этанолом (30 мл) с получением указанного в заголовке соединения (4,7 г). Соединение, полученное в примере 9,представлено в табл 1.(1). После промывания гексаном 60% гидрид натрия (масляная суспензия) (1,0 г) суспендировали в N-метилпирролидоне (30 мл). К суспензии добавляли 8-бром-4-гидрокси-2 метилхинолин (5,0 г) в виде одной порции при комнатной температуре с последующим перемешиванием при комнатной температуре в течение 1 ч. К полученному раствору добавлялиN-фенилбис(трифторметансульфонамид) (9,0 г) в виде одной порции с последующим перемешиванием при комнатной температуре в течение 1 ч. К полученной реакционной смеси добавляли 4-изопропилоксикарбонил-1,2,3,6-тетрагидропиридин (8,5 г) и полученную смесь перемешивали в течение ночи при комнатной температуре. Эту реакционную смесь вливали в смесь воды и этилацетата для разделения. После экстракции водной фазы этилацетатом объединенную органическую фазу сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel (C200), элюент: гексанэтилацетат = 9:1) и полученное таким образом твердое вещество промывали смесью диизопропилового эфира и гексана с получением 8-бром 4-(4-изопропилоксикарбонил-1,2,3,6-тетрагидропиридин-1-ил)-2-метилхинолина (6,0 г). Т.пл. 130,0-131,0 С.(4,8 г) суспендировали в смешанном растворителе из деаэрированной воды (15 мл), толуола(7,5 мл) и этанола (7,5 мл) с последующим добавлением к суспензии тетракис(трифенилфосфин)палладия (0,88 г) и полученную смесь нагревали с обратным холодильником при кипячении в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры для разделения. После экстракции водной фазы этилацетатом объединенную органическую фазу сушили над безводным сульфатом натрия. Обезвоживающий агент отфильтровывали, после чего фильтрат концентрировали при пониженном давлении и полученный осадок кристаллизовали из диизопропилового эфира. Кристаллы собирали фильтрованием и промывали небольшим количество диизопропилового эфира с получением указанного в заголовке соединения (5,3 г). Т.пл. 131,0-133,0 С. Соединение, полученное в примере 10,включено в перечень соединений табл. 1.(10 мл) суспендировали 8-(2,4-дихлорфенил)-4(4-карбамоил-1,2,3,6-тетрагидропиридин-1-ил)2-метилхинолин (0,10 г) и суспензию нагревали при кипячении с обратным холодильником в течение 1 ч. После концентрирования реакционной смеси при пониженном давлении к ней добавляли 28% водный аммиак (2 мл) с последующим концентрированием при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (силикагель: Wako Gel(С 200), элюент: хлороформ-метанол = 20:1-10:1) и осажденное твердое вещество промывали этилацетатом с получением указанного в заголовке соединения (74 мг). Т.пл. 218,0-220,0 С. Соединение, полученное в примере 11,представлено в табл. 1. Таблица 11 Пример исследования (исследование связывания рецептора КРФ) Мембраны лобной части коры головного мозга крысы или мембраны миндалевидного тельца мозга обезьяны использовали в качестве препарата рецептора. 125I-меченого лиганда проводили согласно следующему способу, описанному в The Journal ofNeuroscience, 7, 88 (1987). Получение рецепторных мембран. Лобную кору (кору лобной доли полушария мозга) крысы или миндалевидное тельце мозга обезьяны гомогенизировали в 50 мМ Трис-НСl-буфере (рН 7,0), содержащем 10 мМMgCl2 и 2 мМ ЭДТА, и центрифугировали при 48000 х g и осадок промывали один раз ТрисHCl-буфером. Промытый осадок суспендировали в 50 мМ Трис-HCl-буфере (рН 7,0), содержащем 10 мМ MgCl2, 2 мМ ЭДТА, 0,1% бычий сывороточный альбумин и 100 калликреиновых ед./мл апротинина, для получения препарата мембран. Тест связывания рецептора КРФ. Препарат мембран (0,3 мг белка/мл), 125IКРФ (0,2 нМ) и тестируемое лекарственное средство взаимодействовали при 25 С в течение 2 ч. После завершения реакции реакционную смесь фильтровали с отсасыванием через стеклянный фильтр (GF/C), обработанный 0,3% полиэтиленимином, и этот стеклянный фильтр промывали три раза забуференным фосфатом солевым раствором, содержащим 0,01% Тритон 33 Х-100. После промывания измеряли радиоактивность этой фильтровальной бумаги в гаммасчетчике. Количество связавшегося 125I-KPФ при проведении реакции в присутствии 1 мкМ КРФ принимали за степень неспецифического связывания 125I-КРФ, а разность между общей степенью связывания 125I-КРФ и степенью неспецифического связывания 125I-КРФ рассматривали как степень специфического связывания 125IКРФ. Кривую ингибирования получали реакцией определенной концентрации (0,2 нМ) 125IКРФ с различными концентрациями каждого тестируемого лекарственного средства в условиях, описанных выше. Концентрацию тестируемого лекарственного средства, при которой связывание 125I-КРФ ингибируется на 50%(IC50), определяли из этой кривой ингибирования. В результате было обнаружено, что соединения 1-01, 1-02, 1-05, 1-06, 1-07, 1-09, 1-10, 112, 1-15, 1-16, 12-01 - 12-09, 16-05, 16-06 и 16-12 могли служить примерами типичных соединений, имеющих величину IC50 500 нМ или менее. Промышленная применимость Согласно данному изобретению предложены соединения, имеющие высокую аффинность в отношении рецепторов КРФ. Эти соединения являются эффективными при заболеваниях, в которых, как считается, участвует КРФ,таких как депрессия, тревожность, болезнь Альцгеймера, болезнь Паркинсона, хорея Хантингтона, нарушение питания, гипертензия, желудочные заболевания, лекарственная зависимость, эпилепсия, инфаркт мозга, ишемия мозга,отек мозга, связанные с иммунитетом заболевания, алопеция и тому подобное. 34 С 1-5 алкильную группу, С 3-8 циклоалкильную группу, С 3-8 циклоалкил-С 1-5 алкильную группу,C1-5 алкокси-С 1-5 алкильную группу, С 3-8 циклоалкилокси-С 1-5 алкильную группу или фенильную группу, или R1 и R2, взятые вместе с соседним атомом азота, представляют 5-8-членную насыщенную гетероциклическую группу, представленную формулой-CO2R3 (где R3 обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу,С 3-8 циклоалкил-С 1-5 алкильную группу, С 1-5 алкокси-С 1-5 алкильную группу, С 3-8 циклоалкилокси-С 1-5 алкильную группу или фенильную группу), иHet обозначает любую из гетероциклических групп, представленных следующими формулами от формы (01) до формы (20):[I] где А обозначает группу, представленную следующими формулами [II] или [III]:[III] находится в положении 3 или 4,R0 обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу или С 3-8 циклоалкил-С 1-5 алкильную группу,n равно целому числу 0-5 иY обозначает цианогруппу, группу, представленную формулой -CONR1(R2) (где каждый из R1 и R2, которые могут быть одинаковыми или различными, обозначает атом водорода, где Е обозначает СН или N,R4 обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу,С 3-8 циклоалкил-С 1-5 алкильную группу, гидроксильную группу, С 1-5 алкоксигруппу, С 3-8 циклоалкилоксигруппу или группу, представленную формулой -N(R10)R11 (где каждый из R10 и R11, которые могут быть одинаковыми или 35 различными, обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу или С 3-8 циклоалкил-С 1-5 алкильную группу),каждый из R5, R6, R7 и R8, которые могут быть одинаковыми или различными, обозначает атом водорода, атом галогена, C1-5 алкильную группу, С 3-8 циклоалкильную группу, С 3-8 циклоалкил-С 1-5 алкильную группу, гидроксильную группу, С 1-5 алкоксигруппу, С 3-8 циклоалкилоксигруппу или группу, представленную формулой -N(R12)R13 (где каждый из R12 и R13,которые могут быть одинаковыми или различными, обозначает атом водорода, С 1-5 алкильную группу, С 3-8 циклоалкильную группу или С 3-8 циклоалкил-С 1-5 алкильную группу), группу,представленную формулой -CO2R14 (где R14 обозначает атом водорода, С 1-5 алкильную группу,С 3-8 циклоалкильную группу, С 3-8 циклоалкилС 1-5 алкильную группу, С 1-5 алкокси-С 1-5 алкильную группу, С 3-8 циклоалкилокси-С 1-5 алкильную группу или фенильную группу), цианогруппу,нитрогруппу, С 1-5 алкилтиогруппу, трифторметильную группу или трифторметоксигруппу,R9 обозначает атом водорода, С 1-5 алкильную группу, С 2-5 алкалкенильную группу,С 2-5 алкинильную группу, С 3-8 циклоалкильную группу или С 3-8 циклоалкил-С 1-5 алкильную группу, и Аr обозначает арильную или гетероарильную группу, незамещенную или замещенную 13 заместителями, которые могут быть одинаковыми или различными и выбраны из атомов галогена, С 1-5 алкильных групп, С 1-5 алкоксигрупп, С 1-5 алкилтиогрупп, трифторметильной группы, трифторметоксигруппы и групп, представленных формулой -N(R15)R16 (где каждый изR15 и R16, которые могут быть одинаковыми или различными, обозначает атом водорода или С 1-5 алкильную группу); или его фармацевтически приемлемая соль или е гидрат. 2. Тетрагидропиридиногетероциклическое производное по п.1, которое имеет формулу [IV] 36 0, его фармацевтически приемлемая соль или е гидрат. 5. Тетрагидропиридиногетероциклическое производное по п.4, которое имеет формулу [VI] где каждый из R18, R19 и R20, которые могут быть одинаковыми или различными, обозначает атом водорода, метильную группу, атом фтора или атом хлора и каждый из X5, X6 и X7, которые могут быть одинаковыми или различными,обозначает атом водорода, метильную группу,атом хлора, трифторметильную группу или трифторметоксигруппу, его фармацевтически приемлемая соль или е гидрат. 6. Тетрагидропиридиногетероциклическое производное по п.5, которое имеет формулу где R18, R19 и R20 имеют определенные выше значения и каждый из X8 и X9, которые могут быть одинаковыми или различными, обозначает атом хлора, трифторметильную группу или трифторметоксигруппу, его фармацевтически приемлемая соль или е гидрат. 7. Тетрагидропиридиногетероциклическое производное по п.6, которое имеет формулу где Het имеет определенное выше значение и m равно 0 или 1, его фармацевтически приемлемая соль или е гидрат. 3. Тетрагидропиридиногетероциклическое производное по п.2, которое имеет формулу [V] где X9 имеет определенное выше значение и R21 обозначает атом водорода, атом хлора или метильную группу, его фармацевтически приемлемая соль или е гидрат. 8. Тетрагидропиридиногетероциклическое производное по п.2, которое имеет формулу [IX] где R4, R5, R6, R7, Аr и m имеют определенные выше значения, его фармацевтически приемлемая соль или е гидрат. 4. Тетрагидропиридиногетероциклическое производное по п.3, где m в формуле (V) равно где R4, R5, R6, Аr и m имеют определенные выше значения. 9. Тетрагидропиридиногетероциклическое производное или его фармацевтически приемлемая соль или е гидрат по п.8, где m в форму 37 ле [IX] равно 0, его фармацевтически приемлемая соль или е гидрат. 10. Тетрагидропиридиногетероциклическое производное по п.9, которое имеет формулу [X] где каждый из R22 и R23, которые могут быть одинаковыми или различными, обозначает атом водорода или метильную группу и каждый изX10, X11 и X12, которые могут быть одинаковыми или различными, обозначает атом водорода,атом хлора, атом брома, метоксигруппу, метилтиогруппу или трифторметильную группу, его фармацевтически приемлемая соль или е гидрат. 11. Тетрагидропиридиногетероциклическое производное по п.9, которое имеет формулу [XI] где X13 обозначает атом хлора или атом брома,X14 обозначает атом хлора, атом брома или трифторметильную группу и X15 обозначает атом водорода, атом хлора, атом брома, метоксигруппу, метилтиогруппу или трифторметильную группу, его фармацевтически приемлемая соль или е гидрат. 12. Антагонист против рецепторов КРФ,содержащий тетрагидропиридиногетероциклическое производное, его фармацевтически приемлемую соль или е гидрат, по любому из пп.111 в качестве активного ингредиента. 13. Применение тетрагидропиридиногетероциклического производного, его фармацевтически приемлемой соли или е гидрата по любому из пп.1-11 в качестве антагониста против рецепторов кортикотропин-рилизинг-фактора.
МПК / Метки
МПК: A61P 43/00, C07D 401/04, A61K 31/4365
Метки: кортикотропин-рилизинг-фактора, гетероциклические, группы, пиперидиновые, антагонистов, качестве, тетрагидропиридиновые, содержащие, рецепторов, соединения
Код ссылки
<a href="https://eas.patents.su/20-5289-geterociklicheskie-soedineniya-soderzhashhie-tetragidropiridinovye-ili-piperidinovye-gruppy-v-kachestve-antagonistov-receptorov-kortikotropin-rilizing-faktora.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические соединения, содержащие тетрагидропиридиновые или пиперидиновые группы, в качестве антагонистов рецепторов кортикотропин-рилизинг-фактора</a>
Предыдущий патент: Производные диазепинкарбоксамида, способ их получения, их применение в качестве лекарственных средств, фармацевтические композиции и их применение
Следующий патент: Способ диагностики и прогнозирования вич инфекции у человека
Случайный патент: Биметаллический термостат с печатной платой, помещённой между чувствительным термостатическим элементом и реле