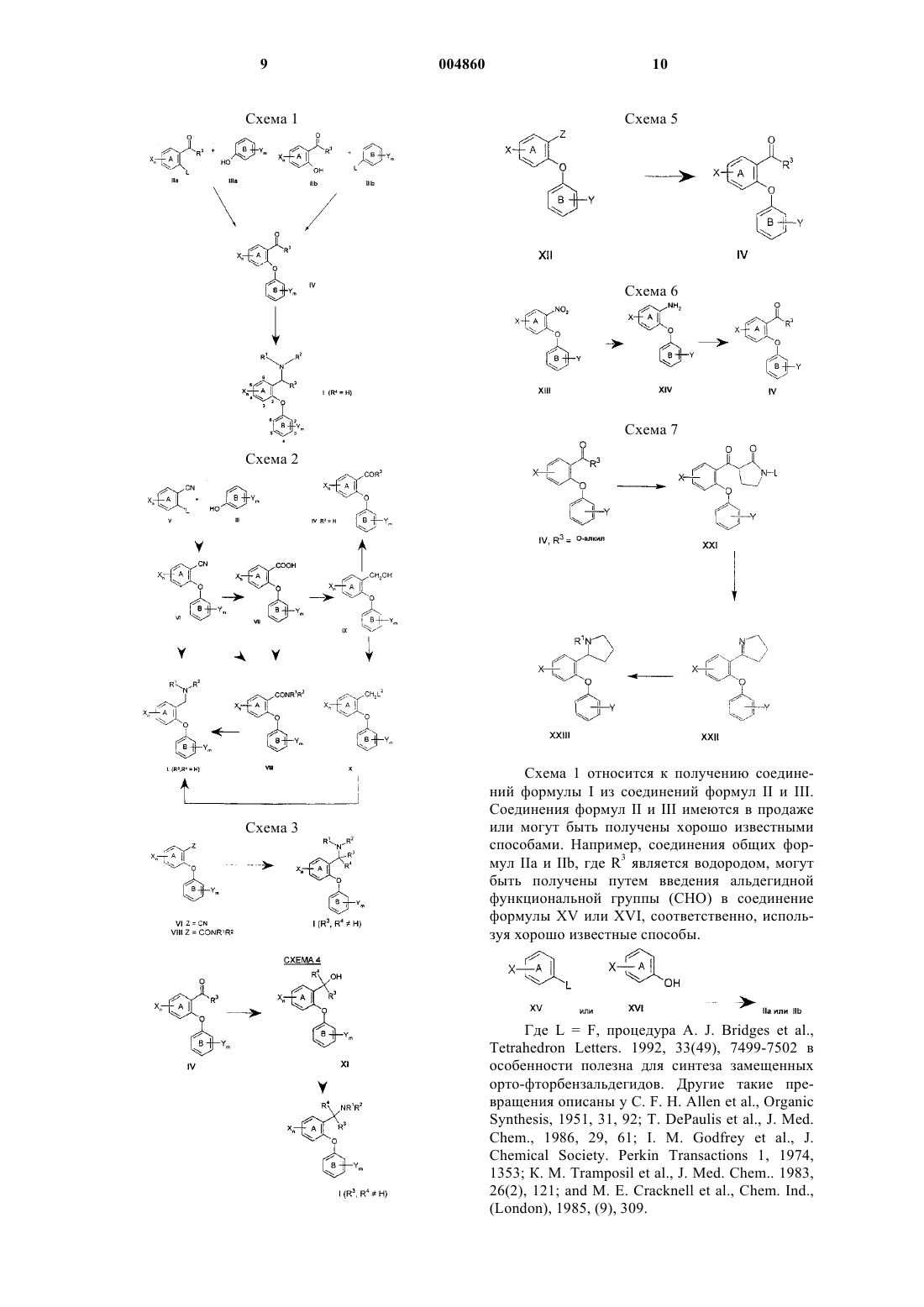
Ингибиторы обратного захвата моноаминов для лечения расстройств цнс
Номер патента: 4860
Опубликовано: 26.08.2004
Авторы: Хауард Гарри Ралф Младший, Шмидт Кристофер Джозеф, Эллиотт Марк Леонард, Сигер Томас Франсис
Формула / Реферат
1. Соединение формулы
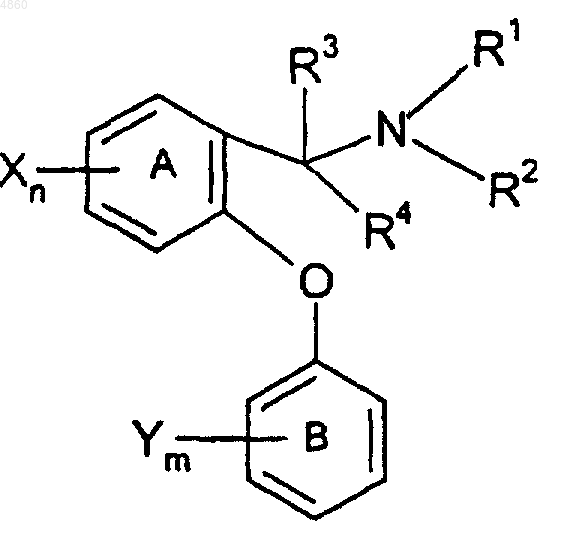
где кольца A и B являются фенилом;
n и m независимо выбраны из 1, 2, 3;
R1 и R2 независимо выбраны из водорода, (C1-C4)алкила, (C2-C4)алкенила и (C2-C4)алкинила или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют 4-8-членное насыщенное кольцо, содержащее один или два гетероатома, включая азот, к которому присоединены R1 и R2, где второй гетероатом, если таковой имеется, выбран из кислорода, азота и серы, при условии, что указанное кольцо не может содержать два соседних атома кислорода или два соседних атома серы, и где указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (C1-C6)алкила;
R3 и R4 независимо выбраны из водорода и (C1-C4)алкила, возможно замещенного атомами фтора в количестве от одного до трех, или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют 4-8-членное насыщенное карбоциклическое кольцо, причем указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (C1-C6)алкила;
или R2 и R3 вместе с атомом азота, к которому присоединен R2, и атомом углерода, к которому присоединен R3, образуют 4-8-членное насыщенное кольцо, содержащее 1 или 2 гетероатома, включая азот, к которому присоединен R2, где второй гетероатом, если таковой имеется, выбран из кислорода, азота и серы, при условии, что указанное кольцо не может содержать два соседних атома кислорода или два соседних атома серы, и где указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (C1-C6)алкила;
каждый X независимо выбран из водорода, галогено (то есть хлоро, фторо, бромо или иодо), (C1-C4)алкила, возможно замещенного атомами фтора в количестве от одного до трех, (C1-C4)алкокси, возможно замещенного атомами фтора в количестве от одного до трех, циано, нитро, амино, (C1-C4)алкиламино, ди-[(C1-C4) алкил]амино, NR5(C=O)(C1-C4)алкила, SO2NR5R6 и SOp(C1-C6)алкила, где R5 и R6 независимо выбраны из водорода и (C1-C6)алкила и p равно 0, 1 или 2; и
каждый Y независимо выбран из водорода, (C1-C6)алкила и галогено;
при условии, что: (а) не более, чем один из NR1R2, CR3R4 и R2NCR3 может образовывать кольцо, (б) по крайней мере один X должен быть отличным от водорода, когда (1) R3 и R4 оба представляют собой водород, (2) R1 и R2 независимо выбраны из водорода и (C1-C4)алкила, и (3) кольцо B является моно- или дизамещенным соответственно одной или двумя галогеногруппами, и (в) если каждый X представляет собой водород и Y представляет собой галоген, то R2NCR3 не может образовывать 4,5-дигидро-1H-имидазольное кольцо, и (г) если R1, R2, R3 и R4 все представляют собой водород и кольцо B является незамещенным, то X не может представлять собой галогено;
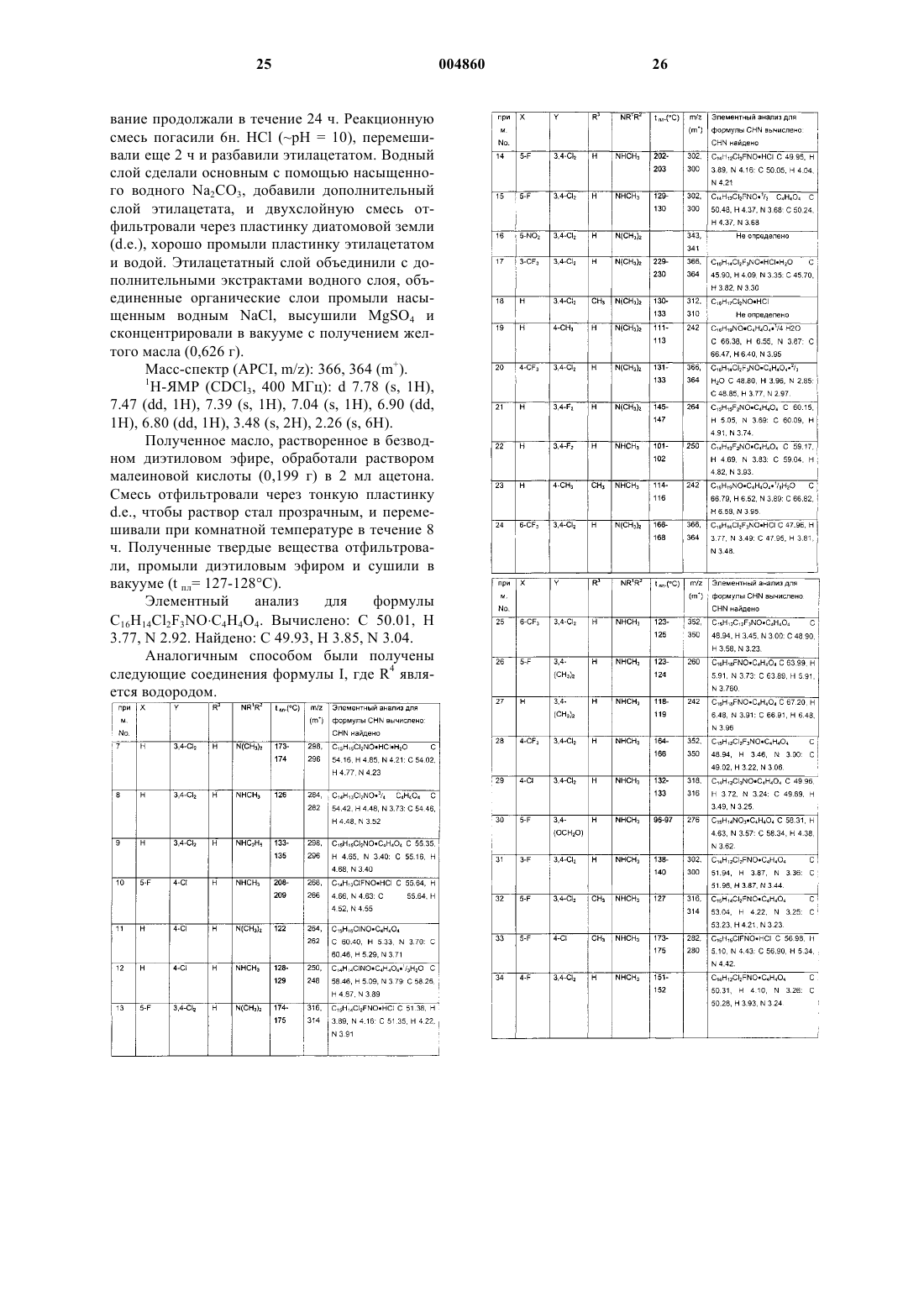
или его фармацевтически приемлемая соль.
2. Соединение или соль по п.1, где n равно 1, X является фторо, R3 и R4 представляют собой водород, R1 является водородом, R2 является метилом, m равно 2 и Y является Ym, что представляет собой 3,4-дихлоро.
3. Соединение или соль по п.1, где m равно 0, n равно 1, R3 и R4 представляют собой водород, X является хлоро, бромо, иодо или метилом, R1 является водородом и R2 является метилом.
4. Соединение или соль по п.1, где указанные соединение или соль выбраны из следующих соединений и их фармацевтически приемлемых солей:
[2-(3,4-дихлорфенокси)-5-фторбензил]диметиламин;
[2-(3,4-дихлорфенокси)-5-фторбензил]метиламин;
[2-(3,4-дихлорфенокси)-5-трифторметилбензил]диметиламин;
N-[4-(3,4-дихлорфенокси)-3-диметиламинометилфенил]ацетамид;
{1-[2-(3,4-дихлорфенокси)фенил]этил}диметиламин;
[2-(3,4-дихлорфенокси)-4-трифторметилбензил]диметиламин;
[2-(3,4-дихлорфенокси)-4-трифторметилбензил]метиламин;
[4-хлор-2-(3,4-дихлорфенокси)бензил]метиламин;
{1-[2-(3,4-дихлорфенокси)-5-фторфенил]этил}метиламин;
{1-[2-(3,4-дихлорфенокси)фенил]этил}метиламин;
{1-[2-(4-хлорфенокси)фенил]этил}метиламин;
[2-(3,4-дихлорфенокси)-5-метоксибензил]метиламин;
[2-(4-хлорфенокси)-5-фторбензил]метиламин;
{1-[2-(4-хлорфенокси)-5-фторфенил]этил}метиламин;
[2-(3,4-дихлорфенокси)-5-метилбензил]диметиламин;
[4-бром-2-(3,4-дихлорфенокси)бензил]метиламин;
[5-бром-2-(3,4-дихлорфенокси)бензил]метиламин;
[2-(3,4-дихлорфенокси)-4,5-диметоксибензил]метиламин;
[2-(3,4-дихлорфенокси)-4-метоксибензил]диметиламин;
4-(3,4-дихлорфенокси)-3-метиламинометилбензонитрил;
[2-(3,4-дихлорфенокси)-4,5-диметилбензил]метиламин;
3-(3,4-дихлорфенокси)-4-метиламинометилбензонитрил;
(+)-{1-[2-(3,4-дихлорфенокси)-5-фторфенил]этил}метиламин;
(-)-{1-[2-(3,4-дихлорфенокси)-5-фторфнил]этил}метиламин;
[2-(3,4-дихлорфенокси)-5-трифторметилбензил]метиламин;
[2-(3,4-дихлорфенокси)-4-метоксибензил]метиламин;
[2-(4-хлор-3-фторфенокси)-5-фторбензил]метиламин;
[2-(3-хлор-4-фторфенокси)-5-фторбензил]метиламин;
(+/-)-2-[2-(3,4-дихлорфенокси)-5-фторфнил]пирролидин;
(-)-2-[2-(3,4-дихлорфенокси)-5-фторфенил]пирролидин;
(+)-2-[2-(3,4-дихлорфенокси)-5-фторфенил]пирролидин и
2-[2-(3,4-дихлорфенокси)-5-фторфенил]-N-метилпирролидин.
5. Фармацевтическая композиция для лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью Паркинсона, депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей, большой депрессии, одноэпизодной депрессии, рекуррентной депрессии, депрессии, вызванной злоупотреблением у детей и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, предпочтительно человека, содержащая количество соединения по п.1, которое эффективно в лечении такого расстройства или состояния, и фармацевтически приемлемый носитель.
6. Фармацевтическая композиция для лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, предпочтительно человека, содержащая количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в лечении такого расстройства или состояния, и фармацевтически приемлемый носитель.
7. Способ лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью Паркинсона, депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей, большой депрессии, одноэпизодной депрессии, рекуррентной депрессии, депрессии, вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в лечении такого расстройства или состояния.
8. Способ лечеэшя расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят количество соединения по п.1, которое эффективно в лечении такого расстройства или состояния.
9. Фармацевтическая композиция для лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью Паркинсона, депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей, большой депрессии, одноэпизодной депрессии, рекуррентной депрессии, депрессии, вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, содержащая эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
10. Фармацевтическая композиции для лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, норэпинефрина или дофамина, у млекопитающего, содержащая эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения по п.1 и фармацевтически приемлемый носитель.
11. Способ лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью Паркинсона, депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей, большой депрессии, одноэпизодной депрессии, рекуррентной депрессии, депрессии, вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, предпочтительно человека, при котором млекопитающему, нуждающемуся в таком лечении, вводят эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения по п.1 или его фармацевтически приемлемой соли.
12. Способ лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, норэпинефрина или дофамина, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения формулы I или его фармацевтически приемлемой соли.
13. Фармацевтическая композиция для лечения состояния или расстройства, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, содержащая
а) фармацевтически приемлемый носитель;
б) соединение по п.1 и
в) антагонист NK-1 рецептора или антагонист 5HT1D рецептора либо их фармацевтически приемлемую соль;
где количество активных соединений (то есть соединения формулы I и антагониста NK-1 рецептора или антагониста 5HT1D рецептора) таково, что комбинация эффективна в лечении такого расстройства или состояния.
14. Способ лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят:
а) соединение формулы I, как оно определено выше, или его фармацевтически приемлемую соль и
б) антагонист NK-1 рецептора или антагонист 5HT1D рецептора либо их фармацевтически приемлемую соль;
где количества активных соединений (то есть соединения формулы I и антагониста NK-1 рецептора или антагониста 5HT1D рецептора) таковы, что комбинация эффективна в лечении такого расстройства или состояния.
Текст
1 Предпосылки изобретения Селективные ингибиторы обратного захвата серотонина (СИОЗС) в настоящее время обеспечивают эффективность в лечении большого депрессивного расстройства (БДР) и в общем отмечаются психиатрами и врачами первичной медико-санитарной помощи как эффективные, хорошо переносимые и легко вводимые. Однако их связывают с нежелательными свойствами, такими как частые случаи сексуальных расстройств, замедленное начало действия и уровень невосприимчивости, составляющий 30% (смотри М. J. Gitlin, Journal of ClinicalPsychiatry, 1994, 55, 406-413 и R. Т. Segraves,Journal of Clinical Psychiatry, 1992, 10(2), 4-10). Преклинические и клинические данные показывают, что сексуальное расстройство, связанное с СИОЗС терапией, можно уменьшить благодаря использованию ингибиторов обратного захвата дофамина (ИОЗД), такого как бупропион (смотри А. К. Ashton, Journal of Clinical Psychiatry,1998, 59(3), 112-115). К тому же, комбинация ИОЗС и ИОЗД может ускорять начало действия,а также оказывать ослабление боли у невосприимчивых пациентов, возможно благодаря синергическому механизму (см. R. D. Marshall etal, Journal of Psychopharmacology, 1995, 9(3),284-286). Это изобретение относится к новым производным биарилового эфира, которые проявляют активность в качестве ингибиторов обратного захвата моноаминов (например дофамина,серотонина), фармацевтическим композициям,содержащим такие соединения, и способам применения таких соединений для лечения расстройств центральной нервной системы (ЦНС) и других расстройств. Патент США 4018830, опубликованный 19 апреля 1997, относится к фенилтиоаралкиламинам и 2-фенилтиобензиламинам, которые проявляют активность в качестве антиаритмических агентов. Публикация РСТ 97/17325, опубликованная 15 мая 1997, относится к производным N,Nдиметил-2-(арилтио)бензиламина, которые селективно влияют на транспорт серотонина в центральной нервной системе и пригодны в качестве антидепрессантов. Патент США 5190965, опубликованный 2 марта 1993, и патент США 5430063, опубликованный 4 июля 1995, относятся к производным феноксифенила, которые полезны в лечении депрессии. Патент США 4161529, опубликованный 17 июля 1979, относится к производному пирролидина, которое обладает антихолестеримической и гиполимической активностями. Краткое изложение сущности изобретения Настоящее изобретение относится к соединениям формулыn и m независимо выбраны из 1, 2, 3;R1 и R2 независимо выбраны из водорода,(С 1-С 4)алкила, (С 2-С 4)алкенила и (С 2-С 4)алкинила, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют 4-8-членное насыщенное кольцо, содержащее один или два гетероатома, включая азот, к которому присоединены R1 и R2, где второй гетероатом, если таковой имеется, выбран из кислорода, азота и серы, при условии, что указанное кольцо не может содержать два соседних атома кислорода или два соседних атома серы, и где указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (С 1-С 6)алкила;R3 и R4 независимо выбраны из водорода и(С 1-С 4)алкила, возможно замещенного атомами фтора в количестве от одного до трех, или R3 иR4 вместе с атомом углерода, к которому они присоединены, образуют 4-8-членное насыщенное карбоциклическое кольцо, причем указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (С 1-С 6)алкила; или R2 и R3 вместе с атомом азота, к которому присоединен R2, и атомом углерода, к которому присоединен R3, образуют 4-8-членное насыщенное кольцо, содержащее 1 или 2 гетероатома, включая азот, к которому присоединенR2, где второй гетероатом, если таковой имеется, выбран из кислорода, азота и серы, при условии, что указанное кольцо не может содержать два соседних атома кислорода или два соседних атома серы, и где указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (С 1-С 6)алкила; каждый X независимо выбран из водорода,галогено (то есть хлоро, фторо, бромо или иодо), (С 1-С 4)алкила, возможно замещенного атомами фтора в количестве от одного до трех, (С 1 С 4)алкокси, возможно замещенного атомами фтора в количестве от одного до трех, циано,нитро, амино, (С 1-С 4)алкиламино, ди-[(С 1-С 4) алкил]амино, NR5(С=О)(С 1-С 4)алкила, SO2NR5R6 иSОР(С 1-С 6)алкила, где R5 и R6 независимо выбраны из водорода и (С 1-С 6)алкила, и р равно 0,1 или 2; и каждый Y независимо выбран из водорода,(С 1-С 6)алкила и галогено; при условии, что (а) не более, чем один из 3 кольцо, (б) по крайней мере один X должен быть отличным от водорода, когда (1) R3 и R4 оба представляют собой водород, (2) R1 и R2 независимо выбраны из водорода и (С 1-С 4)алкила, и (3) кольцо В является моно- или дизамещенным соответственно одной или двумя галогеногруппами, и (в) если каждый X представляет собой водород, и Y представляет собой галоген, то R2NCR3 нe может образовывать 4,5 дигидро-1 Н-имидазольное кольцо, и (г) если R1,R2, R3 и R4 все представляют собой водород, и кольцо В является незамещенным, то X не может представлять собой галогено; или их фармацевтически приемлемым солям. Предпочтительно, n равно 1, X является фторо, R3 и R4 представляют собой водород, R1 является водородом, R2 является метилом, m равно 2, и Y является Ym, что представляет собой 3,4-дихлоро. Предпочтительно, m равно 0, n равно 1, R3 4 и R представляют собой водород, X является хлоро, бромо, иодо или метилом, R1 является водородом, и R2 является метилом. Предпочтительные соединения или их соли могут быть выбраны из следующих соединений и их фармацевтически приемлемых солей(+)-2-[2-(3,4-дихлорфенокси)-5-фторфенил]пирролидин и 2-[2-(3,4-дихлорфенокси)-5-фторфенил]-Nметилпирролидин. Настоящее изобретение также относится к фармацевтической композиции для лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью Паркинсона,депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей,большой депрессии, одноэпизодной депрессии,рекуррентной депрессии, депрессии, вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, предпочтительно человека, содержащей количество соединения формулы I, которое эффективно в лечении такого расстройства или состояния, и фармацевтически приемлемый носитель. Согласно настоящему изобретению также предложена фармацевтическая композиция для лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, предпочтительно человека, содержащая количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в лечении такого расстройства или состояния, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения расстройства или состояния,выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью 5 Паркинсона, депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей, большой депрессии, одноэпизодной депрессии, рекуррентной депрессии, депрессии,вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в лечении такого расстройства или состояния. Кроме того, настоящее изобретение относится к способу лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят количество соединения формулы I, которое эффективно в лечении такого расстройства или состояния. Согласно настоящему изобретению также предложена фармацевтическая композиция для лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком,депрессии у пациентов с болезнью Паркинсона,депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей,большой депрессии, одноэпизодной депрессии,рекуррентной депрессии, депрессии, вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, содержащая эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Кроме того, согласно настоящему изобретению предложена фармацевтическая композиция для лечения расстройства или состояния,которое можно лечить путем ингибирования обратного захвата серотонина, норэпинефрина или дофамина, у млекопитающего, содержащая эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения формулы I и фармацевтически приемлемый носитель. Данное изобретение также относится к способу лечения расстройства или состояния,выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью Паркинсона, депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей, большой депрессии, одноэпизодной депрессии, рекуррентной депрессии, депрессии,вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, предпочти 004860 6 тельно человека, при котором млекопитающему,нуждающемуся в таком лечении, вводят эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу лечения расстройства или состояния,которое можно лечить путем ингибирования обратного захвата серотонина, норэпинефрина или дофамина, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения формулы I или его фармацевтически приемлемой соли. Кроме того, согласно настоящему изобретению предложена фармацевтическая композиция для лечения состояния или расстройства,которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, содержащая а) фармацевтически приемлемый носитель; б) соединение формулы I; и в) антагонист NK-1 рецептора или антагонист 5HT1D рецептора либо их фармацевтически приемлемую соль; где количество активных соединений (то есть соединения формулы I и антагониста NK-1 рецептора или антагониста 5 НТ 1D рецептора) таково, что комбинация эффективна в лечении такого расстройства или состояния. Согласно настоящему изобретению также предложен способ лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего,при котором млекопитающему, нуждающемуся в таком лечении, вводят а) соединение формулы I, как оно определено выше, или его фармацевтически приемлемую соль; и б) антагонист NK-1 рецептора или антагонист 5 НТ 1D рецептора либо их фармацевтически приемлемую соль; где количества активных соединений (то есть соединения формулы I и антагониста NK-1 рецептора или антагониста 5 НТ 1D рецептора) таковы, что комбинация эффективна в лечении такого расстройства или состояния. Настоящее изобретение также относится к фармацевтически приемлемым солям присоединения кислоты соединений формулы I. Примерами фармацевтически приемлемых солей присоединения кислоты соединений формулы I являются соли хлороводородной кислоты, паратолуол сульфокислоты, фумаровой кислоты,лимонной кислоты, янтарной кислоты, салициловой кислоты, щавелевой кислоты, бромоводородной кислоты, фосфорной кислоты, метан 7 сульфоновой кислоты, винной кислоты, малеиновой кислоты, ди-паратолуоилвинной кислоты,уксусной кислоты, серной кислоты, иодоводородной кислоты и миндальной кислоты. Если не указано иначе, термин галогено,используемый здесь, включает в себя фторо,хлоро, бромо и иодо. Если не указано иначе, термин алкил,используемый здесь, может быть прямым, разветвленным или циклическим и может содержать в себе прямые и циклические группировки,а также разветвленные и циклические группировки. Термин лечение, используемый здесь,относится к реверсированию, облегчению, ингибированию развития или предупреждению расстройства или состояния, к которому такой термин относится, или к одному или более, чем одному симптомам такого состояния или расстройства. Термин лечение, используемый здесь, относится к акту лечения, где лечение определено непосредственно выше. Соединения формулы I могут иметь оптические центры и, следовательно, могут существовать в различных энантиомерных конфигурациях. Изобретение включает в себя все энантиомеры, диастереомеры и другие стереоизомеры таких соединений формулы I, а также рацемические и другие их смеси. Настоящее изобретение также относится ко всем меченным радиоизотопной меткой формам соединений формулы I. Предпочтительными меченные радиоизотопной меткой соединениями формулы I являются те, где радиоизотопные метки выбраны из 3 Н, 11 С, 14 С,18F, 123I и 125I. Такие меченные радиоизотопной меткой соединения полезны в качестве исследовательских и диагностических средств в метаболических фармакокинетических исследованиях и в анализе связывания, как у животных, так и у человека. Химическая зависимость, используемая здесь, подразумевает патологическое пристрастие, сильное желание или привычка к лекарственному средству. Такие лекарственные средства в общем вводят пораженному болезнью индивиду любым из различных способов введения, включающих в себя пероральный, парентеральный, назальный или путем ингаляции. Примерами химических зависимостей, которые можно лечить способами по настоящему изобретению, являются зависимости от алкоголя,никотина, кокаина, героина, фенобарбитала и бензодиазепинов (например Валиум (товарный знак. Лечение химической зависимости, используемое здесь, подразумевает уменьшение или облегчение такой зависимости. Предпочтительные воплощения этого изобретения включают в себя следующие соединения и их фармацевтически приемлемые соли: 1-[2-(3,4-дихлорфенокси)-5-фторфенил]1-метилэтилметиламин, 004860[4-хлор-2-(3,4-дихлорфенокси)-5-метансульфонилбензил]метиламин. Подробное описание изобретения Соединения формулы I можно получить согласно следующим реакционным схемам и обсуждениям. Если не указано иначе, А, В, R1,R2, R3, R4, R5, R6, X, Y, m и n, и структурная формула I, изображенные на реакционных схемах и в обсуждении, которые последуют, такие как определено выше. Схема 1 относится к получению соединений формулы I из соединений формул II и III. Соединения формул II и III имеются в продаже или могут быть получены хорошо известными способами. Например, соединения общих формул IIа и IIb, где R3 является водородом, могут быть получены путем введения альдегидной функциональной группы (СНО) в соединение формулы XV или XVI, соответственно, используя хорошо известные способы. Где L = F, процедура A. J. Bridges et al.,Tetrahedron Letters. 1992, 33(49), 7499-7502 в особенности полезна для синтеза замещенных орто-фторбензальдегидов. Другие такие превращения описаны у С. F. H. Allen et al., Organic 11 Возвращаясь к схеме 1, соединение (то есть альдегид или кетон) формулы IIа, где L является соответствующей уходящей группой,такой как фторо, хлоро, нитро или трифторсульфонато, реагирует с соединением (то есть фенолом) формулы IIIa в присутствии основания, образуя соответствующее соединение формулы IV. Эту реакцию в общем проводят при температуре примерно от 0 С до примерно 150 С в течение примерно от одного часа до примерно трех дней, предпочтительно примерно при 90-95 С в течение примерно 18 ч, в полярном растворителе, таком как диметилсульфоксид (ДМСО), N,N-диметилформамид (ДМФ),N,N-диметилацетамид (ДМА) или N-метил-2 пирролидинон (НМП), предпочтительно ДМФ. Подходящие основания включают в себя безводный карбонат натрия (Na2 СО 3), карбонат калия (K2 СО 3), гидроксид натрия (NaOH), гидроксид калия (КОН) и амины, такие как пирролидин, триэтиламин и пиридин, причем предпочтительным является безводный К 2 СО 3. Подробности проведения этой процедуры можно найти в G. W. Yeager et al., Synthesis. 1995, 2830; J. R. Dimmock et al., Journal of MedicinalChemistry, 1996, 39(20), 3984-3997. Альтернативно, фенолы формулы IIb и соединения формулы IIIb можно превратить в альдегиды или кетоны общей формулы IV в соответствии с процедурами, описанными у К. Tomisava et аl.,Chemical and Pharmaceutical Bulletin, 1984, 32(8),3066-3074. Соединения формулы IV можно превратить в соединения формулы I в условиях восстановительного аминирования. Например, соединение формулы IV может реагировать с соединением формулы HNR1R2 с образованием промежуточного соединения формулы XVII которое можно выделить или превратить непосредственно на той же самой реакционной стадии в соединения формулы I. Это превращение можно осуществить in situ или применяя в качестве исходного вещества выделенное соединение формулы XVII, используя один или несколько известных способов. Например, соединение формулы IV и соответствующее соединение формулы HNR1R2 можно присоединить друг к другу в присутствии дегидратирующего реагента, такого как тетрахлорид титана(IV) или изопропилат титана(IV) в реакционно инертном растворителе,таком как бензол, толуол, этанол или подобном 12 растворителе, пока реакция не закончится, в соответствии с процедурой S. Bhattarcharyya(Journal of Organic Chemistry, 1995, 60(15), 49284929). Альтернативно, соединение формулы IV и соединение формулы HNR1R2 можно присоединить друг к другу в инертном растворителе,таком как бензол или толуол, в присутствии или отсутствии поглотителя воды, таком как молекулярные сита, и нагревают, чтобы отщепить воду, получающуюся в ходе образования промежуточного соединения формулы XVII. Степень завершения превращения соединений формулы IV в вышеуказанное(ые) промежуточное(ые) соединение(я) формулы XVII можно определить, используя одну или более чем одну аналитические методики, включая 1 Н-ЯМР спектроскопию. В некоторых случаях возможно или желательно выделить промежуточные соединения формулы XVII, и они затем реагируют с восстанавливающим агентом, селективным для восстановления промежуточного соединения, с образованием желаемых соединений формулы I. Такие восстанавливающие агенты хорошо известны и включают в себя, например, борогидрид натрия (NaBH4), цианоборогидрид натрияet al., Tetrahedron Letters, 1990, 31, 5595. Это восстановление в общем проводят в полярном растворителе, таком как метанол, этанол, изопропанол, или в подобном растворителе при температурах примерно от 0 С примерно до 100 С, предпочтительно при комнатной температуре. В процедуре,описанной уBhattarcharyya, промежуточное соединение формулы XVII получают в этаноле и без выделения восстанавливают до продукта формулы I,используя NaBH4. В качестве альтернативы промежуточные альдегидным или кетоновым соединениям формулы IV также можно получить соединения формулы VI (то есть нитрилы),как показано на схеме 2, для применения в качестве промежуточных соединений в синтезах желаемых соединений формулы I, используя процедуру образования дифенилового эфира,аналогичную описанной на схеме 1. Процедуры для получения соединений формулы VI можно адаптировать из процедур, найденных в литературе. (Смотри, например D. С. Remy et al., J.Med. Chem 1975, 18(2), 142-148; E. A. Schmittling et al., Journal of Organic Chemistry, 1993,58(12), 3229-3230). Превращение полученных таким образом нитрилов формулы VI в желаемые продукты формулы I можно осуществить несколькими путями, как показано на схеме 2. Например,нитрильную группу VI можно гидролизовать в кислых условиях, используя для этого хорошо известные методы, чтобы получить производное карбоновой кислоты формулы VII. (См., например, A. I. Meyers et al., Tetrahedron Letters, 1984, 13 25 (28), 2941; и R. W. Higgins et al., J. OrganicChemistry, 1951, 16, 1275). Это производное карбоновой кислоты, в свою очередь, можно превратить в производное карбоксамида,имеющее формулу VIII, используя один или более чем один из стандартных способов, которые описаны в химической литературе, например, посредством реакции галогенангидрида кислоты, полученного из соединений формулыVII, с амином общей формулы HNR1R2. (См. R.E. Kent et al., Organic Synthesis, Coll. Vol. III,1955, 490; и R. M. Herbst et al., Organic Synthesis,Coll. Vol. II, 1943, 11 для обсуждения реакции Шоттена-Баумана). Полученные карбоксамиды формулы VIII, где R1 и R2 являются водородами,можно также получить непосредственно из нитрилов формулы VI с помощью специальных гидролитических способов, используя, например, пероксид водорода или водные соли едких щелочных металлов. (См. ChemistryIndustry,1961, 1987; С. R. Noller, Organic Synthesis. Coll.Vol. II, 1943, 586; и J. H. Hall и M. Gisler, J. Organic Chemistry, 1976, 41, 3769). Потом производные карбоксамида формулы VIII можно восстановить, используя один из множества восстанавливающих агентов, пригодных для такого превращения с получением желаемых соединений формулы I. (См., например, А. С. Соре et al.,Organic Synthesis, Coll.Vol. IV, 1963, 339, для использования алюмогидрида лития в диэтиловом эфире или ТГФ). Альтернативно, нитрилы формулы VI можно восстановить с образованием желаемых соединений общей формулы I, гдеR1 и R2 являются водородами, путем использования одного из множества восстанавливающих агентов, описанных в химической литературе,которые являются селективными для такого превращения (включая каталитическую гидрогенизацию, используя газ водород и оксид платины (II), как описано у J. A. Secrist, III и М. W.Tetrahedron Letters, 1976, 2875). Такие восстанавливающие агенты могут также включать в себя алюмогидрид лития в инертном растворителе, таком как диэтиловый эфир или тетрагидрофуран. Наконец, нитрилы формулы VI можно превратить в соответствующие альдегиды общей формулы IV, где R3 является водородом,используя реакционные условия, специальные для этого превращения, такие как триэтоксиалюмогидрид лития в растворителе, таком как ТГФ или диэтиловый эфир, как описано у Н. С.Synthesis, 1972, 217. Используя альтернативный путь синтеза,промежуточные карбоновые кислоты формулыVII (или их метиловые или этиловые производные) можно восстановить до соответствующих описанных бензиловых спиртов формулы IX. Этот процесс хорошо освещен в литературе и может быть выполнен, используя селективные восстанавливающие агенты, такие как борогидрид натрия (смотри, например, J. V. В. Kanth etOrganic Chemistry, 1973, 38, 2786) и подобные восстанавливающие агенты. Полученные таким образом спирты формулы IX можно затем селективно повторно окислить с получением соответствующих альдегидов формулы IV (R3 = Н), например, используя пиридиниумхлорхромат в метиленхлориде,в соответствии с процедурой Е. J. Corey et al.,Tetrahedron Letters, 1975, 31, 2647-2650 или C.G. Huang, Journal of Organic Chemistry, 1991,56(16), 4846-4853. Гидроксильную группу соединения формулы IX можно также превратить в более реакционноспособную уходящую группу L2 (например мезилат, трифлат), как описано в научной литературе (смотри, например, М. S.Newman et al., J. Organic Chemistry, 1974, 39 1036; and E. K. Anderson et al., Synthesis, 1974,665) с образованием промежуточных соединений формулы X, которые могут затем реагировать с соответствующими аминами формулыHNR1R2, с образованием соответствующих желаемых соединений формулы I. Схемы 3 и 4 иллюстрируют процессы, которые можно применять для введения заместителей (R3 и R4) в альфа положение боковой цепи бензиламина. По схеме 3 в соответствии с процедурой D. J. Calderwood et al., (TetrahedronVI или амид формулы VIII могут быть обработаны реагентом формулы R3MJ2 (где М является металлом, таким как церий, и J является галогеном, таким как Cl или Вr) с образованием соединения формулы I, где R1 = R2 = водород. Такие соединения можно затем превратить в соединения формулы I, где R1 и R2 отличны от водорода, например, посредством процедур восстановительного аминирования, описанных здесь. Альтернативно, в соответствии со схемой 4 промежуточные соединения формулы IV могут реагировать, например, с реактивом Гриньяра (то есть R4MgJ) в хорошо созданных условиях с образованием промежуточных спиртов формулы XI. Такие спирты формулы XI можно превратить одним из нескольких способов. Например, спирт может реагировать с NaN3 в водном ДМФ с заменой ОН в формуле XI на N3, в соответствии с процедурой Sharpless et аl., (Tetrahedron Letters, 1996, 37(19), 3219-3222. Полученное таким образом азидопроизводное можно затем восстановить до первичного амина формулы I (R1 = R2 = Н) в различных условиях, например, используя водород и сульфат бария в 15 этаноле (A. Guy et al., Synthesis, 1988, 11, 900904), алюмогидрид лития в эфире (М. Saito et al.,Journal of Medicinal Chemistry. 1980, 23(12),1364) или трибутилгидрид олова в бензоле (J.Sosiety, 1985, 107(2), 519). Полученный таким образом первичный амин (-NH2) соединения формулы I можно превратить в соединения формулы I, где R1 и R2 отличны от водорода, как описано ранее. В дополнение к способам, описанным выше на схемах 1 и 2 для получения промежуточных альдегидов и кетонов формулы IV, существуют другие способы, которые обеспечивают получение соединений формулы IV. Например,соединение формулы XII, в котором группа Z является атомом водорода, может взаимодействовать в условиях ацилирования по ФриделюКравтсу (например АlCl3/СН 2 Сl2/R3 СОСl) с образованием кетонов формулы IV, в которых R3 не является водородом. Эта процедура изображена на схеме 5 и хорошо освещена в научной литературе. Местоположение ацильной группы(COR3) может определяться природой и местоположением имеющихся заместителей X и/илиY, а также условиями реакции. В случаях, когда желательно получить соединения формулы IV(R3 = Н) из XII (Z = Н), введение функциональной альдегидной группы (СНО) можно осуществить, используя условия, описанные выше для получения промежуточных соединений IIа и IIb на схеме 1. Получение соединений формулы IV, где R3= Н (то есть альдегидов), можно осуществить,используя одну или более чем одну известные процедуры для формилирования ароматических колец, включающие в себя реакцию дихлордиметилового эфира и тетрахлорида титана (IV) в метиленхлориде, в соответствии с процедурой,описанной у М. L. Mancini et al., Synthetic Communications, 1989, 2001-2007 или Н. Chikashita etal., J. Organic Chemistry, 1991, 56, 1692. Альтернативно, в результате взаимодействия соединений формулы XII, где Z является галогеном (например Вr, I), с сильным основанием (например н-сек- или тpeт-бутиллитием,диизопропиламидом лития) в инертном растворителе, таким как гексан или ТГФ, с последующим взаимодействием с реагентом, таким какN,N-диметилформамид (ДМФ), образуются альдегиды, подобные альдегидам формулы IV. (См.M. P. Hoyer et al J. Organic Chemistry. 1986,51(26), 5106; и N. Eisen etal., Angew. Chem. International Edition, 1986, 25(11), 1026). Другой способ для получения соединений формулы IV состоит в окислении алкильной группы (например СН 3, С 2 Н 5) в Z положении соединений формулы XII. Окисление может приводить к образованию альдегида формулы 16 1983, (12), 1000; European Patent 451650, 1991,Bayer AG), или в более жестких условиях может происходить образование карбоновой кислоты формулы VII, которую затем можно превратить в соединения формулы I, как показано на схеме 2. Успех этой окислительной процедуры будет,конечно, зависеть от природы и местоположения дополнительных заместителей X и Y в соединениях формулы XII. Еще одна альтернатива для получения промежуточных соединений формулы IV иллюстрирована на схеме 6. Соединения формулыLetters, 1987, 28(31), 3627) и Е. Roberts et al.,(Journal of Chemical Sosiety, 1925, 127, 2004),можно восстановить в обнаруженных в химической литературе условиях до соответствующих аминов формулы XIV. Эти реакции восстановления можно выполнить, используя газообразный водород (Н 2) и катализатор (например Pd/C,никель Ренея) в спиртовом растворителе, таком как этанол, при давлениях водорода примерно от одной атмосферы до примерно пяти атмосфер, или используя восстановление in situ (железо/уксусная кислота или олово/соляная кислота) с образованием соответствующих соединений формулы XIV. Эти последние промежуточные соединения формулы XIV можно затем превратить через их диазониевые соли (полученные, например, используя NaNO2 и водныйClarke и R. R. Read, Organic Synthesis, 1941,514), которые затем можно превратить через соответствующие карбоновые кислоты формулы VII в альдегиды общей формулы IV, где R3 = Н, как показано на схеме 2. Промежуточные соединения формулы XIV также можно непосредственно превратить в соответствующие альдегиды формулы IV путем их взаимодействия с формальдоксимом с последующим кислотным гидролизом, как описано уW.F. Beech в J. Chemical Society, 1954, 1297. Для получения соединений общей формулы I, где R2 и R3, взятые вместе с атомом азота,к которому присоединен R2, и атомом углерода,к которому присоединен R3, образуют азотсодержащее кольцо, можно использовать адаптацию процедуры, описанную у L. S. Bleicher etal., (J. Organic Chemistry, 1998, 63, 1109), как показано на схеме 7. Так, эфир общей формулыIV (R3 = О-алкил) взаимодействует с циклическим лактамом общей формулы XXX, 17L 4 является реакционно лабильной группой, такой как -СН=СН 2, в присутствии сильного основания, такого как метилат натрия, с образованием промежуточного соединения формулы XXI. Это промежуточное соединение затем можно превратить в соответствующий циклический имин формулы XXII в присутствии сильной кислоты, такой как хлороводородная кислота, обычно при кипячении с обратным холодильником. Потом соединения формулыXXII можно восстановить с образованием циклических аминов формулы XXIII (где R1 = Н),используя, например, борогидрид натрия в метаноле, как описано ранее. Такие соединения формулы XXIII можно затем превратить в соединения формулы XXIII (где R1 такой, как определено для соединений формулы I), как обсуждалось ранее. Активность in vitro соединений по настоящему изобретению по отношению к сайтам обратного захвата конкретного моноамина можно определить, используя синаптосомы крысы или клетки НЕК-293 (культура клеток почки человеческого эмбриона), трансфицированные переносчиком человеческого серотонина, дофамина или норэпинефрина, в соответствии со следующей процедурой, адаптированной из процедур,описанных у S. Snyder et al., (Molecular Pharmacology, 1971, 7, 66-80), D. T. Wong et al., (Biochemical Pharmacology, 1973, 22, 311-322), H. F.Dawley обезглавливают, и мозги быстро удаляют. Кору, гиппокамп и полосатое тело отсекают и помещают в охлажденный на льду сахарозный буфер, 1 грамм в 20 мл буфера (буфер готовят,используя 320 мМ сахарозы, содержащей 1 мг/мл глюкозы, 0,1 мМ этилендиаминтетрауксусной кислоты (ЭДТА), скорректированный до рН = 7,4 с помощью трис(гидроксиметил)аминометана (ТРИС. Ткани гомогенизируют в стеклянной пробирке для гомогенизации с тефлоновым (Teflon) пестиком при 350 об./мин,используя гомогенизатор Поттерса (Potters). Гомогенат центрифугируют при 1000 g в течение 10 мин при 4 С. Полученную надосадочную жидкость повторно центрифугируют при 17000g в течение 20 мин при 4 С. Конечный осадок ресуспендируют в соответствующем объеме сахарозного буфера, что дает менее 10% захвата. Приготовление клеток: клетки НЕК-293,трансфицированные переносчиком человеческого серотонина (5-НТ), норэпинефрина (NE) или дофамина (DA), выращивают в DMEM (модифицированная по способу Дульбекко среда Игла, Life Technologies Inc., 9800 Medical Centertolog no. 26300-053), 2 мМ L-глутамина и 250 мкг/мл G 418 для переносчика 5-НТ и NE, или 2 мкг/мл пуромицина (puromycin) для переносчика DA, для выбранного давления. Клетки выращивают в тройных флаконах Gibco, собирают в забуференный фосфатом физиологический раствор (Life Technologies, catolog no. 14190-136) и разбавляют до соответствующего количества с получением менее 10% захвата. Анализ захвата нейромедиатора: анализы по захвату проводят в стеклянных пробирках,содержащих 50 мкл растворителя, ингибитора или 10 мкМ сертралина, дезипрамина (desipramine) или номифенсина (nomifensine) для анализа неспецифического захвата 5-НТ, NE или DA,соответственно. Каждая пробирка содержит 400 мкл [3H]5-HT (5 нМ в конце), [3H]NE (10 нМ в конце) или [3H]DA (5 нМ в конце), приготовленные в модифицированном растворе Кребса(Krebs), содержащего 100 мкМ паргилина (pargyline) и глюкозу (1 мг/мл). Пробирки помещают на лед и добавляют в каждую пробирку 50 мкл синаптосом или клеток. Пробирки затем инкубируют при 37 С в течение 7 мин (5-НТ, DA) или в течение 10 мин (NE). Инкубацию прерывают путем фильтрования (GF/B фильтры), используя 96-луночный харвестер клеток Бранделя (Brandel), фильтры промывают модифицированным буфером Кребса (Krebs) и подсчитывают, используя сцинтилляционный счетчик Wallac Model 1214 или Wallac Beta Plate Model 1205. Примеры экспериментов Получение 1. 2-(3,4-Дихлорфенокси)-5 трифторметилбензальдегид. В атмосфере азота в круглодонную колбу объемом 50 мл, снабженную обратным холодильником и магнитной мешалкой, поместили 0,829 г (6,0 ммоль) K2 СО 3 и 0,342 г (2,1 ммоль) 3,4-дихлорфенолаCo.,Milwaukee, Wl) в 10 мл безводного N,Nдиметилформамида (ДМФ). После перемешивания смеси в течение 5 мин добавили 0,384 г (2,0 ммоль) 2 фтор-5-трифторметилбензальдегида (Aldrich), и смесь нагревали при 90-95 С в течение ночи. После того, как реакционной смеси дали охладиться до комнатной температуры, смесь разбавили водой и ЕtOАс (этилацетатом), водный слой экстрагировали дополнительной порцией ЕtOАс, и органические слои объединяли, промывали водой и насыщенным раствором NaCl и сушили над MgSO4. После удаления растворителя в вакууме получили светло-желтое масло(0,680 г). 1 Н-ЯМР (CDCl3, 400 МГц) d 10.46 (s, 1H),8.18 (s, 1H), 7.74 (m, 1H), 7.48 (m, 1H), 7.23 (m,1H), 6.97 (m, 2H). Масс-спектр (ГХ/МС (газовая хроматофафия/масс-спектрометрия), m/z): 334 (m+). Аналогичным способом были получены следующие альдегидные и кетоновые промежуточные соединения формулы IV: Получение 32. 5-Циано-2-(3,4-дихлорфенокси)бензальдегид. В атмосфере азота в высушенной пламенем трехгорлой круглодонной колбе, снабженной обратным холодильником и магнитной мешалкой, смесь 5-бром-2-(3,4-дихлорфенокси) бензальдегида (3,0 г, 8,7 ммоль), цианида цинка(II) (1,5 г, 13 ммоль) и тетракис(трифенилфосфин) палладия (0) (1,5 г, 1,3 ммоль) в безводном ДМФ (145 мл) перемешивали при комнатной температуре, дегазируя азотом в течение 5 мин. После нагревания приблизительно при 80 С в течение 90 мин реакцию считали законченной, проверяя с помощью ТСХ (тонкослойная хроматография) (50% СН 2 Сl:гексаны), и оставили охлаждаться до комнатной температуры. Реакционную смесь затем разбавили водой и этилацетатом и перемешивали еще в течение 10 мин. Водный слой отделили, дважды экстраги 21 ровали этилацетатом и объединили с исходным этилацетатным слоем, промыли водным раствором сегнетовой соли (виннокислый калийнатрий), а затем водным раствором NaCl. Органический слой сушили Na2SO4, отфильтровали и сконцентрировали в вакууме до масла. В результате флэш-хроматографии полученного масла на силикагелевой колонке 15 х 5 см с элюированием смесью СН 2 Сl2:гексаны (1:1) получили указанный в заголовке продукт в виде белого твердого вещества, 1,5 г (60%), tпл. = 122126 С. Масс-спектр (ГХ/МС, m/z): 291 (m+), 262. 1 Н-ЯМР (CDCl3, d): 10.47 (s, 1H), 8.22 (d,1H), 7.75 (dd, 1H), 7.53 (d, 1H), 7.25 (m, 1H), 6.98(dd, 1H), 6.92 (d, 1H). Аналогичным способом был получен 4 циано-2-(3,4-дихлорфенокси)бензальдегид из соответствующего 4-бром-2-(3,4-дихлорфенокси)бензальдегида в виде прозрачного масла с выходом 16%. Масс-спектр (ГХ/МС, m/z): 291 (m+). 1 Н-ЯМР (CDCl3, d): 10.45 (s, 1H), 8.02 (d,1H), 7,55 (m, 2H), 7.23 (m, 1H), 7.14 (m, 1H), 6.96(dd, 1H). Получение 33. 4,5-Диметокси-2-фторбензальдегид. В высушенную пламенем круглодонную колбу, снабженную магнитной мешалкой и впускным отверстием для азота, поместили 4 фторвератрол (0,78 г, 5,0 ммоль, Aldrich Chemical Co.) в 20 мл безводного CH2Cl2. После охлаждения до 0 С добавили хлорид титана (IV)(0,91 мл, 1,57 г, 8,3 ммоль) и через 10 мин добавили 1,1-дихлордиметиловый эфир (0,45 мл,0,575 г, 5,0 ммоль). Смесь оставили нагреваться до комнатной температуры и через 2 ч погасили избытком водного насыщенного раствораNаНСО 3. Суспензию отфильтровали через фильтрующую пластинку d.e. (диатомовая земля), водную фазу экстрагировали дополнительными количествами CH2Cl2, и органические фазы объединили и промыли водой, затем водным насыщенным раствором NaCl. После сушки сMgSО 4 органический растворитель удалили в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества(910 мг). 1 Н-ЯМР (CDCl3, d): 10.2 (s, 1 Н). 7.26 (d,1H), 6.64 (d, 1H), 3.93 (s, 3H), 3.89 (s, 3 Н). Получение 34. 2-(3,4-Дихлорфенокси)-5 фторбензонитрил. В атмосфере азота в одногорлой круглодонной колбе, снабженной обратным холодильником и магнитной мешалкой, смесь 3,4 дихлорфенола (1,96 г, 12 ммоль) и безводного карбоната калия (4,14 г, 30 ммоль) в безводномN,N-диметилформамиде (ДМФ, 50 мл) обработали 2,5-дифторбензонитрилом (1,39 г, 10 ммоль, Aldrich Chemical Co., Milwaukee, Wl) и нагревали до 95-100 С в течение 18 ч. Смесь затем охладили до комнатной температуры и 22 разбавили водой и этилацетатом (ЕА), водный слой экстрагировали дополнительными порциями ЕА, и этилацетатные слои объединяли, промывали водой, 2 н. NaOH, водой и, наконец, насыщенным водным раствором NaCl. После высушивания над MgSО 4 растворитель удаляли в вакууме с получением рыжевато-коричневого твердого вещества. Масс-спектр (ГХ/МС): 281 (m+). 1 Н-ЯМР (CDCl3, 300 МГц, d): 7.43 (d, 1 Н),7.37 (dd, 1 Н), 7.26 (т, 1 Н), 7.12 (d, 1H), 6.92(m,2H). Аналогичным способом были получены следующие бензонитрилы формулы VI, выделенные в результате флэш-хроматографии (силикагель, элюирование 20% СН 2 Сl2 в гексанах): Получение 38. 2-(3,4-Дихлорфенокси)-5 фтор-N-метилбензамид. К смеси 0,602 г (2,0 ммоль) 2-(3,4 дихлорфенокси)-5-фторбензойной кислоты в 20 мл безводного бензола добавили две капли N,Nдиметилформамида (ДМФ) с последующим медленным добавлением 0,785 г (481 мкл, 6,6 ммоль) тионилхлорида. После нагревания смеси до температуры дефлегмации в течение 3,5 ч раствор перемешивали при комнатной температуре в течение ночи и сконцентрировали в вакууме с получением рыжевато-коричневого масла, которое затем дважды подвергли азеотропной перегонке со свежими порциями бензола. Остаток снова растворили в 4 мл бензола и добавили к 15 мл 1,0 М CH3NH2 в СН 3 ОН (Aldrich Chem. Co) при 25 С. Через 12 ч смесь сконцентрировали в вакууме и распределили между водой и ЕtOАс. Водный слой затем экстрагировали дополнительной порцией ЕtOАс,объединенные органические экстракты промыли водой, затем насыщенным водным растворомNaCl, сушили MgSO4, отфильтровали и концентрировали в вакууме до коричневого масла, которое медленно затвердело при стоянии (0,654 г). 1 Н-ЯМР (CDCl3, 400 МГц, 6): 7,89 (dd, 1H),7.41 (d, 1H), 7.30 (bs, 1H, NH), 7.09 (m, 2H), 6.83(m, 2H), 2.95 (d, 3 Н). Получение 39. 2-(3,4-Дихлорфенокси)-5 фторбензонитрил. В высушенную пламенем колбу, снабженную впускным отверстием для азота и магнитной мешалкой, поместили 2,9 г (18 ммоль) 3,4 дихлорфенола, 6,2 г (45 ммоль) карбоната калия и 50 мл безводного ДМФ. При перемешивании добавили 2,08 г (15 ммоль) 2,5-дифторбензо 23 нитрила (Aldrich Chem. Co), и смесь нагревали в течение ночи при 105 С. Охладили до комнатной температуры и распределили между водой и этилацетатом. Водный слой повторно экстрагировали этилацетатом, объединенные органические слои промыли последовательно 2 н. NaOH,водой, насыщенным водным NaCl и сушилиMgSO4. В результате удаления растворителя в вакууме получили указанный в заголовке продукт в виде светло-бурого масла, которое медленно затвердело (3,5 г). Масс-спектр (APCI (химическая ионизация при атмосферном давлении), m/z): 281 (m+). 1 Н-ЯМР (CDCl3, 400 МГц, ): 7.43 (d, 1H),7.37 (dd, 1H), 7.26 (m, 1H), 7.12 (d, 1H), 6.92(m,2H). Получение 40. 2-(3,4-Дихлорфенокси)-3 фторбензальдегид. В высушенную пламенем колбу, снабженную впускным отверстием для азота и магнитной мешалкой, поместили при перемешивании при комнатной температуре 1,24 г (9 ммоль) карбоната калия и 20 мл безводного ДМФ, а затем 0,513 г (3,15 ммоль) 3,4-дихлорфенола. Через 5 мин добавили 0,426 г (3,0 ммоль) 2,5 дифторбензальдегида (Aldrich Chem. Co), и смесь нагревали при 95 С в течение 18 ч. После охлаждения до комнатной температуры смесь разбавили водой, дважды экстрагировали ЕеtO,и органические экстракты промыли водой и насыщенным NaCl и высушили над MgSO4. В результате удаления растворителя получили коричневое масло (963 мг), которое подвергли хроматографированию (силикагель 230-400 меш, элюирование смесью (5% ЕtOАс:95% гексаны. Указанный в заголовке продукт выделили из соответствующих фракций в виде белого легкоплавкого твердого вещества (0,572 г). 1 Н-ЯМР (CDCl3, 400 МГц, 5): 7.60 (dd, 1H),7.42 (d, 1H), 7.28 (m, 1H), 7.10 (d, 1H), 6.95 (dd,1H), 6.87 (dd, 1H). Пример 1. 2-Фтор-6-(паратолилокси)бензиламин. В высушенную пламенем колбу, снабженную впускным отверстием для азота и магнитной мешалкой, поместили 6,0 мл 1,0 М алюмогидрида лития в ТГФ (6,0 ммоль, Aldrich Chem.Co.) и добавили дополнительно 10 мл безводного ТГФ при комнатной температуре. При перемешивании добавили с помощью шприца 0,341 г (1,5 ммоль) 2-фтор-6-(паратолилокси)бензонитрила (Maybridge Chem. Co. Ltd., Trevillett,Tintagael, Cornwall, UK), что вызывало небольшое вспенивание. Через 4 ч ТСХ (тонкослойная хроматография) (СНСl3:СН 3OН, 95:5) показала отсутствие исходного материала и наличие двух новых очень полярных пятен. При охлаждении на ледяной бане реакционную смесь погасили,используя 230 мл Н 2 О, 230 мл 15% NaOH и затем 690 мл Н 2 О. После перемешивания при комнатной температуре в течение 15 мин, смесь 24 отфильтровали через пластинку диатомовой земли, затем пластинку промыли малыми количествами CH2Cl2, и объединенный органический фильтрат сконцентрировали в вакууме с получением желтого масла (0,287 г). Его подвергли хроматографированию (10 г силикагеля (230400 меш, элюируя сначала CH2Cl2, а затем добавляя СН 3 ОН во все возрастающих количествах. В результате элюирования получили 2 фтор-6-(паратолилокси)бензиламин (менее полярный из двух пятен) в виде желтого масла(m -NH3). 1 Н-ЯМР (CDCl3, 400 МГц): d 7.12 (m, 3 Н),6.86 (m, 2H), 6.78 (t, 1H), 6.60 (dd, 1H), 3.92 (s,2H), 2.32 (s, ЗН), 1.72 (bs, 2H, NH2). В результате дальнейшего элюирования получили 2-(паратолилокси)бензиламин (более полярный компонент) в виде желтого масла(0,082 г). 1 Н-ЯМР (CDCl3, 400 МГц): d 7.34 (d, 1H),7.12 (m, 4H), 6.86 (m, 3 Н), 3.87 (s, 2 Н), 2.31 (s,3 Н), 1.80 (bs, 2H, NH2). Аналогичными способами были получены следующие бензиламины формулы I (где R1-4 = Н ) из соответствующих бензонитрилов формулы VI: Пример 6. Малеат[2-(3,4-дихлорфенокси)5-трифторметилбензил]диметиламина. В круглодонную колбу, снабженную магнитной мешалкой и впускным отверстием для азота, поместили 0,331 г (4,06 ммоль) гидрохлорида диметиламина (Aldrich) и 0,410 г (4,06 ммоль) триэтиламина в 25 мл этанола при перемешивании, пока раствор не стал прозрачным. При комнатной температуре добавили с помощью шприца 1,15 г (1,2 мл, 4,06 ммоль) изопропилата титана (IV), затем 0,680 г (2,03 ммоль) 2(3,4-дихлорфенокси)-5-трифторметилбензальдегида с образованием желто-бурого раствора,который перемешивали в течение ночи. К полученному мутному раствору добавили 0,115 г(3,05 ммоль) борогидрида натрия, и перемеши 25 вание продолжали в течение 24 ч. Реакционную смесь погасили 6 н. HCl (рН = 10), перемешивали еще 2 ч и разбавили этилацетатом. Водный слой сделали основным с помощью насыщенного водного Na2CO3, добавили дополнительный слой этилацетата, и двухслойную смесь отфильтровали через пластинку диатомовой земли(d.e.), хорошо промыли пластинку этилацетатом и водой. Этилацетатный слой объединили с дополнительными экстрактами водного слоя, объединенные органические слои промыли насыщенным водным NaCl, высушили MgSO4 и сконцентрировали в вакууме с получением желтого масла (0,626 г). Масс-спектр (APCI, m/z): 366, 364 (m+). 1 Н-ЯМР (CDCl3, 400 МГц): d 7.78 (s, 1H),7.47 (dd, 1H), 7.39 (s, 1H), 7.04 (s, 1 Н), 6.90 (dd,1H), 6.80 (dd, 1H), 3.48 (s, 2 Н), 2.26 (s, 6H). Полученное масло, растворенное в безводном диэтиловом эфире, обработали раствором малеиновой кислоты (0,199 г) в 2 мл ацетона. Смесь отфильтровали через тонкую пластинкуd.e., чтобы раствор стал прозрачным, и перемешивали при комнатной температуре в течение 8 ч. Полученные твердые вещества отфильтровали, промыли диэтиловым эфиром и сушили в вакууме (t пл= 127-128 С). Элементный анализ для формулыC16H14Cl2F3NOC4H4O4. Вычислено: С 50.01, Н 3.77, N 2.92. Найдено: С 49.93, Н 3.85, N 3.04. Аналогичным способом были получены следующие соединения формулы I, где R4 является водородом. Пример 52. Малеат (2-фтор-6-(паратолилокси)бензил)диметиламина (1, R12 =CH3). В атмосфере азота раствор 0,120 г (0,52 ммоль) 2-фтор-6-(паратолилокси)бензиламина(2,86 ммоль) 37% водного формальдегида (Aldrich), при этом образовался твердый осадок. Затем добавили триацетоксиборогидрид натрия(0,319 г, 1,43 ммоль), при этом образовывалась пена до просветления раствора. После перемешивания при комнатной температуре в течение ночи добавили воду и этилацетат, затем водный слой экстрагировали этилацетатом, органические слои объединяли и промывали водой и насыщенным NaCl. После высушивания надMgSO4 растворитель удаляли в вакууме с получением светло-желтой пленки (0,110 г). Масс-спектр (APCl, m/z): 260 (m+1). 1 Н-ЯМР (CDC,l3, 400 МГц): d 7.28 (m, 1H),7.14 (m, 2H), 6.91 (m, 2H), 6.83 (t, 1 Н), 6.56 (d,1H), 4.38 (s, 2H), 2.79 (s, 6H), 2.32 (s, 3 Н). Сырой амин (84 мг) растворили в диэтиловом эфире и обработали раствором 38 мг малеиновой кислоты (1 эквивалент) в 2 мл ацетона. После перемешивания при комнатной температуре в течение 18 ч белую твердую соль отфильтровали, промыли небольшими количествами диэтилового эфира и высушили в высоком 28 вакууме с получением 0,048 г указанного в заголовке продукта (t пл.= 147-148 С). Элементный анализ для формулыC16H18FNOC4H4O4. Вычислено: С 63.99, Н 5.90,N 3.73. Найдено: С 63.97, Н 5.91, N 3.67. Пример 53. Гидрохлорид 4-(3,4-дихлорфенокси)-3-(диметиламинометил)фениламина. В атмосфере азота, в склянке аппарата Парра (Parr) объемом 250 мл смешали 0,265 г 10% Pd на углероде, 30 мл этилацетата и 0,53 г(1,55 ммоль) [2-(3,4-дихлорфенокси)-5-нитробензил]диметиламина (получен как в приготовлении 1) с последующим добавлением 2 капель уксусной кислоты. Смесь гидрировали при давлении водорода 40-45 фунтов/кв.дюйм (275,8310,3 кПа) в течение 90 мин. К этому моменту времени ТСХ (90:10 CHCl3:CH3OH) показала отсутствие исходного материала. Добавили насыщенный NaHCO3, чтобы рН было больше 7,раствор отфильтровали через пластинку d.e. и промыли ее водой и этилацетатом. Органические слои объединили, промыли водой и насыщенным NaCl, высушили над MgSO4 и сконцентрировали в вакууме до рыжевато-коричневого масла (0,325 г). Масс-спектр (APCI, m/z): 313, 311. 1 Н-ЯМР (CDCl3, 400 МГц): d 7.39 (m, 2H),7.21 (m, 3 Н), 6.70 (dd, 1H), 4.52 (s, 2H), 2.89 (s,6H). Масло растворили в диэтиловом эфире,смешали с 2,1 мл 1,0 М HCl в диэтиловом эфире(Aldrich), перемешивали при комнатной температуре в течение 2 ч и отфильтровали. После сушки в вакууме получили указанный в заголовке продукт (0,286 г, tпл.= 228 С). Пример 54. Гидрохлорид N-[4-(3,4 дихлорфенокси)-3-диметиламинометилфенил] ацетамида. К суспензии 0,130 г (0,375 ммоль) гидрохлорида 4-(3,4-дихлорфенокси)-3-(диметиламинометил)фениламина (из примера 53) в 3 мл толуола при комнатной температуре, в атмосфере азота, добавили 110 мл триэтиламина. Через 2 ч добавили 28 мл (0,394 ммоль) ацетилхлорида, и смесь перемешивали еще 1 ч, после чего ее разбавили этилацетатом и насыщенным воднымNaHCO3. Водный слой затем экстрагировали этилацетатом, и органические слои объединили,промыли водой и насыщенным NaCl, сушилиMgSO4 и сконцентрировали с получением рыжевато-коричневого масла (0,116 г). Масс-спектр (APCl, m/z): 355, 353. Сырой продукт растворили в диэтиловом эфире, смешали с 330 мл 1,0 М HCl в диэтиловом эфире. После перемешивания при комнатной температуре твердые вещества отфильтровали и промыли малыми количествами диэтилового эфира, высушили в вакууме с получением указанного в заголовке продукта (88 мг, t пл.= 199-202 С). 29 Элементный анализ для формулыChem. Co., Milwaukee, Wl) в 60 мл безводного толуола. После перемешивания смеси в течение 5 мин добавили 89 мг (0,24 ммоль) трифторметансульфоната меди (II) (трифлат меди) и 0,26 гCommunications, 1975, vol. 40, p728), и смесь нагревали до температуры дефлегмации в течение ночи. Развитие реакции контролировали,используя ТСХ(элюирование смесью СНСl3:СН 3 ОН:АсОН (9:1:0,5. После того, как реакционной смеси дали охладиться до комнатной температуры, ее разбавили водой и этилацетатом; водный слой подкислили 6 н. HCl и повторно экстрагировали дополнительной порцией этилацетата. Органические слои объединили,промыли водой и насыщенным NaCl, высушили над MgSO4. После удаления растворителя в вакууме получили темно-коричневое масло (2,6 г),представляющее собой смесь указанного в заголовке продукта и непрореагировавшую 5-фтор 2-иодбензойную кислоту. Альтернативно, раствор 4,28 г (15 ммоль) 2-(3,4-дихлорфенокси)-5-фторбензальдегида(получение 5) в 25 мл ацетона охладили до 510 С и с помощью шприца обработали его 5,8 мл (15,6 ммоль) 2,67 М реагента Джонса(Jones). Через 1 ч при этой температуре реакционную смесь погасили с помощью 8 мл изопропанола, оставили нагреваться до 25 С и отфильтровали через пластинку d.e. Фильтрат сконцентрировали в вакууме примерно до 1/4 от первоначального объема, разбавили водой и несколько раз экстрагировали CHCl3. Органические слои промыли водой, затем насыщеннымNaCl, высушили над MgSO4 и сконцентрировали. В результате получили 2-(3,4-дихлорфенокси)-5-фторбензойную кислоту в виде рыжевато-коричневого твердого вещества (4,19 г). 1 Н-ЯМР (CDCl3, 400 МГц, ): 7.78 (dd, 1H),7.38 (d, 1H), 7.27 (m, 1H), 6.98 (т, 2 Н), 6.81 (dd,1H). Реагент Джонса был получен из 13,4 г триоксида хрома и 11,5 мл концентрированнойH2SO4 и разбавлен водой до конечного объема 50 мл. Б. Этиловый эфир 2-(3,4-дихлорфенокси)5-фторбензойной кислоты. 30 Смесь продуктов, полученных на предыдущей стадии, в 75 мл этанола обработали 1 млH2SO4 и нагревали до температуры дефлегмации в течение 7 ч, затем перемешивали при комнатной температуре в течение ночи. Растворитель удалили в вакууме, остаток растворили в этилацетате, промыли его водой, насыщенным водным Na2CO3 и снова водой. После сушки сMgSO4 растворитель выпарили в вакууме, в результате получили коричневое масло (2,1 г). 1 Н-ЯМР (CDCl3, 400 МГц, 8): 7.64 (dd, 1H),7.31 (d, 1H), 7.22 (m, 1H), 7.03 (dd, 1H), 6.92 (s,1H), 6.72 (dd, 1H), 4.24 (q, 2H), 1.19 (t, 3 Н). В. 3-[2-(3,4-Дихлорфенокси)-5-фторбензоил]-1-винилпирролидин-2-он. В атмосфере азота раствор 12,2 мл (12,2 ммоль) 1,0 М бис-(триметилсилил)амида лития в ТГФ (Aldrich Chem. Co.) перемешали и охладили до -30 С, одновременно с помощью шприца добавили 781 мкл (0,812 г, 7,31 ммоль) 1 винил-2-пирролидинона (Aldrich Chem. Co.). После перемешивания при этой температуре в течение 1 ч добавили полученный на предыдущей стадии этиловый эфир в 20 мл ТГФ, в результате получили почти черный раствор. Смесь перемешивали при комнатной температуре в течение 72 ч, затем разбавили водой и этилацетатом. Водный слой затем экстрагировали этилацетатом, органические слои объединили, промыли водой и насыщенным NaCl, высушили надMgSO4 и сконцентрировали в вакууме с получением рыжевато-коричневой пены (2,18 г). Этот материал использовали без очистки на следующей стадии. Г. 5-[2-(3,4-Дихлорфенокси)-5-фторфенил]-2,3-дигидро-1 Н-пиррол. Материал, полученный на предыдущей стадии, объединили с 40 мл 6 н. HCl и кипятили с обратным холодильником в течение 30 мин,при этом образовался смолистый осадок. Добавили 30 мл 1,4-диоксана, и полученный раствор кипятили с обратным холодильником дополнительно в течение 30 ч с образованием черного раствора. Реакционную смесь подщелочили насыщенным водным K2 СО 3 и трижды экстрагировали этилацетатом. Объединенные органические экстракты промыли водой и насыщеннымNaCl, высушили МgSO4 и обработали активированным углем (Darco G60). Отфильтровали через пластинку d.e., хорошо промыли ее этилацетатом и сконцентрировали фильтрат, в результате чего получили рыжевато-коричневое масло(0,803 г), которое без дальнейшей очистки использовали на следующей стадии. Масс-спектр (т/е): 325, 323 (m+). Д. Гидрохлорид 2-[2-(3,4-дихлорфенокси)5-фторфенил]пирролидина. К полученному на предыдущей стадии материалу (0,300 г, 0,93 ммоль) в 15 мл абсолютного этанола добавили 70 мг (1,86 ммоль) борогидрида натрия при комнатной температуре в атмосфере азота (Осторожно: вспенивание). 31 Через 24 ч ТСХ (СНСl3:СН 3 ОН, 95:5) показала,что образовался новый полярный продукт. Добавили воду, чтобы погасить оставшийся борогидрид натрия, и смесь упарили до прозрачного масла, которое повторно растворили в этилацетате и промыли водой. Органический слой затем промыли водой, насыщенным NaCl, затем высушили MgSO4 и удалили растворитель в вакууме. В результате получили прозрачную пленку (0,202 г). Масс-спектр (m/е): 328, 326 (m+1). 1 Н-ЯМР (CDCl3, 400 МГц, ): 7.35 (dd, 1H),7.32 (d, 1H), 6.96 (d, 1H), 6.87 (m, 2H), 6.73 (dd,1H), 4.26 (t, 1H), 3.11 (m, 1H), 2.97 (m, 1H), 1.78(m, 2H), 1.52 (m, 1H). Свободное основание растворили в 5 мл диэтилового эфира, смешали с 622 мл 1,0 М HCl в диэтиловом эфире и затем перемешивали в течение 1,5 ч с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (165 мг, tпл.= 171-173 С). Масс-спектр (m/е): 328, 326 (m+1). Элементный анализ для формулыC16H14Cl2FNOHCl. Вычислено: С 52.99, Н 4.17,N 3.86. Найдено: С 53.23, Н 4.25, N 3.89. Пример 56. [2-(3,4-Дихлорфенокси)-5 фторбензил]метиламин. В атмосфере азота смесь 0,313 г (1,0 ммоль) 2-(3,4-дихлорфенокси)-5-фтор-N-метилбензамида в 5,0 мл безводного ТГФ обработали с помощью шприца 4,0 мл (4,0 ммоль) 1,0 М ВН 3 в ТГФ (Aldrich Chem. Co.), эту смесь нагревали до температуры дефлегмации в течение 48 ч. Реакционную смесь погасили путем добавления 25 мл 6 н. HCl и нагревали до температуры дефлегмации до тех пор, пока свободный амин не перестал детектироваться с помощью ТСХ(СНСl3: СН 3 ОН:ТЭА (триэтиламин) 95:5:1). Охлажденную смесь затем разбавили водой, подщелочили K2 СО 3 и экстрагировали этилацетатом. Объединенные органические слои промыли водой и насыщенным NaCl, затем высушилиMgSO4, отфильтровали и сконцентрировали в вакууме до свободного основания в виде светлокоричневого масла (0,164 г, 54%). Это соединение превратили в соль гидрохлорид, как описано ранее (t пл. = 200-202 С). Пример 57. 2-(3,4-Дихлорфенокси)-5 фторбензиламин. В высушенную пламенем колбу, снабженную впускным отверстием для азота и магнитной мешалкой, поместили 3,0 мл 2,0 М комплекса боранметилсульфид в ТГФ (6,0 ммольAldrich Chem. Co.) и затем дополнительно 10 мл безводного ТГФ при комнатной температуре. При перемешивании добавили медленно с помощью шприца 0,562 г (2,0 ммоль) 2-(3,4 дихлорфенокси)-5-фторбензонитрила (указанное в заголовке соединение получения 37), что вызывало некоторое пенообразование. После этого реакционную смесь нагревали с обратным(СНСl3:СН 3 ОН:конц. NH4OH, 95:5:1) показала отсутствие исходного материала. При охлаждении на ледяной бане реакционную смесь погасили, используя 10 мл 6 н. HCl, затем дополнительно нагревали до температуры дефлегмации в течение 1 ч, чтобы разрушить борный комплекс, и медленно подщелочили насыщенным водным Nа 2 СО 3. Смесь разбавили водой и этилацетатом, органический слой объединили со второй экстракцией водного слоя и затем промыли водой и насыщенным водным NaCl. После сушки над MgSO4 растворитель удалили в вакууме с получением желто-коричневого масла(0,676 г). Масло распределили между диэтиловым эфиром и 6 н. HCl. Эфирный слой повторно экстрагировали 6 н. HCl, водные слои объединили, подщелочили водным Nа 2 СО 3 и экстрагировали повторно диэтиловым эфиром. Эти последние органические экстракты сушили(MgSO4) и сконцентрировали в вакууме до рыжевато-коричневого масла (0,538 г). Масс-спектр (APCI, m/z): 286 (m+1), 288. Масло растворили в диэтиловом эфире и смешали с 2,0 мл 1,0 М HCl в диэтиловом эфире. Полученные твердые вещества перемешивали при комнатной температуре в течение 2 ч,отфильтровали, промыли диэтиловым эфиром и высушили в вакууме с получением соли гидрохлорида указанного в заголовке продукта (0,434 г, t пл.= 190-194 С). Элементный анализ для формулыn и m независимо выбраны из 1, 2, 3;R1 и R2 независимо выбраны из водорода,(С 1-С 4)алкила, (С 2-С 4)алкенила и (С 2-С 4)алкинила, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют 4-8-членное насыщенное кольцо, содержащее один или два гетероатома, включая азот, к которому присоединены R1 и R2, где второй гетероатом, если таковой имеется, выбран из кислорода, азота и серы, при условии, что указанное кольцо не может содержать два соседних атома кислорода или два соседних атома серы, и где указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (C1-С 6)алкила;R3 и R4 независимо выбраны из водорода и(С 1-С 4)алкила, возможно замещенного атомами фтора в количестве от одного до трех, или R3 иR4 вместе с атомом углерода, к которому они присоединены, образуют 4-8-членное насыщенное карбоциклическое кольцо, причем указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (С 1-С 6)алкила; или R2 и R3 вместе с атомом азота, к которому присоединен R2, и атомом углерода, к которому присоединен R3, образуют 4-8-членное насыщенное кольцо, содержащее 1 или 2 гетероатома, включая азот, к которому присоединенR2, где второй гетероатом, если таковой имеется, выбран из кислорода, азота и серы, при условии, что указанное кольцо не может содержать два соседних атома кислорода или два соседних атома серы, и где указанное кольцо возможно может быть замещено в пригодных местах связывания заместителями в количестве от одного до трех, независимо выбранными из гидрокси и (С 1-С 6)алкила; каждый X независимо выбран из водорода,галогено (то есть хлоро, фторо, бромо или иодо), (С 1-С 4)алкила, возможно замещенного атомами фтора в количестве от одного до трех, (С 1 С 4)алкокси, возможно замещенного атомами фтора в количестве от одного до трех, циано,нитро, амино, (C1-С 4)алкиламино, ди-[(С 1-С 4) алкил]амино, NR5(С=О)(С 1-С 4)алкила, SO2NR5R6 иSОр(С 1-С 6)алкила, где R5 и R6 независимо выбраны из водорода и (C1-С 6)алкила и р равно 0,1 или 2; и каждый Y независимо выбран из водорода,(С 1-С 6)алкила и галогено; при условии, что: (а) не более, чем один изNR1R2, CR3R4 и R2NCR3 может образовывать кольцо, (б) по крайней мере один X должен быть отличным от водорода, когда (1) R3 и R4 оба представляют собой водород, (2) R1 и R2 независимо выбраны из водорода и (С 1-С 4)алкила, и (3) кольцо В является моно- или дизамещенным соответственно одной или двумя галогеногруппами, и (в) если каждый X представляет собой водород и Y представляет собой галоген, то R2NCR3 нe может образовывать 4,5 дигидро-1 Н-имидазольное кольцо, и (г) если R1,R2, R3 и R4 все представляют собой водород и кольцо В является незамещенным, то X не может представлять собой галогено; или его фармацевтически приемлемая соль. 2. Соединение или соль по п.1, где n равно 1, X является фторо, R3 и R4 представляют собой водород, R1 является водородом, R2 является метилом, m равно 2 и Y является Ym, что представляет собой 3,4-дихлоро. 3. Соединение или соль по п.1, где m равно 0, n равно 1, R3 и R4 представляют собой водород, X является хлоро, бромо, иодо или мети 004860 34 лом, R1 является водородом и R2 является метилом. 4. Соединение или соль по п.1, где указанные соединение или соль выбраны из следующих соединений и их фармацевтически приемлемых солей:(+)-2-[2-(3,4-дихлорфенокси)-5-фторфенил]пирролидин и 2-[2-(3,4-дихлорфенокси)-5-фторфенил]-Nметилпирролидин. 5. Фармацевтическая композиция для лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком,депрессии у пациентов с болезнью Паркинсона,депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей,большой депрессии, одноэпизодной депрессии,рекуррентной депрессии, депрессии, вызванной злоупотреблением у детей и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, предпочтительно человека, содержащая количество соединения по п.1,которое эффективно в лечении такого расстройства или состояния, и фармацевтически приемлемый носитель. 6. Фармацевтическая композиция для лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, предпочтительно человека, содержащая количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в лечении такого расстройства или состояния, и фармацевтически приемлемый носитель. 7. Способ лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью Паркинсона, депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин,депрессии у детей, большой депрессии, одноэпизодной депрессии, рекуррентной депрессии,депрессии, вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего,при котором млекопитающему, нуждающемуся в таком лечении, вводят количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в лечении такого расстройства или состояния. 8. Способ лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят количество соединения по п.1, которое эффективно в лечении такого расстройства или состояния. 9. Фармацевтическая композиция для лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком,депрессии у пациентов с болезнью Паркинсона, 004860 36 депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин, депрессии у детей,большой депрессии, одноэпизодной депрессии,рекуррентной депрессии, депрессии, вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего, содержащая эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. 10. Фармацевтическая композиции для лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, норэпинефрина или дофамина, у млекопитающего, содержащая эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения по п.1 и фармацевтически приемлемый носитель. 11. Способ лечения расстройства или состояния, выбранного из депрессии, депрессии у пациентов с раком, депрессии у пациентов с болезнью Паркинсона, депрессии после инфаркта миокарда, субсиндромной симптоматической депрессии, депрессии у бесплодных женщин,депрессии у детей, большой депрессии, одноэпизодной депрессии, рекуррентной депрессии,депрессии, вызванной злоупотреблением у детей, и послеродовой депрессии, расстройства генерализованной тревоги, у млекопитающего,предпочтительно человека, при котором млекопитающему, нуждающемуся в таком лечении,вводят эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения по п.1 или его фармацевтически приемлемой соли. 12. Способ лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, норэпинефрина или дофамина, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят эффективное для ингибирования обратного захвата серотонина, дофамина или норэпинефрина количество соединения формулы I или его фармацевтически приемлемой соли. 13. Фармацевтическая композиция для лечения состояния или расстройства, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, содержащая а) фармацевтически приемлемый носитель; б) соединение по п.1 и в) антагонист NK-1 рецептора или антагонист 5 НТ 1D рецептора либо их фармацевтически приемлемую соль; где количество активных соединений (то есть соединения формулы I и антагониста NK-1 рецептора или антагониста 5 НТ 1D рецептора) таково, что комбинация эффективна в лечении такого расстройства или состояния. 14. Способ лечения расстройства или состояния, которое можно лечить путем ингибирования обратного захвата серотонина, дофамина или норэпинефрина, у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят: а) соединение формулы I, как оно определено выше, или его фармацевтически приемлемую соль и 38 б) антагонист NK-1 рецептора или антагонист 5 НТ 1D рецептора либо их фармацевтически приемлемую соль; где количества активных соединений (то есть соединения формулы I и антагониста NK-1 рецептора или антагониста 5 НТ 1D рецептора) таковы, что комбинация эффективна в лечении такого расстройства или состояния.
МПК / Метки
МПК: C07C 217/58, A61K 31/135, A61P 25/24
Метки: обратного, расстройств, цнс, моноаминов, ингибиторы, захвата, лечения
Код ссылки
<a href="https://eas.patents.su/20-4860-ingibitory-obratnogo-zahvata-monoaminov-dlya-lecheniya-rasstrojjstv-cns.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы обратного захвата моноаминов для лечения расстройств цнс</a>
Предыдущий патент: Новые соединения циклогептена и содержащие их фармацевтические композиции
Следующий патент: Производные пурина
Случайный патент: Устройство для установки ручки, поддерживающего элемента или аналогичного элемента