Производные n-фенил-2-пиримидинамина и способ их получения
Номер патента: 15103
Опубликовано: 30.06.2011
Авторы: Ким Хонг-Ёуб, Лии Гонг-Ял, Ким Ёнг-Сеок, Чо Дае-Жин, Лии Сан-Эйх, Ким Донг-Ён, Хан Бьенг-Чеол, Вуу Сеок-Хун
Формула / Реферат
1. Производное N-фенил-2-пиримидинамина формулы (1)

или его соль, где
R1 представляет селективно замещенный тиазол, имидазол или пиразин, где заместитель является аминогруппой или алкилом, содержащим от 1 до 6 атомов углерода;
R2, R3и R6, каждый независимо, представляет водород, галоген, алкил, содержащий от 1 до 6 атомов углерода, или алкокси, содержащий от 1 до 6 атомов углерода;
R4 и R5, каждый независимо, представляют водород, и R4и R5 не являются одновременно водородом; или
R4 или R5, каждый, представляет радикал формулы (2)
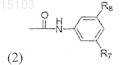
где R7представляет алкил, содержащий от 1 до 6 атомов углерода, или алкил, содержащий от 1 до 6 атомов углерода, замещенный 1-3 галогенами,
R8 представляет алифатический углеводород, имеющий от 5 до 10 атомов углерода, или представляет селективно замещенный 5-7-членный насыщенный или ненасыщенный моноциклический радикал, где заместитель является алкилом, содержащим от 1 до 6 атомов углерода, или бициклический или трициклический радикал, селективно связанный с бензольным кольцом (кольцами), каждое из которых имеет от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, или представляет пиперазинил или гомопиперазинил, каждый из которых замещен алкилом, содержащим от 1 до 6 атомов углерода;
при условии, что если R4 представляет радикал формулы (2), то минимум один из R2, R3, R5 и R6, каждый независимо, представляет водород, галоген, алкил, содержащий от 1 до 6 атомов углерода, или алкокси, содержащий от 1 до 6 атомов углерода; или
при условии, что если R5 представляет радикал формулы (2), то минимум один из R2, R3, R4 и R6, каждый независимо, представляет водород, галоген, алкил, содержащий от 1 до 6 атомов углерода, или алкокси, содержащий от 1 до 6 атомов углерода.
2. Соединение по п.1, где
R1 представляет пиразин, 2-метилпиразин или тиазол;
R4 или R5представляют радикал формулы (2)
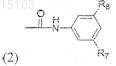
где R7представляет трифторметил или метил,
R8 представляет 2-метилмидазол, 4-метилмидазол,
при условии, что если R4 представляет радикал формулы (2), то минимум один из R2, R3, R5 и R6, каждый независимо, представляет водород, фтор, метил или метокси,
при условии, что если R5 представляет радикал формулы (2), то минимум один из R2, R3, R4 и R6, каждый независимо, представляет водород, фтор, метил или метокси.
3. Соединение по п.1 или 2, выбранное из группы
4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид;
4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид;
4-метил-N-[5-метилтиазол-2-ил]-3-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид;
4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин-2-ил)пиримидин-2-иламино] бензамид;
4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин-2-ил)пиримидин-2-иламино] бензамид;
4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(3-метилпиразин-2-ил)пиримидин-2-иламино]бензамид;
4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(3-метилпиразин-2-ил)пиримидин-2-иламино]бензамид или
N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид дигидрохлорид.
4. Способ получения соединения формулы (1), который включает взаимодействие соединения формулы (4а) или (4b)
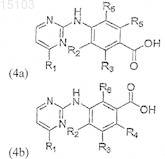
где R1-R6 соответствуют определению в п.1, с соединением формулы (5)
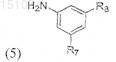
где R7-R8 соответствуют определению в п.1, для образования соединения формулы (1а) или (1b)
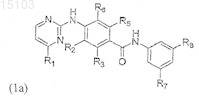
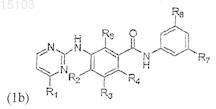
где R1-R8 соответствуют определению в п.1 формулы изобретения.
5. Лекарственный препарат, включающий в себя эффективное количество соединения формулы (1) или его соли согласно определению в одном (любом) из пп.1-3 в качестве действующего вещества вместе с фармацевтически приемлемыми носителями.
6. Лекарственный препарат по п.5, где препарат используется для лечения рака легких, рака желудка, рака толстой кишки, рака поджелудочной железы, гепатомы, рака предстательной железы, рака груди, хронической или острой лейкемии, гематологической злокачественной опухоли, рака головного мозга, рака мочевого пузыря, рака прямой кишки, рака шейки матки и/или лимфомы.
7. Лекарственный препарат по п.5 или 6, используемый для перорального приема.
8. Лекарственный препарат по п.5 или 6, используемый для инъекций.
9. Способ лечения теплокровных животных, заключающийся во введении фармацевтически активного количества соединения формулы (1) или его соли по пп.1-3.
10. Способ по п.9 для лечения рака легких, рака желудка, рака толстой кишки, рака поджелудочной железы, гепатомы, рака предстательной железы, рака груди, хронической или острой лейкемии, гематологической злокачественной опухоли, рака головного мозга, рака мочевого пузыря, рака прямой кишки, рака шейки матки и/или лимфомы.
11. Соединение по п.1 или 2, где R1 представляет пиразин, 2-метилпиразин или тиазол, R2, R3, R5, R6, каждый независимо, представляют водород, R4представляет радикал формулы (2), R7представляет трифторметил или метил и R8представляет 2-метилимидазол или 4-метилимидазол.
12. Соединение по п.1 или 2, где R1представляет пиразин, 2-метилпиразин или тиазол, R2представляет метил, R3, R4, R6, каждый независимо, представляют водород, R5представляет радикал формулы (2), R7представляет трифторметил или метил и R8представляет 2-метилимидазол или 4-метилимидазол.
Текст
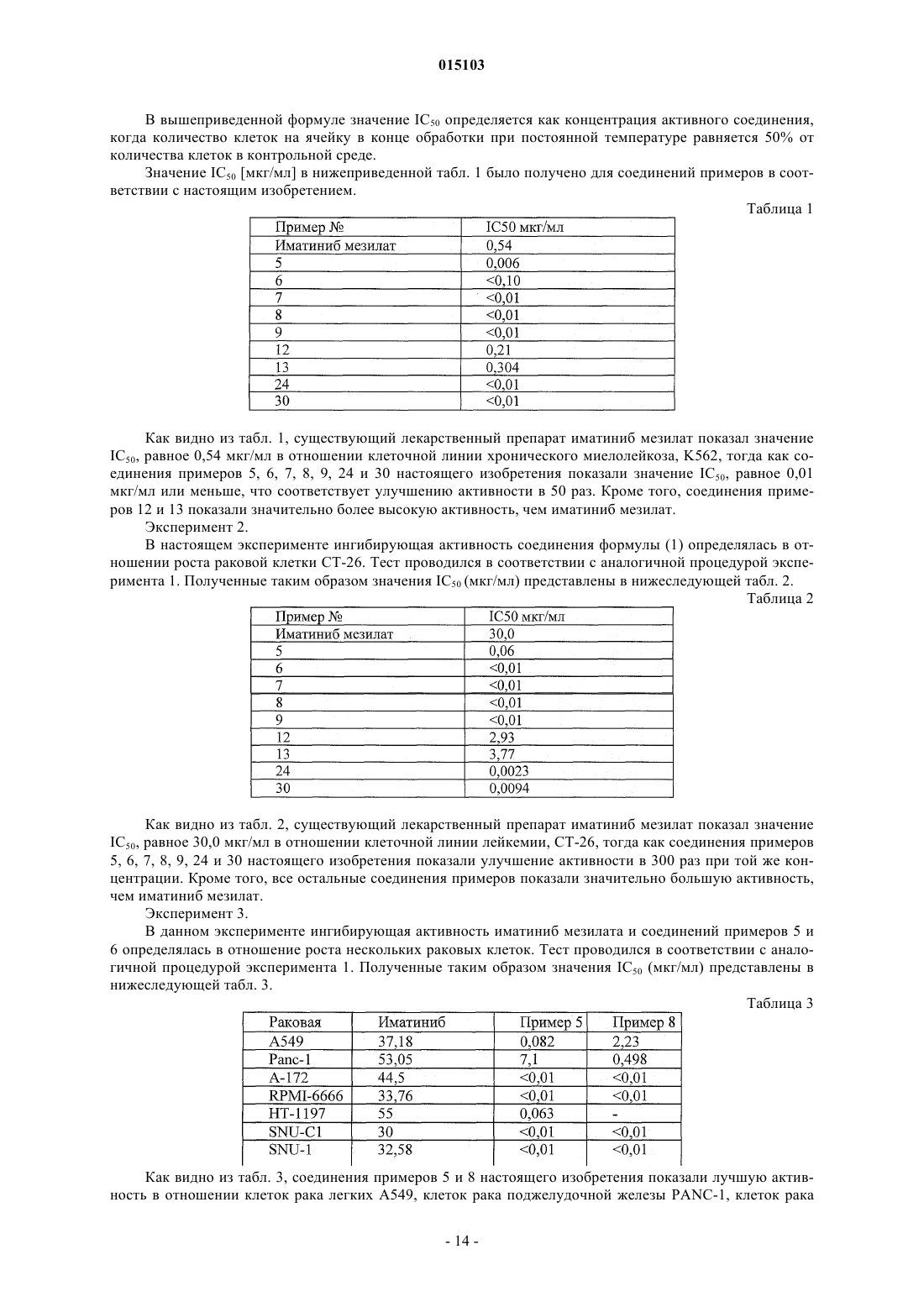
Настоящее изобретение относится к новому производному N-фенил-2-пиридинамина,представленному вышеуказанной формулой (1), и его соли, оказывающим подавляющий эффект на рак теплокровных животных, такой как рак легких, рак желудка, рак толстой кишки, рак поджелудочной железы, гепатома, рак предстательной железы, рак груди, хроническая или острая лейкемия, гематологическая злокачественная опухоль, рак головного мозга, рак мочевого пузыря, рак прямой кишки, рак шейки матки, лимфома и т.д. Настоящее изобретение также относится к способу приготовления соединения и фармацевтическому соединению для лечения вышеназванных различных заболеваний, содержащему действующее количество соединения в качестве активного ингредиента вместе с фармацевтически приемлемыми инертными носителями 015103 Техническое описание Настоящее изобретение относится к производному N-фенил-2-пиримидинамина, представленному следующей формулой (1)R1 представляет селективно замещенный тиазол, имидазол или пиразин (где заместитель является аминогруппой или низшим алкилом);R2, R3 и R6, каждый независимо, представляет водород, галоген, низший алкил или низший алкокси;R4 и R5, каждый независимо, представляют водород, и R4 и R5 не являются одновременно водородом; или R4 или R5 каждый представляет радикал со следующей формулой (2): где R7 представляет низший алкил или низший алкил, замещенный 1-3 галогенами,R8 представляет алифатический углеводород, имеющий от 5 до 10 атомов углерода, или представляет селективно замещенный 5-7-членный насыщенный или ненасыщенный моноциклический радикал(где заместитель является низшим алкилом), или бициклический или трициклический радикал, селективно связанный с бензольным кольцом (кольцами), каждый из которых имеет от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, или представляет пиперазинил или гомопиперазинил, каждый из которых замещен низшим алкилом; при условии, что R4 представляет радикал формулы (2), то минимум один из R2, R3, R5 и R6, каждый независимо, представляет водород, галоген, низший алкил или низший алкокси; или при условии, что R5 представляет радикал формулы (2), то минимум один из R2, R3, R4 и R6, каждый независимо, представляет водород, галоген, низший алкил или низший алкокси. Настоящее изобретение также относится к способу получения соединения формулы (1) и лекарственного препарата, включающего в себя эффективное количество соединения формулы (1) или его соли в качестве действующего вещества вместе с фармацевтически пригодными инертными носителями. Уровень техники Известно лекарственное средство при хроническом миелолейкозе - иматиниб мезилат (Gleevec, открытая публикация корейского патента 1993-0021624 и открытая публикация корейского патента 2001-0021950), -имеет структуру вышеприведенной формулы (1), где радикал амидного типа нижеприведенной формулы (3) (n=0) замещен в позиции R7, R4 является метилом, a R9 - метилпиперазином, и обнаруживает ограниченный терапевтический эффект, низкую стабильность и определенные проблемы в процессе производства То есть поскольку иматиниб мезилат имеет высокие гигроскопические свойства, он может легко разрушаться под воздействием влажности окружающей среды. Следовательно, это соединение необходимо перекристаллизовывать из специального растворителя, такого как метанол, для поддержания формы кристалла и использовать сразу после его получения. Кроме того, это соединение обнаруживает терапевтический эффект только для хронического миелолейкоза и имеет небольшой эффект для других областей, в отличие от других противораковых агентов. Его синтез осуществляется в следующем порядке: 4-хлорметилбензойная кислота сначала соединяется с N-метилпиперазином, хлорирование проводится с помощью тионилхлорида, а получающаяся боковая часть соединяется с базовой структурой, причем использование тионилхлорида вызывает множество проблем, таких как образование токсичного газа,взрывоопасность, снижение выхода реакции и т.д. В частности, стабильность промежуточного соединения оказывает отрицательное воздействие на общий выход соединения. Описание изобретения Техническая задача Таким образом, изобретатели провели обширное и тщательное исследование для решения вышеозначенной проблемы. В результате, изобретатели обнаружили, что новое соединение формулы (1) согласно вышеприведенному описанию обнаруживает лучший эффект, и оформили настоящее изобретение.-1 015103 Техническое решение Таким образом, целью настоящего изобретения является получение производного N-фенил-2 пиримидинамина следующей формулы (1):R1 представляет селективно замещенный тиазол, имидазол, пиразин или пиридин (где заместитель является аминогруппой или низшим алкилом);R2, R3 и R6, каждый независимо, представляет водород, галоген, низший алкил или низший алкокси;R4 и R5, каждый независимо, представляют водород, галоген, низший алкил или низший алкокси; илиR4 или R5 каждый представляет радикал со следующей формулой (2): где R7 представляет низший алкил или низший алкил, замещенный 1-3 галогенами,R8 представляет алифатический углеводород, имеющий от 5 до 10 атомов углерода, или представляет селективно замещенный 5-7-членный насыщенный или ненасыщенный моноциклический радикал(где заместитель является низшим алкилом), или бициклический или трициклический радикал, селективно связанный с бензольным кольцом (кольцами), каждое из которых имеет от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, или представляет пиперазинил или гомопиперазинил, каждый из которых замещен низшим алкилом; при условии, что R4 представляет радикал формулы (2), то минимум один из R2, R3, R5 и R6, каждый независимо, представляет водород, галоген, низший алкил или низший алкокси; или при условии, что R5 представляет радикал формулы (2), то минимум один из R2, R3, R4 и R6, каждый независимо, представляет водород, галоген, низший алкил или низший алкокси. Еще одной целью настоящего изобретения является создание способа получения соединения формулы (1). Еще одной целью настоящего изобретения является создание лекарственного препарата для лечения рака теплокровных животных, например рака легких, рака желудка, рака толстой кишки, рака поджелудочной железы, гепатомы, рака предстательной железы, рака груди, хронической или острой лейкемии, гематологической злокачественной опухоли, рака головного мозга, рака мочевого пузыря, рака прямой кишки, рака шейки матки, лимфомы и т.д., включающий в себя эффективное количество соединения формулы (1) или его соли в качестве действующего вещества вместе с фармацевтически пригодными инертными носителями. Еще одной целью настоящего изобретения является создание метода лечения рака у теплокровных животных, например рака легких, рака желудка, рака толстой кишки, рака поджелудочной железы, гепатомы, рака предстательной железы, рака груди, хронической или острой лейкемии, гематологической злокачественной опухоли, рака головного мозга, рака мочевого пузыря, рака прямой кишки, рака шейки матки, лимфомы и т.д., заключающийся в принятии внутрь в случае необходимости такого лечения определенного количества соединения формулы (1) или его соли согласно определению формулы изобретения 1, эффективного для обеспечения такого лечения. Ниже данное изобретение будет объяснено более подробно. Описание чертежа На чертеже даны фармакокинетические данные соединений примеров 5 и 8 в соответствии с настоящим изобретением в сравнении со стандартным лекарственным средством иматиниб мезилата. Лучший способ В вышеуказанных определениях заместителей производного N-фенил-2-пиримидинамина формулы(1) термин низший алкил, используемый отдельно или в сложных терминах, означает радикал неразветвленного или разветвленного и насыщенного алифатического углеводорода, имеющего от 1 до 6 атомов углерода, такого как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, н-гексил и т.д., но не ограничивается этим. Термин "алифатический" радикал означает алкенил, алкинил или алкил. Термин "низший алкокси", используемый отдельно или в сложных терминах,означает радикал с прямой или разветвленной цепью и насыщенного алифатического углеводорода,-2 015103 имеющего от 1 до 6 атомов углерода, такого как метокси, этокси, н-пропокси, изопропокси, н-бутокси,изобутокси, втор-бутокси, трет-бутокси, пентокси, изопентокси, н-гексокси и т.д., но не ограничивается этим. Предпочтительные соединения среди соединений формулы (1) включают в себя те, гдеR4 или R5 представляет радикал со следующей формулой (2): где R7 представляет трифторметил или метил,R8 представляет 2-метилмидазол, 4-метилмидазол,при условии, что R4 представляет радикал формулы (2), то минимум один из R2, R3, R5 и R6, каждый независимо, представляет водород, фтор, метил или метокси,при условии, R5 представляет радикал формулы (2), то минимум один из R2, R3, R4 и R6, каждый независимо, представляет водород, фтор, метил или метокси. В плане ингибирования протеинкиназы особо предпочтительны те соединения соединений формулы (1), где R1 представляет пиразин, 2-метилпиразин или тиазол, R2, R3, R5, R6, каждый независимо,представляет водород, R4 представляет радикал формулы (2), R7 представляет трифторметил или метил, aR8 представляет 2-метилмидазол, 4-метилмидазол. Кроме того, особенно предпочтительно соединение формулы (1), где R1 представляет пиразин, 2 метилпиразин или тиазол, R2 представляет метил, R3, R4, R6, каждый независимо, представляет водород,R5 представляет радикал формулы (2), R7 представляет трифторметил или метил, a R8 представляет 2 метилмидазол, 4-метилмидазол. Соединение формулы (1) включает в себя одну или более основных групп или один или более основных радикалов, и может, таким образом, образовывать дополнительную соль кислоты с алифатической сульфокислотой (т.е. метансульфоновой, этансульфоновой), соляной кислотой, серной кислотой,фосфорной кислотой, трифторуксусной кислотой, уксусной кислотой, пропионовой кислотой, гликолевой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, лимонной кислотой, винной кислотой, щавелевой кислотой, аминокислотой (т.е. лизином), бензойной кислотой, салициловой кислотой и др. Если в молекуле присутствуют несколько основных групп, соединение формулы (1) может образовывать моно- или поли-соль кислоты. Из вышеуказанных фармацевтически пригодных солей соль уксусной кислоты и соль соляной кислоты лучше соли метансульфоновой кислоты, так как имеют лучшую растворимость в воде и имеют лучшую абсорбционную способность в тесте с протеинкиназой. Согласно настоящему изобретению соединение определенной выше формулы (1) и его соль могут быть получены с помощью способа, заключающегося во взаимодействии соединения, представленного следующей формулой (4 а) или (4b): где R1-R6 соответствуют определению, приведенному выше, с соединением, представленным следующей формулой (5): где R7-R8 соответствуют определению, приведенному выше, для образования соединения, представленного следующей формулой (1 а) или (1b): где R1-R8 соответствуют определению, описанному выше. Таким образом, вышеописанный способ является еще одной целью настоящего изобретения. Вышеуказанный способ, согласно настоящему изобретению, проводится предпочтительно в растворителе и в присутствии основания. Могут использоваться любые стандартные растворители или основания, не оказывающие отрицательного воздействия на реакцию, но особенно можно отметить один или несколько растворителей, выбранных из группы, в которую входят тетрагидрофуран, метиленхлорид, этанол, N,N-диметилацетамид, этилацетат, одно или несколько оснований, выбранных из группы, в которую входят пиридин и триэтиламин, карбонат натрия, карбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, и один или несколько катализаторов, выбранных из группы, в которую входят медь, иодид меди(II) и оксид меди. Исходные материалы, используемые в вышеописанном способе в соответствии с настоящим изобретением, являются коммерчески доступными и могут быть легко получены. Взаимодействие можно проводить обычным путем при охлаждении или нагревании. После завершения реакции взаимодействия названных соединений получающийся продукт может быть очищен далее с помощью обычных процессов обработки, например колоночной хроматографии,перекристаллизации и т.д. Вышеуказанный способ получения соединения формулы (1) настоящего изобретения дает такие преимущества, как стабильность химической структуры промежуточных соединений, простой контроль условий реакции, повышение выхода реакции и т.д. в сравнении с известным способом, включающим в себя этапы взаимодействия соединения формулы (4) с соединением формулы (5). Соединение формулы (1) настоящего изобретения обнаруживает лучший эффект в отношении рака легких, рака желудка, рака толстой кишки, рака поджелудочной железы, гепатомы, рака предстательной железы, рака груди, хронической или острой лейкемии, гематологической злокачественной опухоли, рака головного мозга, рака мочевого пузыря, рака прямой кишки, рака шейки матки, лимфомы и т.д., и таким образом может быть успешно использован для лечения этих заболеваний. В частности, соединение формулы (1) проявляет лучший лечебный эффект в отношении хронического миелолейкоза, чем иматиниб мезилат, а также соединение формулы (1) проявляет превосходную противораковую активность в отношении отдельных частей тела, включая рак легких, рак желудка, рак толстой кишки, рак поджелудочной железы, гепатому, рак предстательной железы, рак груди, хроническую или острую лейкемию,гематологическую злокачественную опухоль, рак головного мозга, рак мочевого пузыря, рак прямой кишки, рак шейки матки, лимфому и т.д. Кроме того, если форма соли соединения формулы (1) изменяется с метансульфоната на ацетат или гидрохлорид, растворимость в воде и абсорбция в тело животных значительно повышается. Эффект соединения формулы (1) и его соли согласно настоящему изобретению может быть подтвержден результатами следующих экспериментов. Если действующее соединение согласно настоящему изобретению используется для клинических целей, то предпочтительно его назначение в количестве от 1 до 100 мг, предпочтительно от 3 до 10 мг на 1 кг массы тела в день. Суммарная суточная доза может назначаться за один или несколько раз. Но конкретная дозировка для каждого пациента может изменяться в зависимости от конкретного используемого соединения, массы тела, пола и состояния здоровья пациента, диеты, времени, способа применения, скорости выведения, состава смеси агента, степени тяжести заболевания и т.д. Соединение настоящего изобретения может назначаться в виде инъекций или пероральных препаратов. Инъекции, например стерильные водные или масляные суспензии для инъекций, могут быть приготовлены согласно известной процедуре с использованием подходящего диспергирующего, смачивающего или суспендирующего агента. Среди растворителей, которые могут быть использованы для приготовления инъекций, - вода, раствор Рингера и изотонический раствор NaCl. Стерильное фиксирующее масло также может быть использовано обычным образом в качестве растворителя или суспендирующей среды. Для этих целей может использоваться любое не стимулирующее фиксирующее масло, включая моноили диглицерид. Для инъекций могут использоваться также такие жирные кислоты, как олеиновая.-4 015103 В качестве твердых препаратов для перорального применения можно назвать капсулы, таблетки,драже, порошки, гранулы и т.д., предпочтительно капсулы и таблетки. Для таблеток и драже желательно использование кишечно-растворимых оболочек. Твердые препараты могут быть приготовлены смешением действующего соединения формулы (1) согласно настоящему изобретению минимум с одним носителем, выбранным из группы, в которую входят неактивные наполнители, такие как сахароза, лактоза, крахмал и т.д., лубриканты, такие как стеарат магния, агент распадаемости и связующий агент. Если соединение настоящего изобретения используется клинически для лечения рака легких, рака желудка, рака толстой кишки, рака поджелудочной железы, гепатомы, рака предстательной железы, рака груди, хронической или острой лейкемии, гематологической злокачественной опухоли, рака головного мозга, рака мочевого пузыря, рака прямой кишки, рака шейки матки, лимфомы и т.д., действующее соединение формулы (1) может назначаться отдельно или вместе с существующими химиотерапевтическими агентами, такими как 5-Fu, цисплатин, таксол, метотрексат, антрациклин и т.д. Более конкретно данное изобретение может быть объяснено в следующих примерах и экспериментах. Но необходимо понимать, что эти примеры и эксперименты предназначены для иллюстрации настоящего изобретения, а ни в коей мере не для ограничения объема настоящего изобретения. В следующих примерах значение Rf было измерено на силикагеле (Merck, 60F254, Германия), соотношение каждого растворителя в смеси элюента было объемным (об./об.), а точка плавления была измерена с помощью прибора термоанализа ДСК (NETZSCH, кювета DSC204). Измерение 1 Н-ЯМР (ядерный магнитный резонанс) проводилось с помощью Brucker, Ас-200. Примеры Препарат 1. Препарат 3-диметиламино-1-тиазол-2-ил-пропенона. 2-Ацетилтиазол (35 г, 0,275 моль) и N,N-диметилформамид диметилацеталь (55 мл, 0,412 моль) добавляются в реакционную емкость при комнатной температуре, затем нагреваются и перемешиваются при 70-80 С в течение 4 ч. Смесь охлаждается до комнатной температуры, к ней добавляется эфир (30 мл) и смесь перемешивается в течение 1 ч в ледяной бане. Полученное твердое вещество оранжевого цвета фильтруется и затем высушивается при комнатной температуре для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 3,01 (s, 3 Н), 6,13 (d, 1H), 7,56 (m, 1H), 7,93 (m, 2H). Препарат 2. Препарат 3-диметиламино-1-пиразин-2-ил-пропенона. Вместо 2-ацетилтиазола в соответствии с подобной процедурой для препарата 1 используется 2 ацетилпиразин для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 2,99 (s, 3 Н), 3,19 (s. 3 Н), 6,34 (d, 1H), 7,95 (d, 1H), 8,55 (d, 1H), 8,63 (d,1H),9,31(s, 1H). Препарат 3. Препарат 3-диметиламино-1-(3-метилпиразин-2-ил)-пропенона. Вместо 2-ацетилтиазола в соответствии с процедурой для препарата 1 используется 2-ацетил-3 метилпиразин для получения названного соединения в виде твердого вещества коричневого цвета. 1 Н-ЯМР (CDCl3, ) = 2,74 (s, 3 Н), 2,90 (s, 3 Н), 3,31 (s, 3 Н), 5,94 (d, 1H), 7,78 (d, 1H), 8,37 (s, 1H), 8,45(d, 1H). Препарат 4. Препарат 3-диметиламино-N-тиазол-2-ил-акриламида. Вместо 2-ацетилтиазола в соответствии с процедурой для препарата 1 используется N-тиазол-2-илацетамид для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 2,45 (s, 3 Н), 2,48 (s, 3 Н), 5,37 (d, 1H), 6,85 (d, 1H), 7,36 (d, 1H), 8,21 (d, 1H), 9,35(s, 1H). Препарат 5. Препарат 3-диметиламино-1-имидазол-1-ил-пропенона. Вместо 2-ацетилтиазола в соответствии с процедурой для препарата 1 используется Nацетилимидазол для получения названного соединения в виде твердого вещества коричневого цвета. 1 Н-ЯМР (CDCl3, ) = 2,54 (s, 3 Н), 2,62 (s, 3 Н), 5,34 (d, 1 Н), 6,73 (d, 1H), 7,55 (d, 1H), 7,93 (d, 1H). Препарат 6. Препарат нитрата этилового эфира 4-гуанидинобензойной кислоты. Этиловый эфир 4-аминобензойной кислоты (20 г, 0,121 моль), азотная кислота (7,26 г, 0121 моль),цианамид (50%, 14 мл, 0,182 моль) смешиваются с этанолом (50 мл) с обратным холодильником. Через 24 ч смесь охлаждается до комнатной температуры и затем промывается этанолом для получения названного соединения в виде кристаллического твердого вещества. 1 Н-ЯМР (ДМСО 6, ) = 1,32 (t, 3 Н), 4,32 (q, 2 Н), 7,35 (d, 2 Н), 7,98 (br, 3 Н), 9,93 (br, 1 Н). Препарат 7. Препарат нитрата этилового эфира 3-гуанидино-4-метилбензойной кислоты. Вместо этилового эфира 4-аминобензойной кислоты в соответствии с процедурой для препарата 6 используется этиловый эфир 3-амино-4-метилбензойной кислоты для получения названного соединения в виде кристаллического твердого вещества. 1 Н-ЯМР (ДМСО-d6, ) = 1,30 (t, 3 Н), 2,27 (s, 3 Н), 4,22 (q, 2H), 7,22 (br, 3 Н), 7,31 (d, 1H), 7,75 (s, 1H),7,82 (d, 1H), 9,38 (s, 1H). Препарат 8. Препарат этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты.-5 015103 3-Диметиламино-1-пиридин-3-ил-пропенон (3,3 г, 18,71 ммоль), нитрат этилового эфира 4 гуанидинобензойной кислоты (5 г, 18,71 ммоль), полученный в препарате 6, гидроксид натрия (0,83 г,20,58 ммоль) и изопропанол (25 мл) добавляются в реакционную емкость и перемешиваются с обратным холодильником. Через 48 ч реакционная емкость охлаждается до комнатной температуры, органический слой экстрагируется с помощью этилацетата и воды, отгоняется под вакуумом и затем промывается эфиром для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 1,34 (t, 3 Н), 4,30 (q, 2H), 7,63 (d, 2H), 7,97 (m, 4H), 8,70 (d, 1H), 8,80 (d, 1H),8,85 (m, 1H), 9,38 (m, 1H), 10,27 (s, 1H). Препарат 9. Препарат этилового эфира 4-(4-тиазол-2-ил-пиримидин-2-иламино)бензойной кислоты. Вместо 3 диметиламино-1-пиридин-3-ил-пропенона в соответствии с процедурой для препарата 8 используется 3-диметиламино-1-тиазол-2-ил-пропенон, приготовленный в препарате 1, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 1,32 (t, 3 Н), 4,24 (q, 2H), 7,52 (d, 2 Н), 7,94 (m, 5H), 8,05 (d, 1H), 8,66 (d, 1H),10,29 (s, 1H). Препарат 10. Препарат этилового эфира 4-метил-3-(4-тиазол-2-ил-пиримидин-2 иламино)бензойной кислоты. Вместо 3-диметиламино-1-пиридин-3-ил-пропенона и нитрата этилового эфира 4-гуанидинобензойной кислоты в соответствии с процедурой для препарата 8 используются 3-диметиламино-1 тиазол-2-ил-пропенон и нитрат этилового эфира 3-гуанидино-4-метилбензойной кислоты, приготовленные в препарате 7, для получения названного соединения в виде желтой жидкости. 1 Н-ЯМР (CDCl3, ) = 1,07 (t, 3 Н), 2,33 (s, 3 Н), 4,29 (q, 2H), 7,40 (m, 2H), 7,67 (d, 1H), 7,98 (d, 1H),8,07 (d, 1H), 8,24 (s, 1H), 9,26 (s, 1H). Препарат 11. Препарат этилового эфира 4-метил-3-(4-пиразин-2-ил-пиримидин-2-иламино)бензойной кислоты. Вместо 3-диметиламино-1-пиридин-3-ил-пропенона и нитрата этилового эфира 4-гуанидинобензойной кислоты в соответствии с процедурой для препарата 8 используются 3-диметиламино-1 пиразин-2-ил-пропенон, приготовленный в препарате 2, и нитрат этилового эфира 3-гуанидино-4 метилбензойной кислоты для получения названного соединения в виде твердого вещества желтого цвета. 1(d, 1H), 8,64 (d, 2 Н), 8,97 (s, 1 Н), 9,68 (s, 1H). Препарат 12. Препарат этилового эфира 4-(4-пиразин-2-ил-пиримидин-2-иламино)бензойной кислоты. Вместо 3-диметиламино-1-пиридин-3-ил-пропенона в соответствии с процедурой для препарата 8 используется 3-диметиламино-1-пиразин-2-ил-пропенон для получения названного соединения в виде твердого вещества желтого цвета. 1H-ЯМР (CDCl3, ) = 1,27 (t, 3 Н), 4,36 (q, 2H), 6,60 (d, 1H), 6,63 (m, 2H), 7,74 (m, 2H), 8,12 (d, 1H),8,87 (т, 3 Н), 9,88 (s, 1H). Препарат 13. Препарат этилового эфира 4-метил-3-[4-(3-метилпиразин-2-ил)пиримидин-2-иламино] бензойной кислоты. Вместо 3-диметиламино-1-тиазол-2-ил-пропенона в соответствии с процедурой для препарата 10 используется 3-диметиламино-1-(3-метилпиразин-2-ил)пропенон, приготовленный в препарате 3 для получения названного соединения в виде желтой жидкости. 1 Н-ЯМР (CDCl3, ) = 1,35 (t, 3 Н), 2,37 (s, 3 Н), 2,87 (s, 3 Н), 4,35 (q, 2H), 7,26 (t, 2H), 7,36 (d, 1H), 7,74(m, 1H), 8,48 (s, 1H), 8,51 (m, 1H), 8,56 (m, 1H), 8,63 (s, 1H). Препарат 14. Препарат этилового эфира 4-[4-(3-метилпиразин-2-ил)пиримидин-2-иламино]бензойной кислоты. Вместо 3-диметиламино-1-пиридин-3-ил-пропенона в соответствии с процедурой для препарата 8 используется 3-диметиламино-1-(3-метилпиразин-2-ил)-пропенон для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 1,29 (t, 3 Н), 2,53 (s, 3 Н), 4,65 (q, 2H), 7,37 (d, 2H), 7,77 (m, 2H), 8,62 (s, 1H), 8,64(m, 1H), 8,58 (m, 2H), 8,99 (s, 1H). Препарат 15. Препарат этилового эфира 4-метил-3-[4-(тиазол-2-иламино)пиримидин-2 иламино]бензойной кислоты. Вместо 3-диметиламино-1-тиазол-2-ил-пропенона в соответствии с процедурой для препарата 10 используется 3-диметиламино-N-тиазол-2-ил-акриламид, приготовленный в препарате 4, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 1,26 (t, 3 Н), 2,14 (s, 3 Н), 5,22 (q, 2H), 7,24 (d, 2H), 7,32 (d, 1H), 7,46 (m, 3 Н),8,03 (m, 2 Н), 8,53 (s, 1H), 9,25 (s, 1H). Препарат 16. Препарат этилового эфира 4-[4-(тиазол-2-иламино)пиримидин-2-иламино]бензойной кислоты. Вместо 3-диметиламино-1-пиридин-3-ил-пропенона в соответствии с процедурой для препарата 8 используется 3-диметиламино-N-тиазол-2-ил-акриламид для получения названного соединения в виде-6 015103 твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 1,63 (t, 3 Н), 4,87 (q, 2H), 7,34 (d, 1H), 7,45 (d, 1H), 7,58 (m, 3 Н), 8,14 (m, 2 Н),8,23 (d, 1H), 9,62 (s, 1H), 10,25 (s, 1H). Препарат 17. Препарат этилового эфира 3-(4-имидазол-1-ил-пиримидин-2-иламино)-4-метилбензойной кислоты. Вместо 3-диметиламино-1-тиазол-5-ил-пропенона в соответствии с процедурой для препарата 10 используется 3-диметиламино-1-имидазол-1-ил-пропенон, приготовленный в препарате 5, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 1,27 (t, 3 Н), 2,15 (s, 3 Н), 4,36 (q, 2 Н), 6,02 (d, 1H), 9,63 (d, 1H), 7,26 (m, 2H),7,35 (m, 3 Н), 7,55 (d, 1H), 7,83 (s, 1H), 8,63 (s, 1H). Препарат 18. Препарат этилового эфира 4-(4-имидазол-1-ил-пиримидин-2-иламино)бензойной кислоты. Вместо 3-диметиламино-1-пиридин-3-ил-пропенона в соответствии с процедурой для препарата 8 используется 3-диметиламино-1-имидазол-1-ил-пропенон для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 1,33 (t, 3 Н), 4,36 (q, 2 Н), 6,03 (d, 1 Н), 6,93 (d, 1H), 7,33 (m, 2H), 7,64 (m, 2H),7,89 (s, 1H), 8,77 (s, 1H). Препарат 19. Препарат 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты. Этиловый эфир 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты, приготовленный в препарате 8 (19,6 г, 59,6 ммоль), и 2 Н-гидроксид натрия (190 мл) добавляются в реакционную емкость со смесью воды (190 мл) и этанола в качестве растворителя (190 мл), перемешиваются с обратным холодильником и охлаждаются до комнатной температуры, и с помощью раствора гидрохлорида регулируется рН смеси до значения 1-2. Смесь перемешивается в течение 1 ч и фильтруется для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 7,57 (m, 2H), 7,92 (q, 5 Н), 8,55 (d, 1H), 8,67 (d, 1H), 8,80 (s, 1H), 9,43 (br,1H), 10,20 (s, 1H). Препарат 20. Препарат 4-(4-тиазол-2-ил-пиримидин-2-иламино)бензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 4-(4-тиазол-2-ил-пиримидин-2 иламино)бензойной кислоты для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 7,54 (d, 1H), 7,93 (m, 4H), 8,05 (d, 1H), 8,11 (d, 1H), 8,7 (d, 1H), 10,30 (s, 1H),12,34 (br, 1H). Препарат 21. Препарат 4-метил-3-(4-тиазол-2-ил-примидин-2-иламино)бензойной кислоты. Вместо этилового эфира 4-(4-придин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 10 используется этиловый эфир 4-метил-3-(4-тиазол-2-ил-примидин-2 иламино)бензойной кислоты для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,32 (s, 3 Н), 7,39 (т,2 Н), 7,66 (т, 1H), 7,98 (d, 1H), 8,07 (d, 1H), 8,14 (s, 1H),8,57 (d, 1H), 9,25 (s, 1H), 12,75 (s, 1H). Препарат 22. Препарат 4-метил-3-(4-пиразин-2-ил-пиримидин-2-иламино)бензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 4-метил-3-(4-пиразин-2-ил-пиримидин 2-иламино)бензойной кислоты, приготовленный в препарате 11, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,34 (s, 3H), 7,33 (d, 1H), 7,63 (d, 2H), 8,33 (s, 1H), 8,59 (d, 1H), 8,74 (s, 2 Н),9,12 (s, 1H), 9,42 (s, 1H). Препарат 23. Препарат 4-(4-пиразин-2-ил-пиримидин-2-иламино)бензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 4-(4-пиразин-2-ил-пиримидин-2 иламино)бензойной кислоты, приготовленный в препарате 12, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 7,23 (m, 2H), 7,56 (d, 1H), 7,69 (s, 1 Н), 8,36 (т, 3 Н), 8,68 (т, 2 Н), 9,10 (s, 1H),12,54 (br, 1H). Препарат 24. Препарат 4-метил-3-[4-(3-метилпиразин-2-ил)пиримидин-2-иламино]бензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 4-метил-3-[4-(3-метилпиразин-2-ил) пиримидин-2-иламино]бензойной кислоты, приготовленный в препарате 13, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,31 (m, 3 Н), 2,64 (s, 3 Н), 7,30 (d, 2 Н), 7,64 (d, 1H), 8,12 (s, 1H), 8,55 (m, 3 Н),-7 015103 9,07 (s, 1H), 12,75 (br, 1H). Препарат 25. Препарат 4-[4-(3-метилпиразин-2-ил)пиримидин-2-иламино]бензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 4-[4-(3-метилпиразин-2-ил)пиримидин 2-иламино]бензойной кислоты, приготовленный в препарате 14, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 1,85 (s, 3 Н), 7,36 (d, 2 Н), 7,44 (s, 1H), 7,65 (d, 1H), 8,15 (s, 1H), 8,56 (m, 3 Н),9,12 (s, 1H), 12,67 (br, 1H). Препарат 26. Препарат 4-метил-3-[4-(тиазол-2-иламино)пиримидин-2-иламино]бензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 4-метил-3-[4-(тиазол-2-иламино)пиримидин-2-иламино]бензойной кислоты, приготовленный в препарате 15, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 1,85 (s, 3 Н), 7,36 (d, 2H), 7,44 (s, 1H), 7,65 (d, 1H), 8,15 (s, 1H), 8,56 (m, 3 Н),9,12 (s, 1H), 12,67 (br, 1H). Препарат 27. Препарат 4-[4-(тиазол-2-иламино)пиримидин-2-иламино]бензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 4-[4-(тиазол-2-иламино)пиримидин-2 иламино]бензойной кислоты, приготовленный в препарате 16, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 6,03 (s, 1H), 6,68 (m, 2H), 7,05 (s, 1H), 7,35 (d, 1H), 7,77 (m, 2 Н), 8,21 (s, Н),9,82 (s, 1H), 10,24 (s, 1H). Препарат 28. Препарат 3-(4-имидазол-1-ил-пиримидин-2-иламино)-4-метилбензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 3-(4-имидазол-1-ил-пиримидин-2 иламино)-4-метилбензойной кислоты, приготовленный в препарате 17, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,38 (s, 3 Н), 6,24 (d, 1H), 7,12 (d, 1H), 7,34 (m, 3 Н), 7,49 (m, 2 Н), 7,69 (s, 1H),8,95 (s, 1H). Препарат 29. Препарат 4-(4-имидазол-1-ил-пиримидин-2-иламино)бензойной кислоты. Вместо этилового эфира 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой для препарата 19 используется этиловый эфир 4-(4-имидазол-1-ил-пиримидин-2 иламино)бензойной кислоты, приготовленный в препарате 18, для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 6,32 (d, 1H), 6,96 (m, 2 Н), 7,32 (d, 1H), 7,56 (d, 1H), 7,89 (m, 2 Н), 8,12 (m,2 Н), 9,32 (s, 1H). Препарат 30. Препарат 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина. 3-Амино-5-бромобензотрифторметан (17,1 г, 71,24 ммоль), 4-метилимидазол (17,6 г, 213,72 ммоль),карбонат калия (9,8 г, 71,24 ммоль), медь (1,1 г, 17,81 ммоль) и йодид меди(II) (3,4 г, 17,81 ммоль) добавляются к N,N-диметилацетамиду (100 мл) при комнатной температуре и перемешиваются с ним в течение 16 ч при 140-150C. После завершения реакции температура реакционной емкости охлаждается до комнатной. Затем к этой смеси добавляется этилацетат (200 мл) и перемешивается с ним в течение 30 мин. Реакционная смесь фильтруется целлитом и органический слой отфильтрованного раствора промывается водой, высушивается сульфатом магния, отгоняется под вакуумом и промывается н-гексаном для получения названного соединения в виде твердого вещества белесого цвета. 1 Н-ЯМР (CDCl3, ) = 2,28 (s, 3 Н), 4,04 (br, 2 Н), 6,79 (s, 1H), 6,83 (s, 1H), 6,92 (s, 1H), 7,00 (s, 1H), 7,77(s, 1H). Препарат 31. Препарат 3-(2-метилимидазол-1-ил)-5-трифторметилфениламина. Вместо 4-метилимидазола в соответствии с процедурой для препарата 30 используется 2 метилимидазол для получения названного соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3, ) = 2,36 (s, 3 Н), 4,17 (br, 2H), 6,69 (s, 1H), 6,86 (s, 1H), 6,91 (s, 1H), 7,02 (s, 1H), 7,26(200 мг, 0,83 ммоль), N,N-диметилформамид (10 мл) и диэтилцианофосфат (0,245 мл, 1,658 ммоль) добавляются в реакционную емкость и охлаждаются до температуры 10C. К ним добавляется триэтиламин(0,231 мл, 1,658 ммоль). Через 30 мин смесь при 60 С перемешивается в течение 15 ч. Смесь охлаждается до комнатной температуры и с раствором этилацетата и бикарбоната натрия получается органический-8 015103 слой, сгущаемый под вакуумом и подвергаемый колоночной хроматографии (5:1/CHCl3:МеОН) для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,20 (s, 3 Н), 7,39 (s, 1H), 7,56 (d, 2H), 8,03 (m, 5H), 8,17 (s, 1H), 8,21 (d, 1H),8,32 (s, 1H), 8,49 (d, 2H), 8,63 (d, 1H), 8,72 (d, 1H), 9,36 (s, 1H), 10,15 (s, 1H), 10,48 (s, 1H). Пример 2. Препарат N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2-иламино]бензамида. В соответствии с процедурой, указанной в примере 1, но вместо 3-(4-метилимидазол-1-ил)-5 трифторметилфениламина, используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин, приготовленный в препарате 31, для получения названного соединения в виде твердого вещества белесого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,25 (s, 3 Н), 7,32 (s, 1H), 7,55 (d, 2H), 8,05 (m, 5H), 8,17 (s, 1H), 8,21 (d, 1H),8,26 (d, 1H), 8,37 (s, 1H), 8,50 (d, 2H), 8,64 (d, 1H), 8,78 (d, 1H), 9,42 (s, 1H), 10,25 (s, 1H), 11,21 (s, 1H). Пример 3. Препарат N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-(4-тиазол-2-ил-пиримидин-2-иламино)бензойная кислота, приготовленная в препарате 20, для получения названного соединения в виде твердого вещества белесого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,21 (s, 3 Н), 7,43 (m, 1 Н), 7,56 (m, 1H), 7,65 (m, 1H), 8,06 (m, 7H), 8,19 (m,2H), 8,71 (d, 1H), 10,29 (s, 1H), 10,52 (s, 1H). Пример 4. Препарат N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(тиазол-2-ил)пиримидин-2-иламино[бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 3 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфенил для получения названного соединения в виде твердого вещества белесого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,23 (s, 3 Н), 7,42 (m, 1 Н), 7,55 (m, 1 Н), 7,68 (m, 1 Н), 8,07 (m, 7 Н), 8,20 (m,2 Н), 8,73 (d, 1H), 10,31 (s,lH), 10,55 (s, 1H). Пример 5. Препарат 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2 ил)пиримидин-2-иламино]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-метил-3-(4-тиазол-2-ил-пиримидин-2-иламино)бензойная кислота, приготовленная в препарате 21, для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,19 (s, 3 Н), 2,36 (s, 3 Н), 7,24 (s, 1H), 7,35 (m, 2H), 7,47 (s, 1H), 7,64 (d, 1H),7,71 (d, 1H), 7,92 (d, 1H), 8,01 (s, 1H), 8,11 (s, 1 Н), 8,30 (s,2H), 8,47 (d, 1H), 9,00 (s, 1H), 10,49 (s, 1H). Пример 6. Препарат 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2 ил)пиримидин-2-иламино]бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 5 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин для получения названного соединения. 1H-ЯМР (ДМСО-d6, ) = 2,20 (s, 3 Н), 2,38 (s, 3 Н), 7,25 (s, 1H), 7,42 (m, 2H), 7,47 (s, 1H), 7,68 (d, 1H),7,73 (d, 1H), 7,96 (d, 1H), 8,06 (s 1H), 8,15 (s, 1H), 8,35 (s, 2H), 8,51 (d, 1H), 9,23 (s, 1H), 10,52 (s, 1H). Пример 7. Препарат 4-метил-N-[5-метилтиазол-2-ил]-3-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамида. 4-Метил-3-(4-тиазол-2-ил-пиримидин-2-иламино)бензойная кислота и 3-амино-5-метилтиазол используются вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты и 3-(4-метилимидазол 1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 5 для получения названного соединения в виде твердого вещества желто-коричневого цвета. 1H-ЯМР (ДМСО-d6, ) = 2,32 (s, 3 Н), 2,36 (s, 3 Н), 7,19 (s, 1H), 7,44 (d, 2H), 7,85 (d, 1H), 7,95 (s, 1 Н),8,06 (s, 1H), 8,31 (s, 1H), 8,58 (d, 1H), 9,29 (s, 1H), 12,36 (s, 1H). Пример 8. Препарат 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин-2 ил)пиримидин-2-иламино]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-метил-3-(4-пиразин-2-ил-пиримидин-2-иламино)бензойная кислота, приготовленная в препарате 22, для получения названного соединения в виде твердого вещества бледножелтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,21 (s, 3 Н), 2,38 (s, 3 Н), 7,35 (s, 1H), 7,39 (s, 1H), 7,54 (s, 1H), 7,63 (d, 1H),7,75 (d, 1H), 8,14 (d, 2H), 8,38 (d, 2H), 8,54 (d, 2H), 8,68 (s, 1H), 9,06 (s, 1H), 9,45 (s, 1H), 10,56 (s, 1H). Пример 9. Препарат 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин-2 ил)пиримидин-2-иламино]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 2 используется 4-метил-3-(4-пиразин-2-ил-пиримидин-2-иламино)бензойная кислота для по-9 015103 лучения названного соединения в виде твердого вещества бледно-желтого цвета. 1(s, 1H). Пример 10. Препарат N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиразин-2 ил)пиримидин-2-иламино)бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-(4-пиразин-2-ил-пиримидин-2-иламино)бензойная кислота, приготовленная в препарате 23, для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО 6, ) = 2,20 (s, 3 Н), 7,35 (s, 1H), 7,61 (m, 1H), 8,07 (s, 3 Н), 8,19 (d, 2H), 8,36 (s, 1H),8,43 (d, 1H), 8,57 (d, 2H), 9,29 (s, 1H), 10,12 (s, 1H), 10,42 (s, 1H). Пример 11. Препарат N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиразин-2 ил)пиримидин-2-иламино)бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 10 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,34 (s, 3 Н), 2,29 (d, 2H), 7,52 (m, 3 Н), 7,94 (s, 3 Н), 8,03 (d, 2H), 8,40 (d, 1H),8,51 (d, 2H), 9,17 (s, 1H), 10,09 (s, 1H),10,39 (s, 1H). Пример 12. Препарат 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(3 метилпиразин-2-ил)пиримидин-2-иламино]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-метил-3-[4-(3-метилпиразин-2-ил)пиримидин-2-иламино]бензойная кислота,приготовленная в препарате 24, для получения названного соединения в виде твердого вещества бледножелтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,22 (s, 3 Н), 2,39 (s, 3 Н), 2,79 (s, 3 Н), 7,06 (s, 1H), 7,20 (s, 1H), 7,32 (s, 3 Н),7,59 (d, 2H), 8,18 (s, 1H), 8,50 (m, 3 Н), 8,58 (s, 1H), 8,92 (s, 1H). Пример 13. Препарат 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(3 метилпиразин-2-ил)пиримидин-2-иламино]бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 12 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,39 (s,3H), 2,43 (s, 3 Н), 2,80 (s, 3 Н), 7,08(d, 1H), 7,26 (s, 1H), 7,33 (m, 3H),7,61 (d, 1H), 8,10 (d, 2H), 8,50 (d, 2H), 8,56 (d, 1H), 8,64 (s, 1H), 9,16 (s, 1H). Пример 14. Препарат N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(3-метилпиразин-2 ил)пиримидин-2-иламино]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-[4-(3-метилпиразин-2-ил)пиримидин-2-иламино]бензойная кислота, приготовленная в препарате 25, для получения названного соединения в виде твердого вещества бледножелтого цвета. 1H-ЯМР (ДМСО-d6, ) = 2,24 (s, 3 Н), 2,75 (s, 3 Н), 2,21 (s, 1H), 7,54 (m, 3 Н), 7,92 (m, 3 Н), 8,07 (d, 2H),8,24 (s, 1H), 3,36 (d, 1H), 8,42 (d, 2H), 9,37 (s, 1H), 9,98 (s, 1H). Пример 15. Препарат N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(3-метилпиразин-2 ил)пиримидин-2-иламино]бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 14 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,36 (s, 3 Н), 2,79 (s, 3 Н), 7,17 (d, 2H), 7,31 (m, 3 Н), 7,64 (m, 3 Н), 7,92 (d, 2H),8,15 (d, 1H), 8,29 (d, 2H), 9,12 (s, 1H), 9,62 (s, 1H). Пример 16. Препарат 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2 иламино)пиримидин-2-иламино]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-метил-3-[4-(тиазол-2-иламино)пиримидин-2-иламино]бензойная кислота,приготовленная в препарате 26, для получения названного соединения в виде твердого вещества бледножелтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,19 (s, 3 Н), 2,35 (s, 3 Н), 7,02 (d, 1H), 7,15 (s, 1H), 7,24 (s, 1H), 7,32 (s, 1H),7,56 (m, 3 Н), 7,97 (d, 2H), 8,40 (s, 1H), 8,52 (d, 1H), 8,67 (s, IH), 9,00 (s, 1H), 9,54 (s, 1H), 10,49 (s, 1H). Пример 17. Препарат 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2 иламино)пиримидин-2-иламино]бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 16 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин для получения названного соединения в виде твердого вещества бледно-желтого цвета.N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(тиазол-2 иламино)пиримидин-2-иламино]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-[4-(тиазол-2-иламино)пиримидин-2-иламино]бензойная кислота, приготовленная в препарате 27, для получения названного соединения в виде твердого вещества бледно-желтокоричневого цвета. 1 Н-ЯМР (ДМСО-d6, 6) = 2,24 (s, 3H), 6,92 (d, 1H), 7,13 (s, 1H), 7,27 (s, 1H), 7,51 (d, 2H), 7,89 (m, 3 Н),7,96 (d, 2H), 8,29 (s, 1H), 8,30 (d, 1H), 9,58 (s, 1H), 8,96 (s, 1H), 9,38 (s, 1H), 10,16 (s, 1H). Пример 19. ПрепаратN-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(тиазол-2 иламино)пиримидин-2-иламино]бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 18 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,26 (s, 3 Н), 7,05 (d, 1 Н), 7,10 (s, 1H), 7,24 (d, 2H), 7,45 (d, 2H), 7,69 (m, 3H),7,89 (d, 2H), 8,24 (d, 1H), 8,65 (s, 1H), 9,16 (s, 1H), 9,43 (s, 1H), 10,27 (s, 1H). Пример 20. Препарат 3-(4-имидазол-1-ил-пиримидин-2-иламино)-4-метил-N-[3-(4-метилимидазол 1-ил)-5-трифторметилфенил]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 3-(4-имидазол-1-ил-пиримидин-2-иламино)бензойная кислота, приготовленная в препарате 28, для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,27 (s, 3 Н), 2,30 (s, 3 Н), 6,84 (d, 1 Н), 7,24 (s, 1H), 7,39 (s, 1H), 7,56 (d, 2H),7,89 (m, 3 Н), 7,92 (d, 2H), 8,07 (s, 1H), 8,35 (s, 1 Н), 8,42 (d, 1H), 9,40 (s, 1H), 9,89 (s, 1H). Пример 21. Препарат 3-(4-имидазол-1-ил-пиримидин-2-иламино)-4-метил-N-[3-(2-метилимидазол 1-ил)-5-трифторметилфенил]бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 20 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,29 (s, 3 Н), 2,35 (s, 3 Н), 6,96 (d, 1H), 7,15 (d, 2H), 7,30 (s, 1H), 7,59 (m, 3 Н),7,74 (d, 2H), 7,88 (d, 2H), 8,32 (s, 1H), 8,39 (d, 1H), 9,37 (s, 1H), 10,15 (s, 1H). Пример 22. Препарат 4-(4-имидазол-1-ил-пиримидин-2-иламино)-N-[3-(4-метилимидазол-1-ил)-5 трифторметилфенил]бензамида. Вместо 4-(4-пиридин-3-ил-пиримидин-2-иламино)бензойной кислоты в соответствии с процедурой в примере 1 используется 4-(4-имидазол-1-ил-пиримидин-2-иламино)бензойная кислота, приготовленная в препарате 29, для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,24 (s, 3 Н), 6,92 (d, 1H), 7,30 (s, 1H), 7,43 (d, 2H), 7,49 (d, 2H), 7,76 (m, 3H),7,87 (d, 2H), 8,21 (s, 1H), 8,25 (s, 1H), 8,29 (s, 1H), 9,45 (s, 1H), 10,02 (s, 1H). Пример 23. Препарат 4-(4-имидазол-1-ил-пиримидин-2-иламино)-N-[3-(2-метилимидазол-1-ил)-5 трифторметилфенил]бензамида. Вместо 3-(4-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 22 используется 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин для получения названного соединения в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,26 (s, 3 Н), 7,04 (d, 1H), 7,28 (d, 2H), 7,48 (d, 2H), 7,52 (d, 2H), 7,64 (m, 3 Н),7,81 (d,2H), 8,30 (s, 1H), 8,33 (d, 1 Н), 8,47 (s, 1H), 10,09 (s, 1H). Пример 24. Препарат N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3 ил)пиримидин-2-иламино] бензамид гидрохлорида.N-[3-(4-Метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2-иламино] бензамид (100 мг, 0,19 ммоль), приготовленный в примере 1, добавляется к ацетону (20 мл) и смесь охлаждается до 0C. К ней по капле добавляется смесь из HCl (35%, 42,5 мкл, 0,41 ммоль) и ацетона (5 мл). Затем смесь перемешивается при комнатной температуре в течение 18 ч и фильтруется для получения названного соединения в виде твердого вещества желто-коричневого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,25 (s, 3 Н), 7,34 (s, 1H), 7,55 (d, 2H), 8,09 (m, 5H), 8,17 (s, 1H), 8,27 (d, 1H),8,35 (s, 1H), 8,54 (d, 2H), 8,63 (d, 1H), 8,75 (d, 1H), 9,52 (s, 1H), 10,69 (s, 1H). Пример 25. Препарат N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3 ил)пиримидин-2-иламино]бензамид дигидрохлорида. ВместоN-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2 иламино]бензамида в соответствии с процедурой в примере 24 используется N-[3-(2-метилимидазол-1 ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2-иламино]бензамид для получения названного соединения в виде твердого вещества желто-коричневого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,32 (s, 3 Н), 7,37 (s, 1H), 7,62 (d, 2H), 8,14 (m, 5H), 8,26 (s, 1H), 8,31 (d, 1H),- 11015103 8,39 (s, 1H), 8,51 (d, 2H), 8,71(d, 1H), 8,83 (d, 1H), 8,47 (s, 1H), 10,37 (s, 1H). Пример 26. Препарат 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин 2-ил)пиримидин-2-иламино)бензамид дигидрохлорида. ВместоN-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2 иламино]бензамида в соответствии с процедурой в примере 24 используется 4-метил-N-[3-(4 метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин-2-ил)пиримидин-2-иламино]бензамид, приготовленный в примере 8, для получения названного соединения в виде твердого вещества желтокоричневого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,29 (s, 6H), 7,31 (s, 1H), 7,35 (s, 1 Н), 7,57 (s, 1H), 7,61 (d, 1H), 7,54 (d, 2H),8,41 (d, 2H), 8,56 (d, 2H), 8,76 (s, 1H), 9,27 (s, 1H), 9,78 (s, 1H), 10,87 (s, 1H). Пример 27. Препарат 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин 2-ил)пиримидин-2-иламино]бензамид дигидрохлорида. ВместоN-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2 иламино]бензамида в соответствии с процедурой в примере 24 используется 4-метил-N-[3-(2 метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин-2-ил)пиримидин-2-иламино]бензамид, приготовленный в примере 8, для получения названного соединения в виде твердого вещества желтокоричневого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,30 (s, 6 Н), 7,12 (s, 1H), 7,32 (s, 1H), 7,45 (s, 1H), 7,49 (d, 1H), 7,67 (d, 1H),7,82 (d, 1H), 8,23 (s, 1H), 8,35 (d, 2H), 8,67 (d, 2H), 8,98 (s, 1H), 9,37 (s, 1H), 9,65 (s, 1H), 10,82 (s, 1H). Пример 28. Препарат 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2 ил)пиримидин-2-иламино]бензамид дигидрохлорида. ВместоN-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2 иламино]бензамида в соответствии с процедурой в примере 24 используется 4-метил-N-[3-(4 метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид, приготовленный в примере 5, для получения названного соединения в виде твердого вещества желтокоричневого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,21 (s, 6 Н), 7,19 (s, 1H), 7,39 (s, 1H), 7,49 (s, 1 Н), 7,71 (s, 1H), 7,79 (d, 1H),7,97 (d, 1H), 8,09 (s, 2H), 8,21 (s, 1H), 8,35 (s, 2H), 8,51 (d, 1H), 9,24 (s, 1H), 10,37 (s, 1H). Пример 29. Препарат 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2 ил)пиримидин-2-иламино]бензамид дигидрохлорида. ВместоN-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2 иламино]бензамида в соответствии с процедурой в примере 24 используется 4-метил-N-[3-(2 метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид, приготовленный в примере 6, для получения названного соединения в виде твердого вещества желтокоричневого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,23 (s, 6H), 7,27 (s, 1H), 7,39 (m, 2H), 7,46 (s, 1H), 7,72 (d, 1H), 7,79 (d, 1H),8,02 (d,3H), 8,10 (s, 1H), 8,19 (s, 1H), 8,42 (s, 2H), 8,56 (d, 1H), 9,39 (s, 1H), 10,84 (s, 1H). Пример 30. Препарат N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(тиазол-2-илпиримидин-2-иламино]бензамид дигидрохлорида. ВместоN-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2 иламино]бензамида в соответствии с процедурой в примере 24 используется N-[3-(4-метилимидазол-1 ил)-5-трифторметилфенил]-4-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид, приготовленный в примере 3, для получения названного соединения в виде твердого вещества желто-коричневого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,26 (s, 3H), 7,39 (s, 1H), 7,51 (d, 2H), 7,61 (s, 1H), 7,69 (d, 1H), 7,74 (s, 1H),8,05 (s, 1H), 8,13 (m, 3H), 8,19 (s, 1H), 8,25 (d, 1H), 8,83 (d, 1H), 10,40 (s, 1H), 10,79 (s, 1H). Пример 31. ПрепаратN-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(пиридин-3-ил)пиримидин-2 иламино]бензамида в соответствии с процедурой в примере 24 используется N-[3-(2-метилимидазол-1 ил)-5-трифторметилфенил]-4-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид, приготовленный в примере 3, для получения названного соединения в виде твердого вещества желто-коричневого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,22 (s, 3H), 7,29 (d, 1H), 7,38 (d, 2H), 7,47 (d, 2H), 7,53 (d, 1H), 7,68 (m, 3H),7,92 (d, 2H), 8,35 (d, 1H), 8,74 (d, 1H), 10,21 (s, 1H), 10,49 (s, 1H). Пример 32. Препарат N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(2-метилимидазол 1-ил)пиримидин-2-иламино]бензамида. 3-(2-Метилимидазол-1-ил)-5-трифторметилфениламин, приготовленный в препарате 31, и 4-[4-(2 метилимидазол-1-ил)пиримидин-2-амино]бензойная кислота используются в соответствии с процедурой в примере 1 для получения соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,26 (s, 3 Н), 2,75 (s, 3 Н), 7,03 (d, 1 Н), 7,25 (d, 2H), 7,47 (d, 2H), 7,52 (d, 1H),7,65 (m, 3 Н), 7,80 (d, 2H), 7,81 (d, 1H), 8,34 (d, 1H), 8,45 (s, 1H), 10,08 (s, 1H). Пример 33. Препарат N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(2-метилимидазол- 12015103 1-ил)пиримидин-2-иламино]бензамида. Вместо 3-(2-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 32 используется 3-(4-метилимидазол-1-ил)-5-трифторметилфениламин, приготовленный в препарате 30, для получения соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,23 (s, 3 Н), 2,76 (s, 3 Н), 6,92 (d, 1H), 7,31 (d, 1H), 7,44 (d, 2H), 7,48 (d, 2 Н),7,77 (m, 3 Н), 7,88 (d, 2 Н), 8,20 (s, 1 Н), 8,27 (s, 1H), 8,30 (s, 1H), 9,43 (s, 1H), 10,03 (s, 1H). Пример 34. Препарат 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(2 метилимидазол-1-ил)пиримидин-2-иламино]бензамида. 4-Метил-3-[4-(2-метилимидазол-1-ил)пиримидин-2-амино]бензойная кислота и 3-(2-метилимидазол-1-ил)-5-трифторметилфениламин, приготовленный в препарате 31, используются в соответствии с процедурой в примере 1 для получения соединения в виде твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6, ) = 2,29 (s, 3 Н), 2,33 (s, 3 Н), 2,77 (s, 3 Н), 6,95 (d, 1H), 7,15 (d, 2H), 7,31 (s, 1H),7,60 (m, 3 Н), 7,75 (d, 2H), 7,89 (d, 2H), 8,33 (s, 1H), 8,40 (d, 1H), 9,39 (s, 1H), 10,15 (s, 1H). Пример 35. Препарат 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(2 метилимидазол-1-ил)пиримидин-2-иламино]бензамида. Вместо 3-(2-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 34 используется 3-(4-метилимидазол-1-ил)-5-трифторметилфениламин, приготовленный в препарате 30, для получения соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,27 (s, 3 Н), 2,31 (s, 3 Н), 2,71 (s, 3 Н), 6,85 (d, 1 Н), 7,25 (d, 2H), 7,39 (s, 1H),7,57 (d, 2H), 7,88 (m, 3H), 7,93 (d, 2H), 8,08 (s, 1H), 8,37 (d, 1H), 8,43 (d, 1H), 9,41 (s, 1H), 9,88 (s, 1H). Пример 36. Препарат N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(4-метилимидазол 1-ил)пиримидин-2-иламино]бензамида. 4-[4-(4-Метилимидазол-1-ил)пиримидин-2-амино]бензойная кислота и 3-(2-метилимидазол-1-ил)-5 трифторметилфениламин, приготовленный в препарате 31, используются в соответствии с процедурой в примере 1 для получения соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,25 (s, 3 Н), 2,77 (s, 3 Н), 7,02 (d, 1H), 7,27 (d, 2H), 7,48 (d, 2H), 7,53 (d,2H),7,66 (m, 3 Н), 7,81 (d, 2H), 8,32 (s, 1H), 8,33 (d, 1H), 8,45 (s, 1H), 10,07 (s, 1H). Пример 37. Препарат N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(4-метилимидазол 1-ил)пиримидин-2-иламино]бензамида. Вместо 3-(2-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 36 используется 3-(4-метилимидазол-1-ил)-5-трифторметилфениламин, приготовленный в препарате 30, для получения соединения в виде твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6, ) = 2,22 (s, 3 Н), 2,75 (s, 3 Н), 6,93 (d, 1H), 7,32 (s, 1H), 7,45 (d, 2H), 7,47 (s, 2H),7,78 (m, 3 Н), 7,89 (d, 2H), 8,21 (s, 1H), 8,28 (s, 1H), 8,31 (s, 1H), 9,45 (s, 1H), 10,01 (s, 1H). Пример 38. Препарат 4-метил-N-[3-(2-метилимидазол-1-ил-5-трифторметилфенил]-3-[4-(4 метилимидазол-1-ил)пиримидин-2-иламино]бензамида. 4-Метил-3-[4-(4-метилимидазол-1-ил)пиримидин-2-иламино]бензойная кислота и 3-(2-метилимидазол-1-ил)-5-трифторфениламин, приготовленный в препарате 31, используются в соответствии с процедурой в примере 1 для получения соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,27 (s, 3 Н), 2,34 (s, 3 Н), 2,75 (s, 3 Н), 6,97 (d, 1H), 7,17 (d, 2H), 7,30 (s, 1 Н),7,61 (m, 3 Н), 7,77 (d, 2H), 7,88 (d, 2H), 8,33 (s, 1H), 8,41 (d, 1H), 9,38 (s, 1H), 10,17 (s, 1H). Пример 39. Препарат 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(4 метилимидазол-1-ил)пиримидин-2-иламино]бензамида. Вместо 3-(2-метилимидазол-1-ил)-5-трифторметилфениламина в соответствии с процедурой в примере 38 используется 3-(4-метилимидазол-1-ил)-5-трифторметилфениламин, приготовленный в препарате 30, для получения соединения в виде твердого вещества желтого цвета. 1 Н-ЯМР (ДМСО-d6, ) = 2,26 (s, 3 Н), 2,32 (s, 3 Н), 2,71 (s, 3 Н), 6,88 (d, 1H), 7,27 (s, 1H),7,40 (s, 1H), 7,57 (d, 2H), 7,88 (m, 3H), 7,95 (d, 2H), 8,10 (s, 1H), 8,39 (s, 1H), 8,45 (d, 1H), 9,43 (s, 1H),9,90 (s, 1H). Эксперимент 1. В настоящем эксперименте ингибирующая активность соединения формулы (1) определялась в отношении роста раковой клетки K562. Сначала клетки выдерживались в среде RPMI (Roswell Park Memorial Institute) - 1640, содержащей 10%-ную (об./об.) эмбриональную бычью сыворотку, в инкубаторе при 37 С и 5% по объему СО 2. Раковые клетки (1000 клеток) переносились на пластинку с 96 ячейками, и тестовое соединение разводилось. Пластинка выдерживалась при вышеуказанных условиях в течение 2 дней. После этой обработки к клеткам добавлялся 0,2% раствор бромида (3-[4,5-диметилтиазол-2-ил]2,5-дифенилтетразолия. Полученная смесь выдерживалась при постоянной температуре в течение 4 ч. Надосадочная жидкость удалялась для получения кристалла. Для растворения кристалла добавлялся ДМСО и измерялся коэффициент поглощения при 540 нм. Значение IC50 вычислялось с помощью компьютерной системы по следующей формуле:- 13015103 В вышеприведенной формуле значение IC50 определяется как концентрация активного соединения,когда количество клеток на ячейку в конце обработки при постоянной температуре равняется 50% от количества клеток в контрольной среде. Значение IC50 [мкг/мл] в нижеприведенной табл. 1 было получено для соединений примеров в соответствии с настоящим изобретением. Таблица 1 Как видно из табл. 1, существующий лекарственный препарат иматиниб мезилат показал значениеIC50, равное 0,54 мкг/мл в отношении клеточной линии хронического миелолейкоза, K562, тогда как соединения примеров 5, 6, 7, 8, 9, 24 и 30 настоящего изобретения показали значение IC50, равное 0,01 мкг/мл или меньше, что соответствует улучшению активности в 50 раз. Кроме того, соединения примеров 12 и 13 показали значительно более высокую активность, чем иматиниб мезилат. Эксперимент 2. В настоящем эксперименте ингибирующая активность соединения формулы (1) определялась в отношении роста раковой клетки СТ-26. Тест проводился в соответствии с аналогичной процедурой эксперимента 1. Полученные таким образом значения IC50 (мкг/мл) представлены в нижеследующей табл. 2. Таблица 2 Как видно из табл. 2, существующий лекарственный препарат иматиниб мезилат показал значениеIC50, равное 30,0 мкг/мл в отношении клеточной линии лейкемии, СТ-26, тогда как соединения примеров 5, 6, 7, 8, 9, 24 и 30 настоящего изобретения показали улучшение активности в 300 раз при той же концентрации. Кроме того, все остальные соединения примеров показали значительно большую активность,чем иматиниб мезилат. Эксперимент 3. В данном эксперименте ингибирующая активность иматиниб мезилата и соединений примеров 5 и 6 определялась в отношение роста нескольких раковых клеток. Тест проводился в соответствии с аналогичной процедурой эксперимента 1. Полученные таким образом значения IC50 (мкг/мл) представлены в нижеследующей табл. 3. Таблица 3 Как видно из табл. 3, соединения примеров 5 и 8 настоящего изобретения показали лучшую активность в отношении клеток рака легких А 549, клеток рака поджелудочной железы PANC-1, клеток рака- 14015103 головного мозга А 172, клеток лимфомы RPMI-6666, клеток рака мочевого пузыря НТ-1197, клеток рака толстой кишки SNU-C1 и клеток рака желудка SNU-1 минимум в 15 раз и максимум в 50 раз и больше по сравнению с иматиниб мезаилатом соответственно. Вследствие этого ожидается разработка нового терапевтического агента против этих типов рака, а также хронической и острой лейкемии. Эксперимент 4. В данном эксперименте ингибирующая активность иматиниб мезилата, цисплатина и соединения примера 8 определялась в отношении роста саркомы, раковых клеток эпителия ротовой полости, раковых клеток яичников, раковых клеток легких и раковых клеток желудка. Тест проводился в соответствии с аналогичной процедурой эксперимента 1. Полученные таким образом значения IC50 (мкг/мл) представлены в нижеследующей табл. 4. Таблица 4 Как видно из табл. 4, соединение примера 8 настоящего изобретения показало лучшую активность в отношении клеток саркомы Саркома-180 и раковых клеток эпителия ротовой полости KB более чем в 1104 раз соответственно, чем иматиниб мезилат, и в отношении клеток рака желудка SNU-1, клеток рака яичников SR-OV-03 и клеток рака легких А 549 более чем в 170, 12 и 3,5 раза соответственно, чем иматиниб мезилат, в сравнительном эксперименте с цисплатином соединение примера 8 показало аналогичную активность в отношении клеток саркомы Sarcoma-180 и раковых клеток эпителия ротовой полости KB и лучшую активность в отношении клеток рака желудка SNU-1 более чем в 8 раз. Вследствие этого ожидается разработка нового терапевтического агента против этих типов рака, а также хронической и острой лейкемии. Эксперимент 5. Сравнительный фармакокинетический тест на белых крысах. За день до теста белые крысам (Sprague-Dawley, 250-280 г, самцы) была введена анестезия в виде пентобарбитала натрия (50 мг/кг, интраперитонеально). Затем крысам через сонную артерию и яремную вену был введен катетер (полиэтиленовая трубка, диаметр 0,58 мм) и выведен к спине. После операции крысы были зафиксированы на 16 ч и использованы для теста. Кровь из сонной артерии отбиралась через 0, 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 8, 10, 12 и 24 ч. Пробы для анализа с помощью ВЭЖХ готовились с использованием собранной крови согласно следующей процедуре и были проанализированы при следующих условиях. Подготовка пробы для анализа с помощью ВЭЖХ (высокоэффективная жидкостная хроматография). Кровь отбиралась каждый раз в заранее установлено время в количестве 0,8 мл и центрифугировалась при 15000 об/мин в течение 7 мин для отделения 300 мкл плазмы. Для удаления протеинов добавлялся МеОН в количестве 600 мкл, в два раза большем, чем количество плазмы, и смесь взбалтывалась в течение 30 мин. Смесь снова центрифугировалась при 15 000 об/мин в течение 15 мин для получения свободно плавающего на поверхности протеина, который затем анализировался с помощью ВЭЖХ. Условия ВЭЖХ анализа примера 5. Расход: 1,0 мл/мин, УФ (ультрафиолетовое)-детектирование при 267 нм Колонка: 4,6150 мм, 5 С 18-AR-II, COSMOSIL Элюент: Смесь пробы ионной пары (420 мл) и МеОН (580 мл) Проба ионной пары: 7,5 г 1-октансульфоновой кислоты растворяется в 800 мл воды. Получающаяся смесь с помощью фосфорной кислоты корректируется до рН 2,5 и разбавляется водой до объема 1000 мл. Условия ВЭЖХ анализа примера 8. Расход: 1,5 мл/мин, УФ-детектирование при 271 нм Колонка: Внутренний диаметр 4,6250 мм, Capcell Pack Phenyl UG120 Элюент: ацетонитрил: 0,2% муравьиная кислота в воде (75:25) Когда иматиниб мезилат и соединения примеров 5 и 8 вводились белым крысам перорально при дозировке 100 мг/кг соответственно, анализ ВЭЖХ подтверждал, что Смакс (максимальная концентрация в крови) и AUC (площадь под кривой концентрации в крови в зависимости от времени) соединения примера 5 были примерно в 4 раза и 5 раз соответственно больше чем для иматиниб мезилата. Кроме того, анализ ВЭЖХ подтверждал, что Смакс и AUC соединения примера 8 были примерно в 1,5 и 3 раза соответственно больше чем для иматиниб мезилата. В данной работе фармакокинетическими параметрами являются Тмакс (время до достижения максимальной концентрации в крови), Смакс (максимальная концентрация в крови) и AUC (площадь под кривой концентрации в крови в зависимости от времени). AUC вычис- 15015103 лялась по формуле трапеции (см. табл. 5 и чертеж). Таблица 5 Как видно из табл. 5, несмотря на то, что концентрация примеров 5 и 8 такая же, как и у иматиниб мезилата, обнаружено, что их фармакокинетические параметры Тмакс, Смакс и AUC выше, чем у иматиниб мезилата (табл. 5 и чертеж). На основании этих результатов можно сделать вывод о том, что соединения примеров 5 и 8 обнаруживают такой же эффект, что и иматиниб мезилат, при их клиническом применении примерно в два раз меньшей суточной дозе, чем у иматиниб мезилата. Вследствие этого соединение настоящего изобретения имеет лучший терапевтический эффект и некоторые преимущества, например, в стоимости и т.д., а также при промышленном производстве может быть разработана его рецептура для лекарственной формы для перорального применения (таблетки или капсулы) или для инъекций. Эксперимент 6. Тест на острую токсичность на мышах (перорально). Для определения острой токсичности соединения настоящего изобретения при пероральном применении мыши (ICR, 24-26 г) фиксировались на 16 ч. Одна группа состояла из 10 самцов и 10 самок. Первая группа являлась контрольной, которой перорально назначалась 0,5% натрийкарбоксиметилцеллюлоза (CMC). Соединения примеров 5 и 8 назначались каждой тестовой группе перорально в дозировке 2000 мг/кг - максимальная дозировка в тесте на острую токсичность. После приема клиническое состояние мышей наблюдалось в течение 14 дней, и измерялось изменение веса. В последний, четырнадцатый после начала, день теста мыши подвергались аутопсии для изучения изменений внутренних органов. За период наблюдений не было обнаружено ни одной ненормальной реакции или специфичного результата аутопсии. Кроме этого, вес тел мышей тестовых групп не показал никаких статистически значимых изменений по сравнению с контрольной группой. Кроме того, поскольку ни одна мышь не умерла во время теста, было подтверждено, что соединения примеров 5 и 8 имеют летальную дозу LD50 в количестве 2000 мг/кг или более. Это означает, что соединения настоящего изобретения, включая соединения примеров 5 и 8, безопасны в отношении острой токсичности. Тест на острую токсичность на крысах (перорально). В этом тесте острая токсичность соединения настоящего изобретения при введении соединения внутривенно определялась на крысах (SD-Rat, 100-110 г). Одна группа состояла из 5 самцов и 5 самок. Первая группа являлась контрольной, которой внутривенно назначалась 0,5% натрийкарбоксиметилцеллюлоза. Соединения примеров 5 и 8 назначались каждой тестовой группе перорально в дозировке 1000,2000 мг/кг соответственно. После приема клиническое состояние мышей наблюдалось в течение 14 дней и измерялось изменение веса. В последний, четырнадцатый после начала, день теста мыши подвергались аутопсии для изучения изменений внутренних органов. За период наблюдений не было обнаружено ни одной ненормальной реакции или специфичного результата аутопсии. Кроме этого, вес тел мышей тестовых групп не показал никаких статистически значимых изменений по сравнению с контрольной группой. Кроме того, поскольку ни одна мышь не умерла во время теста, было подтверждено, что соединения примеров 5 и 8 имеют летальную дозу LD50 в количестве 2000 мг/кг или более. Это означает, что соединения настоящего изобретения, включая соединения примеров 5 и 8, безопасны в отношении острой токсичности. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное N-фенил-2-пиримидинамина формулы (1)R1 представляет селективно замещенный тиазол, имидазол или пиразин, где заместитель является аминогруппой или алкилом, содержащим от 1 до 6 атомов углерода;R4 и R5, каждый независимо, представляют водород и R4 и R5 не являются одновременно водородом; илиR4 или R5, каждый, представляют радикал формулы (2) где R7 представляет алкил, содержащий от 1 до 6 атомов углерода, или алкил, содержащий от 1 до 6 атомов углерода, замещенный 1-3 галогенами,R8 представляет алифатический углеводород, имеющий от 5 до 10 атомов углерода, или представляет селективно замещенный 5-7-членный насыщенный или ненасыщенный моноциклический радикал,где заместитель является алкилом, содержащим от 1 до 6 атомов углерода, или бициклический или трициклический радикал, селективно связанный с бензольным кольцом (кольцами), каждое из которых имеет от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, или представляет пиперазинил или гомопиперазинил, каждый из которых замещен алкилом, содержащим от 1 до 6 атомов углерода; при условии, что если R4 представляет радикал формулы (2), то минимум один из R2, R3, R5 и R6,каждый независимо, представляет водород, галоген, алкил, содержащий от 1 до 6 атомов углерода, или алкокси, содержащий от 1 до 6 атомов углерода; или при условии, что если R5 представляет радикал формулы (2), то минимум один из R2, R3, R4 и R6,каждый независимо, представляет водород, галоген, алкил, содержащий от 1 до 6 атомов углерода, или алкокси, содержащий от 1 до 6 атомов углерода. 2. Соединение по п.1, гдеR4 или R5 представляют радикал формулы (2) где R7 представляет трифторметил или метил,R8 представляет 2-метилимидазол, 4-метилимидазол,при условии, что если R4 представляет радикал формулы (2), то минимум один из R2, R3, R5 и R6,каждый независимо, представляет водород, фтор, метил или метокси,при условии, что если R5 представляет радикал формулы (2), то минимум один из R2, R3, R4 и R6,каждый независимо, представляет водород, фтор, метил или метокси. 3. Соединение по п.1 или 2, выбранное из группы 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2-ил)пиримидин-2 иламино]бензамид; 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(тиазол-2-ил)пиримидин-2 иламино]бензамид; 4-метил-N-[5-метилтиазол-2-ил]-3-[4-(тиазол-2-ил)пиримидин-2-иламино]бензамид; 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин-2-ил)пиримидин-2 иламино]бензамид; 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(пиразин-2-ил)пиримидин-2 иламино]бензамид; 4-метил-N-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(3-метилпиразин-2 ил)пиримидин-2-иламино]бензамид; 4-метил-N-[3-(2-метилимидазол-1-ил)-5-трифторметилфенил]-3-[4-(3-метилпиразин-2 ил)пиримидин-2-иламино]бензамид илиN-[3-(4-метилимидазол-1-ил)-5-трифторметилфенил]-4-[4-(тиазол-2-ил)пиримидин-2 иламино]бензамид дигидрохлорид. 4. Способ получения соединения формулы (1), который включает взаимодействие соединения формулы (4 а) или (4b) где R7-R8 соответствуют определению в п.1, для образования соединения формулы (1 а) или (1b) где R1-R8 соответствуют определению в п.1 формулы изобретения. 5. Лекарственный препарат, включающий в себя эффективное количество соединения формулы (1) или его соли согласно определению в одном (любом) из пп.1-3 в качестве действующего вещества вместе с фармацевтически приемлемыми носителями. 6. Лекарственный препарат по п.5, где препарат используется для лечения рака легких, рака желудка, рака толстой кишки, рака поджелудочной железы, гепатомы, рака предстательной железы, рака груди, хронической или острой лейкемии, гематологической злокачественной опухоли, рака головного мозга, рака мочевого пузыря, рака прямой кишки, рака шейки матки и/или лимфомы. 7. Лекарственный препарат по п.5 или 6, используемый для перорального приема. 8. Лекарственный препарат по п.5 или 6, используемый для инъекций. 9. Способ лечения теплокровных животных, заключающийся во введении фармацевтически активного количества соединения формулы (1) или его соли по пп.1-3. 10. Способ по п.9 для лечения рака легких, рака желудка, рака толстой кишки, рака поджелудочной железы, гепатомы, рака предстательной железы, рака груди, хронической или острой лейкемии, гематологической злокачественной опухоли, рака головного мозга, рака мочевого пузыря, рака прямой кишки,рака шейки матки и/или лимфомы. 11. Соединение по п.1 или 2, где R1 представляет пиразин, 2-метилпиразин или тиазол, R2, R3, R5,R6, каждый независимо, представляют водород, R4 представляет радикал формулы (2), R7 представляет трифторметил или метил и R8 представляет 2-метилимидазол или 4-метилимидазол. 12. Соединение по п.1 или 2, где R1 представляет пиразин, 2-метилпиразин или тиазол, R2 представляет метил, R3, R4, R6, каждый независимо, представляют водород, R5 представляет радикал формулы (2),R7 представляет трифторметил или метил и R8 представляет 2-метилимидазол или 4-метилимидазол.
МПК / Метки
МПК: A61K 31/4965, C07D 401/02, C07D 239/02, C07D 417/00, A61K 31/425, A61K 31/505, A61K 31/44, C07D 239/28, A61P 35/00
Метки: способ, получения, n-фенил-2-пиримидинамина, производные
Код ссылки
<a href="https://eas.patents.su/20-15103-proizvodnye-n-fenil-2-pirimidinamina-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные n-фенил-2-пиримидинамина и способ их получения</a>
Предыдущий патент: Препараты наночастиц мезилата иматиниба
Следующий патент: Новые соединения, обладающие ингибирующей активностью в отношении натрийзависимого транспортера
Случайный патент: Кристаллический 2, 5-дион-3-(1-метил-1н-индол-3-ил) -4-[1-(пиридин -2- илметил)пиперидин-4-ил] -1н-индол-3-ил-1н-пирролмоногидрохлорид