Способ получения энантиомерно обогащенных или чистых соединений
Номер патента: 15994
Опубликовано: 30.01.2012
Авторы: Майвальд Михаэль, Заал Кристоф, Шлютер Тобиас, Шиманн Кай, Эмде Ульрих
Формула / Реферат
1. Способ получения энантиомерно обогащенных или чистых соединений формулы I
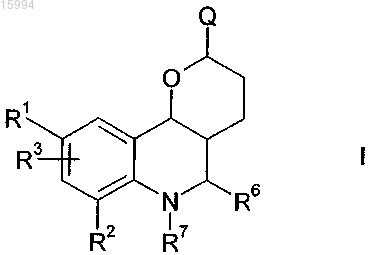
где R1 означает Н, А или -(CY2)n-NR2,
R2 означает Н или F,
R3 означает Н или А,
Y означает Н или Hal,
Е означает NR1CONR1- или -NR1-,
А означает неразветвленный или разветвленный алкил, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов С, в котором один или более атомов Н могут быть заменены Hal, или циклопропил, циклобутил, циклопентил, циклогексил или циклогептил, в котором один или более атомов Н могут быть заменены Hal,
Hal означает F, Cl, Br или I,
R означает Н или А,
Q означает CH2-E-(CH2)pR1,
R6 означает фенил 2-, 3- или 4-пиридил, пиримидил, фурил или тиенил, каждый из которых является незамещенным, либо моно- или полизамещенным остатками Hal, NO2, CN, ОН, A, CF3, OCF3, OCH(CF3)2 или -ОСОСН3,
R7 означает Н и
n означает 0, 1, 2, 3, 4, 5, 6 или 7,
p означает 0, 1, 2, 3, 4 или 5, предпочтительно 1 или 2,
а также их сольватов, таутомеров, солей и полиморфных форм,
включающий следующие стадии:
а) рацемическое или не энантиомерно чистое соединение формулы IA
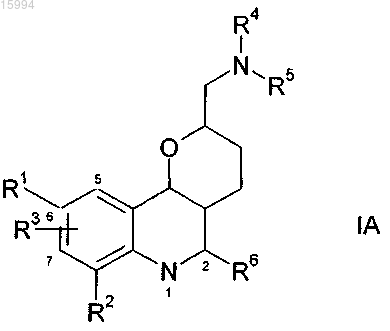
где R1, R2, R3 и R6 имеют определенные выше значения, а
R4, R5 означают независимо друг от друга Н, А или CONH(CH2)n-NA2,
вводят в реакцию с энантиомерно чистой (2R,3R)-(-)-ди-O-бензоилвинной кислотой с образованием кристаллического комплекса,
b) образованный на стадии а) комплекс выделяют и обрабатывают основанием с получением энантиомерно обогащенных или чистых соединений формулы IA
и, необязательно,
c) энантиомерно обогащенное или чистое соединение формулы IA превращают затем в другие соединения формулы I.
2. Способ по п.1, где R4 и R5 в формуле IA оба означают Н.
3. Способ по п.1, где R4 означает Н и R5 означает метил.
4. Способ по любому из пп.1-3 для получения соединений формулы IB

где R4 и R5 имеют значения, определенные в пп.2 и 3.
5. Способ по п.1, в котором получают энантиомерно обогащенное или чистое соединение формулы II
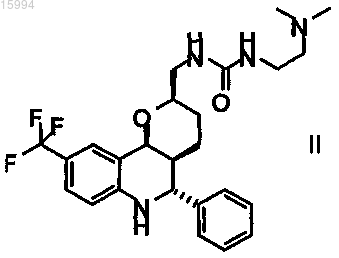
1-(2-диметиламиноэтил)-3-((2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4a,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевину.
6. Способ по п.5, который дополнительно включает следующие стадии:
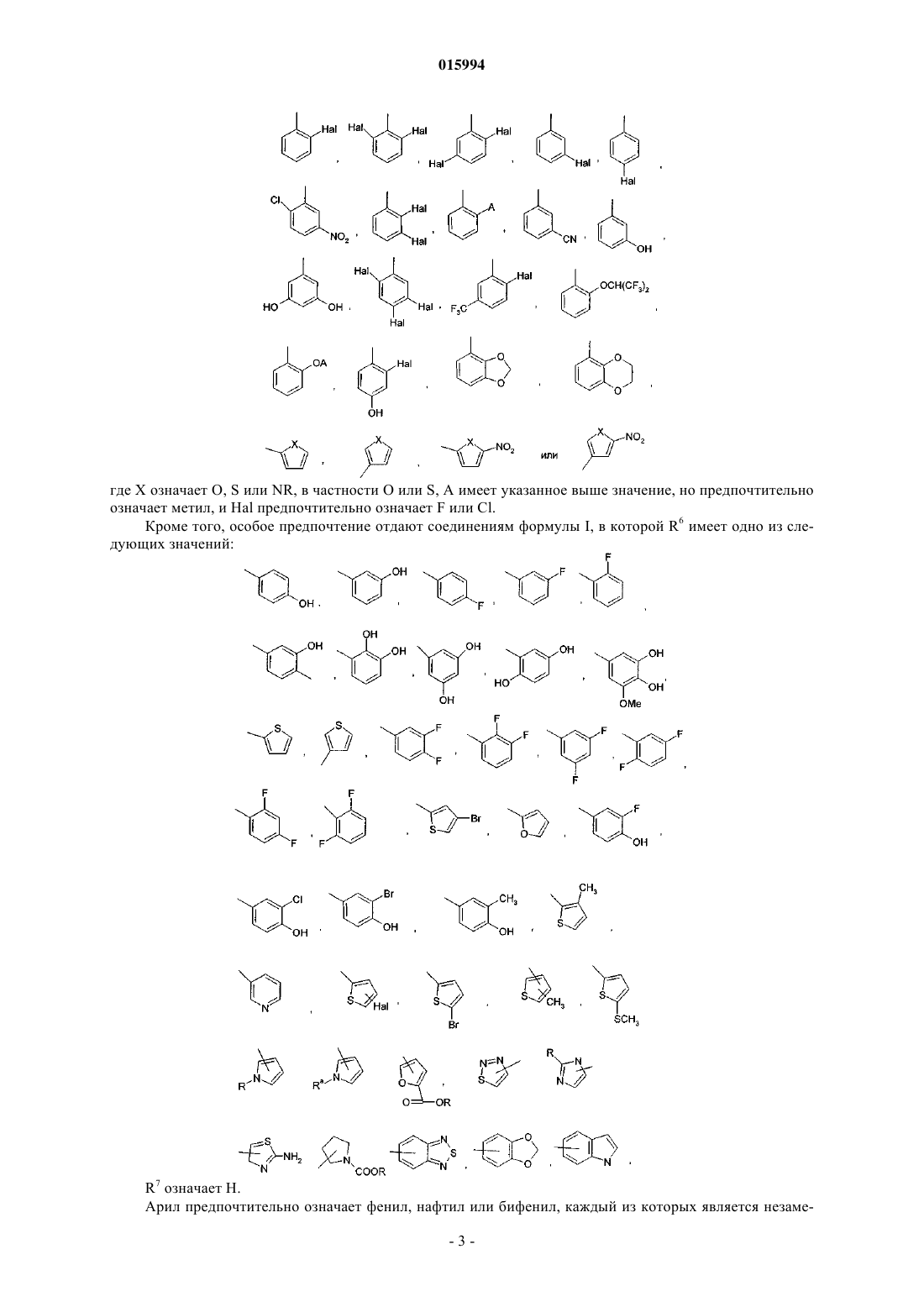
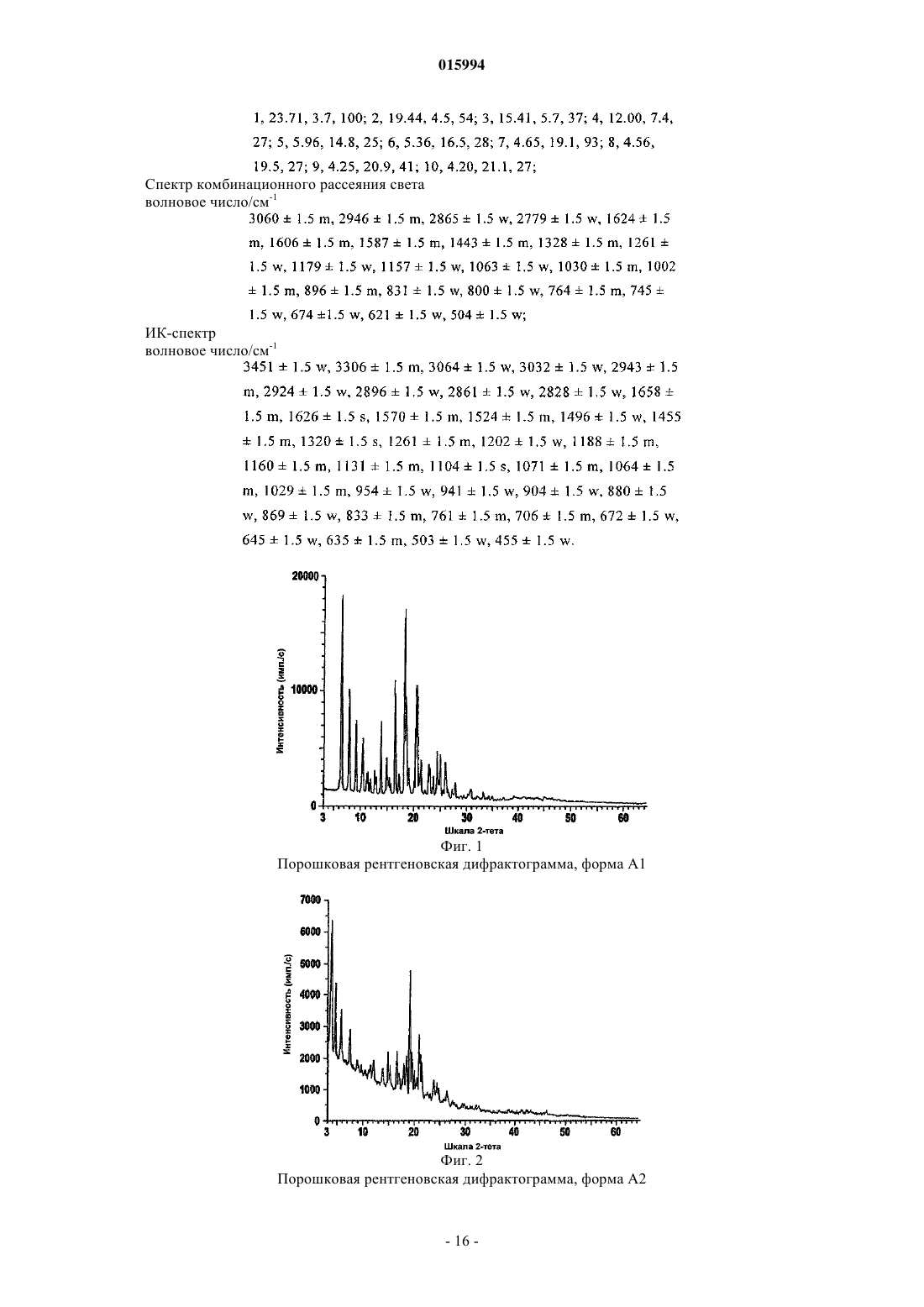
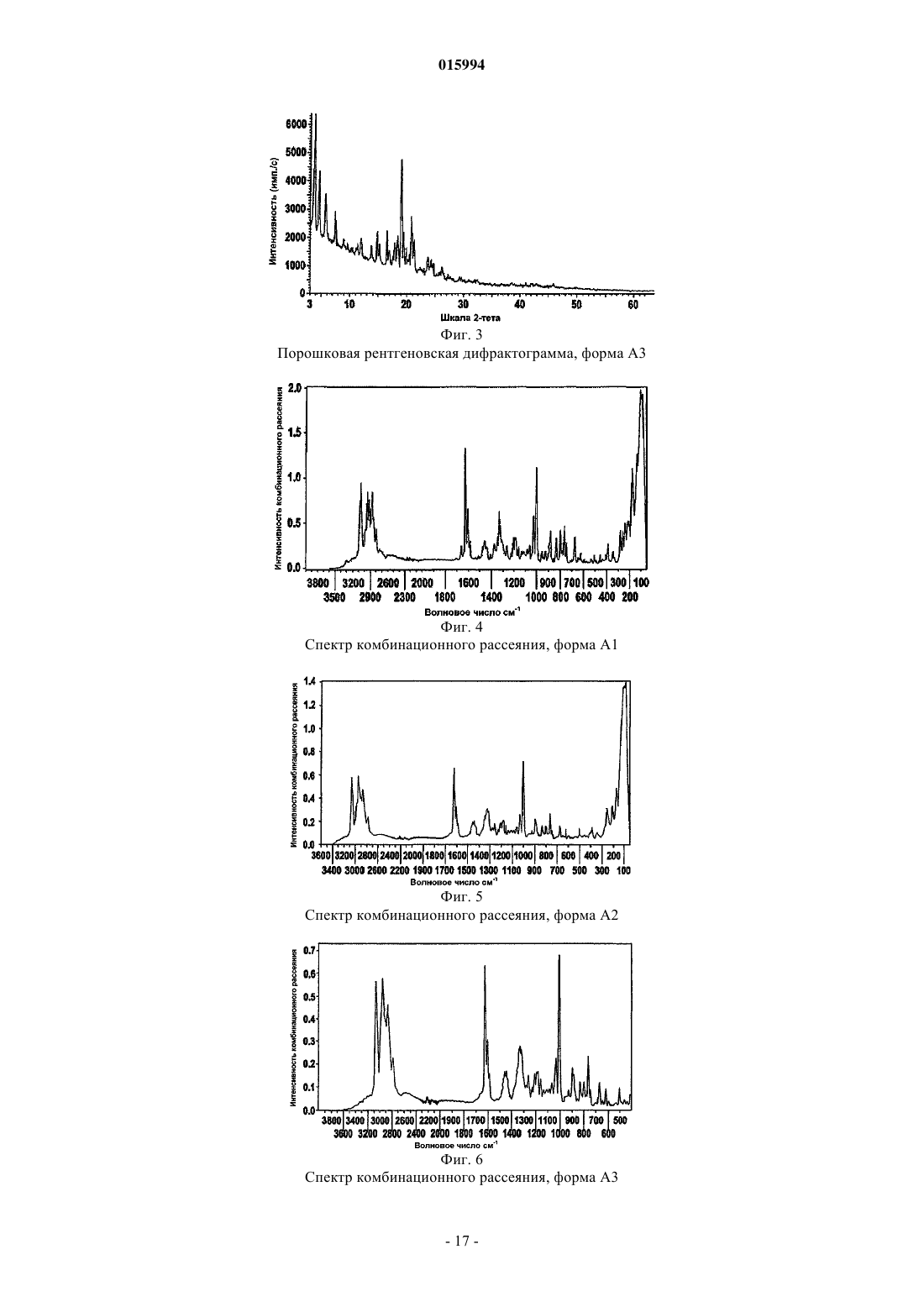
d) соединение формулы II кристаллизуют в подходящем растворителе с получением кристаллической формы A1, A2 или A3, по существу, свободной от других форм соединения формулы II, и, необязательно,
e) кристаллическую форму, образованную на стадии d), или смесь любых форм соединения формулы II, образованных на стадиях с) и d), перекристаллизовывают в подходящем растворителе с получением отличающейся кристаллической формы, по существу, свободной от других форм соединения формулы II.
7. Способ по п.6, в котором на стадии d) соединение формулы II кристаллизуют в ацетоне, ацетон/воде или ацетонитрил/воде.
8. Способ по п.6 или 7, в котором на стадии е) кристаллическую форму или смесь перекристаллизовывают в н-гептане.
9. Способ по любому из пп.6-8, где 1-(2-диметиламиноэтил)-3-((2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4а,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевину получают в кристаллической форме А1, обладающей следующими характеристиками:
Порошковая рентгеновская дифрактограмма
№, d/Å, 2q±0,1, I/Io

Спектр комбинационного рассеяния света
волновое число/см-1

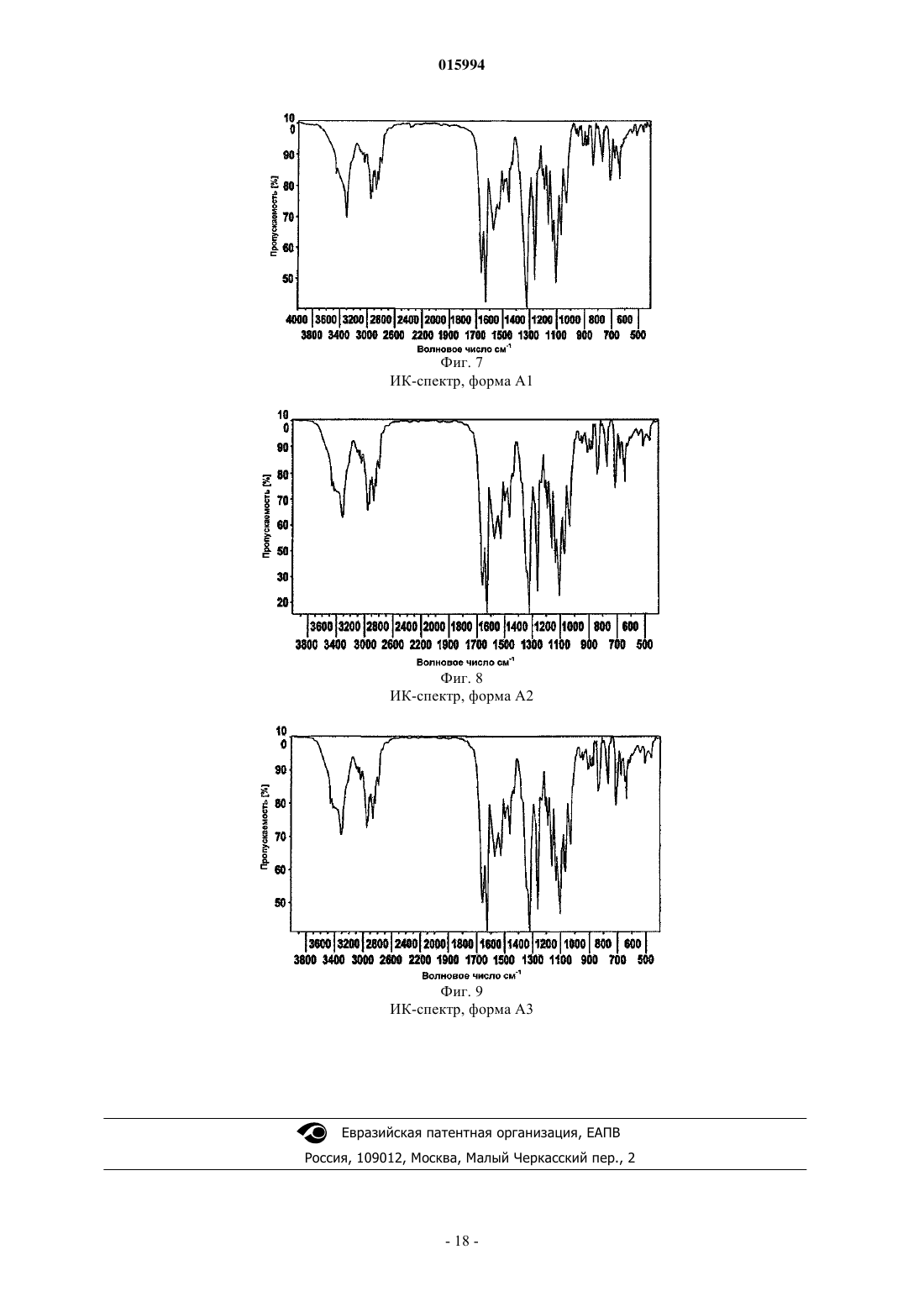
ИК-спектр
волновое число/см-1
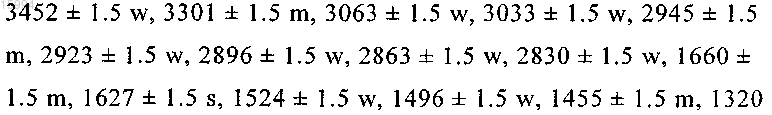

10. Способ по любому из пп.6-8, где 1-(2-диметиламиноэтил)-3-((2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4а,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевину получают в кристаллической форме А2, обладающей следующими характеристиками:
Порошковая рентгеновская дифрактограмма
№, d/Å, 2q±0,1, I/Io
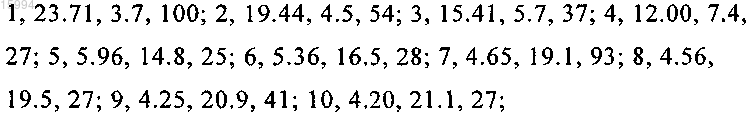
Спектр комбинационного рассеяния света
волновое число/см-1
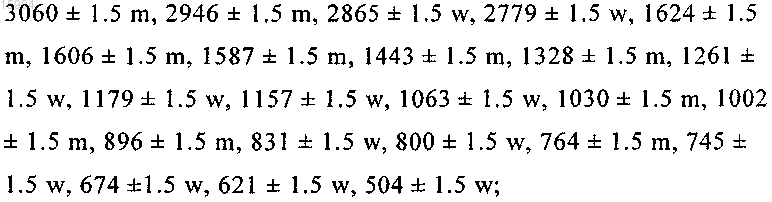
ИК-спектр
волновое число/см-1

Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНО ОБОГАЩЕННЫХ ИЛИ ЧИСТЫХ СОЕДИНЕНИЙ Изобретение относится к способу получения энантиомерно обогащенных или чистых соединений формулы I где R1, R2, R3, R6, R7 и Q имеют значения, указанные в описании, а также их кристаллических форм,применимых для лечения пролиферативных заболеваний, таких как рак.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) 015994 Изобретение относится к способу получения энантиомерно обогащенных или чистых соединений формулы I где R1 означает Н, А или -(CY2)n-NR2,R2 означает Н или F,R3 означает Н или А,Y означает Н или Hal,Е означает NR1CONR1- или -NR1-,А означает неразветвленный или разветвленный алкил, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов С, в котором один или более атомов Н могут быть заменены Hal, или циклопропил, циклобутил,циклопентил, циклогексил или циклогептил, в котором один или более атомов Н могут быть замененыHal,Hal означает F, Cl, Br или I,R означает Н или А,Q означает CH2-E-(CH2)PR1,R6 означает фенил 2-, 3- или 4-пиридил, пиримидил, фурил или тиенил, каждый из которых является незамещенным, либо моно- или полизамещенным остатками Hal, NO2, CN, ОН, A, CF3, OCF3,OCH(CF3)2 или -ОСОСН 3,R7 означает Н иn означает 0, 1, 2, 3, 4, 5, 6 или 7,р означает 0, 1, 2, 3, 4 или 5, предпочтительно 1 или 2,а также их сольватов, таутомеров, солей и полиморфных форм,включающий следующие стадии: а) рацемическое или не энантиомерно чистое соединение формулы IA где R1, R2, R3 и R6 имеют определенные выше значения, аR4, R5 означают независимо друг от друга Н, А или CONH(CH2)n-NA2,вводят в реакцию с энантиомерно чистой (2R,3R)-(-)-ди-O-бензоилвинной кислотой с образованием кристаллического комплекса,b) образованный на стадии а) комплекс выделяют и обрабатывают основанием с получением энантиомерно обогащенных или чистых соединений формулы IA и, необязательно,c) энантиомерно обогащенное или чистое соединение формулы IA превращают затем в другие соединения формулы I. Предпочтительными соединениями формулы I являются соединения формулы II где R1-R6 и Q имеют приведенные выше значения. Соединения согласно настоящему изобретению применяются для лечения и профилактики болезней, на которые влияет ингибирование, регулирование и/или модуляция митотических двигательных белков, особенно митотического двигательного белка Eg5. Такие болезни, главным образом, представляют собой все типы рака и других новообразований. Соединениями, подобными полученным в настоящем изобретении, являются, например, соедине-1 015994 ния, раскрытые в WO 2005/063735. Неожиданно установлено, что рацемическое или не энантиомерно чистое соединение формулы I и особенно соединение формулы I, где Q означает CH2NH2, образует комплексы с энантиомерно чистыми производными винной кислоты, предпочтительно бензоилвинной кислотой и особенно (2R,3R)-(-)-ди-О-бензоилвинной кислотой, которые формируют кристаллы с высокой энантиомерной чистотой. После отделения кристаллической фазы от пригодного растворителя, предпочтительно полярных протоновых растворителей, таких как спирты, их смесей или смесей спирт/вода, энантиомерно обогащенное или чистое соединение формулы I можно получить из комплекса с помощью реакции с основанием, таким как гидроксид щелочного металла, предпочтительно гидроксид натрия. Энантиомерно обогащнные или чистые соединения формулы I, где Q означает другой, чем CH2NH2, радикал, затем получают с помощью общепринятых путей синтеза, исходя из обогащенных или чистых соединений формулы I, где Q означает CH2NH2. Таким образом, изобретение предпочтительно относится к способу получения энантиомерно обогащенных или чистых соединений формулы I, который включает следующие стадии:a) рацемическое или не энантиомерно чистое соединение формулы I вводят в реакцию с энантиомерно чистым производным винной кислоты в пригодном растворителе, предпочтительно неорганическом растворителе, таким образом, что образуется кристаллический комплекс,b) комплекс, образованный на стадии а), выделяют и обрабатывают основанием и, необязательно,c) затем энантиомерно обогащенное или чистое соединение формулы I, где Q означает CH2NH2,превращают в другие соединения формулы I, где Q означает другой, чем CH2NH2, радикал, с помощью стандартного метода, превращающего первичную аминогруппу. Стандартные методы, применяемые на стадии с), представляют собой, например, алкилирование,амидирование, ацилирование, гидроксилирование. Предпочтительно стандартная методика представляет собой реакцию с карбонилдиимидазолом и амином, таким как N,N-диэтилэтилендиамин. Выше и ниже радикалы R, R1, R2, R3, R4, R5, R6, R7, X, Y, Q, Z, m, p и s имеют значения, указанные для формулы I, если только явно не указано иное. Если отдельные радикалы встречаются в формулах соединений несколько раз, радикалы принимают указанные значения независимо друг от друга. Остаток А означает алкил, предпочтительно неразветвлнный (линейный) или разветвлнный алкил, и имеет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 С атомов. А предпочтительно означает метил, кроме того, этил,пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3 метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-,1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2 метилпропил, 1,1,2- или 1,2,2-триметилпропил, кроме того, предпочтительно, например, трифторметил. А чрезвычайно предпочтительно означает алкил, который имеет 1, 2, 3, 4, 5 или 6 С атомов, предпочтительно метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, трифторметил, пентафторэтил или 1,1,1-трифторэтил. А также означает циклоалкил. Циклоалкил предпочтительно означает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил, но, в частности,циклопентил.R1 предпочтительно означает A, CF3, предпочтительно также трет-бутил, -CH(CH3)CH2CH3, изопропил, этил или метил. В частности, R1 означает трет-бутил, изопропил, этил, CF3, метил,CH(CH3)CH2CH3, н-пропил, н-бутил. R1 особенно предпочтительно означает трет-бутил, изопропил, этил или CF3.R означает Н или F. Если радикалы и индексы, такие как, например, n, встречаются более чем один раз, радикалы и индексы могут независимо друг от друга принимать разные значения.R6 означает фенил, 2-, 3- или 4-пиридил, пиримидил, фурил или тиенил, каждый из которых является незамещенным или моно- или полизамещн остатками Hal, CN, NO2, ОН, CF3, OCH(CF3)2, ОСОСН 3 или A. R6 предпочтительно не представляет собой гетероароматический радикал. В частности, R6 означает одну из следующих групп: где X означает О, S или NR, в частности О или S, А имеет указанное выше значение, но предпочтительно означает метил, и Hal предпочтительно означает F или Cl. Кроме того, особое предпочтение отдают соединениям формулы I, в которой R6 имеет одно из следующих значений:R7 означает Н. Арил предпочтительно означает фенил, нафтил или бифенил, каждый из которых является незаме-3 015994 щенным или моно-, ди- или тризамещен остатками Hal, А, ОН, ОА, NH2, NO2, CN, COOH, COOA,CONH2, NHCOA, NHCONH2, NHSO2A, CHO, COA, SO2NH2, SO2A, -CH2-COOH или -OCH2-COOH. Арил предпочтительно означает фенил, о-, м- или п-толил, о-, м- или п-этилфенил, о-, м- или ппропилфенил, о-, м- или п-изопропилфенил, о-, м- или п-трет-бутилфенил, о-, м- или п-гидроксифенил,о-, м- или п-метоксифенил, о-, м- или п-нитрофенил, о-, м- или п-аминофенил, о-, м- или п-(Nметиламино)фенил, о-, м- или п-(N-метиламинокарбонил)фенил, о-, м- или п-ацетамидофенил, о-, м- или п-метоксифенил, о-, м- или п-этоксифенил, о-, м- или п-этоксикарбонилфенил, о-, м- или п-(N,Nдиметиламино)фенил, о-, м- или п-(N,N-диметиламинокарбонил)фенил, о-, м- или п-(N-этиламино)фенил, о-, м- или п-(N,N-диэтиламино)фенил, о-, м- или п-фторфенил, о-, м- или п-бромфенил, о-, м- или пхлорфенил, о-, м- или п-(метилсульфонамидо)фенил, о-, м- или п-(метилсульфонил)фенил, кроме того,предпочтительно 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дифторфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5 дихлорфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дибромфенил, 2,4- или 2,5-динитрофенил, 2,5- или 3,4 диметоксифенил, 3-нитро-4-хлорфенил, 3-амино-4-хлор-, 2-амино-3-хлор-, 2-амино-4-хлор-, 2-амино-5 хлор- или 2-амино-6-хлорфенил, 2-нитро-4-N,N-диметиламино- или 3-нитро-4-N,N-диметиламинофенил,2,3-диаминофенил, 2,3,4-, 2,3,5-, 2,3,6-, 2,4,6- или 3,4,5-трихлорфенил, 2,4,6-триметоксифенил, 2 гидрокси-3,5-дихлорфенил, п-йодфенил, 3,6-дихлор-4-аминофенил, 4-фтор-3-хлорфенил, 2-фтор-4 бромфенил, 2,5-дифтор-4-бромфенил, 3-бром-6-метоксифенил, 3-хлор-6-метоксифенил, 3-хлор-4 ацетамидофенил, 3-фтор-4-метоксифенил, 3-амино-6-метилфенил, 3-хлор-4-ацетамидофенил или 2,5 диметил-4-хлорфенил. Гетероарил предпочтительно означает моно- или бициклический ароматический гетероцикл,имеющий один или несколько атомов N, О и/или S, который является незамещенным или моно-, ди- или тризамещен остатками Hal, A, NO2, NHA, NA2, ОА, СООА или CN. Гетероарил особенно предпочтительно означает моноциклический насыщенный или ароматический гетероцикл, имеющий один атом N, S или О, который может быть незамещенным или моно-, ди- или тризамещен остатками Hal, A, NHA, NA2, NO2, COOA или бензилом. Независимо от дополнительных замещений незамещенный гетероарил означает, например, 2- или 3-фурил, 2- или 3-тиенил, 1-, 2- или 3-пирролил, 1-, 2-, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 2-,4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 3- или 4 пиридил, 2-, 4-, 5- или 6-пиримидинил, кроме того, предпочтительно 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4 триазол-1-, -3- или 5-ил, 1- или 5-тетразолил, 1,2,3-оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5-ил,1,3,4-тиадиазол-2- или -5-ил, 1,2,4-тиадиазол-3- или -5-ил, 1,2,3-тиадиазол-4- или -5-ил, 3- или 4 пиридазинил, пиразинил, 1-, 2-, 3-, 4-, 5-, 6- или 7-индолил, 4- или 5-изоиндолил, 1-, 2-, 4- или 5 бензимидазолил, 1-, 3-, 4-, 5-, 6- или 7-бензопиразолил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 3-, 4-, 5-, 6- или 7-бензизоксазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил, 2-, 4-, 5-, 6- или 7-бензизотиазолил, 4-, 5-, 6- или 7 бенз-2,1,3-оксадиазолил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолил, 3-, 4-, 5-,6-, 7-или 8-циннолинил, 2-, 4-, 5-, 6-, 7- или 8-хиназолинил, 5- или 6-хинноксалинил, 2-, 3-, 5-, 6-, 7- или 8-2 Н-бензо-1,4-оксазинил, кроме того, предпочтительно 1,3-бензодиоксол-5-ил, 1,4-бензодиоксан-6-ил,2,1,3-бензотиадиазол-4- или -5-ил или 2,1,3-бензоксадиазол-5-ил.Hal предпочтительно означает F, Cl или Br, но также I, особенно предпочтительно F или Cl. По всему изобретению, все радикалы, которые встречаются более чем один раз, могут быть одинаковыми или различными, т.е. являются независимыми друг от друга. Соединения формулы I, а также исходные вещества для их получения, кроме того, получают методами, сами по себе известными, такими, как описанные в литературе (например, в стандартных работах,таких как Houben-Weyl, Methoden der organischen Chemie [Методы органической химии], Georg-ThiemeVerlag, Stuttgart), точнее говоря, при реакционных условиях, которые известны и являются подходящими для упомянутых реакций. Также можно применять варианты, которые сами по себе известны, но не упомянуты здесь более подробно. При необходимости исходные вещества могут быть также получены in situ, без выделения их из реакционной смеси, а вместо этого немедленно превращены далее в соединения формулы I. Реакцию в основном проводят в инертном растворителе, предпочтительно в присутствии протонной кислоты или кислоты Льюиса, такой как ТФУ, HFIP (гексафторизопропанол), соли висмута(III), соли иттербия(III) или CAN (церий(IV) аммоний нитрат). В зависимости от используемых условий время реакции составляет от нескольких минут до 14 дней, температура реакции находится в интервале между приблизительно 0 и 180, как правило, между 0 и 100, особенно предпочтительно между 15 и 35 С. Примерами пригодных инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2 дихлорэтан, тетрахлорметан, хлороформ или дихлорметан; нитрилы, такие как ацетонитрил; сероуглерод; карбоновые кислоты, такие как муравьиная кислота или уксусная кислота; нитросоединения, такие как нитрометан или нитробензол, или смеси упомянутых растворителей. Соединения формулы I, в которой R7 принимает значение, которое отличается от Н, предпочтительно получают путм алкилирования или ацилирования из соединений формулы I, в которой R7 представляет собой Н.-4 015994 При необходимости, функционально модифицированная амино и/или гидроксильная группа в соединении формулы I может быть получена путм сольволиза или гидрогенолиза стандартными способами. Это может быть выполнено, например, используя NaOH или KOH в воде, воде/ТГФ или воде/диоксане при температурах в интервале от 0 до 100 С. Восстановление сложного эфира до альдегида или спирта или восстановление нитрила до альдегида или амина выполняют с помощью способов, известных специалисту, квалифицированному в данной области техники, и описанных в стандартных работах по органической химии. Кроме того, изобретение относится к лекарственным средствам, которые включают по крайней мере одно соединение формулы I и/или его фармацевтически приемлемые производные, сольваты и стереоизомеры, включая их смеси во всех соотношениях, и необязательно наполнители и/или вспомогательные вещества. Фармацевтические препараты могут вводиться в форме дозированных единиц, которые включают заданное количество активного ингредиента на дозированную единицу. Такая единица может включать,например, от 0,5 мг до 1 г, предпочтительно от 1 до 700 мг, особенно предпочтительно от 5 до 100 мг,соединения в соответствии с настоящим изобретением в зависимости от подлежащего лечению состояния, способа введения и возраста, веса и состояния пациента, или фармацевтические препараты могут применяться в форме дозированных единиц, которые включают заданное количество активного ингредиента на дозированную единицу. Предпочтительными препаратами дозированных единиц являются те препараты, которые включают суточную дозу или частичную дозу, как показано выше, или их соответствующую часть активного ингредиента. Кроме того, фармацевтические препараты этого типа могут быть получены, используя способ, который в основном известен в области фармацевтики. Фармацевтические препараты могут быть приспособлены для их введения с помощью какого-либо желаемого пригодного способа, например перорального (включая буккальный или подъязычный), ректальнного, назальнного, местного (включая буккальный, подъязычный или чрезкожный), вагинального или парентерального (включая подкожный, внутримышечный, внутривенный или интрадермальный) способа. Такие препараты могут быть получены, используя все способы, известные в области фармацевтики, например путм объединения активного ингредиента с наполнителем(ями) или вспомогательным(и) веществом(ами). Фармацевтические препараты, приспособленные для орального введения, могут вводиться в виде отдельных единиц, таких как, например, капсулы или таблетки; порошков или гранул; растворов или суспензий в водных или неводных жидкостях; съедобных пен или пенистых продуктов; или жидких эмульсий типа "масло-в-воде" или "вода-в-масле". Терапевтически эффективное количество соединения формулы I зависит от многих факторов,включая, например, возраст и вес животного, определнное состояние, которое требует лечения, и его серьзности, природы препарата и способа введения, и, в конечном счете, определяется лечащим врачом или ветеринаром. Однако эффективное количество соединения в соответствии с изобретением для лечения роста опухоли, например рака ободочной кишки или молочной железы, обычно находится в диапазоне от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и, в частности, обычно в диапазоне от 1 до 10 мг/кг веса тела в сутки. Таким образом, фактическое суточное количество для взрослого млекопитающего массой 70 кг находится обычно в диапазоне от 70 до 700 мг, причем все это количество ежесуточно можно вводить в виде одной разовой дозы, или, как обычно, в виде нескольких частичных доз (например, двух, трех, четырех, пяти или шести доз), которые в сумме содержат ту же суточную дозу активного компонента. Эффективное количество соли, или сольвата, или физиологически функционального производного может быть определено как доля эффективного количества соединения в соответствии с изобретением как такового. Можно предположить, что аналогичные дозы пригодны для лечения других упомянутых выше состояний. Изобретение также относится к способу получения энантиомерно обогащенных или чистых соединений формулы IA, которые являются предпочтительными соединениями формулы I и которые могут служить промежуточными соединениями в способе получения энантиомерно обогащенных или чистых соединений формулы I, которые отличаются от соединений формулы IA где R1, R2, R3 и R6 имеют определенные выше значения,-5 015994R4, R5 означают независимо друг от друга T-(CH2)p-R1, а вместе также и -(СН 2)5-, -(СН 2)n-Х-(СН 2)nили -(CH2)n-Z-(CH2)n-,где Т означает -CONR - или одинарную связь,p принимает значения 0, 1, 2, 3, 4 или 5, предпочтительно 1 или 2,n принимает определенные выше значения,R1 предпочтительно означает А, циклоалкил, -C(CH3)3, - CF3, Hal, -(CY2)n-CF3. Особенно предпочтительно означает CF3. В особенно предпочтительных соединениях формулы I и IAR4, R5 предпочтительно означают Н или A, CONH(CH2)nNA2,. Особенно предпочтительными являются соединения формулы I и также IA, где R4 и R5 означают одновременно Н или R4 означает Н и R5 означает А, предпочтительно метил.R6 предпочтительно означает арил или гетарил. Особенно предпочтительным является незамещенный или замещенный арил, предпочтительно фенил. Предпочтительными соединениями формулы IA являются соединения формулы IA1 где R1, R2, R3, R4, R5 и R6 имеют приведенные выше значения. Особенно предпочтительными являются соединения формулы IB где R4 и R5 имеют определенные выше значения. Предпочтительными соединениями формулы IB являются соединения формулы IB1 где R4 и R5 имеют приведенные выше значения. Промежуточные соединения для способа согласно изобретению, такие как соединение IA, где R4 и 5R означают H или A, могут также быть получены в соответствии с WO 2005/063735, в частности, путем взаимодействия соединения Aa предпочтительно в присутствии протонной кислоты или кислоты Льюиса, такой как, например, трифторуксусная кислота, гексафторизопропанол, хлорид висмута(III), трифлат иттербия(III), трифлат скандия(III) или церий(IV) аммоний нитрат. Неожиданно установлено, что рацемическое или не энантиомерно чистое соединение формулы IA и особенно соединение формулы IA, где R4 и R5 оба означают Н, образуют комплексы с энантиомерно чистыми производными винной кислоты, предпочтительно бензоилвинной кислотой и особенно (2R,3R)-(-)ди-О-бензоилвинной кислоты, которые образуют кристаллы с высокой энантиомерной чистотой. После отделения кристаллической фазы от пригодного растворителя энантиомерно обогащенное или чистое соединение формулы IA можно получить из комплекса с помощью реакции с основанием,таким как гидроксид щелочного металла, предпочтительно гидроксид натрия. Энантиомерно обогащенные или чистые соединения формулы I затем получают с помощью общепринятых путей синтеза, исходя из обогащенных или чистых соединений формулы IA. Таким образом, изобретение относится к способу получения энантиомерно обогащенных или чистых соединений формулы I, который включает следующие стадии:a) рацемическое или не энантиомерно чистое соединение формулы IA вводят в реакцию с энантиомерно чистым производным винной кислоты в пригодном растворителе, предпочтительно неорганическом растворителе, таким образом, что образуется кристаллический комплекс,b) комплекс, образованный на стадии а), выделяют и обрабатывают основанием и, необязательно,c) затем энантиомерно обогащенное или чистое соединение формулы IA превращают в другие соединения формулы I с помощью стандартного метода, превращающего первичную аминогруппу. Стандартные методы, применяемые на стадии с), представляют собой, например, алкилирование,амидирование, ацилирование, гидроксилирование. Предпочтительно стандартная методика представляет собой реакцию с карбонилдиимидазолом и амином, таким как N, N-диэтилэтилендиамин. В предпочтительном варианте осуществления изобретения рацемическое или не энантиомерно чистое соединение формулы IA, где R4 и R5 оба означают H, или где R4 означает H и R5 означает алкил,предпочтительно метил, суспендируют или растворяют в органическом растворителе, таком как спирт,предпочтительно этанол, при температурах между 20 и 120 С, предпочтительно между 40 и 90 С и особенно предпочтительно при температуре кипения растворителя при нормальном давлении. При прибавлении винной кислоты раствор оставляют охлаждаться до приблизительно комнатной температуры и стоять в течение от нескольких часов до нескольких дней, предпочтительно от около 1 до около 24 ч, особенно от около 8 до около 20 ч. Кристаллы отделяют и обрабатывают гидроксидом натрия с получением свободного основания формулы IA. В особенно предпочтительном варианте осуществления настоящего изобретения, с помощью способа согласно изобретению получают энантиомерно обогащенное или чистое соединение II(1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4 а,5,6,10b-гексагидро 2H-пирано[3,2-с]хинолин-2-илметил)мочевину). Термин энантиомерно обогащенный или чистый предпочтительно относится к энантиомерной чистоте выше 60%, такой как от выше 80 до около 100%. В частности, термин относится к энантиомерной чистоте выше чем 98%. В наиболее предпочтительном варианте осуществления настоящее изобретение относится к кристаллической форме соединения формулы II и ее применению для лечения пролиферативных заболеваний, таких как рак, фармацевтическим композициям, содержащим кристаллическую форму, и способам е получения. Соединение формулы II, а также их терапевтически приемлемые соли, описаны в WO 2005/063735. Соединение формулы II является терапевтически активным и особенно пригодным для лечения пролиферативных заболеваний. Неожиданно установлено, что соединение формулы II является особенно стабильным в его основной, то есть несолевой форме, и может существовать в нескольких кристаллических формах, таких какAl, A2 и A3, предпочтительно А 1. Ещ одна цель настоящего изобретения состояла в том, чтобы предложить способ получения форм А 1 и А 2 и A3, по существу, свободных от других форм соединения фор-7 015994 мулы II, таких как аморфная форма. Порошковую рентгеновскую дифракцию (XRPD) используют в качестве метода, позволяющего дифференцировать форму A1, A2 и A3 от какой-либо другой и некристаллической или аморфной формы соединения формулы II. Кроме того, цель настоящего изобретения состояла в том, чтобы предложить фармацевтические препараты, содержащие соединение формулы I в форме А 1 или А 2 или A3, предпочтительно А 1. Форма А 1 является кристаллической формой, которая неожиданно проявляет выгодные свойства,например является чтко определнной, термодинамически более стабильной и менее гигроскопичной,чем форма А 2, A3 и аморфная форма, особенно при комнатной температуре. Форма А 1 также проявляет лучшую химическую стойкость, то есть обеспечивает более длительный срок хранения на основании улучшенного качества, температурной стабильности и светостойкости. При определнных условиях формы А 2 и A3 могут полностью или частично превращаться в форму А 1. Форма А 1 отличается большей термодинамической стабильностью, чем формы А 2 и A3. Более того, форма А 1 отличается тем, что, по существу, является негигроскопичной. Форму А 1 можно отличить от формы А 2, A3 и аморфной формы, используя рентгеновскую порошковую дифрактометрию. Идентификацию формы А 1, формы А 2 и A3 можно осуществить в соответствии с общепринятыми методами, которые могут быть найдены, например, в изданиях Bunn, С.W. (1948), Chemical Crystallography, Clarendon Press, London; or Klug, H. P.Alexander, L.E. (1974), X-Ray Diffraction Procedures, JohnWiley and Sons, New York. Форма А 1 в соответствии с настоящим изобретением отличается порошковой дифракционной картиной, показывающей, по существу, приведенные на фиг. 1 параметры. В соответствии с изобретением далее предлагается способ получения форм A1, A2 и A3. Форму А 1 можно получить путем кристаллизации или перекристаллизации любой формы соединения формулы II или смесей любых форм в подходящем растворителе, таком как, например, ацетон/вода или предпочтительно ацетонитрил или ацетонитрил/вода, при приблизительно комнатной температуре или повышенной температуре и в течение длительного времени. Примеры "длительного времени" включают, но не ограничиваются ими, периоды от нескольких часов, например 2 ч, до нескольких недель. Пригодными растворителями являются, 2-пропанол, ацетонитрил, тетрагидрофуран, толуол, хлороформ,формамид, 2-бутанон или пиридин. Ацетонитрил является наиболее предпочтительным. Более того, пригодными растворителями являются надкритические жидкости с их модификаторами. Такими растворителями являются, например, жидкий углекислый газ, этилен, пропан, бутан, динитрооксид (N2O). Пригодными модификаторами являются этанол, метанол или этилацетат. Другими пригодными растворителями являются растворители, состоящие из больших молекул, такие как транскутол, этиленгликоль, пропиленгликоль, солютол, продукты Capryol PGMC, Capryol 90, алифатические углеводороды с длинной цепью, например гексан, октан, декан и спирты с длинной цепью, такие как гексанолы, октанолы, деканолы и их сложные эфиры. Форму А 1 можно получить путем суспендирования любой формы соединения формулы II или смесей любых форм в вышеупомянутых растворителях, а предпочтительно ацетонитриле, при приблизительно комнатной температуре или повышенной температуре и в течение длительного времени. Примеры "длительного времени" включают, но не ограничиваются ими, периоды от нескольких часов, например 2 ч, до нескольких недель. Ее также можно получить путем растворения или суспендирования любой формы соединения формулы II или смесей любых форм в чистом органическом растворителе, предпочтительно ацетоне, при добавлении антирастворителя, такого как вода. Форму А 2 можно получить путем перекристаллизации или суспендирования любой формы соединения формулы II, предпочтительно А 1, или смесей любых форм в н-гептане, при приблизительно комнатной температуре или повышенной температуре и в течение длительного времени. Примеры "длительного времени" включают, но не ограничиваются ими, периоды от нескольких часов, например 2 ч, до нескольких недель. Форму А 2 затем получают путем упаривания растворителя. Форму A3 можно получить путем распределения любой формы соединения формулы II, предпочтительно формы А 1, в н-гептане с последующим перемешиванием при комнатной температуре в течение от 1 до 20 дней, предпочтительно от 1 до 10 дней. Особенно предпочтительно перемешивание осуществляют в течение от 1 до 5 дней. Форму A3 затем выделяют с помощью фильтрования и сушки в вакууме. Форма А 1, полученная в соответствии с настоящим изобретением, является, по существу, свободной от других кристаллических и некристаллических форм, то есть от соединений форм, таких как форма А 2 или A3. По существу, выражение "свободная от других форм" следует понимать так, что форма А 1 содержит менее чем 10%, предпочтительно менее чем 5% любых других форм, например формы А 2 и/или формы A3. Форма А 2, полученная в соответствии с настоящим изобретением, является, по существу, свободной от других кристаллических и некристаллических форм, то есть от соединений форм, таких как форма А 1. По существу, выражение "свободная от других форм" следует понимать так, что форма А 2 содержит менее чем 10%, предпочтительно менее чем 5% любых других форм, например формы А 1. Настоящее изобретение также относится к смесям, содержащим форму А 1 в смеси с другими твр-8 015994 дыми формами соединения формулы II. Такие смеси включают предпочтительно более чем 50 мас.% формы А 1. Другие варианты осуществления включают, например, смеси, содержащие обнаруживаемое количество формы А, 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 98 или 99 мас.% формы А 1. Примеры других тврдых форм включают, но не ограничиваются ими, форму А 2, A3 и аморфную форму. Аморфную форму обнаруживали после перекристаллизации из ДМФА (диметилформамида),ДМСО, уксусной кислоты и водных растворов при рН 0-6. Обнаруживаемое количество формы A1, A2 и A3 означает количество, которое может быть обнаружено с использованием общепринятых методов, таких как ИК-Фурье-спектроскопия, спектроскопия комбинационного рассеяния, порошковая рентгеновская дифрактометрия и подобные. Термин "химическая стойкость" включает, но не ограничивается ими, температурную стабильность и светостойкость. Полученные в соответствии с настоящим изобретением полиморфные формы согласно изобретению, то есть форма A1, A2 и A3, проанализированы, охарактеризованы и дифференцированы друг от друга и аморфной формы с помощью по сути известного метода рентгеновской порошковой дифрактометрии. Ещ одним пригодным методом для анализа, определения характеристик и дифференцирования индивидуальных форм является спектроскопия комбинационного рассеяния или ИК-спектроскопия. Соединения формулы II также образуют стабильные сольваты с различными растворителями. Индивидуальные сольваты являются ещ одной целью настоящего изобретения. Сольваты получают путем кристаллизации в соответствующем растворителе без добавления антирастворителя, такого как вода. Предпочтительными растворителями для получения сольватов согласно настоящему изобретению являются метил-трет-бутиловый эфир (МТБЭ), ацетон и этилацетат. Другими предпочтительными растворителями для получения новых сольватов являются этанол, 1-пропанол, 1-бутанол и изобутилметилкетон(ИБМК). Другие сольваты получают, используя следующие растворители: анизол, 2-бутанол, бутилацетат, кумол, диэтиловый эфир, этилформиат, муравьиная кислота, изобутилацетат, изопропилацетат, метилацетат, 3-метил-1-бутанол, метилэтилкетон, пентан, 1-пентанол, 2-пентанол, пропилацетат. Для обеспечения введения пациенту эффективной дозы формы A1, A2 или A3 в соответствии с изобретением можно использовать любые пригодные пути. Например, можно использовать пероральные или парентеральные препараты и т.п. Лекарственные формы включают капсулы, таблетки, дисперсии,суспензии и т.п., например покрытые энтеросолюбильной оболочкой капсулы и/или таблетки, капсулы и/или таблетки, содержащие покрытые энтеросолюбильной оболочкой пеллеты. Во всех лекарственных формах соединение формулы II в формах A1, A2 и A3 может находиться в смеси с другими пригодными компонентами. В соответствии с изобретением далее предлагается фармацевтическая композиция, содержащая форму А 1, А 2 или A3, предпочтительно А 1, в качестве активного ингредиента, в комбинации с фармацевтически приемлемым носителем, разбавителем или наполнителем и необязательно другими терапевтическими ингредиентами. Композиции, содержащие другие терапевтические ингредиенты, представляют особый интерес для лечения пролиферативных заболеваний, таких как рак. Изобретение также предлагает применение форм A1, A2 или A3, предпочтительно А 1, при изготовлении лекарственного средства для применения для лечения пролиферативных болезней, таких как рак, и родственных болезней и состояний и способ лечения болезней, нарушений или состояний, который включает введение субъекту,страдающему от вышеуказанного состояния, терапевтически эффективного количества формы A1, A2 или A3. Композиции согласно изобретению включают композиции, пригодные для перорального или парентерального введения. Композиции могут быть легко представлены в виде стандартных лекарственных форм и приготовлены с помощью любого из известных в области фармацевтики методов. При практическом использовании изобретения наиболее пригодный путь введения, так же как и величина терапевтической дозы форм A1, A2 и A3 в каком-либо конкретном случае, будет зависеть от природы и тяжести болезни, подлежащей лечению. Доза и частота введения могут также изменяться в зависимости от возраста, веса тела и ответной реакции индивидуального пациента. Соединение согласно изобретению в качестве активного компонента можно объединять в тесную смесь с фармацевтическим носителем согласно обычным технологическим примам, такую как в случае оральных препаратов. Средства для комбинированной терапии, содержащие соединение формулы II и другие активные фармацевтические ингредиенты, раскрыты в WO 2005/063735. Соответствующие комбинации или смеси соединения формулы II и других активных фармацевтических ингредиентов также уместны и в случае соединений формулы II в форме A1, A2 и A3. Примеры,которые следуют ниже, предназначены для дальнейшей иллюстрации путей получения соединения согласно изобретению, а не для ограничения объма изобретения, как определено выше или заявлено ниже. Пример 1. Синтез 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9-трифторметил 3,4,4a,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевины. а) К раствору 4-аминобензотрифторида (5,00 кг, 31,0 моль) в 10 л ацетонитрила при интенсивном охлаждении на ледяной бане прибавляли трифторуксусную кислоту (2,39 л, 31,0 моль) на протяжении 20 мин. Во втором сосуде в 5 л ацетонитрила растворяли 3,4-дигидро-2 Н-пиран-2-метанол (3,61 кг, 31,0 моль) и бензальдегид (3,19 кг, 31 моль) и охлаждали до 10 С. К этому раствору на протяжении 30 мин прибавляли заранее приготовленную ТФУ-соль 4-аминобензотрифторида, поддерживая температуру ниже 15 С. Смесь перемешивали в течение 14 ч при 25 С, охлаждали до 15 С и образовавшийся осадок отфильтровывали и промывали 2,5 л ацетонитрила (3,36 кг жлтых кристаллов). К сырому продукту прибавляли 12 л ТГФ, нагревали с обратным холодильником и фильтровали при 50 С. Получали 1,96 кг (5,39 кг, 17%) жлтых кристаллов, идентифицированных как единственный трансизомер 1. Аналитика: т.пл.: 282-283 С. Фильтрат концентрировали до объема 3 л, охлаждали до 4 С и образовавшиеся в течение ночи кристаллы отфильтровывали (340 г жлтых кристаллов, идентифицировали как 1:1 смесь цис- и трансизомеров). Фильтрат обрабатывали 4 л петролейного эфира, охлаждали до 4 С в течение ночи, образовавшиеся кристаллы отфильтровывали, промывали диэтиловым эфиром и сушили. Получали 524 г (1,44 моль, 5%) зеленоватых кристаллов, идентифицированных как цис-изомер.b) Соединение 1 (330 г, 0,91 моль) суспендировали в 10 л ДХМ. К этой суспензии при 22 С прибавляли триэтиламин (208 мл, 1,50 ммоль) и метансульфонилхлорид (101 мл, 1,30 моль) в виде раствора в 200 мл ДХМ. Во время прибавления температура повышается до 30 С и смесь становится прозрачной спустя 1 ч при КТ. Ее перемешивали при КТ в течение ночи, и раствор выливали в воду со льдом. Органический слой отделяли и промывали водой 3 раза. Его сушили над сульфатом натрия, фильтровали и растворитель упаривали. Сырой продукт повторно растворяли/суспендировали в горячем этаноле (0,5 л),перемешивали в течение 2 ч и охлаждали до 4 С в течение ночи. Осадок отфильтровывали и сушили. Получали 383 г (0,87 моль, 96%) бесцветного тврдого вещества 2. с) В автоклаве 3,00 г (6,80 ммоль) мезилата 2 растворяли в 30 мл метанола. Реакционную смесь перемешивали и автоклав охлаждали и продували газообразным аммиаком. Газ внутри автоклава удаляли путем снижения давления. Автоклав ещ раз продували газообразным аммиаком. Давлению аммиака позволяли подняться до 5 бар. Температуру повышали до 100 С и реакционную смесь перемешивали в течение ночи. Во время протекания реакции продукт выпадал в осадок. Автоклав охлаждали, а давление снижали. Реакционную смесь собирали, прибавляли 100 мл метанола и охлаждали до 0 С. Образующиеся кристаллы собирали путем фильтрования, получая 2,14 г (5,91 ммоль, 87%) амина 3, который непосредственно использовали на следующей стадии без дополнительной очистки.d) 7,18 г (19,8 ммоль) рацемического амина 3 суспендировали в 200 мл этанола и нагревали с обратным холодильником. Прибавляли 3,55 г (9,9 ммоль) (2R,3R)-(-)-ди-O-бензоилвинной кислоты и 20 мл этанола и раствор нагревали с обратным холодильником. Раствор фильтровали и фильтр промывали 30 мл этанола. Фильтрат оставляли стоять в течение около 18 ч при комнатной температуре. В течение этого времени начиналось выпадение осадка. Кристаллы собирали путем фильтрования, промывали небольшим количеством холодного этанола и затем сушили на воздухе, получая 3,53 г (3,3 ммоль, 33%) диаминовой соли винной кислоты. Аналитика: т.пл.: 169-171 С; []D20 = -101,6(МеОН, с = 0,51). 11,9 г (11,0 ммоль) диаминовой соли винной кислоты суспендировали в 200 мл 2 н. NaOH. Через 15 мин реакционную смесь экстрагировали 750 мл этилацетата. Органический слой промывали рассолом,сушили Na2SO4 и растворители удаляли при пониженном давлении, получая 7,82 г (21,6 ммоль, 98%) энантиомерно чистого амина 4. е) Соединение 4 (168 г, 0,46 моль) растворяли в ДХМ (2 L) и на протяжении 10 мин при КТ небольшими порциями прибавляли карбонилдиимидазол (81,1 г, 0,50 моль). Смесь перемешивали в течение 2 ч при КТ. ТСХ показывала полное израсходование исходного вещества. Затем на протяжении 10- 10015994 мин прибавляли N,N-диэтилэтилендиамин (110 мл, 1,01 моль), в ходе чего температура повышалась до 27 С. Смесь перемешивали при КТ в течение 15 ч и выливали в воду со льдом (3 л). Смесь оттитровывали до рН 8 разбавленным раствором HCl, органическую фазу отделяли и дважды промывали водой (2 л). Раствор сушили над сульфатом натрия, фильтровали и растворитель упаривали при пониженном давлении. Остаток разбавляли диэтиловым эфиром, осадок отфильтровывали, промывали диэтиловым эфиром и сушили в вакууме, получая 188 г (0,40 моль), 85% бесцветных кристаллов, идентифицированных как 1(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4 а,5,6,10b-гексагидро-2Hпирано[3,2-с]хинолин-2-илметил)мочевина. Фильтрат охлаждали до 4 С в течение ночи и дополнительные 18 г (0,04 моль, 8%) целевого продукта 5 отфильтровывали и сушили в вакууме. Объединенные фракции повторно растворяли в ацетоне (1 л), нагревали до 40 С и медленно прибавляли воду (3 л). Смесь охлаждали до 4 С в течение 3 ч, образовавшийся осадок отфильтровывали и сушили в течение 3 дней при 80 С при пониженном давлении. Получали 192 г (0,40 моль, 87%) соединения 5 в виде бесцветного тврдого вещества. Аналитика: т.пл.: 123 С, [ ]D20 = -85,6(МеОН, с = 1,07). Пример 2. Соединение 1 (3,9 г, 8,83 ммоль) прибавляли в раствор метиламина (40 мл, 33%-ный раствор в этаноле) и реакционную смесь перемешивали в течение ночи при 100 С. Для завершения реакции прибавляли дополнительный метиламин (20 мл, 33%-ный раствор в этаноле) и реакционную смесь перемешивали в течение ночи при 100 С. Реакционную смесь охлаждали до комнатной температуры. Во время охлаждения происходило выпадение осадка. Образующиеся кристаллы собирали путем фильтрования и сушили при 35 С в вакуумном сушильном шкафу. Выход: 1,17 г бесцветных кристаллов. Остаток раствора концентрировали при пониженном давлении и обрабатывали трет-бутилметиловым эфиром. Образующиеся кристаллы собирали путем фильтрования и сушили при 35 С в вакуумном сушильном шкафу. Выход: 1,6 г бесцветных кристаллов. Вещество, полученное при проведении двух кристаллизаций, объединяли, получая 2,77 г (7,35 ммоль, 83% выход) соединения рац-2. Соединение рац-2 (0,93 г, 2,47 ммоль) растворяли в 15 мл этанола и нагревали с обратным холодильником. Прибавляли 0,45 г (1,24 ммоль) (2R,3R)-(-)-ди-О-бензоилвинной кислоты и 25 мл этанола и раствор нагревали с обратным холодильником. Раствор фильтровали и фильтр промывали 5 мл горячего этанола. Фильтрат оставляли стоять в течение около 18 ч при комнатной температуре. В течение этого времени начиналось выпадение осадка. Кристаллы собирали путем фильтрования, промывали небольшим количеством холодного этанола и затем сушили на воздухе, получая соединение (-)-2 (0,42 г, 0,38 ммоль) в виде диаминовой соли винной кислоты. Аналитика: т.пл. 200-203 С, D = -105,8 (метанол). Порцию кристаллов обрабатывали 1 н. NaOH, экстрагировали этилацетатом и растворитель удаляли при пониженном давлении. Оптическая чистота образующегося соединения (-)-2, определенная с помощью хиральной ЖХВР, составляла 98%. Пример 3. Форма А 1 (стабильный полиморф) 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5 фенил-9-трифторметил-3,4,4 а,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевины.I) Затравка кристаллов. При осторожном нагревании соединение 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9 трифторметил-3,4,4 а,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевины (1 г) растворяли в 2-пропаноле (50 мл). Все растворители удаляли при пониженном давлении. При осторожном нагревании часть образующегося остатка (0,5 г) растворяли в ацетоне (4,5 мл). Воду (4,0 мл) прибавляли до момента начала кристаллизации. Прибавляли дополнительное количество воды (2 мл) и смесь оставляли стоять на 18 ч при 0 С (баня со льдом). Образующиеся кристаллы собирали путем фильтрования, промывали холодной водой и сушили (80 С, 0,3 торр), получая бесцветные кристаллы (0,45 г) 1-(2 диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4 а,5,6,10b-гексагидро-2Hпирано[3,2-с]хинолин-2-илметил)мочевины. Кристаллы использовали в качестве затравочных кристал- 11015994 лов (см. часть II).II) Кристаллизация. При осторожном нагревании соединение формулы I (271,6 г) растворяли в ацетоне (2 л). Все растворители удаляли при пониженном давлении. Остаток (261 г) растворяли в горячем ацетоне (1 л). Медленно прибавляли воду (3 л). Когда прибавляли приблизительно 2,6 л воды, ранее прозрачный раствор становился мутным. Прибавляли затравочные кристаллы (см. часть I) и смесь оставляли стоять на 3 ч при 0 С (баня со льдом). Образующиеся кристаллы собирали путем фильтрования и промывали холодной водой. Полученные кристаллы сушили в течение 3 дней (80 С, 1 торр), получая бесцветные кристаллы (243 г) 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4 а,5,6,10bгексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевины в виде формы А 1. Порошковая рентгеновская дифрактограмма (фиг. 1) Спектр комбинационного рассеяния (фиг. 4) волновое число/см-1 Пример 4. Форма А 2 (метастабильный полиморф) 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5 фенил-9-трифторметил-3,4,4a,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевины. 1-(2-Диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4 а,5,6,10b-гексагидро 2H-пирано[3,2-с]хинолин-2-илметил)мочевину (50 мг, 0,105 ммоль) в форме А 1 распределяли в нгептане (200 мл) и суспензию перемешивали при комнатной температуре в течение 5 дней. Суспензию переносили в чашку Петри и сушили в сушильном шкафу на воздухе при 40 С в течение 1 дня. Перекристаллизованное вещество идентифицировали как 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил 9-трифторметил-3,4,4 а,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевину в полиморфной форме А 2. Порошковая рентгеновская дифрактограмма (фиг. 2) Спектр комбинационного рассеяния (фиг. 5) волновое число/см-1 Пример 5. Форма A3 (метастабильный полиморф) 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5 фенил-9-трифторметил-3,4,4 а,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевины. Форму А 1 (100 мг, 0,210 ммоль) распределяли в н-гептане (35 мл) и суспензию перемешивали при комнатной температуре в течение 5 дней. Осадок отфильтровывали, используя бумажный фильтр, и тотчас же сушили в вакууме. Вещество идентифицировали как 1-(2-диметиламиноэтил)-32R,4aS,R5,10bS)-5-фенил-9-трифторметил-3,4,4 а,5,6,10b-гексагидро-2 Н-пирано[3,2-с]хинолин-2 илметил)мочевину в полиморфной форме A3. Порошковая рентгеновская дифрактограмма Спектр комбинационного рассеяния (фиг. 6) Волновое число/см-1 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения энантиомерно обогащенных или чистых соединений формулы I где R1 означает Н, А или -(CY2)n-NR2,R2 означает Н или F,R3 означает Н или А,Y означает Н или Hal,Е означает NR1CONR1- или -NR1-,А означает неразветвленный или разветвленный алкил, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов С, в котором один или более атомов Н могут быть заменены Hal, или циклопропил, циклобутил,циклопентил, циклогексил или циклогептил, в котором один или более атомов Н могут быть замененыHal,Hal означает F, Cl, Br или I,R означает Н или А,Q означает CH2-E-(CH2)pR1,R6 означает фенил 2-, 3- или 4-пиридил, пиримидил, фурил или тиенил, каждый из которых является незамещенным, либо моно- или полизамещенным остатками Hal, NO2, CN, ОН, A, CF3, OCF3,OCH(CF3)2 или -ОСОСН 3,R7 означает Н иn означает 0, 1, 2, 3, 4, 5, 6 или 7,p означает 0, 1, 2, 3, 4 или 5, предпочтительно 1 или 2,а также их сольватов, таутомеров, солей и полиморфных форм,включающий следующие стадии: а) рацемическое или не энантиомерно чистое соединение формулы IA где R1, R2, R3 и R6 имеют определенные выше значения, аR4, R5 означают независимо друг от друга Н, А или CONH(CH2)n-NA2,вводят в реакцию с энантиомерно чистой (2R,3R)-(-)-ди-O-бензоилвинной кислотой с образованием кристаллического комплекса,b) образованный на стадии а) комплекс выделяют и обрабатывают основанием с получением энантиомерно обогащенных или чистых соединений формулы IA и, необязательно,c) энантиомерно обогащенное или чистое соединение формулы IA превращают затем в другие соединения формулы I. 2. Способ по п.1, где R4 и R5 в формуле IA оба означают Н. 3. Способ по п.1, где R4 означает Н и R5 означает метил. 4. Способ по любому из пп.1-3 для получения соединений формулы IB где R4 и R5 имеют значения, определенные в пп.2 и 3. 5. Способ по п.1, в котором получают энантиомерно обогащенное или чистое соединение формулы II 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9-трифторметил-3,4,4a,5,6,10b-гексагидро 2H-пирано[3,2-с]хинолин-2-илметил)мочевину. 6. Способ по п.5, который дополнительно включает следующие стадии:d) соединение формулы II кристаллизуют в подходящем растворителе с получением кристаллической формы A1, A2 или A3, по существу, свободной от других форм соединения формулы II, и, необязательно,e) кристаллическую форму, образованную на стадии d), или смесь любых форм соединения формулы II, образованных на стадиях с) и d), перекристаллизовывают в подходящем растворителе с получением отличающейся кристаллической формы, по существу, свободной от других форм соединения формулы II. 7. Способ по п.6, в котором на стадии d) соединение формулы II кристаллизуют в ацетоне, ацетон/воде или ацетонитрил/воде. 8. Способ по п.6 или 7, в котором на стадии е) кристаллическую форму или смесь перекристаллизовывают в н-гептане. 9. Способ по любому из пп.6-8, где 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9 трифторметил-3,4,4 а,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевину получают в кристаллической форме А 1, обладающей следующими характеристиками: Порошковая рентгеновская дифрактограмма Спектр комбинационного рассеяния света волновое число/см-1 10. Способ по любому из пп.6-8, где 1-(2-диметиламиноэтил)-3-2R,4aS,5R,10bS)-5-фенил-9 трифторметил-3,4,4 а,5,6,10b-гексагидро-2H-пирано[3,2-с]хинолин-2-илметил)мочевину получают в кристаллической форме А 2, обладающей следующими характеристиками: Порошковая рентгеновская дифрактограмма Спектр комбинационного рассеяния света волновое число/см-1
МПК / Метки
МПК: C07D 491/04, A61P 35/02, A61K 31/436
Метки: соединений, получения, чистых, энантиомерно, обогащенных, способ
Код ссылки
<a href="https://eas.patents.su/19-15994-sposob-polucheniya-enantiomerno-obogashhennyh-ili-chistyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения энантиомерно обогащенных или чистых соединений</a>
Предыдущий патент: Сборная панель для домостроения и способ изготовления такой панели
Следующий патент: Трактор с устройством автоматического управления направлением движения
Случайный патент: Метаболиты (r)-3-(4-(7h-пирроло[2,3-d]пиримидин-4-ил)-1h-пиразол-1-ил)-3-циклопентилпропаннитрила, ингибитора janus киназ