Способ получения практически чистых изомеров альфа-бисоксимов
Номер патента: 404
Опубликовано: 24.06.1999
Авторы: Мюллер Рут, Реми Бенуа, Байер Херберт, Заутер Хуберт, Гёц Норберт
Формула / Реферат
1. Способ получения практически чистых изомеров a -бисоксимов формулы Ia
R1O-N=CR2-CR3=N-OR4, Ia
в которых группы R1О- и R2 по отношению к связи N=C находятся в цис-положении относительно друг друга и в которых радикалы имеют следующее значение:
R1 и R4 обозначают водород или С-органический радикал;
R2 обозначает водород, циано, нитро, гидрокси, амино, галоген или органический радикал, который может быть непосредственно либо через атом кислорода, серы или азота связан со скелетом;
R3 обозначает водород, циано, нитро, гидрокси, амино, галоген, алкил, галогеналкил, алкокси, галогеналкокси, алкилтио, алкиламино, диалкиламино или циклоалкил,
отличающийся тем, что смесь изомеров a -бисоксимов формул Iа и Ib
R1O-N=CR2-CR3=N-OR4 R1O-N=CR2-CR3=N-OR4
"цис" "транс"
Ia Ib
обрабатывают в органическом растворителе кислотой Льюиса.
2. Способ получения соединений формулы Iа по п.1, отличающийся тем, что a -бисоксим формулы Ib по п.1, в котором группы R1О- и R2 по отношению к связи N=C находятся в транс-положении относительно друг друга, обрабатывают в органическом растворителе кислотой Льюиса.
3. Способ по п.1, отличающийся тем, что для получения практически чистых изомеров a -бисоксимов формулы Iа'
R1O-N=CR2-CR3=N-OR4, Ia'
в которых группы R1О- и R2 и группы R3 и -OR4 по отношению к связям N=C находятся соответственно в цис-положении относительно друг друга, смесь изомеров a -бисоксимов формул Ia' и Ib'
R1O-N=CR2-CR3=N-OR4 R1O-N=CR2-CR3=N-OR4
"цис" "цис" "транс" "цис"
Ia' Ib'
обрабатывают в органическом растворителе кислотой Льюиса.
4. Способ по п.3, отличающийся тем, что a -бисоксим формулы Ib'
R1O-N=CR2-CR3=N-OR4,
"транс" "цис"
Ib'
в котором группы R1О- и R2 по отношению к связи N=C находятся в транс-положении относительно друг друга, а группы R3 и -OR4 по отношению к связи С = N находятся в цис-положении относительно друг друга, обрабатывают в органическом растворителе кислотой Льюиса.
5. Способ по пп.1, 2, 3 или 4, отличающийся тем, что применяют апротонный органический растворитель.
6. Способ по пп.1, 2, 3 или 4, отличающийся тем, что реакцию осуществляют в диапазоне температур от -40 до 150ш С.
7. Способ по пп.1, 2, 3 или 4, отличающийся тем, что в качестве кислоты Льюиса применяют галогенид полуметалла либо металла третьей или четвертой главной группы, либо переходного металла.
8. Способ по п.7, отличающийся тем, что в качестве кислоты Льюиса применяют галогенид бора, алюминия, олова, цинка, железа или титана.
9. Способ по п.7, отличающийся тем, что в качестве галогенида применяют фторид, хлорид или бромид.
10. Способ по п.7, отличающийся тем, что в качестве кислоты Льюиса применяют фторид, хлорид или бромид полуметалла, либо металла третьей или четвертой главной группы, либо переходного металла.
11. Способ по пп.1, 2, 3 или 4, отличающийся тем, что в качестве кислоты Льюиса применяют АlСl3, АlВr3, FeCl3, ВВr3, ВСl3, ВF3, SnCl4 ZnCl2, ZnBr2 или TiCl4.
12. Способ по пп.1, 2, 3 или 4, отличающийся тем, что в качестве органического растворителя применяют толуол, метиленхлорид или тетрагидрофуран.
Текст
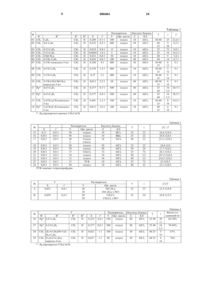
1 Настоящее изобретение относится к способу получения практически чистых изомеровR1O-N=CR2-CR3=N-OR4 ,Ia в которых группы R1O- и R2 по отношению к связи N=C находятся в цис-положении относительно друг друга и в которых радикалы имеют следующее значение:R1 и R4 обозначают водород или Сорганический радикал;R2 обозначает водород, циано, нитро, гидрокси, амино, галоген или органический радикал, который может быть непосредственно, либо через атом кислорода, серы или азота связан со скелетом;-Бисоксимы известны из литературы в качестве промежуточных продуктов и в качестве действующих веществ, предназначенных для борьбы с вредителями или вредоносными грибами (см. международные заявки WO-A 95/18789, WO-A 95/21153, WO-A 95/21154, WOA 95/21156, заявки Германии Р 4432336.0, Р 4441674.1). Описанные в этих публикациях действующие вещества в зависимости от конфигурации двойной связи группы R1O-N=CR2- обладают, как правило, различным действием, причем эффективность соединений, в которых группы R1 О- и R2 по отношению к связи N=C находятся в цис-положении относительно друг друга, обычно выше. С учетом этого фактора в указанных публикациях предлагается разделять изомеры по традиционной методике (например,посредством хроматографии). Однако выделение требуемого изомера из смеси изомеров имеет тот недостаток, что довольно значительная часть дорогих промежуточных или конечных продуктов остается неиспользованной, поскольку они представлены "не в той" конфигурации. Из литературы известны способы изомеризации -бисоксимов, недостаток которых обусловлен тем, что они или ограничены получением лишь оксимов с определенными (стабильными) радикалами и/или характеризуются неизбирательностью и/или неудовлетворительным выходом продуктов [ср. патент Германии DE-A 2908688; журнал "Общая химия", СССР, 58/1. стр. 181 (1988 г.); Tetrahedron 41/22, 5181 (1985); журнал "Органическая химия", СССР, 20, стр. 135 (1984 г.); журнал "Органическая химия",СССР, 27/1, стр. 97 (1991 г.); Journ. Phys. Chem. 91/26. 6490 (1987); Recl. Trav. Chim. Pays-Bas 111/2. 79 (1992)]. Кроме того, в литературе описывается конверсия бисоксимов в определенный изомер в условиях кислотного катализа [Synth. Reakt.Chem. 496. 197 (1983)]. Однако эти способы имеют тот недостаток, что их можно использовать только при работе с соединениями, заместители в которых устойчивы к действию кислот. Далее, в более ранней международной заявке WO-A 95/21153 описывается изомеризация соединения А в А', осуществляемая в простом эфире с помощью НСl с 75%-ным выходом. В основу изобретения была положена задача разработать универсальный способ получения практически чистых изомеров бисоксимов формулы IаR1O-N=CR2-CR3=N-OR4 ,в которых группы R1 О- и R2 по отношению к связи N=C находятся в цис-положении относительно друг друга, который может применяться,в частности, также при работе с соединениями,в которых заместители R1, R2, R3 и R4 неустойчивы к действию кислот, либо содержат группы,неустойчивые к кислотам. В соответствии с указанной задачей был создан способ получения практически чистых изомеров -бисоксимов формулы IaR1O-N=CR2-CR3=N-OR4 ,Ia в которых группы R1 О- и R2 по отношению к связи N=C находятся в цис-положении относительно друг друга, отличающийся тем, что смесь изомеров -бисоксимов формул Ia и IbIb обрабатывают в органическом растворителе кислотой Льюиса. По способу согласно изобретению практически чистые изомеры -бисоксимов формулыIа можно получать также в том случае, если бисоксим формулы Ib, в котором группы R1 О- иR2 по отношению к связи N=C находятся в транс-положении, обрабатывать в органическом растворителе кислотой Льюиса. В принципе способ по изобретению может осуществляться во всех органических растворителях, соответственно разбавителях, которые при взаимодействии с используемыми кислотами Льюиса не высвобождают протонные кислоты. С учетом этого фактора предпочтительное применение имеют апротонные органические растворители. Пригодными для использования в указанных целях растворителями являются, например, алифатические углеводороды, такие как пентан, гексан, гептан, циклогексан и петролейный эфир, ароматические углеводороды, такие как бензол, толуол, орто-, мета- и пара-ксилол, 3 галогенированные углеводороды, такие как метиленхлорид, хлороформ, 1,2-дихлорэтан и хлорбензол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, третбутилметиловый эфир, диоксан, анизол и тетрагидрофуран, а также диметилсульфоксид и диметилформамид; особенно предпочтительны среди названных алифатические углеводороды,в частности пентан, гексан, гептан, циклогексан и петролейный эфир, и ароматические углеводороды, в частности толуол, орто-, мета- и параксилол. Возможно также использование смесей указанных растворителей. Температура реакции зависит от типа заместителей -бисоксимов. Преимущественно изомеризацию проводят при температурах, по крайней мере, -40 С. При температурах свыше 150 С может уже начаться обусловленное такими температурами разложение бисоксимов. Однако это обусловленное температурами разложение зависит в основном от типа и стабильности заместителей и, таким образом, в случае устойчивых бисоксимов реакцию можно проводить также при повышенных температурах. Поэтому эту реакцию осуществляют обычно в диапазоне температур от -30 С до 140 С, предпочтительно от -10 С до 120 С. При осуществлении реакций согласно изобретению могут использоваться в принципе все кислоты Льюиса, которые в соответственно выбранном растворителе настолько устойчивы,что не происходит высвобождения никаких протонных кислот. Поэтому в качестве кислот Льюиса, как правило, могут использоваться галогениды полуметаллов либо металлов третьей или четвертой главной группы или же переходных металлов. Предпочтительно применяют галогениды бора, алюминия, олова, цинка, железа или титана. В качестве галогенидов при этом наиболее пригодны фториды, хлориды или бромиды. Примерами обычно применяемых в способе по изобретению кислот Льюиса являются АlСl3, AlBr3, FеСl3, ВВr3, ВСl3, ВF3, SnCl4,ZnCl2, ZnBr2 или TiCl4. В принципе достаточно использовать кислоты Льюиса в каталитических количествах,причем с увеличением количества соответствующей кислоты скорость реакции может возрастать. В соответствии с этим кислоту Льюиса применяют обычно в количестве от 0,1 до 500 мол.% (в пересчете на количество бисоксима Ib или на количество смеси бисоксимов Iа и Ib),что является вполне достаточным. Большие количества хотя и не нарушают реакцию, однако по соображениям экономичности процесса этого, как правило, и не требуется, а с учетом применения способа в промышленном масштабе(аспекты, связанные с техникой безопасности, и проблемы экологического характера) этого следует избегать. Исходя из вышеизложенного,рекомендуется использовать кислоты Льюиса преимущественно в количествах от 0,5 мол.% до 4 300 мол.%, предпочтительно от 1 мол.% до 150 мол.%, прежде всего от 10 мол.% до 80 мол.%. Вышеописанная методика осуществления способа согласно изобретению обеспечивает прежде всего возможность получения практически чистых изомеров -бисоксимов формулы Iа'R1O-N=CR2-CRЗ=N-OR4 ,Iа' в которых группы R1 О- и R2 и группы R3 и -OR4 по отношению к связям N=C находятся соответственно в цис-положении относительно друг друга, благодаря тому, что смесь изомеров бисоксимов формул Ia' и Ib'Ib' обрабатывают в органическом растворителе кислотой Льюиса. По способу согласно изобретению практически чистые изомеры -бисоксимов формулыIа' можно получать также в том случае, если бисоксим формулы Ib' обрабатывать в органическом растворителе кислотой Льюиса. Реакционные смеси перерабатывают по обычной технологии, например, смешением с водой, разделением фаз и необязательно хроматографической очисткой сырых продуктов. Конечные продукты получают частично в виде вязких масел, из которых при пониженном давлении и при умеренно повышенных температурах удаляют летучие компоненты или которые подвергают очистке. При получении конечных продуктов в виде твердых веществ очистку можно проводить также путем перекристаллизации либо выщелачивания. Предлагаемый способ имеет широкий диапазон применения. Прежде всего с помощью этого способа возможно получение практически чистых изомеров -бисоксимов формулы Iа,соответственно Iа', несущих группы, которые неустойчивы в кислых условиях реакции или которые могут образовывать комплексы с кислотами Льюиса, например, соединения, замещенные атомами галогена или группами простых эфиров, либо сложноэфирными группами(ср. таблицу 1). С помощью вышеописанного способа из четырех возможных изомеров -бисоксимов неожиданным образом получают преимущественно изомер Iа, соответственно Iа'. Предлагаемый способ обеспечивает такие условия реакции, при осуществлении которой, как правило,происходит предпочтительно изомеризацияR1 О-замещенной связи N=С и в то же время можно в значительной степени предотвратить изомеризацию R4 О-замещенной двойной связиN=C ср. таблицу 2 и таблицу 3 ([ie]:Ix). Кроме того, было установлено, что реакцию по способу согласно изобретению можно осуществлять 5 также в частности с такими -бисоксимами, в которых R1 и/или R4 обозначают водород. Предлагаемый способ пригоден прежде всего для получения практически чистых изомеров -бисоксимов, описанных в приведенных выше публикациях в качестве промежуточных продуктов и в качестве действующих веществ,предназначенных для борьбы с вредителями или вредоносными грибами. В соответствии с этим понятие "С-органический радикал" и понятие"органический радикал" включают в себя прежде всего значения, указанные в этих публикациях в общем и в частности. Примеры Общие принципы осуществления реакций со смесями изомеров -бисоксимов. а) Х молей смеси -бисоксимов [I'; соотношение изомеров (Ia':Ib'):i] в Y мл органического растворителя (Орг. раств.) смешивали с Z мол.% кислоты Льюиса (КЛ) и перемешивали в течение t часов при температуре [ТС]. После завершения переработки полученное в этих условиях соотношение изомеров [ie] (означаетIa':Ib') исследовали посредством газовой хрома 1 тографииH-ЯМРспектроскопии (ЯМР). Результаты этих исследований представлены в таблице 1. б) В других опытах Х молей смеси изомеров -бисоксимов формулы I [R1=СН 3,R2=C6H5, R3=СН 3, R4=H; соотношение изомеров(Орг. раств.) смешивали с Z мол.% кислоты Льюиса (КЛ) и перемешивали в течение t часов при температуре [ТС]. После завершения переработки полученное в этих условиях соотношение изомеров [iе]:Ix [iе] означает Ia':Ib' исследовали посредством газовой хроматографии(Ix:количество еще одного изомера еще неизвестной стереохимии). Результаты этих исследований представлены в таблице 2. в) В других опытах согласно Z. Anorg.[ТС]. После завершения переработки полученное в этих условиях соотношение изомеров[i6]:Ix [ie] означает Ia':Ib' исследовали посредством газовой хроматографии (ГХ), ЖХВД или 1H-ЯМР-спектроскопии (ЯМР) (Ix:количество еще одного изомера еще неизвестной стереохимии). Результаты этих сравнительных исследований представлены в таблице 3. Пример 01 (таблица 1). Получение (Е,Е)-1 фенил-1-метоксииминопропан-2-он-2-оксима. 40 г (0,208 моля) (Е,Е/Z,Е)-1-фенил-1 метоксииминопропан-2-он-2-оксима 6 смешивали с 2,77 г AlCl3. По истечении 25 ч при 30-40 С реакционную смесь смешивали с этиловым эфиром уксусной кислоты. Смесь промывали 2 Н соляной кислотой и сушили. Затем растворитель отгоняли при пониженном давлении. После кристаллизации в н-пентане получили 32,5 г (81% от теории) указанного в заголовке соединения в виде бесцветных кристаллов(s, 3 Н); 3,91 (s, 3H); 7,17 (m, 2H); 7,40 (m, 3H); 8,66 (s, широкий, ОН). Пример 02 (таблица 1). Получение (Е,Е)-1(4-фторфенил)-1-метоксииминопропан-2-он-2 оксима. 115,9 г (0,552 моля) (Е,Е/Z,Е)-1-(4 фторфенил)-1-метоксииминопропан-2-он-2 оксима (соотношение изомеров E,E:Z,E=1:1,9) в 600 мл толуола смешивали с 36,7 г AlCl3. По истечении 9 ч при 60 С и 20 ч при комнатной температуре (приблизительно 25 С) реакционную смесь добавляли в другую смесь из этилового эфира уксусной кислоты и ледяной воды. Полученную смесь смешивали с 10%-ной соляной кислотой и экстрагировали этиловым эфиром уксусной кислоты. Органическую фазу промывали и сушили. Затем растворитель отгоняли при пониженном давлении. После кристаллизации в н-пентане получили 86,4 г (75% от теории) указанного в заголовке соединения в виде бесцветных кристаллов (tпл: 156-157 С). 1(s, 3H); 3,91 (s, 3H); 7,03-7,25 (m, 4H); 8,67 (s,OH). Пример 03 (таблица 1): Получение (Е,Е)-1(4-хлорфенил)-1-метоксииминопропан-2-он-2 оксима 4 г (0,018 моля) (Е,Е/Z,Е)-1-(4-хлорфенил)1-метоксииминопропан-2-он-2-оксима (соотношение изомеров E,E:Z,E = 1:1,1) в 15 мл толуола смешивали с 0,2 г AlCl3. По истечении 72 ч при комнатной температуре (приблизительно 25 С) реакционную смесь смешивали с ледяной водой. Затем смесь экстрагировали третбутилметиловым эфиром. Органическую фазу промывали 10%-ной соляной кислотой и водой и сушили. Затем растворитель отгоняли при пониженном давлении. После кристаллизации в н-пентане получили 3,4 г (85% от теории) указанного в заголовке соединения в виде бесцветных кристаллов (tпл: 174-176C). 1 7 4:1) в 400 мл толуола смешивали с 5,2 г AlCl3. По истечении 8 ч при 30-40 С, а затем по истечении еще 12 ч при комнатной температуре(приблизительно 25 С) реакционную смесь добавляли к другой смеси из 100 мл этилового эфира уксусной кислоты и 200 мл 2H соляной кислоты. Полученную смесь экстрагировали этиловым эфиром уксусной кислоты. Органическую фазу промывали и сушили. Затем растворитель отгоняли при пониженном давлении. После кристаллизации в н-пентане получили 65 г (85% от теории) указанного в заголовке соединения в виде желтоватых кристаллов со степенью чистоты 90%. 1(s, 3 Н); 2,35 (s, 3 Н); 4,07 (s, 3 Н); 6,57 (s, 1H); 9,67 (s, широкий, ОН). Пример 08 (таблица 1). Получение (Е,Е)-1(4-цианофенил)-1-метоксииминопропан -2-он-2 оксима. 71,4 г (0,329 моля) (Е,Е/Z,Е)-1-(4 цианофенил)-1-метоксииминопропан-2-он-2 оксима (соотношение изомеров E,E:Z,E = 1,5:1) в 400 мл толуола смешивали с 4,4 г AlCl3. По истечении 5 ч при 35-40 С, а затем по истечении еще 72 ч при комнатной температуре (приблизительно 25 С) реакционную смесь добавляли к другой смеси из этилового эфира уксусной кислоты и 2H соляной кислоты. После экстрагирования этиловым эфиром уксусной кислоты органическую фазу промывали и сушили. Затем растворитель отгоняли при пониженном давлении. После кристаллизации в н-пентане/ метаноле получили 60,6 г (85% от теории) указанного в заголовке соединения в виде кристаллов желтоватого цвета (tпл: 165-170 С). 1 8 оксима (соотношение изомеров E,E:Z,E = 2:1) в 400 мл толуола смешивали с 4,9 г АlСl3. По истечении 8 ч при 30-40 С, а затем по истечении еще 16 ч при комнатной температуре (приблизительно 25 С) реакционную смесь добавляли к другой смеси из этилового эфира уксусной кислоты и 2H соляной кислоты. После экстрагирования этиловым эфиром уксусной кислоты органическую фазу промывали и сушили. Затем растворитель отгоняли при пониженном давлении. После кристаллизации в н-пентане/ метаноле получили 67,1 г (84% от теории) указанного в заголовке соединения в виде кристаллов желтоватого цвета (tпл: 163-166 С). 1(0,922 моля) гидрохлорида O-метилгидроксиламина и 200 мл метанола. По истечении 24 ч при комнатной температуре (приблизительно 25 С) растворитель удаляли при пониженном давлении. Полученный таким путем остаток растворяли в трет-бутилметиловом эфире и смешивали с 2H соляной кислотой. Водную фазу повторно экстрагировали трет-бутилметиловым эфиром. Из объединенных органических фаз после промывки, сушки и удаления растворителя получили смесь изомеров E,E:Z,E в соотношении 1:1,4 (определение посредством ГХ) со степенью чистоты 90-95%. 1H-ЯМР [СDСl3/ТМС;(част./млн)]: 2,05/2,10 (2s, 1H,1H); 3,91/3,97 (2s, 1H,1H); 7,18/7,38/7,61 (3m, 5H,5H); 9,14 (s, широкий,ОН,ОН'). По аналогичной технологии были получены среди прочих соединения формулы Iа', представленные в таблице 4. толуол толуол толуол толуол толуолY Орг. раств. 15 0,11 0,9:1 50 толуол 16 0,011 0,9:1 50 толуол 17 0,011 0,9:1 20 Толуол 3 СН 2 Сl2 18 0,011 0,9:1 20 толуол 19 0,011 0,9:1 50 толуол 20 0,011 0,8:1 15 СН 2 Сl2 21 0,011 0,9:1 10 толуол 22 0,011 0,9:1 15 толуол 23 0,011 0,8:1 15 ТГФ 24 0,011 0,9:1 50 толуол ТГФ означает тетрагидрофуран ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения практически чистых изомеров -бисоксимов формулы IaR1O-N=CR2-CR3=N-OR4,в которых группы R1 О- и R2 по отношению к связи N=C находятся в цис-положении относительно друг друга и в которых радикалы имеют следующее значение:R1 и R4 обозначают водород или Сорганический радикал;R2 обозначает водород, циано, нитро, гидрокси, амино, галоген или органический радикал, который может быть непосредственно либо через атом кислорода, серы или азота связан со скелетом;R3 обозначает водород, циано, нитро, гидрокси, амино, галоген, алкил, галогеналкил, алкокси, галогеналкокси, алкилтио, алкиламино,диалкиламино или циклоалкил,отличающийся тем, что смесь изомеров бисоксимов формул Iа и IbIb обрабатывают в органическом растворителе кислотой Льюиса. 2. Способ получения соединений формулыIа по п.1, отличающийся тем, что -бисоксим формулы Ib по п.1, в котором группы R1 О- и R2 по отношению к связи N=C находятся в трансположении относительно друг друга, обрабатывают в органическом растворителе кислотой Льюиса. 3. Способ по п.1, отличающийся тем, что для получения практически чистых изомеров бисоксимов формулы Iа'Ib' обрабатывают в органическом растворителе кислотой Льюиса. 4. Способ по п.3, отличающийся тем, чтоIb' в котором группы R1 О- и R2 по отношению к связи N=C находятся в транс-положении относительно друг друга, а группы R3 и OR4 по отношению к связи С = N находятся в цисположении относительно друг друга, обрабатывают в органическом растворителе кислотой Льюиса. 5. Способ по пп.1, 2, 3 или 4, отличающийся тем, что применяют апротонный органический растворитель. 6. Способ по пп.1, 2, 3 или 4, отличающийся тем, что реакцию осуществляют в диапазоне температур от -40 до 150 С. 7. Способ по пп.1, 2, 3 или 4, отличающийся тем, что в качестве кислоты Льюиса применяют галогенид полуметалла либо металла третьей или четвертой главной группы, либо переходного металла. 8. Способ по п.7, отличающийся тем, что в качестве кислоты Льюиса применяют галогенид бора, алюминия, олова, цинка, железа или титана. 9. Способ по п.7, отличающийся тем, что в качестве галогенида применяют фторид, хлорид или бромид. 10. Способ по п.7, отличающийся тем, что в качестве кислоты Льюиса применяют фторид,хлорид или бромид полуметалла, либо металла третьей или четвертой главной группы, либо переходного металла. 11. Способ по пп.1, 2, 3 или 4, отличающийся тем, что в качестве кислоты Льюиса применяют АlСl3, АlВr3, FeCl3, ВВr3, ВСl3, ВF3,SnCl4 ZnCl2, ZnBr2 или TiCl4. 12. Способ по пп.1, 2, 3 или 4, отличающийся тем, что в качестве органического растворителя применяют толуол, метиленхлорид или тетрагидрофуран.
МПК / Метки
МПК: C07C 249/04
Метки: практически, получения, чистых, способ, изомеров, альфа-бисоксимов
Код ссылки
<a href="https://eas.patents.su/7-404-sposob-polucheniya-prakticheski-chistyh-izomerov-alfa-bisoksimov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения практически чистых изомеров альфа-бисоксимов</a>
Предыдущий патент: Способ перехода между несовместимыми катализаторами полимеризации
Следующий патент: Винилсульфоксиды и способ их синтеза
Случайный патент: Запорное устройство, снабженное защелками в форме крючка с усилительными штырями