Способ получения энантиомерно обогащенных n-производных лактамов
Номер патента: 1964
Опубликовано: 22.10.2001
Авторы: Уоллис Кристофер Джон, Махмаудиан Махмауд, Досон Майкл Джон
Формула / Реферат
1. Способ получения, по существу, энантиомерно чистого N-защищенного (1R,4S)-2-азабицикло[2.2.1]гепт-5-ен-3-она формулы (IV)
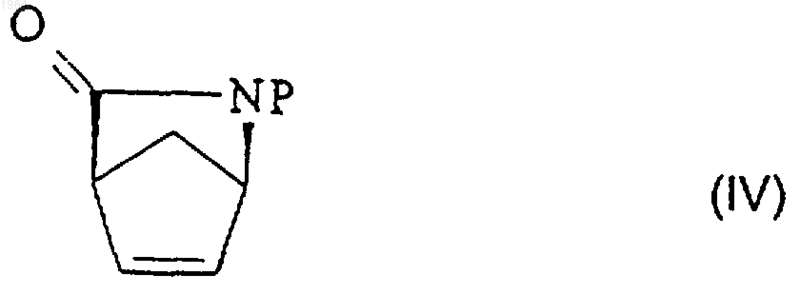
где Р представляет собой активирующую и защитную группу, при котором рацемическую смесь N-защищенного (+)-2-азабицикло[2.2.1]гепт-5-ен-3-она (V)
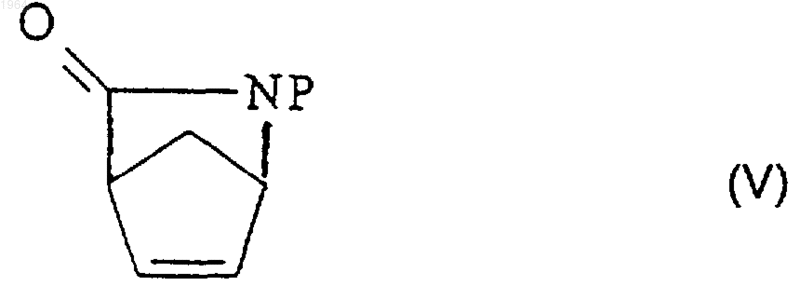
где Р представляет собой активирующую и защитную группу, обрабатывают ферментом ацилазой и выделяют непрореагировавший энантиомер формулы (IV) из реакционной смеси общепринятыми методами.
2. Способ энантиомерного разделения рацемической смеси N-защищенного (+)-2-азабицикло[2.2.1]гепт-5-ен-3-она (V)
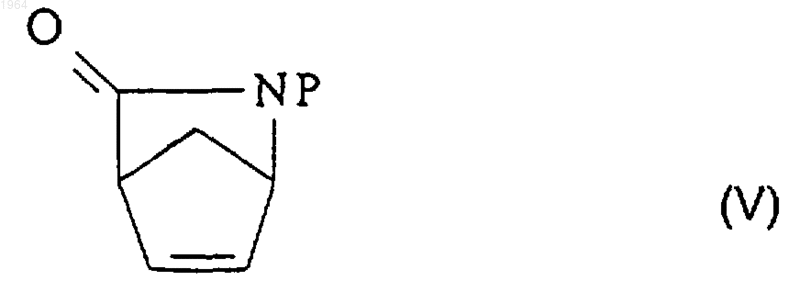
где Р представляет собой активирующую и защитную группу, для получения, по существу, энантиомерно чистого N-защищенного (1R,4S)-2-азабицикло[2.2.1]гепт-5-ен-3-она (IV), при котором обрабатывают эту смесь ферментом ацилазой.
3. Способ по п.1 или 2, где Р представляет собой ацильную или замещенную оксикарбонильную группу.
4. Способ по любому из пп.1-3, где Р представляет собой формильную или алканоильную группу, имеющую от 1 до 4 атомов углерода.
5. Способ по любому из пп.1-3, где Р представляет собой алкилоксикарбонильную или аралкилоксикарбонильную группу.
6. Способ по п.5, где Р представляет собой трет-бутилоксикарбонильную или бензилоксикарбонильную группу.
7. Способ по любому из пп.1-6, где фермент ацилазу получают из Bacillus sp.
8. Способ по п.7, где фермент ацилаза представляет собой Савиназу (Savinase).
9. Способ по любому из пп.1-8, где реакцию проводят в смеси органического растворителя и воды.
10. Способ по п.9, где органический растворитель представляет собой смешивающийся с водой органический растворитель и используют менее 70% воды по объему.
11. Способ по п.10, где смешивающийся с водой органический растворитель представляет собой тетрагидрофуран или 1,4-диоксан.
12. Способ по любому из пп.1-11, где реакцию проводят в диапазоне рН от 6 до 11 и при температуре от 20 до 50шС.
13. Способ по п.12, где реакцию проводят при рН приблизительно 8 и температуре приблизительно 30шС.
14. Способ по любому из пп.1-13, где непрореагировавший N-защищенный (1R,4S)-2-азабицикло[2.2.1]гепт-5-ен-3-он формулы (IV) выделяют экстракцией растворителем.
Текст
Настоящее изобретение относится к способу получения энантиомерно обогащенных Nпроизводных (1R,4S)-2-азабицикло[2.2.1]гепт-5 ен-3-онов. Известен (ЕР 0434 450) Абакавир (Abacavir), 2-аминопуриновый нуклеозидный аналог,имеющий следующую структуру (I) торые описаны в ЕР-А-0424064, и которые при нормальных условиях не обладают активностью по отношению к лактаму формулы (II), описанному в ЕР-А-0424064. Поэтому, по одному из аспектов настоящего изобретения, авторы изобретения предлагают способ энантиомерного разделения рацемической смеси и обладающий сильной активностью против вируса иммунодефицита человека (ВИЧ) и вируса гепатита В (HBV). Существует потребность в синтезе больших количеств абакавира для клинических испытаний. В дальнейшем, как только абакавир будет одобрен национальными медицинскими органами управления, большие количества абакавира потребуются также для продажи в качестве лекарств, отпускаемым по рецептам, для лечения ВИЧ-инфекций. Важной стадией в производстве абакавира является получение энантиомерно чистого замещенного циклопентенового кольца. Известны способы, в которых исходным соединением является лактам формулы (II): где Р представляет собой активирующую и защитную группу, для получения по существу энантиомерно чистого N-защищенного (1R,4S)2-азабицикло[2.2.1]гепт-5-ен-3-она (IV), при котором обрабатывают эту смесь ферментом ацилазой. Согласно другому аспекту настоящего изобретения авторы изобретения предлагают способ получения по существу энантиомерно чистого(1R,4S)-2 азабицикло[2.2.1]гепт-5-ен-3-она вышеуказанной формулы (IV), где Р представляет собой активирующую и защитную группу, при котором рацемическую смесь N-защищенного -2 азабицикло[2.2.1]гепт-5-ен-3-она вышеуказанной формулы (V), где Р представляет собой активирующую или защитную группу, обрабатывают ферментом ацилазой и непрореагировавший энантиомер формулы (IV) выделяют из реакционной смеси общепринятыми методами. Предпочтительно активирующая/защитная группа является ацильной или замещенной оксикарбонильной группой. Предпочтительные ацильные группы включают в себя формильную или низшую алканоильную группу (например имеющую в алкильной части от 1 до 4 атомов углерода), в частности ацетильную. Предпочтительными замещенными оксикарбонильными группами будут группы с формулой ROC(O)-,где R может быть алкильной или аралкильной группой. Предпочтительной алкильной группой является трет-бутил. Возможной аралкильной группой является бензил. Поскольку авторы изобретения также обнаружили, что в водных условиях может происходить в сущности удаление защиты с этих защищенных ацилами соединений, предпочтительно проводить эту реакцию в смеси органического растворителя и воды. Предпочтительно использовать смешивающиеся с водой органические растворители, такие как простые циклические эфиры, например тетрагидрофуран или 1,4-диоксан. Чтобы минимизировать удаление защиты, предпочтительно использовать менее 70% воды, более предпочтительно приблизительно 50% или менее (по объему). Установлено, что наиболее подходящей является смесь тетрагидрофурана и воды в соотношении приблизительно 50:50 (объем/объем). Известен (ЕР-А-0424064) способ, где рацемический лактам (II), полученный в результате взаимодействия циклопентадиена с тозилцианидом,можно подвергать взаимодействию с лактамазами, что дает единственный цис-энантиомер или смесь циc-энантиомеров, которая обогащена одним из этих энантиомеров, соединения(III), полученного в результате раскрытия кольца: вместе с непрореагировавшим лактамом, который энантиомерно обогащен тем или иным энантиомером. Авторы изобретения разработали высокопроизводительный и экономичный способ получения по существу энантиомерно чистых промежуточных продуктов, имеющих формулу где Р является активирующей и защитной группой, из их рацематов. Авторы изобретения обнаружили, что дериватизация лактамного атома азота в соединении формулы (II) группой Р (как в формуле (V) ниже) активирует лактамную связь для гидролиза. Неожиданно авторы изобретения обнаружили, что для получения соединений формулы (IV) можно использовать ферменты, которые легче получать, чем те, ко 3 При использовании, как указано выше, реакция обычно протекает в одной фазе. Однако нет причин, по которым успешным также не будет использование органического растворителя с целью создания двухфазной системы, такой как с ароматическими углеводородами. По завершении реакции непрореагировавший и по существу энантиомерно чистый Nзащищенный (1R,4S)-2-азабицикло[2.2.1]гепт-5 ен-3-он формулы (IV) можно выделить из реакционной смеси с помощью общепринятых методов, таких как экстракция растворителем. Был обнаружен ряд ферментов ацилаз, которые энантиоселективно гидролизуют лактамную связь так, чтобы оставлять при этом желаемый изомер. Авторы изобретения обнаружили,что, в частности, надлежащий профиль активности показывают ферменты, получаемые из Bacillus sp. Например, субтилизин Subtilisin carlsberg (ALTUS) дает N-защищенный (1R,4S)-2 азабицикло[2.2.1]гепт-5-ен-3-он [(IV), Р представляет собой трет-бутилоксикарбонил] из рацемической смеси (V) с энантиомерным избытком, составляющим 73%. Другие ферменты включают в себя протеазу Bacillus sp., нейтразу(Neutrase), Новозим 243 (Novozyme 243), Алкалазу (Alcalase) и Савиназу (Savinase) и имеются в продаже от ALTUS и NOVO. Также можно использовать ферменты, демонстрирующие энантиоселективный гидролиз, из других источников, такие как эстераза печени свиньи(ALTUS), панкреатическая липаза свиньи (Biocatalysts), Flavorpro-192 (пептидаза, Biocatalysts),Flavorpro-373 (глутаминаза, Biocatalysts), Promod-TP (эндопептидаза, Biocatalysts), липаза-СЕsp., Amano), липаза PGE (из корневой и слюнной железы теленка, Amano) и ацилаза Aspergillus sp. (Sigma). Предпочтительно будут использовать имеющийся в продаже фермент ацилазу Савиназу (NOVO), поскольку, в частности, было обнаружено, что он показывает скорости биоконверсии N-защищенного (1R,4S)-2-азабицикло[2.2.1]гепт-5-ен-3-она, подходящую для использования в промышленных масштабах. Савиназа является протеолитическим ферментом,получаемым глубинной ферментацией алкалофильных видов Bacillus. Она представляет собой эндопротеазу серинового типа. В тестах,проведенных авторами изобретения, этот фермент не показал какую-либо способность гидролизовать рацемическую смесь неацилированного лактама формулы (II) при использовании в нормальных условиях. Биоконверсию N-защищенного (1S,4R)-2 азабицикло[2.2.1]гепт-5-ен-3-она желательно проводить в диапазоне рН от 6 до 11, предпочтительно от 7 до 9. Предпочтительно использовать температурный диапазон от 20 до 50 С. Наиболее предпочтительно проводить этот про 001964 4 цесс при значении рН, равном приблизительно 8, и температуре приблизительно 30 С. Соотношение савиназа/субстрат в диапазоне от 1:1 до 10:1, например от 2:1 до 5:1 (масса/масса) обеспечивает быструю, полностью протекающую реакцию. Оптимальное соотношение для данного фермента можно легко определить простым проведением эксперимента. Исходные соединения формулы (V), в которой Р представляет собой тpeтбутилоксикарбонил, можно получить из соответствующего незащищенного рацемического лактама формулы (II) способами, аналогичными описанным в Taylor et al., Tet Asymmetry, 4,p.1117 (1993). Соединения формулы (V), в которой Р представляет собой формил или низший алканоил, можно получить из соответствующего незащищенного рацемического лактама формулы (II) способами, описанными в T.W.McOmie, "Protective Groups in Organic Chemistry", Plenam Press, New York, 1973, pp. 43-93,или аналогичными способами. Соединение формулы (IV) можно легко превратить путем гидролиза в соответствующуюNзащищенную аминокислоту можно легко превратить в соответствующий аминоспирт формулы (VI) с помощью реагентов, способных превращать карбоновые кислоты в спирты, например алюмогидрида лития или борана. В качестве альтернативы соединение формулы (IV) можно непосредственно превратить, путем раскрытия кольца, в соответствующий аминоспирт формулы (VI), используя борогидрид натрия, таким способом, который описан в Tet. Asymm, 4, р. 1117 (1993). Нижеследующие примеры приведены только с целью иллюстрации и не предназначены для того, чтобы каким-либо образом ограничить объем данного изобретения. Пример 1. Тестировали несколько гидролитических ферментов на способность энантиоселективно гидролизовать лактамную связь рацемического-трет-бутилового эфира 3-оксо-2 азабицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты [(V), Р представляет собой третбутилоксикарбонил]. Реакции проводили при комнатной температуре в стеклянных флаконах с магнитными мешалками (рабочий объем 4 мл),содержащих 1 мг/мл рацемическое соединение в смеси 50% тетрагидрофурана: 50% фосфатного буфера (50 мМ, рН 7) (объем/объем) при комнатной температуре. Каждый фермент добавляли с получением конечной концентрации 25 мг/мл. Это соответствует соотношению фермента и субстрата, равному 25:1 (масса/масса), ко 5 торое в целях скрининга могло выявить любую возможную гидролитическую активность. Колбы без ферментов служили контролем. Периодически отбирали пробы и перед анализом с помощью ВЭЖХ разбавляли водой в соотношении 1:2. Условия ВЭЖХ: Колонка: Spherisorb С 6 (15 х 0,46 см). Изократические при комнатной температуре при 1 мл/мин. Подвижная фаза: 30% (объем/объем) ацетонитрил, содержащий 0,1% (объем/объем) муравьиную кислоту. Детекция при длине волны 200 нм. Было показано, что химический гидролиз-трет-бутилового эфира 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты при этих условиях реакции пренебрежимо мал. Оказалось, что несколько ферментов энантиоселективно гидролизуют рацемическое соединение с получением (-)-(1R,4S)-трет-бутилового эфира 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты, как свидетельствует отрицательный знак вращения в хирализаторе (ВЭЖХдетекторе вращения плоскости поляризации света). Для дальнейшего исследования была выбрана Савиназа. Реакционную смесь, содержащую приблизительно 50% исходного вещества, анализировали с помощью хиральной ВЭЖХ, и было показано, что остаточный лактам имеет энантиомерный избыток, составляющий 96,3%. Более того, остаточный субстрат имел правильную абсолютную конфигурацию для синтеза абакавира. Хиральная ВЭЖХ: Колонка: Chiralcel OD-H (25 х 0,46 см). Изократическая при 5 С при 0,5 мл/мин. Подвижная фаза: 2% (объем/объем) изопропиловый спирт/гептан. Детекция при длине волны 205 нм. Сравнительный пример 1. Раствор, содержащий рацемический лактам -2-азабицикло[2.2.1]гепт-5-ен-3-он (II) при 1 мг/мл (рабочий объем 4 мл), обрабатывали Савиназой (которую можно получить отNOVO) (25 мг/мл) в смеси 50% тетрагидрофурана:50% фосфатного буфера (50 мМ, рН 7). Колба без фермента служила контролем. Периодически отбирали пробы и перед анализом с помощью ВЭЖХ разбавляли водой в соотношении 1:2. ВЭЖХ: Колонка: Spherisorb C6 (15 х 0,46 см). Изократическая при комнатной температуре при 1 мл/мин. Подвижная фаза: 4% (объем/объем) ацетонитрил, содержащий 0,1% (объем/объем) муравьиную кислоту. Детекция при длине волны 200 нм. После 4 дней инкубации при комнатной температуре реакции не было.-трет-бутилового эфира 3-оксо-2 азабицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты [(V), Р представляет собой трет-бутилоксикарбонил] в смеси тетрагидрофуран/50 мМ фосфат с рН 8,0 в соотношении 50:50 (объем/объем) при 30 С. Реакцию контролировали с помощью хиральной ВЭЖХ в течение промежутка времени до 2 дней. По завершении реакции (приблизительно 51% конверсия, энантиомерный избыток (-)(1R,4S)-трет-бутилового эфира 3-оксо-2 азабицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты составляет более 99,8%) фермент отфильтровывали, и рН осветленного раствора повышали до 9 с помощью раствора бикарбоната натрия. Затем полученное экстрагировали 3 х 200 мл циклогексана. Объединенную органическую фазу подвергали реэкстрации раствором бикарбоната натрия (100 мл), после чего промывали 100 мл рассола. В результате выпаривания и сушки получили сыпучее белое твердое вещество (4,2 г; выход 84% от теоретического). Это вещество было идентифицировано как (-)-(1R,4S)-третбутиловый эфир 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты с помощью ЯМР; энантиомерный избыток по результатам хиральной ВЭЖХ составил более 99,8%. Хиральная ВЭЖХ: Колонка: Chiralcel OD-H (25 х 0,46 см). Изократическая, 0,5 мл/мин. Подвижная фаза: 2% (объем/объем) изопропиловый спирт/гептан. Детекция при длине волны 205 нм. Температура: 5 С. Пример 3. Раствор вышеуказанного (-)-(1R,4S)-третбутилового эфира 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты (3,5 г) в тетрагидрофуране (10 мл) добавляли к суспензии борогидрида натрия (1,27 г) в метаноле (10 мл) и эту смесь перемешивали при температуре приблизительно 20 С в течение приблизительно 18 ч. Добавляли дополнительное количество тетрагидрофурана (10 мл) и борогидрида натрия(1,27 г) и продолжали перемешивание приблизительно в течение дополнительных 2 ч. Осторожно добавляли 2 М соляную кислоту (30 мл) и затем толуол (20 мл). Разделяли два слоя и дополнительно экстрагировали водный слой толуолом (2 х 25 мл). Объединенные органические экстракты промывали рассолом (20 мл), сушили над сульфатом натрия и выпаривали с получением трет-бутилового эфира(1R,4S)-(4 гидроксиметил)-циклопент-2-ен-1-ил-карбаминовой кислоты (3,23 г), с энантиомерным избытком, составляющим по результатам хиральной ВЭЖХ 99,2%, в виде бледно-желтой смолы, 7 которая спектроскопически и хроматографически была идентична аутентичной пробе. Хиральная ВЭЖХ: Колонка: Chiralcel OD-H (25 х 0,46 см). Элюция: 1,0 мл/мин. Подвижная фаза: 3% (объем/объем) изопропиловый спирт/гептан. Детекция при длине волны 205 нм. Температура: 35 С. Пример 4. Савиназу тестировали на способность энантиоселективно гидролизовать лактамную связь рацемического цис-2-ацетил-2-азабицикло[2.2.1]гепт-5-ен-3-она. Реакцию проводили в стеклянном флаконе (рабочий объем 4 мл) с магнитной мешалкой, содержащем 1 мг/мл субстрат в смеси (объем/объем) 50% тетрагидрофурана/50% фосфатного буфера (50 мМ, рН 7) при комнатной температуре. Реакцию начинали добавлением Савиназы до конечной концентрации 25 мг/мл. Колба без фермента служила контролем. Периодически отбирали пробы и перед анализами с помощью ВЭЖХ разбавляли водой в соотношении 1:2. ВЭЖХ: Колонка: Spherisorb C6 (15 х 0,46 см). Изократическая при 20 С при 1 мл/мин. Подвижная фаза: 5% (объем/объем) ацетонитрил, содержащий 0,1% (объем/объем) муравьиную кислоту. Детекция при длине волны 210 нм. Хиральная ВЭЖХ: Колонка: Chiralpak AD (25 х 0,46 см). Изократическая при 20 С при 1 мл/мин. Подвижная фаза: 2% (объем/объем) этанол/гептан. Детекция при длине волны 215 нм. Было показано, что при отсутствии фермента химический гидролиз субстрата в условиях реакции был пренебрежимо мал. Однако значительный неферментативный гидролиз субстрата происходил, если из реакционных смесей исключали тетрагидрофуран. Савиназа энантиоселективно гидролизовала рацемический цис-2 ацетил-2-азабицикло[2.2.1]гепт-5-ен-3-он с получением (-)-(1R,4S)-2-ацетил-2-азабицикло[2.2.1]гепт 5-ен-3-она, как свидетельствует отрицательный знак вращения в хирализаторе и анализ с помощью хиральной ВЭЖХ. Реакционную смесь,содержащую приблизительно 50% исходного вещества, анализировали с помощью хиральной ВЭЖХ через два дня, и сравнением с аутентичной пробой было показано, что остаточный лактам имеет энантиомерный избыток, составляющий более 99,8%, и правильную абсолютную конфигурацию для синтеза абакавира. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения, по существу, энантиомерно чистого N-защищенного (1R,4S)-2 азабицикло[2.2.1]гепт-5-ен-3-она формулы (IV) где Р представляет собой активирующую и защитную группу, при котором рацемическую смесь N-защищенного -2-азабицикло[2.2.1]гепт 5-ен-3-она (V) где Р представляет собой активирующую и защитную группу, обрабатывают ферментом ацилазой и выделяют непрореагировавший энантиомер формулы (IV) из реакционной смеси общепринятыми методами. 2. Способ энантиомерного разделения рацемической смеси N-защищенного -2 азабицикло[2.2.1]гепт-5-ен-3-она (V) где Р представляет собой активирующую и защитную группу, для получения, по существу,энантиомерно чистого N-защищенного (1R,4S)2-азабицикло[2.2.1]гепт-5-ен-3-она (IV), при котором обрабатывают эту смесь ферментом ацилазой. 3. Способ по п.1 или 2, где Р представляет собой ацильную или замещенную оксикарбонильную группу. 4. Способ по любому из пп.1-3, где Р представляет собой формильную или алканоильную группу, имеющую от 1 до 4 атомов углерода. 5. Способ по любому из пп.1-3, где Р представляет собой алкилоксикарбонильную или аралкилоксикарбонильную группу. 6. Способ по п.5, где Р представляет собой трет-бутилоксикарбонильную или бензилоксикарбонильную группу. 7. Способ по любому из пп.1-6, где фермент ацилазу получают из Bacillus sp. 8. Способ по п.7, где фермент ацилаза представляет собой Савиназу (Savinase). 9. Способ по любому из пп.1-8, где реакцию проводят в смеси органического растворителя и воды. 10. Способ по п.9, где органический растворитель представляет собой смешивающийся с водой органический растворитель и используют менее 70% воды по объему. 11. Способ по п.10, где смешивающийся с водой органический растворитель представляет собой тетрагидрофуран или 1,4-диоксан. 12. Способ по любому из пп.1-11, где реакцию проводят в диапазоне рН от 6 до 11 и при температуре от 20 до 50 С. 13. Способ по п.12, где реакцию проводят при рН приблизительно 8 и температуре приблизительно 30 С. 14. Способ по любому из пп.1-13, где непрореагировавший N-защищенный (1R,4S)-2 10 азабицикло[2.2.1]гепт-5-ен-3-он формулы (IV) выделяют экстракцией растворителем.
МПК / Метки
МПК: C12P 41/00, C07D 209/52
Метки: обогащенных, n-производных, получения, способ, энантиомерно, лактамов
Код ссылки
<a href="https://eas.patents.su/6-1964-sposob-polucheniya-enantiomerno-obogashhennyh-n-proizvodnyh-laktamov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения энантиомерно обогащенных n-производных лактамов</a>
Предыдущий патент: Атропизомеры 3-арил-4(3н)-хиназолинонов и их использование в качестве антагонистов амра-рецепторов
Следующий патент: Электропроводящий керамический материал
Случайный патент: Когезионный однофазный биоразлагаемый гидрогель, способ его получения и применение










