Антагонисты рецепторов эндотелина
Формула / Реферат
1. Соединение общей формулы I
в которой Z представляет собой радикал

в котором R1 и R3 являются водородом,
R4 является хлором или н.алкоксигруппой,
R5 является группой -О-СН2-Аr, в которой Аr является фенилом, замещенным одним или двумя заместителями, выбранными из СООН, хлора, или Аr является пиридилом, замещенным СООН, R15 является низшим алкилом;
Р представляет СООН;
R2 представляет группу
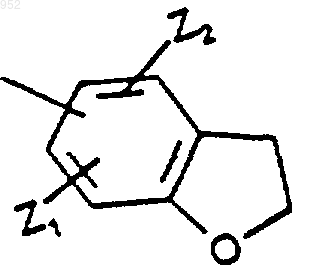
в которой Z1 и Z2 является независимо н.алкокси группой или водородом;
Ra является водородом
или его фармацевтически приемлемые соли.
2. Соединение по п.1, выбранное из группы, включающей (Е)-3-[1-н-бутил-5-[2-(2-карбокси-6-хлорфенил)метокси-4-хлорфенил]-1Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6-ил)метил]проп-2-еновую кислоту;
(Е)-3-[1-н-бутил-5-[2-(2-карбоксифенил)метокси-4-хлорфенил]-1Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6-ил) метил]проп-2-еноат;
(Е)-3-[1-н-бутил-5-[2-(2-карбоксифенил)метокси-4-метокси-фенил]-1Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6-ил)метил]проп-2-еновую кислоту;
(Е)-3-[1-н-бутил-5-[2-(2-карбокси-6-хлорфенил)метокси-4-метоксифенил]-1Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидро-бензофуран-6-ил)метил]проп-2-еновую кислоту;
(Е)-3-[1-н-бутил-5-[2-(2-карбокси-5-хлорфенил)метокси-4-метоксифенил]-1Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6-ил)метил]проп-2-еновую кислоту;
(Е)-3-[1-н-бутил-5-[2-(3-карбокси-2-пиридил)метокси-4-метоксифенил]-1Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6-ил)метил]проп-2-еновую кислоту; и
(Е)-3-[1-н-бутил-5-[2-(2-карбокси-5-хлорфенил)метокси-4-хлор-фенил]-1Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6-ил)метил]проп-2-еновую кислоту.
3. Соединение по п.1, которое представляет (Е)-3-[1-н-бутил-5-[2-(2-карбоксифенил)метокси-4-хлорфенил]-1Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6-ил)метил]проп-2-еновую кислоту.
4. Соединение формулы (II)
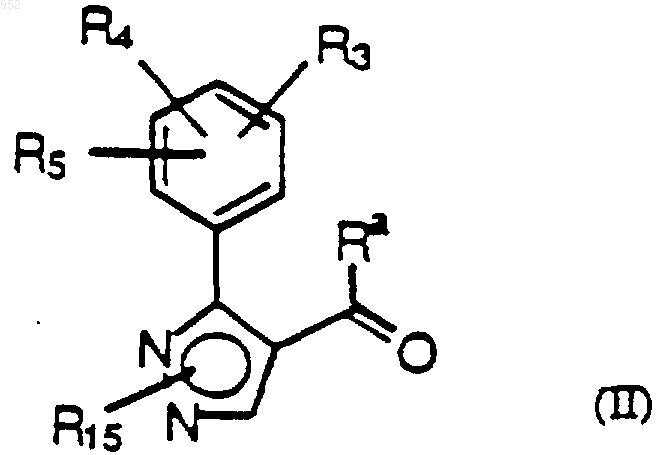
где Ra, R3, R4, R5 и R15 такие как описаны в п.1 для формулы (I).
5. Фармацевтическая композиция, содержащая соединение по п.1 в эффективном количестве и фармацевтически приемлемый носитель.
6. Соединение по п.1 для использования в качестве антагониста рецепторов эндотелина.
7. Способ лечения болезней, вызванных избытком эндотелина, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества антагониста рецепторов эндотелина по п.1.
8. Способ по п.7 для лечения гипертензии, почечной недостаточности или цереброваскулярной болезни, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
9. Способ по п.7 для лечения хронической почечной недостаточности, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
10. Способ по п.7 для лечения доброкачественной гипертрофии простаты, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
11. Способ по п.7 для лечения застойной сердечной недостаточности, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
12. Способ по п.7 для лечения нестабильной стенокардии, коронарного вазоспазма и повреждения миокарда, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
13. Способ по п.7 для профилактики или лечения рестеноза, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
14. Способ по п.7 для лечения легочной гипертензии, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
15. Способ по п.7 для лечения атеросклероза, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
16. Способ по п.7 для профилактики и лечения осложнений диабета, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
17. Способ по п.7 для лечения удара или субарахноидного кровоизлияния, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
18. Способ получения соединения формулы (Id)
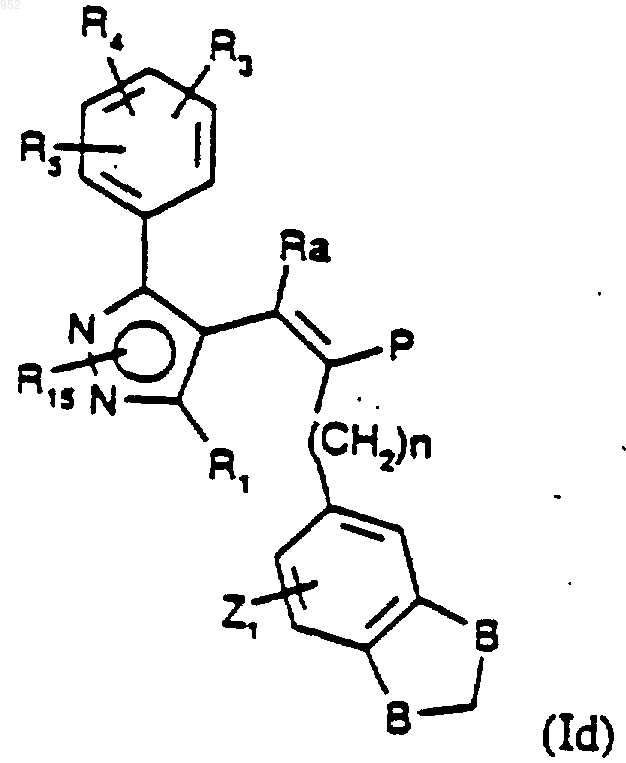
где один В представляет СН2 и другой представляет О, a Z1, Ra, P, R1, R3-R5, R15, n определены в п.1 путем
(а) взаимодействия соединения формулы (II)
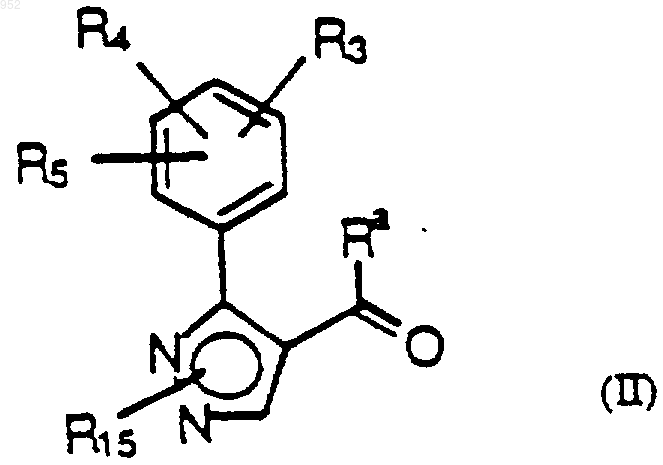
или его защищенной формы или предшественника с соединением формулы (8)
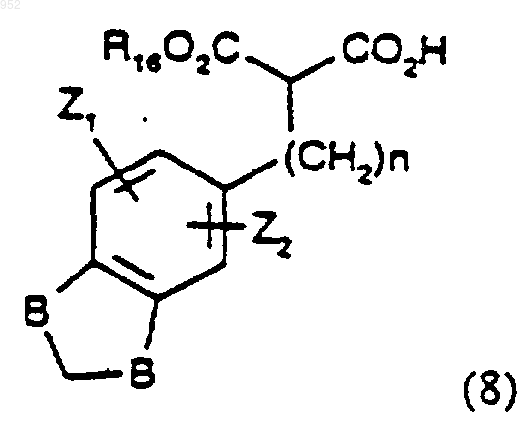
где один В представляет СН2 и другой представляет О и R2 и R16 такие как определены в п.1 для формулы (Id);
с последующим, если необходимо или желательно, б) превращением одного соединения формулы (Id) в другое соединение формулы (Id) способом, хорошо известным в данной области; и/или (в) образованием соли.
Текст
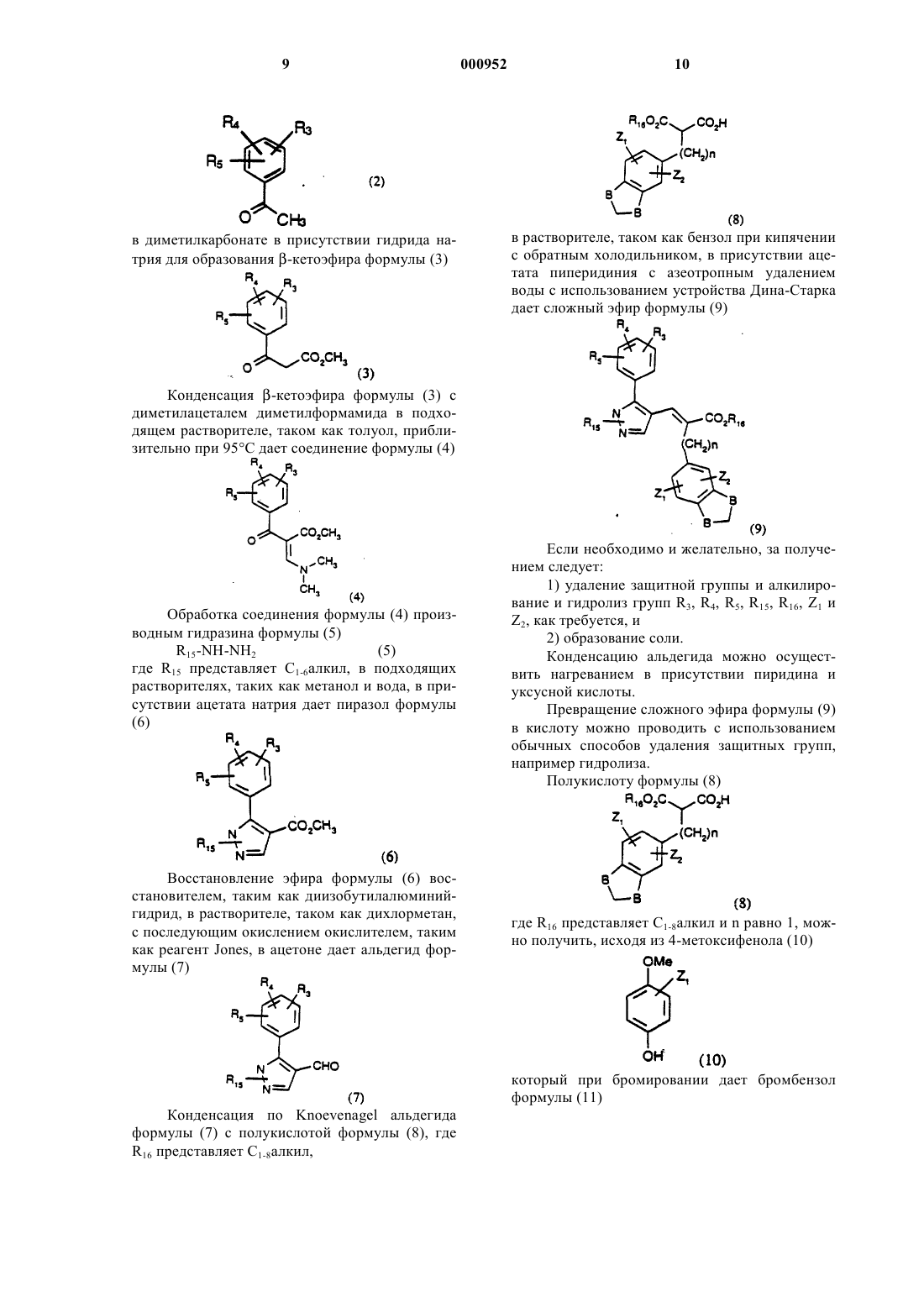
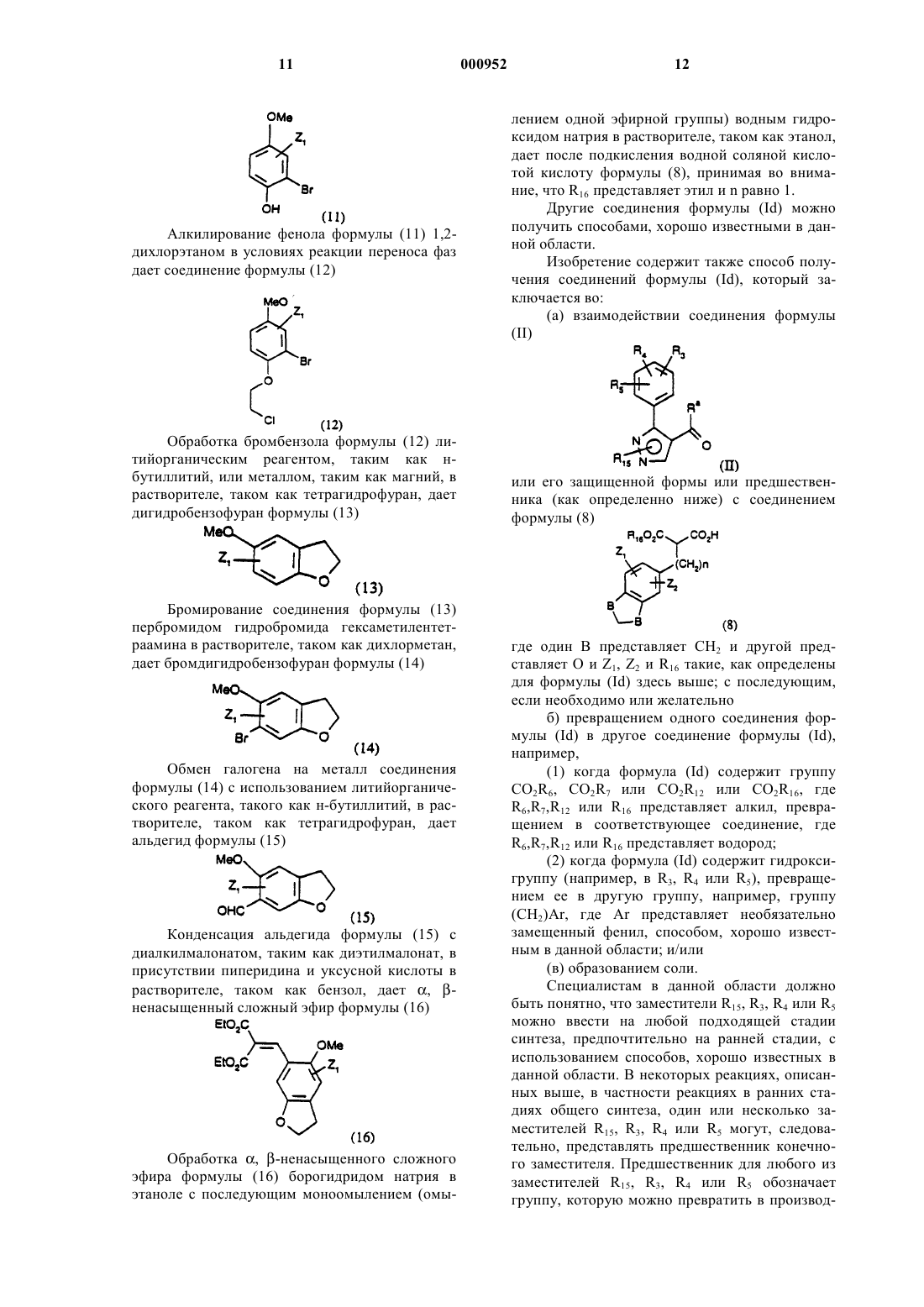
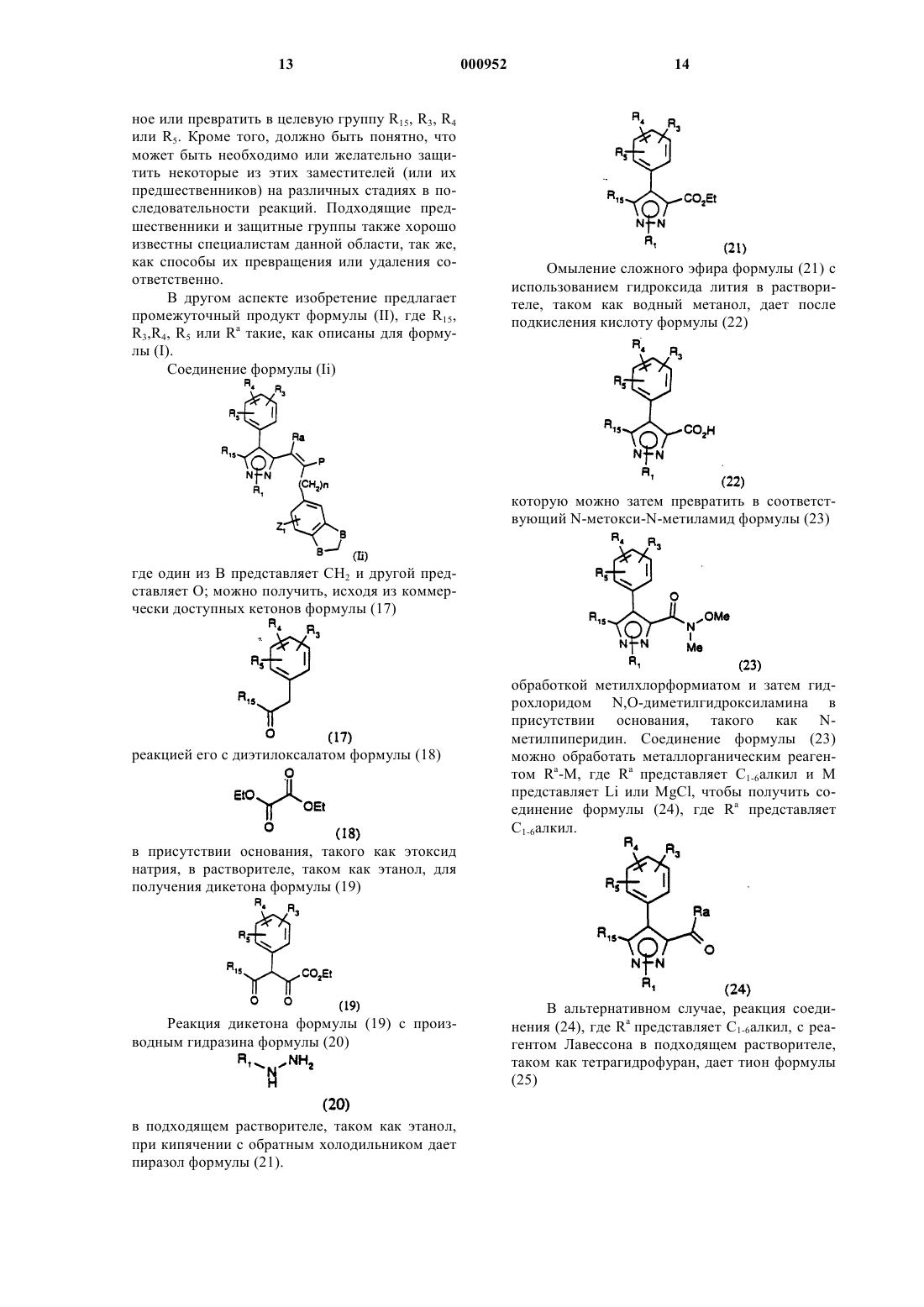
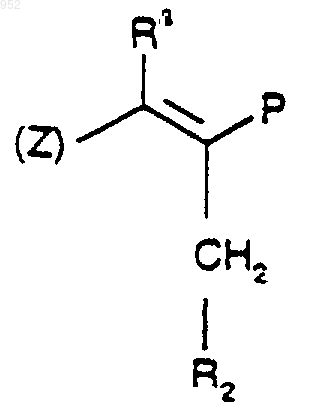
1 Настоящее изобретение относится к новым пирролам, пиразолам и триазолам, фармацевтическим композициям, содержащим эти соединения, и их применению в качестве антагонистов рецепторов эндотелина. Эндотелин (ЕТ) является очень сильным сосудосуживающим пептидом, синтезируемым и выделяемым васкулярным эндотелием. Эндотелин существует в виде трех изоформ ЕТ-1,ЕТ-2 и ЕТ-3. [Если не оговорено особо, термин"эндотелин" будет обозначать любую изоформу или все изоформы эндотелина]. Эндотелин обладает глубоким действием на сердечнососудистую систему и, в частности, на венечное,почечное и мозговое кровообращение. Повышенное или патологическое выделение эндотелина связано с сокращением гладких мышц,которое вовлекается в патогенез сердечнососудистой, цереброваскулярной, респираторной и почечной патофизиологии. Повышенные уровни эндотелина описаны в плазме пациентов с существенной гипертензией, острым инфарктом миокарда, субарахноидальным кровоизлиянием, атеросклерозом и пациентов с уремией,подвергаемых диализу.In vivo эндотелин обладает резко выраженным действием на кровяное давление и минутный сердечный выброс. Внутривенная болюсная инъекция ЕТ (от 0,1 до 3 нмоль/кг) у крыс вызывает временную, связанную с дозой депрессорную реакцию (продолжительность от 0,5 до 2 мин), за которой следует устойчивое,зависимое от дозы повышение артериального кровяного давления, которое может оставаться повышенным в течение от 2 до 3 ч после дозированного введения. Дозы выше 3 нмоль/кг,введенные крысам, часто оказываются смертельными. По-видимому,эндотелин производит предпочтительное действие в почечном сосудистом ложе. Он вызывает заметное длительное понижение в почечном кровотоке, сопровождаемое значительным понижением в GFR(уровне клубочковой фильтрации), объеме мочи, мочевой экскреции, натрия и калия. Эндотелин оказывает длительное антинатриуретическое действие, несмотря на существенное повышение содержания предсердного натриуретического пептида. Эндотелин стимулирует также активность ренина плазмы. Эти открытия дают возможность предположить, что ЕТ вовлекается в регуляцию почечной функции и вовлекается в ряд почечных нарушений, включая острую почечную недостаточность, циклоспориновую нефротоксичность, почечную недостаточность,индуцированную радиактивным контрастным средством, и хроническую почечную недостаточность. Исследования показали, что in vivo церебральная сосудистая сеть очень восприимчива как к сосудорасширяющему, так и сосудосуживающему действию эндотелина. Следовательно, 000952 2 ЕТ может быть важным медиатором церебрального вазоспазма, обычного и частого смертельного следствия субарахноидального кровоизлияния. ЕТ оказывает также непосредственное действие на центральную нервную систему, такое как тяжелое апноэ и ишемические повреждения, которое наводит на мысль, что ЕТ может содействовать развитию церебральных инфарктов и нейронной гибели. ЕТ вовлекается также в ишемию миокардаPharm., 165: 301-304, 1989 and Luscher, Circ., 83; 701, 1991), сердечную недостаточность, пролиферацию клеток сосудов гладких мышц (Takagi,Biochem and Biophys.Res.Coromun.; 168: 537543, 1990, Bobek et al., Am.J. Physiol., 258: 408C415, 1990) и атеросклероз (Nakaki et al., Biochem. And Biophys. Re s.Comiaun., 158: 880-881,1989, and Lerman et al., New Eng.J. of Med., 325: 997-1001, 1991). Повышенные уровни эндотелина были найдены после коронарной пластической операции на сосудах с применением катетер-баллона (Kadel et al., No 2491 Circ., 82: 627,1990). Кроме того, было обнаружено, что эндотелин является сильнодействующим сжимающим средством изолированной ткани дыхательных путей млекопитающего, включая бронхи человека.(Uchida et al., Eur.J. of Pharm., 154: 227-228,1988, LaGente, Clin.Exp.Allergy 20: 343-348,1990; and Springall et al., Lancet, 337: 697701,1991). Эндотелин может играть роль в патогенезе интерстициального легочного фиброза и ассоциированной легочной гипертензии, Glardet al., Supra, p. 112. Эндотелин связан с вызыванием геморрагического и некротического повреждения в слизистой оболочке желудка (Whittle et al., Br.J.Pharm, 95: 1011-1013, 1988); феноменом Raynaud, Cinniniello et al., 337: 114-115, 1991); болезнью Крона и неспецифическим язвенным колитом Munch et al., Lancet, Vol. 339, р. 381; мигренью (Edmeads, Headache, Feb. 1991, p. 127); сепсисом (Weitzberg et al., Circ. Shock 33: 222-227, 1991; Pittet et al., Ann. Surg, 213:262264, 1991), вызываемой циклоспорином, почечной недостаточностью или гипертензией (Eur.J.Pharmacol., 180:191-192, 1990, Kidney Jnt., 37: 1487-1491, 1990) и эндотоксичным шоком и вызываемыми эндотоксинами заболеваниями (Biochem.Biophys.Res.Commun., 161: 1220-1227,1989, Acta Physiol. Scand., 137: 317-318, 1989), и воспалительными кожными болезнями (Clin.Res., 41: 451 and 484, 1993). Эндотелин вовлекается также в преэклампсию беременности, Clark et al., Am.J. Obstet.Gynecol., Feb. 1992, p. 624-628; сахарный диабет, Takahashi et al., Diabetologia (1990) 33: 306310; и острое сосудистое отторжение после трансплантации почек, Watschinger et al., Transplantation Vol. 52, No 4 pp. 743-746. Эндотелин стимулирует как резорбцию,так и анаболизм костей и может играть соединительную роль в костной коррекции. Tatrai etal., Endocrinology, Vol. 131, р. 603-607. Описано, что эндотелин стимулирует перенос спермы в маточной полости, Casey et al.,J.Clin. Endo and Metabolism.Vol. 74, No 1, p. 223225, следовательно, антагонисты эндотелина могут быть полезными в качестве мужских контрацептивов. Эндотелин модулирует яичниковый/менструальный цикл, Kenegsberyg J. of Clin.Endo and Met., Vol. 74, No 1, p. 12, и может также играть роль в регуляции сосудистого тонуса полового члена мужчины, Lau et al., Asia PacificAmer. Physio. Soc., 1991, H1078-H1085. Эндотелин также медиирует потенциальное сокращение гладкой мышцы простаты человека, Langenstroer et al., J. Urology, Vol. 149, p. 495-499. Таким образом, антагонисты рецепторов эндотелина могут представлять необычный подход к фармакотерапии гипертензии, острой и хронической почечной недостаточности, индуцированной ишемией почечной недостаточности, почечной недостаточности, индуцированной сепсисом эндотоксином, профилактике и/или лечению почечной недостаточности, индуцированной радиоактивными контрастными средствами, острой и хронической индуцированной циклоспорином почечной недостаточности, цереброваскулярного спазма, субарахноидного кровоизлияния, ишемии миокарда, стенокардии, застойной сердечной недостаточности,острого коронарного синдрома, повреждения миокарда, нестабильной стенокардии, астмы,первичной легочной гипертензии, легочной гипертензии, вторичной к присущей легочной болезни, атеросклероза, феномена Raynaud, язв,сепсиса, мигрени, глаукомы, эндотоксического шока, индуцированной эндотоксином недостаточности нескольких органов или диссеминированного внутрисосудистого свертывания, индуцированной циклоспорином почечной недостаточности и как вспомогательного средства в пластических операциях на сосудах для предотвращения рестеноза, для лечения диабета, диабетической ретинопатии, ретинопатии, диабетической нефропатии, диабетической макроваксулярной болезни, атеросклероза, преэклампсии беременности, для костной коррекции трансплантации почек, в качестве мужских контрацептивов, для лечения бесплодия и приаризма и доброкачественной гипертрофии простаты. 4 Данное изобретение включает соединения,представленные формулой (I) и фармацевтические композиции, содержащие эти соединения,и их применению в качестве антагонистов рецепторов эндотелина, которые полезны для профилактики или лечения ряда сердечнососудистых и почечных болезней, включая, но не ограничиваясь ими, гипертензию, острую и хроническую почечную недостаточность, индуцированную циклоспорином нефротоксичность,доброкачественную гипертрофию простаты,легочную гипертензию, мигрень, удар, субарахноидное кровоизлияние, цереброваскулярный вазоспазм, ишемию миокарда, стенокардию,застойную сердечную недостаточность, нестабильную стенокардию, коронарный вазоспазм и повреждение миокарда, осложнения диабета,включая, но не ограничиваясь ими, атеросклероз, диабетическую нефропатию, диабетическую ретинопатию, ретинопатию, диабетическую макроваскулярную болезнь, и в качестве вспомогательного средства при пластической операции на сосудах для профилактики растеноза. Данное изобретение далее включает способ противодействия рецепторам эндотелина в животном, включая людей, который заключается в введении животному, нуждающемуся в этом, эффективного количества соединения формулы (I). Данное изобретение включает также промежуточные продукты, представленные формулой (II). В следующем аспекте настоящее изобретение предлагает способ получения соединения формулы (Id). Соединения данного изобретения представлены соединениями со структурной формулой (I)Ra независимо представляет водород илиR3 и R5 независимо представляют R13OH,С 1-8 алкокси, S(O)qR11, N(R6)2, NO2, Br, F, I, Cl,NHCOR6,R13CO2R7,-X-R9-Y,CF3,-Х(С(R6)2)ОR6, -(CH2)mX'R8 или -Х(СН 2)nR8, где каждая метиленовая группа в -X(CH2)nR8 может быть незамещена или замещена одной или двумя группами -(СН 2)nАr;NHCOR6, где С 1-5 алкокси может быть незамещен или замещен ОН, метокси или галогеном;R6 независимо представляет водород или С 1-8 алкил;R7 независимо представляет водород,C1-10 алкил, С 2-10 алкенил или С 2-8 алкинил, все из которых могут быть незамещены или замещены одной или несколькими группами, выбранными из группы, включающей ОН, N(R6)2, CO2R12,галоген и XC1-10 алкил; или R7 представляетR8 независимо представляет R11, CO2R7,CO2C(R11)2O(CO)XR7, РО 3(R7)2, SO2NR7R11,NR7SO2R11, CONR7SO2R11, SО 3R7, SO2R7,P(O)(OR7)R7,CN,CO2(CH2)mC(O)N(R6)2,С(R11)2N(R7)2, С(O)N(R6)2, NR7C(O)NR7SO2R11,OR6 или тетразол, который незамещен или замещен C1-6 алкилом;R9 независимо представляет связь, C1-10 алкилен, C1-10 алкенилен, C1-10 алкилиден, C1-10 алкинилен, все из которых могут быть неразветвленными или разветвленными, или фенилен, все из которых могут быть незамещены или замещены одной или несколькими группами,выбранными из группы, включающей ОН,N(R6)2, COOH и галоген;R11 независимо представляет водород, Аr,C1-8 алкил, С 2-8 алкенил, С 2-8 алкинил, все из которых могут быть незамещены или замещены одним или несколькими группами, выбранными из группы, включающей ОН, СН 2OН, N(R6)2 или галогена;R13 независимо представляет двухвалентный Аr, C1-10 алкилен, C1-10 алкилиден, С 2-10 алкенилен, все из которых незамещены или замещены одной или несколькими группами, выбран 000952R16 независимо представляет C1-6 алкил или фенил, замещенный одной или несколькими группами, выбранными из группы, включающейY независимо представляет СН 3 или Х(СН 2)nАr; нафтил, индолил, пиридил, тиенил, оксазолидинил, тиазолил, изотиазолил, пиразолил, триазолил, тетразолил, имидазолил, имидазолидинил,тиазолидинил, изоксазолил, оксадиазолил, тиадиазолил, морфонилил, пиперидинил, пиперазинил, пирролил или пиримидил, все из которых незамещены или замещены одной или несколькими группами Z1 или Z2; А независимо представляет С=O илиNRaSO2R16, O(CH2)mNRaC(O)NRaSO2R16, тетразолил, который может быть незамещен или замещен C1-6 алкилом, СF3 или С(O)R6;O-O(CH2)nAr или O-OR6; или их фармацевтически приемлемыми солями. Все группы алкилы, алкенилы, алкинилы и алкокси могут быть неразветвленными или разветвленными. Галогеном может быть Br, Cl, F или I. Соединения настоящего изобретения могут содержать один или несколько асимметричных атомов углерода и могут существовать в рацемической и оптически активной форме. Все эти соединения и их диастереоизомеры рассматриваются, как находящиеся в пределах объема настоящего изобретения. Предпочтительны соединения, у которых Р представляет CO2R6; более предпочтительно Р представляет СО 2 Н;R3 и R5 независимо представляют водород,CO2R6, ОН, C1-8 алкокси, С 1-8 алкил, N(R6)2, NO2,Br, F, Cl, I, R13CO2R7, Х(СН 2)nR8, (CH2)mX'R8 или Х(С(R6)2)mOR6. В контексте группы R3 и R5 предпочтительно не представляют водород. В частности, в группе R3 предпочтительно представляет Br, Cl,C1-8 алкокси, например, метокси; Х(СН 2)nR8, где Х предпочтительно представляет О, n равно 0, 1 или 2 и R8 предпочтительно выбирают из группы, включающей:C1-8 алкил, например, метил, R11 предпочтительно представляет С 1-8 алкил (например, метил,изопропил или трет-бутил) или фенил, необязательно замещенный Br, Cl, F, С 1-8 алкилом, например, метилом; или R8 представляет фенил или пиридил,замещенный одной или несколькими группами из Br, Cl, СO2 Н, СН 2 ОН; и R5 представляет С 1-8 алкокси, например,метокси, или N(R6)2, где R6 предпочтительно представляет Н или метил;R4 представляет водород, ОН, С 1-5 алкокси,N(R6)2, Br, F, Cl, I, NНСОСН 3 или S(О)qC1-5 алкил, где С 1-5 алкил может быть не замещен или замещен ОН, метокси или галогеном;R4 более предпочтительно представляет водород;R6 представляет водород или С 1-8 алкил,например, метил или этил;R7 представляет водород, C1-10 алкил, С 2-10 алкенил или С 2-8 алкинил, все из которых могут быть незамещены или замещены одной или несколькими группами, выбранными из группы,включающей ОН, N(R6)2, CO2R12, галогены, илиR7 представляет (СН 2)nАr. Когда R7 представляет (СН 2)nАr, n предпочтительно равно нулю или 1 и Аr предпочтительно представляет фенил,незамещенный или замещенный галогеном или С 1-5 алкокси.R11 представляет водород, фенил, пиридил,где фенил и пиридил могут быть не замещены или замещены одной или двумя С 1-4 алкильными группами; C1-8 алкил, С 2-8 алкенил, С 2-8 алкинил,все из которых могут быть незамещены или замещены одной или несколькими группами, выбранными из группы, включающей ОН, СН 2 ОН,N(R6)2 и галоген;R12 представляет водород или C1-6 алкил.R13 представляет фенил, пиридил или С 2-10 алкилен, все из которых могут быть неза 000952 8 мещены или замещены одной или несколькими группами, выбранными из группы, включающейR15 предпочтительно представляет водород или C1-6 алкил, например, этил, изопропил нбутил, циклопропилметил или циклопропилэтил.(Е)-3-[1-н-бутил-5-[2-(2-карбокси-5-хлорфенил)метокси-4-хлорфенил]-1 Н-пиразол-4-ил]2-[(5-метокси-2,3-дигидробензофуран-6-ил)метил]проп-2-еновая кислота. Настоящее изобретение предлагает соединения формулы (I), которые можно получить способами сходными со способами приведенными ниже. Соединения формулы (Id) где один В представляет СН 2 и другой представляет O, можно получить алкилированием кетона формулы (2) в диметилкарбонате в присутствии гидрида натрия для образования -кетоэфира формулы (3) в растворителе, таком как бензол при кипячении с обратным холодильником, в присутствии ацетата пиперидиния с азеотропным удалением воды с использованием устройства Дина-Старка дает сложный эфир формулы (9) Конденсация -кетоэфира формулы (3) с диметилацеталем диметилформамида в подходящем растворителе, таком как толуол, приблизительно при 95 С дает соединение формулы (4) Обработка соединения формулы (4) производным гидразина формулы (5)(5) где R15 представляет C1-6 алкил, в подходящих растворителях, таких как метанол и вода, в присутствии ацетата натрия дает пиразол формулы Восстановление эфира формулы (6) восстановителем, таким как диизобутилалюминийгидрид, в растворителе, таком как дихлорметан,с последующим окислением окислителем, таким как реагент Jones, в ацетоне дает альдегид формулы (7) Если необходимо и желательно, за получением следует: 1) удаление защитной группы и алкилирование и гидролиз групп R3, R4, R5, R15, R16, Z1 иZ2, как требуется, и 2) образование соли. Конденсацию альдегида можно осуществить нагреванием в присутствии пиридина и уксусной кислоты. Превращение сложного эфира формулы (9) в кислоту можно проводить с использованием обычных способов удаления защитных групп,например гидролиза. Полукислоту формулы (8) который при бромировании дает бромбензол формулы (11) Конденсация по Knoevenagel альдегида формулы (7) с полукислотой формулы (8), где Алкилирование фенола формулы (11) 1,2 дихлорэтаном в условиях реакции переноса фаз дает соединение формулы (12) Обработка бромбензола формулы (12) литийорганическим реагентом, таким как нбутиллитий, или металлом, таким как магний, в растворителе, таком как тетрагидрофуран, дает дигидробензофуран формулы (13) Бромирование соединения формулы (13) пербромидом гидробромида гексаметилентетраамина в растворителе, таком как дихлорметан,дает бромдигидробензофуран формулы (14) Обмен галогена на металл соединения формулы (14) с использованием литийорганического реагента, такого как н-бутиллитий, в растворителе, таком как тетрагидрофуран, дает альдегид формулы (15) Конденсация альдегида формулы (15) с диалкилмалонатом, таким как диэтилмалонат, в присутствии пиперидина и уксусной кислоты в растворителе, таком как бензол, дает , ненасыщенный сложный эфир формулы (16) Обработка , -ненасыщенного сложного эфира формулы (16) борогидридом натрия в этаноле с последующим моноомылением (омы 000952 12 лением одной эфирной группы) водным гидроксидом натрия в растворителе, таком как этанол,дает после подкисления водной соляной кислотой кислоту формулы (8), принимая во внимание, что R16 представляет этил и n равно 1. Другие соединения формулы (Id) можно получить способами, хорошо известными в данной области. Изобретение содержит также способ получения соединений формулы (Id), который заключается во: или его защищенной формы или предшественника (как определенно ниже) с соединением формулы (8) где один В представляет СН 2 и другой представляет О и Z1, Z2 и R16 такие, как определены для формулы (Id) здесь выше; с последующим,если необходимо или желательно б) превращением одного соединения формулы (Id) в другое соединение формулы (Id),например,(1) когда формула (Id) содержит группу(СН 2)Аr, где Аr представляет необязательно замещенный фенил, способом, хорошо известным в данной области; и/или(в) образованием соли. Специалистам в данной области должно быть понятно, что заместители R15, R3, R4 или R5 можно ввести на любой подходящей стадии синтеза, предпочтительно на ранней стадии, с использованием способов, хорошо известных в данной области. В некоторых реакциях, описанных выше, в частности реакциях в ранних стадиях общего синтеза, один или несколько заместителей R15, R3, R4 или R5 могут, следовательно, представлять предшественник конечного заместителя. Предшественник для любого из заместителей R15, R3, R4 или R5 обозначает группу, которую можно превратить в производ 13 ное или превратить в целевую группу R15, R3, R4 или R5. Кроме того, должно быть понятно, что может быть необходимо или желательно защитить некоторые из этих заместителей (или их предшественников) на различных стадиях в последовательности реакций. Подходящие предшественники и защитные группы также хорошо известны специалистам данной области, так же,как способы их превращения или удаления соответственно. В другом аспекте изобретение предлагает промежуточный продукт формулы (II), где R15,R3,R4, R5 или Ra такие, как описаны для формулы (I). Соединение формулы (Ii) Омыление сложного эфира формулы (21) с использованием гидроксида лития в растворителе, таком как водный метанол, дает после подкисления кислоту формулы (22) которую можно затем превратить в соответствующий N-метокси-N-метиламид формулы (23) где один из В представляет СН 2 и другой представляет О; можно получить, исходя из коммерчески доступных кетонов формулы (17) обработкой метилхлорформиатом и затем гидрохлоридом N,O-диметилгидроксиламина в присутствии основания, такого как Nметилпиперидин. Соединение формулы (23) можно обработать металлорганическим реагентом Ra-M, где Ra представляет C1-6 алкил и М представляет Li или МgСl, чтобы получить соединение формулы (24), где Ra представляет С 1-6 алкил. в присутствии основания, такого как этоксид натрия, в растворителе, таком как этанол, для получения дикетона формулы (19) Реакция дикетона формулы (19) с производным гидразина формулы (20) в подходящем растворителе, таком как этанол,при кипячении с обратным холодильником дает пиразол формулы (21). который можно обработать диазоэфиром (26) в кипящем с обратным холодильником тетрагидрофуране для получения тиирана формулы Обработка тиирана формулы (27) триметилфосфитом при кипячении в растворителе,таком как хлороформ, дает соединения формулы (28), где Ra представляет C1-6 алкил. исходя из сложного арилового эфира формулы(29), где R16 представляет C1-6 алкил, для получения пиррола формулы (30). Соединение формулы (30) можно последовательно превратить в соединения формулы (Iе), следуя той же самой последовательности стадий, как описано выше для превращений соединения (6) и соединения(21) в соединения (Id) и соединение (Ii) соответственно. Соединения формулы (Ih) можно получить, исходя из бороновой кислоты формулы реакцией ее с триазолом формулы (32), где Х представляет Сl или Br, в стандартных условиях сочетания Suzuki для получения сложного эфира формулы (33) Омыление сложного эфира формулы (28) с использованием гидроксида лития в растворе,таком как водный метанол, дает после подкисления уксусной кислотой кислоту формулы (Ii),где Р представляет СО 2 Н. Соединения формулы (Iе) Соединение формулы (31) можно получить реакцией соответствующего металлорганического производного (например, лития или Гриньяра) с триалкилборатом с последующим гидролизом. Соединение формулы (32) можно получить, исходя из диметилмалоната реакцией его с п-ацетаминобензолсульфонилазидом в растворителе, таком как ацетонитрил, в присутствии основания, такого как триэтиламин, для получения диметилдиазомалоната(34). Обработка диазомалоната формулы (34) амином формулы (35)(35) с последующей кислотной обработкой дает триазол формулы (36) Реакция соединения формулы (36) с РХ 5,где Х представляет Вr или Сl, в присутствии карбоната калия в диметилформамиде дает соединение формулы (32). Соединение формулы (Ij) можно получить,исходя из анилина формулы (37) в подходящем растворителе, таком как этиловый спирт, при кипячении с обратным холодильником для получения пиррола формулы Дикетон формулы (38) можно получить реакцией ,-ненасыщенного кетона формулы с силиловым простым эфиром енола формулы в присутствии кислоты Льюиса, такой как хлорид цинка, в подходящем растворителе, таком как дихлорметан, с последующим кислотным гидролизом. Соединения формулы (33) и соединения формулы (39) можно последовательно превра 000952 18 тить в соединения формулы (Ih) и соединения формулы (Ij), соответственно, следуя той же последовательности стадий, как последовательность, описанная выше, для превращений соединения (6), соединения (21) и соединения (30) в соединения (Id), соединение (Ii) и соединение(Iе) соответственно. Для использования соединения формулы(I) или его фармацевтически приемлемой соли для лечения людей и других млекопитающих его обычно изготавливают в соответствии с обычной фармацевтической практикой в виде фармацевтической композиции. Соединения формулы (I) и их фармацевтически приемлемые соли можно вводить стандартным способом для лечения указанных болезней, например, перорально, парентерально,сублингвально, чрескожно, ректально, путем ингаляции или путем трансбуккального введения. Соединения формулы (I) и их фармацевтически приемлемые соли, которые активны, когда их дают перорально, можно изготовить в виде сиропов, таблеток, капсул и лепешек. Готовая препаративная форма в виде сиропа обычно будет состоять из суспензии или раствора соединения или соли в жидком носителе,например этаноле, арахисовом масле, оливковом масле, глицерине или воде с корригентом или красящим средством. Когда композиция находится в форме таблетки, можно использовать любой фармацевтический носитель, обычно используемый для получения твердых готовых препаративных форм. Примеры таких носителей включают стеарат магния, сульфат кальция, тальк, желатин, агар, пектин, аравийскую камедь, стеариновую кислоту, крахмал, лактозу и сахарозу. Когда композиция находится в форме капсулы, пригодно любое обычное капсулирование, например, с использованием вышеуказанных носителей, в стенках капсулы из твердого желатина. Когда композиция находится в форме капсулы со стенками из мягкого желатина, можно рассматривать любой фармацевтический носитель, обычно используемый для получения дисперсий или суспензий, например водные камеди, целлюлозы, силикаты или масла, их вводят в стенки капсул из мягкого желатина. Типичные парентеральные композиции состоят из раствора или суспензии соединения или соли в стерильном водном или неводном носителе, необязательно содержащем парентерально приемлемое масло, например, полиэтиленгликоль, поливинилпиролидон, лецитин, арахисовое масло или кунжутное масло. Типичные композиции для ингаляции находятся в форме раствора, суспезии или эмульсии, которые можно вводить в виде сухого порошка или в форме аэрозоля с использованием обычного пропелланта, такого как дихлордифторметан или трихлорфторметан. 19 Типичная готовая препаративная форма в виде суппозитория содержит соединение формулы (I) или его фармацевтически приемлемую соль, которая активна при введении этим путем,со связующим и/или смазывающим агентом,например, полимерными гликолями, желатинами, какао-масло или другими низкоплавкими растительными восками или жирами или их синтетическими аналогами. Типичные чрескожные готовые препаративные формы содержат общепринятый водный или неводный наполнитель и имеют форму, например, крема, мази, лосьона или пасты, или находятся в форме содержащего лекарственное средство пластыря, повязки или пленки. Предпочтительна композиция в унифицированной лекарственной форме, например таблетки, капсулы, или измеренной аэрозольной дозе так, чтобы пациент мог ввести себе разовую дозу. Каждая унифицированная доза для перорального введения содержит подходящее количество от 0,1 мг до 500 мг/кг, предпочтительно от 1 мг до 100 мг/кг, и каждая унифицированная доза для парентерального введения содержит подходящее количество от 0,1 до 100 мг соединения формулы (I) или его фармацевтически приемлемой соли, вычисленное для этого соединения как свободной кислоты. Каждая унифицированная доза для интраназального введения содержит подходящие 1-400 мг, предпочтительно от 10 до 200 мг на человека. Местная готовая препаративная форма содержит подходящее количество от 0,01 до 1,0% соединения формулы (I). Подходящая схема приема суточной дозы для перорального введения составляет от около 0,01 до 40 мг/кг соединения формулы (I) или его фармацевтически приемлемой соли, вычисленной как свободная кислота. Подходящая схема приема суточной дозы для парентерального введения составляет от около 0,001 до 40 мг/кг соединения формулы (I) или его фармацевтически приемлемой соли, вычисленной как свободная кислота. Подходящая схема приема суточной дозы для интраназального введения и пероральной ингаляции составляет от около 10 до 500 мг/человека. Активный ингредиент можно вводить от 1 до 6 раз в день, что достаточно для проявления желаемой активности. Никакие неприемлемые токсикологические эффекты не ожидаются, когда соединения по изобретению вводят в соответствии с настоящим изобретением. Биологическую активность соединения формулы (I) демонстрируют следующими испытаниями: 1. Анализ связывания А) Получение мембран клеток СНО (яичник китайского хомячка) Клетки СНО, стабильно трансфецированные ЕТА- и ЕТB-рецепторами человека, выращи 000952 20 вали в планшетах размером 245245 мм с культурой ткани в модифицированной по способу Дульбекко среде Игла, дополненной 10% фетальной телячьей сывороткой. Сливающиеся клетки промывали забуференным фосфатом Дульбекко, физиологическим раствором, содержащим коктейль ингибитора протеазы (5 мМEDTA (этилендиаминтетрауксусная кислота),0,5 мМ PMSF (фенилметилсульфонилфторид), 5 мкг/мл лейпептина и 0,1 Е/мл апротинина) и соскабливали в тот же буфер. После цетрифугирования при 800 xg, клетки лизировали замораживанием в жидком азоте и оттаиванием на льду с последующей гомогенизацией (30 раз с использованием стеклянного гомогенизатора) в буфере для лизиса, содержащем 20 мМ Трис НСl, рН 7,5, и коктейль ингибитора протеазы. После первоначального центрифугирования при 800 хд в течение 10 мин для удаления неразрушенных клеток и ядер супернатанты центрифугировали при 40000 xg в течение 15 мин и осадок снова суспендировали в 50 мМ Трис НСl,рН 7,5, и 10 мМ МgСl2 и хранили в небольших аликвотах при -70 С после замораживания в жидком N2. Белок определяли, используя способ ВСА и DSA (альбумин бычьей сыворотки) в качестве стандарта. Б) Изучение связывания Связывание [125I]ЕТ-1 с мембранами, полученными из клеток СНО, проводили по способу Elshoubagy et al. (1993). Анализ начинали в объме 100 мкл добавлением 25 мкл [125I]ET-1(неспецифическое связывание) 100 нМ немеченного ЕТ-1. Концентрация мембранных белков были 0,5 и 0,05 мкг на аналитическую пробирку для ЕТA- и ЕТB-рецепторов, соответственно. Инкубацию (30 С, 60 мин) останавливали разбавлением холодным буфером (20 мМ Трис НСl, рН 7,6, и 10 мМ MgCl2) и фильтрованием через фильтры GF/C Whatman (Clifton, NJ),предварительно пропитанными в 0,1% BSA. Фильтры промывали 3 раза (по 5 мл каждый раз) тем же самым буфером с использованием сборщика клеток Brandel и подсчет проводили с использованием счетчика гамма излучения при эффективности 75%. Следующие примеры иллюстративные и не ограничивают соединения по этому изобретению. Пример 1.(5,40 мл, 104,84 ммоль) при 0 С. Реакционной смеси дают нагреться до комнатной температуры. После перемешивания в течение 2 ч реакци 21 онную смесь гасят водой и экстрагируют этилацетатом (3200 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4). Удаление растворителя при пониженном давлении дает 21,28 г сырого указанного в заголовке соединения в виде темного масла: 1H ЯМР (250 МГц, СDСl3)7,49 (шир.,1 Н), 6,96 (д, 1 Н), 6,72-6,62 (м, 2 Н), 3,71 (с, 3 Н). б) 2-Бром-1-(2-хлорэтокси)-4-метоксибензол К раствору 2-бром-4-метоксифенола (20,00 г, 98,04 ммоль) в 1,2-дихлорэтане (50,00 мл, 0,63 моль) добавляют гидроксид натрия (12,00 г, 0,29 моль) и хлорид бензилтриэтиламмония (3,00 г) в воде (150 мл). Смесь перемешивают при кипячении с обратным холодильником в течение 24 ч и экстрагируют этилацетатом (3150 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4). После удаления растворителя при пониженном давлении флэш-хроматография (смесь диэтиловый эфир/гексан, 1:1) остатка дает 14,20 г (66% после двух стадий) указанного в заголовке соединения в виде желтого масла: 1(с, 3 Н). в) 5-Метокси-2,3-дигидробензофуран К раствору 2-бром-1-(2-хлорэтокси)-4 метоксибензола (1,38 г, 5,22 ммоль) в ТГФ добавляют 190 мг (7,82 ммоль) Мg и Меl (3 мл). Смесь обрабатывают ультразвуком в течение 2 ч и перемешивают при комнатной температуре в течение дополнительных 20 ч. Реакционную смесь гасят 3 н НСl (50 мл) и экстрагируют смесью 1:1 гексан/этилацетат (350 мл). Объединенные органические экстракты промывают насыщенным соленым раствором Na НСО 3 и сушат (Na2SO4). После удаления растворителя при пониженном давлении флэшхроматография (гексан/этилацетат, 3:1) остатка дает 0,66 г (85%) указанного в заголовке соединения в виде бесцветной жидкости: 1 Н ЯМР (400 МГц, СDСl3)6,80 (д, 1 Н),6,70 (д, 1 Н), 6,65 (дд, 1 Н), 4,53 (т, 2 Н), 3,75 (с,3 Н), 3,18 (т, 3 Н). г) 6-Бром-5-метокси-2,3-дигидробензофуран К раствору 5-метокси-2,3-дигидробензофурана (1,00 г, 6,66 ммоль) в дихлорметане (10 мл) добавляют пербромид гидробромида гексаметилентетраамина (2,79 г, 7,32 ммоль) при-78 С. Реакционной смеси дают нагреться до комнатной температуры. После перемешивания в течение 3 ч, реакционную смесь гасят водой и экстрагируют этилацетатом (350 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4). После удаления растворителя при пониженном давлении получают 1,45 г (96%) указанного в заго 000952 22 ловке соединения в виде темного твердого вещества: 1H ЯМР (250 МГц, СDСl3)7,00 (с, 1 Н),6,82 (с, 1 Н), 4,57 (т, 2 Н), 3,81 (с, 3 Н), 3,15 (т,2 Н). д) 5-Метокси-2,3-дигидробензофуран-6 аль К раствору 6-бром-5-метокси-2,3 дигидробензофурана (9,20 г, 40,35 ммоль) в ТГФ (50 мл) добавляют по каплям н-бутиллитий(5,00 мл, 60,53 ммоль) и смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь гасят водой и экстрагируют этилацетатом (3150 мл). Объединенные органические экстракты промывают и сушат(Na2SО 4) и растворитель удаляют при пониженном давлении. Флэш-хроматография(эфир/гексан, 1:1) остатка дает 5,42 г (76%) указанного в заголовке соединения в виде желтого твердого вещества: 1H ЯМР (250 МГц, СDСl3)10,32 (С, 1 Н),6,90 (с, 1 Н), 6,82 (с, 1 Н), 4,57 (т, 2 Н), 3,91 (С,3 Н), 3,25 (т, 2 Н). е) Диэтил-2-(5-метокси-2,3-дигидробензофуран-6-илиден)малонат К раствору 5-метокси-2,3-дигидробензофуран-6-аля (295 г, 1,66 ммоль) в бензоле добавляют диэтилмалонат (265 мг, 1,66 ммоль),уксусную кислоту (20 мл, 0,35 ммоль) и пиперидин (30 мл, 0,30 ммоль). Смесь нагревают при кипячении с обратным холодильником в течение 3 ч и затем выливают в 100 мл воды. Эту смесь экстрагируют тремя порциями по 50 мл этилацетата. Объединенные органические экстракты промывают солевым раствором и сушат(Na2SO4). Удаление растворителя при пониженном давлении дает количественный выход указанного в заголовке соединения в виде желтоватого масла: 1H ЯМР (400 МГц, СDСl3)8,02 (с, 1 Н),6,79 (с, 1 Н), 6,78 (с, 1 Н), 4,52 (т, 2 Н), 4,30 (м,4 Н), 3,80 (с, 3 Н), 3,18 (т, 2 Н), 1,28 (м, 6 Н). ж) Диэтил-2-(5-метокси-2,3-дигидробензофуранил)метилмалонат К раствору диэтил-2-(5-метокси-2,3 дигидробензофуран-6-илиден)малоната (1,80 г,5,62 ммоль) в этаноле (25 мл) добавляют боргидрид натрия (0,22 г, 5,66 ммоль) при комнатной температуре. После перемешивания в течение 2 ч реакционную смесь гасят водой и экстрагируют этилацетатом (350 мл) . Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4). После удаления растворителя при пониженном давлении флэш-хроматография (диэтиловый эфир/гексан,1:1) темного остатка дает 1,47 г (82%) указанного в заголовке соединения в виде желтого масла:H ЯМР (250 МГц, СDСl3)6,70 (с, 1 Н),6,54 (с, 1 Н), 4,44 (т, 2 Н), 4,12 (к, 2 Н), 3,74 (с,4 Н), 3,11 (м, 4 Н), 1,18 (т, 6 Н). з) Этил, водород-2-(5-метокси-2,3-дигидробензофуран-6-ил)метилмалонат К раствору диэтил-2-(5-метокси-2,3 дигидробензофуранил)метилмалоната (6,55 г,20,34 ммоль) в этаноле (50 мл) добавляют раствор гидроксида калия (1,35 г, 24,40 ммоль) в воде (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 5 ч. После концентрирования водный слой промывают эфиром и подкисляют концентрированной НСl до рН 1 и экстрагируют этилацетатом (3100 мл). Органические экстракты промывают солевым раствором и сушат (Na2SO4). Удаление растворителя при пониженном давлении дает 5,26 г(88%) указанного в заголовке соединения в виде белого твердого вещества: 1 Н ЯМР (250 МГц, СDСl3)11,43 (шир.,1 Н), 6,72 (с, 1 Н), 6,58 (с, 1 Н), 4,48 (т, 2 Н), 4,16(к, 2 Н), 3,82 (т, 1 Н), 3,75 (с, 3 Н), 3,14 (т, 3 Н),1,20 (т, 3 Н); MC(ESI) m/e 295,2 [М+Н]+; т.пл.: 114-116 С. и) 4-Хлор-2-гидроксиацетофенон В круглодонную колбу на 500 мл, продутую аргоном, помещают 26,00 г (0,153 моль) 3 ацетоксихлорбензола, охлаждают на ледяной бане. Затем порциями добавляют 30,00 г (0,225 моль) АlСl3. Получаемую смесь нагревают до 140 С в течение 2 ч (предостережение: происходит энергичное выделение газа) и затем охлаждают до 0 С, обрабатывают 15 мл концентрированной НСl в 100 мл ледяной воды, экстрагируют EtOAc (3300 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4), удаление растворителя дает 24,00 г (92%) указанного в заголовке соединения в виде светло-желтой жидкости: 1(22,00 г, 0,129 моль) в ДМФ (200 мл) добавляют К 2 СО 3 (72,00 г, 0,516 моль) и брометилметиловый эфир (0,134 моль). После перемешивания при 55 С в течение 1 ч смесь выливают в воду и экстрагируют TtOAc (3300 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4), удаление растворителя при пониженном давлении дает 25,00 г(0,257 моль). После перемешивания в течение 10 мин при комнатной температуре смесь нагревают до 70 С в течение 45 мин. Получаемой смеси дают охладиться до комнатной температуры и распределяют между водой и этилацетатом. Органический слой отделяют и промывают солевым раствором и сушат (Na2SO4). Удаление растворителя при пониженном давлении дает 29,00 г (92%) указанного в заголовке соединения в виде масла МС(ESI) m/z 273 (М+Н)+: 1H ЯМР (400 МГц, СDСl3)7,82 (д, J=8,4 Гц, 1 Н), 7,25 (д, J=1,8 Гц, 1 Н), 7,06 (дд, J=1,8,8,4 Гц, 1H), 5,25 (c, 2H), 3,97 (с, 2 Н), 3,72 (с,3 Н), 3,51 (с, 3 Н). м) Метил-(Z)-2-(4-хлор-2-метоксиметокси) бензоил-3-(диметиламино)пропеноат Смесь метил-2-(4-хлор-2-метоксиметокси)бензоилацетата (24,00 г, 0,107 моль) и диметилацеталя N,N-диметилформамида (25,51 г,0,214 моль) нагревают до 90 С в течение ночи. Концентрирование при пониженном давлении дает 34,86 г (100%) указанного в заголовке соединения в виде масла: MC(ESI) m/z 328(34,00 г, 0,104 моль) и н-бутилгидрозина (37,00 г, 0,208 моль) в 600 мл смеси МеОН/Н 2O (9:1) добавляют NaOAc (84,86 г, 0,624 моль). Получаемую смесь перемешивают при комнатной температуре в течение ночи и затем распределяют между водой и СН 2 Сl2. Органический слой отделяют и промывают солевым раствором и сушат (Na2SO4). Удаление растворителя при пониженном давлении дает 35,50 г (97%) указанного в заголовке соединения в виде масла:(м, 2 Н), 1,12 (м, 2 Н), 0,74 (т, 3 Н). о)1-н-Бутил-5-(4-хлор-2-метоксиметоксифенил)-4-гидроксиметилпиразол К раствору метил-1-н-бутил-5-(4-хлор-2 метоксиметоксифенил)-1 Н-пиразол-4-илкарбоксилата (10,00 г, 0,028 моль) в 200 мл CH2Cl2 при 0 С добавляют 85,2 мл 1,5 М Dibal-H в толуоле. После перемешивания в течение 1 ч реакционную смесь гасят МеОН (100 мл) и затем добавляют 35 мл концентр. НСl в 200 мл воды. Получаемую смесь перемешивают в течение 15 мин и экстрагируют СН 2 Сl2 (3200 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SО 4). Удаление растворителя при пониженном давлении дает(м, 2 Н), 0,81 (т, 3 Н). п) 1-н-Бутил-5-(4-хлор-2-метоксиметоксифенил)-1 Н-пиразол-4-илкарбоксальдегид К раствору 1-н-бутил-5-(4-хлор-2-метоксиметоксифенил)-4-гидроксиметилпиразола (10,00 г, 30,86 ммоль) в 150 мл ацетона при 0 С добавляют реагент Jones до сохранения розового цвета смеси (30 мл). Затем добавляют 60 мл изопропилового спирта и получаемую смесь перемешивают при комнатной температуре в течение 15 мин, разбавляют 300 мл холодной воды и экстрагируют CH2Cl2 (3200 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4). После удаления растворителя при пониженном давлении флэшхроматография остатка с использованием 25%m/z 323 (М+Н)+: 1 Н ЯМР (400 МГц, СDСl3)9,54(с, 1 Н),8,07 (с, 1 Н), 7,35 (д, 1 Н), 7,18 (м, 2 Н), 5,13 (с,2 Н), 3,90-4,05 (м, 2 Н), 3,38 (с, 3 Н), 1,75 (м, 2 Н),1,20 (м, 2 Н), 0,83 (т, 3 Н). р) Этил-(Е)-3-[1-н-бутил-5-(4-хлор-2 метоксиметоксифенил)-1 Н-пиразол-4-ил]-2-[(5 метокси-2,3-дигидробензофуран-6-ил)метил]-2 пропеноат К смеси 1-н-бутил-5-(4-хлор-2-метоксиметоксифенил)-1 Н-пиразол-4-илкарбоксальдегида (5,50 г, 17,08 ммоль) и этил, водород-2-(5 метокси-2,3-дигидробензофуран-6-ил)метилмалоната (7,28 г, 24,70 ммоль) в 50 мл бензола добавляют пиперидин (2,16 г, 25,41 ммоль) и АсОН (0,51 г, 8,50 ммоль) соответственно. После нагревания при кипячении с обратным холодильником в течение 3 ч смесь выливают в воду, экстрагируют EtOAC (3100 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4). После удаления растворителя при пониженном давлении флэш-хроматографии остатка с использованием 25% EtOAc в гексане дает 4,50 г (48%) указанного в заголовке соединения в виде масла: MC(ESI) m/z 555 (М+Н)+: 1EtOH (60 мл) добавляют 0,6 мл концетр. НСl. После нагревания при кипячении с обратным холодильником в течение 3 ч смесь концентрируют и затем разбавляют EtOAc. Получаемую смесь промывают 5% раствором NаНСО 3 солевым раствором и сушат (Na2SO4). После удаления растворителя при пониженном давлении колоночная хроматография остатка с использованием 25 % EtOAc в гексане дает 2,65 г (64%) указанного в заголовке соединения в виде твердого вещества: т.пл. 158-160 С, MC(ESI) m/z 511 (М+Н)+; 1(с, 3 Н), 3,16 (т, 2 Н), 1,67 (м, 2 Н), 1,20 (т, 3 Н),1,17(м, 2 Н), 0,80 (т, 3 Н). т) Метил-3-хлор-2-метилбензоат К раствору 3-хлор-2-метилбензойной кислоты (1,00 г, 5,86 ммоль) в метаноле (25 мл) добавляют 3 капли серной кислоты. Смесь перемешивают при кипячении с обратным холодильником в течение 18 ч. После концентрирования остаток растворяют в эфире, промывают 10% раствором гидроксида натрия, солевым раствором и сушат (Na2SO4). Удаление растворителя при пониженном давлении дает 0,95 г(88%) указанного в заголовке соединения в виде белого твердого вещества: 1 Н ЯМР (250 МГц, СDСl3)7,62 (д, 1 Н),7,41 (д, 1 Н), 7,05 (т, 1 Н), 3,82 (с, 3 Н), 2,55 (с,3 Н). у) 2-Хлор-6-метилкарбоксилатбензилбромид К раствору метил-3-хлор-2-метилбензоатаNBS(N-бромсукцинимид) (1,50 г, 8,45 ммоль) и бензоилпероксид (0,20 г, 0,83 ммоль). После перемешивания при кипячении с обратным холодильником в течение 18 ч смесь выливают в воду и получаемую смесь экстрагируют этилацетатом (350 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SO4). После удаления растворителя при пониженном давлении флэшхроматография (эфир/гексан, 1:1) остатка дает 1,87 г (82%) указанного в заголовке соединения в виде темного масла: 1 27 К раствору этил-(Е)-3-[1-н-бутил-5-(2 гидрокси-4-хлорфенил)-1 Н-пиразол-4-ил]-2-[(5 метокси-2,3-дигидробензофуран-6-ил)метил]-2 пропеноата (0,20 г, 0,39 ммоль) и метил-2 бромметил-3-хлорбензоата (0,13 г, 0,47 ммоль) в ДМФ (5 мл) добавляют гидрит натрия (0,02 г,0,59 ммоль) при 0 С. Смесь перемешивают при комнатной температуре в течение 4 ч. После водной обработки, экстракции этилацетатом(315 мл) объединенные органические экстракты промывают солевым раствором и сушат(Na2SO4). После удаления растворителя при пониженном давлении флэш-хроматография(этилацетат/гексан, 1:1) остатка дает указанного в заголовке соединения в виде масла (0,22 г,80%); 1 Н ЯМР (250 МГц, СDСl3)7,78 (д, 1 Н),7,55 (д, 1 Н), 7,48 (с, 1 Н), 7,32 (м, 2 Н), 7,12 (д,2 Н), 6,75 (С, 1 Н), 6,45 (с, 1 Н), 5,55 (дд, J=10,27,5 Гц, 2 Н), 4,49 (т, 2 Н), 4,10 (к, 2 Н), 3,83 (с,3 Н), 3,77 (т, 2 Н), 3,65 (с, 3 Н), 3,15 (т, 2 Н), 1,52(0,20 г, 0,29 ммоль) в метаноле (5 мл) добавляют раствор гидроксида натрия (0,04 г, 0,87 ммоль) в воде (2 мл). Смесь перемешивают при кипячении с обратным холодильником в течение 18 ч. Метанол удаляют при пониженном давлении и водный слой промывают эфиром. Водный слой затем подкисляют концентрированной НСl до рН 1 и экстрагируют этилацетатом (350 мл). Объединенные органические экстракты промывают солевым раствором и сушат (Na2SО 4). Удаление растворителя дает твердый продукт. Перекристаллизацией из метанола получают указанное в заголовке соединение в виде бледно-желтого продукта (0,17 г, 91%): 1 Н ЯМР (400 МГц, CDCl3)7,75 (д, 1 Н),7,80 (с, 1 Н), 7,48 (м, 2 Н), 7,33 (с, 1 Н), 7,25 (т,1 Н), 7,10 (с, 1 Н), 7,05 (м, 2 Н), 6,65 (с, 1H), 6,35 28 а) Этил-(E)-3-[1-н-бутил-5-(2-метоксикарбонил)фенилметокси-4-хлорфенил]-1 Н-пиразол 4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6 ил)метил]-2-пропеноат Следуя способу примера (1 ф), за исключением того,что метил-2-бромметил-3 хлорбензоат заменяют на метил-2 бромметилбензоат, указанное в заголовке соединение получают с выходом 85 %. б) Следуя способу примера (1 х), за исключением того, что этил-(E)-3-[1-н-бутил-5-(2 метоксикарбонил)-6-хлорфенилметокси-4 хлорфенил]-1 Н-пиразол-4-ил]-2-[(5-метокси-2,3 дигидробензофуран-6-ил)метил]-2-пропеноат заменяют на этил-(Е)-3-[1-н-бутил-5-[2-(2 метоксикарбонил)фенилметокси-4-хлорфенил]1 Н-пиразол-4-ил]-2-[(5-метокси-2,3-дигидробензофуран-6-ил)метил]-2-пропеноат, указанное в заголовке соединение получают с выходом 90% в виде белого твердого вещества:(Е)-3-[1-н-Бутил-5-[1-N-этил-5-тетразолил)метокси]-4-метоксифенил]-1 Н-пиразол-4 ил]-2-[(5-метокси-2,3-дигидробензофуран-6 ил)метил]-проп-2-еновая кислота Пример 18. Готовые препаративные формы для фармацевтического использования, включающие соединения по настоящему изобретению, можно получить в различных формах и с использова 000952 30 нием различных наполнителей. Примеры таких готовых преперативных форм приводятся ниже. Готовая препаративная форма для ингаляции Соединение формулы I (от 1 до 100 мг) распыляют из ингалятора с измеренной дозой для доставки желаемого количества лекарственного средства на каждое использование. Таблетки/ингредиенты 1. Активный ингредиент Способ получения таблеток Стадия 1: Ингредиенты 1, 2, 3 и 4 смешивают в подходящем миксере/смесителе. Стадия 2: К смеси стадии 1 порциями добавляют достаточное количество воды с осторожным перемешиванием после каждого добавления. Добавление воды и перемешивание проводят до тех пор, пока масса не достигнет консистенции, которая позволяет превратить ее во влажные гранулы. Стадия 3: Влажную массу превращают в гранулы пропусканием ее через вибрационный гранулятор, используя сито меш 8 (2,38 мм). Стадия 4: Влажные гранулы затем сушат в печи при 140F (60C) до достижения сухого состояния. Стадия 5: Сухие гранулы смазывают ингредиентом 5. Стадия 6: Смазанные гранулы прессуют на подходящем прессе для таблетирования. Парантеральная готовая препаративная форма Фармацевтическую композицию для парентерального введения получают растворением подходящего количества соединения формулы I в полиэтиленгликоле при нагревании. Этот раствор затем разбавляют водой для инъекций PhEur. (до 100 мл). Раствор затем стерилизуют фильтрованием через мембранный фильтр 0,22 микрон и запаивают в стерильных контейнерах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы I в котором R1 и R3 являются водородом,R4 является хлором или н.алкоксигруппой,R5 является группой -О-СН 2-Аr, в которой Аr является фенилом, замещенным одним или двумя заместителями, выбранными из СООН,хлора, или Аr является пиридилом, замещенным СООН, R15 является низшим алкилом; Р представляет СООН;Ra является водородом или его фармацевтически приемлемые соли. 2. Соединение по п.1, выбранное из группы,включающей где Ra, R3, R4, R5 и R15 такие, как описаны в п.1 для формулы (I). 5. Фармацевтическая композиция, содержащая соединение по п.1 в эффективном количестве и фармацевтически приемлемый носитель. 6. Соединение по п.1 для использования в качестве антагониста рецепторов эндотелина. 7. Способ лечения болезней, вызванных избытком эндотелина, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества антагониста рецепторов эндотелина по п.1. 8. Способ по п.7 для лечения гипертензии,почечной недостаточности или цереброваскулярной болезни, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 9. Способ по п.7 для лечения хронической почечной недостаточности, отличающийся тем,что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 10. Способ по п.7 для лечения доброкачественной гипертрофии простаты, отличающийся тем, что он заключается во введении субъекту,нуждающемуся в этом, эффективного количества соединения по п.1. 11. Способ по п.7 для лечения застойной сердечной недостаточности, отличающийся тем,что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 12. Способ по п.7 для лечения нестабильной стенокардии, коронарного вазоспазма и повреждения миокарда, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 13. Способ по п.7 для профилактики или лечения рестеноза, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 14. Способ по п.7 для лечения легочной гипертензии, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 15. Способ по п.7 для лечения атеросклероза, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 16. Способ по п.7 для профилактики и лечения осложнений диабета, отличающийся тем, 33 что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 17. Способ по п.7 для лечения удара или субарахноидного кровоизлияния, отличающийся тем, что он заключается во введении субъекту, нуждающемуся в этом, эффективного количества соединения по п.1. 18. Способ получения соединения формулы (Id) или его защищенной формы или предшественника с соединением формулы (8) где один В представляет СН 2 и другой представляет О и R2 и R16 такие, как определены в п.1 для формулы (Id); с последующим, если необходимо или желательно,б) превращением одного соединения формулы (Id) в другое соединение формулы (Id) способом, хорошо известным в данной области; и/или
МПК / Метки
МПК: A61K 31/415, C07D 405/02, A61P 9/02
Метки: эндотелина, антагонисты, рецепторов
Код ссылки
<a href="https://eas.patents.su/18-952-antagonisty-receptorov-endotelina.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты рецепторов эндотелина</a>
Предыдущий патент: Способ лечения боли висцерального происхождения.
Следующий патент: Способ непрерывного получения чистых эфиров 5-формилвалериановой кислоты.
Случайный патент: Способ и устройство для изготовления труб или иных длинномерных полых изделий