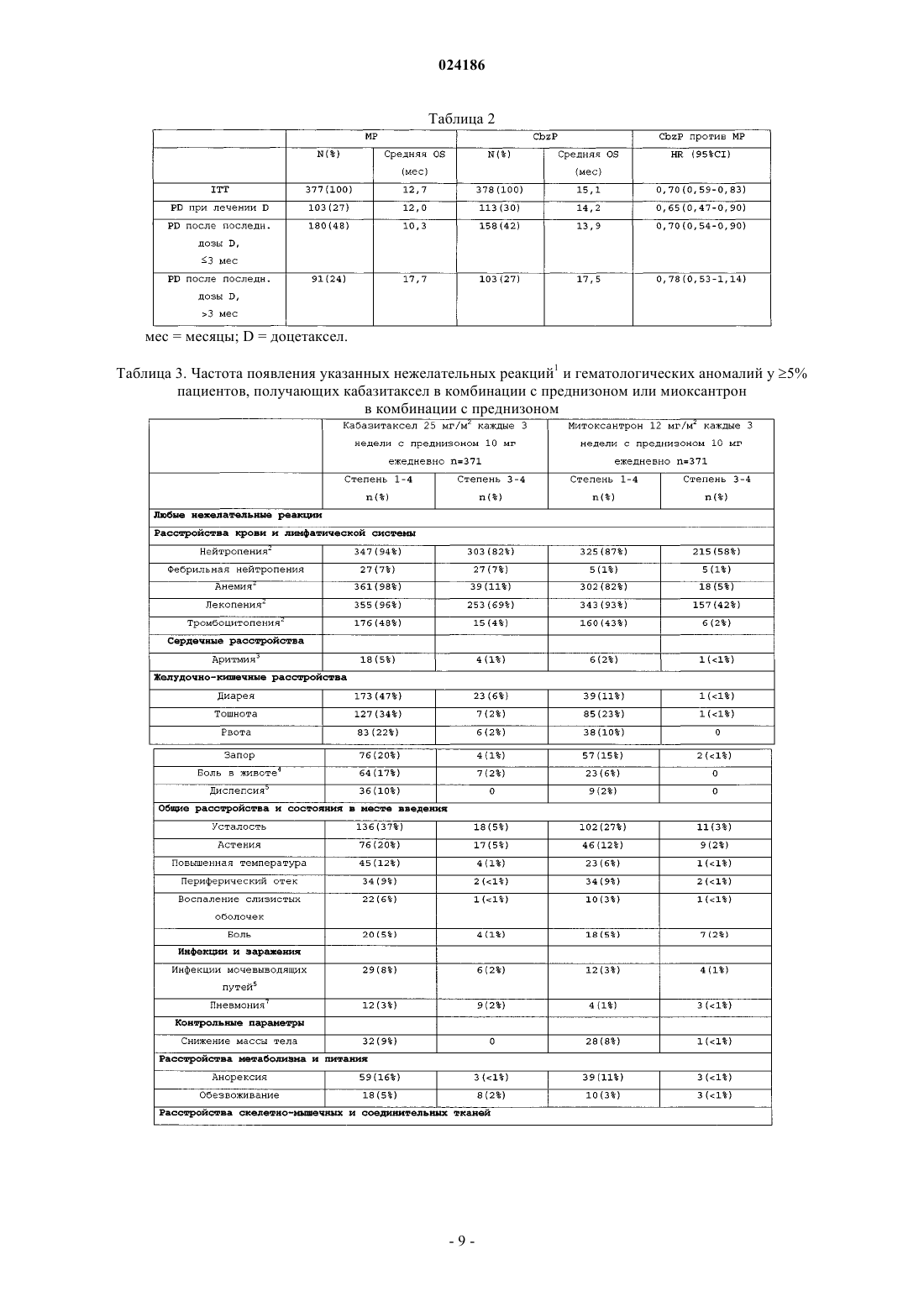
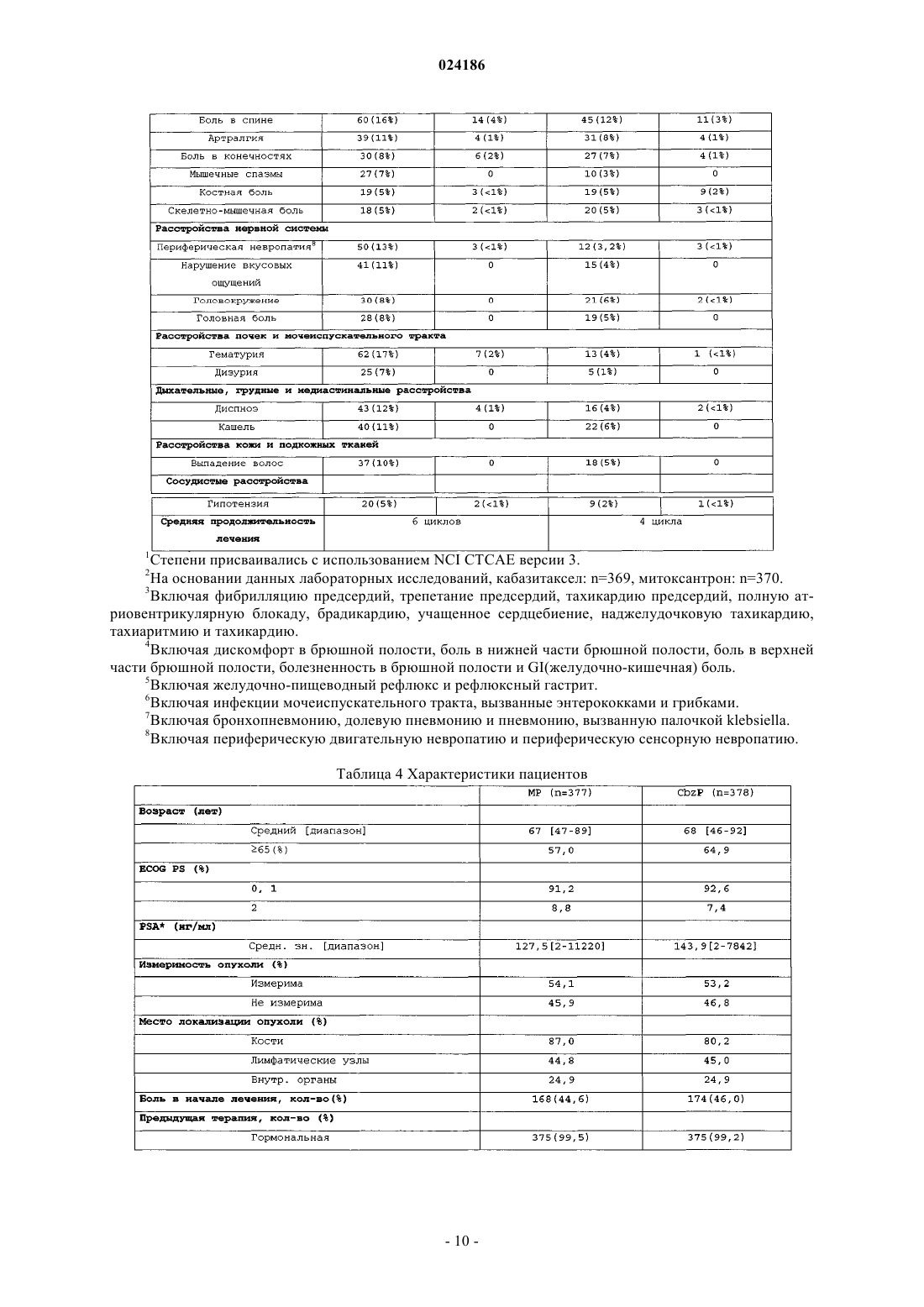
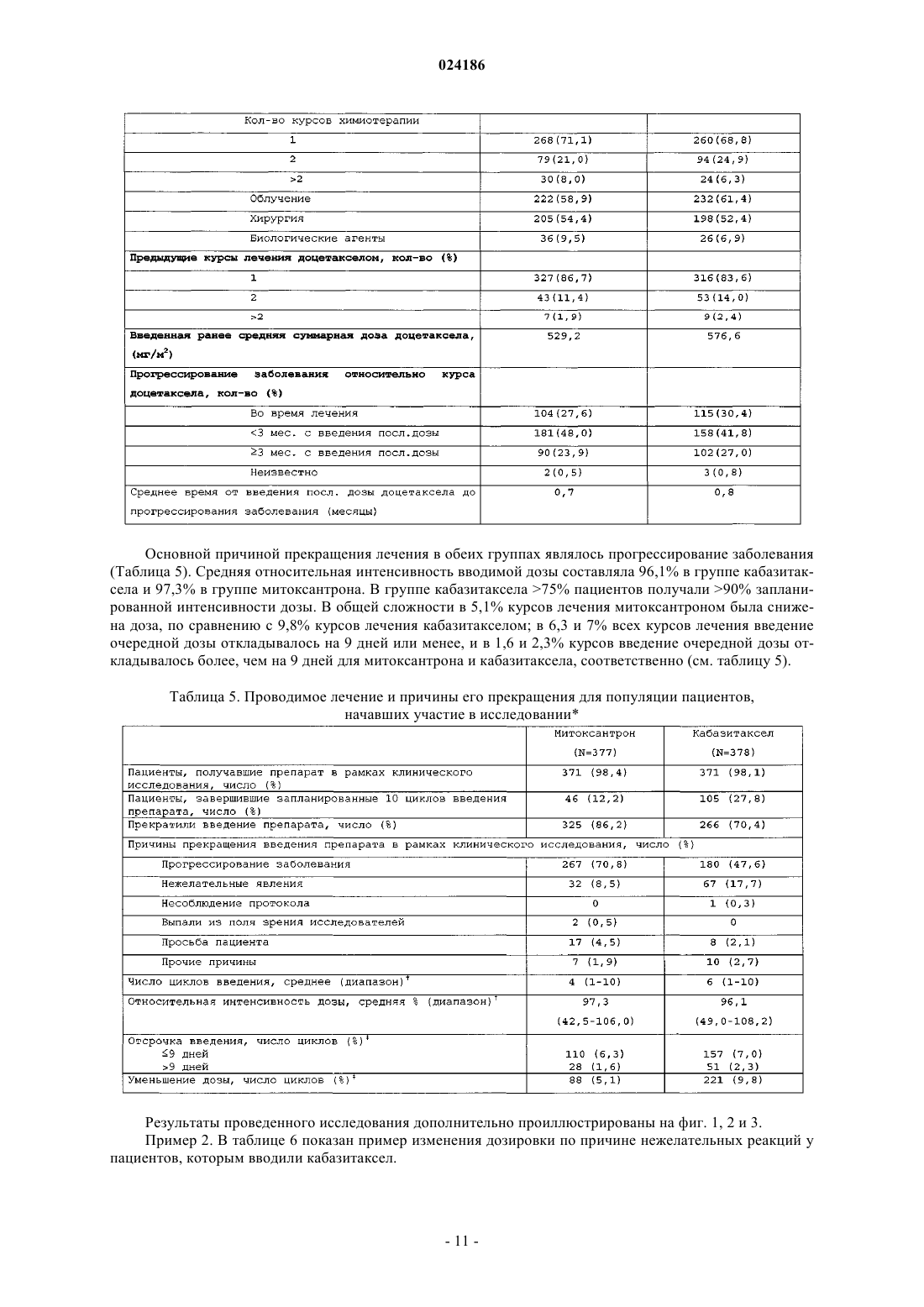
Применение кабазитаксела в комбинации с преднизоном или преднизолоном для лечения рака простаты
Формула / Реферат
1. Способ лечения пациентов с раком простаты, включающий введение соединения формулы
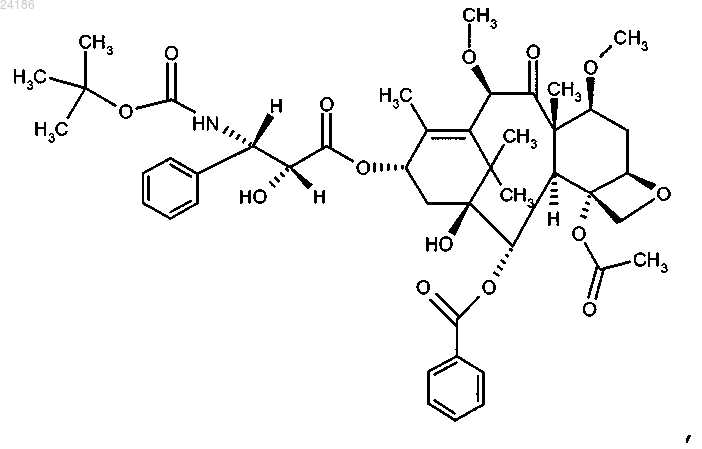
которое может иметь форму основания или форму гидрата или сольвата, в комбинации с преднизоном или преднизолоном указанному пациенту.
2. Способ по п.1, где у подвергаемых лечению пациентов не удалось добиться удовлетворительных результатов при лечении, основанном на применении таксанов.
3. Способ по пп.1 или 2, где подвергаемых лечению пациентов ранее лечили по схемам, основанным на применении доцетаксела.
4. Способ по любому из пп.1-3, где рак простаты является метастатическим заболеванием на поздней стадии.
5. Способ по п.3, где рак простаты представляет собой кастрационно-резистентный рак простаты или гормон-рефрактерный рак простаты.
6. Способ по любому из пп.1-5, в котором указанное соединение находится в форме сольвата с ацетоном.
7. Способ по п.6, где упомянутый сольват с ацетоном содержит от 5 до 8 мас.% ацетона.
8. Способ по п.7, где упомянутый сольват с ацетоном содержит от 5 до 7 мас.% ацетона.
9. Способ по любому из пп.1-8, в котором указанное соединение вводится в дозе от 15 до 25 мг/м2, причем преднизон или преднизолон вводят в дозе 10 мг/день.
10. Способ по п.9, в котором указанное соединение вводится в дозе 25 мг/м2.
11. Способ по любому из пп.1-10, который включает повторное введение указанного соединения в виде нового цикла каждые 3 недели.
12. Способ по п.11, где среднее число циклов равно 6.
13. Способ по любому из пп.1-12, в котором указанное соединение вводится в комбинации с преднизоном при его применении в качестве лекарственного средства для лечения пациентов с кастрационно-резистентным метастатическим раком простаты или гормон-рефрактерным раком простаты, которых ранее лечили по схемам, основанным на применении доцетаксела.
14. Способ по п.13, в котором указанное соединение представляет собой кабазитаксел.
15. Способ по любому из пп.1-14, где дополнительно осуществляется мониторинг анализов крови и измерение уровней нейтрофилов у пациента.
16. Способ по п.15, где указанный мониторинг включает отбор образцов крови у пациента.
17. Способ по п.16, где дополнительно прекращают введение кабазитаксела пациенту с количеством нейтрофилов ≤1500 клеток/мм3.
18. Применение соединения формулы
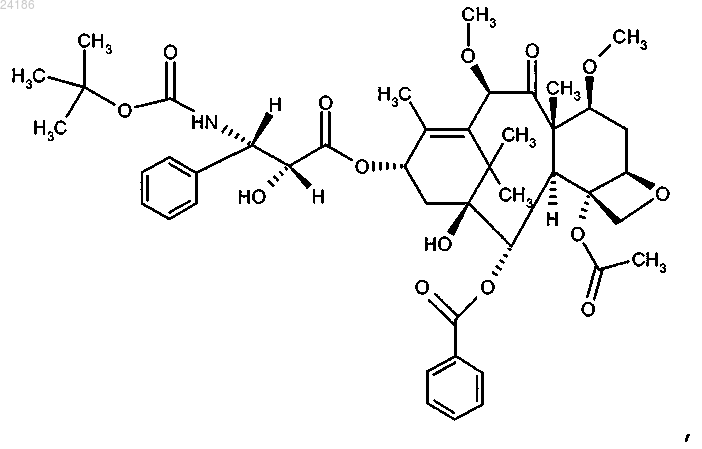
которое может иметь форму основания или форму гидрата или сольвата, в комбинации с преднизоном или преднизолоном для лечения рака простаты.
19. Способ по п.1, дополнительно включающий мониторинг анализов крови пациента с постоянными интервалами во время лечения этого пациента; уменьшение дозы указанного соединения, если у пациента возникла фебрильная нейтропения или продолжительная нейтропения; прекращение лечения, если количество нейтрофилов у пациента ≤1500 клеток/мм3; и необязательно, возобновление лечения, когда количество нейтрофилов у пациента возвращается на уровень ≥1500 клеток/мм3.
20. Способ по п.19, дополнительно включающий введение пациенту G-CSF перед введением указанного соединения, где считается, что для указанного пациента имеется повышенный риск осложнений, связанных с нейтропенией.
21. Способ по п.1, в котором указанное соединение является кабазитакселом и до введения кабазитаксела для снижения риска тяжелой аллергической реакции пациенту вводят лекарственное средство для предупреждения аллергии.
22. Способ увеличения продолжительности жизни пациента с гормон-рефрактерным метастатическим раком простаты, включающий введение пациенту клинически доказанного эффективного количества соединения формулы
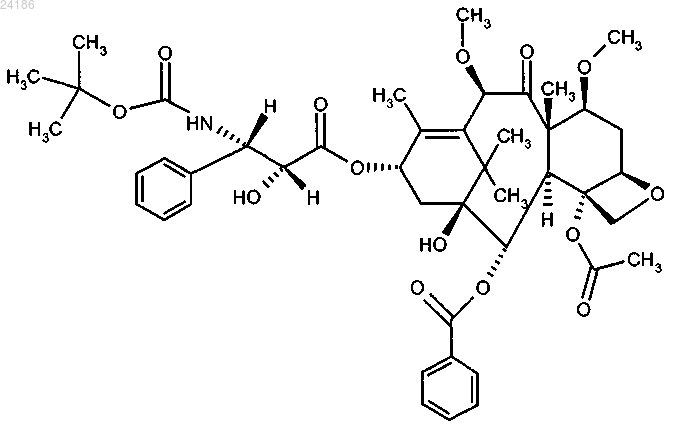
в комбинации с преднизоном или преднизолоном.
Текст
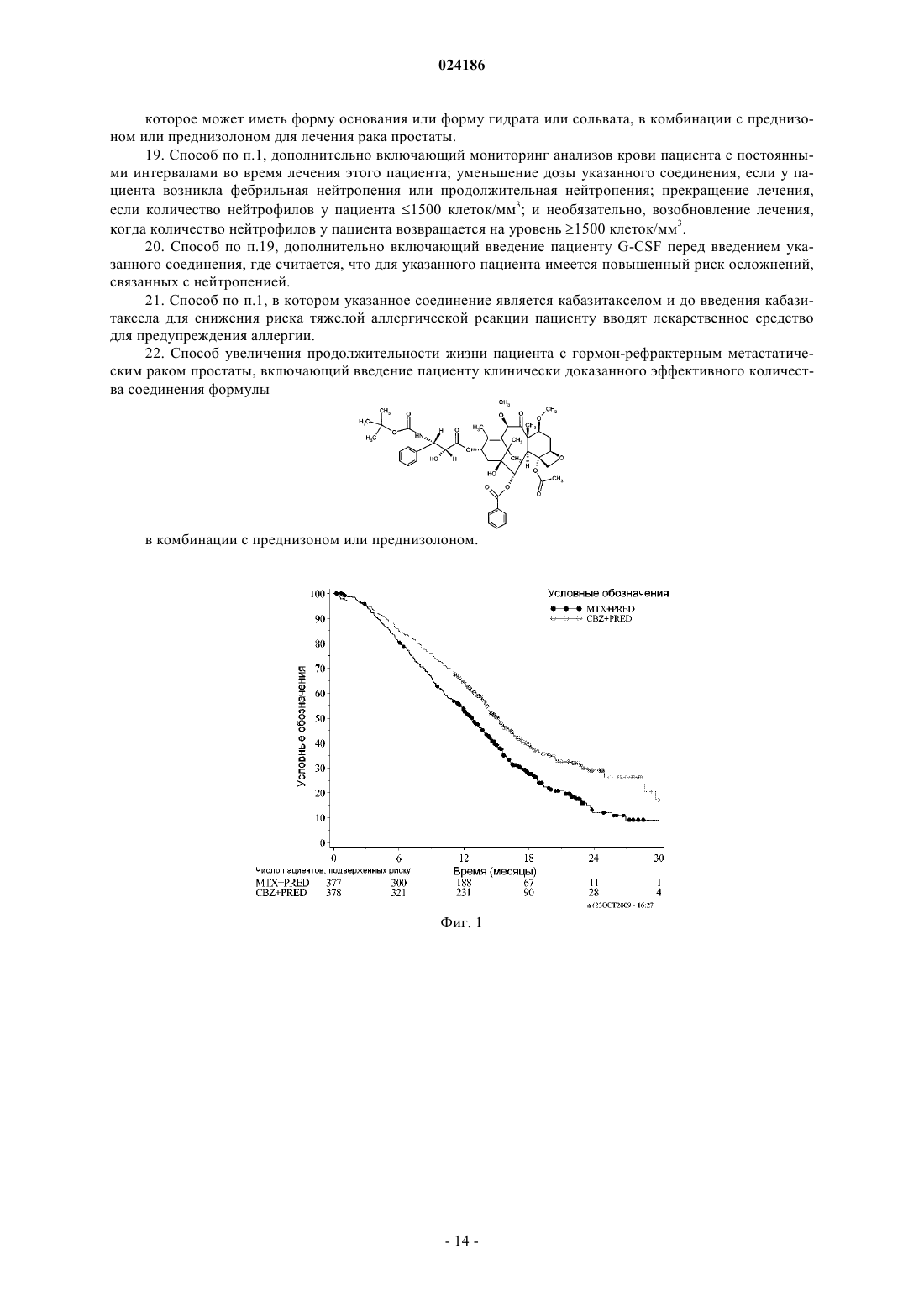
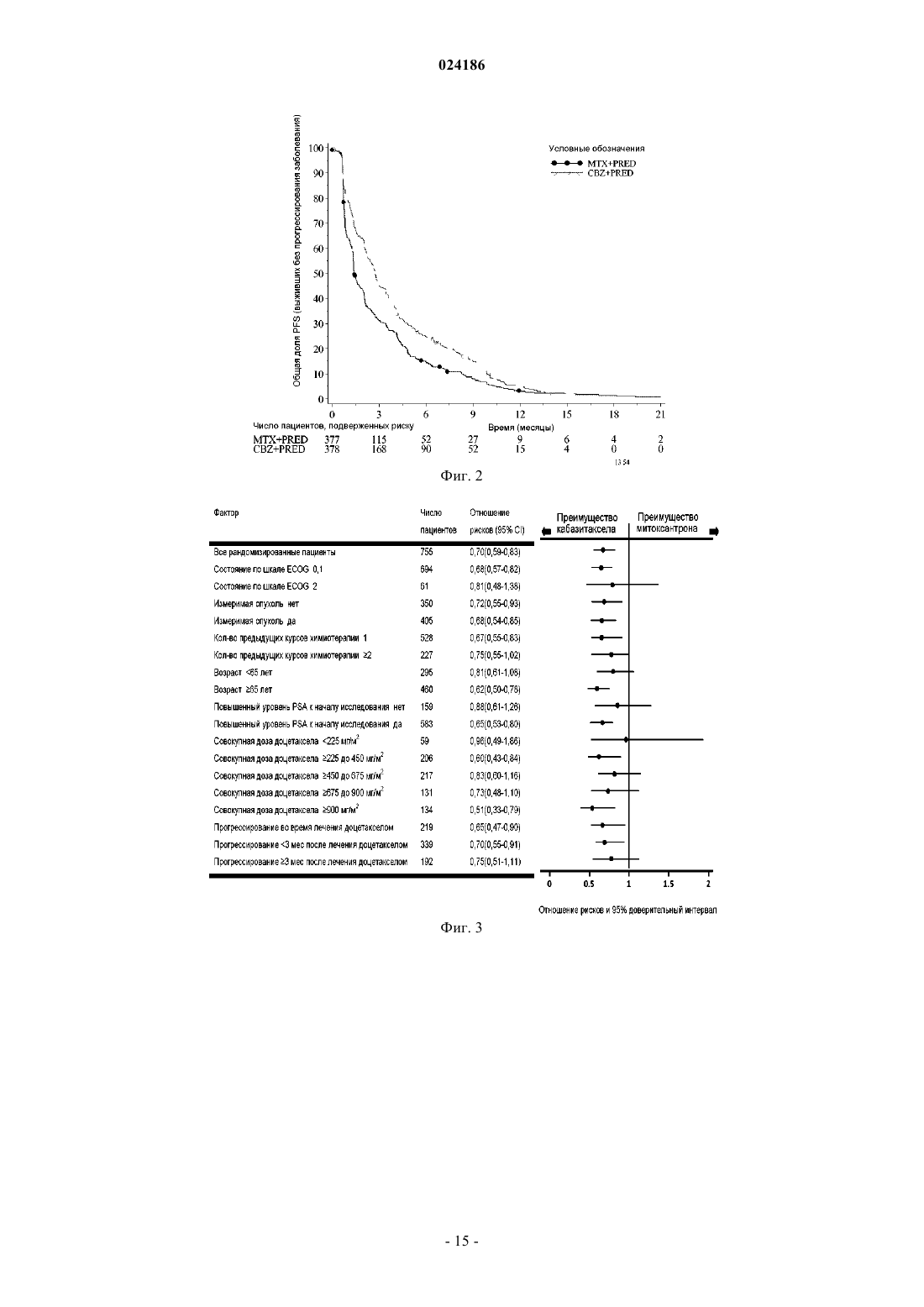
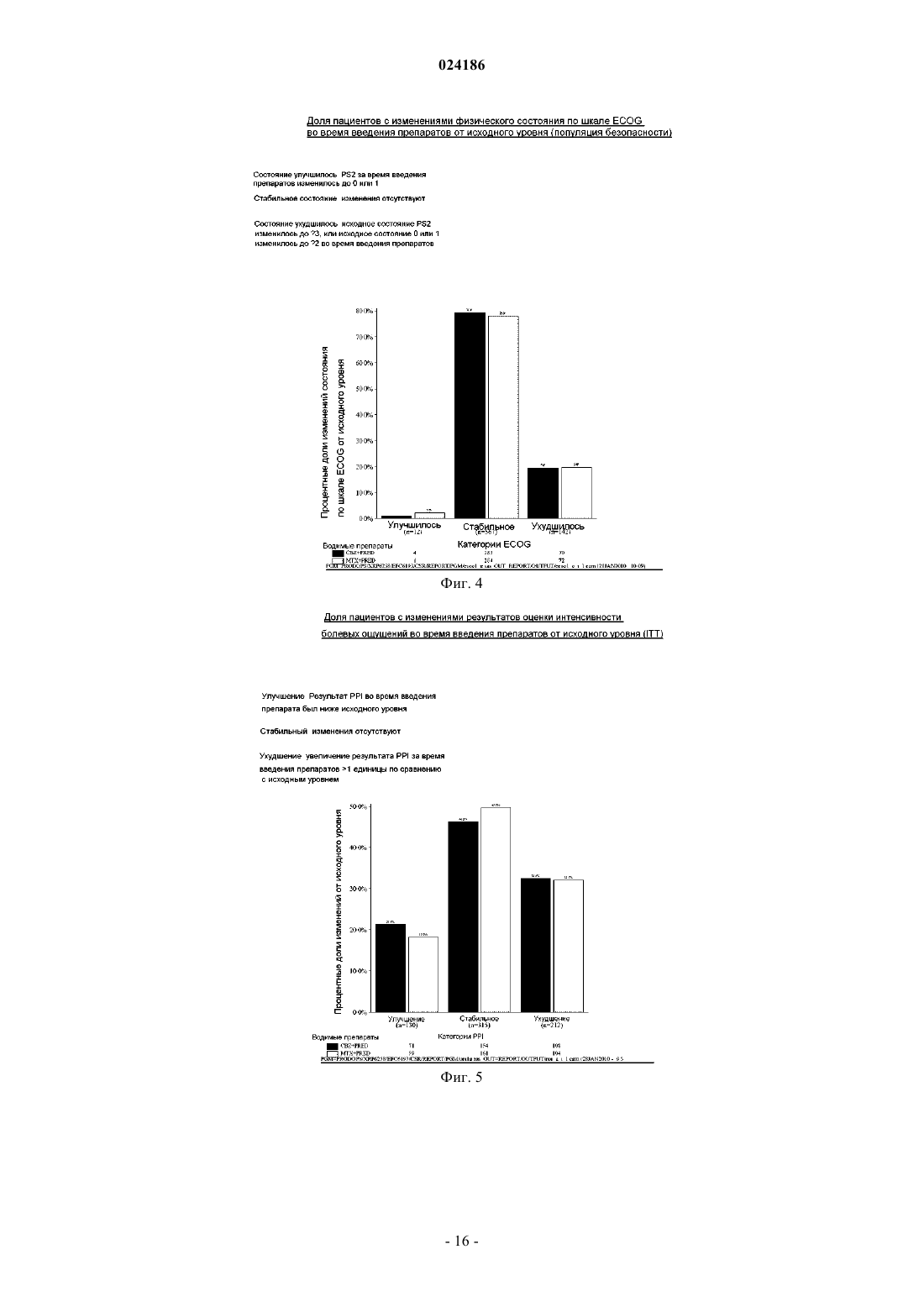
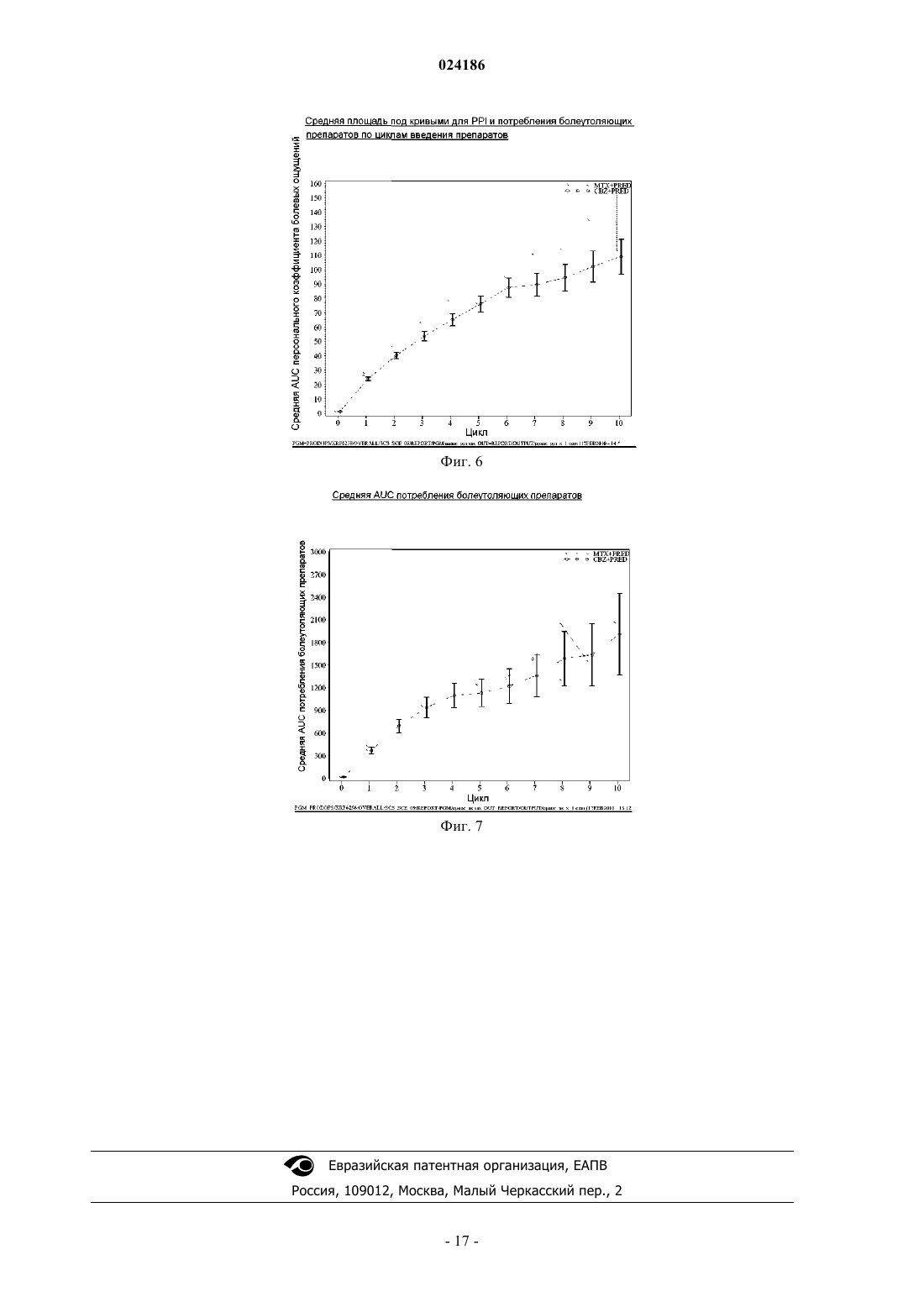
ПРИМЕНЕНИЕ КАБАЗИТАКСЕЛА В КОМБИНАЦИИ С ПРЕДНИЗОНОМ ИЛИ ПРЕДНИЗОЛОНОМ ДЛЯ ЛЕЧЕНИЯ РАКА ПРОСТАТЫ Изобретение относится к способу лечения пациентов с раком простаты, включающему введение соединения формулы которое может иметь форму основания, или форму гидрата, или сольвата, в комбинации с преднизоном или преднизолоном указанному пациенту. Предложенный способ может применяться для лечения метастатического рака простаты, особенно в случае пациентов, лечение которых,основанное на применении таксанов, не привело к удовлетворительным результатам. Изобретение относится к новому противоопухолевому применению кабазитаксела для лечения рака простаты, который может являться метастатическим, в том числе у пациентов, для которых не удалось добиться удовлетворительных результатов с помощью лечения, основанного на применении таксанов. В частности, настоящее изобретение относится к применению кабазитаксела для лечения пациентов с кастрационно-резистентным метастатическим раком простаты, которые ранее подвергались лечению по схеме с применением доцетаксела, что является неудовлетворенной потребностью современной медицины. Проблемы техники известного уровня Рак простаты поражает значительную часть мужского населения во всем мире: в 2002 г. на планете было зарегистрировано 680000 случаев этого заболевания; прогнозируется, что до 2010 г. ежегодно будет возникать 900000 новых случаев рака простаты (СА Cancer J.Clin., 55, 74-108). Рак простаты является наиболее часто встречающимся раковым заболеванием у мужчин после рака легких. Как правило, на первом этапе рак простаты лечат устранением андрогенных гормонов, т.е. путем хирургического удаления яичек (The Current State of Hormonal Therapy for Prostate Cancer CA Cancer J.Clin., May 2002; 52: 154-179) или радиационной терапией (External beam radiation therapy for prostate cancer CA Cancer J. Clin., Nov. 2000; 50: 349-375). Лечение с применением антиандрогенов или гормонов приводят к непродолжительной реакции и не вызывают какого-либо увеличения продолжительности жизни. Применение цитотоксичной химиотерапии не является стандартным способом лечения, хотя установлена роль подобных препаратов в облегчении симптомов и снижении уровней PSA (простатаспецифичного антигена). В случае монотерапии не удалось добиться степени реакции более 30%; осуществлялось тестирование комбинаций, оказывающих влияние на уровни PSA. Не было обнаружено какого-либо влияния на время выживаемости и, более того, проблематичной стала токсичность этих способов лечения, в частности у пациентов старшего возраста, поскольку, помимо ракового заболевания, они, как правило, страдали от связанных с ним проблем со здоровьем и имели ограниченный резерв костного мозга. До настоящего времени, применяемые химиотерапевтические препараты ограничивались циклофосфамидом, антрациклинами (доксорубицином или митоксантроном) и эстрамустином, причем результаты этого лечения были относительно посредственными. Паллиативные эффекты наблюдались у пациентов после введения кортикоидов самих по себе или митоксантрона в сочетании с преднизоном или гидрокортизоном. После клинических испытаний фазы II, комбинация митоксантрона с кортикоидами была признана стандартным способом лечения гормон-резистентного рака простаты. Позднее, лечение с применением доцетаксела в комбинации с этрамустином или преднизоном дало возможность лечить формы рака, устойчивые к устранению гормонов (Advances in Prostate Cancer Chemotherapy: A New EraBegins CA Cancer J.Clin., Sep.2005; 55:300-318), причем продолжительность жизни увеличилась на 2,4 месяца. Общепризнано, что при раке простаты на поздних стадиях трудно оценить реакцию на лечение по причине разнородности заболевания и отсутствия консенсуса относительно критериев этой реакции. У многих пациентов с метастатическим раком простаты не имеется измеримой опухоли, но имеются симптомы, среди которых преобладают костные метастазы. Было обнаружено, что измерение уровня PSA является средством оценки новых потенциальных лекарственных средств, и, кроме того, такими средствами являются измерение размера опухоли, если есть такая возможность, измерение костных опухолей,определение качества жизни и силы болевых ощущений. Кроме того, рак может приобретать резистентность к применяемым средствам, в частности, к таксанам, что ограничивает возможности лечения. Было описано несколько механизмов резистентности к таксанам (экспрессия Р-гликопротеина P-gp, ген mdr-1, изменение метаболизма таксана, мутация гена тубулина и т.д.): см.: Drug Resistance Update 2001, 4(1), 3-8; J.Clin.Onc. 1999, 17(3), 1061-1070. Проблема известного уровня техники, которую предполагалось решить настоящим изобретением,заключалась в разработке новых терапевтических возможностей лечения рака простаты, в частности у пациентов, которым не помогло лечение на основе таксанов, например, пациентов с кастрационнорезистентным метастатическим раком простаты, которые ранее подвергались лечению по схеме, основанной на доцетакселе (который имеется в продаже под торговой маркой Taxotere), причем потребность в указанном лечении не удовлетворена в современной медицине. Известно, что с апреля 2006 г было проведено четыре клинических испытания кабазитаксела. Три теста, проведенные по схеме монотерапии, дали возможность определить максимально переносимую дозу и токсичность при предельных дозировках: эти тесты были проведены на опухолях груди, простаты и на саркоме. Применяли дозировку 10-30 мг/м 2 каждые три часа. Клиническое испытание фазы II проводили на пациентах с раком груди, которые до этого получали таксаны и антрациклины в качестве вспомогательного средства (т.е. после хирургической операции), или в качестве лечения первой линии. Уровни реакции составляли 14,6% при использовании в качестве вспомогательного средства и 9,5% при использовании в качестве лечения второй линии. Краткое описание изобретения Изобретение относится к способу лечения пациентов с раком простаты, включающему введение соединения формулы которое может иметь форму основания или форму гидрата или сольвата, в комбинации с преднизоном или преднизолоном указанному пациенту. В одном из аспектов предложенный способ может применяться для лечения пациентов, в отношении которых не удалось добиться удовлетворительных результатов при лечении, основанном на применении таксанов. В ещ одном аспекте предложенный способ может применяться для лечения пациентов, которых ранее лечили по схемам, основанным на применении доцетаксела. В одном из аспектов настоящего изобретения рак простаты является метастатическим заболеванием на поздней стадии. В одном из аспектов настоящего изобретения рак простаты может представлять собой кастрационно-резистентный рак простаты или гормон-рефрактерный рак простаты. В одном из аспектов настоящего изобретения кабазитаксел может находиться в форме сольвата с ацетоном. Причем упомянутый сольват с ацетоном может содержать от 5 до 8 мас.% ацетона, предпочтительно от 5 до 7 мас.% ацетона. В одном из аспектов настоящего изобретения кабазитаксел вводят в дозе от 15 до 25 мг/м 2, причем преднизон или преднизолон вводят в дозе 10 мг/день. В предпочтительном варианте кабазитаксел вводтя в дозе 25 мг/м 2. В одном из аспектов настоящего изобретения предложенный способ включает повторное введение указанного соединения в виде нового цикла каждые 3 недели. Предпочтительно среднее число циклов равно 6. В одном из аспектов настоящего изобретения кабазитаксел вводят в комбинации с преднизоном при его применении в качестве лекарственного средства для лечения пациентов с кастрационно-резистентным метастатическим раком простаты или гормон-рефрактерным раком простаты, которых ранее лечили по схемам, основанным на применении доцетаксела. В одном из аспектов настоящего изобретения дополнительно осуществляют мониторинг анализов крови и измерение уровней нейтрофилов у пациента. Указанный мониторинг включает отбор образцов крови у пациента. В предпочтительном варианте прекращают введение кабазитаксела пациенту с количеством нейтрофилов 1500 клеток/мм 3. В одном из аспектов настоящего изобретения предложенный способ включает мониторинг анализов крови пациента с постоянными интервалами во время лечения этого пациента; уменьшение дозы указанного соединения, если у пациента возникла фебрильная нейтропения или продолжительная нейтропения; прекращение лечения, если количество нейтрофилов у пациента 1500 клеток/мм 3; и необязательно,возобновление лечения, когда количество нейтрофилов у пациента возвращается на уровень 1500 клеток/мм 3. В предпочтительном варианте предложенный способ дополнительно включает введение пациентуG-CSF перед введением указанного соединения, где считается, что для указанного пациента имеется повышенный риск осложнений, связанных с нейтропенией. В предпочтительном варианте до введения кабазитаксела для снижения риска тяжелой аллергической реакции пациенту вводят лекарственное средство для предупреждения аллергии. Ещ одним аспектом настоящего изобретения является применение соединения формулы которое может иметь форму основания, или форму гидрата или сольвата, в комбинации с преднизоном или преднизолоном для лечения рака простаты. Кроме того, настоящее изобретение относится к способу увеличения продолжительности жизни пациента с гормон-рефрактерным метастатическим раком простаты, включающий введение пациенту клинически доказанного эффективного количества соединения формулы в комбинации с преднизоном или преднизолоном. Краткое описание иллюстративных материалов На фиг. 1 изображены кривые итоговой выживаемости Каплана-Мейера в клиническом исследовании кабазитаксела. На фиг. 2 изображены кривые выживаемости без прогрессирования заболевания Каплана-Мейера в клиническом исследовании кабазитаксела. На фиг. 3 показан анализ итоговой выживаемости в подгруппах пациентов, которые начинали проходить лечение, определенных по исходным характеристикам. Отношение рисков 1 говорит в пользу группы кабазитаксела, тогда как отношение 1 говорит в пользу группы митоксантрона. CI означает доверительный интервал. На фиг. 4 графически изображена доля пациентов с изменениями общего физического состояния по шкале ECOG от исходного уровня во время лечения (популяция безопасности). На фиг. 5 графически изображена доля пациентов, у которых во время лечения произошли изменения результатов по интенсивности болевых ощущений от исходного уровня (ITT). На фиг. 6 графически показана средняя площадь под кривой для PPI и данных о потреблении болеутоляющих препаратов по циклам лечения. На фиг. 7 графически представлены средние AUC данных о потреблении болеутоляющих препаратов. Описание изобретения Определения Термин "эффективное количество" в настоящем описании означает количество фармацевтического соединения, например, кабазитаксела, которое оказывает воздействие на раковое заболевание, подлежащее лечению. Термин "клинически доказанный" в настоящем описании означает данные по клинической эффективности, которые достаточны для того, чтобы удовлетворять стандартам, требуемым для одобренияFDA. Термин "кастрационно-резистентный рак простаты" в настоящем описании является синонимом гормон-рефрактерного рака простаты. Термин "пациент" в настоящем описании включает как человека, так и животных. В одном из вариантов осуществления пациент является человеком. Кабазитаксел принадлежит к семейству таксоидов и имеет формулу Кабазитаксел имеет следующее химическое наименование: 4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,10-диметокси-9-оксо-11-таксен-13-ил (2R,3S)-3-трет-бутоксикарбониламино 2-гидрокси-3-фенилпропионат. Синонимичное наименование кабазитаксела (2,5,7,10,13)-4 ацетокси-13-2R,3S)-3-[(трет-бутоксикарбонил)амино]-2-гидрокси-3-фенилпропаноилокси)-1 гидрокси-7,10-диметокси-9-оксо-5,20-эпокситакс-11-ен-2-ил бензоат. Это соединение и способ его получения описаны в WO 96/30355, ЕР 0817779 В 1 и US 5847170, которые включены в настоящую заявку с помощью ссылки. Кабазитаксел можно вводить в форме основания (сравните приведенную выше формулу) или в форме гидрата. Кроме того, кабазитаксел может иметь форму сольвата, т.е. молекулярного комплекса, характеризующегося включением кристаллизационного растворителя в кристалл, состоящий из молекул действующего начала (по этому вопросу см. стр.1276 J.Pharm. Sci. 1975, 64(8), 1269-1288). Сольват может представлять собой в том числе сольват с ацетоном и,более конкретно, может являться сольватом, описанным в WO 2005/02846. Сольват кабазитаксела с ацетоном может содержать от 5 до 8% и предпочтительно от 5 до 7% по массе ацетона (величина в % означает количество ацетона/(количество ацетона + количество кабазитаксела)100). Среднее содержание ацетона составляет 7%, что приблизительно соответствует стехиометрическому количеству, которое равно 6,5% для сольвата, содержащего одну молекулу ацетона. Описанная ниже методика позволяет по-3 024186 лучить сольват кабазитаксела и ацетона: 940 мл очищенной воды при температуре 205 С (комнатная температура) добавляют к раствору 207 г 4-ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси 7,10-диметокси-9-оксо-11-таксен-13-ил (2R,3S)-3-трет-бутоксикарбониламино-2-гидрокси-3-фенилпропионата при примерно 92% по весу в примерно 2 л ацетона, после чего вносят кристаллические затравки в виде суспензии 2 г 4-ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,10-диметокси-9 оксо-11-таксен-13-ил (2R,3S)-3-трет-бутоксикарбониламино-2-гидрокси-3-фенилпропионата, выделенного из смеси ацетон/вода, в смеси 20 мл воды и 20 мл ацетона. Полученную смесь перемешивают в течение примерно 10-22 ч и добавляют 1,5 л очищенной воды в течение 4-5 ч. Эту смесь перемешивают в течение 60-90 мин и затем фильтруют полученную суспензию при пониженном давлении. Слой осадка промывают на фильтре раствором, полученным из 450 мл ацетона и 550 мл очищенной воды, и затем сушат в печи при 55 С и пониженном давлении (0,7 кПа) в течение 4 ч. Получают 197 г сольвата 4 ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,10-диметокси-9-оксо-11-таксен-13-ил (2R,3S)3-трет-бутоксикарбониламино-2-гидрокси-3-фенилпропионата с ацетоном, содержащего 0,1% воды и 7,2% ацетона (теоретическое количество для стехиометрического сольвата 6,5%). Кабазитаксел можно вводить парентерально, например, внутривенным путем. Галенова форма кабазитаксела, подходящая для введения с помощью внутривенной инфузии, представляет собой такую форму, в которой кабазитаксел растворен в воде в присутствии эксципиентов, выбранных из ПАВ, сорастворителей, глюкозы или хлорида натрия и т.д. Например, галенову форму кабазитаксела можно получить разбавлением заранее приготовленного раствора кабазитаксела, находящегося в стерильном флаконе (80 мг кабазитаксела + 2 мл растворителя + Polysorbat 80), в 6 мл смеси воды и этанола (13% по массе 95% этанола) в стерильном флаконе, с получением 8 мл раствора, пригодного для повторного разбавления в перфузионном мешке. Концентрация кабазитаксела в этом пригодном для повторного разбавления растворе составляет примерно 10 мг/мл. После этого получают раствор для перфузии, вводя соответствующее количество этого пригодного для повторного разбавления раствора в перфузионный мешок, содержащий воду и глюкозу (примерно 5%) или хлорид натрия (примерно 0,9%). Кабазитаксел можно вводить в комбинации с кортикоидом, например, преднизоном или преднизолоном, в виде двух отдельных фармацевтических препаратов. Соответственно, один из аспектов настоящего изобретения относится к способу лечения пациентов с раком простаты, включающему введение кабазитаксела, который может иметь форму основания, или форму гидрата или сольвата, в комбинации с преднизоном или преднизолоном указанному пациенту. Эту комбинацию вводят многократно в соответствии с протоколом, который зависит от пациента,подвергаемого лечению, (возраст, масса тела, история лечения и т.д.), и может быть определен квалифицированным врачом. В одном из аспектов настоящего изобретения, кабазитаксел вводят пациенту с помощью перфузии по дискретной программе с интервалом между введениями, равным 3 неделям, причем этот интервал можно увеличить на 1 или 2 недели в зависимости от того, как пациент перенес предыдущее введение. Среднее число циклов равно 6. Преднизон или преднизолон могут вводиться ежедневно,например, путем принятия одной дозы в день, на протяжении всего курса лечения. Примеры доз для двух этих противоопухолевых агентов приведены в разделе "Примеры". Рекомендуемая в настоящее время доза кабазитаксела составляет 25 мг/м 2 при введении путем инфузии продолжительностью один час, и доза преднизона или преднизолона равна 10 мг в день при пероральном введении. В некоторых аспектах настоящего изобретения, у подлежащего лечению пациента имеется рак простаты, резистентный к гормональной терапии (т.е. гормон-рефрактерный), и этого пациента ранее лечили доцетакселом. В некоторых аспектах, у пациента имеется рак простаты, который прогрессировал во время или после лечения доцетакселом. В некоторых аспектах, пациента ранее лечили доцетакселом при его суммарной дозе не менее 225 мг/м 2. В конкретном аспекте, у пациента наблюдалось прогрессирование заболевания в течение шести месяцев после гормональной терапии или во время лечения доцетакселом,или после лечения доцетакселом. В другом конкретном аспекте, у пациента было зафиксировано прогрессирование заболевания в течение трех месяцев после гормональной терапии или после лечения доцетакселом. В некоторых аспектах настоящего изобретения, у подлежащего лечению пациента имеется измеряемая опухоль и может наблюдаться прогрессирование заболевания за счет метастатического поражения внутренних органов или мягких тканей размером не менее 1 см согласно данным MRI (ЯМРтомографии) или аксиального томографического сканирования (компьютерной томографии). В некоторых аспектах настоящего изобретения, у подлежащего лечению пациента имеется не измеряемая опухоль и может наблюдаться увеличение уровня PSA по результатам трех измерений с 1 недельным интервалом или появление новых очагов поражения. В некоторых аспектах настоящего изобретения, подлежащий лечению пациент подвергся кастрации путем орхидэктомии или с помощью агонистов LHRH, устранения андрогенов или монотерапии с применением эстрамустина. В предпочтительном аспекте ожидаемая продолжительность жизни подлежащего лечению пациен-4 024186 та должна составлять не менее 2 месяцев. В некоторых аспектах лечению не подлежат пациенты, которые ранее получали митоксантрон, или получали менее 225 мг/м 2 доцетаксела, или подергались радиационной терапии, которая привела к уничтожению более 40% костного мозга, или получали лечение в течение 4 недель, предшествующих тесту,или имели невропатию или стоматит, затрагивавшие головной мозг или оболочки головного мозга, или продемонстрировали тяжелую аллергическую реакцию на полисорбаты или преднизон, или анализ крови которых показал заметное уменьшение уровней нейтрофилов, гемоглобина или тромбоцитов, повышенное содержание билирубина и/или ферментов печени и креатинина, или у которых имеются проблемы с сердцем, или инфекции, требующие применения антибиотиков. Один из аспектов настоящего изобретения относится к способу увеличения продолжительности жизни пациента с гормон-рефрактерным метастатическим раком простаты, включающему введение пациенту клинически доказанного эффективного количества кабазитаксела в комбинации с преднизоном или преднизолоном. В конкретном аспекте, пациент перед этим подвергался лечению по схеме, включающей доцетаксел. Кабазитаксел можно вводить в комбинации с лекарственными средствами, предназначенными для предотвращения или ослабления тошноты и рвоты, или для предотвращения или ослабления аллергической реакции на введение кабазитаксела. Предпочтительно, чтобы эти средства вводились пациенту до введения основного препарата, например, как минимум за 30 мин до введения каждой дозы кабазитаксела. Один из аспектов настоящего изобретения относится к способу снижения риска тяжелой аллергической реакции у пациента с раком простаты, подвергаемого лечению кабазитакселом, включающему введение пациенту лекарственного средства для предотвращения аллергической реакции перед введением кабазитаксела. Могут возникать тяжелые аллергические реакции на кабазитаксел, и эти реакции могут включать генерализованную сыпь/эритему, гипотензию и бронхоспазм. Необходимо пристально наблюдать за аллергическими реакциями пациента, в особенности во время первой и второй инфузий. Аллергические реакции могут возникать в течение нескольких минут после начала инфузий кабазитаксела, поэтому должны быть доступны средства и оборудование для лечения гипотензии и бронхоспазма. Если возникает тяжелая аллергическая реакция, необходимо немедленно прервать инфузию кабазитаксела и ввести соответствующее терапевтическое средство. Примеры лекарственных средств, которые могут применяться для профилактики аллергической реакции на лечение кабазитакселом, включают антигистаминные средства, например, дексхлорфенирамин (например, 5 мг) и дифенгидрамин (например, 25 мг) или эквивалентные антигистаминные средства; а также кортикостероиды, например, дексаметазон (например, 8 мг) или эквивалентный стероид. Тем не менее, кабазитаксел не следует давать, и он может быть противопоказан пациентам, у которых имеется история тяжелых аллергических реакций на кабазитаксел. В зависимости от состава вводимой композиции, кабазитаксел может также быть противопоказан пациентам, у которых имеется история аллергических реакций на другие лекарственные средства, в состав которых входит полисорбат 80. При лечении кабазитакселом могут появляться желудочно-кишечные симптомы, например, тошнота, рвота и диарея. Сообщалось о смертности, связанной с диареей и нарушением баланса электролитов. Следовательно, пациентам может также потребоваться регидратация и, при необходимости, лечение противодиарейными или противорвотными средствами. Может потребоваться отложить лечение или сократить дозы, если у пациента возникнет диарея 3 степени. Соответственно, в комбинации с кабазитакселом можно вводить лекарственное средство для профилактики аллергической реакции или лекарственное средство для профилактики или ослабления тошноты и рвоты. Примеры лекарственных средств, которые могут применяться для профилактики или ослабления тошноты и рвоты, включают антагонисты гистаминового рецептора Н 2 и противорвотные средства, такие как ондансетрон, гранисетрон и долесетрон. Возможным побочным эффектом лечения кабазитакселом является нейтропения, которая характеризуется пониженным количеством нейтрофилов. К сожалению, сообщалось о ряде случаев смерти от нейтропении. Поэтому для мониторинга нейтропении необходимо осуществлять частый отбор образцов крови и их анализ. При появлении нейтропении, лечение кабазитакселом может быть прервано и начато вновь, когда количество нейтрофилов вернется на уровень 1500 мм 3. Кабазитаксел не следует давать пациентам с количеством нейтрофилов 1500 клеток/мм 3. Поэтому настоящее изобретение относится также к способу лечения рака простаты кабазитакселом,включающему введение пациенту кабазитаксела, мониторинг анализов крови пациента и определение уровня нейтрофилов. В одном из аспектов этот способ дополнительно включает прекращение лечения кабазитакселом при возникновении нейтропении и, необязательно, возобновление лечения кабазитакселом при восстановлении количества нейтрофилов до уровней 1500/мм 3. В одном из аспектов мониторинг включает отбор образцов крови у пациента. Определение числа нейтрофилов может быть осуществлено по методикам, хорошо известным специалистам в данной области техники. Один из аспектов настоящего изобретения относится к способу снижения риска осложнений нейтропении, включающему введение кабазитаксела в комбинации с агентом, подходящим для лечения нейтропении. Этим агентом для лечения нейтропении является, например, гематопоэтический фактор роста,который регулирует выработку и деятельность нейтрофилов, такой как гранулоцитарный колониестимулирующий фактор человека (G-CSF). В отдельном аспекте изобретения, нейтропения является осложненной нейтропенией. Осложненная нейтропения включает фебрильную нейтропению, продолжительную нейтропению или инфекции, сопутствующие нейтропении. В предпочтительном варианте осуществления, средство для лечения нейтропении вводят до введения кабазитаксела. Отдельный аспект изобретения включает способ уменьшения риска осложнений нейтропении у пациента с раком простаты, которого лечат кабазитакселом, включающий мониторинг результатов анализа крови у пациента через регулярные интервалы времени при лечении пациента кабазитакселом; уменьшение дозы кабазитаксела, если у пациента возникает фебрильная нейтропения или продолжительная нейтропения; прекращение лечения кабазитакселом, если количество нейтрофилов в крови пациента становится 1500 клеток/мм 3; и, необязательно, возобновление лечения кабазитакселом, если количество нейтрофилов у пациента восстанавливается до уровня 1500 клеток/мм 3. В отдельном аспекте, необходимо рассмотреть первичную профилактику с помощью G-CSF у пациентов с клиническими признаками высокого риска (возраст 65 лет, плохое состояние здоровья,имевшиеся ранее эпизоды фебрильной нейтропении, имевшиеся ранее обширные радиационные поражения, плохой статус питания или другие серьезные сопутствующие патологии), которые предрасполагают пациентов к осложнениям продолжительной нейтропении. Терапевтическое применение G-CSF и вторичной профилактики следует иметь в виду для всех пациентов, которые, как считается, имеют повышенный риск осложнений нейтропении. В другом аспекте, мониторинг полного анализа крови проводят на еженедельной основе во время 1 го цикла введения и перед каждым следующим циклом введения с тем, чтобы при необходимости имелась возможность отрегулировать дозу. Следовательно, другой аспектспособа снижения риска осложнений нейтропении включает мониторинг анализов крови пациента и регулировку дозы кабазитаксела. Пример изменения дозы описан в примере 2. В процессе лечения кабазитакселом необходимо выявлять случаи почечной недостаточности и принимать против них энергичные меры, в соответствии со способами, известными специалистам в данной области. Почечная недостаточность может быть связана с сепсисом, обезвоживанием или обструктивной уропатией. Кроме того, нарушение функций печени (например, общий билирубинULN, или AST и/илиALT 1,5ULN) может приводить к увеличению концентрации кабазитаксела, и кабазитаксел не следует давать пациентам с нарушением функции печени. Кабазитаксел может причинять вред плоду при введении беременным женщинам. Преднизон или преднизолон при введении в количестве 10 мг в день не влияют на фармакокинетику кабазитаксела. Первичный метаболизм кабазитаксела происходит под действием CYP3A. Одновременное введение сильных ингибиторов CYP3A (например, кетоконазола, итраконазола, кларитромицина, атазанавира,индинавира, нефазодона, нелфинавира, ритонавира, саквинавира, телитромицина, вориконазола) может увеличить концентрации кабазитаксела. Поэтому следует избегать совместного введения кабазитаксела с сильными ингибиторами CYP3A. Необходимо предупреждать об осторожности при совместном применении кабазитаксела с ингибиторами CYP3A умеренной силы. Один из аспектов настоящего изобретения относится к способу лечения пациента с раком простаты, включающему определение, подергался ли пациент лечению ингибитором CYP3A, прекращение лечения ингибитором CYP3A и затем введение кабазитаксела пациенту. Одновременное введение с сильным стимулятором CYP3A (например, фенитоином, карбамазепином, рифампином, рифабутином, рифапентином, фенобарбиталом) может уменьшить концентрации кабазитаксела. Поэтому следует избегать совместного введения кабазитаксела с сильными стимуляторамиCYP3A. Следовательно, один из аспектов настоящего изобретения относится к способу лечения пациента от рака простаты, включающему определение того, подвергался ли пациент лечению стимуляторомCYP3A, прекращение лечения стимулятором CYP3A и введение кабазитаксела пациенту. Кроме того, пациенты должны воздерживаться от употребления препаратов зверобоя. В некоторых аспектах настоящего изобретения, кабазитаксел вводят в таком количестве, которое обеспечивает AUC примерно 991 нгч/мл (CV 34%). В некоторых аспектах настоящего изобретения, кабазитаксел вводят в таком количестве, которое обеспечивает Cmax примерно 226 нгч/мл (CV 107%). В некоторых аспектах настоящего изобретения, кабазитаксел вводят в таком количестве, которое обеспечивает плазменный клиренс 48,5 л/ч (CV 39%). Для обеспечения надлежащего назначения и отпуска лекарственных средств, а также согласия па-6 024186 циента на лечение способами, описанными в настоящей заявке, может применяться ряд образовательных материалов. Например, в литературе и ряде других материалов, например, в инструкции по применению,листовках-вкладышах в упаковки, информации для пациента, информационных листках для врачей, информационных листках для работников здравоохранения, рекламе в медицинских журналах и на вебсайтах продуктов, могут быть описаны риски и польза от применения кабазитаксела. Пример 1. Проводили клиническое исследование, в ходе которого пациентам либо вводили кабазитаксел, либо осуществляли стандартное лечение на основе митоксантрона, где каждый из указанных препаратов применяли в комбинации с преднизоном или преднизолоном. Более конкретно, пациентов в возрасте свыше 18 лет с метастатическим кастрационнорезистентным раком простаты, измеримым по критериям RECIST, или неизмеримым с повышенными уровнями PSA или наличием новых очагов поражения, с общим физическим состоянием по шкале ECOG(Eastern Cooperative Oncology Group - Восточной Объединенной Онкологической Группы США) 0-2 и надлежащим функционированием органов (количество нейтрофилов у пациента должно было составлять 1500 клеток/мм 3, тромбоцитов 100 000 клеток/мм 3, гемоглобин 10 г/дл, креатинин 1,5 верхняя граница нормы (ULN), общий билирубин 1ULN, ASTl,5ULN и ALT1,5ULN), которые должны были ранее подвергаться гормонотерапии, химиотерапии и радиотерапии, но у которых имелось прогрессирующее заболевание во время или после лечения доцетакселом (совокупная доза 225 мг/м 2), случайным образом распределяли по группам, получавшим 10 мг/день преднизона в комбинации с митоксантроном 12 мг/м 2 или кабазитакселом 25 мг/м 2, где оба указанных препарата вводили каждые 3 недели. В исследование не включали пациентов с историей застойной сердечной недостаточности, случаями инфаркта миокарда в течение последних 6 месяцев, или пациентов с неуправляемой сердечной аритмией, стенокардией и/или гипертензией. В клиническое исследование планировали включить 720 пациентов: по 360 в каждую из групп кабазитаксел + преднизон и митоксантрон + преднизон. Фактически в списки исследуемых было включено семьсот пятьдесят пять (755) пациентов (средний возраст 68 лет, 84% белых), 378 человек в группу кабазитаксел и преднизон/преднизолон, и 377 человек в группу митоксантрон и преднизон/преднизолон. Максимальное количество циклов введения составляло 10 для кабазитаксела и 10 для митоксантрона. Среднее число циклов введения было равно 6 для кабазитаксела и 4 для митоксантрона. Средняя доза во время предшествовавшего лечения доцетакселом составляла 576 мг/м 2 для группы, получавшей кабазитаксел, и 529 мг/м 2 для группы, получавшей митоксантрон. Среднее время последующего наблюдения составляло 12,8 месяцев. Измерение результатов проводили на основании тех же тестов, по которым отбирали пациентов для включения в исследование. Предпочтительно использовали данные MRI и спиральные сканы компьютерной томографии (СТ). Результаты оценивали согласно следующим критериям (сравните с рекомендациями RECIST): итоговая продолжительность жизни (OS): время от включения в исследование до даты смерти; полная реакция (CR): исчезновение опухолевых поражений; частичная реакция (PR): сокращение наибольшего диаметра опухоли как минимум на 30%; прогрессирование заболевания(PD): как минимум 20% увеличение суммы наибольшего диаметра опухолей или возникновение одного или нескольких новых очагов опухолевого поражения; устойчивое состояние заболевания (SD): уменьшение опухоли недостаточно для отнесения к PR, и увеличение опухоли недостаточно для отнесения к PD. Подтверждение измерений проводили как минимум через 4 недели после первого обнаружения соответствия критериям реакции. Время выживания без прогрессирования заболевания (PFS) означает время от включения в исследование до даты регистрации прогрессирования заболевания или смерти, где прогрессирование означает либо увеличение PSA, либо увеличение опухоли, либо рост болевых ощущений. Было обнаружено, что комбинация кабазитаксела и преднизона является хорошо переносимой комбинацией с профилем безопасности таксанов. При исследованной в этом клиническом испытании дозе(LD2: 25 мг/м 2 кабазитаксела + 10 мг/м 2/день преднизона), пациенты, получавшие кабазитаксел, продемонстрировали статистически значимое увеличение итоговой продолжительности жизни (OS) по сравнению с митоксантроном (р 0,0001). Отношение рисков составляло 0,70 (95% CI: 0,59-0,83) в пользу кабазитаксела, что соответствует 30% уменьшению риска смерти. Средняя продолжительность жизни для пациентов из группы кабазитаксела составлял 15,1 мес. по сравнению с 12,7 мес. в группе митоксантрона. Примечательно, что увеличение продолжительности жизни наблюдалось независимо от общего физического состояния по шкале ECOG, числа предыдущих курсов химиотерапии и возраста. Польза от применения кабазитаксела заметна также у трети пациентов, которые были невосприимчивы к доцетакселу, но продемонстрировали улучшение при лечении кабазитакселом. Данные о результатах лечения пациентов приведены в таблице 1: Таблица 1. Анализ эффективности лечения (для начавших лечение) Время выживания без прогрессирования заболевания (PFS) определяли по наиболее ранней регистрации прогрессирования опухоли, по критериям PSA или болевых ощущений, группа, получавшая кабазитаксел, также статистически значимо продемонстрировала более продолжительные сроки, по сравнению с группой митоксантрона (р 0,0001, отношение рисков = 0,74 (95% CI: 0,64, 0,86), и среднее время выживания без прогрессирования заболевания составило 2,8 месяца против 1,4 месяца. Количество больных, у которых наблюдалась реакция, и PFS для PSA и оценки опухолей оказались статистически значимыми в пользу кабазитаксела, тогда как количество больных, у которых наблюдалась реакция, и PFS для боли не продемонстрировали статистически значимого различия. Наиболее частые случаи токсического действия 3/4 степени представляли собой нейтропению, чаще наблюдаемую в группе кабазитаксела с результатом 81,7% по сравнению с группой митоксантрона с результатом 58,0%. Доля случаев фебрильной нейтропении составляла 7,5% в группе кабазитаксела и 1,3% в группе митоксантрона. Наиболее частыми (20%) нежелательными реакциями 1-4 степени являлись анемия, лейкопения,нейтропения, тромбоцитопения, диарея, усталость, тошнота, рвота, астения и запор. Наиболее частыми (5%) нежелательными реакциями 3-4 степени у пациентов, получавших кабазитаксел, являлись нейтропения, лейкопения, анемия, фебрильная нейтропения, диарея, усталость и астения. Анализ подгрупп по факторам риска и многофакторный анализ показали, что результаты по OS согласованно и устойчиво демонстрируют преимущество кабазитаксела, как показано в приведенной ниже по тексту таблице. мес = месяцы; D = доцетаксел. Таблица 3. Частота появления указанных нежелательных реакций 1 и гематологических аномалий у 5% пациентов, получающих кабазитаксел в комбинации с преднизоном или миоксантрон в комбинации с преднизоном Степени присваивались с использованием NCI СТСАЕ версии 3. На основании данных лабораторных исследований, кабазитаксел: n=369, митоксантрон: n=370. 3 Включая фибрилляцию предсердий, трепетание предсердий, тахикардию предсердий, полную атриовентрикулярную блокаду, брадикардию, учащенное сердцебиение, наджелудочковую тахикардию,тахиаритмию и тахикардию. 4 Включая дискомфорт в брюшной полости, боль в нижней части брюшной полости, боль в верхней части брюшной полости, болезненность в брюшной полости и GI(желудочно-кишечная) боль. 5 Включая желудочно-пищеводный рефлюкс и рефлюксный гастрит. 6 Включая инфекции мочеиспускательного тракта, вызванные энтерококками и грибками. 7 Включая бронхопневмонию, долевую пневмонию и пневмонию, вызванную палочкой klebsiella. 8 Включая периферическую двигательную невропатию и периферическую сенсорную невропатию. 2 Основной причиной прекращения лечения в обеих группах являлось прогрессирование заболевания(Таблица 5). Средняя относительная интенсивность вводимой дозы составляла 96,1% в группе кабазитаксела и 97,3% в группе митоксантрона. В группе кабазитаксела 75% пациентов получали 90% запланированной интенсивности дозы. В общей сложности в 5,1% курсов лечения митоксантроном была снижена доза, по сравнению с 9,8% курсов лечения кабазитакселом; в 6,3 и 7% всех курсов лечения введение очередной дозы откладывалось на 9 дней или менее, и в 1,6 и 2,3% курсов введение очередной дозы откладывалось более, чем на 9 дней для митоксантрона и кабазитаксела, соответственно (см. таблицу 5). Таблица 5. Проводимое лечение и причины его прекращения для популяции пациентов,начавших участие в исследовании Результаты проведенного исследования дополнительно проиллюстрированы на фиг. 1, 2 и 3. Пример 2. В таблице 6 показан пример изменения дозировки по причине нежелательных реакций у пациентов, которым вводили кабазитаксел. Введение кабазитаксела прекращали, если у пациента продолжалась любая из перечисленных нежелательных реакций при дозировке 20 мг/м 2. Пример 3. Общее физическое состояние и оценка болевых ощущений при введении препаратов. Методики.ECOG PS, определение болевых ощущений и потребление аналгетиков оценивали перед каждым циклом введения и в конце клинического исследования. Оценка болевых ощущений: шкала интенсивности имеющихся болевых ощущений (PPI) из опросника McGill-Melzack (Melzack R. Pain 1975; 1:277-99). Оценку среднего потребления аналгетиков (AS),полученную на основании потребления аналгетиков (в морфиновом эквиваленте), вычисляли для 1 недельного периода перед проведением каждой оценки. Площадь под кривой (AUC) для PPI и AS рассчитывали по формуле трапеций. Кумулятивную величину AUC для PPI и AS рассчитывали вплоть до получения данных для последнего цикла, доступных для каждого из пациентов. Средние значения AUC для групп по каждому из препаратов сравнивали, начиная с цикла 1 до цикла 10. Результаты. Физическое состояние оставалось стабильным у большинства пациентов в период введения препаратов, и было сходным у представителей обоих групп. См. фиг. 4. Результаты PPI в целом были сравнимы; улучшение от исходного уровня составило 21,3% для пациентов из группы CbzP и 18,2% для пациентов из группы МР. См. фиг. 5. Для пациентов из группы CbzP наблюдались меньшие средние площади под кривой (AUC) PPI, что предполагает менее сильные болевые ощущения, в особенности во время циклов 7-10. См. фиг. 6. Потребление аналгетиков было сравнимо для обеих групп (более низкое среднее значение AUC AS означает меньшее потребление болеутоляющих препаратов). См. фиг. 7. Выводы. Несмотря на более продолжительное введение CbzP, не наблюдалось ухудшения PS по шкалеECOG. Результаты по интенсивности болевых ощущений в данном исследовании улучшились на 21% у пациентов из группы CbzP по сравнению с 18% для группы МР. Оценка результатов по интенсивности болевых ощущений дает основание предположить о менее сильных болевых ощущениях у пациентов в группе, которой вводили CbzP. Потребление болеутоляющих медикаментов было сходно в обеих группах. Пример 4. Популяционный фармакокинетический анализ проводили у 170 пациентов с солидными- 12024186 опухолями при дозировках в диапазоне от 10 до 30 мг/м 2 еженедельно или раз в три недели. По результатам популяционного фармакокинетического анализа, после внутривенного введения кабазитаксела в дозировке 25 мг/м 2 раз в три недели, среднее значение Cmax у пациентов с метастатическим раком простаты составляло 226 нг/мл (CV 107%) и достигалось в конце 1-часовой инфузии (Tmax). Среднее значение AUC у пациентов с метастатическим раком простаты составляло 991 нгч/мл (CV 34%). У пациентов с солидными опухолями на поздних стадиях не наблюдалось значительных отклонений от пропорциональности этих параметров вводимой дозе в диапазоне от 10 до 30 мг/м 2. Объем распределения в равновесном состоянии (Vss) составил 4864 л (2642 л/м 2 для пациентов со средним значением BSA 1,84 м 2). По результатам популяционного фармакокинетического анализа, плазменный клиренс кабазитаксела у пациентов с метастатическим раком простаты составляет 48,5 л/ч (CV 39%; 26,4 л/ч/м 2 для пациентов со средним значением BSA 1,84 м 2). После 1-ч внутривенной инфузии, концентрация кабазитаксела в плазме может быть описана 3-компартментной фармакокинетической моделью с периодами полужизни-, - и - 4 мин, 2 и 95 ч, соответственно. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения пациентов с раком простаты, включающий введение соединения формулы которое может иметь форму основания или форму гидрата или сольвата, в комбинации с преднизоном или преднизолоном указанному пациенту. 2. Способ по п.1, где у подвергаемых лечению пациентов не удалось добиться удовлетворительных результатов при лечении, основанном на применении таксанов. 3. Способ по пп.1 или 2, где подвергаемых лечению пациентов ранее лечили по схемам, основанным на применении доцетаксела. 4. Способ по любому из пп.1-3, где рак простаты является метастатическим заболеванием на поздней стадии. 5. Способ по п.3, где рак простаты представляет собой кастрационно-резистентный рак простаты или гормон-рефрактерный рак простаты. 6. Способ по любому из пп.1-5, в котором указанное соединение находится в форме сольвата с ацетоном. 7. Способ по п.6, где упомянутый сольват с ацетоном содержит от 5 до 8 мас.% ацетона. 8. Способ по п.7, где упомянутый сольват с ацетоном содержит от 5 до 7 мас.% ацетона. 9. Способ по любому из пп.1-8, в котором указанное соединение вводится в дозе от 15 до 25 мг/м 2,причем преднизон или преднизолон вводят в дозе 10 мг/день. 10. Способ по п.9, в котором указанное соединение вводится в дозе 25 мг/м 2. 11. Способ по любому из пп.1-10, который включает повторное введение указанного соединения в виде нового цикла каждые 3 недели. 12. Способ по п.11, где среднее число циклов равно 6. 13. Способ по любому из пп.1-12, в котором указанное соединение вводится в комбинации с преднизоном при его применении в качестве лекарственного средства для лечения пациентов с кастрационнорезистентным метастатическим раком простаты или гормон-рефрактерным раком простаты, которых ранее лечили по схемам, основанным на применении доцетаксела. 14. Способ по п.13, в котором указанное соединение представляет собой кабазитаксел. 15. Способ по любому из пп.1-14, где дополнительно осуществляется мониторинг анализов крови и измерение уровней нейтрофилов у пациента. 16. Способ по п.15, где указанный мониторинг включает отбор образцов крови у пациента. 17. Способ по п.16, где дополнительно прекращают введение кабазитаксела пациенту с количеством нейтрофилов 1500 клеток/мм 3. 18. Применение соединения формулы которое может иметь форму основания или форму гидрата или сольвата, в комбинации с преднизоном или преднизолоном для лечения рака простаты. 19. Способ по п.1, дополнительно включающий мониторинг анализов крови пациента с постоянными интервалами во время лечения этого пациента; уменьшение дозы указанного соединения, если у пациента возникла фебрильная нейтропения или продолжительная нейтропения; прекращение лечения,если количество нейтрофилов у пациента 1500 клеток/мм 3; и необязательно, возобновление лечения,когда количество нейтрофилов у пациента возвращается на уровень 1500 клеток/мм 3. 20. Способ по п.19, дополнительно включающий введение пациенту G-CSF перед введением указанного соединения, где считается, что для указанного пациента имеется повышенный риск осложнений,связанных с нейтропенией. 21. Способ по п.1, в котором указанное соединение является кабазитакселом и до введения кабазитаксела для снижения риска тяжелой аллергической реакции пациенту вводят лекарственное средство для предупреждения аллергии. 22. Способ увеличения продолжительности жизни пациента с гормон-рефрактерным метастатическим раком простаты, включающий введение пациенту клинически доказанного эффективного количества соединения формулы
МПК / Метки
МПК: A61K 31/56, A61K 45/06, A61K 31/164, A61P 35/00
Метки: применение, преднизолоном, лечения, кабазитаксела, рака, преднизоном, простаты, комбинации
Код ссылки
<a href="https://eas.patents.su/18-24186-primenenie-kabazitaksela-v-kombinacii-s-prednizonom-ili-prednizolonom-dlya-lecheniya-raka-prostaty.html" rel="bookmark" title="База патентов Евразийского Союза">Применение кабазитаксела в комбинации с преднизоном или преднизолоном для лечения рака простаты</a>
Предыдущий патент: Способ обработки волос
Следующий патент: Способ получения по меньшей мере одного производного этилена
Случайный патент: Модифицированная зерновая мука для изготовления бумаги и способ ее производства