Спирооксетановые производные урацилсодержащих нуклеозидов
Номер патента: 22084
Опубликовано: 30.10.2015
Авторы: Ван Хоф Стивен Морис Паула, Тахри Абделлах, Йонкерс Тим Хьюго Мария, Ху Лили, Рабуассон Пьер Жан-Мари Бернар, Вандик Коэн
Формула / Реферат
1. Соединение формулы (I)
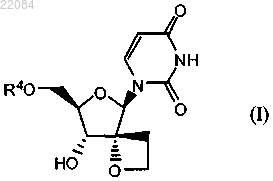
включая его любые возможные стереоизомеры,
где R4 представляет собой монофосфатную, дифосфатную или трифосфатную сложноэфирную группу или R4 представляет собой группу формулы
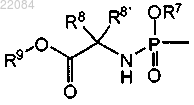
R7 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, каждый из которых, независимо друг от друга, выбирают из галогена или C1-C6-алкила, или R7 представляет собой нафтил;
R8 представляет собой водород или C1-C6-алкил;
R8' представляет собой водород или C1-C6-алкил или
один из R8 и R8' принимает также значение фенил;
R9 представляет собой C1-C6-алкил или бензил,
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, где R4 представляет собой группу формулы
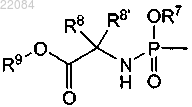
3. Соединение по любому из пп.1, 2, где R7 представляет собой фенил, необязательно замещенный галогеном или одной или двумя C1-C6-алкильными группами, или R7 представляет собой нафтил.
4. Соединение по любому из пп.1, 2, где R7 представляет собой фенил или нафтил.
5. Соединение по любому из пп.1-4, где R8 представляет собой водород и R8' представляет собой водород или C1-C6-алкил.
6. Соединение по любому из пп.1-5, где R8 представляет собой водород и R8' представляет собой метил или этил.
7. Соединение по любому из пп.1-6, где R9 представляет собой н-бутил или бензил.
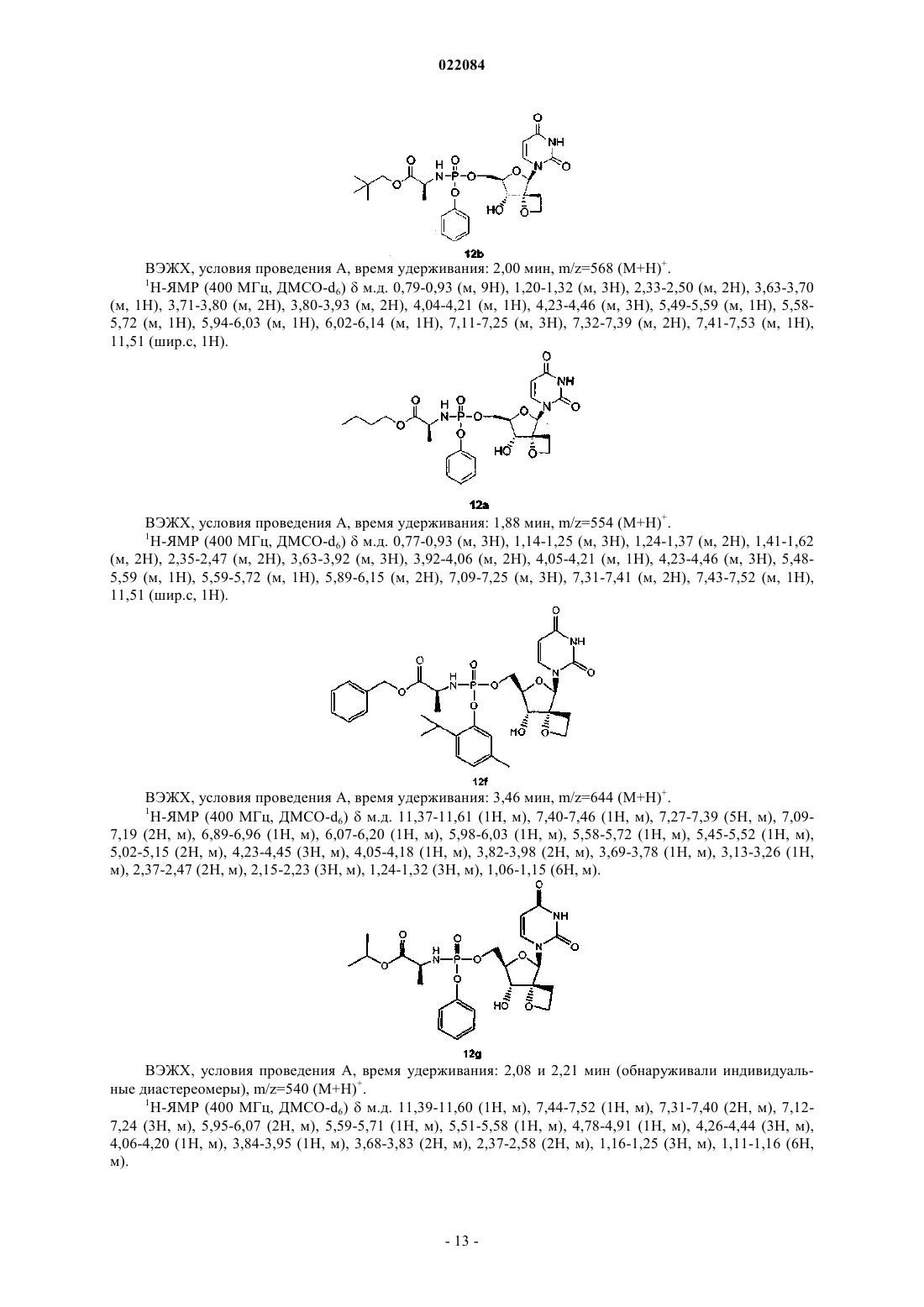
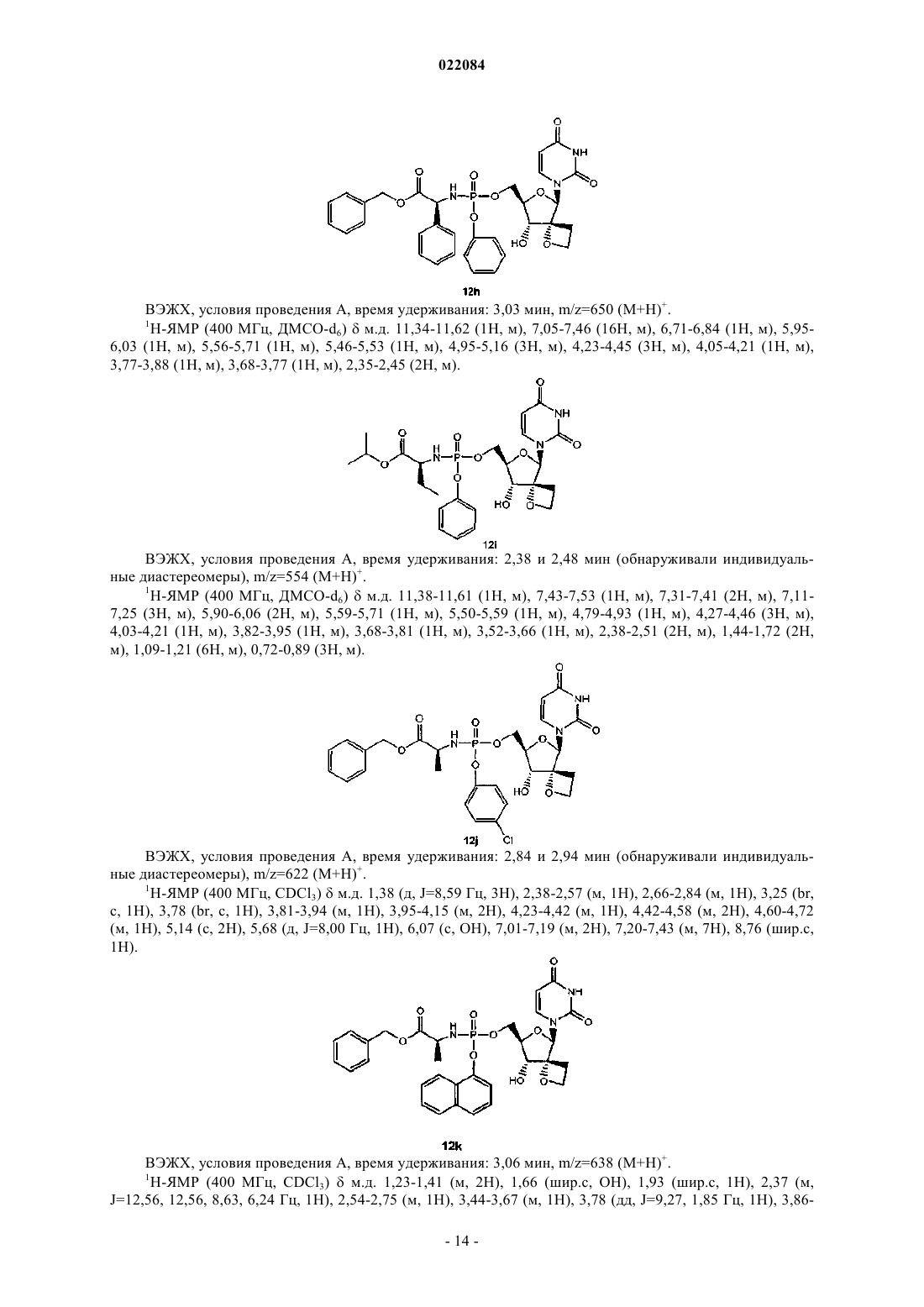
8. Соединение по п.1, где соединение формулы (I) представляет собой:
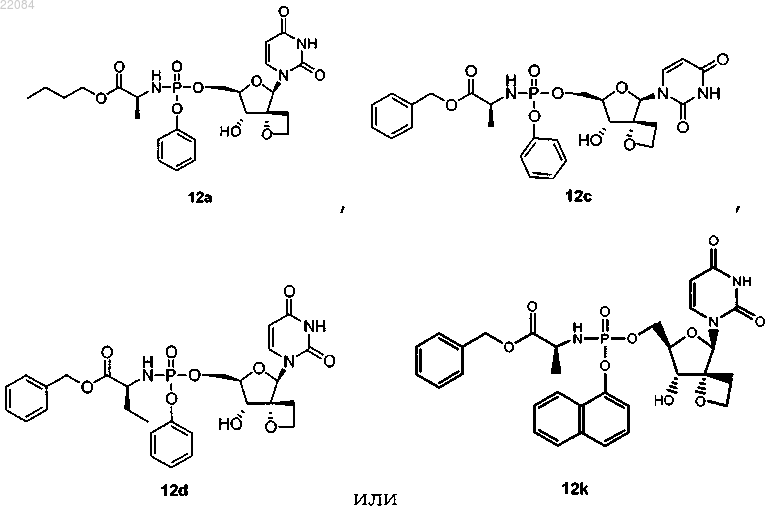
9. Фармацевтическая композиция, содержащая противовирусно эффективное количество соединения формулы (I) по любому из пп.1-8 и фармацевтически приемлемый носитель.
10. Применение соединения по любому из пп.1-8 в качестве ингибитора вируса HCV.
Текст
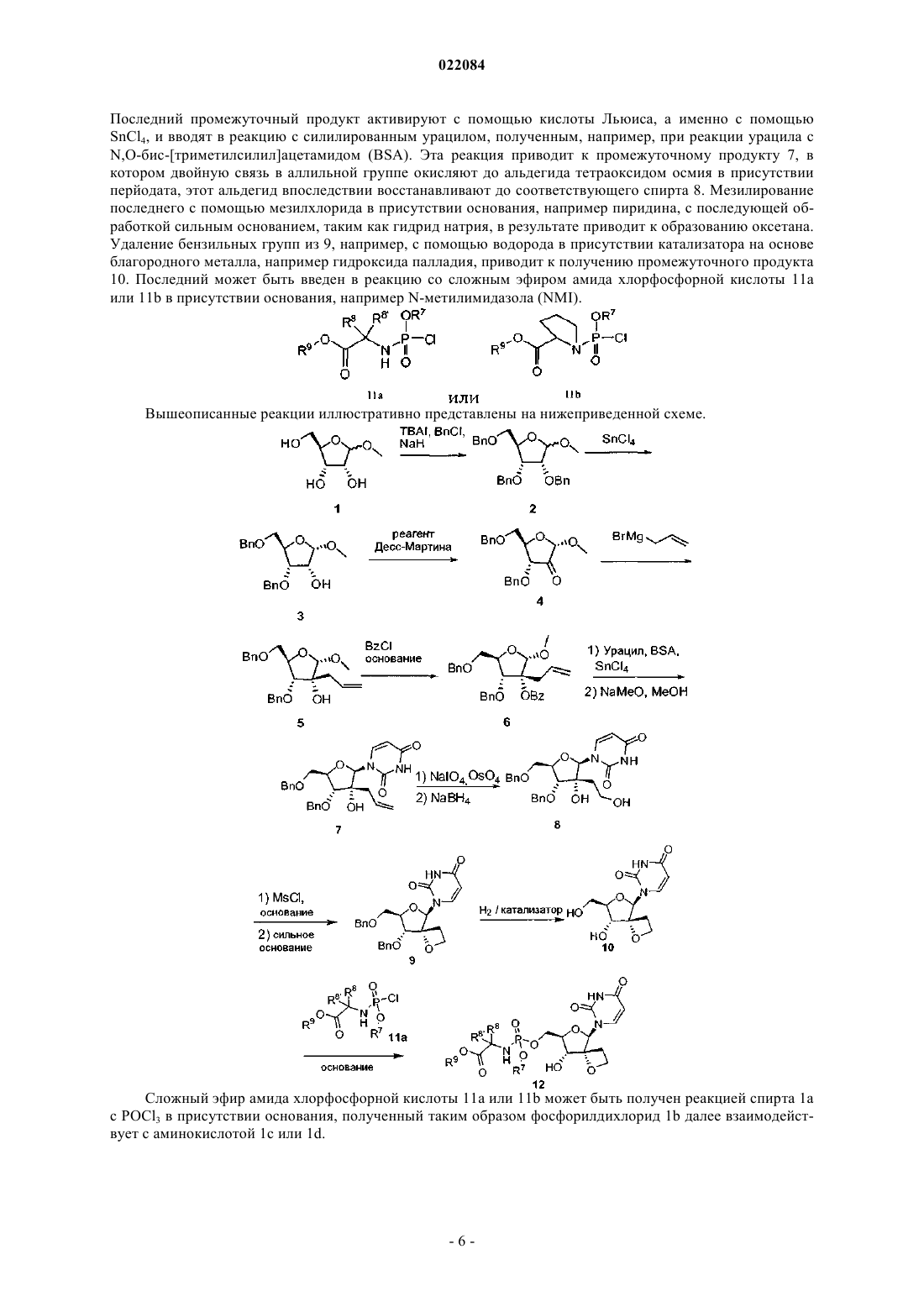
СПИРООКСЕТАНОВЫЕ ПРОИЗВОДНЫЕ УРАЦИЛСОДЕРЖАЩИХ НУКЛЕОЗИДОВ Раскрыты соединения формулы (I) Йонкерс Тим Хьюго Мария,Рабуассон Пьер Жан-Мари Бернар,Вандик Коэн, Ван Хоф Стивен Морис Паула, Ху Лили, Тахри Абделлах (BE) Медведев В.Н. (RU) включая их любые возможные стереоизомеры, где R4 представляет собой монофосфатную,дифосфатную или трифосфатную сложноэфирную группу или R4 представляет собой группу формулыR7 представляет собой необязательно замещенный фенил или нафтил; R8 представляет собой водород или C1-C6-алкил; R8' представляет собой водород или C1-C6-алкил; или один из R8 иR8' принимает также значение фенил; R9 представляет собой C1-C6-алкил или бензил; или их фармацевтически приемлемая соль или сольват; фармацевтическая композиция на их основе и применение соединений I в качестве ингибиторов вируса HCV. Предшествующий уровень техники Изобретение относится к спирооксетановым производным урацилсодержащих нуклеозодов, которые являются ингибиторами вируса гепатита С (HCV).HCV представляет собой одноцепочечный (+)РНК вирус, принадлежащий к семейству вирусов Flaviviridae, к роду гепатовирусов. Фрагмент NS5B полигена РНК кодирует РНК-зависимую РНКполимеразу (RdRp), которая необходима для репликации вируса. Как последствие первоначальной острой инфекции, у большинства инфицированных пациентов развивается хронический гепатит из-за того,что происходит репликация HCV преимущественно в гепатоцитах, но без явного цитопатического проявления. В частности, недостаток интенсивного ответного действия Т-лимфоцитов и сильная предрасположенность вируса к мутации, по всей видимости, способствуют высокой скорости развития хронического инфекционного процесса. Хронический гепатит может развиваться в фиброз печени, приводящий к циррозу, конечной стадии заболевания печени, и НСС (гепатоклеточную карциному), что делает его основной причиной необходимости трансплантации печени. Существует шесть основных генотипов HCV и более 50 подтипов, которые географически по-разному распределены. HCV генотипа 1 представляет собой преобладающий генотип в Европе и США. Экстенсивная генетическая гетерогенность HCV обусловливает существенные осложнения при диагностике и изучении симптомов течения болезни, возможно объясняя трудности в создании вакцины и недостаточную действенность существующей в настоящее время терапии. Передача HCV может происходить при контакте с зараженной кровью или препаратами крови, например, вследствие переливания крови или внутривенного применения лекарственного препарата. Внедрение диагностических тестов, применяемых при скрининге крови, приводит к тенденции понижения числа случаев постинфузионного HCV. Несмотря на то что обеспечивается медленное развитие конечной стадии заболевания печени, существующие инфекции будут оставаться, представляя собой серьезную медицинскую проблему и экономическое бремя на десятилетия. Существующая в настоящее время терапия HCV основывается на (пегилированном) интерферонеальфа (IFN-) в комбинации с рибавирином. Эта комбинированная терапия дает поддерживающий вирусологический контроль у более чем 40% пациентов, инфицированных HCV генотипа 1, и приблизительно у 80% пациентов, инфицированных HCV генотипов 2 и 3. Кроме ограниченной эффективности противHCV генопипа 1, эта комбинированная терапия имеет существенные побочные эффекты и плохо переносима многими пациентами. Большинство побочных эффектов включает подобные гриппу симптомы,гематологические нарушения и психоневрологические симптомы. Следовательно, существует потребность в более эффективных, удобных и лучше переносимых методах лечения. Опыт применения лекарственных препаратов против HIV, в частности ингибиторов HIV протеазы,указывает, что недостаточно оптимальная фармакокинетика и сложный режим дозировки незамедлительно приводят к неумышленным неудачам в соблюдении терапевтических рекомендаций. Это, в свою очередь, означает, что на 24 часу самая низшая точка концентрации (минимум концентрации в плазме) для соответствующих лекарственных препаратов при HIV состоянии часто опускается ниже IC90 илиED90 предельной величины для большей части суток. Следует принять во внимание, что на 24 часу самый низший уровень значений, по крайней мере, для IC50, и более реально для IC90 или ED90, весьма важен для сдерживания проявления "ускользнувших" от лекарственного препарата мутантов. Достижение необходимой фармакокинетики и метаболизма лекарственного препарата, которые обеспечивают такие самые низшие уровни значений, определяют точные перспективы дизайна лекарственного препарата.RdRp, кодируемый фрагментом NS5B, является существенным для репликации одноцепочечной(+)РНК HCV генома. Этот фермент вызывает особый интерес у специалистов в области медицинской химии. Известны как нуклеозидные, так и ненуклеозидные ингибиторы NS5B. Нуклеозидные ингибиторы могут действовать как терминатор цепи биосинтеза или как конкурентный ингибитор, или обоими способами. Чтобы быть активными, нуклеозидные ингибиторы должны поглощаться клеткой и превращаться in vivo в трифосфаты. Это превращение в трифосфаты обычно осуществляется посредством клеточных киназ, которые привносят дополнительные структурные требования к потенциальному ингибитору нуклеозидной полимеразы. Кроме того, это ограничивает прямую оценку нуклеозидов в качестве ингибиторов репликации HCV при испытаниях на клетках, способных к фосфорилированию in situ. Несколько попыток было предпринято для выявления нуклеозидов, являющихся ингибиторамиHCV RdRp, но несмотря на то, что для небольшого количества соединений начали проводить клинические испытания, ни одно соединение не прошло до конца регистрации. В числе проблем, из-за которых нуклеозиды, имеющие своей мишенью HCV, сталкиваются с трудностями их продвижения, представляются следующие: токсичность, мутагенность, отсутствие селективности, низкая эффективность, низкая биологическая доступность, недостаточно оптимальные режимы дозировки и получающиеся в результате большие масса таблетки и стоимость товара. Существует потребность в ингибиторах HCV, которые могут преодолеть недостатки существующей в настоящее время терапии HCV, такие как побочные эффекты, ограниченная эффективность, возникновение устойчивости и отсутствие соблюдения режима терапии, а также и способствовать устойчивому вирусологическому ответу. Настоящее изобретение касается группы ингибирующих HCV производных 1-(8-гидрокси-7(гидроксиметил)-1,6-диоксаспиро[3.4]октан-5-ил)пиримидин-2,4-диона с полезными свойствами, касающимися одного или нескольких нижеприведенных параметров: антивирусная эффективность, благоприятный профиль развития устойчивости, отсутствие токсичности и генотоксичности, подходящие фармакокинетика и фармакодинамика, и простота приготовления препарата и введения. Спирооксетановые производные нуклеозидов, а именно 1-(2-O,2-С-этаноD-рибофуранозил)тимин и 1-(2-O,2-С-этаноDрибофуранозил)урацил, описаны в Org. Biomol. Chem., 2003, 3514-3526. Эти соединения тестировали против HIV, но не было обнаружено активности. Соединения изобретения также могут быть перспективны благодаря тому факту, что у них отсутствует активность против других вирусов, а именно против HIV. HIV-инфицированные пациенты часто страдают от сопутствующих инфекций, таких как HCV. Лечение таких пациентов с помощью ингибитораHCV, который также ингибирует и HIV, может привести к появлению устойчивых к HIV штаммов. Описание сущности изобретения В одном аспекте настоящее изобретение предоставляет соединения, которые могут быть представлены формулой (I) включая их любые возможные стереоизомеры, гдеR4 представляет собой монофосфатную, дифосфатную или трифосфатную сложноэфирную группу или R4 представляет собой группу формулыR7 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, каждый из которых, независимо друг от друга, выбирают из галогена или C1-C6-алкила, или R7 представляет собой нафтил;R8 представляет собой водород или C1-C6-алкил;R8' представляет собой водород или C1-C6-алкил или один из R8 и R8' принимает также значение фенил;R9 представляет собой C1-C6-алкил или бензил,или их фармацевтически приемлемая соль или сольват. В другом аспекте изобретение относится к фармацевтической композиции, содержащей противовирусно эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель. Дополнительно, в другом аспекте изобретение касается применения соединений формулы (I), как указано в этом документе, в качестве ингибитора вируса HCV. Группа -NH-C(R8)(R8')-С(=O)- может образовать аминокислотный остаток, который включает природные и неприродные аминокислотные остатки. Преимущественно интересными являются глицин (Gly) и диметилглицин (Dmg). Также представляют интерес такие аминокислотные остатки, в которых R8' представляет собой водород. Когда в последнем случае R8 отличен от водорода, аминокислотный остаток имеет хиральный центр и конфигурация при ассиметрическом атоме углерода может быть соответствующей L-аминокислоте. Примеры включают остатки аланина (Ala), валина (Val), изолейцина (Ile), -аминобутановой кислоты (ABA, также называемой как 2-аминомасляная кислота или этилглицин), фенилаланина (Phe) и фенилглицина (Phg), а именноL-Ala, L-Val, L-Ile, L-ABA, L-Phe и L-Phg. Подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или подгруппы соединений формулы (I), как определено в этом документе, в которых R4 представляет собой группу формулы Подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или подгруппы соединений формулы (I), как определено в этом документе, в которых:(a) R7 представляет собой фенил, необязательно замещенный галогеном или одной или двумя C1-C6 алкильными группами, или R7 представляет собой нафтил;(b) R7 представляет собой фенил или нафтил. Подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или под-2 022084 группы соединений формулы (I), как определено в этом документе, в которых R8 представляет собой водород и R8' представляет собой водород или C1-C6-алкил. Подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или подгруппы соединений формулы (I), как определено в этом документе, в которых R8 представляет собой водород, и R8' представляет собой метил или этил. Подгруппы соединений формулы (I) представляют собой такие соединения формулы (I) или подгруппы соединений формулы (I), как определено в этом документе, в которых R9 представляет собой нбутил или бензил.(f) R9 представляет собой С 3-С 7 циклоалкил. Представляют интерес соединения 12 а, 12 с, 12d и 12k: либо в свободной форме (т.е. не в форме соли) этих соединений, либо в виде их фармацевтически приемлемых кислотно-аддитивных солей. Соединения формулы (I) имеют несколько центров хиральности, а именно при атомах углерода 1',3' и 4'. Несмотря на то что стереохимия у этих атомов углерода определена, соединения могут демонстрировать по крайней мере 75%, предпочтительно по крайней мере 90%, а также в дополнение до 95% или до 98% энантиомерной чистоты для каждого хирального центра. Хиральность также может иметь место в заместителях, таких, для которых R4 представляет собой который может иметь хиральность у атома углерода, несущего R8 (когда R8 и R8' различны), и у атома фосфора. Фосфорный хиральный центр может быть представлен как Rp, или как SP, или как смесь таких стереоизомеров, включая рацематы. Диастереомеры, происхождение которых возможно в результате наличия хирального фосфорного центра и хирального атома углерода, также могут существовать. Как указано выше, соединение формулы (I) или его фармацевтически приемлемая соль или сольват применяются в качестве ингибитора вируса HCV. Типичные генотипы HCV в соответствии с изобретением включают генотип 1b (преобладающий в Европе) или 1 а (преобладающий в Северной Америке). Соединения формулы (I) представлены в виде определенного стереоизомера, за исключением стереоизомеризации при фосфорном атоме фосфорамидатной группы. Абсолютную конфигурацию таких соединений можно определить, используя способы, известные в данной области техники, такие как, например,дифракция рентгеновских лучей или ЯМР, и/или по причастности к исходным веществам с известной стереохимией. Фармацевтические композиции в соответствии с изобретением предпочтительно будут включать стереоизомерно чистые формы указанного стереоизомера индивидуального соединения формулы (I). Стереоизомерно чистые формы соединений и промежуточных продуктов, упоминаемых в этом документе, определяются как изомеры, по существу, свободные от других энантиомерных или диастереомерных форм таких же базовых молекулярных структур указанных соединений или промежуточных продуктов. А именно, термин "стереоизомерно чистые" имеет отношение к соединениям или к промежуточным продуктам, имеющим стереоизомерный избыток, по крайней мере, от 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) и до стереоизомерного избытка 100% (т.е. 100% одного изомера и полное отсутствие других), более конкретно, имеет отношение к соединениям или к промежуточным продуктам, имеющим стереоизомерный избыток от 90 и до 100%, еще более конкретно, к имеющим стереоизомерный избыток от 94 и до 100% и наиболее конкретно, к имеющим стереоизомерный избыток от 97 и до 100% или от 98 до 100%. Термины "энантиомерно чистые" и "диастереоизомерно чистые" следует понимать аналогичным образом, но в таком случае как имеющие отношение к энантиомерному избытку и к диастереоизомерному избытку, соответственно, при анализе смеси. Чистые стереоизомерные формы соединений и промежуточных продуктов этого изобретения могут быть получены посредством применения методик, известных в данной области техники. Например,энантиомеры могут быть отделены один от другого посредством селективной кристаллизации их диастереомерных солей с оптически активными кислотами или основаниями. Их примеры представляют собой винную кислоту, дибензоилвинную кислоту, дитолилвинную кислоту и камфорсульфоновую кислоту. Альтернативно, энантиомеры могут быть разделены хроматографическими методами с использованием хиральных неподвижных фаз. Указанные химически чистые стереоизомерные формы также могут быть получены из соответствующих химически чистых стереоизомерных форм подобранных исходных веществ, при условии, что реакция протекает стереоспецифично. Предпочтительно, в том случае, если необходим определенный стереоизомер, указанное соединение синтезируют посредством стереоспецифических способов получения. Для этих способов предпочтительно использовать энантиомерно чистые исходные вещества. Диастереомерные рацематы соединений формулы (I) могут быть получены в разделенном виде посредством общепринятых способов. Подходящие физические способы разделения, которые успешно могут быть использованы, представляют собой, например, селективную кристаллизацию и хроматографию,например колоночную хроматографию. Фармацевтически приемлемые кислотно-аддитивные соли включают терапевтически активные нетоксичные формы соединений формулы (I), полученные в виде кислотно-аддитивных солей или основноаддитивных солей. Представляют интерес и свободные, т.е. несолевые формы соединений формулы (I) или какой-либо подгруппы соединений формулы (I), указанных в этом документе. Фармацевтически приемлемые кислотно-аддитивные соли могут быть обычно получены посредством обработки основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористо-водородная или бромисто-водородная кислота, серная, азотная, фосфорная и им подобные кислоты; или органические кислоты,такие как, например, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая(т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная (т.е. гидроксибутандиовая кислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая кислота, салициловая, п-аминосалициловая, памовая кислота и им подобные кислоты. И наоборот, указанные солевые формы при обработке подходящим основанием могут быть превращены в свободные основные формы. Соединения формулы (I), содержащие кислотный протон, могут также быть превращены в их нетоксичные аддитивные солевые формы металла или амина посредством обработки подходящими органическими или неорганическими основаниями. Подходящие основные солевые формы включают, например, аммонийные соли, соли щелочного или щелочно-земельного металла, например литиевые, натриевые, калиевые, магниевые, кальциевые соли и им подобные, соли с органическими основаниями,например бензатиновые, N-метил-D-глюкаминовые, гидрабаминовые соли и соли с аминокислотами,такими как, например, аргинин, лизин и им подобные. Термин "сольваты" охватывает любые фармацевтически приемлемые сольваты, которые соединения формулы (I), а также и их соли способны образовать. Такие сольваты представляют собой, например,гидраты, алкоголяты, например этаноляты, пропаноляты и им подобные. Некоторые соединения формулы (I) также могут существовать в виде их таутомерных форм. Например, таутомерные формы амидных групп (-C(=O)-NH-) представляют собой иминоспирты(-C(OH)=N-), которые могут стать более стабильными в кольцевых структурах ароматического характера. Уридиновое основание представляет собой пример такой формы. Такие формы, несмотря на то что они точно не указаны в структурных формулах, представленных в этом документе, подразумеваются включенными в объем настоящего изобретения. Как используется в этом документе, "С 1-С 4 алкил", как группа или часть группы, обозначает насыщенные линейные или с разветвленной цепью углеводородные радикалы, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2 метил-2-пропил. "С 1-С 6 алкил" охватывает C1-C4-алкильные радикалы и их более высшие гомологи, име-4 022084 ющие 5 или 6 атомов углерода, такие как, например, 1-пентил, 2-пентил, 3-пентил, 1-гексил, 2-гексил, 2 метил-1-бутил, 2-метил-1-пентил, 2-этил-1-бутил, 3-метил-2-пентил и им подобные. Среди C1-C6-алкилов представляют интерес C1-C4-алкилы. "C1-C10-алкил" охватывает C1-C6-алкильные радикалы и их более высшие гомологи, имеющие 7, 8, 9 или 10 атомов углерода, такие как, например, гептил, 2-гептил, 3 гептил, 2-метилгексил, октил, 2-октил, 3-октил, нонил, 2-нонил, 3-нонил, 2-бутилпентил, децил, 2-децил и им подобные. Среди C1-C10-алкилов представляют интерес С 1-С 6-алкил, C1-С 2-алкил, обозначаемые как метил и этил."C3-C6-циклоалкил" включает циклопропил, циклобутил, циклопентил и циклогексил. Вызывающий интерес представляет собой циклопропил. Термин "С 3-С 6-алкенил", как группа или часть группы, обозначает насыщенные линейные и с разветвленной цепью углеводородные радикалы, имеющие насыщенные углерод-углеродные связи и, по крайней мере, одну двойную связь, и имеющие от 3 до 6 атомов углерода, такие как, например, 1 пропенил, 2-пропенил (или аллил), 1-бутенил, 2-бутенил, 3-бутенил, 2-метил-2-пропенил, 2-пентенил, 3 пентенил, 2-гексенил, 3-гексенил, 4-гексенил, 2-метил-2-бутенил, 2-метил-2-пентенил и им подобные. Среди С 3-С 6-алкенилов представляет интерес С 3-С 4-алкенил. Среди С 3-С 6-алкенилов или С 3-С 4 алкенилов представляют интерес такие радикалы, которые имеют одну двойную связь. Термин "галоген" является общим для фтора, хлора, брома и йода. В одном варианте осуществления изобретения термин "фенил-C1-C6-алкил" представляет собой бензил. Как используется в этом документе, термин "(=O)" или "оксо" образует карбонильный фрагмент в том случае, когда присоединен к углеродному атому. Следует заметить, что атом может быть замещен оксо-группой, только когда валентность этого атома дает такую возможность. Термин "монофосфатный, дифосфатный или трифосфатный сложный эфир" относится к группам: В том случае, когда положение радикала в молекулярном фрагменте не определено (например, заместитель в фениле) или представлено связями, жестко не закрепленными, тогда такой радикал может быть расположен на любом атоме такого фрагмента, если получающаяся в результате структура представляет собой химически стабильную. В том случае, когда возможность перемены расположения в молекуле присутствует более чем в одном варианте, тогда каждое определенное расположение обеспечивается независимо. Всякий раз, когда используется в этом документе, термин "соединения формулы (I)" или "представленные здесь соединения" или аналогичные термины, подразумевается, что он включает соединения формулы (I), включая возможные стереоизомерные химические формы и их фармацевтически приемлемые соли и сольваты. Соединения формулы (I) или любой подгруппы формулы (I) могут быть изотопно-меченными, т.е. один или несколько атомов могут быть заменены на изотоп, отличающийся от такового обычного, обнаруженного в природе. Примеры таких изотопов включают изотопы водорода, такие как 2 Н и 3 Н; углерода, такие как 11 С, 13 С и 14 С; азота, такие как 13N и 15N; кислорода, такие как 15O, 17O и 18O; фосфора, такие как 31 Р и 32 Р, серы, такой как 35S; фтора, такой как 18F; хлора, такой как 36Cl; брома, такие как 75Br, 76Br,77Br и 82Br; и йода, такие как 123I, 124I, 125I и 131I. Изотопно-меченные соединения могут быть получены посредством таких способов, которые аналогичны способам, описанным в этом документе, при использовании соответствующих изотопно-меченных реагентов или исходных веществ, или посредством методик, известных в данной области техники. Выбор изотопа, включаемого в изотопно-меченное соединение, зависит от конкретного применения этого соединения. Например, для проведения биологических испытаний распределения в тканях используют включение таких радиоактивных изотопов, как 3 Н или 14 С. Для приборов, получающих изображение за счет радиоактивного излучения, будет пригоден позитрон-излучающий изотоп, такой как 11 С, 18F, 13N или 15O. Включение дейтерия может обеспечить большую метаболическую стабильность, приводящую в результате, например, к возрастанию in vivo периода полувыведения соединения или к снижению требуемой дозировки. Методики синтеза. Исходное вещество 1-[(4R,5R,7R,8R)-8-гидрокси-7-(гидроксиметил)-1,6-диокса-спиро[3.4]октан-5 ил]пиримидин-2,4(1 Н,3 Н)-дион 10 может быть получено нижеописанным путем. Промежуточный продукт 4 может быть получен, как описано в Org. Lett., 2007, 9, 3009-3012, и введен в реакцию с аллилмагнийбромидом, с получением промежуточного продукта 5. Гидроксильная группа в последнем бензоилируется с помощью бензоилхлорида в присутствии основания, например триалкиламина, такого как триэтиламин или N,N-диметилпиридин-4-амин (DMAP), в результате получается промежуточный продукт 6. Последний промежуточный продукт активируют с помощью кислоты Льюиса, а именно с помощьюSnCl4, и вводят в реакцию с силилированным урацилом, полученным, например, при реакции урацила сN,О-бис-[триметилсилил]ацетамидом (BSA). Эта реакция приводит к промежуточному продукту 7, в котором двойную связь в аллильной группе окисляют до альдегида тетраоксидом осмия в присутствии перйодата, этот альдегид впоследствии восстанавливают до соответствующего спирта 8. Мезилирование последнего с помощью мезилхлорида в присутствии основания, например пиридина, с последующей обработкой сильным основанием, таким как гидрид натрия, в результате приводит к образованию оксетана. Удаление бензильных групп из 9, например, с помощью водорода в присутствии катализатора на основе благородного металла, например гидроксида палладия, приводит к получению промежуточного продукта 10. Последний может быть введен в реакцию со сложным эфиром амида хлорфосфорной кислоты 11 а или 11b в присутствии основания, например N-метилимидазола (NMI). Вышеописанные реакции иллюстративно представлены на нижеприведенной схеме. Сложный эфир амида хлорфосфорной кислоты 11 а или 11b может быть получен реакцией спирта 1 а с POCl3 в присутствии основания, полученный таким образом фосфорилдихлорид 1b далее взаимодействует с аминокислотой 1 с или 1d. В следующем аспекте настоящее изобретение имеет отношение к фармацевтической композиции,содержащей терапевтически эффективное количество соединения формулы (I), как указано в этом документе, и фармацевтически приемлемый носитель. Указанная композиция может содержать от 1 до 50% или от 10 до 40% соединения формулы (I), и оставшаяся часть композиции приходится на указанный носитель. Терапевтически эффективное количество в этом контексте представляет собой количество,достаточное для воздействия в профилактических целях против инфекции HCV, с целью ингибированияHCV, стабилизации состояния или ослабления инфекции HCV у инфицированных пациентов или у субъектов, подверженных риску инфицирования. И еще в следующем аспекте это изобретение имеет отношение к способу получения фармацевтической композиции, как указано в этом документе, который включает тщательное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединение формулы (I), как указано в этом документе. Соединения формулы (I) или любые их подгруппы могут быть технологически переработаны в различные фармацевтические формы для их введения. В качестве подходящих композиций можно перечислить все композиции, обычно применяемые для систематически вводимых лекарственных средств. Для получения фармацевтических композиций этого изобретения эффективное количество индивидуального соединения, необязательно в виде солевой формы или металлокомплекса, в качестве активного ингредиента объединяется с добавляемым путем тщательного смешивания фармацевтически приемлемым носителем, причем этот носитель может быть в широко разнообразных формах, в зависимости от формы лекарственного средства, необходимой для введения. Такие фармацевтические композиции желательны в виде единичной дозированной формы, удобной, в частности, для перорального, ректального, чрескожного введения или для парентеральной инъекции. Например, при получении композиций в виде дозированной формы для перорального введения можно применять любую общепринятую фармацевтическую среду, такую как, например, вода, гликоли, масла, спирты и им подобные, в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие вещества, дезинтегрирующие агенты и им подобные - в случае порошков, пилюль, капсул и таблеток. Из-за простоты их введения таблетки и капсулы представляют собой обладающие наибольшим преимуществом пероральные единичные дозированные формы, в случае которых естественно применяются твердые фармацевтические носители. Для парентеральных композиций носитель, как правило, будет включать стерильную воду, по крайней мере, в качестве наибольшей своей составляющей части, тем не менее могут быть включены и другие ингредиенты,например, для увеличения солюбилизации. Растворы для инъекций, например, могут быть приготовлены таким образом, что в них носитель включает солевой раствор, раствор глюкозы или смесь раствора солевого и раствора глюкозы. Суспензии для инъекций также могут быть получены, в этом случае могут применяться подходящие жидкие носители, суспендирующие агенты и им подобные вещества. Также учитываются твердые формы препаратов, предназначенные для превращения в жидкую форму препарата непосредственно перед применением. В композициях, подходящих для введения через кожу, носитель необязательно включает вещество, увеличивающее проникновение, и/или подходящий увлажняющий агент, необязательно объединенный с подходящими вспомогательными веществами любой природы при их небольшом количественном содержании, причем эти вспомогательные вещества не привносят выраженного вредного воздействия на кожу. Соединения настоящего изобретения могут также вводиться посредством пероральной ингаляции или инсуффляции в форме раствора, суспензии или сухого порошка с использованием какой-либо системы доставки в соответствии с известным уровнем техники. Особо предпочтительной представляется разработка технологии получения вышеупомянутых фармацевтических композиций в виде единичной дозированной формы для простоты введения и для равномерности дозирования. Единичная дозированная форма, как используется в этом документе, обозначает физически дискретные единицы, подходящие в качестве унитарных дозировок, причем каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное, чтобы вызвать требуемый терапевтический эффект в сочетании с соответствующим фармацевтическим носителем. Примеры таких единичных дозированных форм представляют собой таблетки (включая таблетки с насечкой или покрытые оболочкой таблетки), капсулы, пилюли, суппозитории, пакетики с порошком, пластинки,растворы или суспензии для инъекций и им подобные, и их сегрегированные множенные единицы. Соединения формулы (I) проявляют активность против HCV и могут применяться при лечении и профилактике инфекции HCV или заболеваний, связанных с HCV. Последние включают прогрессирую-7 022084 щий фиброз печени, воспаление и некроз, ведущие к циррозу, последней стадии заболевания печени, и гепатоцеллюлярную карциному (НСС). Более того, ряд соединений этого изобретения, как предполагается, активны против подвергшихся мутации штаммов HCV. Кроме того, многие соединения этого изобретения демонстрируют благоприятный фармакокинетический профиль и обладают привлекательными свойствами в отношении биодоступности, включая приемлемый период полувыведения, AUC (площадь под кривой) и максимальные значения, и отсутствующие неблагоприятные явления, такие как недостаточно быстрое проявление действия и задержка нахождения в тканях. Противовирусная активность in vitro, против HCV, для соединений формулы (I) может быть протестирована на клеточной модели HCV в системе контроля репликации, основываясь на публикации Lohmann et al. (1999), Science 285:110-113, с последующими модификациями, описанными в работе Krieger etal. (2001), Journal of Virology 75: 4614-4624 (включены в этот документ путем ссылки), что далее представлено в разделе примеров. Эта модель, несмотря на то что она не является всеохватывающей моделью инфекции HCV, представляет собой широко признанную в качестве существующей на данный момент надежной и эффективной модели автономной репликации РНК HCV. Следует принять во внимание, что важно видеть различие между соединениями, которые специфически вмешиваются в функционированиеHCV, и теми соединениями, которые оказывают влияние в виде цитотоксических или цитостатических эффектов на модели репликации HCV, и результатом этого является процесс уменьшения биосинтеза РНК HCV или/и концентрации связанного с этим фермента. Биологические испытания, известные в области определения цитотоксичности на клеточном уровне, базируются, например, на активности митохондриальных ферментов с использованием красителей, флуоресцирующих при окислительновосстановительных процессах, таких как резазурин. Более того, прибор для подсчета клеток показывает наличие характеристики неселективного ингибирования активности связанного с этим гена, такого как ген люциферазы светлячка. Подходящие типы клеток, которые можно снабдить посредством стабильной трансфекции геном-репортером люциферазы, у которого экспрессия зависит от конститутивноактивного генного промотера, и такие клетки можно использовать как счетчик, производящий отбор с исключением неселективных ингибиторов. Благодаря их противо-HCV свойствам, соединения формулы (I), включая любые возможные стереоизомеры, их фармацевтически приемлемые аддитивные соли или сольваты, представляют собой пригодные к применению для лечения теплокровных животных, и в особенности, людей, инфицированныхHCV, и для профилактики инфекций HCV. Соединения настоящего изобретения, следовательно, могут применяться в качестве лекарственного средства, а именно в качестве противо-HCV или HCVингибирующего лекарственного средства. Настоящее изобретение также связано с применением настоящих соединений в производстве лекарственного средства для лечения или профилактики инфекции HCV. В другом дополнительном аспекте настоящее изобретение связано со способом лечения теплокровных животных, и в особенности человека, инфицированных HCV или рискующих стать инфицированнымиHCV, причем указанный способ включает введение противо-HCV эффективного количества соединения формулы (I), как указано в этом документе. Указанное применение в качестве лекарственного средства или способ лечения включает в себя систематическое введение HCV-инфицированным пациентам или субъектам, подверженным инфекции HCV, количества средства, эффективного для противодействия условиям, связанным с инфекцией HCV. В общем случае предполагается, что противовирусное эффективное суточное количество должно составлять от приблизительно 1 до приблизительно 200 мг/кг, или приблизительно от 5 до приблизительно 175 мг/кг, или приблизительно от 10 до приблизительно 150 мг/кг, или приблизительно от 20 до приблизительно 100 мг/кг, или приблизительно от 50 до приблизительно 75 мг/кг массы тела. Средняя величина суточных доз может быть получена путем умножения этих суточных количеств приблизительно на 70. Может быть целесообразным вводить необходимую дозу в виде двух, трех, четырех или в виде большего количества суб-доз с определенными интервалами в течение дня. Указанные суб-дозы могут быть произведены в виде единичных дозированных форм, например, содержащих приблизительно от 1 до приблизительно 5000 мг, или приблизительно от 50 до приблизительно 3000 мг, или приблизительно от 100 до приблизительно 1000 мг, или приблизительно от 200 до приблизительно 600 мг, или приблизительно от 100 до приблизительно 400 мг активного ингредиента на единичную дозированную форму. Используемый здесь термин "приблизительно" имеет значение, хорошо известное специалисту в данной области техники. В некоторых конкретных вариантах осуществления изобретения термин "приблизительно" может быть пропущен и тогда имеют в виду точное количество. В других примерах осуществления изобретения термин "приблизительно" обозначает, что число, следующее за термином "приблизительно", попадает в диапазон 15%, или в диапазон 10%, или в диапазон 5%, или в диапазон 1% от указанного числового значения. Примеры Нижеприведенные схемы предназначены всего лишь для иллюстративных целей и не предназначены для ограничения объема изобретения. Результаты анализа с помощью сочетания методов жидкостной хроматографии и массспектрометрии (LC-MS) получали с использованием какого-либо из нижеприведенных методов. Данные ЯМР-спектров получали на спектрофотометре Bruker 400 МГц. ВЭЖХ, условия проведения А: система: Waters Alliance 2695; колонка: Waters XTerra 2,5 мкм 4,650 мм; температура колонки: 55 С; скорость элюирования: 2 мл/мин; подвижная фаза А: 10 мМ ацетата аммония+0,1% НСООН в Н 2 О; подвижная фаза В: CH3CN ВЭЖХ, условия проведения В: система: Waters Alliance 2695; колонка: Hypercarb 3 мкм 4,650 мм; температура колонки: 50 С; скорость элюирования: 2 мл/мин; подвижная фаза А: 10 мМ ацетата аммония в H2O/CH3CN 1/9; подвижная фаза В: 10 мМ ацетата аммония в H2O/CH3CN 9/1 В атмосфере аргона к раствору 4 (полученному согласно Org. Lett., 2007, 9, 3009-3012) в сухом тетрагидрофуране (ТГФ; 400 мл) при -78 С добавляли аллилмагнийбромид (400 мл, 400 ммоль, 1,0 М в диэтиловом эфире). После перемешивания реакционной массы при -78 С в течение 4 ч реакционную массу оставляли перемешиваться при комнатной температуре в течение 2 ч. Реакцию осторожно гасили с помощью насыщенного водного раствора хлорида аммония. Смесь экстрагировали дихлорметаном и органический слой промывали соляным раствором. Растворитель удаляли и остаток очищали с помощью хроматографии на силикагеле (600 г силикагеля), элюируя в градиенте от 15 до 20% этилацетата в гексане, получали реакционный продукт 5 в виде бесцветного масла (32,9 г, 70%). ВЭЖХ, условия проведения А, время удерживания: 2,97 мин, m/z=402 (M+NH4)+. 1 К раствору соединения 5 (26,6 г, 69,2 ммоль) в сухом дихлорметане (500 мл) при комнатной температуре добавляли N,N-диметилпиридин-4-амин (DMAP; 2,113 г, 17,30 ммоль), триэтиламин (217 мл, 1557 ммоль) и бензоилхлорид (18,05 мл, 156 ммоль). Через 1 ч добавляли дополнительно бензоилхлорид (6 мл) и DMAP (2,1 г). Смесь перемешивали в течение 5 дней. Реакционную смесь затем перемешивали с 1 н. HCl и экстрагировали дихлорметаном. Органические слои объединяли и промывали насыщенным водным раствором NaHCO3, затем следовала промывка солевым раствором. После сушки с помощью MgSO4, фильтрования и упаривания летучих компонентов полученный остаток очищали с помощью колоночной хроматографии на силикагеле (400 г силикагеля),элюируя сначала гептаном и затем смесью, содержащей до 15% этилацетата в гептане, получали реакционный продукт в виде масла (в виде смеси с соединением 5). Смесь еще раз очищали, используя в качестве элюента CH2Cl2 (400 г силикагеля). Чистые фракции собирали и промежуточный продукт 6 получали в виде бесцветного масла (13,05 г, 39%). ВЭЖХ, условия проведения А, время удерживания: 3,41 мин, m/z=457 (M-OMe)+. 1 бис-(Триметилсилил)ацетамид (BSA; 29,2 мл, 118 ммоль) добавляли к смеси соединения 6 (14,0 г,23,1 ммоль) и урацила (5,99 г, 53,4 ммоль) в безводном ацетонитриле (300 мл). Реакционную смесь кипятили с обратным холодильником в течение 1 ч и прозрачный раствор оставляли охлаждаться до комнатной температуры. Хлорид олова (11,55 мл, 99 ммоль) добавляли по каплям при комнатной температуре и смесь далее перемешивали в течение 1 ч-. Смесь затем перемешивали при кипении с обратным холодильником в течение 1,5 ч и снова охлаждали до комнатной температуры. Этилацетат (250 мл) добавляли, затем добавляли насыщенный водный раствор NaHCO3 (250 мл) и смесь перемешивали в течение 15 мин. После фильтрования через целит органический слой отделяли и промывали насыщенным водным раствором NaHCO3 (250 мл). Объединенный водный слой экстрагировали этилацетатом (250 мл) и объединенный органический слой сушили (MgSO4), фильтровали и упаривали досуха при пониженном давлении. Полученное в результате желтое масло растворяли в метаноле и добавляли 25% метанолят натрия(15 мл) и перемешивание продолжали в течение ночи. Добавляли уксусную кислоту (30 мл) и растворитель удаляли. Остаток очищали с помощью колоночной хроматографии с элюентом, изменяющимся от гептан/этилацетат, 50:50 до 100% этилацетата. Промежуточный продукт 7 (9,38 г, 76%) был получен в виде бесцветного масла. ВЭЖХ, условия проведения А, время удерживания: 2,49 мин, m/z=465 (M+H)+. 1 К перемешиваемому раствору 7 (7,8 г, 16,79 ммоль) в смеси ТГФ (10 мл) и Н 2 О (10 мл) добавляли перйодат натрия (11,17 г, 52,2 ммоль), затем добавляли тетраоксид осмия(VIII) (2 мл, 2,5 мас./об.% в трет-бутаноле, 0,168 ммоль) и перемешивание продолжали в течение 2 ч при комнатной температуре. Добавляли воду (100 мл) и проводили экстракцию этилацетатом (250 мл). Органический слой промывали насыщенным водным раствором NaHCO3 (230 мл). Объединенный водный слой экстрагировали этилацетатом и объединенный органический слой сушили над Na2SO4, фильтровали и упаривали досуха при пониженном давлении. Полученное масло растворяли в смеси ТГФ (100 мл) и H2O (20 мл) и добавляли натрийборгидрид (1,361 г, 36,0 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, после чего добавляли воду (100 мл) и проводили экстракцию этилацетатом (250 мл). Объединенный органический слой промывали насыщенным водным раствором NaHCO3, объединенные водные слои экстрагировали этилацетатом, объединенные органический слой сушили над Na2SO4, фильтровали и упаривали досуха при пониженном давлении. Полученное масло очищали с помощью колоночной хроматографии, элюируя (0-10% (об./об.) метанолом в CH2Cl2, затем следовало изократическое элюирование 10% смесью), что позволяло получить реакционный продукт 8 в виде белой пенообразной пленки Метансульфонилхлорид (0,800 мл, 0,34 ммоль) добавляли к соединению 8 (4,32 г, 9,22 ммоль) в сухом пиридине (100 мл). Через 1 ч 15 мин добавляли дополнительно 0,1 экв. метансульфонилхлорида и далее смесь перемешивали при комнатной температуре в течение 45 мин. Затем добавляли небольшое количество метанола и смесь упаривали досуха. Остаток растворяли в этилацетате (100 мл) и промывали насыщенным раствором NaHCO3 (250 мл). Объединенный водный слой экстрагировали этилацетатом. Объединенный органический слой затем сушили над Na2SO4 и концентрировали в вакууме. Полученный остаток растворяли в сухом ТГФ и сразу же добавляли 95% NaH (932 мг, 36,9 ммоль) при комнатной температуре. После перемешивания в течение 2 ч при комнатной температуре реакционную смесь выливали в насыщенный водный раствор NH4Cl (30 мл), затем добавляли CH2Cl2 (250 мл). Отделенный органический слой промывали насыщенным водным раствором NaHCO3 (2100 мл) и объединенный водный слой экстрагировали CH2Cl2 (250 мл). Объединенный органический слой сушили над (Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии, элюируя сначала гептаном, затем этилацетатом, что позволяло получить соединение 9 (3,27 г, 79%) в виде пенообразной пленки. ВЭЖХ, условия проведения А, время удерживания: 2,33 мин, m/z=451 (M+H)+. 1 Н-ЯМР (400 МГц, CDCl3)м.д. 2,20-2,38 (м, 1 Н), 2,38-2,52 (м, 1 Н), 3,62-3,73 (м, 1 Н), 3,89-4,13 (м,3H), 4,38-4,56 (м, 3H), 4,56-4,68 (м, 1 Н), 4,70-4,88 (м, 2 Н), 5,25 (д, J=8,00 Гц, 1 Н), 6,25 (с, 1 Н), 7,18-7,47 Смесь соединения 9 (50 мг, 0,111 ммоль) в метаноле (1 мл) и Pd(OH)2 (8 мг) перемешивали в атмосфере водорода при комнатной температуре. Через 4 ч еще дополнительно добавляли Pd(OH)2 (30 мг) и метанол (1 мл). Смесь интенсивно перемешивали в атмосфере Н 2 в течение ночи. Катализатор удаляли фильтрованием через декалит и растворитель удаляли упариванием. Полученный в результате остаток очищали с помощью хроматографии на силикагеле, элюируя 10% метанолом в зтилацетате, получая промежуточный продукт 10 в виде белого порошка (16,8 мг; 56%). ВЭЖХ, условия проведения В, время удерживания: 1,98 мин, m/z=271 (M+H)+. 1(DIPEA; 2,0 экв., 26,0 ммоль, 4,3 мл) добавляли по каплям. Через 2 ч реакционную массу нагревали до комнатной температуры и растворитель удаляли при пониженном давлении. Добавляли сухой диэтиловый эфир, осадок отфильтровывали и дважды промывали сухим диэтиловым эфиром в атмосфере аргона. Фильтрат упаривали досуха, получая соединение 11, которое хранили в виде 0,90 М раствора в сухом тетрагидрофуране (ТГФ) при -18 С. Пример 8: метил 2-(4R,5R,7R,8R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2 Н)-ил)-8-гидрокси-1,6 диоксаспиро[3.4]октан-7-ил]метокси](фенокси)фосфориламино]-2-метилпропаноат (12 е) К раствору соединения 10 (1,0 экв., 0,28 ммоль, 75 мг) в сухом ТГФ (3 мл) добавляли 1 метилимидазол (NMI; 12,0 экв., 3,33 ммоль, 0,27 мл) при комнатной температуре. Раствор промежуточного продукта 11 (1,4 экв., 0,39 ммоль, 0,43 мл) добавляли по каплям и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь трижды промывали 0,5 М HCl. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: 0-10% метанол в CH2Cl2), получая соединение 12 е (24 мг, выход 15%,чистота 95%) в виде смеси диастереомеров. ВЭЖХ, условия проведения А, время удерживания: 1,49 мин, m/z=526 (M+H)+. 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 1,33 (с, 3H), 1,37 (с, 3H), 2,42-2,43 (м, 2 Н), 3,56 (с, 3H), 3,703,79 (м, 1 Н), 3,80-3.88 (м, 0,4 Н), 3,88-3,96 (м, 0,6 Н), 4,09-4,20 (м, 1 Н), 4,26-4,48 (м, 3H), 5,50-5,56 (м, 1 Н),5,61-5,69 (м, 1 Н), 5,88-5,97 (м, 1 Н), 5,97-6,04 (м, 1 Н), 7,12-7,24 (м, 3H), 7,31-7,41 (м, 2 Н), 7,44 (д, J=8,22 Гц, 0,4 Н), 7,52 (д, J=8,02 Гц, 0,6 Н), 11,49 (шир.с, 1 Н). Пример 9. Используя методику, аналогичную вышеизложенной, были получены нижеперечисленные соединения. В каждом случае анализ выполняли для смесей диастереомеров.H-ЯМР (400 МГц, CDCl3)м.д. 2,40-2,56 (м, 1 Н), 2,67-2,82 (м, 1 Н), 3,29 (шир.с, 1 Н), 3,71-3,97 (м,4 Н), 3,97-4,10 (м, 1 Н), 4,32-4,44 (м, 1 Н), 4,45-4,59 (м, 2 Н), 4,61-4,70 (м, 1 Н), 5,16 (с, 2 Н), 5,68 (д, J=7,80 Гц, 1 Н), 6,10 (д, J=6,44 Гц, 1 Н), 7,10-7,19 (м, 2 Н), 7,24-7,30 (м, 3H), 7,30-7,42 (м, 5 Н), 8,82 (шир.с, 1 Н). Биологические примеры Проведение исследования репликона. Соединения формулы (I) проверяли на наличие активности при ингибировании репликации РНКHCV в биологических испытаниях на клетках. Испытания использовали для демонстрации того, что соединения формулы (I) ингибируют клеточную репликацию для содержащей HCV клеточной линии, также известной как HCV репликоны. Испытания на клетках основывались на экспрессии гена в составе бицистронной конструкции, как описано в работе Lohmann et al. (1999), Science vol. 285 pp. 110-113, с использованием модификаций, описанных в работе Krieger et al. (2001), Journal of Virology 75: 4614-4624,при стратегии многоцелевого скрининга. По сути дела, способ заключался в следующем. При биологических испытаниях использовали устойчиво трансфецированную клеточную линию Huh-7 luc/neo (далее в этом документе обозначаемую какHuh-Luc). Эта клеточная линия содержит кодирующую РНК экспрессируемую бицистронную конструкцию, включающую NS3-NS5B фрагменты дикого типа немутантного HCV типа 1b, полученные при трансляции на участке внутренней посадки рибосомы (IRES) из вируса энцефаломиокардита (EMCV),находящиеся перед участком репортерного гена (FfL-люциферазы), и участок гена селектируемого маркера (neoR, неомицинфосфотрансферазы). На ограничивающих конструкцию 5'- и 3'-концах содержатсяNTR (нетранслируемые участки) генома HCV генотипа 1b. Функционирующая культура клеток, содержащих репликон, в присутствии G418 (neoR) зависит от процесса репликации РНК вируса HCV. Устойчиво трансфецированные репликоном клетки, в которых экспрессируется HCV РНК, имеющая высокий уровень автономной репликации, кодирующая, помимо всего прочего, люциферазу, применяли для скрининга антивирусных свойств соединений. Содержащие репликон клетки высевали в 384-луночные планшеты в присутствии тестируемых и контрольных соединений, которые добавляли в различных концентрациях. Далее проводили инкубацию в течение трех дней, HCV репликацию определяли с помощью измерения активности люциферазы (используя стандартные субстраты и реагенты для анализа люциферазы, и микропланшетную установку для визуализации Perkin Elmer ViewLux ultraHTS). Содержащие репликон клетки в контрольных культурах имели высокий уровень экспрессии гена люциферазы в отсутствии какого-либо ингибитора. Ингибитор 1 ную активность соединения в отношении активности люциферазы контролировали на клетках Huh-Luc,обеспечивая возможность построения графической зависимости "доза - характеристика получаемой активности" для каждого тестируемого соединения. Величины ЕС 50 рассчитывали, эти величины представляют собой количество соединения, требуемое для снижения уровня определяемой люциферазной активности на 50%, или, более конкретно, представляют способность генетически связанного с HCV репликона РНК к репликации. Результаты. Таблица показывает результаты анализа репликона (ЕС 50/ репликон) и результаты анализа цитотоксичности (СС 50 (мкМ) (Huh-7, полученные для соединений вышеприведенных примеров. Кроме того,указана HIV активность (ЕС 50 HIV (мкМ и клеточная токсичность для HIV клеточной линии (СС 50 включая его любые возможные стереоизомеры,где R4 представляет собой монофосфатную, дифосфатную или трифосфатную сложноэфирную группу или R4 представляет собой группу формулыR7 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, каждый из которых, независимо друг от друга, выбирают из галогена или C1-C6-алкила, или R7 представляет собой нафтил;R8 представляет собой водород или C1-C6-алкил;R8' представляет собой водород или C1-C6-алкил или один из R8 и R8' принимает также значение фенил;R9 представляет собой C1-C6-алкил или бензил,или его фармацевтически приемлемая соль или сольват. 2. Соединение по п.1, где R4 представляет собой группу формулы 3. Соединение по любому из пп.1, 2, где R7 представляет собой фенил, необязательно замещенный галогеном или одной или двумя C1-C6-алкильными группами, или R7 представляет собой нафтил.- 16022084 4. Соединение по любому из пп.1, 2, где R7 представляет собой фенил или нафтил. 5. Соединение по любому из пп.1-4, где R8 представляет собой водород и R8' представляет собой водород или C1-C6-алкил. 6. Соединение по любому из пп.1-5, где R8 представляет собой водород и R8' представляет собой метил или этил. 7. Соединение по любому из пп.1-6, где R9 представляет собой н-бутил или бензил. 8. Соединение по п.1, где соединение формулы (I) представляет собой: 9. Фармацевтическая композиция, содержащая противовирусно эффективное количество соединения формулы (I) по любому из пп.1-8 и фармацевтически приемлемый носитель. 10. Применение соединения по любому из пп.1-8 в качестве ингибитора вируса HCV.
МПК / Метки
МПК: C07H 19/10, A61K 31/7072, C07H 19/06
Метки: производные, нуклеозидов, урацилсодержащих, спирооксетановые
Код ссылки
<a href="https://eas.patents.su/18-22084-spirooksetanovye-proizvodnye-uracilsoderzhashhih-nukleozidov.html" rel="bookmark" title="База патентов Евразийского Союза">Спирооксетановые производные урацилсодержащих нуклеозидов</a>
Предыдущий патент: Карбоксамидные соединения и способы их применения
Следующий патент: Система управления циклическими процессами
Случайный патент: Химически индуцируемое усиление образования трещин в подземных каменноугольных отложениях