Новые производные пентаэритрита, их получение и применение , а также промежуточные продукты для их синтеза
Номер патента: 1959
Опубликовано: 22.10.2001
Авторы: Брозиг Хольгер, Виндек Анне-Катрин, Хесс Ульрих
Формула / Реферат
1. Соединение общей формулы I

где R1, R2, R3 представляют собой одинаковые или различные CH2-ONO2, CH2-OR4 или R5, при этом, по крайней мере, один из заместителей R1, R2, R3 идентичен R5,
R4 обозначает Н или C1-С6-алканоил,
R5 обозначает COR6,
R6 обозначает ОН, OR7, NH2, NHR7, NR72, N+R73X-, NR8, NR9R10, NR11R12 или NH-NH2,
R7 обозначает неразветвленный или разветвленный C1-С6-алкил, неразветвленный или разветвленный C1-С6-алкенил, арил-, аралкил-, гетарил- или гетаралкил,
R8 обозначает C1-С6-алкилиден,
R9, R10 обозначают различные между собой R7,
R11, R12 обозначают одинаковые или различные NR72, N+R73X-,
NR8, а также
Х обозначает галоген или анионообразующую группу, а также их терапевтически приемлемые соли, кроме 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты и метилового эфира 3-нитрилокси-2,2-бис (нитрилоксиметил)пропионовой кислоты.
2. Соединение по п.1, соответствующее формулам II-VII
(O2NOCH2)2C(CH2ONO2)COR6 (II),
(O2NOCH2)2C(COR6)2 (III),
O2NOCH2C(COR6)3 (IV),
(O2NOCH2)2C(CH2OR4)COR6 (V),
(O2NOCH2)C(CH2OR4)2COR6 (VI),
(O2NOCH2)C(CH2OR4)(COR6)2 (VII).
3. Соединение по п. 2, где R4 обозначает Н или C1-С6-алканоил и R6 обозначает ОН, OR7, NH2, NHR7, NR72 или N+R73X-.
4. Соединение по п.2, представляющее собой этиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, пропиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, бутиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, бензиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, амид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, N-бензиламид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой киcлоты, гидразид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, диметиловый эфир 1,2-бис(нитрилоксиметил)малоновой кислоты и диметиловый эфир 2-метоксикарбонил-2-нитрилоксиметилмалоновой кислоты.
5. Соединение по п.2, соответствующее формулам IX-XIII,
2,2-бис(нитрилоксиметил)малоновая кислота,
2-карбокси-2-нитрилоксиметилмалоновая кислота,
2,2-бис(нитрилоксиметил)-3-гидроксипропионовая кислота,
3-гидрокси-2-гидроксиметил-2-нитрилоксиметилпропионовая кислота и
2-гидроксиметил-2-нитрилоксиметилмалоновая кислота
(O2NOCH2)2C(COOH)2 (IX),
O2NОСН2С(СООН)3 (X),
(O2NOCH2)2C(CH2OH)COOH (XI),
(O2NOCH2)С(СН2OН)2СООН (XII),
(O2NOCH2)C(CH2OH)(СООН)2 (XIII).
6. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропионат натрия и 3-нитрилокси-2,2-бис (нитрилоксиметил)пропионат калия.
7. Соединение общей формулы XIV

где R13 обозначает группу формулы XV
-O-CH2-C(CH2OH)q(CH2ONO2)r (XV)
и m - r - целые числа, при которых m+n+o+p=4, q+r=3, m и/или r_ 1 и о и/или р_ 1.
8. Соединение по п.7, представляющее собой 3-нитрилокси-2,2-бис(нитрилоксиметил) пропиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты.
9. Соединение общей формулы XVI

где R14, R15, R16 являются одинаковыми или различными и обозначают Н, OR19, ONO2, OR17 или R18,
R17 обозначает COR19 или R23,
R18 обозначает O(PO2H)OR20, O(PO2H)OR22, OSO2OR22 или COOR19,
R19 обозначает Н, неразветвленный или разветвленный C1-C6-алкил,
R20 обозначает неразветвленный или разветвленный C1-C6-алкил-R21,
R21 обозначает NR192, N+R193 или N+R193X-;
R22 обозначает R19, арил или NR192,
R23 обозначает 3- или 5-карбонильный радикал замещенной, при необходимости, по 2, 4 и/или 6-позиции 1,4-дигидропиридин-3,5-дикарбоновой кислоты, 1-замещенный пирролидин-2-карбонильный радикал, N-карбонильный радикал замещенного сиднонимина,
радикал -СО-СН(NHCOR19)-CR192-S-NO,
радикал -СО-СН(NH2)-CR192-S-NO или
радикал -NH-CH(COOR19)-CR192-S-NO и
X обозначает галоген или пригодную анионообразующую группу, а также их терапевтически приемлемые соли, за исключением комбинаций , где
R14 = R15 = R16 = ONO2;
R14 = OH, R15 = R16 = ONO2;
R14 = R15 = OH, R16 = ONO2;
R14 = R15 = R16 = OH;
R14 = R15 = ONO2, R16 = H;
R14 = ONO2, R15 = R16 = H;
R14 = ONO2, R15 = R16 = OR19, R19 = С3Н7;
R14 = R15 = ONO2, R16 = OR19, R19 = С3Н7;
R14 = ONO2, R15 = OR19, R16 = H, R19 = H;
R14 = R15 = OR19, R16 = H, R19 = H;
R14 = R15 = OR17, R16 = H, R17 = COR19, R19 = CH3;
R14 = ONO2, R15 = OR17, R16 = H, R17 = COR19, R19 = CН3;
R14 = R15 = ONO2, R16 = OR17, R17 = СОR19, R19 = H, СН3, C2H5, C4H9, С5Н11, а также R14 = R15 = R16 = H.
10. Соединение по п.9, где R14 обозначает OR19 или R18; R15, R16 обозначают ONO2 и R18 обозначрхт COOR19.
11. Соединение по п.10, соответствующее формуле XVII
(O2NOCH2)3С-CH2-COOR19 (XVII).
12. Соединение по п.11, где R19 обозначает Н, метил или этил.
13. Соединение по п.9, соответствующее формулам (O2NOCH2)3С-CH2-COONa и (O2NOCH2)3С-СН2-СООК: 3,3-бис(нитрилоксиметил)-4-нитрилоксибутират натрия и 3,3-бис(нитрилоксиметил)-4-нитрилоксибутират калия.
14. Соединение по п.10, соответствующее формуле XVIII
(O2NOCH2)3С-CH2-OR19 (XVIII).
15. Соединение по п.14, где R19 обозначает метил или этил.
16. Соединение общей формулы XIX
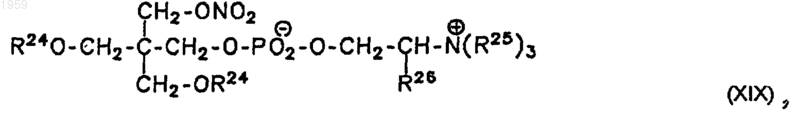
где R24 обозначает Н, NO2, ацил, алкил или алкенил,
R25 обозначает Н или СН3, и
R26 обозначает Н.
17. Соединение по п.16, соответствующее формуле XX
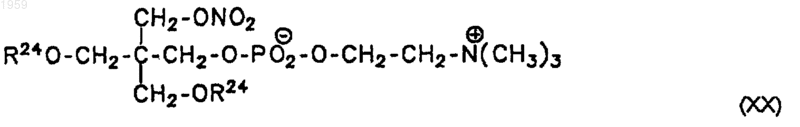
18. Соединение по п.17, соответствующее формуле XXI
(О2NОСН2)3С-СН2-О-(PO2)--O-CH2-CH2-N+(СН3)3 (XXI)
[2,2-бис(нитрилоксиметил)-3-нитрилоксипропил]-фосфорилхолин.
19. Соединение общей формулы XXII
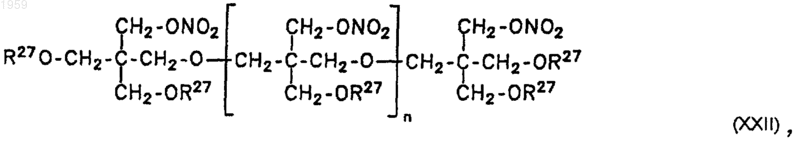
где R27 обозначает независимо друг от друга NO2 или R17-R23, с соответствующим вышеуказанным в п.9 значением, и n обозначает целое число от 0 до 10, предпочтительно от 0 до 4, за исключением комбинаций, где n=0, R27=NO2, n=1, R27=NO2, а также n=2, R27=NO2.
20. Соединение по п.19, соответствующее формуле XXIV, бис-[2,2-бис(нитрилоксиметил)-2-гидроксиметил]этиловый эфир
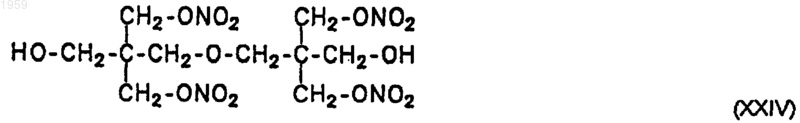
21. Соединение по п.19, соответствующее формуле XXV, [2,2-бис(нитрилоксиметил)-3-нитрилоксипропил]-2,2-бис(нитрилоксиметил)-3-гидроксипропиловый эфир
(О2NО-СН2)3С-СН2-O-СН2-С(СН2-ОН)(СН2-ОNO2)2 (XXV)
22. Соединение общей формулы I

где R1, R2, R3 одинаковые или различные и обозначают СH3-ONO2, CH2-OR4 или R5, причем, по меньшей мере, один из заместителей R1-R3 идентичен R5,
R4 обозначает Н или C1-С6-алканоил,
R5 обозначает COR6,
R6 обозначает, по меньшей мере, в одном значении Сl или Br, далее ОН, OR7, NН2, NHR7, NR72, N+R73X-, NR8, NR9R10, NR11R12 или NH-NH2,
R7 обозначает неразветвленный или разветвленный C1-С6-алкил, неразветвленный или разветвленный C1-С6-алкенил, арил-, аралкил-, гетарил- или гетаралкил,
R8 обозначает C1-С6-алкилиден,
R9, R10 обозначают различные между собой R7,
R11, R12 одинаковые или различные и обозначают NR72, N+R73Х-, NR8, а также Х обозначает галоген или анионообразующую группу.
23. Соединение по п.22, представляющее собой хлорид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, дихлорид 2,2-бис(нитрилоксиметил)малоновой кислоты и дихлорид 2-хлоркарбонил-2-нитрилоксиметилмалоновой кислоты.
24. Соединение общей формулы XIV

где R13, по меньшей мере, в одном значении представляет собой Сl или Вr, в остальных группу формулы XV
-O-СН2-C(CH2OH)q(CH2ONO2)r (XV)
и m - r обозначают целые числа, при которых m+n+o+p=4, q+r=3, m и/или r_ 1 и о и/или р_ 1.
25. Соединение общей формулы XVI

где R14, R15, R16 одинаковые или различные и обозначают Н, OR19, ONO2, OR17 или R18,
R17 обозначает COR19 или R23,
R18, по меньшей мере, в одном значении представляет собой СОСl или СOBr, далее обозначает O(РО2H)ОR20, O(РО2Н)OR22, OSO2OR22 или COOR19,
R19 обозначает Н, неразветвленный или разветвленный C1-С6-алкил,
R20 обозначает неразветвленный или разветвленный C1-С6-алкил-R21,
R21 обозначает NR192, N+R193 или N+R193X-;
R22 обозначает R19, арил или NR192,
R23 обозначает 3- или 5-карбонильный радикал замещенной, при необходимости, по 2, 4 и/или 6-позиции 1,4-дигидропиридин-3,5-дикарбоновой кислоты, 1-замещенный пирролидин-2-карбонильный радикал, N-карбонильный радикал замещенного сиднонимина, радикал -СО-СН(NHCOR19)-СR192-S-NO, радикал -СО-СН(NH2)-CR192-S-NO или радикал -NH-CH(COOR19)-CR192-S-NO, и
Х обозначает галоген или анионообразующую группу.
26. Применение соединения по пп.1-21 в качестве лекарственного средства.
27. Применение соединения по пп.1-21 в качестве сосудорасширяющего средства.
28. Применение соединения по пп.1-21 в качестве эндотелизащитного средства.
29. Применение соединения по пп.1-21 в качестве средства против окислительной нагрузки на организм.
30. Применение соединения по пп.1-21 в качестве средства против окислительной нагрузки на сосуды и ткани организма.
31. Применение соединения по пп.1-21 в качестве средства, ингибирующего агрегацию тромбоцитов.
32. Применение соединения по пп.1-21 в качестве средства против эректильной дисфункции.
33. Применение соединения по пп.1-21 для получения фармацевтических композиций.
34. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропионовая кислота, метиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, соединения oбщей формулы XVI

где R14 = ONO2, R15 = R16 = H; R14 = ONO2, R15 = R16 = OR19, R19 = С3Н7;
R14 = R15 = ONO2, R16 = OR19, R19 = С3Н7;
R14 = ONO2, R15 = OR19, R16 = H, R19 = H;
R14 = R15 = OR19, R16 = H, R19 = H;
R14 = R15 = OR17, R16 = H, R17 = COR19, R19 = СН3;
R14 = ONO2, R15 = OR17, R16 = H, R17 = COR19, R19 = СН3;
R14 = R15 = ONO2, R16 = OR17, R17 = COR19, R19 = H, СН3, С2H5, С4Н9, C5H11; а также R14 = R15 = R16 = H и соединения формулы XXII
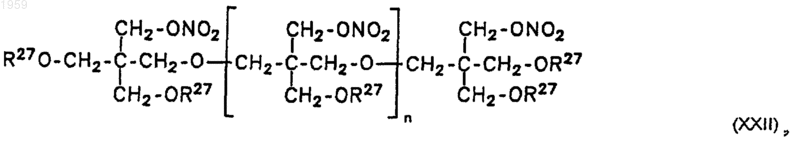
где n = 0, R27 = NO2; n = 1, R27 = NO2, а также
n = 2, R27 = NO2,
в качестве лекарств, в частности, сосудорасширяющих и эндотелизащитных средств, в качестве средства против окислительной нагрузки на организм, в качестве средства против окислительной нагрузки на сосуды и ткани млекопитающих, в качестве средства, ингибирующего агрегацию тромбоцитов, а также в качестве средства против эректильной дисфункции.
35. Применение соединений по п.34 для получения фармацевтических композиций.
36. Фармацевтическая композиция, содержащая одно или несколько соединений по пп.1-21, 34.
37. Фармацевтическая композиция по п.36, отличающаяся тем, что она содержит дополнительно другие используемые для лечения сердца и органов кровообращения активные вещества, в частности, активные вещества из групп АСЕ-ингибиторов, антиатеросклеротических веществ, антигипертензивных веществ, бета-блокаторов, веществ, снижающих уровень холестерина, мочегонных средств, антагонистов кальция, дилататоров коронарных сосудов, веществ, снижающих уровень липидов, дилататоров периферийных сосудов или ингибиторов агрегации тромбоцитов.
38. Применение фармацевтической композиции по пп.36 и 37 для лечения заболеваний сердца и органов кровообращения или для защиты сосудов и тканей.
39. Способы лечения организма человека или животных с применением соединений по пп.1-21, 34 или фармацевтической композиции по пп.36 и 37.
40. Применение 3-нитрилокси-2,2-бис (нитрилоксиметил)пропионовой кислоты, метилового эфира 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, соединения общей формулы XVI

где R14 = R15 = ONO2, R16=H; R14 = ONO2, R15 = R16 = Н;
R14 = ONO2, R15 = R16 = OR19, R19 = С3Н7;
R14 = R15 = ONO2, R16 = OR19, R19 = С3Н7;
R14 = ONO2, R15 = OR19, R16 = H, R19 = H;
R14 = R15 = OR19, R16 = H, R19 = H;
R14 = R15 = OR17, R16 = H, R17 = COR19, R19 = СН3;
R14 = ONO2, R15 = OR17, R16 = H, R17 = COR19, R19 = СН3;
R14 = R15 = ONO2, R16 = OR17, R17 = COR19, R19 = H, СН3, C2H5, С4Н9, C5H11, а также
R14 = R15 = R16 = H
и соединения формулы XXII
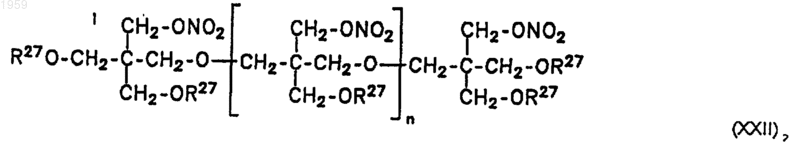
где n = 0, R27 = NO2;
n = 1, R27 = NO2, а также n = 2, R27 = NO2 для получения соединений по пп.1-25.
41. Способ получения 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, отличающийся тем, что 3-нитрилокси-2,2-бис(нитрилоксиметил)пропанол непосредственно окисляют до 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты.
42. Способ по п.41, отличающий тем, что в качестве окислителя используют перманганат калия.
43. Способ получения метилового эфира 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, отличающийся тем, что галогенид 3-нитрилокси-2,2-бис(нитрилоксиметил) пропионовой кислоты этерифицируют метанолом.
44. Способ получения метилового эфира 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, отличающийся тем, что 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовую кислоту переводят в галогенид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, в частности, в хлорид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, и этот галогенид сразу после этого этерифицируют метанолом.
45. Способ по п.44, отличающийся тем, что получение осуществляют без выделения галогенида 3-нитрилокси-2,2-бис(нитрилоксиметил) пропионовой кислоты.
Текст
1 Данное изобретение относится к новым производным пентаэритрита, их получению и применению, в частности, в качестве фармацевтических композиций, а также к промежуточным продуктам для их синтеза. Органический сложный эфир азотной кислоты, такой как глицеринтринитрат (ГТН)Poudres 35: 113 (1953, тролнитрат (FR-PS 984523) или никорандил (US-PS-4200640) и другие подобные соединения являются вазодилататорами, которые при показаниях в случае стенокардии или ишемической болезни сердца(IHK) уже несколько десятилетий находят широкое терапевтическое применение (Nitrangin,Pentalong, Monolong и др.). Описаны также и пентаэритритилнитраты, а также способы их получения (Simecek, Coll. Czech. Сhem. Соmm. 27 (1962), 363; Camp et al., J. Am. Chem. Soc. 77(1955), 751). Такую же и даже большую фармакологическую активность при применении в случае вышеупомянутых показаний обнаруживают органические нитраты" нового типа, такие как, например, SPM 3672 (этиловый сложный эфир N-[3-нитратопивалоил]-L-цистеина)(US-PS-5284 872) и его производные или производные 1,4-дигидропиридина(WO-A192/02503). Наряду с известным на протяжении многих лет применением веществ с нитрозирующим эффектом описывается их использование для лечения и профилактики заболеваний,причиной которых является чрезмерная концентрация серасодержащих аминокислот в жидкостях организма. Такие болезненные состояния,вызываются врожденными или приобретенными недостатками в метаболизме этих аминокислот и характеризуются повышенной концентрацией упомянутых аминокислот в крови и моче (гомоцистинурия), объединяются общим понятием"гомоцистеинамия" (WO-A1-92/18002). Коротко описывается и другое использование упомянутых веществ, например, в качестве средства защиты эндотелия (DE-A1-4410997), средства против патологического повышения внутриглазного давления (WO-A1-95/13812), средства от дисменореи, дисфункциональных маточных кровотечений, преждевременных родов или запоздалых родов вследствие уменьшения сократимости матки (WO-A1-95/13802), средства против климактерических осложнений (WO-A195/13800) или средства против эректильной(1996), 1512-1515). С одной стороны, ныне известные органические сложные эфиры азотной кислоты имеют ряд терапевтических недостатков. Такую картину можно наблюдать, например, при так называемой невосприимчивости к нитратам, то есть,ослаблении действия нитратов при высокой дозе или при применении сложного эфира азотной кислоты длительного действия. Это относится и к побочным эффектам, таким как головная боль,головокружение, тошнота, слабость, покраснение кожи, а также угроза резкого падения кровяного давления с рефлекторной тахикардией(Mutschler,Arzneimittelwirkungen,Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart,1991). С другой стороны, ПЭТН как активное вещество обладает рядом отличных качеств, в частности, незначительные проявления или полное отсутствие вышеупомянутых побочных эффектов, что оправдывает предпочтительное использование этого соединения в качестве фармацевтической композиции перед другими органическими сложными эфирами азотной кислоты (Сводное издание Pentaerythrityltetranitrat", Dr. Dietnich Steikopff Verlag, Darmstadt,1994-1996). Общеизвестна галеновая обработка органических сложных эфиров азотной кислоты для приготовления фармацевтических композиций для лечения стенокардии или ишемической болезни сердца. Ее проводят общеизвестным для фармацевтов способом и по общеизвестным правилам, причем выбор применяемых технологий и используемых вспомогательных веществ в первую очередь зависит от обрабатываемого активного вещества. Особенно важными являются вопросы химико-физических свойств,формы применения, длительности действия, а также вопрос несовместимости лекарственных веществ со вспомогательными веществами. Для медикаментов, показанных при стенокардии или ишемической болезни сердца, прежде всего описывается пероральное, парентнеральное,подъязычное или чрескожное применение в форме таблеток, драже, капсул, растворов, аэрозолей или пластырей (DD-A5-293492, DE-AS2623800, DE-OS-3325652, DE-OS-3328094, DEPS-4007705, DE-OS-4038203, Заявка JP-59/10513(1982. Фактор активации тромбоцитов, 1-алкил-2 ацетиловый эфир аналог фосфатидилхолина формулы Н 3 С-СО-O-СН(СН 2-О-(СН 2)15-СН 3)CH2-O-PO2O-CH2-CH2-N+(CH3)3, даже при чрезвычайно низкой концентрации в крови - 0,1 нМ - способен растворять скопления тромбоцитов и ангиэктазию (Stryer, Biochemie, Spektrumder Wissenschaften, Heidelberg, 1990). Давно известна также возможность использования органического эфира азотной кислоты в качестве взрывчатого вещества (Ull 3manns Encyklopdie der technischen Chemie, Bd. 16, 3. Aufl., UrbanSchwarzenberg, MunchenBerlin, 1965). Задачей изобретения является получение новых производных пентаэритрита с улучшенной фармакологической активностью, в частности, путем достижения свойств, характерных для пентаэритритилтетранитрата и превосходящих свойства других нитратов. Задача изобретения решается благодаря соединениям общей формулы IR1, R2, R3- одинаковые или различные и обозначают CH2-ONO2, CH2-OR4 или R5, причем, по крайней мере,один из заместителей R1R3 идентичен R5,R4 обозначает Н или C1-C6-алканоил,R5 обозначает COR6,R6 обозначает ОН, OR7, NH2, NHR7, NR72,+ 7N R 3X-, NR8, NR9R10, NR11R12 или NH-NH2,R7 обозначает неразветвленный или разветвленный C1-С 6-алкил, неразветвленный или разветвленный C1-С 6-алкенил, арил-, аралкил-,гетарил- или гетаралкил,R8 обозначает C1-С 6-алкилиден,R9, R10 являются различными и обозначают 7R,R11, R12 являются одинаковыми или различными NR72, N+R73X-, NR8, а также Х обозначает галоген или анионообразующую группу, а также их терапевтически приемлемые соли. При этом предпочтительны соединения формул II-VIIR6 обозначает ОН, OR7, NH2, NHR7, NR72 или N+R73X-, в особенности сложные эфиры и смешанные сложные эфиры, амиды, полуамиды,амидоэфиры, а также соли аммония. Другими предпочтительными формами осуществления изобретения являются соединения с одной, двумя и тремя гидрофильными группами. Это касается, в частности, солей металлов и аммония,сложных эфиров, амидов и гидразидов карбоновых кислот. Особо предпочтительны при этом соединения формул VIII-XIII 4 особенно 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовая кислота, 2,2-бис(нитрилоксиметил)малоновая кислота и 2-карбокси-2 нитрилоксиметилмалоновая кислота. В качестве исходных соединений пригодны хорошо доступные азотнокислые эфиры пентаэритрита, причем для их получения, как особенно предпочтительный, указывается способ частичного динитрирования пентаэритритилтетранитрата при помощи гидразина (Simecek, Coll. Czech. Chem. Соmm. 27 (1962), 363 иUS-PS-3 408 383). Другой способ заключается в нитрировании пентаэритрита до тринитрата,после чего проводят его гидразинолиз до пентаэритритилди- и мононитрата, а также хроматографическое разделение полученной смеси. Также в качестве исходных соединений пригодны 2,2-бис(гидроксиметил)малоновая кислота(1934), 615; Bull. Soc. Chim. Fr., 54 (1937),1432), а также 2-карбокси-2-гидроксиметилмалоновая кислота (Hueckel et al., Lieb. Ann. Сhem. 528 (1937), 68). Дальнейшую обработку до необходимых целевых соединений проводят при помощи хорошо известных специалистам реакций и способов. Так, например, благодаря катализированному кислотой взаимодействию нитрилоксиметилированных пропионовой или малоновой кислот или их галогенидов со спиртами или благодаря другим известным специалисту способам этерификаций, таким как переэтерификация, получают соответствующий сложный эфир с хорошим выходом. Особенно пригодными для этой цели являются, в особенности, неразветвленные и разветвленные первичные, вторичные и третичныеC1-С 6-алканолы, C1-С 6-алкенолы, а также ариловые, гетариловые, аралкиловые и гетаралкиловые спирты. Гомологи амидов кислот, полуамиды или гидразиды получают путем взаимодействия названных галогенидов и сложных эфиров с NН 3, первичными и вторичными аминами или гидразинами или 1-замещенными гидразинами. Пригодными для этого являются первичные и вторичные алифатические, ароматические и гетероароматические амины или гидразин и 1 замещенные гидразины. Другой формой осуществления изобретения являются соединения общей формулы XIV где R13 обозначает группу формулы XV-O-CH2-C(CH2OH)q(CH2ONO2)r (XV),а m - r обозначают целые числа, для которых m+n+o+p=4, q+r=3, m и/или r1 и о и/или р 1. При этом наиболее предпочтителен 3 нитрилокси-2,2-бис(нитрилоксиметил)пропиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты. 5 Соединения формулы XIV получают, в частности, из соединений формул VIII-XIII, например,3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты (три-ПК) 2,2-бисHO-CH2-C(CH2OH)q(CH2ONO2)r (XV.1) Таким же образом используют производные соединений формул VIII-XIII, например,производные три-ПК, бис-МК, КН-МК илиXV.1 в качестве исходных соединений для синтеза соединений XIV, функциональные группы которых в качестве пригодных исходных групп открывают специалистам доступ к целевым соединениям через реакции эстерификации. При этом взаимодействие осуществляют общеизвестными способами получения сложных эфиров. Соединения формул VIII-XIII, например, триПК, бис-МК, КН-МК, а также их производные,кроме того, по аналогии пригодны в качестве кислотных компонентов для получения сложных эфиров, спиртовые компоненты которыхoбразуются частично нитрированными многоатомными спиртами, в частности, изосорбидмононитратом, 1-нитроглицерином, 2-нитроглицерином, 1,2-динитроглицерином, 1,3-динитроглицерином или частично нитрированным эритритом. Эти сложные эфиры также включены в объем данного изобретения. Другой формой осуществления изобретения являются соединения общей формулы XVIR14, R15, R16 одинаковые или различные и обозначают Н, OR19, ONO2OR17 или R18OR , OSO2OR22 или COOR19,R19 обозначает Н, неразветвленный или разветвленный С 1-С 6-алкил,R20 обозначает неразветвленный или разветвленный С 1-С 6-алкил-R21,R21 обозначает NR192, N+R193 или N+R193 Х-;X обозначает галоген или пригодную анионообразующую группу, а также их терапев 001959(O2NОСН 2)3 С-СН 2-СООR19 (XVII),где R19 обозначает Н, метил, этил, Na или К, а также соединения формулы XVIII(O2NОСН 2)3 С-СН 2-ОR19 (XVIII),где R19 метил или этил. В качестве исходного соединения пригоден широкодоступный монобромпентаэритрит[1963] 681) и бис-[2,2,2-три(нитрилоксиметил)] этиловый эфир (Friedrich et al., В. 63 [1930] 2683). Дальнейшую обработку до получения отдельных целевых соединений проводят при помощи соответствующих хорошо известных специалисту реакций и способов. Так, возможны 2 многоступенчатых способа синтеза 4 нитрилокси-3,3-бис-(нитрилоксиметил)бутановой кислоты, исходя из монобромпентаэритрита. С одной стороны, монобромпентаэритрит реагирует в нуклеофильной реакции замещения до 3,3-бис(гидроксиметил)-4-гидроксибутилонитрила, который омыляется до 3,3 бис(гидроксиметил)-4-гидроксибутановой кислоты (Govaert et al., Mededeelingen van de Koninklijke Vlaamsche Academie voor Wetenschappen, Letteren en Schoone Kunsten van Belgie,Klasse der Wetenschappen 16 [1954] Nr. 8, 3-12) и затем после этого путем полной этерификации при помощи азотной кислоты (US-PS-3 408 383) превращается в 4-нитрилокси-3,3-бис(нитрилоксиметил)бутановую кислоту. С другой стороны,4-нитрилокси-3,3-бис(нитрилоксиметил) бутановую кислоту получают путем этерификации монобромпентаэритрита при помощи азотной кислоты до 3-нитрилокси-2,2-бис[нитрилоксиметил)пропилбромида (D.Е. Elrik et al.,Am. Soc. 76 [1954] 1374), после чего его подвергают реакции Гриньяра и взаимодействию с диоксидом углерода. Для получения диэтилового эфира 2,2-бис(нитрилоксиметил)малоновой кислоты используют легкодоступный диэтиловый эфир 2,2-бис(гидроксиметил)малоновой кислоты (Gault, Roesch, С. R. Hebd. Seances Acad. Sci.,199 (1934) 615). Метил-2,2,2-трис(нитрилоксиметил)этиловый эфир получают после синтеза простого эфира по Вильямсону или путем взаимодействия пентаэритритилтринитрата с эфирным раствором диазометана в присутствии каталитического количества трифторида бора. Еще одну форму осуществления изобретения представляют собой соединения, в которых 3- или 5-карбонильный радикал замещенной, 7 при необходимости, в 2, 4 и/или 6-позиции 1,4 дигидропиридин-3,5-дикарбоновой кислоты образуется радикалом несимметричного сложного эфира, 1-замещенный пирролидин-2 карбонильный радикал образуется радикалом,или N-карбонильный радикал замещенного сиднонимина образуется радикалом, о которых специалистам известно, что они принадлежат к классу веществ - антагонистов кальция, АСЕингибиторов или коронарных дилататоров. Соединения общей формулы XIXR26 обозначает Н,представляют еще одну форму осуществления изобретения, причем предпочтительны соединения формулы XX особенно соединение формулы XXI(O2NOCH2)3 С-СН 2-О-(РO2)О-СН 2-СН 2-N+(СН 3)3 (XXI) Еще одним примером осуществления данного изобретения являются соединения общей формулы XXIIR27 обозначает независимо друг от другаn обозначает целое число от 0 до 10, предпочтительно от 0 до 4. При этом предпочтительны соединение формулы XXIII(O2NO-СН 2)3 С-СН 2-O-СН 2-С(СН 2-ОН)(CH2ONO2)2 (XXV) Для получения симметричного бис-(2,2 бис(нитрилоксиметил)-2-гидроксиметил)этилового эфира пригоден, например, способ частичного денитрирования бис-[2,2,2-трис(нитрилоксиметил)]этилового эфира при помощи гидразина. Соединения общей формулы I, где R1-R5 имеют вышеуказанные значения, где, по меньшей мере, один из заместителей R6 представляет собой Cl или Вr, в частности, хлорангидрид 3 нитрилокси-2,2-бис(нитрилоксиметил)пропио 001959 8 новой кислоты, дихлорангидрид 2,2-бис(нитрилоксиметил)малоновой кислоты и дихлорангидрид 2-хлоркарбонил-2-нитрилоксиметилмалоновой кислоты, далее соединения общей формулы XIV, где, по меньшей мере, один из заместителей R13 представляет собой Cl или Вr, и соединения общей формулы XVI, где R14-R16 имеют вышеуказанные значения, где, по меньшей мере, один из заместителей R18 представляет собой COCl или СОВr, являются, кроме того,полезными промежуточными продуктами для синтеза вышеописанных целевых соединений. Кроме того, для специалиста является очевидным, что при получении соединений согласно изобретению можно, соответственно, воспользоваться различными производными, в которых реактивные центры дезактивируются известными защитными группами во избежание побочных реакций и побочных продуктов. Эти защитные группы могут быть далее удалены после проведения соответствующей реакции или на соответствующей конечной стадии. Использование этих производных, содержащих защитные группы, также предусматривается данным изобретением. Таким образом возможно и использование фармакологически приемлемых производных всех вышеназванных соединений. Возможными вариантами являются, прежде всего, традиционные продукты присоединения, соли или ферментативно или гидролитически расщепляемые соединения, такие, как сложные эфиры, амиды и т.п. В зависимости от условий способа и исходных материалов, различные целевые продукты получают в виде свободных кислот или оснований, аддитивных солей оснований или кислот или бетаина, которые, в зависимости от конкретного случая, являются предметом изобретения. Так, могут быть получены кислотные,основные, нейтральные или смешанные соли, а также гидраты. С одной стороны, те или иные соли могут быть известным образом превращены в свободные кислоты или основания с использованием соответствующих средств или путем ионного обмена. С другой стороны, полученные свободные кислоты или основания могут образовывать соли с органическими или неорганическими основаниями или кислотами. При получении аддитивных основных солей используют, прежде всего, такие основания,которые образуют пригодные терапевтически приемлемые соли. Такими основаниями являются, например, гидроксиды или гидриды щелочных и щелочно-земельных металлов, аммиак, амины, а также гидразины или гуанидины. При получении аддитивных солей кислот также предпочтительно используют такие кислоты,которые образуют пригодные терапевтически приемлемые соли. Такими кислотами являются,например, галогенводородные, сульфоновая,фосфорная, азотная и перхлорная кислоты, али 9 фатические, ациклические, ароматические, гетероциклические карбоновые или сульфоновые кислоты, такие как муравьиная, уксусная, пропионовая, янтарная, гликолевая, молочная, яблочная, винная, лимонная, глюконовая, сахарная, глюкуроновая, аскорбиновая, малеиновая,гидроксималеиновая, пировиноградная, фенилуксусная, бензойная, п-аминобензойная, антраниловая, п-гидроксибензойная, салициловая,ацетилсалициловая, п-аминосалициловая, эмбоновая, метансульфоновая, этансульфоновая,гидроксиэтансульфоновая, этиленсульфоновая,галогенбензолсульфоновая, толуолсульфоновая,нафтилсульфоновая или сульфаниловая кислота, а также аминокислоты, например, метионин,триптофан, лизин или аргинин. Эти и другие соли новых соединений, такие как, например,пикраты, могут служить в качестве средства для очистки полученных свободных кислот или оснований. Соли кислот или оснований могут быть образованы и выделены из растворов, а после этого из нового соленого раствора могут быть получены свободные кислоты или основания в чистом виде. Благодаря соотношению между новыми соединениями в их свободной форме и их солями эти соли также являются объектами изобретения. Отдельные новые соединения, в зависимости от выбранного исходного материала и способа, могут существовать в виде оптических изомеров или рацемата, или,если они имеют, по крайней мере, два асимметрических центра, то в виде смеси изомеров(смеси рацематов) могут быть разделены при помощи хроматографии или фракционированной кристаллизации на два стереоизомерных(диастереомерных) чистых рацемата. Полученные рацематы разделяют известными способами, например, путем перекристаллизации из оптически активного растворителя, путем использования микроорганизмов, путем взаимодействия с оптически активными агентами с образованием соединений, которые могут быть разделены путем разделения на основе различной растворимости диастереоизомеров. Пригодными оптически активными агентами являютсяL- и D-формы винной, ди-о-толилвинной, яблочной, миндальной, глюконовой, сахарной,глюкуроновой, камфорсульфоновой, хининовой или бинафтилфосфорной кислот и, соответственно, оптически активные основания. Предпочтительно выделяют активную часть обоих антиподов. Исходные материалы известны или,если они должны быть новыми, то их получают традиционными способами. Смеси рацематов и оптически чистых изомеров, а также их соли или продукты присоединения с оптически активными агентами также являются предметом данного изобретения. Соединения данного изобретения могут клинически применяться сами по себе или в виде части галенового препарата, в виде отдель 001959 10 ного активного вещества, в сочетании друг с другом или с известными терапевтическими средствами для улучшения деятельности сердца и органов кровообращения, например, АСЕингибиторами,антиартериосклеротическими,антигипертензивными средствами, бета-блокаторами, средствами, снижающими уровень холестерина, мочегонными средствами, антагонистами кальция, дилататорами коронарных сосудов, средствами, снижающими содержание липидов, дилататорами периферийных сосудов,ингибиторами агрегации тромбоцитов или другими веществами, используемыми для лечения сердца и органов кровообращения. При этом приготовление галеновых препаратов проводят согласно общеизвестным среди специалистов способам и правилам, ориентируясь при выборе технологий и применяемых галеновых вспомогательных материалов в первую очередь на перерабатываемое активное вещество. Особое значение при этом придают вопросам их химико-физических свойств, выбранной формы применения, планируемой продолжительности действия, места действия, а также избежания несовместимости лекарства и вспомогательного вещества. Поэтому специалист обязан при выборе лекарственных форм, вспомогательных веществ и технологий приготовления опираться на традиционные параметры веществ и технологического процесса. При этом лекарственную форму разрабатывают таким образом, чтобы она, с целью обеспечения необходимого терапевтического уровня в плазме, содержала соответствующее активное вещество в таком количестве,которое позволяет разделять дневную дозу для систем с регулируемым высвобождением на 1-2,а для других лекарственных форм вплоть до 10 отдельных доз. Возможно также непрерывное применение путем длительной инфузии. Для достижения эндотелиально-защитного эффекта следует стремиться к тому, чтобы терапевтические показатели крови сохранялись, в общем,как можно дольше. Согласно изобретению, вышеназванные соединения могут применяться,прежде всего, перорально, внутривенно, парентерально, подъязычно или чрескожно. Предпочтительно готовят соответствующие лекарственные композиции в жидкой или твердой форме. Для этого пригодны растворы, в особенности,для приготовления капель, инъекции, аэрозоли или порошковые ингаляторы, а также суспензии, эмульсии, сиропы, таблетки, таблетки в оболочке, драже, капсулы, пилюли, порошки,пастилки, имплантаты, суппозитории, кремы,гели, мази, пластыри или другие системы для чрескожного применения. Фармацевтические композиции содержат традиционные галеновые органические или неорганические носители и вспомогательные вещества, которые сами по себе должны быть химически нейтральными по отношению к соответствующим активным веществам. Допускает 11 ся также химическая дериватизация при нанесении на материал-носитель; это касается, в частности, образования аддуктов с сахарными производными, такими как кросс-кармелозы или циклодекстрины. Пригодными фармацевтическими вспомогательными веществами являются,кроме прочих, вода, солевые растворы, спирты,растительные масла, полиэтиленгликоли, желатина, лактоза, амилоза, стеарат магния, тальк,высокодисперсный диоксид кремния, парафин,моно- и диглицериды жирных кислот, производные целлюлозы, поливинилпирролидон и т.п. Композицию можно стерилизовать и в случае необходимости добавлять вспомогательные вещества, такие как наполнители, связующие вещества, смазочные, разделительные, способствующие распаду, регулирующие влажность,адсорбенты или противоразбрызгивающие средства, консерванты, стабилизаторы, эмульгаторы, растворители, соли для воздействия на осмотическое давление, буферные растворы,красители, ароматизаторы или вкусовые добавки. Во избежание несовместимости лекарственного средства с вспомогательными веществами специалист должен сделать правильный выбор исходя из параметров веществ. Ряд вышеописанных соединений проявляет, в отличие от многих известных применяемых в терапии органических эфиров азотной кислоты, удивительную гидрофильность, которая позволяет осуществить их простую и надежную галеновую переработку, что, в частности, позволяет в дальнейшем отказаться при приготовлении фармацевтических композиций от применения органических растворителей. Наиболее пригодными они являются также для широкого использования в аэрозолях, в частности, в аэрозолях с дозаторами, а также в растворах. Упомянутая хорошая и очень хорошая водорастворимость, кроме того, повышает их резорбцию, что, в конечном счете, ведет к улучшенной биологической применимости. Было также показано, что соединения данного изобретения неожиданно проявляют нужные свойства. Кроме того, они проявляют, в частности, оптимизированное высвобождениеNO, например, за счет различного содержания в биологически трансформированных путем восстановления или окисления NO-предшественниках, или за счет улучшенного или повышенного многофазного высвобождения NO и повышенную согласно цели применения, липо- или гидрофильность, хорошую биологическую применимость, повышенную cGMP-аккумуляцию, а также фармакодинамическое снижение нагрузки, минимизированное возрастание эндотелина в плазме, четко выявленное ингибирование агрегации тромбоцитов благодаря активным группам и эндотелиально-защитное действие. Данное изобретение открывает тем самым улучшенные и значительно расширенные терапевтические возможности лечения таких пато 001959 12 логий, как сердечные и сосудистые заболевания,в частности, заболевание коронарных сосудов,стеноз сосудов и нарушение кровоснабжения периферийных артерий, гипертония, микро- и макроангиопатии при сахарном диабете, атеросклероз, нагрузка на сосуды и ткани в результате окисления, а также заболевания, являющиеся их следствием: эректильная дисфункция, повышенное внутриглазное давление, дисменорея,дисфункциональные маточные кровотечения,такие дисфункции маточной сократимости, как преждевременные роды, климактерические осложнения или недержание. Нижеследующие примеры поясняют сущность изобретения и формы его осуществления,однако не должны ограничивать его объем. Примеры выполненеия Пример 1. Пентаэритритилтринитрат. 158 г (0,5 моль) пентаэритритилтетранитрат (ПЭТН) растворяют в смеси 300 мл диоксана и 300 мл этанола при кипении и на протяжении 1 ч порциями в различных количествах добавляют водный раствор гидразингидрата (1,5-4 моль). После этого реакционную смесь еще 2,5 ч нагревают до кипения с обратным холодильником. Растворители испаряют при 15 мм рт.ст., и осадок, в случае надобности, несколько раз обрабатывают порциями воды по 100 мл, пока объем масляного слоя не перестанет уменьшаться. Водные экстракты (А) собирают, и оставшийся маслянистый слой растворяют в двойном объеме этанола. Выпавший в виде белого осадка ПЭТН отфильтровывают через 24 часа; Т.пл. = 132 С, cодержание азота: 17,35%; Т. пл. = 141 С (2 х ацетон); содержание азота: соответствует. Из фильтрата при 15 мм рт.ст. выпаривают этанол. Вязкий маслянистый осадок состоит из сырого пентаэритритилтринитрата (ПЭТриН); содержание азота: соответствует. Пример 2. Пентаэритритилдинитрат и пентаэритритилмононитрат. Объединенные водные экстракты А согласно примеру 1 трижды обрабатывают эфиром и из отделенного от водного слоя В эфирного слоя после сушки над безводным Na2SO4 выпаривают эфир. Очень вязкий, маслянистый остаток после выпаривания состоит из сырого пентаэритритилдинитрата (ПЭДН). Водную фазу В, которая, наряду с пентаэритритмононитратом (ПЭМН) и пентаэритритом, содержите денитрированные продукты, главным образом гидразиннитрит, до прекращения газовыделения(N2, N2O, NO, N3 Н) постепенно подкисляют при помощи 2N H2SO4, а после этого при 20 мм рт.ст. до необходимого осаждения твердых продуктов концентрируют и выпаривают эфир. Оставшееся после выпаривания эфира кристаллическое вещество с т.пл. 62 С представляет собой сырой ПЭМН. После этого промывают холодным хлороформом и перекристаллизовывают из 13 хлороформа. Т.пл. = 79 С (HCCl3); элементный анализ в таблице 1. Пример 3. Пентаэритритилтринитратацетат и пентаэритритдинитратдиацетат. К 135,5 г (0,5 моль) сырого ПЭТриН [или 56,5 г (0,25 моль) ПЭДН] при охлаждении и перемешивании по частям добавляют смесь 50 мл уксусного ангидрида и 20 мг ацетилхлорида. Затвердевшую после реакции смесь дважды перемешивают с 50 мл этанола и отфильтровывают. В обоих случаях получают бесцветные кристаллы. Пентаэритриттринитратацетат(0,15 моль) ПЭДНдАц растворяют в 400 мл этанола, добавляют раствор 1,5 г NaOH в 50 мл этанола и отгоняют азеотропную этанoлэтилацетатную смесь (Т.крист. при атм.давл. = 71,8 С). После завершения образования этилацетата добавляют еще 1,5 г NaOH в 50 мл этанола и снова фракционируют, пока следующая порция этилацетата не перестанет образовываться. После этого этанол при 15 мм рт.ст. выпаривают, и осадок в случае с ПЭТриН трижды обрабатывают 20 мл воды, а в случае с ПЭДН перемешивают с 100 мл воды и трижды выпаривают эфир. После высушивания в вакууме или удаления эфира остаются чистые вещества ПЭТриН или ПЭДН в виде бесцветных вязких жидкостей, которые высушивают в вакууме над P2O5. ПЭТриН: элементный анализ в таблице 1. ПЭДН: элементный анализ в таблице 1. Пример 5. Пентаэритритилтринитрат 1/3 Н 2 О. ПЭТриН, полученный согласно примеру 4,промывают водой и сразу же перемешивают с 100 мл воды и после этого при температуре не выше 20 С выдерживают до следующего дня. После отфильтровывания и сушки получают устойчивые к воздействию воздуха бесцветные кристаллы. Т.пл. = 32 С; Влагосодержание: (способ Карла-Фишера) соответствующее, после вакуумного высушивания при 60 С. Элементный анализ в таблице 1. Пример 6. Пентаэритритилтринитрат. ПЭТриН получают путем нитрирования пентаэритрита при помощи HNO3 (95%-ной) в присутствии мочевины. Пример 7. Пентаэритритилдинитрат и пентаэритритилмононитрат. ПЭДН и ПЭМН получают из. ПЭТриН путем гидразинолиза (4 моль NH2NH2 50-%-ный) при помощи проведенного непосредственно 14 после этого разделения путем колоночной хроматографии смеси 1:1. Пример 8. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропионовая кислота. К раствору 0,0037 моль пентаэритритилтринитрата (ПЭТриН), 5,5 мл бензола, 9 мл воды и 0,15 мл Aliquat 336 порциями при энергичном перемешивании добавляют 0,0074 моль КМnO4. По окончании добавления температуру 15 С поддерживают на протяжении 2 ч. Сразу после этого добавляют раствор гидросульфита,подкисляют при помощи H2SO4 и отделяют бензольный слой. После удаления растворителя получают 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовую кислоту (триПК) в виде твердого осадка, который многократно перекристаллизовывают из метиленхлорида. Выход: 72%.(%): соответствует. Пример 9. 3-Нитрилокси-2,2-бис (нитрилоксиметил)пропионовая кислота. 0,02 моль ПЭТриН при 25 С по каплям добавляют к 6,5 мл 70%-ной НNО 3. Оставляют на 18 ч при 25 С и сразу после этого 3 ч нагревают при 70 С. После этого упаривают, и осадок(триПК) перекристаллизовывают из хлороформа. Выход: 52%. Элементный анализ: в таблице 1. Пример 10. 3-Нитрилокси-2,2-бис (нитрилоксиметил)пропионовая кислота. В химическом стакане в качестве диафрагмы подвешивают электролизер. 25%-аяH2SO4 служит в качестве католита. Катод состоит из свинца, свинцовую пластинку в качестве анода опускают в раствор анолита, состоящий из 0,0275 моль ПЭТриН, 500 мл 60%-ной H2SO4 и 10 г оксида хрома (VI). По окончании электролиза реакционную смесь экстрагируют эфиром, после удаления эфира остается три-ПК в виде грязно-белой кристаллической массы, которую перекристаллизовывают из хлороформа. Выход: 60%. Элементный анализ: в таблице 1. Пример 11. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропионовая кислота. К раствору 0,095 моль ПЭТриН и 4,2 гNaOH в 150 г 10 С%-ного раствора гипохлорида натрия при перемешивании при 45-50 С добав 15 ляют 1 г хлорида кобальта (II). Через 5 ч фильтруют, экстрагируют при помощи эфира и подкисляют концентрированной соляной кислотой. Кислый раствор экстрагируют при помощи эфира, и эфир упаривают. Сырую кристаллическую массу три-ПК перекристаллизовывают из воды. Выход: 70%. Элементный анализ: в таблице 1. Пример 12. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропионовая кислота. 0,042 молы ПЭТриН нагревают с обратным охлаждением в 30 мл пиридина с 0,084 моль дихлорида селена в течение 20 ч. Осажденный селен отделяют, и фильтрат перегоняют при помощи водяного пара. Водный осадок экстрагируют при помощи эфира и упаривают. Маслянистый осадок три-ПК перекристаллизовывают из хлороформа. Выход: 65%. Элементный анализ: в таблице 1. Пример 13. 2,2-Бис(нитрилоксиметил)малоновая кислота и 2-карбокси-2-нитрилоксиметилмалоновая кислота. К охлажденной до 0 С смеси из 2,5 г 95%ной НNO3, щепотки мочевины, а также 10 мл воды при перемешивании и охлаждении льдом добавляют 1,0 г (0,0061 моль) 2,2-бис(гидроксиметил)малоновой кислоты или 0,004 моль карбокси-2-гидроксиметилмалоновой кислоты. Через 10 мин при перемешивании по каплям добавляют 2,5 г 94 %-ной Н 2SО 4 и перемешивают еще на протяжении часа при 0 С. Органический слой отделяют и упаривают. В виде осадка получают 2,2-бис(нитрилоксиметил)малоновую кислоту или 2-карбокси-2-нитрилоксиметилмалоновую кислоту в виде вязкого масла, которое очищают путем колоночной хроматографии. Выход: 45% или 30%. Элементный анализ: в таблице 1. Пример 14. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропионат натрия и калия. 1,0 г (0,0032 моль) три-ПК растворяют в 30 мл воды. Раствор титруют 1%-ным водным раствором гидроксида натрия или калия при помощи рН-измерительного электрода до рН = 7. После упаривания водного раствора остается белая натриевая или калиевая соль три-ПК, которую перекристаллизовывают из небольшого количества воды. Выход: по 87%. Натриевая соль три-ПК: Элементный анализ: в таблице 1. Калиевая соль три-ПК: Элементный анализ: в таблице 1. Пример 15. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропионат натрия. 7 ммоль три-ПК растворяют в 10 мл воды. Кислый раствор при помощи 1% водного раствора едкого натра доводят до рН = 7 и в течение нескольких часов упаривают при комнатной температуре, при этом происходит медленный рост кристаллов. Выход: 85%. Т.пл. = 310-311 С (Н 2 О); Элементный анализ: в таблице 1. 16 Пример 16. Хлорангидрид 3-нитрилокси 2,2-бис(нитрилоксиметил)пропионовой кислоты. 1 г (3,5 ммоль) три-ПК с 5,3 ммоль тионилхлорида нагревают в течение 1,5 ч с обратным охлаждением; избыток тионилхлорида отгоняют сначала на водяной бане, а затем в вакууме, остаток поглощают диэтиловым эфиром и быстро промывают небольшим количеством ледяной воды. Органические фазы разделяют,сушат над сульфатом натрия, и растворитель выпаривают в вакууме. Полученный маслянистый хлорангидрид 3-нитрилокси-2,2-бис (нитрилоксиметил)пропионовой кислоты (три-ПК) является достаточно чистым для дальнейшего взаимодействия. Выход: 75%. Элементный анализ: в таблице 1. Пример 17. Дихлорангидрид 2,2-бис(нитрилоксиметил)малоновой кислоты и дихлорангидрид 2-хлоркарбонил-2-нитрилоксиметилмалоновой кислоты. Хлорангидриды 2,2-бис(нитрилоксиметил) малоновой кислоты (бис-МК) и 2-карбокси-2 нитрилоксиметилмалоновой кислоты (КН-МК) получают по аналогии с примером 10. Для получения хлорангидрида 2,2-бис(нитрилоксиметил)малоновой кислоты (бис-МКДХ) используют двойное количество тионилхлорида, а для хлорангидрида 2-хлоркарбонил-2-нитрилоксиметилмалоновой кислоты (КН-МКТриХ) - тройное количество тионилхлорида. Выход: 70 и 45%, соответственно. бис-МКДХ: элементный анализ: в таблице 1. КН-МКТриХ: элементный анализ: в таблице 1. Пример 18. Метиловый эфир 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты. К 7 ммоль три-ПК добавляют 1 мл тионилхлорида и 1 каплю сухого ДМФА и, не добавляя влаги, перемешивают 20 мин при комнатной температуре. Сразу после этого отгоняют избыточный тионилхлорид и добавляют к охлажденной до 0 С реакционной смеси 10 мл сухого метанола. Через 30 мин разбавляют 30 мл воды и пять раз экстрагируют диэтиловым эфиром. Очистка при помощи колоночной хроматографии (гексан:этилацетат = 2:1) полученного после выпаривания растворителя сырого продукта дает метиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты (метиловый эфир три-ПК) в виде бесцветных кристаллов. Выход: 44%; Т.пл. = 66 С. Элементный анализ: в таблице 1. Пример 19. Этиловый эфир 3-нитрилокси 2,2-бис(нитрилоксиметил)пропионовой кислоты. К 1 г (3,5 ммоль) три-ПК добавляют 10,5 ммоль этанола, 20 мг толуолсульфокислоты и 30 мл хлороформа и 12 ч нагревают в водоотдели 17 теле с обратным охлаждением. Хлороформенную фазу промывают водным раствором бикарбоната и водой, растворитель выпаривают в вакууме, и осадок очищают при помощи колоночной хроматографии. Этиловый эфир 3-нитрилокси-1,2-бис(нитрилоксиметил)-пропионовой кислоты (этиловый эфир три-ПК) получают в виде бесцветного масла. Выход: 85%. Элементный анализ: в таблице 1. Пример 20. Бутиловый эфир 3-нитрилокси 2,2-бис(нитрилоксиметил)пропионовой кислоты. 1 мл н-бутанола растворяют в 5 мл пиридина и при охлаждении льдом добавляют 0,5 г(1,7 ммоль) три-ПКХ (см. пример 10), растворенного в 5 мл тетрагидрофурана. В течение 1 ч нагревают на водяной бане. Сразу после этого выливают в 50 мл ледяной воды и осторожно нейтрализуют соляной кислотой. Осажденный маслянистый сложный эфир поглощают диэтиловым эфиром, промывают водным раствором карбоната натрия и водой, органическую фазу высушивают над сульфатом натрия, и растворитель выпаривают в вакууме. В результате очистки осадка при помощи колоночной хроматографии получают бутиловый эфир 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты (бутиловый эфир три-ПК) в виде бесцветного масла. Выход: 69%. Элементный анализ: в таблице 1. Пример 21. Диэтиловый эфир 2,2 бис(нитрилоксиметил) малоновой кислоты. К раствору 90 г дегазированной 100% азотной кислоты при -5 С в воздушном потоке медленно добавляют 0,015 моль диэтилового эфира 2,2-бис(гидроксиметил)малоновой кислоты. Через реакционную смесь еще 120 мин пропускают газ при -5 С и сразу после этого выливают в ледяную воду. Из водной фазы дважды выпаривают эфир, органическую фазу промывают 10% раствором гидрокарбоната и промывают водой, высушивают над сульфатом натрия,и растворитель выпаривают в вакууме. Осадок(диэтиловый эфир бис-МК) отделяют путем колоночной хроматографии. Выход: 94%. Rf = 0,52H-ЯМР (300 МГц, CDCl3): соответствует; 13 С-ЯМР (75 МГц, CDCl3): соответствует. Пример 22. Амид 3-нитрилокси-2,2 бис(нитрилоксиметил)пропионовой кислоты. 1 г (3,4 ммоль) три-ПКХ растворяют в 25 мл диоксана и добавляют избыточный концентрированный аммиачный раствор. Через 30 мин выливают в 100 мл ледяной воды и слегка подкисляют разбавленной соляной кислотой. Выпавший в осадок маслянистый амид 2,2 бис(нитрилоксиметил)-3-нитрилоксипропановой кислоты (амид три-ПК) очищают при помощи колоночной хроматографии. Выход: 65%. Элементный анализ: в таблице 1.(нитрилоксиметил)пропионовой кислоты. К 7 ммоль три-ПК примешивают 1 мл тионилхлорида и 1 каплю сухого ДМФА и, не добавляя влаги, 1,5 ч нагревают с обратным охлаждением. Сразу после этого к реакционной смеси добавляют 3 мл холодного концентрированного раствора NН 3 и оставляют раствор для охлаждения до комнатной температуры. После пятикратной экстракции водной фазы при помощи диэтилового эфира, а также удаления растворителя получают маслянистый сырой продукт, из которого путем колоночной хроматографии (гексан:этилацетат = 1:1) выделяют амид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты (амид три-ПК) в виде бесцветных кристаллов. Выход: 32%. Rf = 0,52 (Силикагель, гексан:этилацетат = 1:1); Т.пл.=71-72 С (CHCl3); Элементный анализ: в таблице 1. 1H-ЯМР (300 МГц, (СD3)2 СО): соответствует; 13 С-ЯМР (75 МГц, (СD3)2 СО): соответствует. Пример 24. N-Бензиламид 3-нитрилокси 2,2-бис(нитрилоксиметил)пропионовой кислоты. 1 г (3,5 ммоль) метилового эфира 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты с 3 мл бензиламина и 100 мг хлорида аммония на протяжении 3 ч нагревают до 130 С, охлаждают, поглощают в 50 мл хлороформа и последовательно промывают водой,разбавленной соляной кислотой, водным раствором бикарбоната и снова водой. Полученный после упаривания растворителя сырой продукт очищают при помощи колоночной хроматографии. Получают N-бензиламид 3-нитрилокси 2,2-бис(нитрилоксиметил)пропионовой кислоты(NБзл-aмид три-ПК) в виде бесцветного масла. Выход: 73%. Элементный анализ: в таблице 1. Пример 25. Гидразид 3-нитрилокси-2,2 бис(нитрилоксиметил)пропионовой кислоты. 1 г (3,5 ммоль) метилового эфира 2,2 бис(нитрилоксиметил)-3-нитрилоксипропановой кислоты с избыточным водным раствором гидрохлорида гидразина 5 ч нагревают на водяной бане. Выливают на лед и слегка подкисляют соляной кислотой. После отделения путем колоночной хроматографии выпавшего в осадок масла получают гидразид 3-нитрилокси-2,2 бис(нитрилоксиметил)пропионовой кислоты(гидразид три-ПК) в виде бесцветного масла. Выход: 63%. Элементный анализ: в таблице 1. Пример 26. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропиловый эфир 3-нитрилокси-2,2 бис(нитрилоксиметил)пропионовой кислоты. К 7 ммоль три-ПК примешивают 1 мл тионилхлорида и 1 каплю сухого ДМФА и, не добавляя влаги, 20 мин перемешивают при комнатной температуре. Сразу после этого к реак 19 ционной смеси добавляют 7 ммоль ПЭТриН,растворенного в 7 ммоль пиридина, и перемешивают 3 ч при 70 С. Желтый раствор охлаждают до 0 С и осторожно примешивают ледяную воду. После пятикратной экстракции водной фазы при помощи диэтилового эфира, а также удаления растворителя, получают масло желтого цвета, из которого путем колоночной хроматографии (гексан/этилацетат 1:1) выделяют 3-нитрилокси-2,2-бис(нитрилоксиметил)пропиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты (ПЭТриНэфир три-ПК). Выход 24%. Rf = 0,63 (Силикагель, гексан/этилацетат 1:1); Элементный анализ: в таблице 1. 1H-ЯМР (300 МГц, СDСl3): соответствует; 13 С-ЯМР (75 МГц, CDCl3): соответствует. Пример 27. 2,2-Бис(гидроксиметил)-3 гидроксипропилбромид. 200 г (1,47 моль) пентаэритрита (ПЭ), 1,5 л ледяной уксусной кислоты и 17 мл 48%-ного НВr на протяжении 1,5 ч нагревают с обратным охлаждением. После добавления дополнительных 170 мл 48%-ной НВr реакционную смесь в течение еще 3 ч нагревают до кипения. Эту же процедуру повторяют пpи добавлении 96 мл НВr. Сразу после этого ледяную уксусную кислоту и воду полностью отгоняют, к вязкому осадку примешивают 750 мл 98%-ного этанола и 50 мл 48%-ной НВr и при медленной отгонке удаляют приблизительном 500 мл этанола. После этого добавляют еще 750 мл этанола, который сразу же полностью отгоняют. После добавления 500 мл толуола растворитель отгоняют, и эту же процедуру повторяют. Вязкий осадок с 500 мл высушенного эфира при перемешивании в течение нескольких часов нагревают до кипения, пока не образуется твердое вещество белого цвета. Это твердое вещество отфильтровывают, промывают высушенным эфиром,высушивают и перекристаллизовывают из хлороформа : этилацетата = 3:2. Выход: 50%. Т.пл.= 75-76 С. Элементный анализ в таблице 1. Пример 28. 3,3-Бис(гидроксиметил)-4 гидроксибутиронитрил. К 0,055 моль 2,2-бис(гидроксиметил)-3 гидроксипропилбромида примешивают 0,07 моль KCN, растворяют в 50 мл ацетонитрила и 5 ч нагревают при перемешивании с обратным охлаждением. После охлаждения раствора твердое вещество отфильтровывают и маточный раствор концентрируют. Осадок растворяют в хлороформе, оставшийся КВr отделяют, и растворитель после высушивания отгоняют. Необходимый нитрил выделяют из осадка путем колоночной хроматографии в виде желтоватого масла. Выход: 78%. Элементный анализ в таблице 1. Пример 29. 3,3-Бис(гидроксиметил)-4-гидроксибутановая кислота. К 2,0 г 3,3-бис(гидроксиметил)-4-гидроксибутиронитрила примешивают 25 мл Ba(OH)2(T=0,62) и 30 мин нагревают с обратным охлаждением до прекращения образования аммиака. Сразу после этого добавляют 50 мл воды и воду полностью отгоняют. Бариевую соль кислоты перекристаллизовывают из смеси вода/этанол. 0,005 моль соли растворяют в небольшом количестве воды и при перемешивании добавляют 6,5 мл серной кислоты (0,9 N). Выпавший в осадок сульфат бария подвергают центрифугированию, отгоняют воду и осадок перекристаллизовывают из этанола. Выход: 60%. Элементный анализ в таблице 1. Пример 30. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропилбромид. К 37 мл 95% азотной кислоты при 30 С примешивают 0,4 г мочевины и 5 мин пропускают газ. Сразу после этого раствор охлаждают до 0 С и при перемешивании добавляют 85 мл метиленхлорида и 20 г 2,2-бис(гидроксиметил)3-гидроксипропилбромида. Потом медленно по каплям добавляют 55 г 94%-ной серной кислоты, и раствор перемешивают в течение еще одного часа. Органический слой отделяют, высушивают и удаляют растворитель. После перекристаллизации сырых кристаллов из этанола получают 3-нитрилокси-2,2-бис(нитрилоксиметил)пропилбромид. Выход: 62%. Т.пл. = 90 С. Элементный анализ в таблице 1. Пример 31. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропилбромид. К раствору 90 г дегазированной 100%-ной азотной кислоты при -5 С в воздушном потоке добавляют 0,015 моль 2,2-бис(гидроксиметил)3-гидроксипропилбромида. Через реакционную смесь еще 120 мин пропускают газ при -5 С и сразу после этого выливают в ледяную воду. Выпавший в осадок продукт отфильтровывают,промывают водой или 5%-ным раствором гидрокарбоната натрия и сразу после этого перекристаллизовывают из этанола. Выход: 91%. Пример 32. 4-Нитрилокси-3,3-бис(нитрилоксиметил)бутановая кислота. К 37 мл 95%-ной азотной кислоты при 30 С примешивают 0,4 г мочевины и 5 мин пропускают воздух. Сразу после этого раствор охлаждают до 0 С и при перемешивании добавляют 85 мл метиленхлорида и 0,1 моль 3-бис(гидроксиметил)-4-гидроксибутановой кислоты. Потом медленно по каплям добавляют 55 г 94%ной серной кислоты, и раствор перемешивают еще в течение часа. Органический слой отделяют, экстрагируют 5%-ным раствором гидроксида натрия, водный раствор подкисляют разбавленной соляной кислотой, экстрагируют метиленхлоридом, растворитель высушивают и отгоняют. После перекристаллизации из этанола получают 4-нитрилокси-3,3-бис(нитрилоксиметил)бутановую кислоту (три-БК). Выход: 65%. Элементный анализ: в таблице 1. Пример 33. 4-Нитрилокси-3,3-бис(нитрилоксиметил)бутановая кислота. 21 Эфирный раствор 2,2,2-трис(нитрилоксиметил)этилмагнийбромида получают путем воздействия 34 г 3-нитрилокси-2,2-бис (нитрилоксиметил)пропилбромида, растворенного в 60 мл высушенного диэтилового эфира, на 2,5 г магниевой стружки в атмосфере чистого азота. Раствор освобождают от лишней магниевой стружки путем фильтрации через тампон из стеклянного войлока и переносят в капельную воронку. После этого раствор Гриньяра в течение 15 мин по каплям добавляют в суспензию 150 г мелкоизмельченного порошка диоксида углерода в 60 мл безводного диэтилового эфира. Через час избыток угольной кислоты выпаривают. После этого смесь подкисляют 40 мл холодной 6N соляной кислоты и 4-нитрилокси-3,3 бис(нитрилоксиметил)бутановую кислоту экстрагируют из эфирной фазы (три-БК) при помощи разбавленного водой аммиака. Продукт получают путем добавления еще одной порции кислоты. Выход: 55%. Элементный анализ: в таблице 1. Пример 34. Метиловый эфир 4-нитрилокси-3,3-бис(нитрилоксиметил) бутановой кислоты. К 20 г три-БК примешивают 5-кратный избыток тионилхлорида и при комнатной температуре перемешивают 30 мин. Лишний тионилхлорид отгоняют, и осадок 30 мин с обратным охлаждением перемешивают с 10-кратным избытком метанола. К реакционной смеси при охлаждении примешивают воду и несколько раз экстрагируют диэтиловым эфиром. После высушивания и удаления растворителя остается маслянистый осадок, который содержит до 51% метилового эфира 4-нитрилокси-3,3-бис(нитрилоксиметил)бутановой кислоты (метиловый эфир три-БК). Элементный анализ: в таблице 1. Пример 35. 4-Нитрилокси-3,3-бис(нитрилоксиметил)бутанат натрия и калия. 1,0 г три-БК растворяют в 30 мл воды. Раствор титруют 1%-ным водным раствором гидроксида натрия или калия при помощи рНизмерительного электрода до рН = 7. После упаривания водного раствора остается белая натриевая или калиевая соль три-БК, которую перекристаллизовывают из небольшого количества воды. Выход: соответственно 90%. Натриевая соль три-БК: Элементный анализ: в таблице 1. Калиевая соль три-БК; Элементный анализ: в таблице 1. Пример 36. Метил-2,2,2-трис(нитрилоксиметил)этиловый эфир. Для приготовления метанолятного раствора берут 0,025 моль натрия и 0,12 моль абс. метанола. Добавляют 0,02 моль 3-нитрилокси-2,2 бис(нитрилоксиметил)пропилбромида и, не добавляя влаги, нагревают при помешивании в течение 5 ч с обратным охлаждением. Реакционную смесь после охлаждения смешивают с 5 кратным количеством воды, отделяют эфир(Ме-ПЭтриН-эфир), еще раз промывают водой,высушивают и очищают при помощи колоночной хроматографии. Выход: 75%. Элементный анализ: в таблице 1. Пример 37. Метил-2,2,2-трис(нитрилоксиметил)этиловый эфир. 0,02 моль ПЭТриН при добавлении каталитического количества трифторида бора растворяют в смеси метанол/вода (10:1) и при комнатной температуре примешивают эфирный раствор диазометана до тех пор, пока сохраняется желтоватая окраска или пока не перестанет образовываться N2. Растворитель отгоняют,и осадок поглощают диэтиловым эфиром. Сразу после этого промывают разбавленным едким натром и водой, высушивают и после отгонки растворителя сырой продукт (Ме-ПЭТриНэфир) очищают при помощи колоночной хроматографии. Выход: 49%. Элементный анализ: в таблице 1. Пример 38. Бис-[2,2,2-трис(нитрилоксиметил)]этиловый эфир. 7 ммоль ПЭТриН с 7 ммоль тионилхлорида и 10-кратным избытком пиридина нагревают в течение 30 мин при 50 С на водяной бане при перемешивании. Раствор охлаждают до 0 С,отделяют желтую кристаллическую массу, растворяют в диэтиловом эфире и путем многократной экстракции водным раствором соляной кислоты полностью удаляют пиридин. После удаления эфира остается вязкое масло желтого цвета, из которого после растворения в хлороформе медленно выпадают белые кристаллы бис-[2,2,2-трис(нитрилоксиметил)]этилового эфира (бис-ПЭТриН-эфир). Выход: 76%. Т.пл. = 78 С; Элементный анализ: в таблице 1. Пример 39. Бис-[2,2,2-трис(нитрилоксиметил)]этиловый эфир. Продукт получают путем медленного добавления дипентаэритрита в азотную кислоту с удельным весом 1,52, обеспечивая хорошее водное охлаждение и перемешивание. После завершения добавления 2/3 объема жидкости добавляют в конце серную кислоту, вследствие чего часть нитрата выпадает в осадок. После завершения нитрирования перемешивают еще в течение 15 мин. Реакционную смесь осторожно выливают в ледяную воду, осаждение завершается. После перекристаллизации из этанола продукт содержит чистый бис-ПЭТриН-эфир. Выход: 97%. Т.пл. = 75 С. Элементный анализ в таблице 1. Пример 40. Бис-2,2-бис(нитрилоксиметил)-2-гидроксиметил)]этиловый эфир. 0,0167 моль бис-ПЭТриН-эфира растворяют в смеси 10 мл диоксана и 10 мл этанола при кипении и на протяжении 30 мин порциями примешивают 4,2 г 25-го водного раствора гидразина. Реакционную смесь еще 2 ч нагревают при кипении с обратным холодильником. После реакции растворитель отгоняют, осадок раство 23 ряют в диэтиловом эфире, высушивают и удаляют эфир. Из маслянистого сырого продукта путем колоночной хроматографии выделяют бис-[(2,2-бис(нитрилоксиметил)-2-гидроксиметил)] этиловый эфир (бис-ПЭДН-эфир). Выход: 52%. Элементный анализ: в таблице 1. Пример 41. Исследование фармакологической активности соединений. а) Исследование осуществляют на культивированных клетках (RFL-6-фибробласты, LLCPK1-эпителиальные клетки), которые известны в качестве модели для характеристики активности и толерантности NO-доноров (Bennett et al.,J. Pharmacol. Ther. 250 (1989), 316; Schrder etRes., 28 (1996). 253). Внутриклеточная аккумуляция cGMP в качестве параметра активности и биологической активации нитрата измеряют при помощи радиоиммунного анализа. Протестированные соединения вызывают внутриклеточную аккумуляцию с GMP, которая в 2-10 раз выше по сравнению с GTN или ISMN. б). Активность соединений относительно агрегации тромбоцитов и ингибирования образования тромбоцитов определяют способами,разработанными Резе и др. (Rehse et al.) (Arch.(1996, которые были внедрены в качестве модели, в частности, расширенного Борн-тестаet al., Thromb. Haem. 64(2) (1990), 211) для описания антикоагулянтных, а также антитромботических свойств. Оно также определяется путем прямого ингибирования функции тромбов при помощи органических нитратов и их биотрансформации (Weber et al. Europ. J. Pharmacol.Molecular Pharmacol 247 (1993). 29; Weber et al.,Europ. J. Pharmacol. 309 (1996), 209). Турбодиметрическое измерение, при котором проверяли реакцию тромбоцитов на стимулирующие субстанции, как коллаген, АДФ, адреналин, тромбин, серотонин, арахидоновая кислота и др.,проводили преимущественно с помощью коллагена в отношении агрегирующей способности в присутствии или отсутствии тестируемых ингибирующих соединений. При этом измеряли процент ингибирования образования тромбов в брыжеечных артериях и венах крыс при возрастающем разбавлении 1,2510-4 мольл-1, 6,2510-5 мольл-1 и 1,2510-6 мольл-1. Соединения продемонстрировали существенное ингибирование тромбоцитов: три-ПК 20% метиловый эфир три-ПК 25% этиловый эфир три-ПК 25% ПЭТриN-эфир три-ПК 27% бис-ПЭТриN-эфир 16%. 24 в) Эндотелиальнозащитную активность соединений определяют согласно описанному в заявке DE-A1-44 10 997 способу (Noack-Kojda). г) Исследования активности относительно эректильной дисфункции определяют согласно способу, разработанному Мерфортом и др.Med. J. 312 (1996), 1512). д) Сосудорасширяющие свойства соединений проверяют путем эксперимента на изолированных кольцах аорты кролика (Нsgen, Noack,Kojda: Int Confer. "Mediators in the cardiovascularSystem", S. 9, Malta 2.-5.6.1994), при которых последние подвешивают в ванночке и стимулируют таким сосудосужающим средством, как фенилэфир. После установления стабильного тонуса гладкой мышцы путем добавления вышеупомянутых вазодилататоров при помощи кумулятивной кривой концентрация-активность вычисляется воздействие тонуса. Для этого к буферу в ванночке добавляют вазодилататор в возрастающих концентрациях от 1 нМ до 10 мкМ, причем промывания между различными фракциями не делается. При добавлении вещества у всех колец аорты наблюдается постепенное усиление сокращения в присутствии вазоконстриктора. Степень релаксации выражается в процентах, которые сохраняются при соответствующей концентрации активного вещества(остаточное сокращение). Половина максимально эффективной концентрации EC50 соответствует эффективному значению и приводится как значение pD2 (Концентрация в logМ), соответственно, по сравнению с известными соединениями ПЭТН, РЭТриН, РЭДН, а также ПЭМН с соответствующей гидрофильностью или гидрофобностью Соединение Значение pD2 ПЭТриН-эфир три-ПК 25 Пример 42. Типичная дующий состав: Активное вещество Лактоза Картофельный крахмал Желатин Тальк Стеарат магния Диоксид кремния, высокодисперсный Пример 43. Один баллон аэрозоля содержит: а) три-ПК 0,05 мас. % в воде б) три-ПК 0,3 мас. % в воде в) три-ПК 5 мас. % в воде г) три-ПК 10 мас. % в воде д) Натриевая соль три-ПК 0,3 мас.% в воде е) Натриевая соль три-ПК 5 мас.% в воде ж) Калиевая соль три-ПК 0,3 мас.% в воде з) Калиевая соль три-ПК 5 мас.% в воде и) Натриевая соль три-БК 0,3 мас.% в воде к) Натриевая соль три-БК 5 мас.% в воде л) Калиевая соль три-БК 0,3 мас.% в воде м) Калиевая соль три-БК 5 мас.% в воде 26 Пример 44. Детонирующие свойства соединений определяют известными способами, вычисляя нагрузку расширения, скорость детонации, давление импульса и возбудимость (Ullmanns Encyklopdie der technischen Сhemiе, Bd. 16, 3. Aufl.,UrbanSchwarzenberg, Mnchen-Berlin, 1965). Пример 45. [3-Нитрилокси-2,2-бис (нитрилоксиметил)пропил]фосфорилхолин. К перемешанному раствору 3,5 мл (26 ммоль) триэтиламина и 0,81 г (5,25 ммоль фосфорилхлорида в 30 мл хлороформа в течение 30 мин в атмосфере аргона при 0 С по каплям добавляют 1,35 ПЭТриН (5,0 ммоль), растворенного в 25 мл хлороформа. Без охлаждения перемешивают еще 1 ч. Сразу после этого снова охлаждают до 0 С, быстро по каплям добавляют раствор 2,06 г (7,5 ммоль) холинтозилата в 60 мл пиридина, а после этого 15 ч перемешивают при комнатной температуре. После добавления 3,5 г NaHCO3, растворенного в воде (насыщенного), упаривают в вакууме, осадок поглощают метиленхлоридом и фильтруют. Сырой продукт,полученный после упаривания растворителя в вакууме, очищают путем колоночной хроматографии на силикагеле гексан/этилацетат/метанол = 1:1:1). Получают 830 мг [3-нитрилокси 2,2-бис(нитрилоксиметил)пропил]фосфорилхолина в виде бесцветного масла. Выход: 37%; Элементный анализ: в таблице 1. Таблица 1 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы I где R1, R2, R3 представляют собой одинаковые или различные CH2-ONO2, CH2-OR4 или R5, при этом, по крайней мере, один из заместителей R1,R2, R3 идентичен R5,R4 обозначает Н или C1-С 6-алканоил,R5 обозначает COR6,R6 обозначает ОН, OR7, NH2, NHR7, NR72,+ 7R7 обозначает неразветвленный или разветвленный C1-С 6-алкил, неразветвленный или разветвленный C1-С 6-алкенил, арил-, аралкил-,гетарил- или гетаралкил,R8 обозначает C1-С 6-алкилиден,R9, R10 обозначают различные между собой 7R,R11, R12 обозначают одинаковые или различные NR72, N+R73X-, NR8, а также Х обозначает галоген или анионообразующую группу, а также их терапевтически приемлемые соли, кроме 3-нитрилокси-2,2 бис(нитрилоксиметил)пропионовой кислоты и метилового эфира 3-нитрилокси-2,2-бис (нитрилоксиметил)пропионовой кислоты. 2. Соединение по п.1, соответствующее формулам II-VII(O2NOCH2)2C(CH2ONO2)COR6 (II),(O2NOCH2)2C(COR6)2 (III),O2NOCH2C(COR6)3 (IV),(O2NOCH2)2C(CH2OR4)COR6 (V),(O2NOCH2)C(CH2OR4)2COR6 (VI),(O2NOCH2)C(CH2OR4)(COR6)2 (VII). 3. Соединение по п. 2, где R4 обозначает Н или C1-С 6-алканоил и R6 обозначает ОН, OR7,NH2, NHR7, NR72 или N+R73X-. 4. Соединение по п.2, представляющее собой этиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, пропиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, бутиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, бензиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, амид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, N-бензиламид 3-нитрилокси-2,2-бис(нитрилоксиметил) пропионовой киcлоты, гидразид 3-нитрилокси 2,2-бис(нитрилоксиметил)пропионовой кислоты, диметиловый эфир 1,2-бис(нитрилоксиметил)малоновой кислоты и диметиловый эфир 2 метоксикарбонил-2-нитрилоксиметилмалоновой кислоты. 5. Соединение по п.2, соответствующее формулам IX-XIII,2,2-бис(нитрилоксиметил)малоновая кислота,2-карбокси-2-нитрилоксиметилмалоновая кислота,2,2-бис(нитрилоксиметил)-3-гидроксипропионовая кислота,3-гидрокси-2-гидроксиметил-2-нитрилоксиметилпропионовая кислота и 2-гидроксиметил-2-нитрилоксиметилмалоновая кислота 29 6. 3-нитрилокси-2,2-бис(нитрилоксиметил) пропионат натрия и 3-нитрилокси-2,2-бис (нитрилоксиметил)пропионат калия. 7. Соединение общей формулы XIV где R13 обозначает группу формулы XV-O-CH2-C(CH2OH)q(CH2ONO2)r (XV) и m - r - целые числа, при которых m+n+o+p=4,q+r=3, m и/или r1 и о и/или р 1. 8. Соединение по п.7, представляющее собой 3-нитрилокси-2,2-бис(нитрилоксиметил) пропиловый эфир 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты. 9. Соединение общей формулы XVI где R14, R15, R16 являются одинаковыми или различными и обозначают Н, OR19, ONO2, OR17 илиO(PO2H)OR , OSO2OR или COOR19,R19 обозначает Н, неразветвленный или разветвленный C1-C6-алкил,R20 обозначает неразветвленный или разветвленный C1-C6-алкил-R21,R21 обозначает NR192, N+R193 или N+R193X-;X обозначает галоген или пригодную анионообразующую группу, а также их терапевтически приемлемые соли, за исключением комбинаций , где(O2NOCH2)3 С-CH2-OR19 (XVIII). 15. Соединение по п.14, где R19 обозначает метил или этил. 16. Соединение общей формулы XIX 19[2,2-бис(нитрилоксиметил)-3-нитрилоксипропил]-фосфорилхолин. 19. Соединение общей формулы XXII где R27 обозначает независимо друг от другаNO2 или R17-R23, с соответствующим вышеуказанным в п.9 значением, и n обозначает целое число от 0 до 10, предпочтительно от 0 до 4, за исключением комбинаций, где n=0, R27=NO2,n=1, R27=NO2, а также n=2, R27=NO2. 20. Соединение по п.19, соответствующее формуле XXIV, бис-[2,2-бис(нитрилоксиметил)2-гидроксиметил]этиловый эфир(XXV) 22. Соединение общей формулы I где R1, R2, R3 одинаковые или различные и обозначают СH2-ONO2, CH2-OR4 или R5, причем, по меньшей мере, один из заместителей R1-R3 идентичен R5,R4 обозначает Н или C1-С 6-алканоил,R5 обозначает COR6,R6 обозначает, по меньшей мере, в одном значении Сl или Br, далее ОН, OR7, NН 2, NHR7,NR72, N+R73X-, NR8, NR9R10, NR11R12 или NHNH2,R7 обозначает неразветвленный или разветвленный C1-С 6-алкил, неразветвленный или разветвленный C1-С 6-алкенил, арил-, аралкил-,гетарил- или гетаралкил,R8 обозначает C1-С 6-алкилиден,R9, R10 обозначают различные между собой 7R,R11, R12 одинаковые или различные и обозначают NR72, N+R73 Х-, NR8, а также Х обозначает галоген или анионообразующую группу. 23. Соединение по п.22, представляющее собой хлорид 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, дихлорид 2,2 бис(нитрилоксиметил)малоновой кислоты и дихлорид 2-хлоркарбонил-2-нитрилоксиметилмалоновой кислоты. 24. Соединение общей формулы XIV Х обозначает галоген или анионообразующую группу. 26. Применение соединения по пп.1-21 в качестве лекарственного средства. 27. Применение соединения по пп.1-21 в качестве сосудорасширяющего средства. 28. Применение соединения по пп.1-21 в качестве эндотелизащитного средства. 29. Применение соединения по пп.1-21 в качестве средства против окислительной нагрузки на организм. 30. Применение соединения по пп.1-21 в качестве средства против окислительной нагрузки на сосуды и ткани организма. 31. Применение соединения по пп.1-21 в качестве средства, ингибирующего агрегацию тромбоцитов. 32. Применение соединения по пп.1-21 в качестве средства против эректильной дисфункции. 33. Применение соединения по пп.1-21 для получения фармацевтических композиций. 34. 3-Нитрилокси-2,2-бис(нитрилоксиметил)пропионовая кислота, метиловый эфир 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, соединения oбщей формулы где R13, по меньшей мере, в одном значении представляет собой Сl или Вr, в остальных группу формулы XVm+n+o+p=4, q+r=3, m и/или r1 и о и/или р 1. 25. Соединение общей формулы XVI где R14, R15, R16 одинаковые или различные и обозначают Н, OR19, ONO2, OR17 или R18,R17 обозначает COR19 или R23,R18, по меньшей мере, в одном значении представляет собой СОСl или СOBr, далее обозначает O(РО 2H)ОR20, O(РО 2 Н)OR22, OSO2OR22 или COOR19,R19 обозначает Н, неразветвленный или разветвленный C1-С 6-алкил,R20 обозначает неразветвленный или разветвленный C1-С 6-алкил-R21,R21 обозначает NR192, N+R193 или N+R193X-;n = 2, R27 = NO2,в качестве лекарств, в частности, сосудорасширяющих и эндотелизащитных средств, в качестве средства против окислительной нагрузки на организм, в качестве средства против окислительной нагрузки на сосуды и ткани млекопитающих, в качестве средства, ингибирующего агрегацию тромбоцитов, а также в качестве средства против эректильной дисфункции. 35. Применение соединений по п.34 для получения фармацевтических композиций. 36. Фармацевтическая композиция, содержащая одно или несколько соединений по пп.121, 34. 37. Фармацевтическая композиция по п.36,отличающаяся тем, что она содержит дополнительно другие используемые для лечения сердца и органов кровообращения активные вещества,в частности, активные вещества из групп АСЕингибиторов, антиатеросклеротических веществ, антигипертензивных веществ, бетаблокаторов, веществ, снижающих уровень холестерина, мочегонных средств, антагонистов кальция, дилататоров коронарных сосудов, веществ, снижающих уровень липидов, дилататоров периферийных сосудов или ингибиторов агрегации тромбоцитов. 38. Применение фармацевтической композиции по пп.36 и 37 для лечения заболеваний сердца и органов кровообращения или для защиты сосудов и тканей. 39. Способы лечения организма человека или животных с применением соединений по пп.1-21, 34 или фармацевтической композиции по пп.36 и 37. 40. Применение 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, метилового эфира 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, соединения общей формулы XVIn = 1, R27 = NO2, а также n = 2, R27 = NO2 для получения соединений по пп.1-25. 41. Способ получения 3-нитрилокси-2,2 бис(нитрилоксиметил)пропионовой кислоты,отличающийся тем, что 3-нитрилокси-2,2 бис(нитрилоксиметил)пропанол непосредственно окисляют до 3-нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты. 42. Способ по п.41, отличающий тем, что в качестве окислителя используют перманганат калия. 43. Способ получения метилового эфира 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, отличающийся тем, что галогенид 3-нитрилокси-2,2-бис(нитрилоксиметил) пропионовой кислоты этерифицируют метанолом. 44. Способ получения метилового эфира 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, отличающийся тем, что 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовую кислоту переводят в галогенид 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, в частности, в хлорид 3 нитрилокси-2,2-бис(нитрилоксиметил)пропионовой кислоты, и этот галогенид сразу после этого этерифицируют метанолом. 45. Способ по п.44, отличающийся тем, что получение осуществляют без выделения галогенида 3-нитрилокси-2,2-бис(нитрилоксиметил) пропионовой кислоты.
МПК / Метки
МПК: A61K 31/26, C06B 25/00, C07F 9/09, A61P 7/02, C07C 203/04
Метки: производные, промежуточные, получение, применение, новые, продукты, синтеза, также, пентаэритрита
Код ссылки
<a href="https://eas.patents.su/18-1959-novye-proizvodnye-pentaeritrita-ih-poluchenie-i-primenenie-a-takzhe-promezhutochnye-produkty-dlya-ih-sinteza.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные пентаэритрита, их получение и применение , а также промежуточные продукты для их синтеза</a>