Новые соединения изохинолина, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 7714
Опубликовано: 29.12.2006
Авторы: Бутэн Жан Альбер, Пуассонье-Дюрье Софи, Гаснеро Анн, Ренар Пьер, Лесьё Даниэль, Одино Валери, Бенжан Каролин, Делагранж Филипп, Валле Валери, Йюс Саид
Формула / Реферат
1. Соединения формулы (I)
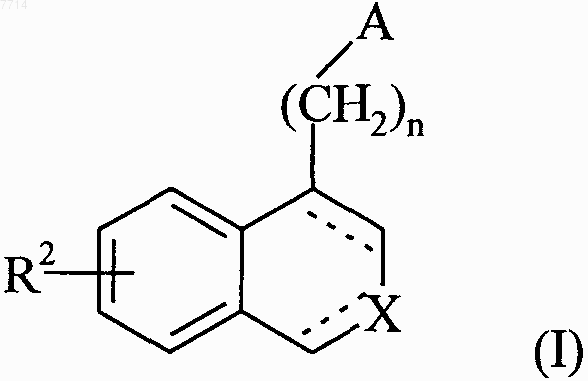
в которой n принимает значения 1, 2 или 3,
А представляет собой группу 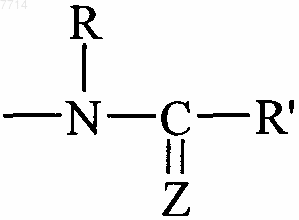 или группу
или группу 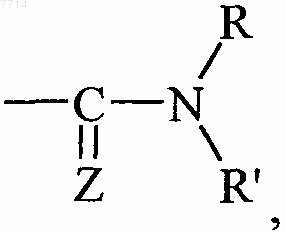 в которых
в которых
Z представляет собой атом кислорода,
R и R", которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу, и
R' представляет собой линейную или разветвленную (С1-С6)алкильную группу, (С3-С8)циклоалкильную группу,
X представляет собой атом азота или группу N-R1, в которой R1 представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу, (С3-С8)циклоалкильную группу, (С3-С8)циклоалкил-(С1-С6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, арильную группу или арил-(С1-С6)алкильную группу, в которой алкильный остаток является линейным или разветвленным,
R2 представляет собой линейную или разветвленную (С1-С6)алкоксигруппу, (С3-С8)циклоалкилокси или (С3-С8)циклоалкил-(С1-С6)алкилоксигруппу, в которой остаток алкилокси является линейным или разветвленным,
обозначение --- указывает, что связь является простой или двойной, при условии, что соблюдена валентность атомов, где
"арил" следует понимать в значении фенильной или нафтильной группы, которые являются незамещенными или замещенными от 1 до 3 раз одинаковыми или разными группами, выбранными из линейной или разветвленной (С1-С6)алкильной группы, линейной или разветвленной (С1-С6)алкоксигруппы, ОН, СООН, алкоксикарбонильной группы, в которой остаток алкокси является линейным или разветвленным, формильной группы, нитрогруппы, цианогруппы, гидроксиметильной группы, аминогруппы (необязательно замещенной одной или двумя линейными или разветвленными (С1-С6)алкильными группами) и атомов галогена, их соли присоединения с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы I по п.1, в которой n принимает значение 2 и А представляет собой
-NHCOR' группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы I по п.1, в которой n принимает значение 3 и А представляет собой CONHR' группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы I по п.1, в которой R2 представляет собой метоксигруппу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы I по п.1, в которой X представляет собой атом азота, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы I по п.1, в которой X представляет собой NPh или NBz группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
7. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-4-изохинолинил)этил]ацетамид, а также его соли присоединения с фармацевтически приемлемой кислотой.
8. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-4-изохинолинил)этил]бутанамид, а также его соли присоединения с фармацевтически приемлемой кислотой.
9. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-4-изохинолинил)этил]пропанамид, а также его соли присоединения с фармацевтически приемлемой кислотой.
10. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-4-изохинолинил)этил]циклопропанкарбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой.
11. Соединение формулы I по п.1, которое представляет собой 4-(6-метокси-4-изохинолинил)-N-метилбутанамид, а также его соли присоединения с фармацевтически приемлемой кислотой.
12. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-2-фенил-1,2,3,4-тетрагидро-4-изохинолинил)этил]ацетамид, а также его соли присоединения с фармацевтически приемлемой кислотой.
13. Соединение формулы I по п.1, которое представляет собой N-[2-(2-бензил-6-метокси-1,2,3,4-тетрагидро-4-изохинолинил)этил]ацетамид, а также его соли присоединения с фармацевтически приемлемой кислотой.
14. Соединение формулы I по п.1, которое представляет собой N-{2-[2-(циклопропилметил)-6-метокси-1,2,3,4-тетрагидро-4-изохинолинил]этил}ацетамид, а также его соли присоединения с фармацевтически приемлемой кислотой.
15. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (II)
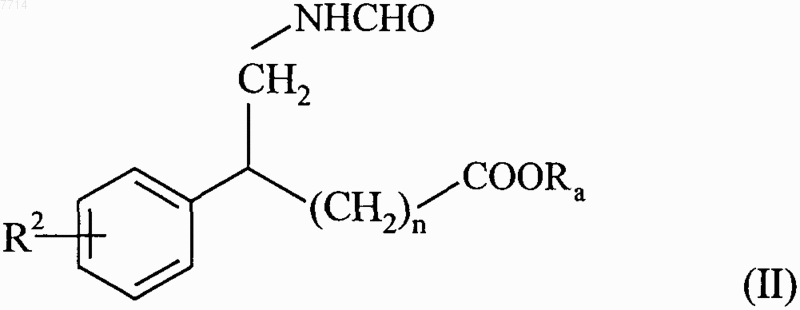
в которой R2 и n принимают значения, указанные для формулы (I), и Ra представляет собой линейную или разветвленную (С1-С6)алкильную группу, которое подвергают воздействию РОСl3, чтобы получить соединение формулы (III)
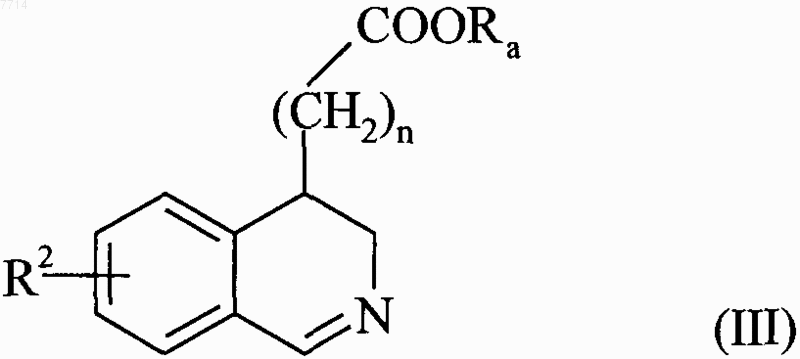
в которой R2, n и Ra принимают значения, указанные выше, которое помещают
в присутствии палладия-на-угле, с получением соединения формулы (IV)
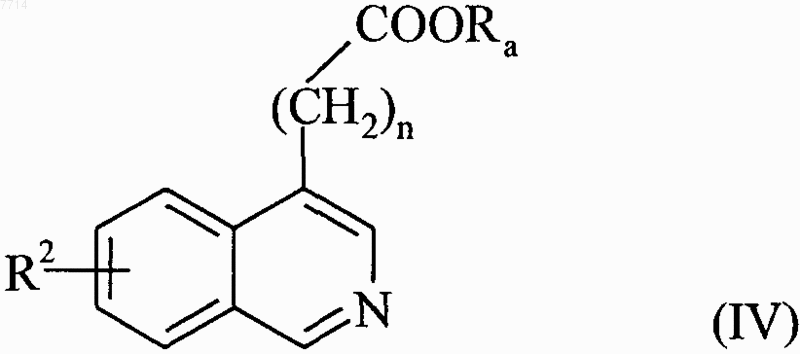
в которой R2, n и Ra принимают значения, указанные выше,
или которое гидрогенизируют в присутствии палладия-на-угле, с получением соединения формулы (V)
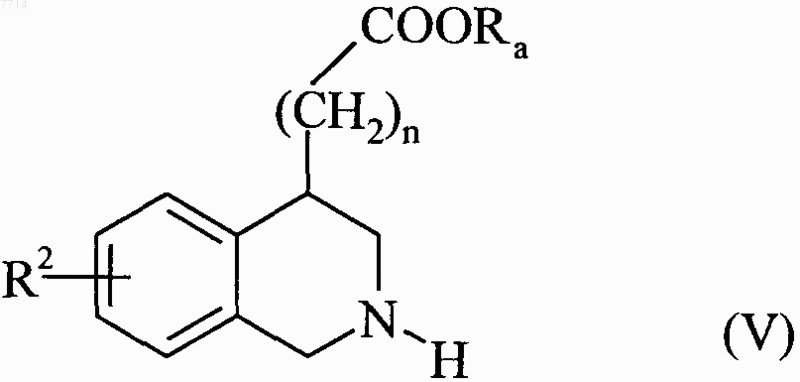
в которой R2, n и Ra принимают значения, указанные выше,
соединение формулы (V) конденсируют с соединением формулы G-R'1, в которой G представляет собой уходящую группу и R'1 может принимать любое из значений, указанных для R1, за исключением атома водорода, с получением соединения формулы (VI)
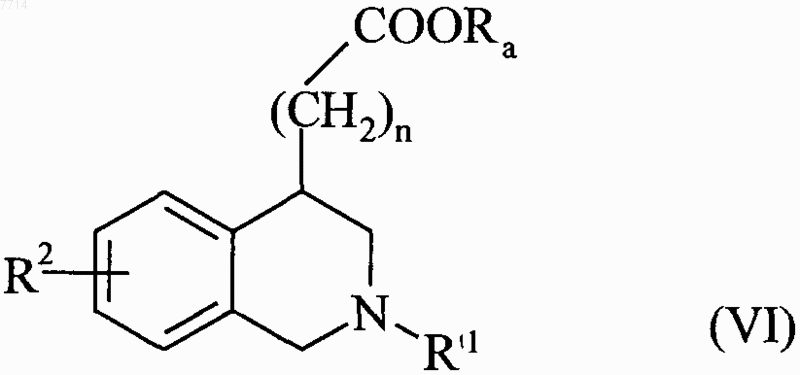
в которой R2, R'1, n и Ra принимают значения, указанные выше, соединения формул (III)-(VI) составляют соединения формулы (VII)
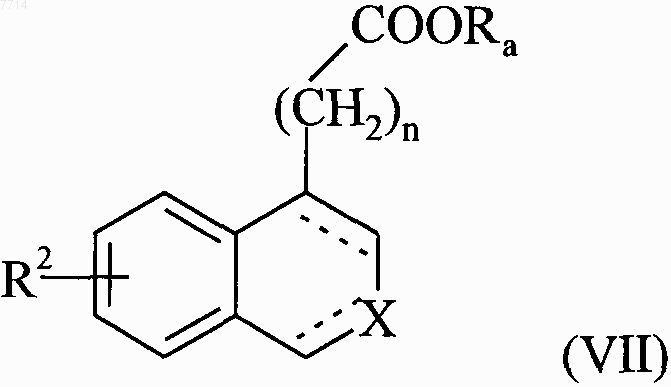
в которой R2, n и Ra принимают значения, указанные выше, и X и обозначение --- принимают значения, указанные для формулы (I),
соединение формулы (VII) конденсируют с амином формулы HNRR', в которой R и R1 принимают значения, указанные для формулы (I), с получением соединения формулы (I/а), частного случая соединений формулы (I)
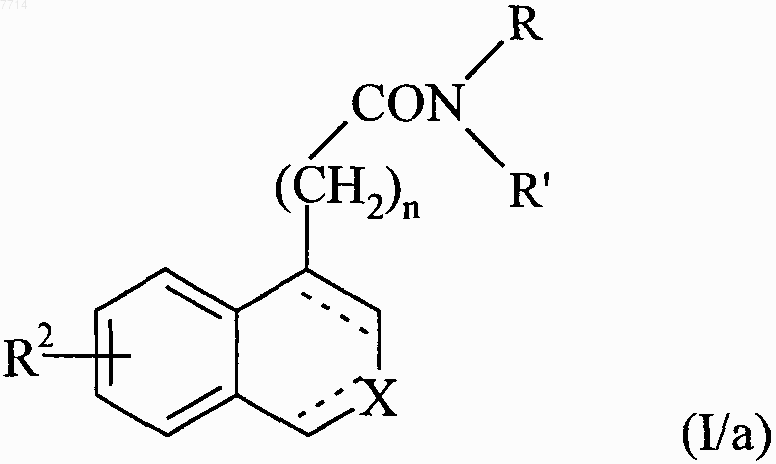
в которой R2, R, R', X, n и обозначение --- принимают значения, указанные выше, или соединение формулы (VII) подвергают последовательности реакций, стандартных в органической химии, чтобы получить соединение формулы (VIII)
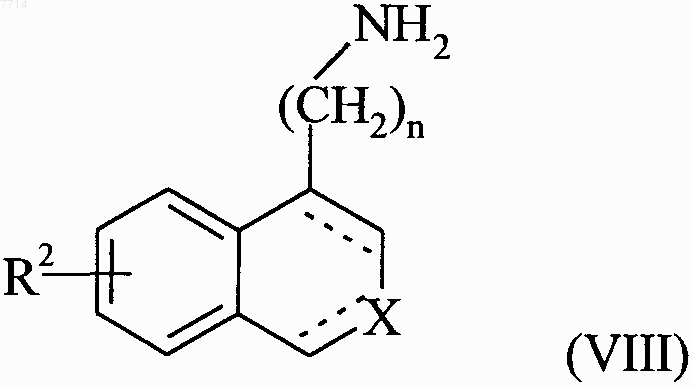
в которой R2, X, n и обозначение --- принимают значения, указанные выше, которое
или подвергают реакции с ацилхлоридом ClCOR' или с соответствующим смешанным или симметрическим ангидридом, в котором R' принимает значения, указанные выше, с получением соединения формулы (I/b), частного случая соединений формулы (I)
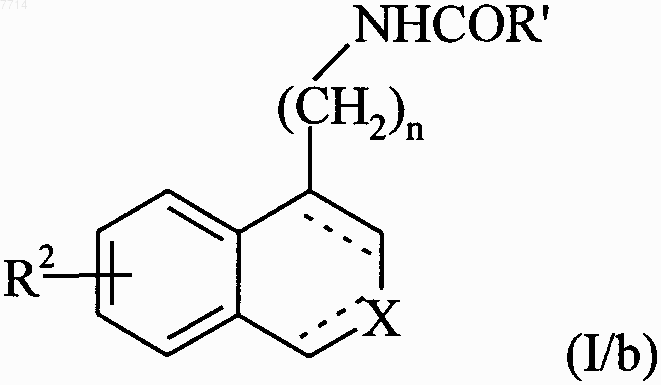
в которой R2, R', X, n и обозначение --- принимают значения, указанные выше, необязательэю далее подвергают реакции с соединением формулы R'a-J, в которой R'a может принимать любое из значений, указанных для R', и J представляет собой уходящую группу, такую как атом галогена или тозильную группу, с получением соединения формулы (I/с), частного случая соединений формулы (I)

в которой R2, R', R'a, X, n и обозначение --- принимают значения, указанные выше,
соединения от (I/а) до (I/с), составляющие совокупность соединений формулы (I), могут быть очищены, согласно обычной методике очистки, при желании, преобразованы в соли присоединения с фармацевтически приемлемой кислотой или основанием, и необязательно разделены на изомеры согласно обычной методике разделения.
16. Фармацевтические композиции, содержащие соединения формулы I по любому из пп.1-14 или их соли присоединения с фармацевтически приемлемой кислотой или основанием в комбинации с одним или более фармацевтически приемлемыми наполнителями.
17. Фармацевтические композиции по п.16 для использования в производстве лекарственных средств для лечения расстройств мелатонинэргической системы.
18. Фармацевтические композиции по п.16 для использования в производстве лекарственных средств для лечения расстройств сна, стресса, беспокойств, сезонных эмоциональных расстройств или глубокой депрессии, сердечно-сосудистых патологий, патологий пищеварительной системы, бессонницы и усталости вследствие нарушения суточного ритма организма, шизофрении, острых тревожных состояний с реакцией паники, меланхолии, расстройств аппетита, ожирения, бессонницы, боли, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных расстройств, связанных с нормальным или патологическим старением, мигрени, потери памяти, болезни Альцгеймера, расстройств мозгового кровообращения, а также при половой дисфункции, как ингибиторы овуляции, иммуномодуляторы и при лечении раковых опухолей.
Текст
007714 Настоящее изобретение относится к новым производным изохинолина, способу их получения, а также к фармацевтическим композициям, содержащим их. Из литературы известны производные изохинолина, которые являются полезными в качестве сосудорасширяющих средств (US 4880817, US 4843071, US 4822800), или полезны как регуляторы роста растений (Czasopismo Techniezne (Krakow), 1992, 89 (1), 7-12), как модуляторы тирозинфосфатазы (WO 99/46268), или также пригодные для синтеза (Tetrahedron Letters, 2002, 43 (19), 3557-3560; Heterocycles,2000, 52 (3), 1371-1383). Соединения настоящего изобретения являются, принимая во внимание их исходную структуру, новыми и обладают фармакологическими свойствами, которые представляют значительный интерес в отношении мелатонинэргических рецепторов. За последние 10 лет многочисленные исследования показали, что мелатонин (N-ацетил-5-метокситриптамин) играет значительную роль в большом количестве физиопатологических явлений, а также в контроле циркадного ритма, но вследствие быстрых метаболических процессов мелатонин имеет довольно короткий период полураспада. Поэтому огромный интерес заключается в возможности создания доступных клинических аналогов мелатонина, которые были бы более устойчивыми к метаболизму,имели агонистический или антагонистический характер, и можно ожидать, имели бы терапевтический эффект как непосредственно у самого гормона или выше. В дополнение к их положительному эффекту в отношении нарушений циркадного ритма (J. Neurosurg.,1985, 63., стр. 321-341) и расстройств сна (Psychopharmacology, 1990, 100, стр. 222-226), лиганды мелатонинэргических систем обладают ценными фармакологическими свойствами в отношении центральной нервной системы, например транквилизаторные и нейролептические свойства (Neuropharmacology ofPineal Secretions, 1990, 8 (3-4), стр. 264-272), болеутоляющие свойства (Pharmacopsychiat., 1987, 20, стр. 222-223), они также пригодны для лечения болезни Паркинсона (J. Neurosurg., 1985, 63, стр. 321-341) и болезни Альцгеймера (Brain Research, 1990, 528, стр. 170-174). Эти соединения также показали активность в отношении некоторых раковых опухолей (Melatonin - Clinical Perspectives, Oxford UniversityPress, 1988, стр. 164-165), овуляции (Science 1987, 227, стр. 714-720), диабета (Clinical Endocrinology,1986, 24, стр. 359-364), и при лечении ожирения (International Journal of Eating Disorders, 1996, 20 (4), стр. 443-446). Указанные различные эффекты приводятся в действие через посредника определенных рецепторов мелатонина. Молекулярно-биологические исследования показали существование множества подтипов рецепторов, которые способны связывать этот гормон (Trends Pharmacol. Sci., 1995, 16, стр. 50; WO 97.04094). Некоторые из этих рецепторов были установлены и охарактеризованы для различных видов,включая млекопитающих. Для того чтобы лучше понимать физиологические функции этих рецепторов,огромным преимуществом является наличие доступных селективных лигандов. Кроме того, такие соединения, взаимодействуя селективно с одним или другим из этих рецепторов, могут быть превосходными медикаментами для клинициста при лечении патологий, связанных с мелатонинэргической системой,некоторые из которых были упомянуты выше. Помимо новизны, соединения настоящего изобретения демонстрируют очень сильную аффинность к рецепторам мелатонина и/или селективность к одним или другим подтипам мелатонинэргических рецепторов. Более конкретно, настоящее изобретение относится к соединениям формулы (I)Z представляет собой атом серы или атом кислорода,R и R", которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, иR' представляет собой линейную или разветвленную (C1-С 6)алкильную группу, линейную или разветвленную (С 2-С 6)алкенильную группу, линейную или разветвленную (С 2-С 6)алкинильную группу, (С 3 С 8)циклоалкильную группу, (С 3-С 8)циклоалкил-(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, арильную группу, арил-(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, гетероарильную группу или гетероарил-(С 1 С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным,X представляет собой атом азота или группу N-R1, в которой R1 представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, (С 3-С 8)циклоалкильную группу, (С 3-1 007714 С 8)циклоалкил-(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, арильную группу, ароильную группу, арил-(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, гетероарильную группу, гетероароильную группу или гетероарил-(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным,R2 представляет собой линейную или разветвленную (С 1-С 6)алкоксигруппу, (С 3-С 8)циклоалкилокси или (С 3-С 8)циклоалкил-(С 1-С 6)алкилоксигруппу, в которой остаток алкилокси является линейным или разветвленным,обозначениеуказывает, что связь является простой или двойной,при условии, что соблюдена валентность атомов, где"арил" следует понимать в значении фенильной или нафтильной группы, которые являются незамещенными или замещенными от 1 до 3 раз одинаковыми или разными группами, выбранными из линейной или разветвленной (С 1-С 6)алкильной группы, линейной или разветвленной (С 1-С 6)алкоксигруппы, ОН, СООН, алкоксикарбонильной группы, в которой остаток алкокси является линейным или разветвленным, формильной группы, нитрогруппы, цианогруппы, гидроксиметильной группы, аминогруппы (необязательно замещенной одной или двумя линейными или разветвленными (С 1 С 6)алкильными группами) и атомов галогена,"гетероарил" следует понимать в значении любой моно- или бициклической группы, которая имеет от 5 до 10 кольцевых членов, и может содержать от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота, такой как группы: фуран, тиофен, пиррол, имидазолин, пиридин, хинолин, изохинолин, хроман,индол, бензотиофен или бензофуран, причем эти группы могут быть частично гидрогенированными, незамещенными или замещенными от одного до трех раз одинаковыми или разными группами, выбранными из линейной или разветвленной (С 1-С 6)алкильной группы, линейной или разветвленной (С 1 С 6)алкоксигруппы, ОН, СООН, алкоксикарбонильной группы, в которой остаток алкокси является линейным или разветвленным, формильной группы, нитрогруппы, цианогруппы, аминогруппы (необязательно замещенной одной или двумя линейными или разветвленными (С 1-С 6)алкильными группами) и атомов галогена,к их энантиомерам и диастереоизомерам, а также к их солям присоединения с фармацевтически приемлемой кислотой или основанием. Из фармацевтически приемлемых кислот можно отметить, не подразумевая никакого ограничения,хлористо-водородную, бромисто-водородную, серную, фосфорную, уксусную, трифторуксусную, молочную, пировиноградную, малоновую, янтарную, глутаровую, фумаровую, винную, малеиновую, лимонную, аскорбиновую, метансульфоновую, камфорную кислоту и т.д. Из фармацевтически приемлемых оснований можно отметить, не подразумевая никакого ограничения, гидроокись натрия, гидроокись калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными значениями для n являются 2 и 3. Предпочтительные соединения согласно изобретению представляют собой соединения формулы (I),в которойn принимает значение 2 и А представляет собой -NHCOR1 группу и в особенности -NHCOR' группу,в которой R' представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, такую как, например, метил, этил, пропил, изопропил, бутил, изобутил, пентил или гексил, или (С 3 С 8)циклоалкильную группу, такую как, например, циклопропил, циклобутил, циклопентил или циклогексил,n принимает значение 3 и А представляет собой -CONHR' группу и в особенности -CONHR1 группу,в которой R' представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, такую как, например, метил, этил, пропил, изопропил, бутил, изобутил, пентил или гексил, или (С 3 С 8)циклоалкильную группу, такую как, например, циклопропил, циклобутил, циклопентил или циклогексил. Группа R2 предпочтительно представляет собой алкоксигруппу и в особенности метоксигруппу.X предпочтительно представляет собой атом азота или NR1 группу, в которой R1 представляет собой циклоалкилалкильную группу, незамещенную или замещенную фенильную группу, или бензильную группу, в которой фенильный остаток является замещенным или незамещенным. Наиболее предпочтительно настоящее изобретение относится к следующим соединениям формулы (I):N-[2-(6-метокси-4-изохинолинил)этил]ацетамид,N-[2-(6-метокси-4-изохинолинил)этил]бутанамид,N-[2-(6-метокси-4-изохинолинил)этил]пропанамид,N-[2-(6-метокси-4-изохинолинил)этил]циклопропанкарбоксамид,4-(6-метокси-4-изохинолинил)-N-метилбутанамид,N-[2-(6-метокси-2-фенил-1,2,3,4-тетрагидро-4-изохинолинил)этил]ацетамид,N-[2-(2-бензил-6-метокси-1,2,3,4-тетрагидро-4-изохинолинил)]этил]ацетамид,N-2-[2-(циклопропилметил)-6-метокси-1,2,3,4-тетрагидро-4-изохинолинил]этилацетамид. Энантиомеры, диастереоизомеры, а также соли присоединения с фармацевтически приемлемой ки-2 007714 слотой или основанием предпочтительных соединений изобретения образуют неотъемлемую часть настоящего изобретения. Настоящее изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества используют соединение формулы (II) в которой R2 и n принимают значения, указанные для формулы (I) и Ra представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, которое подвергают воздействию РОСl3, чтобы получить соединение формулы (III) в которой R2, n и Ra принимают значения, указанные выше, которое помещают в присутствии палладияна-угле, с получением соединения формулы (IV) в которой R2, n и Ra принимают значения, указанные выше,и соединение формулы (V) конденсируют с соединением формулы G-R'1, в которой G представляет собой уходящую группу, такую как а атом галогена или трет-бутоксикарбонильную группу, и R'1 может принимать любое из значений, указанных для R1, за исключением атома водорода, с получением соединения формулы (VI) в которой R2, R'1, n и Ra принимают значения, указанные выше, соединения формул (III)-(VI) составляют соединения формулы (VII) в которой R2, n и Ra принимают значения, указанные выше, и X, и обозначениепринимают значения,указанные для формулы (I), которое конденсируют с амином формулы HNRR', в которой R и R1 принимают значения, указанные для формулы (I), с получением соединения формулы (I/а), частного случая соединений формулы (I)-3 007714 в которой R2, R, R', X, n и обозначениепринимают значения, указанные выше, или соединение формулы (VII) подвергают последовательности реакций, стандартных в органической химии, с получением соединения формулы (VIII) в которой R2, X, n и обозначениепринимают значения, указанные выше,которое или подвергают реакции с ацилхлоридом ClCOR' или соответствующим смешанным или симметрическим ангидридом, в котором R' принимает значения, указанные выше, с получением соединения формулы (I/b), частного случая соединений формулы (I) в которой R2, R', X, n и обозначениепринимают значения, указанные выше,необязательно далее подвергают реакции с соединением формулы R'a-J, в которой R'a может принимать любое из значений, указанных для R' и J представляет собой уходящую группу, такую как атом галогена или тозильную группу, с получением соединения формулы (I/с), частного случая соединений формулы (I)(IX) в которой R' принимает значения, указанные выше, необязательно далее подвергают реакции с соединением формулы R'a-J, как она указана выше, с получением соединения формулы (I/d), частного случая соединений формулы (I) в которой R2, R, R', n, X и обозначениепринимают значения, указанные выше, и R" принимает значения, указанные для формулы (I), причем соединения формул от (I/а) до (I/d) можно подвергнуть действию тионизирующего агента, такого как, например, реагент Лоусона (Lawesson's reagent), с получением соединения формулы (I/е), частного случая соединений формулы (I)C(S)NRR', N(R)C(S)R' или N(R)C(S)NR'R" группу, где R, R' и R" принимают значения, указанные выше,соединения от (I/а) до (I/е), составляющие совокупность соединений формулы (I), могут быть, при желании, очищены, согласно обычной методике очистки, при желании, преобразованы в соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделены на изомеры согласно обычной методике разделения. Исходные соединения (II) или коммерчески доступны или могут быть легко получены специалистом, квалифицированным в данной обрасти техники, стандартными химическими реакциями или химическими реакциями, которые описаны в литературе.-4 007714 Соединения настоящего изобретения и фармацевтические композиции, содержащие их, являются полезными при лечении расстройств мелатонинэргической системы. Фармакологическое исследование соединений настоящего изобретения фактически показало, что они являются нетоксичными, обладают высокой аффинностью к рецепторам мелатонина и значительной активностью в отношении центральной нервной системы и микроциркуляции, что дает возможность утверждать, что продукты настоящего изобретения являются полезными при лечении стресса, расстройств сна, беспокойств, глубокой депрессии, сезонных эмоциональных расстройств, сердечно-сосудистых патологий, патологий пищеварительной системы, бессонницы и усталости вследствие нарушения суточного ритма организма, шизофрении, острых тревожных состояний с реакцией паники, меланхолии, расстройств аппетита, ожирения, бессонницы, боли, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных расстройств, связанных с нормальным или патологическим старением, мигрени, потери памяти, болезни Альцгеймера и расстройств мозгового кровообращения. В другой области активности оказалось, что продукты настоящего изобретения могут использоваться при лечении половых дисфункций, что они имеют свойства ингибирования овуляции и иммуномодулирующую активность, а также, что они могут использоваться при лечении раковых опухолей. Соединения предпочтительно будут использоваться при лечении глубокой депрессии, сезонных эмоциональных расстройств, расстройств сна, сердечно-сосудистых патологий, бессонницы и усталости вследствие нарушения суточного ритма организма, расстройств аппетита и ожирения. Например, соединения будут использоваться при лечении сезонных эмоциональных расстройств и расстройств сна. Настоящее изобретение также относится к фармацевтическим композициям, содержащим по крайней мере одно соединение формулы (I) самостоятельно или в комбинации с одним или более фармацевтически приемлемыми наполнителями. Среди фармацевтических композиций согласно настоящему изобретению можно особенно отметить те, которые являются подходящими для перорального, парентерального, назального, под- или чреcкожного, ректального, подъязычного, глазного или респираторного применения, особенно таблетки или драже, подъязычные таблетки, сашеты, пакетики, желатиновые капсулы, глоссеты, пилюли, суппозитории, кремы, мази, кожные гели и питьевые или инъекционные ампулы. Дозировку варьируют в зависимости от пола, возраста и веса пациента, способа применения, характера терапевтического показания или возможно сопутствующего лечения, она составляет от 0,01 мг до 1 г в сутки в один или большее количество приeмов. Следующие примеры иллюстрируют настоящее изобретение, но никоим образом не ограничивают его. Следующие способы получения приводят к соединениям настоящего изобретения или к промежуточным соединениям, которые являются полезными для получения соединений настоящего изобретения. Получение 1. Этил 4-(6-метокси-3,4-дигидро-4-изохинолинил)бутаноат гидрохлорид. Стадия А. Этил 5-циано-5-(3-метоксифенил)пентаноат. 2 г (3-метоксифенил)ацетонитрила и 1,5 мл этил 4-бромбутирата растворяют в 50 мл диметилформамида при 0 С. 600 мг 60% гидрида натрия (600 мг; 15 ммоль) постепенно добавляют к раствору. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, переносят в 100 мл водного раствора кислоты и экстрагируют эфиром. Затем органическую фазу высушивают над сульфатом магния,отфильтровывают и упаривают при пониженном давлении. Полученное масло очищают при помощи колонки (элюант: эфир/циклогексан 4/6) с получением заглавного соединения в виде масла желтого цвета. Стадия B. Этил 6-амино-5-(3-метоксифенил)гексаноат гидрохлорид. Соединение, полученное на cтадии А (11,2 г; 43 ммоль), предварительно растворяют в 150 мл этанола, заливают в автоклав и затем добавляют никель Ренея (10 мас.%). После этого смесь помещают под давление водорода (10 бар) и нагревают при 50 С в течение 48 ч при перемешивании. После удаления никеля Ренея путем фильтрования органическую фазу упаривают при пониженном давлении. Полученный остаток переносят в эфир, в раствор барботируют газообразный НСl и затем раствор перемешивают до выпадения осадка. После этого полученный осадок отфильтровывают отсасыванием и перекристаллизовывают из толуола и выделяют заглавное соединение в виде твердого вещества белого цвета. Точка плавления: 104-106 С. Стадия C. Этил 6-(формиламино)-5-(3-метоксифенил)гексаноат. Амин, полученный на стадии В, в виде основания (6,4 г; 27 ммоль), растворяют в 60 мл этилформиата. Реакционную смесь при перемешивании, нагревают с орошением в течение 6 ч, и затем упаривают при пониженном давлении. Полученный остаток переносят в эфир. После этого органическую фазу последовательно промывают водным раствором кислоты (1 н. HCl), водой и 10% раствором гидрокарбоната, затем высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении с получением заглавного соединения в виде масла желтого цвета. Стадия D. Этил 4-(6-метокси-3,4-дигидро-4-изохинолинил)бутаноат гидрохлорид. Формальдегид, полученный на cтадии С (6,8 г; 23 ммоль), растворяют в 100 мл ацетонитрила, затем реакционную смесь нагревают приблизительно до 60 С. Добавляют к раствору оксихлорид фосфора (7 мл),раствор нагревают с орошением в течение 6 ч при перемешивании и затем упаривают при пониженном-5 007714 давлении. Полученный остаток дважды обрабатывают этанолом и упаривают при пониженном давлении,а после этого переносят в воду. Водную фазу промывают дихлорметаном, затем ощелачивают насыщенным раствором гидрокарбоната натрия и экстрагируют дихлорметаном. Органическую фазу высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученное масло переносят в эфир, насыщенный газообразным НСl, и затем упаривают при пониженном давлении. Остаток в горячем состоянии переносят в толуол и перемешивают до образования осадка. После этого полученный осадок отфильтровывают отсасыванием и выделяют заглавное соединение в виде твердого вещества белого цвета. Точка плавления: 97-99 С. Получение 2. трет-Бутил 4-(2-аминоэтил)-6-метокси-3,4-дигидро-2(1H)-изохинолинкарбоксилат. Стадия А. Метил циано(3-метоксифенил)ацетат. 25 г (3-метоксифенил)ацетонитрила растворяют в 200 мл безводного THF в матовой колбе Эрленмейера. К раствору добавляют 60% гидрид натрия (8,88 г; 0,37 моль) и реакционную смесь нагревают с орошением в течение 30 мин при перемешивании. Затем по каплям на протяжении получаса добавляют диметилкарбонат (58 мл; 0,6814 моль) и далее реакционную смесь нагревают с орошением в течение 2 ч при перемешивании. Реакционную смесь выливают в холодную и немного подкисленную воду. Водную фазу экстрагируют эфиром, и затем эфирные фазы перед упариванием промывают водой. К полученному выше маслу добавляют раствор карбоната калия (47,15 г; 0,34 моль). После перемешивания смесь промывают эфиром. Полученные эфирные фазы еще раз промывают раствором карбоната калия (12,02 г; 0,08 моль). Две водные фазы объединяют, немедленно подкисляют и экстрагируют эфиром. Таким образом, полученную органическую фазу промывают 10% раствором гидрокарбоната натрия, высушивают над сульфатом магния и упаривают при пониженном давлении с получением заглавного соединения в виде масла светло-оранжево-желтого цвета. Стадия В. Метил 3-амино-2-(3-метоксифенил)пропаноат гидрохлорид. Соединение, полученное на стадии А (34,32 г; 0,1672 моль) растворяют в 150 мл метанола. Раствор заливают в автоклав и затем к раствору добавляют 50 мл хлороформа и оксид платины (10 мас.%). Автоклав помещают под давление водорода (60 бар) при комнатной температуре и перемешивают с помощью магнитной мешалки в течение 24 ч. После удаления катализатора фильтрованием, раствор упаривают при пониженном давлении. Полученное масло переносят в эфир. Образовавшийся осадок отфильтровывают отсасыванием и перекристаллизовывают из ацетонитрила с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 170-172 С. Стадия С. Метил 3-(формиламино)-2-(3-метоксифенил)пропаноат. Соединение, полученное на стадии В (20,25 г; 0,08 моль), в виде основания растворяют в 130 мл этилформиата (1,81 моль). Реакционную смесь нагревают при орошении в течение 6 ч и затем упаривают при пониженном давлении. Полученное масло переносят в этилацетат. Органическую фазу промывают водным раствором основания (NаНСО 3), высушивают над сульфатом магния, отфильтровывают и упаривают с получением заглавного соединения в виде масла желтого цвета. Стадия D. Метил 6-метокси-3,4-дигидро-4-изохинолинкарбоксилат гидрохлорид. Соединение, полученное на cтадии С (8,03 г; 0,03 моль), растворяют в 100 мл ацетонитрила и затем реакционную смесь нагревают приблизительно до 60 С. Добавляют к раствору оксихлорид фосфора (16 мл; 0,17 моль), затем раствор нагревают с орошением в течение 6 ч при перемешивании и затем упаривают при пониженном давлении. Полученный остаток дважды обрабатывают метанолом и упаривают при пониженном давлении, и затем переносят в минимальное количество ацетона. После этого образовавшийся осадок отфильтровывают отсасыванием с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 212-215 С. Стадия E. Метил 6-метокси-1,2,3,4-тетрагидро-4-изохинолинкарбоксилат гидрохлорид. Соединение, полученное на cтадии D (9,21 г), в виде основания растворяют в 150 мл метанола и затем добавляют к раствору палладий-на-угле (900 мг). Реакционную смесь перемешивают в атмосфере водорода при комнатной температуре в течение 4 ч. После удаления палладия-на-угле фильтрованием органическую фазу упаривают при пониженном давлении. Полученное масло переносят в эфир насыщенный НСl. Образовавшийся осадок отфильтровывают отсасыванием и перекристаллизовывают из ацетонитрила с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 191-193 С. Стадия F. трет-Бутил 4-метил-6-метокси-3,4-дигидро-2,4(1H)-изохинолиндикарбоксилат. Соединение, полученное на cтадии Е (4,02 г; 15 ммоль), суспендируют в 100 мл дихлорметана и затем добавляют триэтиламин (6,6 мл). После того как завершится растворение, добавляют ди-трет-бутил дикарбонат (4 г; 18 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 30 мин. Раствор выливают в 100 мл воды и нейтрализуют избыток триэтиламина водным раствором кислоты (0,1 н. НСl). После разделения водную фазу экстрагируют дихлорметаном и объединенные органические фазы высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном дав-6 007714 лении. Заглавное соединение очищают при помощи хроматографирования на силикагеле. Бесцветное масло. Стадия G. трет-Бутил 4-(гидроксиметил)-6-метокси-3,4-дигидро-2(1H)-изохинолинкарбоксилат. Алюмогидрид лития (5,62 г; 148 ммоль) суспендируют в 50 мл безводного тетрагидрофурана. Затем добавляют по каплям раствор соединения, полученного на cтадии F (11,9 г; 37 ммоль), предварительно растворенного в 50 мл безводного тетрагидрофурана. После этого реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют минимально возможное количество раствора гидроксида натрия (2 н. NaOH) к реакционной смеси до тех пор, пока не прекратится выделение газа, с целью образования осадков гидроксидов лития и алюминия. Затем осадки отфильтровывают и промывают тетрагидрофураном. Органическую фазу упаривают при пониженном давлении. Заглавное соединение очищают при помощи хроматографирования на силикагеле. Прозрачное масло желтого цвета. Стадия Н. трет-Бутил 6-метокси-4-[(метилсульфонил)окси]метил-3,4-дигидро-2(1H)-изохинолинкарбоксилат. Соединение, полученное на cтадии G (10,5 г; 36 ммоль), растворяют в 150 мл дихлорметана и затем добавляют триэтиламин (8,5 мл). Раствор охлаждают до 0 С и добавляют, по каплям, метансульфонилхлорид (4,8 мл; 62 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и затем выливают в 150 мл воды. Раствор экстрагируют дихлорметаном, высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Заглавное соединение очищают при помощи хроматографирования на силикагеле. Масло желтого цвета. Стадия I. трет-Бутил 4-(цианометил)-6-метокси-3,4-дигидро-2(1H)-изохинолинкарбоксилат. Цианид калия (5,52 г; 85 ммоль) суспендируют в 50 мл ДМСО и раствор нагревают до 80 С. Соединение, полученное на cтадии Н (6,3 г; 17 ммоль), предварительно растворенное в 50 мл ДМСО, постепенно добавляют к вышеуказанному раствору и затем реакционную смесь снова нагревают при 80 С в течение 30 мин. Раствор выливают в 150 мл воды и трижды экстрагируют дихлорметаном. Затем органическую фазу высушивают над сульфатом магния, отфильтровывают и упаривают. Полученное масло темно-красного цвета очищают при помощи хроматографирования на силикагеле (элюант: циклогексан с постепенным добавлением этилацетата до тех пор, пока не будет достигнуто соотношение 8/2), и выделенное твердое вещество перекристаллизовывают из циклогексана с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 75-77 С. Стадия J. трет-Бутил 4-(2-аминоэтил)-6-метокси-3,4-дигидро-2(1H)-изохинолинкарбоксилат. Соединение, полученное на cтадии I (6,3 г; 21 ммоль), растворяют в 150 мл метанола насыщенного газообразным NН 3(газ). Раствор заливают в автоклав и добавляют никель Ренея (600 мг). После этого реакционную смесь перемешивают при 60 С и при давлении водорода 50 бар в течение 6 ч. После удаления катализатора фильтрованием раствор упаривают при пониженном давлении и получают заглавное соединение в виде бесцветного масла. Получение 3. (6-Метокси-4-изохинолинил)ацетонитрил гидрохлорид. Стадия А. Метил 6-метокси-4-изохинолинкарбоксилат гидрохлорид. Соединение, полученное на cтадии D получения 2 (1,56 г; 0,006 моль), в виде основания, растворяют в 10 мл декагидронафталина и затем добавляют активированный палладий-на-угле (10 мас.%). Реакционную смесь нагревают при 130 С в течение 24 ч при перемешивании. В горячем состоянии катализатор отфильтровывают и промывают этилацетатом. После упаривания при пониженном давлении полученное масло переносят в эфирный раствор насыщенный газообразным НСl(газ). Образовавшийся осадок отфильтровывают отсасыванием и перекристаллизовывают из ацетонитрила с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 178-180 С. Стадия B. (6-Метокси-4-изохинолинил)метанол гидрохлорид. Соединение, полученное на cтадии А (0,395 г; 0,0015 моль), в виде основания, растворяют в 200 мл эфира. Затем при охлаждении колбы на ледяной бане постепенно добавляют алюмогидрид лития (0,14 г; 0,004 моль). Реакционную смесь перемешивают при комнатной температуре в течение 1 недели. В реакционную смесь добавляют минимально возможное количество 30% раствора гидроксида натрия (несколько капель) с целью образования осадков гидроксидов лития и алюминия. Затем осадки отфильтровывают и промывают этилацетатом. Органическую фазу высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученное масло переносят в эфир, насыщенный газообразным НСl(газ). Образовавшийся осадок отфильтровывают отсасыванием и перекристаллизовывают из ацетонитрила с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 250-252 С. Стадия C. 4-(Хлорметил)-6-метоксиизохинолин. Гидрохлорид соединения, полученного на cтадии В (1,09 г; 0,005 моль), суспендируют в 50 мл хлороформа. Добавляют тионилхлорид (2,80 мл; 0,04 моль) и затем реакционную смесь нагревают с ороше-7 007714 нием в течение 24 ч при перемешивании. После упаривания при пониженном давлении, полученный остаток переносят в этиловый эфир. Образовавшийся осадок отфильтровывают отсасыванием и перекристаллизовывают из ацетонитрила с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 256-257 С. Стадия D. (6-Метокси-4-изохинолинил)ацетонитрил гидрохлорид. Гидрохлорид соединения, полученного на cтадии С (0,60 г; 0,0024 моль), растворяют в 10 мл насыщенного водного раствора карбоната калия и 40 мл дихлорметана. Затем к полученному раствору добавляют тетрабутиламмониум бромид (2 г; 0,006 моль) и цианид калия (0,80 г; 0,012 моль). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Раствор экстрагируют дихлорметаном и органическую фазу промывают водой, высушивают над сульфатом магния, отфильтровывают и упаривают. Полученное масло переносят в ацетон и в эфир насыщенный газообразным НСl(газ). Образовавшийся осадок отфильтровывают отсасыванием и перекристаллизовывают из смеси толуол/циклогексан, 5/5, с получением заглавного соединения в виде твердого вещества желтого цвета. Точка плавления: 114-115 С. Получение 4. трет-Бутил 4-(аминометил)-6-метокси-3,4-дигидро-2(1H)-изохинолинкарбоксилат. Стадия А. тpeт-Бутил 6-метокси-4-[(метилсульфонил)окси]метил-3,4-дигидро-2(1H)-изохинолинкарбоксилат. Процедура аналогична стадиям от А до Н получения 2. Стадия В. трет-Бутил 4-(азидометил)-6-метокси-3,4-дигидро-2(1H)-изохинолинкарбоксилат. Азид натрия (1,12 г) суспендируют в 40 мл ДМФА и раствор нагревают до 80 С. К полученному раствору постепенно добавляют соединение, полученное на стадии А (1,6 г), предварительно растворенное в 10 мл ДМФА, и затем реакционную смесь снова нагревают при 80 С в течение от 2 до 3 ч. Раствор выливают в 150 мл воды и трижды экстрагируют этилацетатом. Затем органическую фазу высушивают над сульфатом магния, отфильтровывают и упаривают. Полученное темно-красное масло очищают при помощи хроматографирования на силикателе (элюант: циклогексан с постепенным добавлением этилацетата до тех пор, пока не будет достигнуто соотношение 5/5) с получением заглавного соединения в виде бесцветного масла. Стадия С. трет-Бутил 4-(аминометил)-6-метокси-3,4-дигидро-2(1 Н)-изохинолинкарбоксилат. Соединение, полученное на стадии В (1,14 г), растворяют в 100 мл метанола и затем в раствор добавляют палладий-на-угле (120 мг). Реакционную смесь перемешивают при комнатной температуре в атмосфере водорода в течение 3 ч. После удаления палладия-на-угле фильтрованием, органическую фазу упаривают при пониженном давлении. Полученный остаток очищают при помощи хроматографирования на силикагеле (элюант: циклогексан с постепенным добавлением этилацетата до тех пор, пока не будет достигнуто соотношение 5/5) с получением заглавного соединения в виде бесцветного масла. Пример 1. 4-(6-Метокси-3,4-дигидро-4-изохинолинил)-N-метилбутанамид. Соединение, синтезированное в получении 1 (41 ммоль), в виде основания, растворяют в 10 мл этанола. Добавляют 60 мл водного метиламина и реакционную смесь перемешивают при комнатной температуре в течение 12 ч. После упаривания при пониженном давлении, фильтрат переносят в 50 мл воды и экстрагируют дихлорметаном. Органическую фазу промывают водой, высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Заглавное соединение получают после хроматографирования на силикагеле полученного масла. Масло желтого цвета. Пример 2. 4-(6-Метокси-1,2,3,4-тетрагидро-4-изохинолинил)-N-метилбутанамид. Соединение, полученное в примере 1 (54 ммоль), в виде основания, растворяют в 50 мл метанола и затем в раствор добавляют палладий-на-угле (150 мг). Реакционную смесь перемешивают при комнатной температуре в атмосфере водорода в течение 4 ч. После удаления палладия-на-угле фильтрованием, органическую фазу упаривают при пониженном давлении. Полученное масло очищают при помощи хроматографирования на силикагеле с получением заглавного соединения в виде масла желтого цвета. Пример 3. 4-(6-Метокси-4-изохинолинил)-N-метилбутанамид. Стадия А. Этил 4-(6-метокси-4-изохинолинил)бутаноат гидрохлорид. Соединение, синтезированное в получении 1 (1,6 г; 5 ммоль), при нагревании растворяют в 20 мл толуола, содержащего триэтиламин (0,9 мл) и абсолютный этанол (2 мл). В реакционную смесь добавляют палладий-на-угле (300 мг) и затем смесь нагревают с орошением в течение 24 ч при перемешивании. После удаления палладия-на-угле фильтрованием органическую фазу упаривают при пониженном давлении. Полученный остаток очищают при помощи хроматографирования на силикагеле (элюант: дихлорметан с постепенным добавлением метанола). Полученное масло превращают в форму гидрохлорида и затем образовавшийся осадок перекристаллизовывают из ацетонитрила. Точка плавления: 190-192 С. Стадия В. 4-(6-Метокси-4-изохинолинил)-N-метилбутанамид. Соединение, полученное на стадии А (2,2 г; 7 ммоль), растворяют в 30 мл метиламина (40% в воде) и смесь нагревают с орошением в течение 3 ч при перемешивании. Реакционную смесь переносят в 50 мл-8 007714 воды и экстрагируют эфиром. Органическую фазу промывают водой, высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученное масло очищают при помощи хроматографирования на силикагеле (элюант: дихлорметан с постепенным добавлением метанола). Полученное масло упаривают при пониженном давлении и образовавшийся таким образом осадок перекристаллизовывают из толуола с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 117-119 С. Элементный микроанализ: С% Н%N% Рассчитано 69,74 7,02 10,84 Найдено 69,64 7,22 10,83 Пример 4. N-[2-(6-Метокси-1,2,3,4-тетрагидро-4-изохинолинил)этил]ацетамид гидрохлорид. Соединение, полученное на стадии I получения 2 (6 г; 20 ммоль), растворяют в 100 мл уксусного ангидрида и затем раствор заливают в автоклав. После этого в раствор добавляют никель Ренея (600 мг) и реакционную смесь перемешивают при 60 С и под давление водорода 50 бар в течение 6 ч. После удаления катализатора фильтрованием раствор упаривают при пониженном давлении. Полученное твердое вещество оранжевого цвета переносят в 10% раствор гидроксида натрия и перемешивают в течение 15 мин,затем экстрагируют этилацетатом (3 раза). Органическую фазу один раз промывают водой, высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученное масло переносят в 50 мл метанола. В раствор барботируют газообразный хлористый водород и затем его перемешивают в течение 24 ч с СаСl2 защитой. Раствор упаривают при пониженном давлении и полученный таким образом осадок перекристаллизовывают из ацетонитрила с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 182-184 С. Пример 5. N-[2-(6-Метокси-1,2,3,4-тетрагидро-4-изохинолинил)этил]пропанамид гидрохлорид. Соединение, синтезированное в получении 2, и 2 экв. карбоната калия растворяют в смеси 3/2 этилацетат/вода. Затем в раствор по каплям добавляют пропаноилхлорид (2 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. После разделения фаз органическую фазу промывают водой, высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученное масло очищают при помощи хроматографирования на силикагеле (элюант этилацетат/циклогексан 5/5). Полученное масло переносят в метанол. В раствор барботируют газообразный хлористый водород и затем его перемешивают в течение 24 ч с СаСl2 защитой. Раствор упаривают при пониженном давлении и получают заглавное соединение в виде твердого вещества белого цвета. Точка плавления: 161-163 С. Пример 6. N-[2-(6-Метокси-1,2,3,4-тетрагидро-4-изохинолинил)этил]бутанамид гидрохлорид. Заглавное соединение получают согласно процедуре аналогичной той, что и в примере 5, но вместо пропаноилхлорида используют бутаноилхлорид. Очень гигроскопическое твердое вещество белого цвета. Пример 7. N-[2-(6-Метокси-1,2,3,4-тетрагидро-4-изохинолинил)этил]циклопропанкарбоксамид гидрохлорид. Заглавное соединение получают согласно процедуре аналогичной той, что и в примере 5, но вместо пропаноилхлорида используют хлорангидрид циклопропилкарбоновой кислоты. Твердое вещество белого цвета. Точка плавления: 215-217 С. Пример 8. N-[2-(6-Метокси-1.2,3.4-тетрагидро-4-изохинолинил)этил]циклобутанкарбоксамид гидрохлорид. Заглавное соединение получают согласно процедуре аналогичной той, что и в примере 5, но вместо пропаноилхлорида используют хлорангидрид циклобутилкарбоновой кислоты. Твердое вещество белого цвета. Точка плавления: 130-132 С. Пример 9. N-[2-(6-Метокси-4-изохинолинил)этил]ацетамид гидрохлорид. Соединение, синтезированное в получении 3 (0,30 г; 0,0015 моль), в виде основания предварительно растворяют в 10 мл уксусного ангидрида, заливают в автоклав и затем добавляют никель Ренея (10 мас.%). После этого смесь помещают под давление водорода (60 бар) и нагревают при 60 С в течение 6 ч при перемешивании. После удаления никеля Ренея фильтрованием органическую фазу переносят в 10% раствор гидроксида натрия при комнатной температуре и перемешивают с помощью магнитной мешалки в течение 15 мин. Раствор экстрагируют этилацетатом, органическую фазу промывают соляным раствором, высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученное масло очищают при помощи колонки (элюант дихлорметан с постепенным добавлением метанола до тех пор, пока не будет достигнуто соотношение 9/1). Очищенное масло переносят в эфир,насыщенный газообразным НСl(газ). Образовавшийся осадок отфильтровывают отсасыванием и перекри-9 007714 сталлизовывают из этанола с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 212-214 С. Пример 10. N-[2-(6-Метокси-4-изохинолинил)этил]пропанамид гидрохлорид. Соединение примера 5 растворяют при нагревании в минимальном количестве метанола и затем разбавляют толуолом. В раствор добавляют 1,5 экв. триэтиламина и далее реакционную смесь нагревают с орошением в присутствии палладия-на-угле (10 мас.%) в течение 3 ч. После удаления катализатора фильтрованием, раствор упаривают при пониженном давлении. Полученное масло очищают при помощихроматографирования на силикагеле (элюант дихлорметан/метанол 9/1). Очищенное масло переносят в эфир, насыщенный газообразным НСl(газ), и перемешивают до образования осадка. Образовавшийся таким образом осадок отфильтровывают отсасыванием и помещают под вакуумом в эксикатор. Заглавное соединение получают в виде твердого вещества белого цвета. Точка плавления: 233-235 С. Пример 11. N-[2-(6-Метокси-4-изохинолинил)этил]бутанамид гидрохлорид. Заглавное соединение получают согласно процедуре аналогичной той, что и в примере 10, исходя из соединения, полученного в примере 6. Точка плавления: 195-197 С. Пример 12. N-[2-(6-Метокси-4-изохинолинил)этил]циклопропанкарбоксамид гидрохлорид. Заглавное соединение получают согласно процедуре аналогичной той, что и в примере 10, исходя из соединения, полученного в примере 7. Точка плавления: 226-228 С. Пример 13. N-[2-(6-Метокси-2-фенил-1,2,3,4-тетрагидро-4-изохинолинил)этил]ацетамид гидрохлорид. Соединение, полученное в примере 4 (460 мг; 1,8 ммоль), в виде основания, суспендируют в 30 мл дихлорметана. Затем добавляют трифенилвисмут (900 мг; 2 ммоль) и ацетат меди Сu(ОАс)2 (190 мг; 0,95 ммоль). Реакционную смесь помещают в атмосферу аргона и перемешивают с помощью магнитной мешалки в течение 18 ч при комнатной температуре. Смесь отфильтровывают, переносят в воду и экстрагируют этил ацетатом. Органическую фазу высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученный остаток очищают при помощи хроматографирования на силикагеле (элюант этилацетат/циклогексан 2/8). Очищенное масло переносят в эфир, насыщенный газообразным НСl(газ), и перемешивают до образования осадка, после этого осадок отфильтровывают отсасыванием и помещают под вакуумом в эксикаторе с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 83-85 С. Пример 14. N-[2-(2-Бензил-6-метокси-1.2.3,4-тетрагидро-4-изохинолинил)этил]ацетамид. Соединение, полученное в примере 4 (740 мг; 2,5 ммоль), и карбонат калия (720 мг; 5 ммоль) суспендируют в 20 мл ДМФА, затем в раствор добавляют бензилбромид (0,37 мл; 3 ммоль). Реакционную смесь нагревают при 125 С в течение 4 ч при перемешивании. Раствор выливают в 50 мл воды, подкисленной 6 н. НСl и промывают этилацетатом. После этого водную фазу ощелачивают карбонатом калия и экстрагируют дихлорметаном. Органическую фазу высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученный таким образом остаток очищают при помощи хроматографирования на силикагеле (элюант: дихлорметан с постепенным добавлением метанола до тех пор, пока не будет достигнуто соотношение 9/1). Очищенное масло выкристаллизовывается. Образовавшийся таким образом осадок перекристаллизовывают из смеси 7/3 толуол/циклогексан с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 123-125 С. Пример 15. N-2-[2-(3-Формилфенил)-6-метокси-1,2,3,4-тетрагидро-4-изохинолинил]этилацетамид. Ацетат меди Сu(ОАс)2 (960 мг; 5 ммоль) и триэтиламин (1,5 мл; 10,5 ммоль) суспендируют в 60 мл дихлорметана. Соединение примера 4 (1 г; 3,5 ммоль), 3-формилфенилборную кислоту (1,05 г; 7 ммоль) и молекулярные сита добавляют последовательно и постепенно в раствор. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Смесь отфильтровывают, промывают водой, высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученный остаток очищают при помощи хроматографирования на силикагеле (элюант: дихлорметан с постепенным добавлением метанола до тех пор, пока не будет достигнуто соотношение 9/1) с получением заглавного соединения в виде масла желтого цвета. Пример 16. N-[2-(6-Метокси-2-метил-1,2,3,4-тетрагидро-4-изохинолинил)этил]ацетамид гидрохлорид. Муравьиную кислоту (0,55 мл) и 37% формальдегид (0,6 мл) добавляют при 0 С к соединению, полученному в примере 4 (1,8 г; 7,2 ммоль), в виде основания. Реакционную смесь нагревают при 80 С в течение 24 ч при перемешивании. После охлаждения реакционной смеси до 0 С, добавляют 10 мл 6 н. НСl. Затем смесь промывают эфиром, ощелачивают 2 н. NaOH и экстрагируют эфиром. Органическую фазу высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученное таким образом масло желтого цвета очищают при помощи хроматографирования на силикагеле (элюант: дихлорметан с постепенным добавлением метанола до тех пор, пока не будет достигнуто соотношение 9/1). Очищенное масло переносят в эфир, насыщенный газообразным НСl(газ), и перемеши- 10007714 вают до образования осадка, после этого осадок отфильтровывают отсасыванием и помещают под вакуумом в эксикатор с получением заглавного соединения в виде очень гигроскопического твердого вещества белого цвета. Точка плавления: 59-61 С. Пример 17. N-2-[2-(Циклопропилметил)-6-метокси-1,2,3,4-тетрагидро-4-изохинолинил]этилацетамид гидрохлорид. Соединение, полученное в примере 4 (1,03 г), и карбонат калия (1,25 г) суспендируют в 50 мл ацетона. Раствор перемешивают при комнатной температуре в течение 10 мин и затем к раствору добавляют метилциклопропанбромид (0,36 мл). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Карбонат калия отфильтровывают и восстановленный раствор упаривают. Остаток переносят в воду и водную фазу экстрагируют эфиром. Органическую фазу высушивают над сульфатом магния,отфильтровывают и упаривают при пониженном давлении. Полученный таким образом остаток очищают при помощи хроматографирования на силикагеле (элюант: дихлорметан с постепенным добавлением метанола до тех пор, пока не будет достигнуто соотношение 9/1). Очищенное масло переносят в эфир,насыщенный газообразным НСl(газ), и перемешивают до образования осадка, который затем отфильтровывают отсасыванием и помещают под вакуум в эксикатор с получением заглавного соединения в виде гигроскопического белого твердого вещества. Точка плавления: 50 С. Пример 18. N-[(6-Метокси-1,2,3,4-тетрагидро-4-изохинолинил)метил]ацетамид гидрохлорид. Соединение, синтезированное в получении 4 (0,77 г), и карбонат калия (1,8 г) растворяют в 50 мл смеси 1/1 дихлорметан/вода. Затем к раствору добавляют по каплям ацетилхлорид (0,47 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. После разделения фаз органическую фазу промывают водой, высушивают над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Полученное масло переносят в метанол. В раствор барботируют газообразный хлористый водород и затем его перемешивают в течение 24 ч с СаСl2 защитой. Раствор упаривают при пониженном давлении и полученный осадок перекристаллизовывают из ацетонитрила с получением заглавного соединения в виде твердого вещества белого цвета. Точка плавления: 246-248 С. Фармакологическое исследование Пример А. Исследование острой токсичности. Острую токсичность оценивали после перорального применения к группам животных, каждая из которых включала 8 мышей (262 г). Животных обследовали с равными интервалами в течение первого дня и ежедневно в течение последующих 2 недель после обработки. Дозу LD50 (доза, которая вызывает смерть 50% животных) оценили, и она показала низкую токсичность соединений настоящего изобретения. Пример В. Тест принудительного плавания. Соединения настоящего изобретения тестировали на поведенческой модели, тест принудительного плавания. Устройство представляет собой цилиндр Плексигласа, наполненный водой. Животных тестировали индивидуально с периодом 6 мин. В начале каждого испытания животное помещали в центр цилиндра. Отмечали период неподвижности. Животное считали неподвижным, когда оно прекращало бороться, и оставалось неподвижным на поверхности воды, осуществляя только те движения, которые позволяют ему поддерживать его голову над водой. После применения соединений за 40 мин до начала испытания соединения настоящего изобретения значительно уменьшали период неподвижности, демонстрируя антидепрессантную активность соединений настоящего изобретения. В частности, соединение примера 9, применяемое внутрь с дозой 2,5 мг/кг,вызывает уменьшение продолжительности неподвижности от 102 (контроль) до 57 с. Соединение примера 3, применяемое внутрь с дозой 25 мг/кг, вызывает уменьшение продолжительности неподвижности от 129 (контроль) до 60 с. Пример С. Изучение связывания мелатониновых рецепторов MT1 и МТ 2. Эксперименты связывания MT1 или МТ 2 рецепторов проводили с использованием 2-[125I]йодмелатонина в качестве радиолиганда сравнения. Остаточную радиоактивность определяли с использованием жидкостного сцинтилляционного счетчика. Каждый сравнительный эксперимент связывания был проведен 3 раза с разными тестируемыми соединениями и при разных концентрациях каждого тестируемого соединения. Результаты позволяют определить аффинности связывания (Ki) тестируемых соединений. Таким образом, значения Ki, определенные для соединений настоящего изобретения, показывают связывание одного или другого из MT1 и МТ 2 подтипов рецепторов при значении 10 М. В частности, соединение примера 9 имеет Ki (MT1) 9,1210-9 М и Ki (МТ 2) 2,1610-9 М; соединение примера 3 имеет Ki (MT1) 3,810-9 М и Ki (МТ 2) 2,610-9 М; соединение примера 10 имеет Ki (MT1) 4,2610-9 М и Ki (МТ 2) 1,1410-9 М.- 11007714 Пример D. Действие соединений изобретения на циркадные ритмы двигательной активности крысы. Участие мелатонина во влиянии на большинство физиологических, биохимических и поведенческих циркадных ритмов с чередованием в течение дня/ночи позволило установить фармакологическую модель для исследования мелатонинэргических лигандов. Были проверены эффекты соединений в отношении многочисленных параметров и, в частности относительно циркадных ритмов двигательной активности, которые являются надежным индикатором активности эндогенных циркадных часов. В этом исследовании оценивали эффекты соединений на специфической экспериментальной модели, а именно крысу помещали во временную изоляцию (постоянная темнота). Экспериментальный протокол. Одномесячные крысы мужского пола, как только они попадали в лабораторию, подвергались световому циклу 12 ч света в 24 ч (LD 12 : 12). После 2-3 недель адаптации их помещали в клетки с установленным колесом, связанным с записывающей системой, чтобы определить фазы двигательной активности и таким образом контролировать суточный (LD) или циркадный (DD) ритмы. Как только записанные ритмы показывали стабильную картину в световом цикле LD 12: 12, крыс помещали в постоянную темноту (DD). 2-3 недели спустя, когда свободный курс (ритм, отражающий эндогенные часы) точно установился,крысам назначали ежедневное применение тестируемого соединения. Обследования сделаны посредством наблюдения ритмов активности влияние светового ритма на ритмы активности,исчезновение влияния на ритмы в постоянной темноте,влияние ежедневного применения соединения; кратковременный или длительный эффект. Пакет программ позволяет измерять продолжительность и интенсивность активности, период ритма животных в течение светового курса и в течение лечения,при необходимости, демонстрировать с помощью спектрального анализа существование циркадной и нециркадной (например, ультрадиановой) компоненты. Результаты. Соединения изобретения отчетливо показывают значительное влияние на циркадный ритм via мелатонинэргическую систему. Пример Е. Испытание свет/темнота в клетке. Соединения изобретения тестируют на модели поведения, испытание свет/темнота в клетке, которое позволяет выявить транквилизаторную активность соединений. Оборудование включает две поливиниловые коробки, закрытые плексигласом. Одна из коробок находится в темноте. Лампу помещают над другой коробкой, подавая интенсивность света, приблизительно 4000 люкс, в центре коробки. Непрозрачный пластмассовый туннель отделяет освещенную коробку от темной коробки. Животных тестируют индивидуально с 5-минутными сеансами. Дно каждой коробки очищают перед каждым следующим сеансом. В начале каждого испытания, мышь помещают в туннель,поворачивая в сторону темной коробки. Время, потраченное мышью в освещенной коробке, и количество прохождений через туннель фиксировали после первого вхождения в темную коробку. После применения соединений за 30 мин до начала испытания соединения изобретения значительно увеличили время, проводимое в освещенной коробке, и количество прохождений через туннель, что указывает на транквилизаторную активность соединений изобретения. Пример F. Активность соединений изобретения на каудальной артерии крысы. Соединения изобретения были проверены in vitro на каудальной артерии крысы. Мелатонинэргические рецепторы присутствуют в этих сосудах, таким образом, обеспечивая релевантную фармакологическую модель для исследования активности мелатонинэргического лиганда. Стимуляция рецепторов может вызвать или вазоконстрикцию или расширение в зависимости от изучаемого артериального сегмента. Протокол. Одномесячных крыс приучали к циклу свет/темнота 12 ч/12 ч на протяжении 2-3 недель. После умерщвления подопытного животного хвостовую артерию выделили и содержали в высоко насыщенной кислородом среде. После этого артерии канюлировали на обоих концах, подвешивали вертикально в камере для органов в подходящей среде, и перфузировали через их проксимальный конец. По изменениям давления в перфузионном потоке оценивали сосудосуживающий или сосудорасширяющий эффекты соединений. Активность соединений оценивали на сегментах, которые были предварительно обработаны фенилэфрином (1 М). Кривая концентрация/эффект определялась некумулятивно добавлением концентрации тестируемого соединения на предварительно обработанный сегмент. Когда наблюдаемый эффект достигал равновесия, среду заменяли, и подготовленный образец оставляли на 20 мин перед добавлением той же самой концентрации фенилэфрина и затем концентрации тестируемого соединения.- 12007714 Результаты. Соединения изобретения значительно изменяют диаметр каудальных артерий, предсжатых фенилэфрином. Пример G. Фармацевтическая композиция: таблетки. 1000 таблеток, каждая из которых содержит дозу 5 мг N-[2-(6-метокси-4-изохинолинил)этил]ацетамид гидрохлорид (пример 9) 5 г Пшеничный крахмал 20 г Маисовый крахмал 20 г Лактоза 30 г Стеарат магния 2 г Диоксид кремния 1 г Гидроксипропил целлюлоза 2 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)Z представляет собой атом кислорода,R и R", которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, иR' представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, (С 3 С 8)циклоалкильную группу,X представляет собой атом азота или группу N-R1, в которой R1 представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, (С 3-С 8)циклоалкильную группу, (С 3 С 8)циклоалкил-(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным, арильную группу или арил-(С 1-С 6)алкильную группу, в которой алкильный остаток является линейным или разветвленным,R2 представляет собой линейную или разветвленную (С 1-С 6)алкоксигруппу, (С 3-С 8)циклоалкилокси или (С 3-С 8)циклоалкил-(С 1-С 6)алкилоксигруппу, в которой остаток алкилокси является линейным или разветвленным,обозначениеуказывает, что связь является простой или двойной, при условии, что соблюдена валентность атомов, где"арил" следует понимать в значении фенильной или нафтильной группы, которые являются незамещенными или замещенными от 1 до 3 раз одинаковыми или разными группами, выбранными из линейной или разветвленной (С 1-С 6)алкильной группы, линейной или разветвленной (С 1 С 6)алкоксигруппы, ОН, СООН, алкоксикарбонильной группы, в которой остаток алкокси является линейным или разветвленным, формильной группы, нитрогруппы, цианогруппы, гидроксиметильной группы, аминогруппы (необязательно замещенной одной или двумя линейными или разветвленными (С 1 С 6)алкильными группами) и атомов галогена, их соли присоединения с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы I по п.1, в которой n принимает значение 2 и А представляет собой-NHCOR' группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы I по п.1, в которой n принимает значение 3 и А представляет собойCONHR' группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы I по п.1, в которой R2 представляет собой метоксигруппу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы I по п.1, в которой X представляет собой атом азота, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы I по п.1, в которой X представляет собой NPh или NBz группу, их энантио- 13007714 меры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-4 изохинолинил)этил]ацетамид, а также его соли присоединения с фармацевтически приемлемой кислотой. 8. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-4 изохинолинил)этил]бутанамид, а также его соли присоединения с фармацевтически приемлемой кислотой. 9. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-4 изохинолинил)этил]пропанамид, а также его соли присоединения с фармацевтически приемлемой кислотой. 10. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-4 изохинолинил)этил]циклопропанкарбоксамид, а также его соли присоединения с фармацевтически приемлемой кислотой. 11. Соединение формулы I по п.1, которое представляет собой 4-(6-метокси-4-изохинолинил)-Nметилбутанамид, а также его соли присоединения с фармацевтически приемлемой кислотой. 12. Соединение формулы I по п.1, которое представляет собой N-[2-(6-метокси-2-фенил-1,2,3,4 тетрагидро-4-изохинолинил)этил]ацетамид, а также его соли присоединения с фармацевтически приемлемой кислотой. 13. Соединение формулы I по п.1, которое представляет собой N-[2-(2-бензил-6-метокси-1,2,3,4 тетрагидро-4-изохинолинил)этил]ацетамид, а также его соли присоединения с фармацевтически приемлемой кислотой. 14. Соединение формулы I по п.1, которое представляет собой N-2-[2-(циклопропилметил)-6 метокси-1,2,3,4-тетрагидро-4-изохинолинил]этилацетамид, а также его соли присоединения с фармацевтически приемлемой кислотой. 15. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (II) в которой R2 и n принимают значения, указанные для формулы (I), и Ra представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, которое подвергают воздействию РОСl3, чтобы получить соединение формулы (III) в которой R2, n и Ra принимают значения, указанные выше, которое помещают в присутствии палладия-на-угле, с получением соединения формулы (IV) в которой R2, n и Ra принимают значения, указанные выше,соединение формулы (V) конденсируют с соединением формулы G-R'1, в которой G представляет собой уходящую группу и R'1 может принимать любое из значений, указанных для R1, за исключением атома водорода, с получением соединения формулы (VI) в которой R2, R'1, n и Ra принимают значения, указанные выше, соединения формул (III)-(VI) составляют соединения формулы (VII) в которой R2, n и Ra принимают значения, указанные выше, и X и обозначениепринимают значения,указанные для формулы (I),соединение формулы (VII) конденсируют с амином формулы HNRR', в которой R и R1 принимают значения, указанные для формулы (I), с получением соединения формулы (I/а), частного случая соединений формулы (I) в которой R2, R, R', X, n и обозначениепринимают значения, указанные выше, или соединение формулы (VII) подвергают последовательности реакций, стандартных в органической химии, чтобы получить соединение формулы (VIII) в которой R2, X, n и обозначениепринимают значения, указанные выше, которое или подвергают реакции с ацилхлоридом ClCOR' или с соответствующим смешанным или симметрическим ангидридом, в котором R' принимает значения, указанные выше, с получением соединения формулы (I/b), частного случая соединений формулы (I) в которой R2, R', X, n и обозначениепринимают значения, указанные выше, необязательно далее подвергают реакции с соединением формулы R'a-J, в которой R'a может принимать любое из значений, указанных для R', и J представляет собой уходящую группу, такую как атом галогена или тозильную группу,с получением соединения формулы (I/с), частного случая соединений формулы (I) в которой R2, R', R'a, X, n и обозначениепринимают значения, указанные выше,соединения от (I/а) до (I/с), составляющие совокупность соединений формулы (I), могут быть очищены, согласно обычной методике очистки, при желании, преобразованы в соли присоединения с фармацевтически приемлемой кислотой или основанием, и необязательно разделены на изомеры согласно обычной методике разделения. 16. Фармацевтические композиции, содержащие соединения формулы I по любому из пп.1-14 или их соли присоединения с фармацевтически приемлемой кислотой или основанием в комбинации с одним или более фармацевтически приемлемыми наполнителями.- 15007714 17. Фармацевтические композиции по п.16 для использования в производстве лекарственных средств для лечения расстройств мелатонинэргической системы. 18. Фармацевтические композиции по п.16 для использования в производстве лекарственных средств для лечения расстройств сна, стресса, беспокойств, сезонных эмоциональных расстройств или глубокой депрессии, сердечно-сосудистых патологий, патологий пищеварительной системы, бессонницы и усталости вследствие нарушения суточного ритма организма, шизофрении, острых тревожных состояний с реакцией паники, меланхолии, расстройств аппетита, ожирения, бессонницы, боли, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных расстройств,связанных с нормальным или патологическим старением, мигрени, потери памяти, болезни Альцгеймера,расстройств мозгового кровообращения, а также при половой дисфункции, как ингибиторы овуляции,иммуномодуляторы и при лечении раковых опухолей.
МПК / Метки
МПК: C07D 217/14, A61P 1/00, A61P 9/00, A61K 31/472, A61P 25/00, C07D 217/16
Метки: соединения, композиции, изохинолина, способ, получения, новые, содержащие, фармацевтические
Код ссылки
<a href="https://eas.patents.su/17-7714-novye-soedineniya-izohinolina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения изохинолина, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Ассоциации дальфопристин/хинупристин с цефпиромом
Следующий патент: Ингибиторы вирусной полимеразы
Случайный патент: Способ, система и устройство для обновления модели коллектора в реальном времени с использованием множественного фильтра калмана












