Новые соединения n-бензилпиперазина, способ их получения и фармацевтические композиции их содержащие
Номер патента: 5165
Опубликовано: 30.12.2004
Авторы: Тийеман Жан-Поль, Теста Бернар, Спеддин Мишель, Секшейи Ромео, Арпе Катрин, Шенкер Эстер, Лабидалль Серж, Ле Ридан Ален
Формула / Реферат
1. Соединения формулы (I)
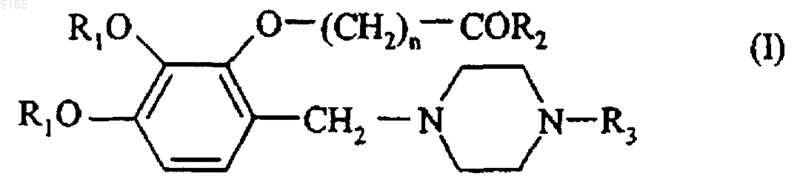
в которой
R1 представляет собой линейную или разветвленную (C1-C6)алкильную группу,
R2 представляет собой гидроксигруппу, линейную или разветвленную (C1-C6)алкоксигруппу или аминогруппу (необязательно замещенную одной или двумя линейными или разветвленными (C1-C6)алкильными группами),
n представляет собой коэффициент от 1 до 12 включительно,
R3 представляет собой
атом водорода,
линейную или разветвленную (C1-C6)алкильную группу, необязательно замещенную фенильной группой (которая сама необязательно замещена одним или более одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (C1-C6)алкильной, линейной или разветвленной (C1-C6)алкокси, гидрокси и тригалометильной групп), (C3-C7)циклоалкильную группу, карбоксигруппу или (C1-C6)алкоксикарбонильную группу,
(C3-C7)циклоалкильную группу,
пиримидинильную группу, необязательно замещенную одной или двумя пирролидинильными группами, или
фенильную группу, необязательно замещенную одним или более одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной (C1-C6)алкильной, линейной или разветвленной (C1-C6)алкокси, гидрокси и тригалометильной групп,
их оптические изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, в которой R1 представляет собой метильную группу.
3. Соединения формулы (I) по п.1, в которой R3 представляет собой алкильную группу, замещенную фенильной группой, предпочтительно бензильную группу, пиримидинильную группу, фенильную группу, предпочтительно замещенную метоксигруппой или атомом водорода.
4. Соединения формулы (I) по п.1, в которой n представляет собой коэффициент от 1 до 7.
5. Соединения формулы (I) по п.4, в которой n представляет собой 6.
6. Соединения формулы (I) по п.1, в которой R2 представляет собой гидроксигруппу.
7. Соединение формулы (I) по п.1, которое представляет собой 7-{6-[(4-бензил-1-пиперазинил)метил]-2,3-диметоксифенокси}гептановую кислоту, и его аддитивные соли.
8. Соединения формулы (I) по п.1, которые представляют собой
7-{6-{[4-(пиримидин-2-ил)-1-пиперазинил]метил}-2,3-диметоксифенокси}гептановую кислоту,
4-{6-[(пиперазин-1-ил)метил]-2,3-диметоксифенокси}масляную кислоту,
7-{6-[(4-(2-метоксифенил)-1-пиперазинил)метил]-2,3-диметоксифенокси}гептановую кислоту,
4-{6-[(4-(2-метоксифенил)-1-пиперазинил)метил]-2,3-диметоксифенокси}масляную кислоту,
и их аддитивные соли.
9. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала применяется соединение формулы (II)
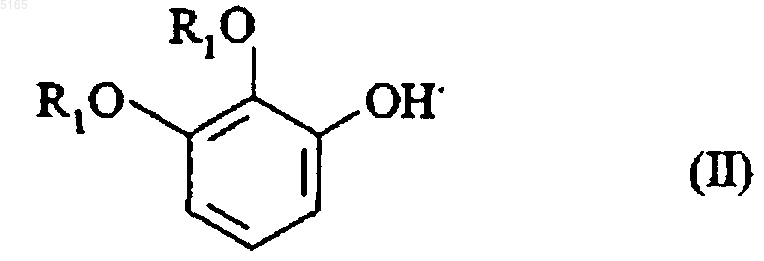
в которой R1 имеет значение, указанное для формулы (I), которое подвергают реакции в присутствии формальдегида с замещенным пиперазином формулы (III)
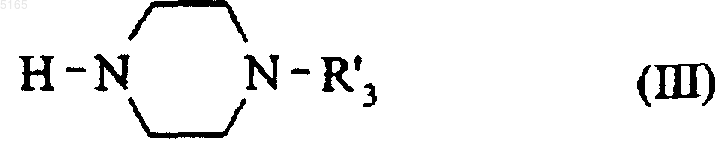
в которой R'3 имеет значение, указанное для R3, за исключением алкильной группы, замещенной карбоксигруппой,
с получением соединения формулы (IV)
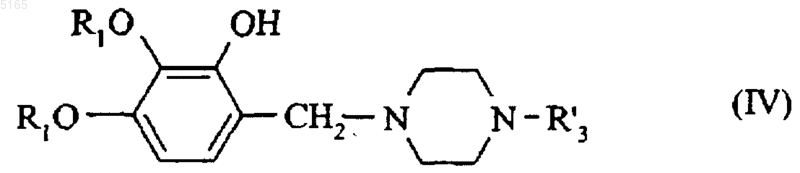
в которой R1 и R'3 имеют значения, указанные здесь ранее, которое подвергают реакции с соединением формулы (V)
X-(CH2)n-COR'2 (V),
в которой X представляет собой атом галогена и R'2 представляет собой линейную или разветвленную (C1-C6)алкоксигруппу, с получением соединения формулы (I/a), частного случая соединений формулы (I)
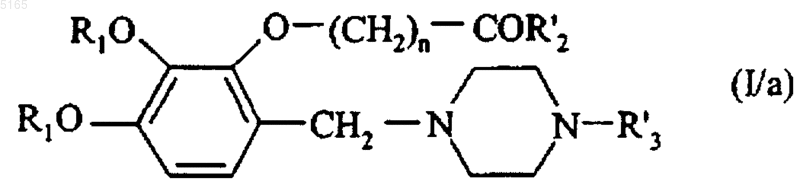
в которой R1, R'2, R'3 и n имеют значения, указанные здесь ранее, это соединение формулы (I/a) переводят, при желании,
в соответствующую моно- или ди-кислоту формулы (I/b), частный случай соединений формулы (I)
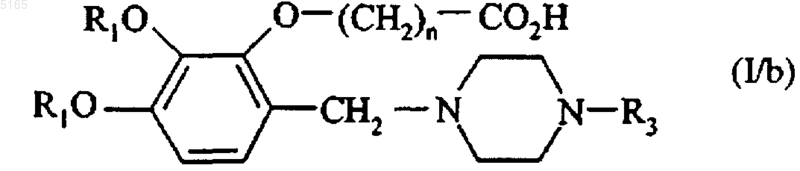
или в соответствующий амид формулы (I/c)
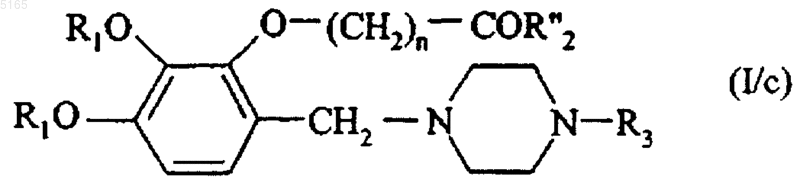
в которой R1, R3 и n имеют значения, указанные для формулы (I), и R"2 представляет собой аминогруппу, необязательно замещенную одной или двумя линейными или разветвленными (C1-C6)алкильными группами,
эти соединения формул (I/a), (I/b) и (I/c) очищают, при необходимости, согласно традиционной методике очистки, разделяют там, где это уместно, на их изомеры и переводят, при желании, в аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Фармацевтические композиции, включающие в качестве активного ингредиента соединение по любому из пп.1-8 в сочетании с одним или более инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями.
11. Фармацевтические композиции по п.10, включающие в качестве активного ингредиента соединение по любому из пп.1-8 для применения при профилактике или лечении острой и хронической клеточной ишемии, острых или хронических ишемичных приступах мозга, сердца или периферийных, за которыми либо следует реперфузия, либо нет, перед любым хирургическим вмешательством, требующим временного прерывания циркуляции крови, при лечении хронических нейродегенеративных заболеваний, а также при усовершенствовании хранения органов, предназначенных для трансплантации, и для возобновления функционирования трансплантатов после реперфузии.
Текст
1 Настоящее изобретение относится к новым соединениям N-бензилпиперазина, к способу их получения и к фармацевтическим композициям,их содержащим. Ранее известное можно проиллюстрировать на примере- описаний французских патентов 1 302 958 и 805 М, которые относятся, соответственно, к получению N-триалкоксибензилпиперазинов и к применению 2,3,4-триметоксибензилпиперазина в качестве лекарственного препарата, имеющего вазолидирующую активность,- статей Hiroshi Ohtaka и др., Chem. Pharm.Bull., 15, 2774-3275 (1987) и Chem. Pharm. Bull.,37, 11, 2124-3122 (1989), которые упоминают триметазидиновые соединения, имеющие вазолидирующую активность, а также синтез 1[бис(4-фторофенил)метил]-4-(2-гидрокси 3,4 диметоксибензил)пиперазина,- статьи Tsuneo Kawashima и др., J. Pharmacobio-Dyn, 14, 449-459 (1991), имеющей отношение к выделению и определению новых метаболитов КВ-2796, включая 1-[бис(4-фторофенил)метил]-4-(2-гидрокси 3,4-диметоксибензил)пиперазин,- описания Европейского патента ЕР 533 579, которое описывает N-бензилпиперазиновые соединения, имеющие противогипоксическую и антиишемическую активность,- и наконец, описания Европейского патента ЕР 617 027, которое описывает N-бензилпиперазиновые соединения для применения при лечении неврональных заболеваний, являющихся следствием дисфункции окислительного метаболизма. Кроме того, что они новы, соединения по настоящему изобретению имеют особенно инновационную фармакологическую активность, и особенно инновационные терапевтические свойства. Они дают возможность, среди прочего,защиты митохондрии, претерпевающей гипоксический стресс, поддержки синтеза АТР в органах, которым не хватает кислорода, такой как защита изолированного сердца, находящегося в ишемическом положении. Наконец, некоторые способны пересекать барьер кровь-мозг. Эти свойства, таким образом, делают их полезными при профилактике или лечении острой и хронической клеточной ишемии, острых или хронических случаев мозговой, сердечной или периферийной ишемии, которые сопровождаются или не сопровождаются реперфузией, перед любым хирургическим вмешательством, требующим временного прерывания циркуляции крови, локально или в общем (турникет, зажим), при лечении хронических нейродегенеративных заболеваний (таких как старческое слабоумие, латентная или установившаяся болезнь Альцгеймера, старение мозга, амиотрофический латеральный склероз, рассеянный склероз или бо 005165 2 лезнь Паркинсона), а также при усовершенствовании хранения органов, предназначенных для трансплантации, и для возобновления функционирования трансплантатов после реперфузии. Соединения по изобретению также имеют существенно большую метаболическую стабильность, по сравнению со всеми соединениями подобной структуры, которые уже описаны,и таким образом обеспечивают лучшую биодоступность. Более конкретно, настоящее изобретение относится к соединениям формулы (I):R1 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,R2 представляет собой гидроксигруппу,линейную или разветвленную (C1-С 6)алкокси группу, или аминогруппу (необязательно замещенную одной или двумя линейными или разветвленными (С 1-С 6)алкильными группами),n представляет собой коэффициент от 1 до 12 включительно.- атом водорода,- линейную или разветвленную (С 1-С 6)алкильную группу, необязательно замещенную фенильной группой (которая сама необязательно замещена одним или более одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной(С 1-С 6)алкоксикарбонильную группу,- (С 3-С 7)циклоалкильную группу,- пиримидинильную группу, необязательно замещенную одной или двумя пирролидинильными группами, или- фенильную группу, необязательно замещенную одним или более одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной(С 1-С 6)алкокси, гидрокси и тригалометильной групп,их оптическим изомерам, и их аддитивным солям с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот можно упомянуть, в качестве примера без внесения ограничений, соляную кислоту, бромоводородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифтороуксусную кислоту, молочную кислоту, пирувовую кислоту, малоновую кислоту, сукциновую кислоту, глутаровую кислоту, фумаровую кислоту, виннокаменную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую ки 3 слоту, оксалиловую кислоту, метансульфоновую кислоту, камфорную кислоту, др. Среди фармацевтически приемлемых оснований можно упомянуть, в качестве неограничивающего примера, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Изобретение также относится к способу получения соединений формулы (I), отличающегося тем, что в качестве исходного материала применяется соединение формулы (II): в которой R1 имеет значение, указанное для формулы (I), которое подвергают реакции, в присутствии формальдегида, с замещенным пиперазином формулы (III): в которой R'3 имеет значение, указанное для R3,за исключением алкильной группы, замещенной карбоксигруппой,с получением соединения формулы (IV): в которой R1 и R'3 имеют значения, указанные здесь ранее, которое подвергают реакции с соединением формулы (V):X-(CH2)n-COR'2 (V) в которой X представляет собой атом галогена иR'2 представляет собой линейную или разветвленную (С 1-С 6)алкоксигруппу, с получением соединения формулы (I/а), частного случая соединений формулы (I) в которой R1, R'2, R'3 и n имеют значения, указанные здесь ранее,это соединение формулы (I/a) переводят,при желании, в соответствующую моно- или дикислоту формулы (I/b), частный случай соединений формулы (I) или в соответствующий амид формулы (I/с) в которой R1, R3 и n имеют значения, указанные для формулы (I) и R2 представляет собой аминогруппу, необязательно замещенную одной или двумя линейными или разветвленными (С 1 С 6)алкильными группами,эти соединения формул (I/a), (I/b) и (I/с) очищают, при необходимости, согласно традиционной методике очистки, разделяют, там, где это уместно, на их изомеры, и переводят, при 4 желании, в аддитивные соли с фармацевтически приемлемой кислотой или основанием. Предпочтительными соединениями по изобретению являются такие, в которых R1 представляет собой метильную группу, R3 представляет собой гидроксигруппу и R3 представляет собой бензильную группу, пиримидинильную группу, фенильную группу, предпочтительно замещенную метокси группой, или атом водорода. Значение n предпочтительно составляет от 1 до 7. Более конкретно, n составляет 6. Предпочтительными соединениями по изобретению являются 7-6-[(4-бензил-1-пиперазинил)метил]-2,3 диметоксифеноксигептановая кислота и ее аддитивные соли,7-(6-[4-(пиримидин-2-ил)-1-пиперазинил] метил-2,3-диметоксифенокси)гептановая кислота и ее аддитивные соли,4-6-[(пиперазин-1-ил)метил]-2,3-диметоксифеноксимасляная кислота и ее аддитивные соли,7-6-[(4-(2-метоксифенил)-1-пиперазинил)метил]-2,3-диметоксифеноксигептановая кислота и ее аддитивные соли,4-6-[(4-(2-метоксифенил)-1-пиперазинил) метил]-2,3-диметоксифеноксимасляная кислота и ее аддитивные соли. Настоящее изобретение также относится к фармацевтическим композициям, включающим в качестве активного ингредиента по меньшей мере одно соединение формулы (I), отдельно или в комбинации с одним или более инертными, нетоксичными эксципиентами или носителями. Среди фармацевтических композиций по изобретению можно упомянуть более конкретно те, которые пригодны для орального, парентерального, назального, кожного применения,таблетки или драже, подъязычные таблетки,желатиновые капсулы, пастилки, суппозитории,кремы, мази, кожные гели, пр. Полезная дозировка может варьироваться в зависимости от возраста и веса пациента, графика приема, применяемой фармацевтической композиции, природы и сложности расстройства и каких-либо связанных лечений. Дозировка варьируется от 10 мг до 1000 мг в день за один или более приемов. Нижеследующие примеры иллюстрируют изобретение, но не ограничивают его никоим образом. Применяемые исходные материалы представляют собой известные соединения или получаются по известным способам. Структуры соединений, описанных в примерах, определяли согласно обычным спектрофотометрическим методикам (инфракрасная,ЯМР, масс-спектрометрия, пр.). 5 Пример 1. Дигидрохлорид этил 7-6-[(4 беизил-1-пиперазинил)метил]-2,3-диметоксифеноксигептаноата. 2,2 г 60% гидрида натрия суспендируют в реакторе, содержащем 250 мл безводного тетрагидрофурана, охлажденного до 0 С. 17,1 г 6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифенола, растворенного в 150 мл безводного THF,по каплям добавляют при комнатной температуре к предыдущей смеси, после чего следуют 14,6 мл этил 7-бромогептаноата 50 мл безводного ТНF. Реакционную смесь нагревают с обратным холодильником на протяжении 15 дней и затем концентрируют досуха при частичном вакууме. Неочищенный остаток отбирают в диэтиловый эфир и полученный осадок после охлаждения при 0 С на протяжении 12 ч отфильтровывают и затем промывают холодным диэтиловым эфиром (4 С). Эфирные растворы концентрируют досуха при частичном вакууме и получают неочищенный остаток, который очищают при помощи хроматографии на кремнеземной колонке, используя градиент дихлорометана/метанола (98/2 до 90/10) с получением ожидаемого продукта в виде основания, которое переводят в соответствующий дигидрохлорид. Точка плавления: 180 С Элементарный микроанализ: Пример 2. Дигидрохлорид 7-6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенокси гептановой кислоты. 10 г соединения, полученного в примере 1,добавляют к раствору, содержащему 4 г гидроксида натрия в 250 мл этанола. Все выдерживают 6 ч без перемешивания. После удаления растворителя при помощи выпаривания остаток очищают при помощи хроматографии на кремнеземной колонке, используя градиент дихлорометана/метанола (95/5 до 0/100). Ожидаемый продукт получают в виде основания и переводят в соответствующий дигидрохлорид. Точка плавления: 190 С. Элементарный микроанализ. Пример 3. Дигидрохлорид этил 6-[(4 бензил-1-пиперазинил)метил]-2,3-диметокси феноксиацетата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя этил 7 бромогептаноат на этил хлороацетат. Точка плавления: 162 С. Элементарный микроанализ: 6 Пример 4. Дигидрохлорид 6-[(4-бензил-1 пиперазинил)метил]-2,3-диметоксифенокси уксусной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 3. Точка плавления: 175 С. Элементарный микроанализ: Пример 5. Дигидрохлорид этил 4-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя этил 7 бромогептаноат на этил 4-бромобутират. Точка плавления: 164 С. Элементарный микроанализ: Пример 6. Дигидрохлорид 4-6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенокси масляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 5. Точка плавления: 200 С Элементарный микроанализ: Пример 7. Дигидрохлорид этил 8-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксиоктаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя этил 7 бромогептаноат на этил 8-бромооктаноат. Точка плавления: 177 С Элементарный микроанализ: Пример 8. Дигидрохлорид 8-6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенокси октановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 7. Точка плавления: 180 С. Элементарный микроанализ: Пример 9. Дигидрохлорид метил 10-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксидеканоата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя этил 7 бромогептаноат на метил 10-бромодеканоата. Пример 10. Дигидрохлорид 10-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксидекановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 9. Точка плавления: 156 С Элементарный микроанализ: Пример 11. Дигидрохлорид метил 11-6[(4-бензил-1-пиперазинил)метил]-2,3-диметоксифеноксиундеканоата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя этил 7 бромогептаноат на метил 11-бромоундеканоат. Точка плавления: 177 С. Элементарный микроанализ: Пример 12. Дигидрохлорид 11-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксиундекановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,полученного в примере 11. Точка плавления: 185 С. Элементарный микроанализ: Пример 13. Дигидрохлорид этил 7-6-[4(пиримидин-2-ил)-1-пиперазинил]метил-2,3 диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[4-(пиримидин-2-ил)-1-пиперазинил]метил 2,3-диметоксифенол. Точка плавления: 128 С Элементарный микроанализ: Пример 14. Дигидрохлорид 7-[6-[4(пиримидин-2-ил)-1-пиперазинил]метил-2,3 диметоксифенокси]гептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 13. Точка плавления: 115 С. Элементарный микроанализ: Пример 15. Дигидрохлорид этил 7-6[(пиперазин-1-ил)метил]-2,3-диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-трет-бутоксикарбонил-1-пиперазинил)метил]-2,3-диметоксифенол. Пример 16. Дигидрохлорид 7-6-[(пиперазин-1-ил)метил]-2,3-диметоксифенокси гептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 15. Точка плавления: 160 С Элементарный микроанализ : Пример 17. Дигидрохлорид этил 7-6-[(4 фенил-1-пиперазинил)метил]-2,3-диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-фенил)-1-пиперазинил]метил-2,3-диметоксифенол. Пример 18. Дигидрохлорид 7-6-[(4-фенил-1-пиперазинил)метил]-2,3-диметоксифеноксигептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 17. Точка плавления: 132 С Элементарный микроанализ: Пример 19. Дигидрохлорид этил 7-6-[(4 циклогекcил-1-пиперазинил)метил]-2,3-диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил-1-пиперазинил)метил]-2,3-диметоксифенол на 6[(4-циклогексил)-1-пиперазинил)метил]-2,3-диметоксифенол. Пример 20. Дигидрохлорид 7-6-[(4-циклогексил-1-пиперазинил)метил]-2,3-диметоксифеноксигептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 19. Точка плавления: 182 С. Элементарный микроанализ: 9 Пример 21. Дигидрохлорид этил 7-6-[(4 н-гептил-1-пиперазинил)метил]-2,3-диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-н-гептил)-1-пиперазинил)метил]-2,3-диметоксифенол. Пример 22. Дигидрохлорид 7-6-[4-нгептил-1-пиперазинил)метил]-2,3-диметоксифеноксигептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 21. Точка плавления: 152 С. Элементарный микроанализ: Пример 23. Дигидрохлорид этил 7-6-[(4 циклопропилметил-1-пиперазинил)метил]-2,3 диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-циклопропилметил-1-пиперазинил)метил]-2,3-диметоксифенол. Пример 24. Дигидрохлорид 7-6-[(4 циклопропилметил-1-пиперазинил)метил]-2,3 диметоксифенокси]гептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 23. Точка плавления: 170 С. Элементарный микроанализ: Пример 25. Дигидрохлорид этил 5-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксипентаноат. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя этил 7 бромогептаноат на этил 5-бромопентаноат. Пример 26. Дигидрохлорид 5-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифенокси пентановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 25. Точка плавления: 181 С. Элементарный микроанализ: Пример 27. Дигидрохлорид этил 6-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксигексаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя этил 7 бромогептаноат на этил 6-бромогексаноат. 10 Пример 28. Дигидрохлорид 6-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксигексановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 27. Точка плавления: 173 С Элементарный микроанализ: Пример 29. Дигидрохлорид этил 4-6[(пиперазин-1-ил)метил]-2,3-диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-трет-бутоксикарбонил-1-пиперазинил)метил]-2,3-диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 30. Дигидрохлорид 4-6-[(пиперазин-1-ил)метил]-2,3-диметоксифенокси масляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 29. Точка плавления: 141 С Элементарный микроанализ: Пример 31. Дигидрохлорид этил 4-6-[(4 фенил-1-пиперазинил)метил]-2,3-диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил-1-пиперазинил)метил]-2,3-диметоксифенол на 6[(4-фенил-1-пиперазинил)метил]-2,3-диметоксифенол и этил 7-бромогептаноат на этил 4 бромобутират. Пример 32. Дигидрохлорид 4-6-[(4 фенил-1-пиперазинил)метил]-2,3-диметоксифенокси масляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 31. Точка плавления: 129 С. Элементарный микроанализ: Пример 33. Дигидрохлорид этил 7-6-[(4(2-метоксифенил)-1-пиперазинил)метил]-2,3 диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[4-(2-метоксифенил-1-пиперазинил)метил]2,3-диметоксифенол. Пример 34. Дигидрохлорид 7-6-[(4-(2 метоксифенил)-1-пиперазинил)метил]-2,3-диметоксифеноксигептановой кислоты. 11 Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 33. Точка плавления: 141 С Элементарный микроанализ: Пример 35. Дигидрохлорид этил 4-6-[(4(2-метоксифенил)-1-пиперазинил)метил]-2,3 диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил-1-пиперазинил)метил]-2,3-диметоксифенол на 6[(4-(2-метоксифенил)-1-пиперазинил)метил]2,3-диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 36. Дигидрохлорид 4-6-[(4-(2 метоксифенил)-1-пиперазинил)метил]-2,3-диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 35. Точка плавления: 153 С. Элементарный микроанализ: Пример 37. Дигидрохлорид этил 4-6-[(4(пиримидин-2-ил)-1-пиперазинил)метил]-2,3 диметокси-феноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил-1-пиперазинил)метил]-2,3-диметоксифенол на 6[(4-(пиримидин-2-ил)-1-пиперазинил)метил]2,3-диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 38. Дигидрохлорид 4-6-[(4-(2 пиримидин-2-ил)-1-пиперазинил)метил]-2,3 диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 37. Точка плавления: 174 С. Элементарный микроанализ: Пример 39. Дигидрохлорид этил 7-6-[(4(4-хлоробензил)-1-пиперазинил)метил]-2,3 диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-(4-хлоробензил)-1-пиперазинил)метил]2,3-диметоксифенол. Пример 40. Дигидрохлорид 7-6-[(4-(4 хлорофенил)-1-пиперазинил)метил]-2,3-диметоксифеноксигептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 39. Пример 41. Дигидрохлорид этил 4-6-[(4(4-хлорофенил)-1-пиперазинил)метил]-2,3-диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-(4-хлоробензил)-1-пиперазинил)метил]2,3-диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 42. Дигидрохлорид 4-6-[(4-(4 хлорофенил)-1-пиперазинил)метил]-2,3-диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 41. Пример 43. Дигидрохлорид этил 4-6-[(4 циклогексил-1-пиперазинил)метил]-2,3-диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-циклогексил-1-пиперазинил)метил]-2,3 диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 44. Дигидрохлорид 4-6-[(4 циклогексил-1-пиперазинил)метил]-2,3 диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 43. Точка плавления: 211 С Элементарный микроанализ: Пример 45. Дигидрохлорид этил 4-6-[(4 н-гептил-1-пиперазинил)метил]-2,3-диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензилпиперазинил)метил]-2,3-диметоксифенол на 6[(4-н-гептил-1-пиперазинил)метил]-2,3-диметоксифенол и этил 7-бромогептаноат на этил 4 бромобутират. Пример 46. Дигидрохлорид 4-6-[(4-нгептил-1-пиперазинил)метил]-2,3-диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 45. Пример 47. Дигидрохлорид этил 4-6-[(4 циклопропилметил-1-пиперазинил)метил]-2,3 диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензилпиперазинил)метил]-2,3-диметоксифенол на 6 13[(4-циклопропилметил-1-пиперазинил)метил]2,3-диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 48. Дигидрохлорид 4-6-[(4 циклопропилметил-1-пиперазинил)метил]-2,3 диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 47. Пример 49. Дигидрохлорид этил 3-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксипропионата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя этил 7 бромогептаноат на этил 3-бромопропионат. Пример 50. Дигидрохлорид 3-6-[(4-бензил-1-пиперазинил)метил]-2,3-диметоксифеноксипропионовой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 49. Пример 51. Тетрагидрохлорид этил 7-6[(4-(2,6-дипирролидинилпиримидин-4-ил)-1 пиперазинил)метил]-2,3-диметоксифенокси гептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-(2,6-дипирролидинилпиримидин-4-ил)-1 пиперазинил)метил]-2,3-диметоксифенол. Пример 52. Тетрагидрохлорид 7-6-[(4(2,6-дипирролидинил-пиримидин-4-ил)-1 пиперазинил)метил]-2,3-диметоксифенокси гептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 51. Пример 53. Тетрагидрохлорид этил 4-6[(4-(2,6-дипирролидинилпиримидин-4-ил)-1 пиперазинил)метил]-2,3-диметоксифенокси бутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензил 1-пиперазинил)метил]-2,3-диметоксифенол на 6-[(4-(2,6-дипирролидинилпиримидин-4-ил)-1 пиперазинил)метил]-2,3-диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 54. Тетрагидрохлорид 4-6-[(4(2,6-дипирролидинилпиримидин-4-ил)-1-пиперазинил)метил]-2,3-диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 53. Пример 55. Дигидрохлорид этил 7-6-[(4 н-(6-этоксикарбонил)гексил-1-пиперазинил) метил]-2,3-диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензилпиперазинил)метил]-2,3-диметоксифенол на 6[(4-н-(6-этоксикарбонил)гексил-1-пиперазинил) метил]-2,3-диметоксифенол. 14 Пример 56. Дигидрохлорид 7-6-[(4-н-(6 карбокси)гексил-1-пиперазинил)метил]-2,3 диметоксифеноксигептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 55. Пример 57. Дигидрохлорид этил 4-6-[(4(3-этоксикарбонил)пропил-1-пиперазинил)метил]-2,3-диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензилпиперазинил)метил]-2,3-диметоксифенол на 6[(4-(3-этоксикарбонил)пропил-1-пиперазинил) метил]-2,3-диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 58. Дигидрохлорид 4-6-[(4-(3 карбокси)пропил-1-пиперазинил)метил]-2,3 диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 57. Пример 59. Дигидрохлорид этил 7-6-[(4(3-этоксикарбонил)пропил-1-пиперазинил)метил]-2,3-диметоксифеноксигептаноата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензилпиперазинил)метил]-2,3-диметоксифенол на 6[(4-(3-этоксикарбонил)пропил-1-пиперазинил) метил]-2,3-диметоксифенол. Пример 60. Дигидрохлорид 7-6-[(4-(3 карбокси)пропил-1-пиперазинил)метил]-2,3 диметоксифеноксигептановой кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 59. Пример 61. Дигидрохлорид этил 4-6-[(4 н-(6-этоксикарбонил)гексил-1-пиперазинил) метил]-2,3-диметоксифеноксибутирата. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя 6-[(4-бензилпиперазинил)метил]-2,3-диметоксифенол на 6[(4-н-(6-этоксикарбонил)гексил-1-пиперазинил) метил]-2,3-диметоксифенол и этил 7-бромогептаноат на этил 4-бромобутират. Пример 62. Дигидрохлорид 4-6-[(4-н-(6 карбокси)гексил-1-пиперазинил)метил]-2,3 диметоксифеноксимасляной кислоты. Ожидаемый продукт получают по способу,описанному в примере 2, исходя из соединения,описанного в примере 61. Пример 63. Дигидрохлорид 7-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифенокси-N,N-диэтилгептанамида. 4,95 г соединения , описанного в примере 2, растворяют в 100 мл дихлорометана. Добавляют 2,17 г дициклогексилкарбодиимида , после чего следуют 2,1 мл N,N-диэтиламина и 1,28 гN,N-диметиламинопиридина. После перемешивания на протяжении 24 ч, раствор фильтруют,и затем концентрируют досуха, и полученный остаток очищают при помощи хроматографии на кремнеземной колонке, используя градиент 15 этилацетат/метанол (100/0 до 80/20) с получением ожидаемого продукта в виде основания, которое переводят в соответствующий дигидрохлорид. Пример 64. Дигидрохлорид 4-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифенокси-N,N-диэтилбутанамида. Ожидаемый продукт получают по способу,описанному в примере 63, исходя из соединения, описанного в примере 6. Точка плавления: 198 С. Элементарный микроанализ: Пример 65. Дигидрохлорид 3-6-[(4 бензил-1-пиперазинил)метил]-2,3-диметоксифеноксипропионамида. Ожидаемый продукт получают из соединения, описанного в примере 50, которое подвергают реакции в аммиачной среде. Фармакологическое изучение соединений по изобретению А. Изучение противоишемической активности соединений по изобретению. Применяемая модель представляла собой модель переходной зародышевой мозговой ишемии, являющейся следствием внутрилуминальной окклюзии, которая имитирует эмболический мозговой припадок у людей. Расположение инфаркта - кортикальное и субкортикальное(R. Bordet и др., J Cereb Blood Flow Metab. 20,2000, 1190-1196 и 1999, 19, 1309-1345). Модель состоит из односторонней окклюзии средины сонной артерии на протяжении 1 ч,после которой следует реперфузия на протяжении 23 ч, у взрослого самца крысы Уистара(Wistar). Целью этого эксперимента является изучить противоишемический эффект соединений по изобретению. Животных анестезировали для операции при помощи 300 мг/кг хлоралгидрата. На протяжении операции их температуру отслеживали и поддерживали на уровне 37 С, используя нагревающее одеяло с контролем температуры. Основной процедурой было приостановить циркуляцию крови в правой части средней мозговой артерии (СМА) при помощи внутрилуминальной окклюзии устья. Через 60 мин, окклюзию удаляли и животных помещали обратно в их клетку. Через 24 ч животных умерщвляли с анестетиком. Их мозги быстро удаляли и замораживали, и в криостате при помощи стереотактической топографии получали 12 секций толщиной по 50 м и расстоянием между ними в 1 м. Секции окрашивали при помощи быстрого крезилового фиолетового. Неокрашенные участки мозговых отделов определяли как зоны,пораженные инфарктом. Неисправленные зоны,пораженные инфарктом, и общие зоны полушарий подсчитывали отдельно для каждой секции, 005165 16 применяя программу анализа изображения. Исправленный общий объем инфаркта подсчитывали для того, чтобы компенсировать эффект отека мозга. Продукт вводили в дозе 1 мг/кг внутривенно за 34 мин до окклюзии. В этой модели соединения по изобретению, и особенно соединение по примеру 2 существенно снижали размер инфаркта коры и стриатума, проявляя нейрозащитный эффект. В. Гипоксия астроцитов в культуре. Протокол эксперимента Культуры астроцитов получают у новорожденных крыс согласно методике, описаннойBooher и Sensenbrenner (Neurobiology, 1972, 2,97-105). Их используют через от трех до шести недель после помещения в культуру, согласно модели гипоксии, описанной Plateel и др. (J. Neurochem. 1995, 65, 2138-2145). Субстрат меняют за 24 часа до начала гипоксии с целью восстановления резервов АТР. После добавления культурной среды, которую дегазировали по отношению O2, и которая содержит данную концентрацию тестируемых молекул, гипоксию осуществляют в анаэробной камере на протяжении 24 часов. Концентрацию АТР определяют,применяя люминесценцию, и выражают в пикомолях АТР/миллиграмм протеина. В этой модели для степеней гипоксии, которые колеблются от 27% до 79%, соединение по Примеру 2 дает восстановление АТР в диапазоне от 35 до 87%, тогда как триметазин не дает эффекта на этот параметр. Максимальный эффект наблюдается при 1 М. С. Нейрозащита в коре головного мозга и белом веществе при помощи соединений по изобретению. В качестве модели применяли модель нейродегенерации на мышах, которая влияла как на кортикальные нейроны, так и на прилегающее белое вещество (S.L. Tahraoui и др, Brain Pathol.,2001, 11, 56-71). Эта модель основывается на внутримозговой инъекции S-бромо-виллардиина, антагониста глутамата, который действует на рецепторы АМРА-кината, или иботената,антагониста рецепторов типа NMDA, у новорожденных мышей. Все инъекции проводили утром между 10:00 и 13:00. Животных заранее подвергали анестезии и держали под нагревающей лампой во время периода обработки. Каждая экспериментальная группа включает от 5 до 12 Шведских мышей обоего пола, из по меньшей мере 2 различных пометов. На 5 день жизни (Р 5) вводили 10 г иботената или 15 г S-бромовиллардиина внутримозгово, используя иголку размера 25G, укрепленную на 50 л шприце,присоединенному к калибрующему устройству,которое подает каплю в 1 л при каждом сжатии. Иголку вставляли на 2 мм под уровень ко 17 жи, в передне-париетальной области правого полушария (2 мм в передней части лямбоидной структуры и на 2 мм снаружи средней линии). Вводили две капли по 1 л (1 л в перивентрикулярное белое вещество и 1 л в кору головного мозга). Каждую каплю разделяет интервал в 30 секунд, во время которого остается на месте, с целью диффузии продукта. Немедленно после этого экситотоксической атаки, внутриполостно вводили тестируемое соединение (3,10 или 30 мг/кг) или носитель (объем инъекции = 5 л). Животных умерщвляли обезглавливанием через 5 дней (Р 10) и их мозги немедленно удаляли и фиксировали в формуле перед фиксацией в парафине. Приготавливали корональные серии по 15 л для всех мозгов и окрашивали крезиловым фиолетовым, что делало возможным определение прямой оси гистологических повреждений как в коре, так и в белом веществе точным и репродуцибельным. Размеры гистологических повреждений определяли за два независимых наблюдения, при которых экспериментальные группы не были известны. Результаты выражают в виде средних значений. В этой модели соединение по примеру 2 особенно снижало размер повреждений в белом веществе и коре, что свидетельствует о важном нейрозащитном эффекте. Триметазидин (ТМЗ),который проверяли в качестве сравнения, имеет очень низкий нейрозащитный эффект.D. Метаболическая стабильность. Модель, которую применяли для оценки метаболической стабильности, была разработана и откалибрована на выделенных крысиных и человеческих моносомах (М. Bertrand и др.,European Journal of Pharmaceutical Sciences,2000, Том 11, Доп.2, S61-S72). Предсказание метаболической биодоступности (MF%) основывалось на измерении invitro метаболической стабильности с применением микросом печени и суммировании общей абсорбции. Коротко, продукт инкубировали при 10-7 М в присутствии крысиных и человеческих микросом печени (0,33 мг протеина/мл) на протяжении 0, 5, 15, 30 и 60 мин. В каждый момент времени, количество неизмененного продукта измеряли при помощи ЖХ-МС-МС. Присущее очищение in vitro (Clint) соответствует кривой(после LN линеаризации) остаточной концентрации неизмененного продукта на протяжении времени инкубирования. Это присущее очищение in vitro затем масштабировали на весь организм в присущем очищении in vivo (VivoClint) с применением факторов 0,045 мг прот/кг печени и весе печени в 11 г для крысы и 1,2 кг для человека. Перевод присущей чистоты in vivo в гепариновую чистоту (HepCl) достигался с при 005165 18 менением модели венного равновесия HepCl=vivoClintHBF/(vivoClint + HBF), где HBF (гепатическое течение крови) соответствует 22 мл/мин для крысы и 1500 мл/мин для человека. Затем выводили MF% из коэффициента гепатической экстракции, применяя следующую формулу:MF%=l-HepCl/HBF. Этот способ дает корреляцию между данными in vitro и in vivo . В этой модели соединения по изобретению показали очень хорошую метаболическую стабильность. Е. Противоапоптический эффект. Изучение in vitro s антиапоптического эффекта на первичных культурах кардиомиоцитов проводили при помощи включения апоптоза при помощи добавления пероксида водорода(Н 2 О 2). Образовавшиеся свободные радикалы включали апоптоз. Это подобно тому, что наблюдается при ишемии-реперфузии (R. VonHarsdorf, Circulation 99, 2934-2941). Кардиомиоциты выделяли из сердец новорожденных крыс и распределяли при плотности в 35 000 клеток/см 2. Процесс апоптоза индуцируется добавлением Н 2 О 2 (0,075 ммоль/л) на протяжении 30 мин. Кардиомиоциты затем помещают обратно в культурную среду на 24 ч. Апоптические клетки визуализируют при помощи различных методик, например, при помощи фрагментации геномной ДНК, которая вовлечена в процесс апоптоза. Это показано следующими двумя методиками (см. вышеуказанную ссылку): 1. Тест TUNEL дает возможность маркировки ядер клеток, проявляя фрагментацию ДНК. 2. Фрагментацию ДНК демонстрирует методика маркирования ДНК. Характерные фрагменты по 180 bр геномной ДНК определяют при помощи электрофореза на агарозном геле. Миграция фосфатидилсерина (ФС) со внутренней стороны мембраны клеточного ядра на наружную сторону (экстернализация) является ранним показателем апоптоза. Это можно визуализировать при помощи флуоресцентной маркировки с применением аннексина-V-FITC(флуоресцеин изоцианат) и количественно определить при помощи сравнения с общим числом клеток. В этой in vitro модели, соединение по Примеру 2 защищает кардиомициты от апоптоза. Эффект выражается в снижении процента клеток, которые претерпевают апоптоз, и в повышении выживаемости клеток. Как следствие,продукт является кардиозащитным продуктом.F. Нейрозащита в отделах СА 1 и СА 3 морского конька. Каиновая кислота является одним из наиболее сильных эндогенных экситотоксинов, которые существуют, что проявляется в ее способности индуцировать острые или суб-острые 19 расстройства эпилептического вида. Гистопатологические изменения, которые наблюдаются,связанные с применением каиновой кислоты,отличаются от мозговой ишемии, вызванной поражениями, которые сначала развиваются в областях СА 1 и СА 3 морского конька (С. Montecot и др., Neuroscience 84, 791-800). Целью являлось изучить защитный эффект против повреждений, индуцированных в основном в отделе СА 3 морского конька, в то время как снижения циркуляции крови не наблюдается. Каиновую кислоту вводили внутриполостно крысе, находящейся в сознании, в дозе 12 мг/кг. За животным затем наблюдали на протяжении около 2 ч, во время чего, после латентного периода, наблюдались конвульсии эпилептического типа. В конце 2 ч конвульсии прекращали при помощи введения 10 мг/кг диазепама. Животных умерщвляли через 7 дней, их мозги выделяли и получали 8 поперечных секций по 15 м толщиной, между которыми было расстояние 150 м. Их анализировали при помощи длительной микроскопии два независимых наблюдателя, которые находились в неведении касательно экспериментальных групп. Были даны оценки от 0 до 3, в зависимости от тяжести нейрональных повреждений. Оценки каждого полушария складывали, чтобы получить оценку повреждений. Продукт вводили в дозе 20 мг/кг внутриполостным путем за 3 мин до введения каиновой кислоты. В этой модели одна инъекция соединения по примеру 2 защищает нейроны отделов СА 1 и СА 3 морского конька от повреждений, вызванных каиновой кислотой, и таким образом показывает сильный нейрозащитный эффект. Фармакологическая композиция Формула для получения 1000 таблеток,каждая из которых содержит дозу в 10 мг: Соединение примера 2 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)R1 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,R2 представляет собой гидроксигруппу,линейную или разветвленную (C1-С 6)алкоксигруппу или аминогруппу (необязательно замещенную одной или двумя линейными или разветвленными (С 1-С 6)алкильными группами), 005165n представляет собой коэффициент от 1 до 12 включительно,R3 представляет собой атом водорода,линейную или разветвленную (С 1-С 6)алкильную группу, необязательно замещенную фенильной группой (которая сама необязательно замещена одним или более одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной(С 1-С 6)алкоксикарбонильную группу,(С 3-С 7)циклоалкильную группу,пиримидинильную группу, необязательно замещенную одной или двумя пирролидинильными группами, или фенильную группу, необязательно замещенную одним или более одинаковыми или различными заместителями, выбираемыми из атомов галогенов и линейной или разветвленной(С 1-С 6)алкокси, гидрокси и тригалометильной групп,их оптические изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1, в которой R1 представляет собой метильную группу. 3. Соединения формулы (I) по п.1, в которой R3 представляет собой алкильную группу,замещенную фенильной группой, предпочтительно бензильную группу, пиримидинильную группу, фенильную группу, предпочтительно замещенную метоксигруппой или атомом водорода. 4. Соединения формулы (I) по п.1, в которой n представляет собой коэффициент от 1 до 7. 5. Соединения формулы (I) по п.4, в которой n представляет собой 6. 6. Соединения формулы (I) по п.1, в которой R2 представляет собой гидроксигруппу. 7. Соединение формулы (I) по п.1, которое представляет собой 7-6-[(4-бензил-1-пиперазинил)метил]-2,3-диметоксифеноксигептановую кислоту, и его аддитивные соли. 8. Соединения формулы (I) по п.1, которые представляют собой 7-6-[4-(пиримидин-2-ил)-1-пиперазинил] метил-2,3-диметоксифеноксигептановую кислоту,4-6-[(пиперазин-1-ил)метил]-2,3-диметоксифеноксимасляную кислоту,7-6-[(4-(2-метоксифенил)-1-пиперазинил) метил]-2,3-диметоксифеноксигептановую кислоту,4-6-[(4-(2-метоксифенил)-1-пиперазинил) метил]-2,3-диметоксифеноксимасляную кислоту, и их аддитивные соли. 9. Способ получения соединений формулы(I) по п.1, отличающийся тем, что в качестве исходного материала применяется соединение формулы (II) в которой R1 имеет значение, указанное для формулы (I), которое подвергают реакции в присутствии формальдегида с замещенным пиперазином формулы (III) в которой R'3 имеет значение, указанное для R3,за исключением алкильной группы, замещенной карбоксигруппой,с получением соединения формулы (IV) в которой R1 и R'3 имеют значения, указанные здесь ранее, которое подвергают реакции с соединением формулы (V)(V) в которой X представляет собой атом галогена иR'2 представляет собой линейную или разветвленную (С 1-С 6)алкоксигруппу, с получением соединения формулы (I/а), частного случая соединений формулы (I)(I/а) переводят, при желании,в соответствующую моно- или ди-кислоту формулы (I/b), частный случай соединений формулы (I) или в соответствующий амид формулы (I/с) в которой R1, R3 и n имеют значения, указанные для формулы (I), и R2 представляет собой аминогруппу, необязательно замещенную одной или двумя линейными или разветвленными (С 1 С 6)алкильными группами,эти соединения формул (I/a), (I/b) и (I/с) очищают, при необходимости, согласно традиционной методике очистки, разделяют там, где это уместно, на их изомеры и переводят, при желании, в аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Фармацевтические композиции, включающие в качестве активного ингредиента соединение по любому из пп.1-8 в сочетании с одним или более инертными, нетоксичными,фармацевтически приемлемыми эксципиентами или носителями. 11. Фармацевтические композиции по п.10,включающие в качестве активного ингредиента соединение по любому из пп.1-8 для применения при профилактике или лечении острой и хронической клеточной ишемии, острых или хронических ишемичных приступах мозга,сердца или периферийных, за которыми либо следует реперфузия, либо нет, перед любым хирургическим вмешательством, требующим временного прерывания циркуляции крови, при лечении хронических нейродегенеративных заболеваний, а также при усовершенствовании хранения органов, предназначенных для трансплантации, и для возобновления функционирования трансплантатов после реперфузии.
МПК / Метки
МПК: A61K 31/495, C07D 295/03, A61P 25/28, A61P 9/10, A61P 41/00
Метки: способ, композиции, получения, новые, n-бензилпиперазина, фармацевтические, соединения, содержащие
Код ссылки
<a href="https://eas.patents.su/12-5165-novye-soedineniya-n-benzilpiperazina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-ih-soderzhashhie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения n-бензилпиперазина, способ их получения и фармацевтические композиции их содержащие</a>
Предыдущий патент: Способ и набор реагентов для определения активности 5′-нуклеотидазы
Следующий патент: Композиция, содержащая щелочную сфингомиелиназу, для применения в качестве диетического препарата, пищевой добавки или фармацевтического продукта
Случайный патент: Горловина загрузочная шприца вакуумного












