2-(1h-индол-3-ил)-2-оксоацетамиды, обладающие противоопухолевой активностью
Формула / Реферат
1. Соединения формулы I
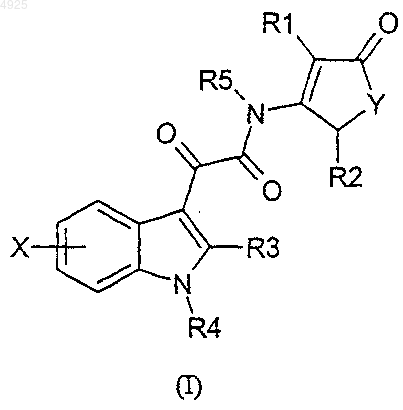
где R1, R2 и R5 независимо представляют собой водород или C1-C6алкильную группу;
R3 представляет собой водород, C1-C4алкил, аралкил, возможно замещенный фенил;
R4 представляет собой водород, прямой или разветвленный C1-C8алкил, C5-C6циклоалкил; аралкил; гетероаралкил;
X представляет собой одну или более чем одну группу, максимально четыре, независимо выбранную из водорода; C1-C6алкила; C1-C6галогеналкила; C1-C6гидроксиалкила; C1-C6аминоалкила; C1-C6алкокси- C1-C6алкила; C1-C18ацилокси- C1-C6алкила; гидрокси; C1-C4алкокси; C1-C3галогеналкокси; фенокси; аралкокси; C1-C3ацилокси; амино; C1-C3алкиламино; C1-C3ациламино; C1-C3алкилсульфониламино; ароиламино; галогена; нитро; циано; трифторметила; карбокси; C1-C6алкоксикарбонила; группы RaRbN(CH2)nC(=O)-, где Ra и Rb независимо представляют собой водород, C1-C3алкил или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое, пиперазиновое или морфолиновое кольцо и n=0 или целому числу от 1 до 4; группы RaRcN(CH2)nC(=O)-, где Ra и n такие, как определено выше, а Rc представляет собой C1-C4алкоксикарбонильную группу; группы R1C(=O)-, где R1 такой, как определено выше; сульфонила; меркапто; C1-C4алкилтио; C1-C4алкилсульфинила; C1-C4алкилсульфонила; аминосульфонила; C1-C3алкиламиносульфонила; группы -P(=O)(OR1)(OR2), где R1 и R2 такие, как определено выше; группы (E)- или (Z)-C(R1)=C(R2)-C(=O)R6, где R6 представляет собой гидрокси, C1-C6алкокси, NRaRb или группу формулы RaRbN(CH2)mNR1-, где m равно целому числу от 2 до 4 и R1, R2, Ra и Rb такие, как определено выше;
Y представляет собой атом кислорода или серы, их изомеры, энантиомеры и их смеси, и их фармацевтически приемлемые соли.
2. Соединения по п.1, где Y представляет собой атом кислорода.
3. Соединения по п.1, где Y представляет собой атом серы.
4. Соединения по пп.1, 2 или 3, где R1, R2 и R3 представляют собой водород или метил.
5. Соединения по любому из пп.1-4, где R4 представляет собой водород; метил; бензил, замещенный по бензольному кольцу одной или более чем одной группой, выбранной из метила, трет-бутила, фтора, хлора, брома, гидрокси, ацетокси, метокси, трифторметокси, бензилокси, трифторметила, циано, нитро, амино, ацетиламино, метилсульфониламино, метилмеркапто, метилсульфинила, метилсульфонила, фенила, этоксикарбонила, карбокси, карбоксиметила, (этоксикарбонил)метила, (трет-бутоксикарбонил)метила, (бензилоксикарбонил)метила, (диметилкарбамоил)метила; a -нафтил, b -нафтил; 4-пиридил; 4-пиридил-N-оксид.
6. Соединения по любому из пп.1-5, где X представляет собой метил, этил, фтор, хлор, бром, гидрокси, ацетокси, метокси, фенокси, трифторметокси, трифторметил, циано, нитро, амино, ацетиламино, метилсульфониламино, метилмеркапто, метилсульфинил, метилсульфонил, карбокси, метоксикарбонил, трет-бутоксикарбонил, диэтилкарбамоил, (2-аминоэтил)карбамоил, (2-диметиламиноэтил)карбамоил, (E)- и (Z)-2-карбоксиэтен-1-ил, (E)- и (Z)-(2-трет-бутоксикарбонил)этен-1-ил, (E)- и (Z)-(этоксикарбонил)этенил, гидроксиметил и аллилоксиметил.
7. Фармацевтические композиции, содержащие соединение по пп.1-6 в смеси с приемлемым носителем.
8. Применение соединений по пп.1-6 для приготовления лекарств для лечения опухолей.
Текст
1 Настоящее изобретение относится к 2-(1 Ниндол-3-ил)-2-оксоацетамидам,обладающим противоопухолевой активностью, в частности,против твердых опухолей, точнее против опухолей толстой кишки и легких. Колоректальная карцинома является одним из самых распространенных опухолевых заболеваний в западных странах, которое насчитывает примерно 421000 новых случаев в мире каждый год и является самой частой причиной смерти, кроме рака легких и рака молочной железы. Хирургическое лечение возможно примерно у 40-50% пациентов, оставшуюся часть пациентов можно лечить с помощью комбинированной химиотерапии, достигая полной ремиссии не выше 5%. Колоректальные опухоли обычно невосприимчивы или мало чувствительны к доступной в настоящее время химиотерапии, и единственным агентом, обладающим некоторой эффективностью для этого типа рака, является 5 фторурацил. В настоящее время не имеется терапевтических альтернатив в случае, когда комбинированная химиотерапия, основанная на 5-ФУ (5 фторурацил), является неэффективной. Следовательно, имеется острая необходимость в новых лекарствах, активных в отношении этого типа опухолей. В WO 99712917 (Roche Diagnostics) описаны производные 4-уреидо и тиоуреидо 2(5 Н)фуранона или 2(5 Н)-тиофенона, обладающие противоопухолевой активностью, в частности, в отношении опухолей толстой кишки. В WO 98/09946 (Asta Medica) описаны производные индол-3-глиоксиламида. Эти соединения замещены по атому азота амидной группы ароматическим и пиридильным остатками и, как сообщается, обладают антиастматической, антиаллергической, иммуносупрессивной и имуномодулирующей активностью. В Proceedings of the American Associationfor Cancer Research, том 40, рефераты 1893 и 4110, 1999) описывается соединение N-(4 пиридил)-2-(1-(4-хлорбензил)-1 Н-индол-3-ил)глиоксиламид (D-24,851), обладающее противоопухолевыми эффектами in vitro и in vivo. Было обнаружено, что производные N-(5 оксо-2,5-дигидрофуран-3-ил) или N-(5-оксо-2,5 дигидротиофен-3-ил)-2-(1 Н-индол-3-ил)-2-оксоацетамида имеют заметную противоопухолевую активность, в частности, в отношении твердых опухолей человека. Соединения по изобретению можно представить общей формулой (I) где R1, R2 и R5 независимо представляет собой водород или С 1-С 6 алкильную группу;R4 представляет собой водород, прямой или разветвленный С 1-С 8 алкил,С 5 С 6 циклоалкил; аралкил; гетероаралкил;X представляет собой одну или более чем одну группу, максимально четыре, независимо выбранную из водорода; С 1-С 6 алкила; С 1 С 6 галогеноалкила; С 1-С 6 гидроксиалкила; С 1 С 6 аминоалкила; С 1-С 6 алкокси-С 1-С 6 алкила; С 1-С 18 ацилоксиС 1-С 6 алкила; гидрокси; С 1 С 4 алкокси; С 1-С 3 галогеноалкокси; фенокси; аралокси; С 1-С 3 ацилокси; амино; С 1-С 3 алкиламино; С 1-С 3 ациламино; С 1-С 3 алкилсульфониламино; ароиламино; галогена; нитро; циано; трифторметила; карбокси; С 1-С 6 алкоксикарбонила; группы RaRbN(CH2)nC(=O)-, где Ra и Rb независимо представляют собой водород, С 1 С 3 алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое, пиперазиновое или морфолиновое кольцо, и n=0 или целому числу от 1 до 4; группы RaRcN(CH2)nC(=O)-, где Ra и(Z)-C(R1)=C(R2)-C(=O)R6, где R6 представляет собой гидрокси, С 1-С 6 алкокси, NRaRb или группу формулы RaRbN(CH2)mNR1-, где m равно целому числу от 2 до 4, и R1, R2, Ra и Rb такие, как определено выше;Y представляет собой атом кислорода или серы,а также их изомеры, энантиомеры и их смеси. Изобретение также относится к солям соединений формулы (I), которые можно получить путем взаимодействия нетоксичных кислот или оснований с ионизируемыми группами, присутствующими в соединениях формулы (I). Возможно замещенный фенил предпочтительно означает фенил, 4-метилфенил, 2,4-диметоксифенил, 4-метоксифенил, 4-нитрофенил,3-хлорфенил, 4-гидроксифенил, 3,5-диметокси 3 4-гидроксифенил, 3-цианофенил, 2-гидроксифенил, 2-карбоксифенил. Аралкил предпочтительно означает бензил, фенетил, нафтилметил, бифенилметил, возможно замещенные одной или более чем одной хлоро, фторо, трифторметильной, нитро, циано,метилсульфонильной, трет-бутильной группой. Гетероалкил предпочтительно означает пиридилметил.R1, R2, R3 и R5 предпочтительно представляют собой водород и метил.R4 предпочтительно представляет собой водород; метил; бензил, замещенный по бензольному кольцу одной или более чем одной группой, выбранной из метила, трет-бутила,фтора, хлора, брома, гидрокси, ацетокси, метокси, трифторметокси, бензилокси, трифторметила, циано, нитро, амино, ацетиламино, метилсульфониламино, метилмеркапто, метилсульфинила, метилсульфонила, фенила, этоксикарбонила, карбокси, карбоксиметила, (этоксикарбонил)метила, (трет-бутоксикарбонил)метила,(бензилоксикарбонил)метила, (диметилкарбамоил)метила; -нафтил; -нафтил; 4-пиридил; 4-пиридил-N-оксид.X предпочтительно представляет собой метил, этил, фтор, хлор, бром, гидрокси, ацетокси, метокси, фенокси, трифторметокси, трифторметил, циано, нитро, амино, ацетиламино,метилсульфониламино, метилмеркапто, метилсульфинил, метилсульфонил, карбокси, метоксикарбонил, трет-бутоксикарбонил, диэтилкарбамоил,(2-аминоэтил)карбамоил,(2-диметиламиноэтил)карбамоил, (Е)- и (Z)-2-карбоксиэтен-1-ил, (Е)- и (Z)-(2-трет-бутоксикарбонил) этен-1-ил, (Е)- и (Z)-(этоксикарбонил)этенил,гидроксиметил и аллилоксиметил.Y предпочтительно представляет собой атом кислорода. Соединения по изобретению можно получить путем взаимодействия соединений формулы (II) где Y, R1 и R2 такие, как определено выше. Реакцию проводят в растворителе, таком как этиловый эфир, изопропиловый эфир, метил-трет-бутиловый эфир, тетрагидрофуран,диоксан, 1,2-диметоксиэтан, дихлорметан, 1,2 004925 4 дихлорэтан, толуол, диметилформамид, диметилацетамид, диметилсульфоксид, при температуре в интервале от 0 С до температуры дефлегмации растворителя, используя 1-3 молярных эквивалента соединений формулы (III). Возможно, реакцию можно осуществить в присутствии карбоната щелочного или щелочно-земельного металла. Реакцию предпочтительно проводят в растворителе, таком как этиловый эфир, ТГФ (тетрагидрофуран) или 1,2-диметоксиэтан, при температуре в интервале от комнатной температуры до 80 С, в присутствии по меньшей мере одного эквивалента карбоната калия. Конечные соединения формулы (I) можно затем превратить в другие соединения формулы(I) согласно методикам, обычно применяемым для превращения функциональных групп, например, реакциям, таким как гидролиз эфирных групп, этерификация карбоновых кислот, амидирование и тому подобное. Например, если в соединениях формулы (II) X и R4 содержат заместители, которые препятствуют протеканию реакции соединений формулы (II) с соединениями формулы (III), то применяют подходящие защитные группы, которые затем удаляют обычными способами. Соединения формулы (I), в которых R5 представляет собой С 1-С 6 алкильную группу,получают алкилированием соединений формулы (I), в которых R5 представляет собой водород, производным R5-Hal, где Hal предпочтительно представляет собой хлор, бром или йод,в присутствии гидрида щелочного или щелочноземельного металла. Соединения формулы (II) получают путем взаимодействия соединений формулы (IV) где X, R3 и R4 такие, как определено выше, с оксалилхлоридом. Реакцию обычно проводят в растворителе,таком как этиловый эфир, изопропиловый эфир,трет-бутилметиловый эфир, тетрагидрофуран,диоксан, дихлорметан, при температуре в интервале от -10 до 25 С, используя от одного до двух молярных эквивалентов оксалилхлорида,предпочтительно от 0 до 25 С в этиловом эфире или тетрагидрофуране и используя небольшой избыток (1,2 молярных эквивалента) оксалилхлорида. Реакция обычно завершается через 3 ч. Соединения формулы (IV) получают путем взаимодействия индолов формулы (V) с галогенидами формулы R4-Hal (VI), где Hal предпочтительно представляет собой хлор, бром или йод, в присутствии связывающих кислоту агентов. Реакцию обычно проводят, используя эквимолярное количество или небольшой избыток галогенида (VI) в протонном, диполярном апротонном или неполярном растворителе, таком как этанол, изопропанол, трет-бутанол, тетрагидрофуран, диоксан, диметилсульфоксид, диметилформамид, диметилацетамид, N-метилпирролидинон, ацетонитрил, в присутствии гидроксида, алкоксида или гидрида щелочного или щелочно-земельного металла, такого как гидроксид натрия, гидрид натрия, трет-бутоксид калия. Реакцию обычно проводят при температуре в интервале от 0 С до температуры дефлегмации растворителя в течение периода времени от 30 мин до 24 ч, предпочтительно в диметилсульфоксиде в присутствии гидрида натрия в эквимолярном количестве к соединению (V), путем взаимодействия соединений (V) с гидридом натрия при 0-25 С с последующим добавлением соединений (VI) и нагреванием до 50-70 С. Реакция обычно завершается через 3 ч. Соединения формул (V) и (VI) известны или их можно получить известными способами,и многие из них имеются в продаже. Соединения формулы (III), где Y представляет собой атом кислорода, получают согласно приведенным на следующей схеме реакциям, применяя в качестве исходных веществ известные соединения формулы (VII). Соединения (VII) сначала превращают в енамины (VIII) путем взаимодействия с солью аммония, такой как ацетат аммония. Енамины затем превращают в соединения (III), где Y = О, нагреванием в диметилформамиде. Альтернативно, соединения (III), где Y представляет собой кислород или серу, можно получить из известных фурандионов или тиофендионов (IX) с помощью расплавления с солью аммония, такой как ацетат аммония. Соединения по изобретению фармакологически протестировали в отношении четырех линий опухолевых клеток человека: НТ 29 (кар 004925Lymphokines", J. Immunolog. Methods, (1984), 70,257-268). Полученные данные показали, что соединения по настоящему изобретению обладают заметной активностью в отношении твердых опухолей, в частности в отношении опухолей толстой кишки и легких. Соединения по изобретению можно вводить в дозах в интервале от 0,01 мг/кг до 1 г/кг веса тела в сутки. Предпочтительно режимы дозировок могут составлять примерно от 1 до примерно 500 мг/кг веса тела в сутки, применяя такие единичные дозы с тем, чтобы ввести за 24 ч примерно от 70 мг до примерно 3,5 г активного вещества пациенту с массой тела примерно 70 кг. Такие режимы дозировок могут корректироваться для получения лучшего терапевтического эффекта. Например, дозировки могут корректироваться, принимая во внимание терапевтический режим пациента. Активные соединения по изобретению можно вводить перорально, внутривенно, внутримышечно или подкожно. Соединения по изобретению можно вводить согласно хорошо известным терапевтическим методикам в комбинации с другими агентами, вызывающими регрессию опухолей, чтобы синергически усилить противоопухолевые эффекты указанных соединений. Примерами соединений, которые можно применять в комбинации с соединениями по изобретению, являются цисплатин, карбоплатин, доксорубицин,топотекан, таксол, таксотер, винкристин, 5 фторурацил. Фармацевтические композиции по настоящему изобретению содержат в себе терапевтически эффективные количества по меньшей мере одного соединения по изобретению в смеси с фармацевтически приемлемыми эксципиентами. Композиции для перорального применения обычно включают в себя инертный разбавитель или пищевой носитель и могут заключаться в желатиновые капсулы или могут быть спрессованы в таблетки. Другими подходящими для перорального введения формами являются капсулы, пилюли, эликсиры, суспензии или сиропы. 7 Таблетки, пилюли, капсулы и подобные композиции могут содержать следующие ингредиенты (в дополнение к активной субстанции): связующий агент, такой как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза; разрыхляющий агент, такой как альгиновая кислота, примогель, кукурузный крахмал и тому подобные; смазывающее вещество, такое как стеарат магния; скользящее вещество, такое как коллоидный диоксид кремния; подслащающий агент, такой как сахароза или сахарин; корригент, такой как мятное масло, метилсалицилат или апельсиновый корригент. Если выбранная композиция представлена в форме капсул, то она может содержать дополнительно жидкий носитель, такой как жирное масло. Другие композиции могут содержать другие различные материалы, которые изменяют физическую форму, такие как покрывающие агенты (для таблеток и пилюль), такие как сахар или шеллак. Применяемые в приготовлении композиций материалы должны быть фармацевтически чистыми и нетоксичными в применяемых дозах. Для приготовления фармацевтических композиций для парентерального введения активный ингредиент может быть соединен с растворами или суспензиями, которые могут содержать дополнительно следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, масла,полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатные агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для корректирования тоничности раствора, такие как хлорид натрия или декстроза. Парентеральный препарат может быть заключен в ампулы, шприцы одноразового применения или стеклянные или пластиковые флаконы. Изобретение далее описано следующими примерами. Получение 1. 4-Амино-5 Н-фуран-2-он. Раствор этил-4-хлорацетоацетата (7,02 мл) и ацетата аммония (11,8 г) в абсолютном этаноле (180 мл) кипятят с обратным холодильником в течение 3 ч и оставляют на ночь при комнатной температуре. Затем раствор концентрируют досуха дистилляцией при пониженном давлении, и полученный остаток очищают флэшхроматографией (силикагель, 200 г; элюент СН 2 Сl2/СН 3OН/ТЭА (триэтиламин) 15/5/2) с получением 6,53 г этил-(Z)-3-амино-4-хлор-2 бутаноата в виде темного масла, которое применяют без дополнительной очистки.Z-конформацию относительно двойной связи подтверждают тестами ЯМР-спектроскопии ядерного эффекта Оверхаузера (NOE). Полученный продукт (6,30 г) растворяют в безводном диметилформамиде, и раствор нагревают в атмосфере азота при 100 С в течение 2 ч 30 мин, а затем при 130 С в течение 1 ч 30 мин. Диметилформамид затем отгоняют при пониженном давлении при 90 С, полученный остаток растворяют в абсолютном этаноле (50 мл) и обрабатывают активированным углем (1,5 г). Уголь отфильтровывают, фильтрат концентрируют досуха, и полученный остаток очищают флэш-хроматографией (силикагель, 190 г; элюент СН 2 Сl2/СН 3OН 9/1). Хроматографические фракции, содержащие продукт, объединяют,концентрируют досуха, и остаток кристаллизуют из этилацетата (3 мл) и диизопропилового эфира (6 мл) с получением 2,54 г 4-амино-5 Нфуран-2-она. Тпл= 157-159 С 1 Н-ЯМР (ДМСО-d6, млн-1): 4.45 (s, 1H); 4.57 (s, 2H); 7.20 (br.s, 2H). Получение 2. 1-(2,4,6-Триметилбензил) индол. Раствор индола (1,185 г) в безводном ДМСО (3 мл) добавляют по каплям к суспензии гидрида натрия (60%-ная суспензия в минеральном масле; 0,44 г) в безводном ДМСО (10 мл). Через 2 ч к полученному раствору добавляют раствор 2,4,6-триметилбензилхлорида (1,9 г) в безводном ДМСО (2 мл) и нагревают при 60 С в течение 6 ч. Реакционную смесь оставляют при комнатной температуре на ночь, затем вливают в воду (250 мл), экстрагируют этилацетатом и сушат (Na2SO4). Осушающий агент отфильтровывают, растворитель упаривают при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель; элюент н-гексан/этилацетат 9/1) с получением 2,2 г 1-(2,4,6-триметилбензил)индола. Тпл = 79-81 С Получение 3. 1-(н-Октил)индол. Раствор индола (1,0 г) в безводном ДМСО(1 мл) добавляют по каплям к суспензии гидрида натрия (60%-ная суспензия в минеральном масле; 0,37 г) в безводном ДМСО (20 мл). Смесь нагревают при 60 С в течение 1 ч. После охлаждения до комнатной температуры к полученному раствору по каплям добавляют раствор ноктилбромида (2,82 мл) в безводном ДМСО (2,8 мл) и выдерживают при комнатной температуре в течение ночи. Реакционную смесь вливают в воду (200 мл) и экстрагируют этилацетатом (2 х 50 мл). Объединенные органические фазы промывают насыщенным раствором NaCl, сушат и упаривают досуха. Полученный остаток очищают колоночной хроматографией (силикагель; элюент н-гексан) с получением 1,86 г 1-(н 9 октил)индола в виде масла. Соединение характеризуют по его спектру 1 Н-ЯМР. Получение 4. 1-Замещенные индолы. Следуя процедурам, описанным в примерах 2 и 3, получают следующие 1-замещенные индолы, используя в качестве исходных соединений подходящие индолы и галогениды, возможно с последующими стандартными химическими превращениями полученных 1-замещенных индолов 1-(4-хлорбензил)-5-хлориндол, масло; 1-(4-хлорбензил)-6-хлориндол, масло; 1-(4-хлорбензил)-2-метилиндол, масло; 1-(4-хлорбензил)-5-нитроиндол, Тпл = 135137 С; 1-(4-хлорбензил)-6-фториндол, масло; 1-[4-(метилсульфонил)бензил]-5-хлориндол, Тпл = 133-135 С; 1-(4-хлорбензил)-5-метоксииндол, масло; 1-(3-хлорбензил)индол, масло; 1-(4-фторбензил)индол, масло; 1-(-нафтил)индол, Тпл = 106-108 С; 1-(4-бифенилметил)индол, Тпл=130-133 С; 1-(4-метоксибензил)индол, масло; 1-бензилиндол, масло; 1-(4-хлорбензил)индол, масло; 1-метилиндол, масло; 5-хлор-1-(4-хлорбензил)-2-метилиндол; 5-метокси-1-(4-хлорбензил)-2-метилиндол; 1-(4-хлорбензил)-2,5-диметилиндол; 4-хлор-1-(4-хлорбензил)индол; 4-ацетокси-1-(4-хлорбензил)индол; 1-(4-хлорбензил)-4-метилиндол, масло; 1-(4-хлорбензил)-5-цианоиндол, Тпл=108110 С; 5-бром-1-(4-хлорбензил)индол, масло; 5,6-диметокси-1-(4-хлорбензил)индол, масло; 5-бензилокси-1-(4-хлорбензил)индол; 1-(4-хлорбензил)-5-(метоксикарбонил)индол; 5-ацетиламино-1-(4-хлорбензил)индол; 5-метансульфониламино-1-(4-хлорбензил) индол; 1-(4-хлорбензил)-5-метилиндол, масло; 1-(4-хлорбензил)-6-метилиндол, масло; 1-(4-хлорбензил)-7-нитроиндол, Тпл = 243245 С; 1-(4-хлорбензил)-7-метилиндол, масло; 1-(4-хлорбензил)-4-метоксииндол, масло; 1-(4-хлорбензил)-4-(этоксикарбонил)индол ; 1-(4-хлорбензил)-4-нитроиндол, масло; 4-ацетиламино-1-(4-хлорбензил)индол; 6-циано-1-(4-хлорбензил)индол; 5,7-диметокси-1-(4-хлорбензил)индол; 1-(4-хлорбензил)-2-фенилиндол, масло; 1-(4-хлорбензил)-2-фенил-5-метилиндол; 1-(4-хлорбензил)-2,7-диметилиндол; 1-(4-хлорбензил)-6-метоксииндол; 2-(4-хлорфенил)-1-этилиндол; 1-(4-хлорбензил)-2-(2-пиридил)индол; 1-метил-6-метоксииндол; 5-хлор-1-(4-метоксибензил)-2-метилиндол; 1-(4-пиридилметил)индол, масло; 1-(4-пиридилметил)-6-хлориндол; 1-[4-(метилсульфонил)бензил]-1 Н-индол,Тпл = 133-135 С; 6-бром-1-(4-хлорбензил)-1 Н-индол, масло; 1-[(3,5-диметил-4-изоксазолил)метил]-1 Ниндол, масло; 4-(1 Н-индол-1-илметил)бензонитрил, масло; 1-(4-хлорбензил)-6-фенокси-1 Н-индол,масло; 1-(5-хлор-2-фторбензил)-1 Н-индол, масло; 4-(1 Н-индол-1-илметил)бензойная кислота,Тпл = 155-158 С; этиловый эфир 4-(1 Н-индол-1-илметил) бензойной кислоты, масло (получен взаимодействием 4-(1 Н-индол-1-илметил)6 ензойной кислоты с 1,1-карбонилдиимидазолом в ТГФ с последующей обработкой абсолютным этанолом при 70 С в течение 3 ч); 1-(4-хлорбензил)-7-фтор-1 Н-индол, масло;[4-(1 Н-индол-1-илметил)фенил]уксусная кислота; этиловый эфир [4-(1 Н-индол-1-илметил) фенил]уксусной кислоты, масло (получен взаимодействием [4-(1 Н-индол-1-илметил)фенил]уксусной кислоты с 1,1-карбонилдиимидазолом в ТГФ при комнатной температуре в течение 4 ч с последующей обработкой абсолютным этанолом при комнатной температуре в течение ночи); трет-бутиловый эфир [4-(1 Н-индол-1-илметил)фенил]уксусной кислоты, масло (получен взаимодействием [4-(1 Н-индол-1-илметил)фенил]уксусной кислоты с избытком ди-третбутилацеталя N,N-диметилформамида в толуоле при 80 С);N-[2-(диметиламино)этил]-2-[4-(1 Н-индол 1-илметил)фенил]ацетамид, масло (получен взаимодействием [4-(1 Н-индол-1-илметил)фенил]уксусной кислоты с 1,1-карбонилдиимидазолом в ТГФ при комнатной температуре в течение 3 ч с последующей обработкой N,N-диметилэтилендиамином при комнатной температуре в течение 2 ч); метиловый эфир 3-(1 Н-индол-1-илметил) бензойной кислоты, масло; 3-(1 Н-индол-1-илметил)бензойная кислота,Тпл = 158-160 С (получена обработкой этанольного раствора метилового эфира 3-(1 Н-индол-1 илметил)бензойной кислоты 1 н NaOH с последующим подкислением 2 н НО);N-[2-(диметиламино)этил]-3-(1 Н-индол-1 илметил)бензамид, масло (получен взаимодействием 3-(1 Н-индол-1-илметил)бензойной кислоты с 1,1-карбонилдиимидазолом в ТГФ при комнатной температуре в течение 2 ч с последующей обработкой N,N-диметилэтилендиамином при комнатной температуре в течение 2 ч);[1-(4-хлорбензил)-1 Н-индол-4-ил]метанол,Тпл = 66-67 С (получен восстановлением 1-(4 хлорбензил)-4-метоксикарбонил)-1 Н-индола с помощью LiAlH4); 1-(4-хлорбензил)-1 Н-индол-4-карбальдегид, Тпл = 66-68 С (получен окислением [1-(4 хлорбензил)-1 Н-индол-4-ил]метанола избытком МnО 2 в кипящем СН 2 С 12); 1-(4-хлорбензил)-1 Н-индол-4-карбоновая кислота, Тпл = 190-193 С; 7-(бензилокси)-1-(4 фторбензил)-1 Н-индол, масло; 2-(диметиламино)этил-1-(4-хлорбензил)1 Н-индол-4-карбоксилат, масло (получен взаимодействием 1-(4-хлорбензил)-1 Н-индол-4 карбоновой кислоты с 1,1-карбонилдиимидазолом в ТГФ при комнатной температуре в течение 2 ч с последующей обработкой избытком 2-диметиламиноэтанола при температуре дефлегмации); 2-[4-(1 Н-индол-1-илметил)фенил]-N,Nдиметилацетамид, масло (получен взаимодействием [4-(1 Н-индол-1-илметил)фенил]уксусной кислоты с 1,1-карбонилдиимидазолом в ТГФ при комнатной температуре в течение 2 ч с последующей обработкой 5,2 н раствором диметиламина в этаноле); бензиловый эфир [4-(1 Н-индол-1-илметил) фенил]уксусной кислоты, масло (получен взаимодействием[4-(1 Н-индол-1-илметил)фенил] уксусной кислоты с 1,1 -карбонилдиимидазолом в ТГФ при комнатной температуре в течение 2 ч с последующей обработкой бензиловым спиртом); 1-(4-хлорбензил)-1 Н-индол-4-карбонитрил,Тпл = 85-87 С; 1-(4-метил-3-нитробензил)-1 Н-индол, масло; трет-бутиловый эфир(2 Е)-3-[1-(4 хлорбензил)-1 Н-индол-4-ил]-2-пропеновой кислоты, Тпл = 91-94 С (получен по реакции Виттига взаимодействием 1-(4-хлорбензил)-1 Ниндол-4-карбальдегида с Ph3P=CHCOOtBu в кипящем СН 2 Сl2); тртет-бутиловый эфир 1-(4-хлорбензил)1 Н-индол-4-карбоновой кислоты, масло (получен взаимодействием 1-(4-хлорбензил)-1 Ниндол-4-карбоновой кислоты с избытком дитрет-бутилацеталя N,N-диметилформамида в толуоле при 80 С); 1-[4-(бензилокси)бензил]-1 Н-индол, Тпл = 78-80 С; 1-[1-(4-хлорбензил)-1 Н-индол-4-ил]этанол 14 1-[1-(4-хлорбензил)-1 Н-индол-4-ил]этанон,Тпл=123-125 С (получен окислением 1-[1-(4 хлорбензил)-1 Н-индол-4-ил]этанола избытком МnО 2 в кипящем СНСl3); 2-[4-[(аллилокси)метил]-1-(4-хлорбензил)]1 Н-индол, масло (получен алкилированием [1(4-хлорбензил)-1 Н-индол-4-ил]метанола аллилбромидом в ДМФ в присутствии NaH при комнатной температуре в течение 3 ч). Получение 5. 4-Амино-5 Н-тиофен-2-он. Имеющийся в продаже 4-гидрокси-2(5 Н)тиофенон (1,16 г) добавляют в расплавленный ацетат аммония (3,08 г) при температуре 130 С. Через 30 мин расплавленную смесь охлаждают,добавляют 1,2-диметоксиэтан (50 мл). После перемешивания в течение 30 мин твердый остаток отфильтровывают и выбрасывают. Раствор диметоксиэтана концентрируют досуха и полученный твердый остаток очищают колоночной хроматографией на силикагеле. Элюирование вначале осуществляют смесью CH2Cl2/CH3OH 9/1, затем CH2Cl2/CH3OH 8/2. Самые первые выходящие фракции, содержащие продукт, объединяют и концентрируют досуха с получением 4-амино-5 Н-тиофен-2-она (0,43 г). 1 Н-ЯМР (ДMCO-d6, млн-1): 3.90 (s, 2H); 4.95 (s, 1H); 7.43 (br.s, 2H). Тпл =122-126 С. Элементный анализ для формулыC4H5NOS: вычислено, %: С = 41,72, Н = 4,38, N = 12,16, S = 27,84; обнаружено, %: С = 41,81, Н = 4,45, N = 11,81, S = 27,24. Пример 1. 2-(1-(4-Хлорбензил)-1 Н-индол 3-ил)-2-оксоацетилхлорид. К перемешиваемому и охлажденному до 0 С раствору 1-(4-хлорбензил)-1 Н-индола (2,0 г) в безводном этиловом эфире (5 мл) по каплям добавляют раствор оксалилхлорида (0,85 мл) в безводном этиловом эфире (2 мл). Реакционную смесь оставляют при комнатной температуре на 2 ч. Выделившийся твердый осадок отфильтровывают, промывают безводным этиловым эфиром и сушат в вакууме при 40 С с получением 2-(1-(4-хлорбензил)-1 Н-индол-3-ил)-2-оксоацетилхлорида (1,64 г). Тпл=151-153 С. 1 Н-ЯМР (CDCl3-d3, млн-1): 5.43 (s, 2H); 7.12 (d, 2H); 7.25-7.45 (m, 5H); 8.25 (s, 1H); 8.43(m, 1H). Пример 2. N-(5-оксо-2,5-дигидрофуран-3 ил)-2-(1-(4-хлорбензил)-1 Н-индол-3-ил)-2-оксоацетамид. Раствор 2-(1-(4-хлорбензил)-1 Н-индол-3 ил)-2-оксоацетилхлорида (0,45 г) и 4-амино-5 Нфуран-2-она (0,30 г) в безводном тетрагидрофуране (10 мл) кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь выливают в воду (200 мл) и полученную суспензию перемешивают в течение 1 ч. Твердый осадок отфильтровывают, ресуспендируют в метаноле(4,3 мл), перемешивая в течение 1 ч и затем снова отфильтровывают с получением N-(5-oкco2,5-дигидрофуран-3-ил)-2-(1-(4-хлорбензил)-1 Ниндол-3-ил)-2-оксоацетамида (0,27 г). Тпл = 253-255 С. 1 Н-ЯМР (ДМСО-d6, млн-1): 5.13 (s, 2H); 5.65 (s, 2H); 6.05 (s, 1H); 7.25-7.50 (m, 6 Н); 7.65(m, 1 Н); 8.30 (m, 1 Н); 9.05 (s, 1H); 11.90 (s, 1H). Элементный анализ для формулыC21H15ClN2O4: вычислено, %: С = 63,89, Н = 3,83, N = 7,10, Cl = 8,98; обнаружено, %: С = 63,65, Н = 4,02, N = 6,89, Cl = 9,13. Пример 3. N-(5-оксо-2,5-дигидрофуран-3 ил)-2-(1-(4-фторбензил)-1 Н-индол-3-ил)-2-оксоацетамид. Раствор 1-(4-фторбензил)-1 Н-индола (0,50 г) в безводном этиловом эфире (5 мл) добавляют по каплям к перемешиваемому охлажденному до 0 С раствору оксалилхлорида (0,209 мл) в безводном этиловом эфире (5 мл). Реакционную смесь оставляют при комнатной температуре на 2 ч, затем упаривают досуха, полученный остаток повторно растворяют в безводном тетрагидрофуране (5 мл) и этот раствор добавляют по каплям к раствору 4-амино-5 Н-фуран-2-она(0,45 г) в безводном тетрагидрофуране (22 мл). После чего смесь кипятят с обратным холодильником в течение 3 ч и выдерживают при комнатной температуре в течение ночи. Реакционную смесь вливают в воду (300 мл), и полученную суспензию перемешивают в течение 1 ч. Твердый осадок отфильтровывают, ресуспендируют в горячем метаноле (20 мл) при перемешивании в течение 30 мин и выдерживают при комнатной температуре в течение 2 ч. После фильтрования получают N-(5-оксо-2,5-дигидрофуран-3-ил)-2-(1-(4-фторбензил)-1 Н-индол-3 ил)-2-оксоацетамид (0,35 г). Тпл = 260-262 С. 1 Н-ЯМР (ДМСО-d6, млн-1): 5.15 (s, 2H); 5.65 (s, 2H); 6.05 (s, 1H); 7.10-7.25 (m, 1 Н); 7.257.50 (2m, 4+1 Н); 7.65 (m, 1 Н); 8.30 (m, 1 Н); 9.1(s, 1H); 11.90 (s, 1H). Элементный анализ для формулы 16 1 Н-ЯМР (ДМСО-d6, млн-1): 5.13 (s, 2H); 5.65 (s, 2H); 6.05 (s, 1H); 7.40 (m, 5 Н); 7.65 (d,1H); 8.23 (s, 1H); 9.12 (s, 1H); 11.87 (s, 1H). Элементный анализ для формулыN-(5-оксо-2,5-дигидрофуран-3-ил)-2-(6 хлор-1-(4-хлорбензил)-1 Н-индол-3-ил)-2-оксоацетамид; Тпл = 255-257 С (из смеси этилацетат/Еt2 О); 1 Н-ЯМР (ДMCO-d6, млн"1): 5.13 (s, 2H); 5.68 (s, 2H); 6.05 (s, 1H); 7.35 (m, 5 Н); 7.80 (s,1H); 8.23 (d, 1H); 9.10 (s, 1H); 11.87 (s, 1H). Элементный анализ для формулы(m, 1 Н); 11.98 (s, 1 Н). Элементный анализ для формулыN-(5-оксо-2,5-дигидрофуран-3-ил)-2-(1-(4 хлорбензил)-5-нитро-1 Н-индол-3-ил)-2-оксоацетамид; Тпл = 248-250C (из метанола); Элементный анализ для формулыN-(5-оксо-2,5-дигидрофуран-3-ил)-2-(1-(4 хлорбензил)-6-фтор-1 Н-индол-3-ил)-2-оксоацетамид; Тпл = 242-245 С (из метанола); Элементный анализ для формулы 17 Элементный анализ для формулыN-(5-оксо-2,5-дигидрофуран-3-ил)-2-(1-(4 хлорбензил)-5-метокси-1 Н-индол-3-ил)-2-оксоацетамид; Тпл = 238-240 С (из метанола и этилацетата); 1 Н-ЯМР (ДМСО-d6, млн-1): 3.80 (s, 3H); 5.13 (s, 2H); 5.65 (s, 2H); 6.05 (s, 1 Н); 6.95 (m,1 Н); 7.30-7.55 (m, 5 Н); 7.80 (m, 1 Н); 9.00 (s, 1H); 11.90 (s, 1H). Элементный анализ для формулыN-(5-оксо-2,5-дигидрофуран-3-ил)-2-(1-(3 хлорбензил)-1 Н-индол-3-ил)-2-оксо-ацетамид; Тпл = 268-270 С (из метанола); Элементный анализ для формулы(s, 1 Н). Элементный анализ для формулы(s, 1 Н); 8.35 (m, 1 Н); 11.85 (s, 1H). Элементный анализ для формулыN-(5-оксо-2,5-дигидрофуран-3-ил)-2-(1 бензил-1 Н-индол-3-ил)-2-оксоацетамид; Тпл = 275-277 С (из метанола); 1 Н-ЯМР (ДМСO-d6, млн-1): 5.10 (s, 2H); 5.85 (s, 2H); 6.05 (s, 1H); 7.30 (m, 7 Н); 7.60 (m,1H); 8.25 (m, 1H); 9.05 (s, 1H); 11.90 (s, 1H). Элементный анализ для формулыN-(5-оксо-2,5-дигидрофуран-3-ил)-2-(1-(4 пиридилметил)-6-хлор-1 Н-индол-3-ил)-2-оксоацетамид; 2-[1-(4-цианобензил)-1 Н-индол-3-ил]-2 оксо-N-(5-оксо-2,5-дигидро-3-фуранил)ацетамид, Тпл 260 С; 2-[6-бром-1-(4-хлорбензил)-1 Н-индол-3 ил]-2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил) ацетамид, Тпл = 268-270 С; 1-(4-хлорбензил)-3-оксо[(5-оксо-2,5-дигидро-3-фуранил)амино]ацетил-1 Н-индол-6 карбоновая кислота, Тпл 300 С (получена взаимодействием соответствующего 6-метоксикарбонильного производного с тремя мольэквивалентами 1 н NaOH в 1-метил-2-пирролидиноне при комнатной температуре в течение 26 ночи с последующим подкислением концентрированной HCl до рН = 1); 2-1-[(3,5-диметил-4-изоксазолил)метил]1 Н-индол-3-ил-2-оксо-N-(5-оксо-2,5-дигидро 3-фуранил)ацетамид, Тпл = 295-297 С; 2-[1-(3-нитробензил)-1 Н-индол-3-ил]-2 оксо-N-(5-оксо-2,5-дигидро-3-фуранил)ацетамид, Тпл = 257-260 С; 2-[1-(2,5-дифторбензил)-1 Н-индол-3-ил]-2 оксо-N-(5-оксо-2,5-дигидро-3-фуранил)ацетамид, Тпл = 272-275 сС; 2-[1-(5-хлор-2-фторбензил)-1 Н-индол-3 ил]-2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил) ацетамид, Тпл = 285-287 С; 2-[1-(4-трет-бутилбензил)-1 Н-индол-3-ил]2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил)ацетамид, Тпл = 218-220 С; этил-4-[(-3-оксо[(5-оксо-2,5-дигидро-3 фуранил)амино]ацетил-1 Н-индол-1-ил)метил] бензоат, Тпл = 158-160 С; 2-[1-(4-хлорбензил)-7-фтор-1 Н-индол-3 ил]-2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил) ацетамид, Тпл = 260-263 С; этил-4-[(-3-оксо[(5-оксо-2,5-дигидро-3 фуранил)амино]ацетил-1 Н-индол-1-ил)метил] фенилацетат, Тпл = 228-230 С; 2-(1-4-[2-(диметиламино)-2-оксоэтил]бензил-1 Н-индол-3-ил)-2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил)ацетамид, Тпл = 228-229 С; бензил-4-[(-3-оксо[(5-оксо-2,5-дигидро 3-фуранил)амино]ацетил-1 Н-индол-1-ил)метил]фенилацетат, Тпл = 204-205 С; 2-[1-(4-метил-3-нитробензил)-1 Н-индол-3 ил]-2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил) ацетамид, Тпл = 238-240C; трет-бутиловый эфир 4-[3-(5-оксо-2,5 дигидрофуран-3-иламинооксалил)-индол-1-илметил]фенилуксусной кислоты, Тпл = 195198 С; трет-бутиловый эфир 1-(4-хлорбензил)-3(5-оксо-2,5-дигидрофуран-3-иламинооксалил)1 Н-индол-4-карбоновой кислоты, Тпл = 278 С; 2-1-[4-(бензилокси)бензил]-1 Н-индол-3 ил-2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил) ацетамид, Тпл = 258-260 С; 2-[1-(4-хлорбензил)-4-циано-1 Н-индол-3 ил]-2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил) ацетамид, Тпл 250 С; трет-бутиловый эфир (2 Е)-3-(1-(4-хлорбензил)-3-оксо[(5-оксо-2,5-дигидро-3-фуранил) амино]ацетил-1 Н-индол-4-ил)-2-пропеновой кислоты, Тпл = 240-242 С; 2-[4-[(аллилокси)метил]-1-(4-хлорбензил)1 Н-индол-3-ил]-2-оксо-N-(5-оксо-2,5-дигидро-3 фуранил)ацетамид, Тпл = 157-160 С; Пример 5. 2-[1-(4-Хлорбензил)-1 Н-индол 3-ил]-2-оксо-N(5-оксо-2,5-дигидро-3-тиенил) ацетамид. Суспензию 4-амино-5 Н-тиофен-2-она (103 мг)(138 мг) и 2-(1-(4-хлорбензил)-1 Н-индол-3-ил)-2 оксоацетилхлорида (334 мг) (пример 1) в 1,2 27 диметоксиэтане (5 мл) перемешивают при комнатной температуре в течение 2 ч. После этого реакционную смесь выливают в воду (50 мл), полученный твердый осадок отфильтровывают и тщательно промывают водой. Ещ влажное твердое вещество суспендируют в метаноле, перемешивают в течение 30 мин, отфильтровывают и сушат в вакууме при 40 С с получением 2-[1-(4-хлорбензил)-1 Н-индол 3-ил]-2-оксо-N-(5-оксо-2,5-дигидро-3-тиенил)ацетамид (280 мг). Тпл = 268-270 С. 1 Н-ЯМР (ДМСО-d6, млн-1): 4.49 (s, 2H); 5.65 (s, 2H); 6.75 (s, 1H); 7.34 (m, 2 Н); 7.35 (m,2 Н); 7.43 (m, 2 Н); 7.63 (m, 1 Н); 8.25 (m, 1 Н); 9.07 (s, 1H); 11.70 (s, 1 Н). Элементный анализ для формулыC21H15ClN2O3S: вычислено, %: С = 61,39, Н = 3,68, N = 6,82, Cl = 8,63, S = 7,80; найдено, %: С = 61,26, Н = 3,70, N = 6,75,Cl = 8,56, S = 7,72. Аналогичным путем получают следующее соединение: 2-[1-(4-фторбензил)-1 Н-индол-3-ил]-2-оксо-N-(5-оксо-2,5-дигидро-3-тиенил)ацетамид,Тпл = 248-250 С; Пример 6. 2-[1-(4-Хлорбензил)-1 Н-индол 3-ил]-N-метил-2-оксо-N-(5-оксо-2,5-дигидро-3 фуранил)ацетамид В атмосфере азота к раствору 2-[1-(4 хлорбензил)-1 Н-индол-3-ил]-2-оксо-N-(5-оксо 2,5-дигидро-3-фуранил)ацетамида (100 мг) в безводном ДМФ (2 мл) добавляют гидрид натрия (10 мг 60%-ной (по массе) суспензии в минеральном масле). Через 20 мин добавляют метилиодид (0,016 мл). Через 3 ч растворитель удаляют на роторном испарителе, и полученный остаток распределяют между водой и этилацетатом. Органический слой сушат над сульфатом натрия и концентрируют досуха. Полученный остаток суспендируют в кипящей смеси СН 3 ОН/i-PrOH 1/1. После охлаждения до комнатной температуры нерастворимый материал отфильтровывают и сушат в печи при 60 С в течение 3 ч с получением 2-[1-(4-хлорбензил)1 Н-индол-3-ил]-N-метил-2-оксо-N-(5-оксо-2,5 дигидро-3-фуранил)ацетамид (52 мг). Тпл = 205-208 С. 1 Н-ЯМР (ДМСО-d6, млн-1): 3.27 (s, 3H); 5.44 (s, 2H); 5.56 (s, 2H); 5.87 (s, 1 Н); 7.25-7.47(m, 6 Н); 7.55-7.69 (m, 1 Н); 8.09-8.22 (m, 1 Н); 8.64 (s, 1H). Элементный анализ для формулы 28 ил)метил]фенилацетата (300 мг) в ДМФ (10 мл) гидрируют при комнатной температуре и давлении в присутствии 10%-ного палладия на угле (60 мг 50%-ной (по массе) суспензии в воде). Через 3 ч 30 мин катализатор отфильтровывают и фильтрат концентрируют досуха. Полученный остаток суспендируют в абсолютном этаноле и отфильтровывают с получением 4[(3-оксо[(5-оксо-2,5-дигидро-3-фуранил)амино] ацетил-1 Н-индол-1-ил)метил]фенилуксусную кислоту (160 мг). Тпл 270 С. 1 Н-ЯМР (ДМСО-d6, млн-1): 3.55 (s, 2H); 5.13 (s, 2H); 5.60 (s, 2H); 6.05 (s, 1 Н); 7.20-7.40(m, 6 Н); 7.65 (m, 1 Н); 8.30 (m, 1 Н); 9.05 (s, 1H); 11.88 (br. s, 1H); 12.25 (br.s, 1H). Элементный анализ для формулыC23H18N2O6: вычислено, %: С = 66,02, Н = 4,34, N = 6,70; найдено, %: С = 65,99, Н = 4,39, N = 6,68. Применяя аналогичную процедуру, следующее соединение получают каталитическим гидрированием 2-1-[4-(бензилокси)бензил]-1 Ниндол-3-ил-2-оксо-N-(5-оксо-2,5-дигидро-3-фуранил)ацетамида: 2-[1-(4-гидроксибензил)-1 Н-индол-3-ил]-2 оксо-N-(5-оксо-2,5-дигидро-3-фуранил)ацетамид, Тпл = 303-305 С. Пример 8. 1-(4-Хлорбензил)-3-(5-оксо-2,5 дигидрофуран-3-иламинооксалил)-1 Н-индол-4 карбоновая кислота. К раствору трет-бутилового эфира 1-(4 хлорбензил)-3-(5-оксо-2,5-дигидрофуран-3 иламинооксалил)-1 Н-индол-4-карбоновой кислоты (200 мг) в CH2Cl2 добавляют трифторуксусную кислоту (0,2 мл) и перемешивают при комнатной температуре в течение 4 ч. Затем добавляют дополнительное количество трифторуксусной кислоты (0,2 мл), и реакционную смесь перемешивают в течение ночи. После упаривания на роторном испарителе полученный остаток суспендируют в этилацетате при перемешивании и отфильтровывают твердое вещество с получением 1-(4-хлорбензил)-3-(5 оксо-2,5-дигидрофуран-3-иламинооксалил)-1 Ниндол-4-карбоновую кислоту (120 мг). Тпл = 279 С. Элементный анализ для формулыC22H15ClN2O6: вычислено, %: С = 66,21, Н = 3,45, N = 6,38, Cl = 8,08; найдено, %: С = 59,51, Н = 3,47, N = 6,22,Cl = 7,88. Используя аналогичную процедуру, получают следующее соединение, применяя в качестве исходного соединения трет-бутиловый эфир (2 Е)-3-(1-(4-хлорбензил)-3-оксо[(5-оксо 2,5-дигидро-3-фуранил)амино]ацетил-1 Н-индол-4-ил)-2-пропеновой кислоты:(2 Е)-3-(1-(4-хлорбензил)-3-оксо[(5-оксо 2,5-дигидро-3-фуранил)амино]ацетил-1 Н-индол-4-ил)-2-пропеновая кислота, Тпл 250 С. Пример 9. 1-(4-Хлорбензил)-N-[2-(диметиламино)этил]-3-оксо[(5-оксо-2,5-дигидро-3-фуранил)амино]ацетил-1 Н-индол-4-карбоксамид. К перемешиваемому раствору 1-(4-хлорбензил)-3-(5-оксо-2,5-дигидрофуран-3-иламинооксалил)-1 Н-индол-4-карбоновой кислоты (50 мг) и N,N-диметилэтилендиамина (0,014 мл) в безводном ДМФ (1 мл) в атмосфере азота добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (44 мг). После перемешивания при комнатной температуре в течение 4 ч реакционную смесь концентрируют досуха на роторном испарителе, и остаток смешивают с водой. Твердое вещество отфильтровывают и тщательно промывают водой с получением 1-(4 хлорбензил)-N-[2-(диметиламино)этил]-3-оксо[(5-оксо-2,5-дигидро-3-фуранил)амино]ацетил 1 Н-индол-4-карбоксамид (49 мг). Тпл = 225-227C. Элементный анализ для формулыC26H25ClN4O5: вычислено, %: С = 61,36, Н = 4,95, N = 11,01, Cl = 6,97; найдено, %: С = 61,28, Н = 5,02, N = 11,02,Cl = 6,90. Применяя аналогичную процедуру, получают следующие соединения путем взаимодействия 1-(4-хлорбензил)-3-(5-оксо-2,5-дигидрофуран-3-иламинооксалил)-1 Н-индол-4-карбоновой кислоты с N-(трет-бутоксикарбонил)этилендиамином или диэтиламином: трет-бутил 2-[(1-(4-хлорбензил)-3-оксо(пример 9) в CH2Cl2 (1 мл) добавляют трифторуксусную кислоту (0,1 мл). После перемешивания при комнатной температуре в течение 3 ч растворитель удаляют на роторном испарителе,а остаток смешивают с водой, корректируя рН примерно до 8-9 с помощью 1 н NaOH. Осадок отфильтровывают и тщательно промывают с получением N-(2-аминоэтил)-1-(4-хлорбензил)3-оксо[(5-оксо-2,5-дигидро-3-фуранил)амино] ацетил-1 Н-индол-4-карбоксамид (25 мг). Тпл=190-196 С. Пример 11. 2-[1-(4-Хлорбензил)-4-(гидроксиметил)-1 Н-индол-3-ил]-2-оксо-N-(5-оксо-2,5 дигидро-3-фуранил)ацетамид. 30 2-[4-[(аллилокси)метил]-1-(4-хлорбензил)1 Н-индол-3-ил]-2-оксо-N-(5-оксо-2,5-дигидро-3 фуранил)ацетамид (239 мг) растворяют в смеси СН 3 ОН/Н 2 О=9/1 (10 мл), и затем добавляют 10%-ный Pd/C (12 мг) и паратолуолсульфокислоту (12 мг). Реакционную смесь кипятят с обратным холодильником примерно в течение 6 ч,затем разбавляют ДМФ и С 2 Н 5 ОН, катализатор отфильтровывают через целит и растворитель удаляют при пониженном давлении. Сырой продукт промывают ацетоном и отфильтровывают. Фильтрат концентрируют, и полученное твердое вещество очищают хроматографией на силикагеле (элюент: СН 2 Сl2/С 2 Н 5 ОН=95/5) с получением чистого 2-[1-(4-хлорбензил)-4(гидроксиметил)-1 Н-индол-3-ил]-2-оксо-N-(5 оксо-2,5-дигидро-3-фуранил)ацетамид (50 мг). Твердое вещество кристаллизуют из CH3CN с получением 63 мг соединения с Тпл = 238-240 С. 1 Н-ЯМР (ДМСО-d6, млн-1): 11.78 (bs, 1 Н); 8.89 (s, 1 Н); 7.49-7.29 (м, 7 Н); 6.02 (s, 1H); 5.63(s, 2H); 5.15 (s, 2H); 5.10 (d, 2H, J 6.0 Гц); 4.89 (t,1H, J 6.0 Гц). Пример 12. Оценка противоопухолевого эффекта соединений по изобретению. Соединения по изобретению были фармакологически протестированы в отношении четырех линий опухолевых клеток человека: НТ 29 (карцинома толстой кишки), PC 3 (карцинома предстательной железы), Н 460 М (карцинома легких), MKN45 (карцинома желудка). Клетки инкубировали с тестируемыми соединениями в течение 144 ч, затем определяли цитотоксичность, используя МТТ (3-(4,5-диметилтиазол-2 ил)-2,5-дифенилтетразолия бромид) анализLymphokines", J. Immunol. Methods, (1984),70,257-268). Полученные данные показали, что соединения по настоящему изобретению обладают заметной активностью в отношении твердых опухолей, в частности против опухоли толстой кишки и опухоли легких. Цитотоксическая активность представленных соединений по изобретению в отношении опухолевых линий человека НТ 29: аденокарцинома толстой кишки человека РСЗ: карцинома предстательной железы человека Н 460 М: карцинома легких человека где R1, R2 и R5 независимо представляют собой водород или С 1-С 6 алкильную группу;R4 представляет собой водород, прямой или разветвленный С 1-С 8 алкил,С 5 С 6 циклоалкил; аралкил; гетероаралкил;X представляет собой одну или более чем одну группу, максимально четыре, независимо выбранную из водорода; С 1-С 6 алкила; С 1 С 6 галогеналкила; С 1-С 6 гидроксиалкила; С 1 С 6 аминоалкила; С 1-С 6 алкокси-С 1-С 6 алкила; С 1-С 18 ацилокси-С 1-С 6 алкила; гидрокси; С 1 С 4 алкокси; С 1-С 3 галогеналкокси; фенокси; аралкокси; С 1-С 3 ацилокси; амино; С 1-С 3 алкиламино; С 1-С 3 ациламино; С 1-С 3 алкилсульфониламино; ароиламино; галогена; нитро; циано; трифторметила; карбокси; С 1-С 6 алкоксикарбонила; группы RaRbN(CH2)nC(=O)-, где Ra иRb независимо представляют собой водород,С 1-С 3 алкил или Ra и Rb вместе с атомом азота,к которому они присоединены, образуют пирролидиновое, пиперидиновое, пиперазиновое или морфолиновое кольцо и n=0 или целому числу от 1 до 4; группы RaRcN(CH2)nC(=O)-, гдеR6 представляет собой гидрокси, С 1-С 6 алкокси,NRaRb или группу формулы RaRbN(CH2)mNR1-,где m равно целому числу от 2 до 4 и R1, R2, Ra и Rb такие, как определено выше;Y представляет собой атом кислорода или серы, их изомеры, энантиомеры и их смеси, и их фармацевтически приемлемые соли. 2. Соединения по п.1, где Y представляет собой атом кислорода. 3. Соединения по п.1, где Y представляет собой атом серы. 4. Соединения по пп.1, 2 или 3, где R1, R2 и R3 представляют собой водород или метил. 5. Соединения по любому из пп.1-4, где R4 представляет собой водород; метил; бензил,замещенный по бензольному кольцу одной или более чем одной группой, выбранной из метила,трет-бутила, фтора, хлора, брома, гидрокси,ацетокси, метокси, трифторметокси, бензилокси, трифторметила, циано, нитро, амино, ацетиламино, метилсульфониламино, метилмеркапто,метилсульфинила, метилсульфонила, фенила,этоксикарбонила, карбокси, карбоксиметила,(этоксикарбонил)метила, (трет-бутоксикарбонил)метила, (бензилоксикарбонил)метила, (диметилкарбамоил)метила; -нафтил, -нафтил; 4 пиридил; 4-пиридил-N-оксид. 6. Соединения по любому из пп.1-5, где X представляет собой метил, этил, фтор, хлор,бром, гидрокси, ацетокси, метокси, фенокси,трифторметокси, трифторметил, циано, нитро,амино, ацетиламино, метилсульфониламино,метилмеркапто, метилсульфинил, метилсульфонил, карбокси, метоксикарбонил, трет-бутоксикарбонил, диэтилкарбамоил, (2-аминоэтил) карбамоил,(2-диметиламиноэтил)карбамоил,(Е)- и (Z)-2-карбоксиэтен-1-ил, (Е)- и (Z)-(2 трет-бутоксикарбонил)этен-1-ил, (Е)- и (Z)(этоксикарбонил)этенил, гидроксиметил и аллилоксиметил. 7. Фармацевтические композиции, содержащие соединение по пп.1-6 в смеси с приемлемым носителем. 8. Применение соединений по пп.1-6 для приготовления лекарств для лечения опухолей.
МПК / Метки
МПК: C07D 405/12, A61P 35/00, A61K 31/404
Метки: обладающие, противоопухолевой, 2-(1h-индол-3-ил)-2-оксоацетамиды, активностью
Код ссылки
<a href="https://eas.patents.su/17-4925-2-1h-indol-3-il-2-oksoacetamidy-obladayushhie-protivoopuholevojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">2-(1h-индол-3-ил)-2-оксоацетамиды, обладающие противоопухолевой активностью</a>





















