Сложные эфиры (+)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола и их использование в качестве пролекарств антагониста mdl 110907 5ht2a рецепторов
Номер патента: 3667
Опубликовано: 28.08.2003
Авторы: Карр Альберт А., Ван Хейфте Люк Е., Косли Рэймонд В.Мл.
Формула / Реферат
1. Соединение формулы I
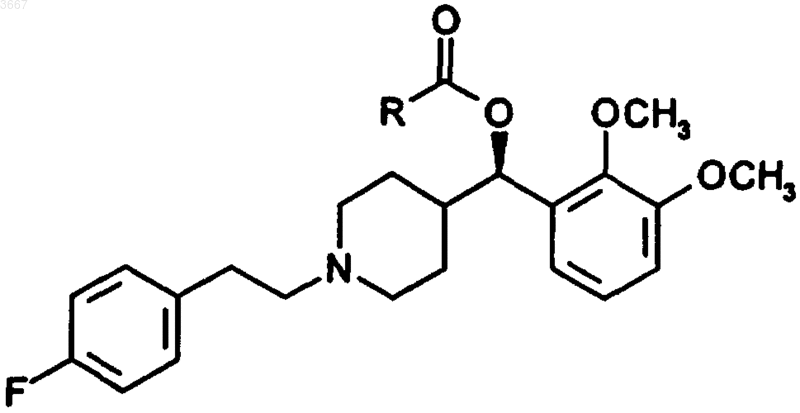
Формула I
где R представляет собой C4-C20алкил,
или его стереоизомер, или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором R представляет собой C5-C20алкил с неразветвленной цепью.
3. Соединение по п.1, выбранное из группы, включающей
(+)-a-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанолдеканоат;
(+)-a-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанолгексаноат;
(+)-a-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанолоктаноат;
(+)-a-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанолгексадеканоат;
(+)-a-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанол-2,2-диметилоктаноат.
4. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый носитель.
5. Фармацевтическая композиция по п.4, где R представляет собой C9-алкил с неразветвленной цепью и в которой фармацевтически приемлемый носитель представляет собой фармацевтически приемлемое масло, выбранное из группы, включающей кунжутное, оливковое, арахисовое, кукурузное, миндальное, хлопковое масло, масло земляного ореха и касторовое масло.
6. Фармацевтическая композиция по п.5, где масло представляет собой кунжутное масло.
7. Способ ингибирования действия серотонина на 5HT2a-рецептор, включающий введение терапевтически эффективного количества соединения по п.1 пациенту, который в этом нуждается.
8. Способ по п.7, где R представляет C9-алкил с неразветвленной цепью.
9. Способ по п.7, в котором соединение вводят внутримышечно или подкожно.
10. Способ по п.7, в котором соединение вводят внутримышечно и ингибирование действия серотонина на 5HT2a-рецептор продолжается от примерно 2 недель до примерно 1 месяца.
11. Способ лечения пациента, страдающего от одного или более заболеваний, выбранных из группы, включающей психическое расстройство, шизофрению, биполярную депрессию, депрессию, состояние тревоги, навязчивое компульсивное расстройство, привыкание к наркотикам, коронарный вазоспазм, стенокардию и заболевания, связанные с образованием тромбов, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1.
12. Способ по п.11, где R представляет C9-алкил с неразветвленной цепью.
13. Способ по п.11, в котором соединение вводят внутримышечно или подкожно.
14. Способ по п.11, в котором соединение вводят внутримышечно и пациента лечат от примерно 2 недель до примерно 1 месяца.
15. Способ получения соединения формулы I
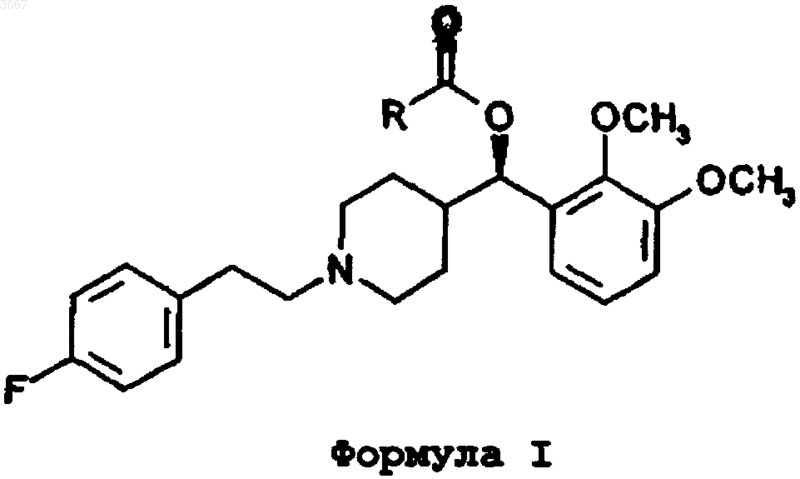
где R представляет собой C4-C20алкил,
или его стереоизомера, или его фармацевтически приемлемой соли,
включающий взаимодействие спирта (5)

с галогенангидридом кислоты формулы RC(O)X, ангидридом кислоты формулы (RCO)2O или карбоновой кислотой формулы RCO2H, где R имеет значение, определенное выше и X представляет собой хлор или бром, в присутствии достаточного количества подходящего основания для получения соединения формулы I.
16. Способ по п.15, в котором X представляет собой хлор и R представляет собой алкил с неразветвленной цепью.
17. Способ по п.15, где R представляет собой C9-алкил с неразветвленной или разветвленной цепью и основание представляет собой триэтиламин.
18. Способ по п.15, в котором спирт (5) реагирует с RCOX, где R представляет собой C9-алкил с неразветвленной цепью и X представляет собой хлор.
19. Применение соединения по п.1 в качестве фармацевтически активного вещества.
Текст
1 Соединение (+)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанол, также известное как MDL 100907, является мощным антагонистом рецептора 5HT2a, которое проходит клинические испытания для лечения шизофрении. J. Pharm. Exp. Ther. 277: 9689881 (1996), включено в настоящее описание в качестве ссылки. Указанное соединение описано в патенте США 5134149, включенном в настоящее описание в качестве ссылки.MDL 100907 ингибирует действие серотонина на 5 НТ 2 а рецептор, и вследствие этого пригоден для лечения различных расстройств. Однако это соединение может также действовать непосредственно или косвенно, вызывая при этом терапевтические эффекты, отличные от антагонизма 5 НТ 2 а. Например, в European Journal of Pharmacology 273: 273-279 (1995) показано, что MDL 100907 вызывает тонизирующее ингибирующее воздействие на отток допамина в медиальный префронтальный участок коры головного мозга. Некоторые применения MDL 100907 раскрыты в патентах или патентных заявках. В патенте США 5169096 заявленные соединения имеют общую формулу,которая охватывает M100907 и раскрыто применение для лечения нервно-психической анорексии,вариантной стенокардии, синдрома Рэйнауда, коронарного вазоспазма, профилактического лечения мигрени, сердечно-сосудистых расстройств,таких как гипертензия, периферических сосудистых заболеваний, тромботических эпизодов, кардиолегочных обострении и аритмий, и анестезирующие свойства. См. также патенты США 4783471; 4912117 и 5021428, которые являются выделенными из патента США 5169096. См. также патенты США 4877798 (фибромиалгия),4908369 (бессонница), 5106855 (глаукома), ЕР 319962 (состояние тревоги), ЕР 337136 (экстрапирамидальная симптоматика), все они включены в настоящее описание в качестве ссылки. М 100907 был затем отдельно заявлен в патенте США 5134149, в котором заявлено применение для ингибирования действия серотонина на 5Ht2 рецепторы, лечение состояния тревоги, вариантной стенокардии, нервнопсихической анорексии, синдрома Рэйнауда,перемежающейся хромоты, коронарного или периферического вазоспазма, фибромиалгии,экстрапирамидальной симптоматики, аритмии,заболеваний, связанных с тромбозом, транзиторных ишемических атак, зависимости от наркотиков, психических заболеваний, таких как шизофрения и мания. См. также патенты США 5561144; 5700812; 5700813; 5721249, выделенные из патента США 5139149, и также патент США 5618824 (навязчивое компульсивное расстройство) и PCT/US/02597 (депрессивные расстройства, включающие основной депрессивный эпизод и дистимию, а также биполярные расстройства), бессонницу и приступы апноэ во сне. 2 Целью настоящего изобретения является получение нового соединения, которое после введения высвобождает терапевтически эффективное количество MDL 100907 в течение продолжительного периода времени. Продолжительный период времени означает время большее, чем действие единичной дозы MDL 100907, и может продолжаться в течение нескольких дней, нескольких недель, около одного месяца и вплоть до примерно от 6 до примерно 8 недель, предпочтительно от около 2 недель до около 1 месяца. Имеется множество преимуществ при введении единичной дозы соединения пациенту,действие которой продолжается в течение продолжительного периода времени. Это позволяет избежать проблем, решение которых особенно важно для пациентов, страдающих от психических расстройств или имеющего поведенческие реакции, которые относятся к шизофрении, навязчивому компульсивному расстройству, депрессии, состоянию тревоги, анорексии и зависимости от наркотиков. Другое преимущество включает отсутствие типичного колебания уровня лекарства в организме, которое имеет место при лечении с использованием многократного введения единичных доз, в результате чего пациент ощущает повышенную эффективность лечения при более низких концентрациях лекарственного средства. Хотя концепция приготовления лекарственных средств длительного высвобождения не является новой, не все соединения способны химически модифицироваться с получением при этом нового соединения, способного при метаболизме превращаться в активный ингредиент с необходимой скоростью и в течение необходимого периода времени. Другие факторы относятся к сложности получения композиции длительного высвобождения, поскольку связывание с белками и другие физиологические процессы могут оказывать влияние на терапевтическое действие активного ингредиента, см., например. Biochemical Pharmacology, Vol. 36,10, pp. 1715-1722 (1987), включено в настоящее описание в качестве ссылки. Таким образом, химически модифицированное соединение должно быть совместимым с фармацевтически приемлемым носителем и быть достаточно стабильным, чтобы существенно не разрушаться до превращения в активный ингредиент. Короче говоря, разработка технологии приготовления лекарственного средства длительного высвобождения представляет собой трудную задачу с непредсказуемым решением. Сущность изобретения Настоящее изобретение относится к соединению формулы I 3 где R представляет С 4-С 20 алкил, или к его стереоизомеру, или к его фармацевтически приемлемой соли. Настоящее изобретение также включает фармацевтическую композицию, включающую соединение формулы I и фармацевтически приемлемый носитель; способ игнибирования действия серотонина на 5 НТ 2 а рецептор, включающий введение соединения формулы I пациенту, который в этом нуждается; способ лечения болезненного состояния,включающий введение пациенту, который нуждается в таком лечении, терапевтически эффективного количества соединения формулы I,причем болезненное состояние представляет собой психические расстройства (включая шизофрению), навязчивое компульсивное расстройство, заболевания, связанные с тромбозом,коронарный вазоспазм, состояние тревоги,нервно-психическую анорексию, синдром Рэйнауда (Raynaud), фибромиалгию, экстрапирамидальные побочные эффекты, состояние тревоги,аритмию, депрессию, биполярную депрессию,бессонницу, приступы апноэ во сне, синдром Рэйнауда или зависимость от наркотиков; и способ получения соединений, включающий взаимодействие спирта структуры (5), приведенной ниже, с галогенангидридом, ангидридом кислоты или карбоновой кислотой в присутствии достаточного количества подходящего основания. Подробное описание изобретения Термины, используемые в настоящем описании, имеют следующее значение: а) Фармацевтически приемлемая соль означает или кислотно-аддитивную соль или основно-аддитивную соль основания, которые возможно получить для соединений, являющихся предметом настоящего изобретения. Фармацевтически приемлемая кислотноаддитивная соль включает любую нетоксичную аддитивную соль органической или неорганической кислоты и соединения основного характера,представленного формулой I. Примеры неорганических кислот, которые образуют подходящие соли, включают хлороводородную, бромоводородную, серную и фосфорную кислоты и кислые соли металлов, такие как моногидроортофосфат натрия и гидросульфат калия. Примеры органических кислот, которые образуют подходящие соли,включают моно-, ди- и трикарбоновые кислоты. Примерами таких кислот являются уксусная, гликолевая, молочная, пировиноградная, малоновая,янтарная, глутаровая, фумаровая, яблочная, щавелевая, лимонная, аскорбиновая, малеиновая, гидроксималеиновая, бензойная, гидроксибензойная,фенилуксусная, коричная, салициловая, 2 феноксибензойная, п-толуолсульфокислота и сульфоновые кислоты, такие как метансульфоновая кислота и 2-гидроксиэтансульфоновая кислота. Могут быть образованы соли моно-, или дикислот, и такие соли могут существовать или в 4 гидратированной форме, или, по существу, в безводной форме. В общем, кислотно-аддитивные соли указанных соединений более растворимы в воде и различных гидрофильных органических растворителях и которые по сравнению с соответствующими формами свободного основания,обычно, имеют более высокие температуры плавления. Фармацевтически приемлемые основноаддитивные соли включают нетоксичные аддитивные соли соединения формулы (I) или любого его промежуточного продукта с органическими или неорганическими основаниями. Примерами являются гидроксиды щелочных или щелочно-земельных металлов, таких как гидроксиды натрия, калия, кальция, магния или бария; аммиак, и алифатические, алициклические или ароматические органические амины,такие как метиламин, триметиламин и ликолин. Выбор подходящей соли может быть важным для того, чтобы сложный эфир не гидролизовался. Критерии выбора подходящей соли хорошо известны специалистам в данной области.b) Стереоизомеры представляют общий термин для всех изомеров индивидуальной молекулы, которые отличаются только по пространственной ориентации атомов молекулы. Этот термин включает изомеры зеркального отражения(цис/транс) изомеры и изомеры соединений с более чем одним хиральным центром, которые не являются зеркальным отображением друг друга (диастереомеры).c) Алкил означает разветвленную или линейную алкильную группу, имеющую определенное количество атомов углерода в алкильной группе, например, С 4-С 20 алкил означает линейную или разветвленную алкильную группу, содержащую четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать,тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать или двадцать атомов углерода или любые их интервалы С 5-С 20, C1-C15, C3-C15, C5-C15 и С 7-С 9,но не ограничивается.d) Пациент означает теплокровное животное, например, такое, как крыса, мыши, собаки, кошки, морские свинки, приматы, такие как люди.e) Термины лечить и лечение означают смягчать симптомы, устранять причину симптомов либо кратковременно, либо совсем, или предупреждать или ослаблять проявление симптомов указанных заболеваний или состояний.f) Терапевтически эффективное количество означает количество соединения, эффективное для лечения указанных заболеваний или состояний.g) Фармацевтически приемлемый носитель означает нетоксичный растворитель, диспергатор,наполнитель, адъювант или другой материал, который смешивают с соединением, являющимся пред 5 метом настоящего изобретения, для того чтобы обеспечить получение фармацевтической композиции, а именно дозированной формы, пригодной для введения пациенту. Одним из примеров таких носителей является фармацевтически приемлемое масло, обычно используемое для парентерального введения.h) Термин восстанавливающий сон означает сон, который обеспечивает отдохнувшее состояние при пробуждении.i) Термин нарушение сна означает бессонницу и обструктивные приступы апноэ во сне.j) Термин бессонница означает первичную бессонницу и бессонницу, связанную с другими психическими расстройствами, и бессонницу, вызванную действием каких-либо веществ.k) Термин первичная бессонница означает трудности засыпания, сохранения сна или достижения восстанавливающего сна, которые не вызваны психическим расстройством или физиологическим воздействием, обусловленным принятием или отменой каких-либо определенных веществ (вызываемая веществами). При использовании в настоящем описании этот термин также включает бессонницу, связанную с нарушением циркадного ритма, которая означает бессонницу вследствие изменения нормального режима засыпания и пробужденияl) Термин бессонница, связанная с другими психическими расстройствами означает трудности засыпания, сохранения сна или достижения восстанавливающего сна, которые вызваны основными психическими расстройствами, такими как депрессия, состояние тревоги,шизофрения.m) Термин бессонница, вызванная действием веществ означает трудности засыпания,сохранения сна или достижения восстанавливающего сна, которые вызваны физиологическим воздействием, обусловленным принятием или отменой каких-либо определенных веществ,таких как кофеин, алкоголь, амфетамин, опиоиды, седативные средства, снотворные средства и транквилизаторы.n) Термин обструктивные приступы апноэ во сне означает повторяющиеся случаи,связанные с обструкцией верхних дыхательных путей во время сна и обычно характеризуется громким храпом или кратковременными затруднениями дыхания, которые чередуются с эпизодами тишины.(+)-Изомер -(2,3-диметоксифенил)-1-[2(4-фторфенил)этил]-4-пиперидинметанола может быть получен по методам, описанным в патенте США 5134149. Один из подходящих методов приведен ниже. На стадии А схемы I реакцию этерификации проводят между рацемическим альфа-(2,3 диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанолом (структура 1) и (+)-изомером альфа-метоксифенилуксусной кислоты (структура 2). Такая этерификация дает смесь диастереомеров, обозначенную как структура 3. Указанные диастереомеры подвергают хроматографии на силикагеле, которая позволяет разделить два диастереомера и выделить при этом (+,+)диастереомер, как показано на стадии В. На стадии С (+,+)-диастереомер гидролизуют, что приводит к получению (+)-изомера альфа-(2,3 диметоксифенил)-1-[2-(4-фторфенил)этил]-4 пиперидинметанола. Реакцию этерификации можно проводить,используя методики, известные в данной области техники. Обычно примерно эквивалентные количества рацемического альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола и (+)-изомера альфа-метоксифенилуксусной кислоты приводят в контакт в органическом растворителе, таком как метиленхлорид, ТГФ, хлороформ или толуол, и кипятят с обратным холодильником в течение времени,в интервале от 5 до 24 ч. Этерификацию обычно проводят в присутствии эквивалентного количества дициклогексилкарбодиимида (DCC) и каталитического количества 4-диметиламинопиридина (DMAP). Образовавшиеся диастереомеры могут быть выделены фильтрацией дициклогексилмочевины и упариванием фильтрата. 7 Диастереомеры затем подвергают хроматографии на силикагеле, которая позволяет разделить (+,+) и (-,+) диастереомеры. Хроматографическое разделение можно проводить по методикам, известным в данной области техники. Одним из подходящих элюентов является смесь гексана и этилацетата в соотношении 1:1. Полученный (+,+) диастереомер затем подвергают реакции гидролиза, которая приводит к получению (+)-энантиомера альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола. Гидролиз проводят, приводя в контакт диастереомер с избытком основания, такого как карбонат калия, в водном спиртовом растворе. Гидролиз проводят при температуре от около 15 до около 30 С в течение времени, в интервале от 2 до 24 ч. Полученный (+)-изомер альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола может быть затем выделен разбавлением водой и экстракцией метиленхлоридом. Затем полученное соединение очищают перекристаллизацией из системы растворителей, такой как циклогексан/гексан или этилацетат/гексан. Способы получения исходных соединений в соответствии со схемой реакций 1 известны в данной области техники. Например, в патенте США 4783471 сообщается о том, каким образом получают рацемический альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)-этил]-4-пиперидинметанол. Указанный патент включен в настоящее описание в качестве ссылки. В примерах 1 и 2 настоящей заявки также показаны подходящие способы. Альтернативно, рацемический альфа(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4 пиперидинметанол может быть получен следующим образом. Сначала 4-гидроксипиперидин подвергают реакции N-алкилирования с п-фторфенилэтилбромидом, что приводит к получению 4 гидрокси-1-[2-(4-фторфенил)этил]пиперидина. Данное соединение бромируют, используя Рh3 РВr2, и получают 4-бром-1-[2-(4-фторфенил) этил]пиперидин. Полученное соединение приводят во взаимодействие с Мg, с получением реактива Гриньяра, который затем реагирует с 2,3 диметоксибензальдегидом с образованием требуемого продукта - -альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола. (+)-Изомер альфа-метоксифенилуксусной кислоты известен в данной области техники. Схема II Формула I На схеме II Х означает хлор или бром,причем хлор является более предпочтительным, 003667 8 и R имеет значения, которые указаны выше. На данной схеме реакций показано, каким образом осуществляют непрерывное получение соединения формулы I из спирта (5). Спирт (5) взаимодействует с галогенангидридом (RC(O)X), RCO2H или ангидридом кислоты (RСО)2 О в присутствии достаточного количества подходящего основания. Подходящее основание представляет основание, в присутствии которого возможно образование сложного эфира из галогенангидрида или ангидрида кислоты. Примерами подходящих оснований являются триалкиламины, пиридин, такой как диметиламинопиридин, диизопропиламины, Nметилморфолины, причем предпочтительным является триэтиламин. Достаточное количество указанного основания может быть установлено специалистом в данной области, это количество,в присутствии которого возможно образование соединения формулы I. Предпочтительно основание добавляют к спирту (5) и полученную смесь добавляют по каплям к галогенангидриду или ангидриду кислоты в подходящем растворителе. Примерами подходящих растворителей являются хлороформ, метиленхлорид или толуол, все из них легко доступны, предпочтительным является хлороформ. Температура реакции может находиться в интервале примерно 0-25 С. Реакционную смесь можно перемешивать для улучшения прохождения реакции в течение от нескольких часов до в течение ночи. Для ускорения прохождения реакции может быть добавлен катализатор, например, 4-диметиламинопиридин или подобный. Исходные соединения для получения галогенангидрида (RCOX) легко доступны специалистам в данной области. Например, компания"Aldrich Chemical company" предоставляет стеароилхлорид, гептадеканоилхлорид, пальмитоилхлорид, миристиноилхлорид, изовалерилхлорид, валерилхлорид, гексаноилхлорид, гексаноилхлорид, гептаноилхлорид, октаноилхлорид,нонаноилхлорид, деканоилхлорид, ундеканоилхлорид или додеканоилхлорид. Что касается тех галогенангидридов, которые не являются легко доступными, то специалист в данной области может синтезировать требуемый галогенангидрид. Например, карбоновую кислоту можно смешать с галогенидным донором для получения необходимого галогенангидрида. Одним из примеров представляет смешение карбоновой кислоты (0,17 моль), метиленхлорида (660 мл) и диметилформамида (0,5 мл) в атмосфере азота. Затем добавляют оксалилхлорид (0,2 моль) в течение примерно 5 мин при перемешивании. Перемешивают при температуре окружающей среды в течение 3 ч и выпаривают растворитель в вакууме, получая галогенангидрид. Другой метод заключается в том, что растворяют карбоновую кислоту (10 ммоль) в метиленхлориде(50 мл). Охлаждают до 0 С, помещают в атмосферу азота и добавляют по каплям тионилхлорид (11 ммоль). Перемешивают при комнатной температуре в течение нескольких часов, выпаривают летучие продукты в вакууме и получают галогенангидрид. Карбоновые кислоты легко доступны или могут быть легко синтезированы специалистами в данной области. Исходные вещества для получения ангидридов кислот (RCO)2O легко доступны специалистам в данной области. Например, компания"Aldrich Chemical company" предоставляет бутановый ангидрид, изобутановый ангидрид, валериановый ангидрид, 2,2-диметилглутаровый ангидрид и фталевый ангидрид. Альтернативно,ангидриды кислот могут быть получены способами, хорошо известными в данной области. Исходные материалы для получения ангидридов кислот (RCO)2O легко доступны или могут быть получены способами, хорошо известными в данной области. Например, см. Advanced Organic Chemistry, Reactions, Mechanisms, and Structure, 4th ed., John WileySons,New York 1992, приведено в настоящем описании в качестве ссылки. Компания "AldrichChemical company" также предоставляет изовалериановую кислоту, валериановую кислоту,трет-бутилуксусную кислоту, 2,2-диметилбутановую кислоту, 2-этилбутановую кислоту,гексановую кислоту, 3-метилвалериановую кислоту, 4-метилвалериановую кислоту, гептановую кислоту, октановую кислоту, 2-пропилпентановую кислоту, нонановую кислоту, декановую кислоту, ундекановую кислоту, лауриновую кислоту, тридекановую кислоту, миристиловую кислоту, пентадекановую кислоту, пальмитиновую кислоту, гептадекановую кислоту,стеариновую кислоту, нонандекановую кислоту,эйкозановую кислоту, также как и другие кислоты, в которых радикал R включает от четырх до двадцати алкильных групп. Следующие примеры приведены для того,чтобы дополнительно проиллюстрировать изобретение. Однако они не должны рассматриваться как ограничивающие объем настоящего изобретения каким-либо образом. Пример 1. Исходные вещества. Пример 1, стадии A-D, показывает получение исходного вещества -альфа(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола, структура 1, схема I. А) 1-[2-(4-Фторфенил)этил]-4-пиперидинкарбоксамид. Готовят раствор гексагидроизоникотинамида (10,9 г, 85,0 ммоль), 2-(4-фторфенил)этилбромида (15,7 мг, 77,3 ммоль) и K2 СО 3(2,3 г, 167 ммоль) в ДМФ (280 мл) и перемешивают в атмосфере аргона при температуре 9095 С в течение ночи. Охлажднный раствор концентрируют до получения белого маслянистого твердого вещества. Вещество распределяют между водой и СН 2 Сl2. Слои разделяют, 003667 10 водный слой экстрагируют CH2Cl2. Объединeнные органические слои дважды промывают водой, высушивают (МgSO4), фильтруют и упаривают до получения маслянистого твeрдого вещества. Твeрдое вещество перекристаллизовывают из EtOAc и получают 1-[2-(4 фторфенил)этил]-4-пиперидинкарбоксамид в виде белого порошка, т.пл. 177-178 С (с разл.) Элементный анализ: вычислено для C14H19FN2O: С 67,18; Н 7,65; N 11,19. Найдено: С 67.25; Н 7,67; N 11,13.(5,1 г, 87,3 ммоль) порциями добавляют 1-[2-(4 фторфенил)этил]-4-пиперидинкарбоксамид (8,9 г, 35,6 ммоль). После добавления всего вещества раствор кипятят с обратным холодильником в течение 2 ч. Охлажденный раствор осторожно вливают в разбавленный NH4 ОH с целью разложения РОСl3. Водный раствор охлаждают до 0 С, после чего дважды экстрагируют CH2Cl2. Объединeнные органические слои сушат(MgSO4), фильтруют и упаривают, получая при этом 8,1 г маслянистого твeрдого вещества. Твeрдое вещество перегоняют (т.кип. 150 С, 0,1 мм рт.ст.) и получают прозрачное бесцветное масло, которое затвердевает. Данное вещество кристаллизуют из гексана и получают 4-циано 1-[2-(4-фторфенил)этил]пиперидин в виде белых игл, т.пл. 47-48 С. Элементный анализ, вычислено для C14H17FN2: С 72,39; Н 7,38; N 12,06. Найдено: С 72,62; Н 7,49; N 12,12.C) 1-[2-(4-Фторофенил)этил]-4-пиперидинкарбоксальдегид. К перемешиваемому раствору 4-циано-1[2-(4-фторофенил)этил]пиперидина (1,00 г, 4,3 ммоль) в ТГФ (20 мл) в атмосфере аргона при 0 С с помощью шприца добавляют гидрид диизобутилалюминия (DIBAL-H) (4,6 мл 1,0 М раствор в ТГФ, 4,6 ммоль). После перемешивания в течение ночи при комнатной температуре добавляют 10% водный раствор НСl (25 мл) и полученный раствор перемешивают в течение 3 ч. Затем всю смесь выливают в 10% водный раствор NaOH (50 мл), после чего дважды экстрагируют эфиром. Объединeнные органические слои промывают насыщенным раствором соли,высушивают (MgSO4), фильтруют и упаривают,получая при этом бледно-жeлтое масло. Масло подвергают хроматографии на силикагеле,элюируют EtOAc. Соответствующие фракции объединяют и упаривают, получая при этом масло. Указанное масло перегоняют (т.кип. 166 С, 0,05 мм рт.ст.), получая при этом 1-[2-(4 фторфенил)этил]-4-пиперидинкарбоксальдегида в виде бесцветного масла. Элементный анализ: вычислено для C14H18FNO: С 71,46; Н 7,71; N 5,95. Найдено: С 71,08, Н 7,81; N 5,86.(0,93 г, 6,7 ммоль) в ТГФ (20 мл) в атмосфере аргона при 0 С добавляют н-бутиллитий (2,7 мл 2,5 М раствора в гексане, 6,75 ммоль). После перемешивания в течение 2,5 ч раствор охлаждают до -78 С и с помощью капельной воронки обрабатывают 1-[2-(4-фторофенил)этил]-4-пиперидин-карбоксальдегидом (1,30 г, 5,5 ммоль) в ТГФ (25 мл). Удаляют охлаждающую баню и перемешивают раствор в течение 2 ч. Добавляют воду, разделяют слои, водный слой экстрагируют EtOAc. Объединенные органические слои промывают насыщенным раствором соли,высушивают (MgSО 4), фильтруют и хроматографируют на силикагеле, элюируя ацетоном. Соответствующие фракции объединяют и выпаривают, получая при этом белое твердое вещество. Полученное вещество перекристаллизовывают из гексана и получают рацемический альфа(2,3-диметоксифенил)-1-[2-(4-фторфенил) этил]-4-пиперидинметанол в виде блестящих белых игл, т.пл. 126-127 С. Элементный анализ,вычислено для C22H28FNО 3: С 70,75; Н 7,56; N 3,75. Найдено: С 70,87; Н 7,65; N 3,68. Пример 2. Исходные вещества. Пример 2, стадии A-F, иллюстрирует альтернативный способ получения -альфа-(2,3 диметоксифенил)-1-[2-(4-фторфенил)этил]-4 пиперидинметанола, структура 1.NaOH (40 г NaOH в 900 мл Н 2 О), и третбутанолу (1800 мл) добавляют частями ди-третбутилдикарбонат (200 г, 916 ммоль). После перемешивания в течение ночи раствор концентрируют, и полученный водный слой подкисляют водным раствором НСl. Указанный подкисленный водный слой 3 раза экстрагируют эфиром. Объединнные органические слои промывают водой, насыщенным раствором соли, высушивают (MgSO4), фильтруют и упаривают,получая при этом белое твердое вещество, которое перекристаллизуют из смеси EtOAc/гексан(300 мл/200 мл), получая при этом 1-(1,1 диметилэтил)-1,4-пиперидиндикарбоновую кислоту в виде белых игл, т.пл. 147-149 С.(500 мл) в атмосфере аргона в двухлитровой колбе добавляют частями 1,1'-карбонилдиимидазол (38,9 г, 240 ммоль). После перемешивания в течение 1 ч в один прием добавляют гидрохлорид N,O-диметилгидроксиламина. После перемешивания в течение ночи раствор промывают дважды 1 Н НСl, дважды насыщенным раствором NаНСО 3, 1 раз насыщенным 12 раствором соли, высушивают (MgSO4) и упаривают, получая при этом масло. После перегонки получают 1,1-диметиловый эфир 4-(N-метоксиN-метилкарбоксамидо)-1-пиперидиндикарбоновой кислоты в виде прозрачного масла (т.кип. 120-140 С, 0,8 мм рт.ст.)(5,00 г, 36,2 ммоль) в ТГФ (50 мл, безводный) в атмосфере аргона при 0 С. Убирают баню со льдом и перемешивают смесь в течение 90 мин. Смесь охлаждают до -78 С и обрабатывают 1,1 диметиловым эфиром 4-(N-метокси-N-метилкарбоксамидо)-1-пиперидинкарбоновой кислоты (9,20 г, 33,8 ммоль) в ТГФ (50 мл, безводный) с помощью шприца. Убирают охлаждающую баню с сухим льдом и ацетоном и дают смеси достичь комнатной температуры. После перемешивания в течение 3 ч добавляют насыщенный водный раствор NH4Cl, и смесь перемешивают в течение ночи. Разделяют слои и экстрагируют водный слой эфиром. Объединeнные органические слои промывают насыщенным раствором соли, высушивают (МgSO4),фильтруют и упаривают, получая при этом жeлтое масло. Масло подвергают хроматографии на силикагеле, элюируют 20% EtOAc в гексане. Соответствующие фракции объединяют и упаривают, получая при этом жeлтое масло. Масло перегоняют и получают 1,1-диметилэтиловый эфир 4-(2,3-диметоксибензоил)-1 пиперидин карбоновой кислоты (т.кип. 225250 С, 0,05 мм рт.ст.) в виде бесцветного масла. Элементный анализ: вычислено для C19H27NO5: С 65,31; Н 7,79; N 4,01. Найдено: С 65,04, Н 7,92; N 4,11.D) (2,3-Диметоксифенил)-пиперидин-4-илметанон. 1,1-Диметиловый эфир 4-(2,3-диметоксибензоил)-1-пиперидинкарбоновой кислоты (7,75 г, 22,2 ммоль) растворяют в трифторуксусной кислоте (50 мл, 650 ммоль) и перемешивают в течение 45 мин. Полученный раствор выливают в эфир (900 мл) и выдерживают в течение ночи. После фильтрации получают (2,3-диметоксифенил)пиперидин-4-илметанона трифторацетат в виде тонких белых игл, т. пл. 123 С. Элементный анализ: вычислено для C14H19NО 3CF3CO2H: С 52,89; Н 5,55; N 3,86. Найдено: С 52,77, Н 5,62;N 3,82. Полученный (2,3-диметоксифенил)пиперидин-4-илметанона трифторацетат растворяют в воде, обрабатывают NaOH (10% водный раствор) до щелочной реакции и 3 раза экстрагируют дихлорметаном. Объединенные органические слои промывают насыщенным раствором соли, высушивают (МgSO4), фильтруют и упаривают, получая при этом (2,3-диметоксифенил)пиперидин-4-илметанон в виде масла. 13 Е) Моногидрохлорид (2,3-диметоксифенил)[1-[2-(4-фторфенил)этил]-4-пиперидинил] метанона. Готовят раствор (2,3-диметоксифенил)пиперидин-4-илметанона (8,00 г, 32,1 ммоль) и 2(4-фторфенил)этилбромида (6,52 г, 32,1 ммоль) в ДМФ (90 мл), обрабатывают K2 СО 3 (7,0 г, 50,7 ммоль), перемешивают и нагревают до 80 С в атмосфере аргона в течение ночи. Охлажденный раствор выливают в смесь 2/1 EtOAc/толуол и воды. Разделяют слои и экстрагируют водный слой смесью 2/1 EtOAc/толуол. Объединенные органические слои промывают 2 раза водой, 1 раз насыщенным раствором соли, сушат(MgSО 4), фильтруют и упаривают, получая при этом 11,0 г масла. Полученное масло хроматографируют на силикагеле, элюируя EtOAc. Соответствующие фракции объединяют, концентрируют, растворяют в этилацетате и обрабатывают смесью HCl/этилацетат. Моногидрохлорид(1240 мг, 32,8 ммоль) в течение 1 ч. После перемешивания в течение ночи раствор концентрируют, получая при этом твердое вещество. Твердое вещество распределяют между водой и эфиром. Разделяют слои и экстрагируют водный слой эфиром. Объединенные органические слои промывают насыщенным раствором соли, высушивают (MgSО 4), фильтруют и упаривают,получая при этом твердое вещество. Полученное твердое вещество хроматографируют на силикагеле, элюируя ацетоном. Соответствующие фракции объединяют и упаривают, получая при этом белое твердое вещество. Твердое вещество перекристаллизовывают из циклогексанона, получая при этом -альфа-(2,3 диметоксифенил)-1-[2-(4-фторфенил)этил]-4 пиперидинметанол в виде белых игл, т.пл. 126127 С. Элементный анализ: вычислено для С 22 Н 28FNО 3: С 70,75; Н 7,56; N 3,75. Найдено: С 70,86; Н 7,72; N 3,93. Пример 3. Исходное вещество. Этот пример иллюстрирует получение спирта, структура 5. Получение(75 мл) кипятят с обратным холодильником в течение 17 ч, дают остыть до комнатной температуры и фильтруют. Фильтрат концентрируют и хроматографируют на колонке с силикагелем,элюируя смесью этилацетат/гексан (1:1), получая при этом два диастереомера, Rf=0,l и 0,2(ТСХ EtOAc/гексан, 1:1). Промежуточные фракции повторно хроматографируют для получения дополнительного количества вещества. Указанные фракции с Rf=0,2 объединяют и получают один диастереомерный сложный эфир,(+,+)-(2,3-диметоксифенил)-1-[2-(4-фторофенил) этил]-4-пиперидинилметил-альфа-метоксибензолацетат.B) Получение (+)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторофенил)этил]-4-пиперидинметанола. К перемешиваемому раствору 0,97 г (1,9 ммоль) указанного выше диастереомерного эфира, Rf=0,2, в 25 мл метанола добавляют 0,5 г(3,6 ммоль) карбоната калия и 5,0 мл воды. После перемешивания в течение 17 ч при комнатной температуре реакционную смесь разбавляют водой и дважды экстрагируют метиленхлоридом. Объединенные экстракты промывают водой, насыщенным раствором соли, сушат над МgSO4. После фильтрации фильтрат концентрируют, получая при этом масло и кристаллизуют из 40 мл смеси циклогексан/гексан (1:1),получая при этом (+)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторофенил)этил]-4-пиперидинметанол, т.пл. 112-113 С, []D20=+13,9. Пример 4. (+)(2,3-Диметоксифенил)-1[2-(4-фторофенил)этил]-4-пиперидинметанолдеканоат.(0,158 моль) триэтиламина помещают в трехгорлую колбу емкостью 1 л, снабженную мешалкой, термометром и капельной воронкой, с постоянной продувкой азотом. Добавляют раствор 27,4 г (0,144 моль) деканоилхлорида в 25 мл СНСl3 в течение 5 мин, поддерживая температуру реакционной смеси 20-25 С. Полученный раствор перемешивают в течение 2 ч при температуре 20-25 С. Протекание реакции контролируют по данным ТСХ (смесь 5/95 метанол/СН 2 Сl2; пластинки фирмы Мерк 60F-254; УФ; Rf (+)(2,3-диметоксифенил)-1-[2-(4 фторофенил)этил]-4-пиперидинметанола составляет 0,23, Rf указанного в заглавии соединения -0,55). К реакционной смеси добавляют дополнительно 2,8 г (0,015 моль) деканоилхлорида (фирма Aldrich) и 1,6 г (0,016 моль) три 15 этиламина и продолжают перемешивание в течение 2 ч. Реакционную смесь разбавляют 500 мл СН 2 Сl2 и промывают 250 мл 5% K2 СО 3, 250 мл Н 2O и 250 мл насыщенного раствора NaCl. Органическую фазу высушивают над 500 гMgSO4 и отфильтровывают. Осадок на фильтре промывают 200 мл СН 2 Сl2. Фильтрат концентрируют при 40 С/50 торр, получая при этом масло. Неочищенное вещество очищают однократным хроматографированием (колонка 14 х 29 см, 2,035 кг силикагеля 230-400 меш). Неочищенное вещество вводят в колонку, растворив в 75 мл СН 2 Сl2. Колонку элюируют 24 л смеси 1/4EtOAc/CH2Cl2, собирая 24 фракции по 1 л. Фракции с однородными характеристиками по данным ТСХ объединяют и концентрируют при 35 С/50 торр, и далее при 70 С/0,5 торр в течение 1 ч, получая при этом бесцветное масло. Масс-спектроскопия (М+=528) Элементный анализ: Вычислено для С 32 Н 46FNO4 (527,73): С 72,83%; H 8,79%; N 2,65%. Найдено: C 72,25%; H 8,88%; N 2,63%. Пример 5. (+)(2,3-диметоксифенил)-1[2-(4-фторофенил)этил]-4-пиперидинметанолгексаноат.(+)(2,3-диметоксифенил)-1-[2-(4 фторфенил)этил]-4-пиперидинметанола в 6 мл сухого метиленхлорида добавляют 0,74 мл(0,537 г, 5,32 ммоль) триэтиламина. Раствор охлаждают на бане со льдом, после чего шприцом добавляют 1,07 мл (5,89 ммоль) ангидрида гексановой кислоты. Раствор перемешивают в течение нескольких минут при температуре ледяной бани, и дают возможность нагреться до комнатной температуры. Затем к раствору добавляют 66 мг (0,541 ммоль) 4-диметиламинопиридина. Смесь перемешивают в течение ночи при комнатной температуре, выливают в смесь лед/вода/0,5 М NaOH, экстрагируют эфиром, фильтруют, концентрируют и получают масло. Масло растворяют в метиленхлориде и смеси 2% метанол/метиленхлорид, соответственно. Фракции, содержащие чистый продукт,объединяют и концентрируют, получая при этом масло, которое сушат в течение ночи при 60 С в высоком вакууме, получая при этом указанное в заглавии соединение. Соединение очищают с помощью ТСХ. Данные ИК (КВr),ЯМР (CDCl3) и масс-спектроскопии (МН+=472) подтверждают предполагаемую структуру. Элементный анализ: Вычислено для C28H38FNO4: C 71,31%; H 8,12%; N 2,97%. Найдено: C 70,94%; H 8,07%; N 2,88%.(+)(2,3-диметоксифенил)-1-[2-(4 фторофенил)этил]-4-пиперидинметанола в 6 мл сухого метиленхлорида добавляют 0,74 мл(0,537 г, 5,32 ммоль) триэтиламина. Раствор охлаждают на бане со льдом, после чего шприцом добавляют 1,75 мл (5,89 ммоль) ангидрида октановой кислоты. Раствор перемешивают в течение нескольких минут при температуре ледяной бани, и дают возможность нагреться до комнатной температуры. Затем к раствору добавляют 66 мг (0,541 ммоль) 4-диметиламинопиридина. Смесь перемешивают, промывают водой и насыщенным раствором хлорида натрия. Органический экстракт высушивают(Na2SO4), фильтруют и концентрируют, получая при этом масло. Масло растворяют в метиленхлориде и очищают хроматографией на силикагеле, используя для элюирования 1 и 2% смесь метанол/метиленхлорид, соответственно. Фракции, содержащие чистый продукт,объединяют и концентрируют, получая при этом масло, которое высушивают в течение ночи при 60 С в высоком вакууме, получая при этом указанное в заглавии соединение. Соединение очищают с помощью ТСХ. Данные ИК(+)(2,3-диметоксифенил)-1-[2-(4 фторфенил)этил]-4-пиперидинметанола в 6 мл сухого метиленхлорида добавляют с помощью шприца 0,76 мл (5,46 ммоль) триэтиламина, после чего раствор охлаждают на бане со льдом. К полученному раствору добавляют 2,92 г (5,89 ммоль) ангидрида гексадекановой кислоты, после чего смесь перемешивают в течение 15 мин при температуре 0 С. Реакционной смеси дают возможность нагреться до температуры окружающей среды и добавляют 65 мг (0,536 ммоль) 4-диметиламинопиридина, после чего раствор 17 перемешивают в течение ночи в атмосфере азота. Реакционную смесь выливают в 50 мл 0,5 н раствора гидроксида натрия и 50 мл диэтилового эфира. Наблюдается образование некоторого количества осадка, и полученную суспензию экстрагируют метиленхлоридом. Метиленхлоридный слой промывают водой и насыщенным раствором соли, затем сушат над сульфатом натрия, фильтруют и концентрируют, получая при этом желтое масло. Масло растворяют в метиленхлориде и очищают однократной хроматографией на колонке, заполненной силикагелем и метиленхлоридом, используя для элюирования ту же самую систему растворителей,последовательно, 1 и 2% смесь метанол/метилен-хлорид, соответственно. Соответствующие фракции объединяют и концентрируют, получая при этом желтое масло. Масло дважды сушат в течение ночи при 60 С в высоком вакууме, получая при этом указанное в заглавии соединение. Соединение очищают с помощью ТСХ. Данные ИК (КВr), ЯМР (СDСl3) и масс-спектроскопии (МН+=612) подтверждают предполагаемую структуру. Элементный анализ: Вычислено для С 24 Н 30FNO4: C 74,59%; H 9,55%;(фирма Aldrich) в 100 мл метиленхлорида. Метансульфонилхлорид (12,6 г, 0,11 моль) в метиленхлориде (50 мл) добавляют по каплям к раствору при перемешивании при комнатной температуре в течение 4 ч. Реакционную смесь переносят в отдельную делительную воронку и промывают 1 н раствором НСl (2 раза) и затем насыщенным раствором NаНСО 3 (2 раза). Раствор высушивают над безводным МgSO4,фильтруют и концентрируют в вакууме при 40 С, получая при этом 2-гексен-1-мезилат. Нитрил 2,2-диметил-3-октеновой кислоты получают добавлением 2-гексен-1-мезилата(3,7 г, 0,053 моль) в ТГФ (25 мл) после обработки NaH (60% в минеральном масле) (2,1 г, 0,053 моль) в сухом ТГФ (50 мл). Полученную реакционную смесь перемешивают при кипячении с обратным холодильником в течение 5 ч, охлаждают и смешивают с холодным этанолом (95%),концентрируют в вакууме для удаления растворителя. После добавления воды (50 мл) смесь экстрагируют диэтиловым эфиром (3 х 40 мл). 18 Экстракты промывают водой и затем насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют, получая при этом нитрил 2,2-диметил-3-октеновой кислоты. 2,2-Диметил-3-октеновую кислоту получают добавлением нитрила 2,2-диметил-3 октеновой кислоты (1,51 г, 0,01 моль) к раствору, полученному с использованием 15% NaOH в смеси бутанол/Н 2O (2:3) (30 мл). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 7 ч, охлаждают и подкисляют 10% хлороводородной кислотой. Реакционную смесь экстрагируют диэтиловым эфиром, экстракт промывают насыщенным раствором NaCl и сушат над MgSO4, фильтруют и концентрируют, получая при этом 2,2-диметил 3-октеновую кислоту. 2,2-Диметил-3-октановую кислоту получают растворением 2,2-диметил-3-октеновой кислоты (0,20 г, 1,1 ммоль) в абсолютном этаноле, в атмосфере N2, используя 10% палладий на углероде, с последующим гидрированием в течение 6 ч. Катализатор удаляют фильтрованием и полученный фильтрат концентрируют в вакууме, получая при этом 2,2-диметилоктановую кислоту. К перемешиваемому раствору (+)(2,3 диметоксифенил)-1-[2-(4-фторофенил)этил]-4 пиперидинметанола (3,9 г, 10,4 ммоль) в 70 мл метиленхлорида добавляют дициклогексилкарбодиимид (2,15 г, 10,4 ммоль), 4-диметиламинопиридин (0,1 г) и 2,2-диметилоктановую кислоту (1,70 г, 10,4 ммоль). Полученный раствор перемешивают и кипятят с обратным холодильником в течение 16 ч. Охлажденный реакционный раствор фильтруют и концентрируют, получая при этом масло. Полученное масло хроматографируют на силикагеле, элюируют смесью этилацетат/гексан (1:1). Собирают соответствующие фракции, нагревают (40 С) и концентрируют при пониженном давлении, получая при этом указанное в заглавии соединение. Пример 9. Настоящий пример иллюстрирует фармацевтическую композицию, являющуюся объектом настоящего изобретения. В подходящий мерный сосуд емкостью 100 мл помещают 70 мл кунжутного масла, NF (фирма Sigma), 1,2 г бензилового спирта, NF, и 14,129 г (+)(2,3 диметоксифенил)-1-[2-(4-фторфенил)этил]-4 пиперидинметанолдеканоата. К этому раствору добавляют необходимое количество кунжутного масла NF, для того, чтобы довести объем до 100 мл, и перемешивают до гомогенного состояния. Этот раствор можно простерилизовать и расфасовать для парентеральных инъекций. Пример 10. В настоящем примере описывается поведенческий тест (антагонизм в отношении DOIиндуцированного поведения), предназначенный для того, чтобы идентифицировать соединения, 19 которые обладают антагонистической активностью в отношении 5 НТ 2 а рецепторов. Соединение, являющееся предметом настоящего изобретения и используемое в данном тесте, представляет собой (+)(2,3-диметоксифенил)-1-[2-(4 фторофенил)этил]-4-пиперидинметанолдеканоат - пример 4 настоящего описания. 5-НТ 2 А/2 Сантагонист DOI HCl (1-(2,5-диметокси-4 йодфенил)-2-амино-пропангидрохлорид) вызывает несколько поддающихся количественному определению поведенческих реакций у крыс. Такие поведенческие реакции включают встряхивание (быстрое потряхивание головой и телом, подобно тому, как отряхивается мокрая собака), быстрое постукивание передними лапами (быстрое перебирание передними лапами) и судорожные подергивания шкуры (сокращение параспинальной мускулатуры или сжатие шкуры вдоль спины). 5-НТ 2-антагонисты миансерин, ритансерин и метисергид, также как и селективный 5 НТ 2 А-антагонист MDL 100907,показали в зависимой от дозы блокирование поведенческих эффектов, характерных для DOIWettstein et al., 1996, Soc. Neurosci. Abs. 22: 481). Существенно, что лекарственные препараты,обладающие 5HT2a антагонистической активностью, как полагают, характеризуются нетипичными антипсихотическими свойствами при использовании шизофреничными пациентами(Meltzer et al., 1989, JPET., 251:238-246), а также потенциальной терапевтической активностью в отношении ряда других заболеваний ЦНС,включающих депрессию, дистимию и состояние тревоги (StefanskiGoldberg, 1997, CNS Drugs,7: 399-409). Методы Объекты исследования и их содержание Крыс-самцов линии(18050 г) размещали по семеро в одну клетку и выдерживали в течение 1 недели, для того, чтобы животные акклиматизировались в виварии. Пища и вода были свободно доступны. Температурный и световой цикл (освещение 12 ч включено, 12 ч выключено) поддерживались автоматически. Отдельные особи тестировались 1 раз. Каждая тестируемая группа содержала семь животных. Эксперименты проводили в той комнате в виварии, в которой содержались животные. Приготовление лекарственных препаратов и их введение(+)(2,3-Диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанолдеканоат(эквивалентно 120 мг/кг MDL 100907) растворяют в кунжутном масле и вводят внутримышечно отдельным группам крыс в День 0 в объеме,равном 60 мл/100 г массы тела. Для контроля некоторым животным вводят только одно кунжутное масло. -DOI HCl (3,0 мг/кг, 1 мл/кг массы тела) растворяют в дистиллированной 20 воде, используя ультразвуковую ванну, и вводят внутрибрюшинно в соответствующие дни тестирования. Наблюдения и оценка поведенческих реакций Крысы, получившие (+)(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинментанолдеканоат, были тестированы в отношении ингибирование DOI-индуцированного поведения через 1, 5, 7, 14, 28 и 40 дней после одинарной внутримышечной инъекции (+)-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]4-пиперидинметанолдеканоата. Каждую крысу тестировали 1 раз. Сразу же после инъекцииDOI крыс помещали под поставленную вверх дном прозрачную пластиковую клетку(28 х 25 х 25 см), у которой наверху находилась чистая промокательная бумага. За крысами постоянно пристально наблюдали в течение 30 мин подготовленные наблюдатели (не знавшие об обработке), для того чтобы определить наличие DOI-индуцированного поведения (приступы встряхивания, судорожного подергивания шкуры, быстрого постукивания передними лапами), и затем возвращали крыс в их жилые клетки. Позже крыс использовали для фармакокинетических исследований. Частота проявления DOI-индуцированного поведения регистрировалась и затем суммировалась, для того чтобы получить единую количественную оценку поведения для каждого животного. Анализ данных Определяли среднюю и стандартную ошибку количественных оценок поведения для каждой группы животных. Среднее значение для каждой группы животных, которых подвергали обработке, затем по отдельности сравнивали со средним значением для контрольной группы, которой вводили только растворитель,используя симплексный анализ по дисперсионному критерию (ANOVA), с последующей posthoc сортировкой согласно Bonferroni/Dunn. Различия между группами считали статистически значимыми, если значения р были менее или равны 0,05. Результаты Значительное ингибирование поведения индуцированного DOI наблюдали в течение полных 28 дней. Действие переставало быть значительным на 40-й день. Пример 11. В настоящем примере описана абсорбция единичной дозы MDL 100907, следующая за введением (+)(2,3-диметоксифенил)-1-[2-(4 фторофенил)этил]-4-пиперидинметанолдеканоата (в.м.), соединения согласно настоящему изобретению, в течение времени. Крысам-самцам линии Вистар, общее количество животных девяносто, массой примерно приблизительно 150-200 г, вводили внутримышечно (+)(2,3-диметоксифенил)-1-[2-(4 фторфенил)этил]-4-пиперидинметанолдеканоатMDL 100907) в день 0. Крыс анестезировали внутрибрюшинно летальной дозой нембутала и отбирали кровь через 3 и 6 ч, и через различное количество дней после введения дозы (для каждой временной точки n=5) в гепаринизированные контейнеры. Образцы крови центрифугировали в течение 30 мин при 5 С и примерно 2700 об./мин. Отбирали плазму и хранили при -20 С до начала исследования. Образцы плазмы анализировали соответствующим методом ВЭЖХ. В указанные временные точки также отделяли мозг и хранили при -80 С до начала исследования методом ВЭЖХ. Полученные результаты приведены в таблице. Интервал доз, в которых соединения формулы I проявляют способность ингибировать действие серотонина на 5 НТ 2 а рецепторы могут сильно варьироваться в зависимости от конкретных заболеваний или состояния, подлежащего лечению, и его тяжести, в зависимости от пациента, препаративной формы, наличия других болезненных состояний у пациента, а также других лекарственных средств, которые могут одновременно вводиться пациенту. Как правило, соединения формулы I проявляют серотонин 5HT2a-антагонистические свойства в дозах в интервале от 0,001 мг/кг массы тела пациента/день до 100 мг/кг массы тела пациента/день. Препаративные формы длительного высвобождения могут содержать множество доз, в зависимости от того, в течение какого времени происходит высвобождение активного ингредиента. Доза соединений настоящего изобретения, может быть определена путем введения соединения животным и оценки количества активного ингредиента в плазме крови. Соединения настоящего изобретения могут быть смешаны с фармацевтически приемле 22 мым носителем, который может быть введен наиболее предпочтительным способом для того,чтобы сделать возможным длительное высвобождение соединения настоящего изобретения таким образом, чтобы терапевтически эффективное количество соединения (+)(2,3 диметоксифенил)-1-[2-(4-фторфенил)этил]-4 пиперидинметанола можно было доставлять пациенту в течение нескольких дней или недель. Предпочтительно, препаративная форма длительного высвобождения включает соединение формулы I и фармацевтически приемлемый носитель для парентерального введения и представляет или водную суспензию, масляный раствор, масляную суспензию, или эмульсию. Некоторые масла, которые могут быть использованы для внутримышечного введения, представляют кунжутное, оливковое, арахисовое,кукурузное, миндальное, хлопковое масла, масло земляного ореха или касторовое масло, причем предпочтительным является кунжутное масло. Также может быть добавлен фармацевтически приемлемый консервант, такой как бензиловый спирт. Препаративная форма длительного высвобождения предпочтительно вводится внутримышечно или подкожно, причем предпочтительно внутримышечное введение, хотя другие способы введения, такие как пероральное введение, трансдермальное введение, впрыскивание в нос и т.п., также могут быть использованы, если это соответствует потребностям пациента. Поскольку соединения настоящего изобретения для достижения необходимого терапевтического эффекта высвобождают (+)(2,3 диметоксифенил)-1-[2-(4-фторфенил)этил]-4 пиперидинметанол (активный ингредиент) в организме пациента, указанные соединения могут быть полезны в случае всех тех показаний к применению, в которых используется вышеуказанный активный ингредиент. Некоторые из этих показаний к применению были описаны в опубликованных патентах, в общем приводящих сведения об активном ингредиенте (патент США 4783471) или специально защищающих активный ингредиент (патенты США 5134149, 5561144, 5618824 и PCT/US97/02597),все они включены в настоящее описание в качестве ссылки. В этих документах описано применение в случае психических расстройств (включая шизофрению), навязчивого компульсивного расстройства, заболеваний, связанных с тромбозом, коронарного вазоспазма, перемежающейся хромоты, анорексии, связанной с повышенной возбудимостью, синдрома Рэйнауда, фибромиалгии, экстрапирамидальных побочных эффектов, состояния тревоги, аритмии, депрессии и биполярной депрессии или зависимости от наркотиков (например, таким как кокаин, никотин и т. п.). Некоторые из этих показаний раскрыты в патентах, описанных выше, и в патентах США 235561144, 5618824, 4877798, 5143149 и 5021428, все они включены в настоящее описание в качестве ссылки. Психическое расстройство в том значении,которое используется в настоящем описании,представляет состояние, при котором пациент перенoсит значительные психические нарушения органической и/или эмоциональной природы, характеризующиеся деградaцией личности и потерей контакта с реальностью, часто сопровождающиеся маниями, галлюцинациями или иллюзиями. Типичные примеры психических заболеваний, которые можно лечить соединениями настоящего изобретения, включают шизофрению, подобные шизофрении расстройства,шизоаффективные состояния, маниакальные состояния, кратковременные психические расстройства, общие психические расстройства,психические расстройства, неопределенные специально, психические расстройства, вызванные злоупотреблением лекарственными средствами. См. Diagnostic and Statistical Manual ofAssociation, включено в настоящее описание в качестве ссылки. В настоящее время указанный выше активный ингредиент проходит клинические испытания при лечении шизофрении. Пациенты с навязчиво-компульсивным состоянием (OCD) не могут проявлять навязчивые, печальные мысли или представлениям и не могут отогнать от себя такие мысли или представления. Поскольку OCD характеризуется недостаточным когнитивным запиранием и отклоняющейся от нормы метаболической активностью, схематически связанной с глазным наружным покровом и апертурой, предполагают, что у пациентов с OCD может проявляться недостаточность PPI (предимпульсная заторможенность). Как было обнаружено, вышеуказанный активный ингредиент восстанавливает нарушенную PPI. См. Psychopharmacology 124: 107-116 (19960, R.A. Padich, et al., "5HT modulation of auditory and visual sensorimotor gating: II.Effects of 5HT2a antagonist MDL 100,907 on disruption of sound and light prepluse inhibition produced by 5HT agonist in Wistar rats." Вышеуказанный активный ингредиент также эффективен в случае острого тромбоза,особенно тромбоза коронарных артерий. Указанное соединение снижает скорость агрегации тромбоцитов в результате незначительных изменений эндотелиального слоя сети сосудов и таким образом предотвращает резкое образование патологических тромбов. См. патент США 5561144, описание. Состояние тревоги, вариантная стенокардия, нервно-психическая анорексия, синдром Рэйнауда и коронарный вазоспазм используются в настоящем описании в том значении, в как они определены в 27-ом издании Dorland's Illustrated Medical Dictionary, приводится в качестве ссылки. 24 Фибромиалгия представляет собой хроническое болезненное состояние, при котором пациент страдает от множества симптомов, таких как, например, широко распространенные общие мышечные боли в области позвоночника,ноющие боли, тугоподвижность по утрам, нарушение сна, которое может быть охарактеризовано как недостаточность сна 4 стадии. Экстрапирамидальные побочные эффекты часто сопровождают введение нейролептических лекарственных средств, таких как галоперидол и хлорпромазин. Пациент часто испытывает синдром типа синдрома Паркинсона, при котором пациенты испытывают мышечную ригидность и дрожание. Другие пациенты испытывают акатизию и острые дистонические расстройства. Вышеуказанный активный ингредиент увеличивает длительность потенциала действия ткани миокарда, увеличивая период времени в течение которого ткань миокарда невосприимчива к лечению, и согласно классификационной системе Вогана Вильямса (Vaughan Williams) относится к классу III антиаритмической активности. Соединения настоящего изобретения могут быть использованы для лечения пациента от наркотической зависимости. См. Т. F. Meert, etal., European Journal of Pharmacology 183: 1924,где 5 НТ 2 а антагонисты ингибируют действие как алкоголя, так и кокаина на модели наркотической зависимости у грызунов. Другие модели на животных, такие как модель самостимулирования у грызунов, которая описана в: R.A. Frank, et al., Behavioral Neuroscience 101: 546-559 (1987), могут быть использованы для демонстрации способности соединений настоящего изобретения вылечивать наркотическую зависимость. Соединения настоящего изобретения полезны для лечения пациентов с депрессивными расстройствами и биполярными нарушениями. В издании: Diagnostic and Statistical Manual ofMental Disorders (Third Edition) ("DSM-III-R"),включенном в настоящее описание в качестве ссылки, депрессивные расстройства определены как основной депрессивный синдром, дистимия и депрессивное расстройство NOS. Авторы данного изобретения также включают в эту категорию эпизоды основного депрессивного синдрома, включая хронический тип, меланхолию и сезонные проявления. Биполярные нарушения включают биполярное нарушение, циклотимию и биполярные расстройства NOS. Признаком депрессивного расстройства является один или более периодов депрессии без предшествующих либо маниакального, либо гипоманиакального эпизодов. Признаком биполярной депрессии является наличие одного или более маниакального, либо гипоманиакального эпизодов, обычно сопровождающихся одним или более эпизодом основного депрессивного 25 синдрома. Маниакальный или гипоманиакальный эпизод представляет собой определенный период времени, в течение которого преобладающее настроение является либо приподнятым, экспансивным или раздраженным и существуют ассоциативные симптомы маниакального синдрома, определенные в DSM-III. Расстройство является достаточно тяжелым и вызывает значительный упадок профессиональной и социальной деятельности. Основной депрессивный синдром включает один или более эпизодов основного депрессивного синдрома. Эпизод основного депрессивного синдрома характеризуется: (1) по меньшей мере, пять из следующих признаков: подавленное настроение, потеря интереса к удовольствиям (ангедония), значительная потеря веса или значительное увеличение веса, в том случае, если не соблюдается диета, бессонница или повышенная сонливость, психомоторная возбудимость или заторможенность, усталость или упадок сил, ощущение ненужности или непомерной или неадекватной вины, снижение способности размышлять или концентрировать внимание, или периодически повторяющиеся мысли о смерти, включая самоубийство; (2) не может быть установлено, что органический фактор инициирует и поддерживает патологическое отклонение; (3) отсутствуют мании и галлюцинации, по меньшей мере, в течение 2 недель при отсутствии отчетливых симптомов,связанных с настроением; (4) нет наложений шизофрении, подобных шизофрении расстройств, состояний бреда или психотических расстройств NOS. Дистимия имеет историю болезни, включающую подавленное настроение большее число дней в году в течение, по меньшей мере, 2 лет, причем в течение первых двух лет состояние пациента не соответствует критериям, определяющим эпизоды основного депрессивного синдрома. У детей и подростков подавленное настроение может проявляться как раздражительность. Также присутствуют, по меньшей мере, две следующие характеристики: плохой аппетит или переедание, бессонница или повышенная сонливость, упадок сил или утомляемость, заниженная самооценка, плохая концентрация внимания, трудности принятия решений или чувство беспомощности. Эти симптомы не накладываются на хронические психические расстройства, такие как шизофрения или состояние бреда. Также не может быть установлено, что патологическое отклонение инициировано или поддерживается органическими факторами. Имеется множество способов, позволяющих показать, что соединение настоящего изобретения полезно для лечения депрессивных расстройств и биполярных нарушений, таких как модели на животных. См., например, "Animals Models as simulation of depression" by PaulModels of Depression: An Overview" by Paul Wilner, Pharmac. Ther. 45:425-455 (1990), обе эти работы приведены в настоящем описании в качестве ссылок. Одна из таких моделей представляет собой модель депрессии при хроническом легком стрессе (CMS). Модель CMS использует мягкие факторы,вызывающие стресс, такие как лишение пищи и воды, небольшие температурные изменения,изменения соседей по клетке и т.п. В течение нескольких недель воздействия мягких факторов, вызывающих стресс, животные (не подвергнутые лечению) постепенно уменьшают потребление весьма предпочтительного для них раствора сахарозы, который им продолжают давать в течение нескольких недель после окончания стресса. Эта пониженная восприимчивость к поощрению (раствор сахарозы) соответствует ангедонии, симптому эпизода основного депрессивного синдрома (см., например, Behavioral Pharmacol., 5: Suppl. 1, р. 86 (1994), где использовали модель CMS для оценки действия лития, карбамазепина и кетоконазола; Psychopharmacology 93: 358-364 (1987), где модельCMS использовали для оценки трициклического антидепрессанта;Pharmacology.5:344-350 (1994), где модель CMS использовали для оценки ингибитора катехол-Oметилтрансферазы). Следующие исследования на модели CMS проводили с использованием активного ингредиента соединений настоящего изобретения(здесь и далее MDL 100907), по сравнению с известным соединением антидепрессантом имипрамином. Крыс-самцов линии Вистар приносили в лабораторию за 2 месяца до начала эксперимента, в это время они весили примерно 300 г. За исключением случаев, описанных ниже, пища и вода были легко доступны, поддерживали 12 часовой цикл освещение/темнота (освещение включали в 8 ч утра) при температуре 222 С. Сначала животных приучали потреблять 1% раствор сахарозы; тренировка состояла из восьми одночасовых базисных тестов, в которых сахарозу подавали в клетку, в которой постоянно содержалось животное, после 14 ч лишения пищи и воды. Потребление сахарозы оценивали, взвешивая в конце теста бутылки с раствором сахарозы, которые были предварительно взвешены в начале теста. Таким образом,контролировали потребление сахарозы в аналогичных условиях с недельными интервалами в течение всего эксперимента. На основе данных, представляющих потребление сахарозы в заключительном базисном тесте, животные были разделены на две подходящие группы. Одна группа животных была подвергнута продолжительному мягкому стрессу в течение 9 следующих друг за другом недель. Каждая неделя режима стресса состояла из 27 двух периодов лишения пищи и воды (12 и 14 ч), двух периодов в клетке, располагающейся под углом 45 с горизонтальной поверхностью(12 и 14 ч), двух периодов периодического ночного освещения (освещение включали и выключали каждые 2 ч), двух 14-часовых периодов в запачканной клетке (200 мл воды на подстилке из опилок), два 14-часовых периода спаренного проживания, два 14-часовых периода стробоскопического освещения низкой интенсивности(150 вспышек в минуту). Воздействие стрессовых факторов осуществляли непрерывно в течение дня и ночи, по графику, составленному по закону случая. Контрольные животные содержались в отдельной комнате и не имели контакта с животными, подвергавшимися воздействию стрессовых факторов. Контрольных животных лишали пищи и воды за 14 ч до начала каждого теста с сахарозой, но в остальное время в клетках, где содержались животные, еда и пища были легко доступны. На основе оценки потребления сахарозы крысами после 3 недельного стресса, как подверженные воздействию стрессовых факторов, так и контрольные животные далее были разделены на подгруппы (n=8), и в течение последующих 5 недель им ежедневно вводили растворитель (1 мл/кг, интраперитонально, имипрамин, 10 мг/кг, интраперитонально) или MDL 100907 (0,002, 0,02 и 0,2 мг/кг,перорально). Все инъекции лекарственных средств осуществляли в количестве 1 мл/1 кг массы тела. Лекарственное средство вводили в 10 ч утра, а тест с сахарозой проводили через 24 ч после последнего приема лекарственного средства. Через пять недель введение лекарственного средства было закончено, а через неделю после отмены был проведен заключительный тест с сахарозой. Воздействие стрессовых факторов продолжалось в течение периода лечения и отмены. Полученные результаты проанализированы с использованием многократного анализа дисперсии с последующим LSD-тестом Фишера для post hoc сравнения средних значений. Продолжительный мягкий стресс вызывает постепенное снижение потребления 1% раствора сахарозы, в последнем базисном тесте потребление сахарозы составило примерно 13 г в обеих группах. После 3 недель стресса (неделя 0), потребление находилось на уровне 12,4(+0,4) г в контрольной группе, но снизилось до 7,2(0,20) г в группе животных, подверженных воздействию стрессовых факторов (р 0,001). Такое различие между контрольной группой и группой животных, подверженных воздействию стрессовых факторов, получавших растворитель, сохранялось на подобном уровне до заверения эксперимента. Имипрамин не оказал значительного влияния на потребление сахарозы в контрольной группе животных [F(184)=0,364; NS]. Однако лекарственное средство вызвало постепенное 28 повышение потребления сахарозы в группе животных, подверженных воздействию стрессовых факторов, [F(184)=16,776; (р 0,001)]. Потребление сахарозы в группе животных, получавших имипрамин и подверженных воздействию стрессовых факторов, значительно возросло,после четырех недель лечения, начиная отсчет с недели 0, и после пяти недель лечения не наблюдалось значительных различия между получавшими лекарственное средство подверженными воздействию стрессовых факторов животными и контрольными животными, получавшими лекарственное средство и раствор соли. Потребление сахарозы в группе животных, получавших имипрамин и подверженных воздействию стрессовых факторов, оставалось на том же уровне в течение одной недели после отмены приема лекарственного средства.MDL 100907 не оказал значительного влияния на потребление сахарозы в контрольной группе животных [эффект лечения:F(3168)=0,821; NS взаимосвязь полученная доза х недели: F (15168)=0,499; NS]. У животных,подверженных воздействию стрессовых факторов, MDL 100907 постепенно снимает CMSиндуцированный дефицит приема сахарозы, что приводит к значительному эффекту лечения[F(3168)=22,567; (p0,001)] и характеристике взаимосвязи полученная доза х недели[(F(15158)=1, 5594 р=0,05]. У животных, подверженных воздействию стрессовых факторов, и получавших две более высоких дозы MDL 100907 (0,02 и 0,2 мг/кг) потребление сахарозы значительно повышается по сравнению с начальным (неделя 0) после двух (0,02 мг/кг) и трех (0,2 мг/кг) недель обработки (р=0,03 и р=0,04, соответственно). Этот эффект возрастает в течение следующих недель,и в конце периода приема лекарственного средства (неделя 5) количество раствора сахарозы,выпиваемого указанными животными сравнимо с количеством сахарозы, потребляемого животными в контрольной группе, получающей растворитель, и значительно выше количества раствора сахарозы, потребляемого животными,подвергнутыми воздействию стрессовых факторов и получающих растворитель (0,02 мг/кг: р 0,001, 0,2 мг/кг: р-0,002). В случае наименьшей дозы, равной 0,002 мг/кг, MDL 100907 не оказывает существенного влияния на потребление сахарозы в течение всего периода лечения. Впоследствии, через 5 недель после лечения потребление сахарозы животными, подверженными воздействию стрессовых факторов и получившими указанную дозу, не отличается от потребления сахарозы животными в контрольной группе, получавшей растворитель (р=0,860) и значительно ниже количества сахарозы, потребляемой контрольными животными, получавшими растворитель(р 0,001). Через 1 неделю после прекращения лечения потребление сахарозы существенно не 29 изменяется у всех получавших MDL 100907 контрольных (0,002 мг/кг: р=0,2, 0,02 мг/кг: р=0,9, 0,2 мг/кг: р=0,4) и подверженных стрессовым воздействиям животных (0,002 мг/кг: р=0,6, 0,02 мг/кг: р=0,8, 0,2 мг/кг: р=0,6). Безусловно, клинические испытания на людях также могут быть использованы для демонстрации полезности соединения настоящего изобретения для лечения депрессии, такой как определена согласно классификации депрессивных состояний Гамильтона Abbreviated Hamilton Psychiatric Rating Scale for Depression. Эта классификация включает ряд из 17 категорий,по которым оценивают человека, например, подавленное настроение, чувство вины, склонность к самоубийству, бессонница, состояние тревоги, и т.п., для того чтобы получить баллы,по которым медики определяют, страдает или нет пациент от депрессии. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I Формула I где R представляет собой С 4-С 20 алкил,или его стереоизомер, или его фармацевтически приемлемая соль. 2. Соединение по п.1, в котором R представляет собой C5-С 20 алкил с неразветвленной цепью. 3. Соединение по п.1, выбранное из группы, включающей(+)(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанол-2,2 диметилоктаноат. 4. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый носитель. 5. Фармацевтическая композиция по п.4, гдеR представляет собой С 9-алкил с неразветвленной цепью и в которой фармацевтически приемлемый носитель представляет собой фармацевтически приемлемое масло, выбранное из группы, включающей кунжутное, оливковое, арахисовое, кукурузное, миндальное, хлопковое масло, масло земляного ореха и касторовое масло. 6. Фармацевтическая композиция по п.5,где масло представляет собой кунжутное масло. 30 7. Способ ингибирования действия серотонина на 5 НТ 2 а-рецептор, включающий введение терапевтически эффективного количества соединения по п.1 пациенту, который в этом нуждается. 8. Способ по п.7, где R представляет С 9 алкил с неразветвленной цепью. 9. Способ по п.7, в котором соединение вводят внутримышечно или подкожно. 10. Способ по п.7, в котором соединение вводят внутримышечно и ингибирование действия серотонина на 5HT2a-рецептор продолжается от примерно 2 недель до примерно 1 месяца. 11. Способ лечения пациента, страдающего от одного или более заболеваний, выбранных из группы, включающей психическое расстройство, шизофрению, биполярную депрессию,депрессию, состояние тревоги, навязчивое компульсивное расстройство, привыкание к наркотикам, коронарный вазоспазм, стенокардию и заболевания, связанные с образованием тромбов, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1. 12. Способ по п.11, где R представляет С 9 алкил с неразветвленной цепью. 13. Способ по п.11, в котором соединение вводят внутримышечно или подкожно. 14. Способ по п.11, в котором соединение вводят внутримышечно и пациента лечат от примерно 2 недель до примерно 1 месяца. 15. Способ получения соединения формулы I где R представляет собой С 4-С 20 алкил,или его стереоизомера, или его фармацевтически приемлемой соли,включающий взаимодействие спирта (5)(RCO)2O или карбоновой кислотой формулыRCO2H, где R имеет значение, определенное выше и Х представляет собой хлор или бром, в присутствии достаточного количества подходящего основания для получения соединения формулы I. 16. Способ по п.15, в котором Х представляет собой хлор и R представляет собой алкил с неразветвленной цепью. 17. Способ по п.15, где R представляет собой С 9-алкил с неразветвленной или разветвленной цепью и основание представляет собой триэтиламин. 18. Способ по п.15, в котором спирт (5) реагирует с RCOX, где R представляет собой 32 С 9-алкил с неразветвленной цепью и Х представляет собой хлор. 19. Применение соединения по п.1 в качестве фармацевтически активного вещества.
МПК / Метки
МПК: C07D 211/22, A61P 25/18, A61K 31/445
Метки: рецепторов, +)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола, 5ht2a, антагониста, эфиры, использование, пролекарств, 110907, сложные, качестве
Код ссылки
<a href="https://eas.patents.su/17-3667-slozhnye-efiry-alfa-23-dimetoksifenil-1-2-4-ftorfeniletil-4-piperidinmetanola-i-ih-ispolzovanie-v-kachestve-prolekarstv-antagonista-mdl-110907-5ht2a-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Сложные эфиры (+)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола и их использование в качестве пролекарств антагониста mdl 110907 5ht2a рецепторов</a>
Предыдущий патент: Новые полициклические азаиндолы, способ их получения и фармацевтические композиции, содержащие их
Следующий патент: Способ получения 4-карбоксиамино-2-замещенного-1, 2, 3, 4-тетрагидрохинолина
Случайный патент: Хинолиновые и хиназолиновые соединения, применяемые в терапии, особенно при лечении доброкачественной гиперплазии простаты





















