Производные иминоазаантрациклинона для лечения амилоидоза
Номер патента: 1887
Опубликовано: 22.10.2001
Авторы: Суарато Антонино, Бандьера Тициано, Фаярди Даниэла, Карузо Микеле, Лансен Жаклин
Формула / Реферат
1. Соединение формулы 1
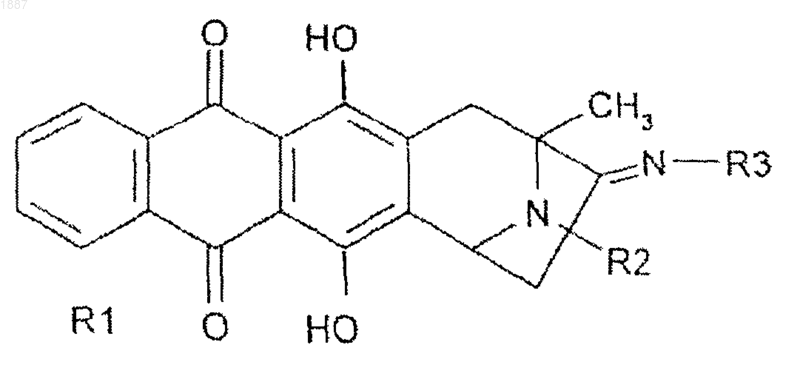
где R1 выбран из водорода и низшего алкоксила, R2 выбран из водорода, C1-4-алкила, аллила, бензила, необязательно замещенного одним-тремя заместителями, выбранными из группы, включающей трифторметил, C1-4-алкил, C1-4-алкокси, галоген и гидрокси; пиридинометил, пиридинометилкарбонил;
R3 выбирают из групп гидроксила, C1-4-алкокси, бензилокси, метиламино или 4-пиридинметилокси, 4-морфолинила, 4-метилпиперазинила, при условии, что когда R1 представляет собой метоксигруппу и R3гидроксигруппу, R2 отличен от 4-пиридинметила, или
его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором R1 выбран из водорода и метокси, R2 выбран из водорода, метила, аллила, бензила, 3-бромбензила, 4-трифторметилбензила, 4-метоксибензила, 3,4-диметоксибензила, 3,5-ди-трет-бутил-4-гидроксибензила, пиридинметила, никотиноила,
R3 выбран из гидрокси, метокси, этокси, бензилокси, 4-пиридинметилокси, метиламино, 4-морфолинила, 4-метилпиперазинила, или его фармацевтически приемлемая соль.
3.Соединение по п.1, которое выбрано из оксима 8-N-(3,4-диметоксибензил)антразалона, оксима S-N-аллилантразалона, O-метилоксима S-N-аллилантразалона и O-этилоксима антразалона, или их фармацевтически приемлемых солей.
4. Способ получения соединения формулы I, определенной в п.1
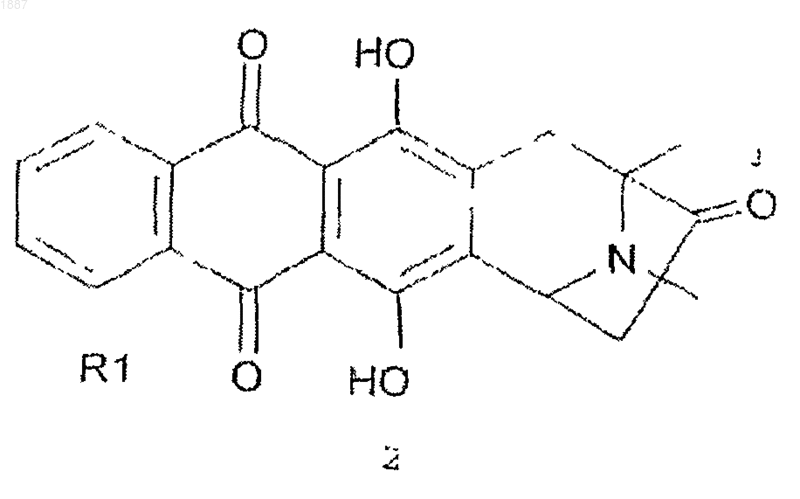
где R1 и R2 имеют указанные в п.1 значения, с соединением формулы
R3-NН2
где R3 имеет указанные в п. 1 значения, и
(b) при необходимости, преобразование полученного таким образом соединения формулы (I) в другое соединение формулы (I) и/или
(с) при необходимости, превращение соединения формулы (I) в его фармацевтически приемлемую соль.
5. Способ по п.4, где на стадии (а) соединение формулы 2, определенное в п.4, взаимодействует с соединением формулы R3-NH2ъ HA, где НА обозначает неорганическую кислоту, в органическом растворителе в присутствии органического или неорганического основания.
6. Фармацевтическая композиция, которая содержит в качестве активного ингредиента соединение формулы I, определенное в любом из пп.1-3, или его фармацевтически приемлемую соль, в смеси с фармацевтически приемлемым носителем или разбавителем.
7. Соединение формулы I, определенное в любом из пп.1-3, или его фармацевтически приемлемая соль для применения в лечении организма человека или животного.
8. Применение соединения формулы I, определенного в любом из пп.1-3, или его фармацевтически приемлемой соли при получении лекарственного средства для лечения амилоидоза AL, болезни Альцгеймера или синдрома Дауна.
9. Способ лечения человека или животного, страдающего от заболевания амилоидоза, или подверженного этому заболеванию, предусматривающий введение ему нетоксичного и эффективного количества соединения формулы (I), определенного в любом из пп.1-3, или его фармацевтически приемлемой соли.
Текст
1 Данное изобретение относится к производным иминоазаантрациклинона, их применению для лечения амилоидоза, способам их получения и содержащим их фармацевтическим композициям. Взаимосвязь между амилоидозом, некрозом клеток и потерей функции ткани имеет, повидимому, отношение к расстройствам различного типа, в том числе некоторым нейродегенеративным расстройствам. Таким образом, предотвращение образования амилоида и/или индукция деградации амилоида может быть важной терапевтической стратегией для всех патологических нарушений, связанных с амилоидозом и нейродегенеративными расстройствами типа Альцгеймера. Данное изобретение относится к иминоазаантрациклинонам и их применению при лечении амилоидоза. Этот новый класс молекул является производным соединения, названного антразалоном, которое характеризуется наличием антрахиноновой системы, конденсированной с содержащим мостик гетероциклическим кольцом, структура которого изображена ниже: Антразалон может рассматриваться как член нового класса молекул, которые относятся к 8-азаантрациклинонам и которые могут быть названы антразалинонами. Соединения, охватываемые данным изобретением, характеризуются присутствием аминогруппы на содержащем мостик гетероциклическом кольце. Более конкретно, данное изобретение относится к производному антразалинона формулы 1 где R1 выбран из водорода, гидроксила, C1-16 алкила, C1-16-алкоксила, С 3-8-циклоалкоксила, галогена, аминогруппы, которая может быть незамещенной или моно- или OSO2(R4), где R4 обозначает алкил или арил;R2 выбран из водорода,RB-СН 2-, где RB обозначает арильную группу, гетероциклильную группу или группу формулы RC-CH=CH-, где RC обозначает водород, C1-16-алкил, С 2-8-алкенил или С 3-8 циклоалкил,C1-16-алкила,С 3-8-циклоалкила, арил-С 1-С 16-алкила, арилокси-С 1-С 16-алкила,ацила формулы -C(R5)=O, где R5 выбран из водорода, С 1-16-алкила, С 2-16-алкенила, С 3-8 001887 2 циклоалкила, арила, гетероциклила, ацильного остатка аминокислоты,R3 выбран из группы формулы ОR6, где R6 обозначает водород, C1-16-алкил, С 2-16-алкенил,С 3-8-циклоалкил, арил-С 1-С 6-алкил, арил,группы формулы NR7R8, где R7 и R8, которые могут быть одинаковыми или различными,обозначают водород, C1-16-алкил, аралкил, С 2-16 алкенил, С 3-8-циклоалкил, гетероциклил, ацил формулы -C(R5)=O, где R5 имеет вышеупомянутое значение,или R7 и R8 вместе с атомом N, к которому они присоединены, обозначают гетероциклил,при условии, что, когда R1 обозначает метоксильную группу и R3 обозначает гидроксильную группу, R2 не является 4-пиридинметилом,или его фармацевтически приемлемую соль. Предпочтительными соединениями формулы 1 являются соединения, в которых"Алкильная" группа или фрагмент представляет собой обычно C1-C16-алкильную группу или фрагмент, С 1-С 16-алкильная группа или фрагмент включает в себя алкильные группы или фрагмент, как с прямой, так и с разветвленной цепью. Предпочтительно, C1-C16-алкильная группа или фрагмент представляет собой С 1-С 12 алкильную группу или фрагмент, такой как гептил, октил, нонил, децил, ундецил или додецил или их изомер с разветвленной цепью. Предпочтительно, C1-C12-алкильная группа или фрагмент представляет собой C1-С 6 алкильную группу или фрагмент, такой как метил, этил, пропил, изопропил, бутил, трет-бутил,изобутил, пентил, гексил или изогексил или их изомер с разветвленной цепью. Алкильные группы и фрагменты, обсужденные выше, могут быть замещены одним или несколькими заместителями, выбранными из циклоалкила, гетероциклила, галогена, СF3,гидрокси, алкокси, арилокси, амино, моно- или диалкиламино, карбокси, алкилоксикарбонила. Термин "алкенил" в применении здесь включает в себя радикалы, как с прямой, так и с разветвленной цепью до 16 атомов углерода,такие как ноненил, деценил и додеценил. Предпочтительные алкенильные группы имеют до 8 атомов углерода. Примеры включают в себя аллил, бутенил, гексенил, октенил. 3 Термин "циклоалкил" в применении здесь обозначает циклоалкильную группу, имеющую 3-8 атомов углерода, предпочтительно от 3 до 5 атомов углерода. Примеры включают в себя циклопропил, циклопентил, циклогексил, циклогептил и циклооктил."Арильная" группа или фрагмент включает в себя как моноциклические, так и бициклические ароматические группы или фрагменты,обычно содержащие от 6 до 10 атомов углерода в кольцевой части, такие как фенил или нафтил,необязательно замещенные одним или несколькими заместителями, предпочтительно одним,двумя или тремя заместителями, выбранными изC1-6-алкила, C1-6-алкокси, трифторметила, галогена, гидрокси или арилокси. Термин "гетероциклил" в применении здесь обозначает 3-, 4-, 5- или 6-членное, насыщенное или ненасыщенное гетероциклическое кольцо, содержащее, по меньшей мере, один гетероатом, выбранный из О, S и N, которое необязательно конденсировано со второй 5- или 6-членной, насыщенной или ненасыщенной гетероциклильной группой или с вышеупомянутой циклоалкильной группой или арильной группой. Примерами гетероциклильных групп являются группы пирролил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиадиазолил, тиенил, фуранил, пиранил, пиридинил, дигидропиридинил, пиперидинил, пиперазинил, пиразинил, пиримидинил, пиридазинил, пирролидинил, морфолинил, бензимидазолил, бензотиазолил или бензоксазолил. Термин "галоген" в применении здесь обозначает фтор, хлор, бром или йод. Термин "аралкил" в применении здесь относится к алкильным группам, рассмотренным выше, замещенным вышеупомянутой арильной группой, например, к бензилу, фенетилу, дифенилметилу и трифенилметилу. Термин "алкокси", "арилокси" или "циклоалкоксил" в применении здесь включает в себя любую из вышеупомянутых алкильной, аралкильной или циклоалкильной групп, связанных с атомом кислорода. Термин "арилоксиалкил" в применении здесь обозначает любой алкил, обсужденный выше, связанный с арилом, обсужденным выше,атомом кислорода, например, феноксиэтил или феноксипропил. Термин "аминокислота" в применении здесь обозначает природно-встречающуюся аминокислоту, например, глицин, аланин, цистеин, фенилаланин, тирозин и т.п. Ацильная группа представляет собой обычно С 1-С 10-ацильную группу, например, C1-C6-ацильную группу, такую как метаноил, этаноил, пропаноил,бутаноил, трет-бутаноил, втор-бутаноил или гексаноил. 4 Данное изобретение включает в себя также все возможные изомеры соединений формулы(I) и их смеси, например, диастереоизомерные смеси и рацемические смеси. Так, стереоцентры в положении 7 и положении 9 могут быть в Rили S-конфигурации (или обеих, т.е. присутствует смесь стереоизомеров). Подобным образом, оксимы и гидразоны могут быть в форме син- или антиизомеров или смеси син- и антиизомеров. Данное изобретение относится также к соли соединений формулы 1, которые имеют солеобразующие группы, в частности, соли соединений, имеющих карбоксильную группу или основную группу (например, аминогруппу). Соли являются обычно физиологически переносимыми или фармацевтически приемлемыми солями, например, солями щелочных металлов или щелочно-земельных металлов (например, солями натрия, калия, лития, кальция и магния), солями аммония и солями с подходящими органическим амином или аминокислотой(например, солями аргинина, прокаина), и аддитивными солями, образованными с подходящими органическими или неорганическими кислотами, например, соляной кислотой, серной кислотой, моно- и дикарбоновыми кислотами и сульфоновыми кислотами (например, уксусной,трифторуксусной, винной, метансульфоновой,п-толуолсульфоновой кислотой). Соединения формулы 1, в которых R1, R2 и R3 имеют вышеуказанные значения, могут быть получены(а) взаимодействием соединения формулы 2(b) если желательно, преобразованием полученного соединения формулы 1 в другое соединение формулы 1 подходящей химической реакцией, и/или(c) преобразованием соединения формулы 1 в его фармацевтически приемлемую соль. Соединение формулы 2 обычно взаимодействует с соединением формулы R3-NН 2 илиR3-NH2HA, где R3 имеет вышеуказанное значение и НА обозначает неорганическую кислоту,обычно соляную или серную кислоту, в органическом растворителе, который обычно выбран из метанола, этанола, диоксана или толуола. Соединение R3-NH2 или R3-NH2HA обычно присутствует в 2-5-кратном избытке. При применении соединения формулы R3-NH2HA реакцию проводят в присутствии эквимолярного количества органического или неорганического основания. Основание обычно выбрано из аце 5 тата натрия и гидрокарбоната натрия или калия. Реакцию обычно проводят в течение периода 124 ч при температуре от комнатной температуры до приблизительно 100 С. Растворителем обычно является этанол и реакцию обычно проводят при 80 С в течение 2-4 ч. Соединения формулы R3-NН 2 или R3NH2HA обычно коммерчески доступны или они могут быть получены аналогично известным процедурам, сообщенным в литературе (см.,например, Houben-Weyl, Methoden der Organischen Chemie, vol. E 16a, Georg Thieme Verlag,Stuttgart 1990). Соединения формулы 1, в которых R1 и R2 имеют вышеуказанные значения и R3 представляет собой OR6, где R6 обозначает водород, могут быть преобразованы в соединения формулы 1, в которой R1 и R2 имеют вышеуказанные значения и R3 представляет собой ОR6, где R6 не является водородом или арилом, согласно известным методам, описанным в литературе (см.,например, J. Chem. Soc. 1949, 71, 3021 или Farmaco, Ed. Sci. 1990, 45, 1013). Соединения формулы 1, в которой R1 и R2 имеют вышеуказанные значения и R3 представляет собой OR6, где R6 не является водородом,могут быть преобразованы в соединения формулы 1, в которой R1 имеет вышеуказанные значения, R2 является ацильной группой формулы -C(R5)=O, где R5 имеет вышеуказанные значения, и R3 представляет собой OR6, где R6 не является водородом, согласно известным процедурам ацилирования. Это преобразование предпочтительно осуществляют взаимодействием соединения формулы 1, в которой R1 имеет вышеуказанные значения, R2 является водородом и R3 представляет собой OR6, где R6 не является водородом, с кислотой формулы R5COOH в присутствии конденсирующего агента,такого как диизопропилкарбодиимид, дициклогексилкарбодиимид или 2-этокси-1-этоксикарбонил-1,2-дигидрохинон (EEDQ). Предпочтительные условия реакции включают использование безводного растворителя, такого как дихлорметан или диметилформамид, при комнатной температуре в течение от 4 до 24 ч. Соединение формулы 1, в которой R1, R2 иR3 имеют вышеуказанные значения, может быть преобразовано в фармацевтически приемлемую соль растворением свободного основания в подходящем органическом растворителе, таком как дихлорметан, метанол, этанол или диоксан, и добавлением раствора фармацевтически приемлемой органической или неорганической кислоты в метаноле, этаноле или диоксане. Образующуюся соль соединения 1 получают выпариванием или концентрированием раствора или соль осаждают добавлением диэтилового эфира к раствору соли. При необходимости, на любой стадии этого процесса все возможные образующиеся диа 001887 6 стереоизомерные смеси и рацемические смеси могут быть разделены обычными способами. Оксимы и гидразоны могут быть получены в виде смесей син- и антиизомеров или в виде индивидуального изомера; эти смеси могут быть разделены на отдельные син- и антиизомеры известными способами, например,хроматографией. Соединения формулы 2, в которой R1 имеет вышеуказанные значения и R2 обозначает остаток RBСН 2, определенный выше, могут быть получены взаимодействием соединения формулы 3 где R1 имеет вышеуказанные значения и W обозначает уходящую (отщепляемую) группу, с амином формулыO-сахариды, такие как производные Oдауносаминила, O-ацил, такой как Oтрифторацетил или О-(п-нитробензоил) или Oэтоксикарбонил, и O-ацеталь, такой как Oтетрагидропиранил (O-ТНР). Предпочтительные амины формулы RBCH2-NH2 включают в себя аллиламин и алкилариламины, например, бензиламин, 3,4-диметоксибензиламин или пиридинметиламин. Соединение формулы 3 обычно реагирует с 1-10-кратным избытком амина формулыRBСН 2-NH2, определенной выше. Реакция может иметь место в подходящем органическом растворителе, таком как дихлорметан или пиридин. Может присутствовать органическое основание, такое как пиридин. Реакция может иметь место в течение периода 6-48 ч, обычно при температуре от -10 С до комнатной температуры. Предпочтительно используют четырехкратный избыток амина формулы RBСН 2-NН 2. Наиболее типичным растворителем является пиридин. Предпочтительными условиями реакции являются комнатная температура в течение 12-24 ч. Соединения формулы 2, в которой R1 имеет вышеуказанные значения и R2 обозначает водород, могут быть получены, например, удалением защиты у соединения формулы 2, где R1 имеет вышеуказанные значения и R2 является 3,4-диметоксибензилом, при помощи 2,3 дихлор-5,6-дициано-1,4-бензохинона(DDQ). Предпочтительные условия включают в себя применение эквивалентного количества DDQ в смеси дихлорметана и воды (обычно в соотношении 20:1 по объему). Реакцию обычно проводят при комнатной температуре в течение 1-6 ч. 7 Соединения формулы 2, где R1 имеет вышеуказанные значения и R2 обозначает C1-16 алкил, С 3-8-циклоалкил, вышеуказанную аралкильную или вышеуказанную арилоксиалкильную группу, могут быть получены из соединений формулы 2, в которой R1 имеет вышеуказанные значения и R2 обозначает водород, при помощи стандартных процедур алкилирования. Например, 8-N-алкил-, -алкенил-, -циклоалкил-,-аралкил- или арилоксиалкилантразалиноны формулы 2 предпочтительно получают взаимодействием соединения формулы 2, где R1 имеет вышеуказанные значения и R2 является водородом, с группой R2-X, где R2 обозначает C1-16 алкил, С 3-8-циклоалкил, вышеуказанный аралкил или вышеуказанный арилоксиалкил и Х обозначает удаляемую группу, такую как галоген, O-SO2 СF3, O-SO2-СН 3 или O-SO2-С 6 Н 4-СН 3. Предпочтительно, Х является галогеном, более предпочтительно, йодом или бромом. Обычно взаимодействие имеет место в присутствии подходящего органического или неорганического основания. Предпочтительные условия включают использование 2-10-кратного избытка R2X в органическом растворителе, таком как дихлорметан или диметилформамид, в присутствии триэтиламина, этилдиизопропиламина или гидрокарбоната натрия, при температуре от 40 до 80 С в течение 4-24 ч. Соединения формулы 2, где R1 имеет вышеуказанные значения и R2 является ацильной группой формулы -C(R5)=O, где R5 имеет вышеуказанные значения, предпочтительно получают взаимодействием соединения формулы 2, где R2 является водородом, с ацилпроизводным формулы R5-CO-Hal или (R5CO)2O, где R5 имеет вышеуказанные значения и Hal обозначает галоген, предпочтительно, хлор. Предпочтительные условия включают использование 2-10-кратного избытка ацилпроизводного в органическом растворителе, таком как дихлорметан или диметилформамид, при температуре от -10 до 40 С в течение 1-24 ч. В следующем примере соединения формулы 2, где R1 имеет вышеуказанные значения и R2 является ацильной группой формулы C(R5)=O, гдеR5 имеет вышеуказанные значения, или ацильным остатком аминокислоты, могут быть получены взаимодействием антразалинона формулы 2, гдеR2 является водородом, с производным кислоты формулы R5-COOH или с подходящим образом защищенной аминокислотой в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид или 2-этокси-1 этоксикарбонил-1,2-дигидрохинон (EEDQ) в безводном органическом растворителе. Предпочтительные условия включают использование 1-4-кратного избытка кислоты или защищенной аминокислоты в сухом органическом растворителе, таком как диметилформамид. Эквивалентное количество EEDQ обычно используют при комнатной температуре в течение 15 ч. 8 Соединения формулы 3 доступны из природных источников или могут быть получены при помощи следующих известных способов синтеза с известными антрациклинами или антрациклинонами в качестве исходных продуктов. Например, 7-O-сахарид, в котором сахаром является дауносаминил, может быть получен из природного источника, такого как даунорубицин, или может быть получен путем синтетической модификации. Другие агликоны, функционализованные в положении С-7, могут быть получены при помощи хорошо известных процедур. Например, производные 7-O-ТНР формулы 3 (W = O-ТНР) могут быть получены взаимодействием агликона формулы 4 с 3,4-дигидро-2 Н-пираном в органическом растворителе и в присутствии кислотного катализатора при комнатной температуре в течение 1-4 ч. Предпочтительные условия включают растворение агликона формулы 4 в дихлорметане и взаимодействие его с 4 эквивалентами 3,4 дигидро-2 Н-пирана в присутствии каталитического количества камфорсульфоновой или птолуолсульфоновой кислоты при комнатной температуре в течение 4 ч. Производное 7-OТНР выделяют промыванием реакционной смеси водным гидрокарбонатом натрия, водой и затем удалением растворителя при пониженном давлении. 7-O-Ацилпроизводные формулы 3 могут быть получены взаимодействием агликона формулы 4 с подходящей карбоновой кислотой,ангидридом карбоновой кислоты или ацилхлоридом в органическом растворителе в присутствии основания при температуре от -10 С до комнатной температуры в течение 1-6 ч. Например, 7-O-ацетилпроизводное формулы 3 (W = O-СОСН 3) может быть получено взаимодействием агликона формулы (4) с уксусным ангидридом в органическом растворителе, таком как дихлорметан и в присутствии органического основания, такого как пиридин. Соединение может быть выделено осаждением неочищенного материала в аполярном растворителе, таком как гексан. Некоторые из исходных продуктов для получения соединений формулы 2 являются известными, другие могут быть получены из известных антрациклинов и антрациклинонов в качестве исходных продуктов при помощи известных процедур. Например, следующие антрациклины являются известными и могут быть представлены той же самой формулой 3:R1=Н, W=O-дауносаминил), 4-аминодаунорубицин (3 с: R1=Н, W=O-дауносаминил). Также известны некоторые 7-О-производные формулы 3,например, 7-O-этоксикарбонилдауноми-цинон (3d:R1=ОСН 3, М=O-СООС 2 Н 5), 7-O-ТНР-дауномицинон (3 е: R1=ОСН 3, W=O-ТНР), 7-O-ацетилдауномицинон (3f: R1=ОСН 3, W=O-СОСН 3). Соединения данного изобретения характеризуются высокой ингибирующей активностью в отношении образования отложений амилоида амилоидогенными белками и способны индуцировать разрушение существующих отложений амилоида. Термин амилоидоз обозначает группу заболеваний, общей характеристикой которых является склонность определенных белков агрегировать и осаждаться в форме агрегатов нерастворимых фибрилл во внеклеточном пространстве. Агрегированный белок может, таким образом, вызвать структурное и функциональное повреждение органов и тканей. Классификация амилоида и амилоидоза недавно была пересмотрена в Bulletin of the World Health Organisation 1993, 71(1), 105. Все различные типы амилоида имеют общую ультраструктурную организацию в виде антипараллельных -складчатых листов, несмотря на тот факт, что они содержат разнообразные широко отличающиеся субъединицы белков [см: Glenner G.G., New England J. Med. 1980, 302, 1283]. Aмилоидоз AL вызывается своеобразными моноклональными легкими цепями иммуноглобулина, которые образуют амилоидные фибриллы. Эти моноклональные легкие цепи продуцируются моноклональными плазматическими клетками с низким митотическим индексом, который ответственен за их хорошо известную нечувствительность к химиотерапии. Злокачественность этих клеток состоит в их белоксинтезирующей активности. Клиническое развитие этого заболевания зависит от селективности участия органа; прогноз может быть крайне неблагоприятным в случае инфильтрации сердца (среднее выживание 12 месяцев) или более доброкачественным в случае участия почек (среднее выживание приблизительно 5 лет). Молекулы, которые могут блокировать или замедлять образование амилоида и увеличивать растворимость существующих отложений амилоида, представляются единственной разумной надеждой для пациентов с амилоидозом AL. Кроме того, поскольку надмолекулярная организация фибрилл амилоида является одинаковой для всех типов амилоида, доступность лекарственного средства, которое препятствует образованию амилоида и увеличивает растворимость существующих отложений, делая возможным выведение из организма при помощи нормальных механизмов, могла бы быть 10 использована при всех типах амилоидоза, в том числе амилоидоза центральной нервной системы, такого как болезнь Aльцгеймера и другие патологии. Действительно, одним из основных патологических признаков болезни Альцгеймера(БА), синдрома Дауна, Dementia pugilistica и амилоидной церебральной ангиопатии является отложение пептида из 39-43 аминокислот, называемого амилоидным -пептидом (А), в форме нерастворимых устойчивых к протеазам амилоидных отложений в паренхиме и на стенках сосудов мозга. Этот маркер связан с потерей нервных клеток в коре головного мозга, лимбических участках, и подкорковых ядрах. Некоторые исследования показали, что селективное повреждение различных нейронных систем и утрата синапса в лобной коре переднего мозга коррелируют со снижением познавательной функции. Патогенез и молекулярная основа этих нейродегенеративных процессов в БА не вполне понятны, но осаждение А-пептидов в форме отложений амилоида в мозгу, возможно, играет центральную роль в генезе этого заболевания. В самом деле, нейротоксические эффекты in vitroA-пептидов на различных клеточных системах,в том числе первичных культивируемых нейронах, сообщались многими исследователямиNeurosci. 1992, 12, 376; Mattson et al., Brain Res. 1993, 621, 35; Pike et al., J. Neurosci. 1993, 13,1676]. Кроме того, сегрегация семейной БА с мутациями в гене белка-предшественника амилоида (АРР) предполагает потенциальную патогенетическую функцию отложения -амилоида в БА [Mullan M. Et al. TINS 1993, 16, 392]. Действительно, растворимая форма А-пептидов продуцируется in vivo и in vitro как результат нормального клеточного метаболизма [Haass et al.Nature 1993, 359, 322]. Нейротоксичность А-пептидов связывали с их фибриллогенными свойствами. Исследования с синтетическими пептидами свидетельствуют о том, что нейроны гиппокампа никак не реагировали при выдерживании со свежим раствором А-40 или A-42 в течение 24 ч, тогда как их жизнеспособность уменьшалась при выдерживании их с А-40 или А-42, предварительно хранящимися в солевых растворах в течение 2-4 дней при 37 С для агрегации пептидов[Lorenzo and Yankner PNAS 1994, 91, 12243]. С другой стороны, неконгофильные "преамилоидные" образования, содержащие неагрегированные А-пептиды, не были связаны с изменением нейронов [Tagliavini et al., Neurosci 11 Нейротоксические и фибриллогенные свойства полноразмерных А-пептидов были также обнаружены в более коротком фрагменте,включающем в себя 25-35 остатков (A25-35) последовательности А. Продолжительное, но не резкое экспонирование нейронов гиппокампа с микромолярной концентрацией A25-35 индуцировало некроз нервных клеток активацией механизма запрограммированной смерти клеток, известной как апоптоз [Forloni et al.,NeuroReport 1993, 4, 523]. В этом случае нейротоксичность также была связана с самоагрегирующим свойством А 25-35. Другие нейродегенеративные расстройства, такие как губчатая энцефалопатия (ГЭ),характеризуются некрозом нервных клеток и внеклеточным отложением амилоида, в этом случае происходящего из белка Приона (PrP). По аналогии с наблюдением, что -амилоид является нейротоксичным, исследовали действия синтетических пептидов, гомологичных различным сегментам PrP, на жизнеспособность первичных крысиных нейронов гиппокампа. Продолжительное нанесение пептида, соответствующего фрагменту PrP 106-126, индуцировало некроз нейронов по механизму апоптоза, тогда как при тех же самых условиях беспорядочно собранная последовательность PrP 106-126 не снижала жизнеспособность клеток [Forloni etvitro и при окрашивании Конго красным агрегаты пептида обнаруживают зеленое двойное лучепреломление, свидетельствующее о листовой конформации, характерной для амилоида. Способность соединений формулы 1 ингибировать образование амилоидных фибрилл оценивали при помощи тестов со светорассеянием и с тиофлавином Т. Тест светорассеяния выполняли, как описано ниже.(KTNMKHMAGAAAAGAWGGLG) синтезировали при помощи твердофазной химии с использованием приборов 430 А Applied Biosystems Instruments и очищали обращенно-фазовой ВЖХ (Beckman Inst. mod 243) в соответствии сForloni et al., Nature 1993, 362, 543. Светорассеяние растворов пептидов оценивали при помощи спектрофлуориметрии (Perkin Elmer LS 50 В), возбуждение и эмиссию наблюдали при 600 нм. При растворении А-фрагмента 25-35 и РrР 106-126 в концентрации 0,5-1 мг/мл (0,4-0,8 мМ и 0,2-0,4 мМ, соответственно) в растворе 10 мМ фосфатного буфера рН 5, они спонтанно агрегируют в пределах часа. При добавлении соединений формулы 1 к растворам пептидов в эквимолярной концентрации наблюдали предотвращение агрегации. 12 Тест с тиофлавином Т измеряет способность тест-соединения ингибировать агрегацию пептида в амилоидные фибриллы. Образование амилоида определяли количественно по флуоресценции тиофлавина Т. Тиофлавин Т связывается специфически с фибриллами амилоида, и это связывание производит смещение в его спектрах поглощения и эмиссии: интенсивность сигнала флуоресценции прямо пропорциональна массе образованного амилоида. Этот тест проводили, как описано ниже. Исходные растворы пептида А 25-36 готовили растворением лиофилизированного пептида в диметилсульфоксиде (ДМСО) при концентрации 7,07 мг/мл. Аликвоты этого раствора растворяли в 50 мМ фосфатном буфере, рН 5, так чтобы получить конечную концентрацию пептида 100 мкМ,и инкубировали в течение 24 ч при 25 С с 30 мкМ тест-соединением, или без него, в конечном объеме 113 мкл. Соединения предварительно растворяли в ДМСО при концентрации 3,39 мМ и затем разбавляли водой таким образом,чтобы иметь менее 3% ДМСО (об/об) в инкубационных смесях. Измерения флуоресценции проводили, как описано Naiki et al., Anal. Biochem. 1989, 177,244 и Н. Levin III, Pritein Sci. 1993, 2, 404. Вкратце, инкубированные пробы разбавляли при концентрации пептида 8 мг/мл в 50 мМ натрий-цитратном буфере, рН 5, содержащем 47 мМ тиофлавин Т в конечном объеме 1,5 мл. Флуоресценцию измеряли с возбуждением при 420 нм и эмиссией при 490 нм в спектрофотометре Kontron fluorescence spectrophotometer и получали средние величины после вычитания фоновой флуоресценции 47 MM ThT. Результаты выражали в виде относительной флуоресценции, т.е. в виде процента флуоресценции пептида А 25-35, инкубированного отдельно (контроля). Соединения 1 уменьшали флуоресценцию тиофлавина Т до 90% при совместном инкубировании с раствором пептида, и было обнаружено, что их токсичность была очень незначительной. Активность соединений, описанных в данном патенте, показана также их противодействием запускаемой затравкой агрегации пептида A1-40 в мономерной форме. Активность описанных соединений оценивали в соответствии с процедурой, описанной ниже. Исходный раствор мономера пептида A140 готовят растворением этого пептида в диметилсульфоксиде при концентрации 33,33 мг/мл. Этот исходный раствор дополнительно разбавляют 1:11,5 диметилсульфоксидом. Затем этот раствор разбавляют 10 мМ фосфатным буфером, рН 7,4, содержащим 150 мМ хлорид натрия, с получением тест-раствора. В пробирку Эппендорфа, содержащую 47 мкл раствора мономера пептида A1-40, добав 13 ляют 3 мкл 830 мкМ водного раствора тестсоединения, содержащего 66,4 мкМ, в расчете на содержание мономера A1-40, предварительно образованных обработанных ультразвуком фибрилл A1-40: полученный раствор является 20 мкМ в отношении мономера A1-40, 50 мкМ в отношении тест-соединения и содержит 4 мкМ, в расчете на содержание мономера A140, предобразованных обработанных ультразвуком фибрилл. Агрегации дают происходить в течение двух часов при 37 С. Затем суспензию центрифугируют при 15000 об/мин в течение 15 мин при +4 С, супернатант собирают и мономерA1-40 измеряют количественно при помощи ВЖХ. Активность некоторых репрезентативных соединений представлена в таблице 1. Активность выражена в виде процента ингибирования агрегации 20 мкМ раствора мономераApl-40, стимулированной 4 мкМ, в расчете на содержание мономера A1-40, предварительно образованными обработанными ультразвуком фибриллами. Соединение 1 а 1 с 1 е 1p 1q 1ac-I Соединения данного изобретения могут быть использованы для приготовления лекарственных средств для предупреждения, для остановки или для замедления образования или для индукции деградации отложений амилоида, которые образуются различными амилоидогенными белками. Таким образом, соединения данного изобретения могут быть использованы при профилактике и лечении различных типов амилоидозных заболеваний. Амилоидозные заболевания включают в себя периферические амилоидозы, подобные амилоидозу AL, амилоидозы центральной нервной системы, подобные болезни Альцгеймера, синдрому Дауна,губчатым энцефалопатиям и т.п. Данное изобретение относится к фармацевтической композиции, содержащей соединение формулы (1) или его фармацевтически приемлемую соль в качестве активного ингредиента, вместе с фармацевтически приемлемым носителем, наполнителем или другой добавкой,если необходимо. Также предложено соединение формулы(1), определенное выше, или его фармацевтически приемлемая соль для применения в лечении организма человека или животного. Кроме того,данное изобретение относится к применению соединения формулы (1) или его фармацевтически приемлемой соли при получении лекарст 14 венного средства для лечения заболевания, связанного с амилоидозом. Фармацевтические композиции, содержащие соединение формулы 1 или его соли, могут быть приготовлены общепринятым образом с использованием общепринятых нетоксических фармацевтических носителей или разбавителей в разнообразных дозированных формах и для разных путей введения. В частности, соединения формулы 1 могут вводиться: А) перорально, например, в виде таблеток,пастилок, лепешек, водной или масляной суспензии, диспергируемых порошков или гранул,эмульсий, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального применения, могут быть приготовлены согласно любому способу, известному в данной области, для приготовления фармацевтических композиций, и такие композиции могут содержать один или несколько агентов, выбранных из группы, состоящей из подслащивающих агентов, улучшающих вкус и запах агентов, красящих агентов и консервантов для обеспечения фармацевтически изящных и вкусных препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые пригодны для приготовления таблеток. Этими наполнителями могут быть, например, инертные разбавители,такие как карбонат кальция, карбонат натрия,лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты,например, кукурузный крахмал или альгиновая кислота; связывающие агенты, например, кукурузный крахмал, желатин или аравийская камедь, и смачивающие агенты, например, стеарат магния или стеариновая кислота или тальк. Таблетки могут не иметь покрытия или они могут быть покрыты известными способами для замедления разрушения их и всасывания в желудочно-кишечном тракте и обеспечения тем самым устойчивого действия на протяжении более продолжительного периода. Например, может быть использован такой материал для замедления действия, как глицерилмоностеарат или глицерилдистеарат. Препарат для перорального применения может быть также представлен в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой,например, арахисовым маслом, жидким парафином или оливковым маслом. Водные суспензии содержат активные вещества в смеси с наполнителями, пригодными для изготовления водных суспензий. 15 Такими наполнителями являются суспендирующие агенты,например,натрийкарбоксиметилцеллюлоза,метилцеллюлоза,гидрокси-, пропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующими или смачивающими агентами могут быть природно-встречающиеся фосфатиды, например,лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, стеарат полиоксиэтилена, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с неполными эфирами,произведенными из жирных кислот и ангидридов гексита, например, моноолеат полиэтиленсорбитана. Вышеуказанные водные суспензии могут также содержать один или несколько консервантов, например, этил- или н-пропил-пгидроксибензоат, один или несколько красящих агентов, один или несколько улучшающих вкус и запах агентов или один или несколько подслащивающих агентов, таких как сахароза или сахарин. Масляная суспензия может быть приготовлена суспендированием активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Могут быть добавлены подслащивающие агенты, такие как изложенные выше,и улучшающие вкус и запах агенты для обеспечения вкусной пероральной композиции. Эти композиции могут сохраняться путем добавления аутооксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы, пригодные для получения водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Примеры подходящих диспергирующих или смачивающих агентов уже указаны выше. Могут также присутствовать дополнительные наполнители, например, подслащивающие, улучшающие вкус и запах агенты. Фармацевтические композиции по данному изобретению могут быть также в форме эмульсий типа масло-в-воде. Масляной фазой может быть растительное масло, например,оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин,или их смеси. Пригодными эмульгирующими агентами могут быть природные камеди, например, ара 001887 16 вийская камедь или трагакантовая камедь, природные фосфатиды, например, соя, лецитин и эфиры или неполные эфиры, произведенные из жирных кислот и ангидридов гексита, например,моноолеат сорбитана, и продукты конденсации вышеуказанных неполных эфиров с этиленоксидом,например,моноолеат полиоксиэтиленсорбитана. Эмульсия может также содержать подслащивающие и улучшающие вкус и запах агенты. Могут быть приготовлены сиропы и эликсиры с подслащивающими агентами, например, глицерином, сорбитом или сахарозой. Такие препараты могут также содержать средство, уменьшающее раздражение, консервант и улучшающие вкус и запах агенты. В) Парентерально, либо подкожно, или внутривенно, или внутримышечно, или внутригрудинно, либо инфузионными способами, в форме стерильной инъекционной водной или маслянистой суспензии. Эти фармацевтические композиции могут быть в форме стерильных инъекционных водных или маслянистых суспензий. Такая суспензия может быть приготовлена в соответствии с известными в данной области способами с использованием пригодных диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше. Стерильный инъекционный препарат может быть также стерильным инъецируемым раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3 бутандиоле. Среди приемлемых носителей и растворителей, которые могут быть применены,находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели является общепринятым применение любых мягких нелетучих масел, в том числе синтетических моно- или диглицеридов. Кроме того, в приготовлении инъекционных растворов используют жирные кислоты, такие как олеиновая кислота. Данное изобретение относится далее к способу лечения человека или животного, например, млекопитающего, страдающего от заболевания амилоидоза или подверженного этому заболеванию, предусматривающему введение ему нетоксичного и терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли. Обычной дневной дозой является доза от 0,1 до 50 мг на кг веса тела, в соответствии с активностью конкретного соединения, возрастом, весом и состоянием субъекта, который проходит лечение, типом и тяжестью заболевания и частотой и путем введения; предпочтительно дневные уровни дозы находятся в пределах 5 мг - 2 г. Количество актив 17 ного ингредиента, которое может быть комбинировано с веществами-носителями для получения дозированной формы для одного приема,будет меняться в зависимости от проходящего лечение хозяина и конкретного способа введения. Например, композиция, предназначенная для перорального введения, может содержать от 5 мг до 2 г активного агента, компаундированного с подходящим и удобным количеством вещества-носителя, которое может быть в варьирующем количестве от 5 до 95 процентов всей композиции. Дозированные стандартные формы обычно содержат от 5 мг до 500 мг активного ингредиента. Следующие далее примеры иллюстрируют изобретение без его ограничения. Пример 1. Оксим 8-N-(3,4-диметоксибензил)антразалона (1 а) Стадия 1. Даунорубицин (3 а, 1,58 г, 3 ммоль) растворяли в сухом пиридине (20 мл), добавляли 3,4 диметоксибензиламин (2 г, 12 ммоль) и выдерживали при комнатной температуре в течение 16 ч. Затем к реакционной смеси добавляли водную 1 н НСl (400 мл) и экстрагировали дихлорметаном (200 мл). Органическую фазу промывали водой (2 х 200 мл), сушили над безводным сульфатом натрия, концентрировали до небольшого объема при пониженном давлении и флэш-хроматографировали на силикагеле с использованием смеси толуол-ацетон (9:1 по объему) в качестве системы элюции с получением 1 г 8-N-(3,4-диметоксибензил)антразалона 2 а (R1=ОСН 3, R2 3,4-диметоксибензил). ТСХ на пластинке силикагеля F254 (Merck), система элюции дихлорметан-ацетон (95:5 по объему)H-ЯМР (400 МГц, CDCl3) : 1,43 (с, 3 Н, СН 3); 2,34 (д, J=17,5 Гц, 1 Н,СН(Н)-12); 2,66, 2,77(два дублета, J=19,4 Гц, 2 Н,СН 2-10); 2,81 (дд, J=7,3, 17,5 Гц, 1 Н, СН(Н)-12); 3,24, 3,79 (два дублета, J=12,8 Гц, 2 Н, N-CH2Ph); 3,85, 3,86 (2 хс, 6 Н, 2 хОСН 3); 4,08 (с, 3 Н, 4 ОСН 3); 4,77 (д, J=7,3 Гц, 1H, Н-7); 6,6-6,8 (м, 3 Н,ароматические водороды); 7,38 (д, J=7,6 Гц, 1H,Н-3); 7,77 (дд, J=7,6, 7,8 Гц, 1H, Н-2); 8,03 (д,J=7,8 Гц, 1H, Н-1); 13,22 (с, 1H, ОН-11); 13,50 (с,1H, ОН-6). Стадия 2. Раствор 8-N-(3,4-диметоксибензил)антразалона 2 а (1 г, 1,89 ммоль) в 30 мл этанола обрабатывали гидрохлоридом гидроксиламина 1(0,2 г, 2,83 ммоль) и ацетатом натрия (0,38 г,2,83 ммоль) и нагревали при температуре дефлегмации в течение 3 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду,органическую фазу отделяли и сушили над безводным сульфатом натрия. Раствор концентрировали до небольшого объема, добавляли диэтиловый эфир и осажденный оксим (1 а) собирали: 0,55 г (выход 54%). Стадия 1. Даунорубицин (3 а, 1,58 г, 3 ммоль) реагировал с аллиламином (0,9 г, 12 ммоль), как описано для получения 2 а в примере 1. Неочищенный материал флэш-хроматографировали на силикагеле с использованием смеси дихлорметана и ацетона (98:2 по объему) в качестве системы элюции с получением 0,85 г 8-Nаллилантразалона 2b (R1=OCH3, R2=аллил). ТСХ на пластинке силикагеля F254 (Merck),система элюции дихлорметан-ацетон (95:5 по объему) Rf=0,1. 1H-ЯМР (200 МГц, CDCl3) : 1,37 (с, 3 Н, СН 3); 2,41 (д, J=17,6 Гц, 1 Н,СН(Н)-12); 2,64 (м, 2 Н, СН 2-10); 2,88 (дд, J=7,2,17,6 Гц, 1 Н, СН(Н)-12); 2,8-3,4 (м, 2 Н,СH2 СН=СН 2); 4,04 (с, 3 Н, 4-ОСН 3); 5,0-5,2 (м,2 Н, CH2CH=CH2); 5,90 (м, 1 Н, СН 2 СН=СН 2); 7,37 (д, J=8,4 Гц, 1 Н, Н-3); 7,75 (дд, J=7,6, 8,4 Гц, 1 Н, H-2); 8,00 (д, J=7,6 Гц, 1 Н, Н-1); 13,0,13,5 (2 хс, 2 Н, ОН-6 + ОН-11). Стадия 2. Раствор 8-N-аллилантразалона 2b (1,5 г,3,58 ммоль) в 30 мл этанола обрабатывали гидрохлоридом гидроксиламина (0,41 г, 5,8 ммоль) и ацетатом натрия (0,47 г, 5,8 ммоль) и нагревали при температуре дефлегмации в течение 3 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли и сушили над безводным сульфатом натрия. Раствор концентрировали до небольшого объема, добавляли н-гексан и осажденный ок 19 сим (1b). Собирали 1,2 г (выход 77%). FAB-MS: Раствор 8-N-аллилантразалона 2b, полученного, как описано в примере 2, (0,5 г, 1,19 ммоль) в 15 мл этанола обрабатывали гидрохлоридом O-метилгидроксиламина (0,2 г, 2,38 ммоль) и ацетатом натрия (0,2 г, 2,38 ммоль) и нагревали при температуре дефлегмации в течение 4 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли и сушили над безводным сульфатом натрия. Реакционную смесь флэшхроматографировали на силикагеле с использованием смеси циклогексан-этилацетат (80:20 по объему) с получением 0,15 г (выход 28%) соединения 1 с. ТСХ на пластинке силикагеля F254(дд, J=0,8, 8,5 Гц, 1 Н, Н-3); 7,75 (дд, J=7,7, 8,5 Гц, 1 Н, Н-2); 8,01 (дд, J=0,8, 7,7 Гц, 1 Н, Н-1)4 13,23, 13,56 (два с, 2 Н, ОН-6 + ОН-11). Действуя, как описано в предыдущих примерах, можно также получить следующие соединения. Пример 4. 20 Раствор 8-N-(3,4-диметоксибензил)антразалона 2 а (1 г, 1,88 ммоль), полученного, как описано в примере 1, в 30 мл этанола обрабатывали гидрохлоридом O-метилгидроксиламина(0,62 г, 7,42 ммоль) и ацетатом натрия (1,01 г,7,42 ммоль) и нагревали при температуре дефлегмации в течение 24 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и выпаривали. Остаток растирали с диэтиловым эфиром и фильтровали с получением 0,69 г (выход 65%) соединения 1 е. Соединение 1 е превращали в гидрохлоридную соль добавлением раствора хлористоводородной кислоты в метаноле к раствору этого соединения в дихлорметане и осаждали гидрохлоридную соль диэтиловым эфиром. Раствор 8-N-(3,4-диметоксибензил)антразалона 2 а (0,5 г, 0,94 ммоль) , полученного, как описано в примере 1, в 30 мл этанола обрабатывали гидрохлоридомO-бензилгидроксиламина (0,30 г, 1,88 ммоль) и ацетатом натрия (0,26 г, 1,88 ммоль) и нагревали при температуре дефлегмации в течение 12 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Реакционную смесь флэш-хроматографировали на силикагеле с использованием смеси дихлорметанацетон (95:5 по объему) с получением 0,30 г Стадия 1. Даунорубицин (3 а, 1,58 г, 3 ммоль) растворяли в сухом пиридине (20 мл), добавляли 4 аминометилпиридин (1,2 г, 12 ммоль) и выдерживали при комнатной температуре в течение 16 ч. Затем к реакционной смеси добавляли водную 1 н НСl (400 мл) и экстрагировали дихлорметаном (200 мл). Органическую фазу промывали водой (2 х 200 мл), сушили над безводным сульфатом натрия, концентрировали до небольшого объема при пониженном давлении и флэш-хроматографировали на силикагеле с использованием смеси толуол-ацетон (9:1 по объему) в качестве системы элюции с получением 0,95 г (выход 67%) 8-N-(4-пиридилметил) антразалона 2 с (R1=ОСН 3, R2=4-пиридилметил).(д, J=6,0 Гц, 2 Н, C6H5N); 13,14 (с, 1 Н, ОН-11); 13,45 (с, 1 Н, ОН-6). Стадия 2. Раствор 8-N-(4-пиридилметил)антразалона 2 с (0,5 г, 1,06 ммоль) в 30 мл этанола обрабатывали гидрохлоридом O-метилгидроксиламина(0,18 г, 2,15 ммоль) и ацетатом натрия (0,29 г,2,15 ммоль) и нагревали при температуре дефлегмации в течение 12 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Остаток флэшхроматографировали на силикагеле с использованием смеси дихлор-метан-ацетон (80:20 по объему) с получением 0,18 г (выход 34%) соединения 1 р. Раствор 8-N-(4-пиридилметил)антразалона 2 с (0,5 г, 1,06 ммоль) в 30 мл этанола обрабатывали гидрохлоридом O-бензилгидроксиламина(0,4 г, 2,51 ммоль) и ацетатом натрия (0,34 г,2,51 ммоль) и нагревали при температуре дефлегмации в течение 6 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду,органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Остаток флэшхроматографировали на силикагеле с использованием смеси дихлорметан-ацетон (80:20 по объему) с получением 0,19 г (выход 31%) соединения 1q. Раствор 8-N-аллилантразалона 2b (0,6 г,1,43 ммоль), полученного, как описано в примере 2, в 15 мл этанола обрабатывали гидрохлоридом O-этилгидроксиламина (0,27 г, 2,77 ммоль) и ацетатом натрия (0,36 г, 2,77 ммоль) и нагревали при температуре дефлегмации в течение 4 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Реакционную смесь флэш-хроматографировали на силикагеле с использованием смеси циклогексан-этилацетат (90:10 по объему) с получением 0,43 г (выход 65%) соединения 1w. Раствор 8-N-аллилантразалона 2b (0,5 г,1,19 ммоль), полученного, как описано в примере 2, в 15 мл этанола обрабатывали N 001887 24 метилгидразином (0,45 г, 9,52 ммоль) и нагревали при температуре дефлегмации в течение 24 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Реакционную смесь флэш-хроматографировали на силикагеле с использованием смеси дихлорметан-метанол (95:5 по объему) с получением 0,31 г (выход 58%) соединения 1 у. Раствор 8-N-(4-пиридилметил)антразалона 2 с (0,5 г, 1,06 ммоль) в 30 мл этанола обрабатывали гидрохлоридом O-этилгидроксиламина (0,4 г, 4,1 ммоль) и ацетатом натрия (0,56 г, 4,1 ммоль) и нагревали при температуре дефлегмации в течение 16 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и выпаривали. Остаток растирали со смесью этанола и диэтилового эфира, фильтровали и промывали той же самой смесью с получением 0,5 г (выход 92%) указанного в заголовке соединения 1 х. 25 Раствор 8-N-(4-пиридилметил)антразалона 2 с (0,5 г, 1,06 ммоль) в 30 мл этанола обрабатывали гидрохлоридом О-(4-пиридилметил)гидроксиламина(0,42 г, 2,61 ммоль) и ацетатом натрия (0,36 г, 2,61 ммоль) и нагревали при температуре дефлегмации в течение 4 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Остаток флэшхроматографировали на силикагеле с использованием смеси хлороформ-метанол (20:1 по объему) с получением 0,23 г (выход 38%) соединения lz. Соединение превращали в гидрохлоридную соль, как описано в примере 5.(DDQ, 0,5 г, 1,89 ммоль) при комнатной температуре. После 4 ч реакционную смесь промывали 5% водным гидрокарбонатом натрия (3 х 200 мл), затем водой. Органическую фазу сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением 0,61 г (85%) антразалона 2d (R1=OCH3,R2=H).H-ЯМР (400 МГц, СDСl3) : 1,45 (с, 3 Н, СН 3); 2,43 (д, J=17,5 Гц, 1 Н,СН(Н)-12); 2,76, 2,84 (два дублета, J=19,2 Гц,2 Н, СН 2-10); 2,86 (дд, J=7,3, 17,5 Гц, 1 Н, СН(Н)12); 4,08 (с, 3 Н, ОСН 3); 5,14 (д, J=7,3 Гц, 1 Н, Н 7); 7,37 (д, J=8,5 Гц, 1 Н, Н-3); 7,76 (дд, J=7,7, 8,5 Гц, 1 Н, Н-2); 8,01 (д, J=7,7 Гц, 1 Н, Н-1); 13,14 (с,1 Н, ОН-11); 13,60 (с, 1 Н, ОН-6). Стадия 2. Раствор антразалона 2 с 1 (0,5 г, 1,32 ммоль) в 30 мл этанола обрабатывали гидрохлоридом гидроксиламина (0,14 г, 2 ммоль) и ацетатом натрия (0,27 г, 2 ммоль) и нагревали при температуре дефлегмации в течение 3 ч. Растворитель выпаривали. Остаток помещали в дихлорметан 26 и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Остаток флэшхроматографировали на силикагеле с использованием смеси хлороформ-метанол (48:2 по объему) с получением 0,06 г (выход 12%) соединения 1 аа в виде смеси 1:1 Е- и Z-оксимов. Раствор антразалона 2d (0,5 г, 1,32 ммоль) в 30 мл этанола обрабатывали гидрохлоридомO-метилгидроксиламина (0,33 г, 3,9 ммоль) и ацетатом натрия (0,53 г, 3,9 ммоль) и нагревали при температуре дефлегмации в течение 12 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Остаток флэш-хроматографировали на силикагеле с использованием смеси дихлорметан-ацетон Раствор антразалона 2d (0,5 г, 1,32 ммоль) в 30 мл этанола обрабатывали гидрохлоридомO-этилгидроксиламина (0,51 г, 5,2 ммоль) и ацетатом натрия (0,71 г, 5,2 ммоль) и нагревали при температуре дефлегмации в течение 24 ч. 27 Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и концентрировали до небольшого объема. Остаток флэш-хроматографировали на силикагеле с использованием смеси гексан-этилацетатметанол (50:20:5 по объему) с получением 0,085 г (выход 15%) менее полярного изомера соединения 1ac-I, т.пл. 258-261 С (разл.) и 0,095 г(выход 17%) более полярного изомера соединения 1ac-II, т.пл. 147-149 С. Раствор антразалона 2d (0,43 г, 1,13 ммоль) в 30 мл этанола обрабатывали гидрохлоридомO-бензилгидроксиламина (0,36 г, 2,26 ммоль) и ацетатом натрия (0,31 г, 2,26 ммоль) и нагревали при температуре дефлегмации в течение 16 ч. Растворитель выпаривали. Остаток помещали в дихлорметан и воду, органическую фазу отделяли, сушили над безводным сульфатом натрия и выпаривали. Остаток растирали с диэтиловым эфиром с получением 0,28 г (выход 51%) соединения 1ad. К раствору O-метилоксима антразалона 1ab (0,117 г, 0,29 ммоль) в 5 мл безводного дихлорметана добавляли 2-(4-пиридил)-уксусную кислоту (0,05 г, 0,29 ммоль), триэтиламин (0,04 мл, 0,29 ммоль) и 4-диметиламинопиридин(0,017 г, 0,145 ммоль). Реакционную смесь охлаждали при 0 С и добавляли N,N'диизопропилкарбодиимид (0,051 мл, 0,33 ммоль) при перемешивании. Реакцию перемешивали в течение 5 ч при комнатной температуре, выливали в буферный раствор с рН 3 и экстрагировали дважды дихлорметаном. Органическую фазу промывали буферным раствором с рН 7 и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растирали с диэтиловым эфиром. Твердое вещество собирали и промывали основательно диэтиловым эфиром с получением 0,08 г (выход 52%) указанного в заголовке соединения (1ae).FAB-MS(+): m/z 500 [МН]+; 350 [М СН 2(С 6 Н 3) (ОСН 3)22 + 2H]+; Стадия 2. Раствор 4-диметокси-8-N-(3,4-диметоксибензил)антразалона 2 е (0,5 г, 1 ммоль) в 30 мл этанола обрабатывали гидрохлоридом гидроксиламина (0,15 г, 2,16 ммоль) и ацетатом натрия (0,29 г, 2,16 ммоль) и нагревали при температуре дефлегмации в течение 8 ч. Осадок фильтровали, промывали смесью этанол-вода,затем этанолом и сушили с получением 0,4 г(0,29 г, 2,15 ммоль) в качестве исходных продуктов . 30 10); 3,18, 3,80 (два дублета, J=12,7 Гц, 2 Н, NCH2-Аr); 3,81, 3,84, 3,86 (три синглета, 9 Н,ОСН 3); 4,58 (д, J=6,1 Гц, 1 Н, Н-7); 6,80 (м, 3 Н,С 6 Н 3-(ОСН 3)2); 7,85 (м, 2 Н, Н-2 + Н-3); 8,36 (м,2 Н, Н-1 + Н-4); 13,15, 13,30 (два синглета, 2 Н,ОН-6 + ОН-11). Пример 33. Таблетки, содержащие следующие ингредиенты, могут быть приготовлены общепринятым способом: Ингредиент Соединение 1 Лактоза Кукурузный крахмал Тальк Стеарат магния Общий вес Пример 34. Капсулы, содержащие следующие ингредиенты, могут быть приготовлены общепринятым способом: Ингредиент Соединение 1 Лактоза Кукурузный крахмал Тальк Вес капсулы где R1 выбран из водорода и низшего алкоксила,R2 выбран из водорода, C1-4-алкила, аллила, бензила, необязательно замещенного одним-тремя заместителями, выбранными из группы, включающей трифторметил, C1-4-алкил, C1-4-алкокси,галоген и гидрокси; пиридинометил, пиридинометилкарбонил;R3 выбирают из групп гидроксила, C1-4 алкокси, бензилокси, метиламино или 4 пиридинметилокси, 4-морфолинила, 4-метилпиперазинила, при условии, что когда R1 представляет собой метоксигруппу иR3 гидроксигруппу, R2 отличен от 4-пиридинметила, или его фармацевтически приемлемая соль. 2. Соединение по п.1, в котором R1 выбран из водорода и метокси, R2 выбран из водорода,метила, аллила, бензила, 3-бромбензила, 4 трифторметилбензила, 4-метоксибензила, 3,4 диметоксибензила, 3,5-ди-трет-бутил-4-гидроксибензила, пиридинметила, никотиноила,R3 выбран из гидрокси, метокси, этокси,бензилокси, 4-пиридинметилокси, метиламино,4-морфолинила, 4-метилпиперазинила, или его фармацевтически приемлемая соль. 3.Соединение по п.1, которое выбрано из оксима 8-N-(3,4-диметоксибензил)антразалона,оксима S-N-аллилантразалона, O-метилоксимаS-N-аллилантразалона и O-этилоксима антразалона, или их фармацевтически приемлемых солей. 4. Способ получения соединения формулы 1, определенной в п.1,а) взаимодейстивем соединения формулы 2(b) при необходимости, преобразование полученного таким образом соединения формулы (1) в другое соединение формулы (1) и/или(с) при необходимости, превращение соединения формулы (1) в его фармацевтически приемлемую соль. 5. Способ по п.4, где на стадии (а) соединение формулы 2, определенное в п.4, взаимодействует с соединением формулы R3-NH2HA,где НА обозначает неорганическую кислоту, в органическом растворителе в присутствии органического или неорганического основания. 6. Фармацевтическая композиция, которая содержит в качестве активного ингредиента соединение формулы 1, определенное в любом из пп.1-3, или его фармацевтически приемлемую соль, в смеси с фармацевтически приемлемым носителем или разбавителем. 7. Соединение формулы 1, определенное в любом из пп.1-3, или его фармацевтически приемлемая соль для применения в лечении организма человека или животного. 8. Применение соединения формулы 1, определенного в любом из пп.1-3, или его фармацевтически приемлемой соли при получении лекарственного средства для лечения амилоидоза AL, болезни Альцгеймера или синдрома Дауна. 9. Способ лечения человека или животного, страдающего от заболевания амилоидоза,или подверженного этому заболеванию, предусматривающий введение ему нетоксичного и эффективного количества соединения формулы(1), определенного в любом из пп.1-3, или его фармацевтически приемлемой соли.
МПК / Метки
МПК: A61P 25/28, A61K 31/435, C07D 471/08
Метки: производные, амилоидоза, иминоазаантрациклинона, лечения
Код ссылки
<a href="https://eas.patents.su/17-1887-proizvodnye-iminoazaantraciklinona-dlya-lecheniya-amiloidoza.html" rel="bookmark" title="База патентов Евразийского Союза">Производные иминоазаантрациклинона для лечения амилоидоза</a>
Предыдущий патент: Стекло с солнцезащитным покрытием
Следующий патент: Производные циклопентанонов, способ их получения и фармацевтические препараты на их основе
Случайный патент: Катализатор дегидрирования и способ получения носителя катализатора дегидрирования





















