Производные циклопентанонов, способ их получения и фармацевтические препараты на их основе
Номер патента: 1888
Опубликовано: 22.10.2001
Авторы: Сагава Хироаки, Койама Нобуто, Икаи Кацусиге, Нисийама Ейдзи, Ву Хуа-Канг, Еноки Тацудзи, Тоно Хидето, Томинага Таканари, Охноги Хирому, Хагийа Митио, Като Икуносин
Формула / Реферат
1. Соединение следующей формулы [I] или его оптически активный антипод или соль
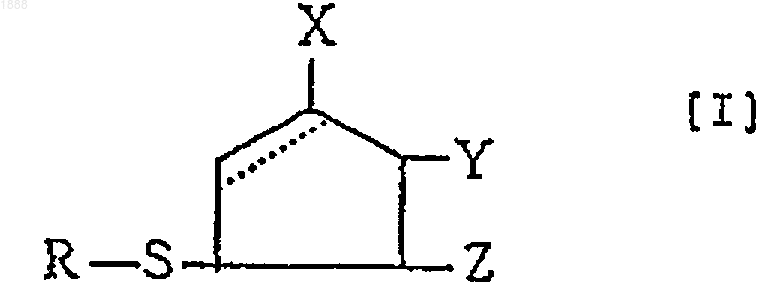
(в которой связь, показанная пунктирной линией в пятичленном кольце, обозначает, что пятичленное кольцо может быть любым циклопентеновым кольцом, имеющим двойную связь, и циклопентановым кольцом, в котором эта связь является насыщенной, и, в случае циклопентенового кольца, Х обозначает ОН, Y обозначает =О и Z обозначает Н, тогда как в случае циклопентанового кольца Х обозначает =О, Y обозначает ОН и Z обозначает ОН; R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты).
2. Соединение или его оптически активный антипод или его соль по п.1, где вышеуказанное соединение представлено следующей формулой [II]
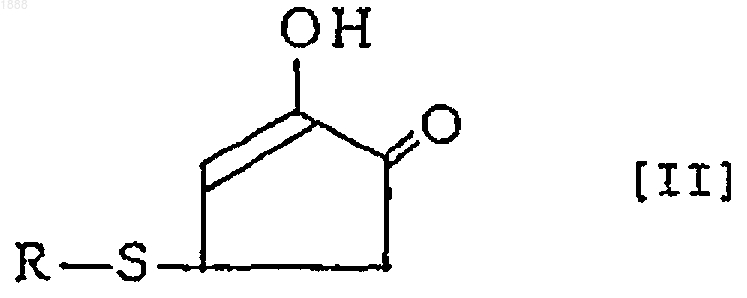
(в которой R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты).
3. Соединение или его оптически активный антипод или соль по п.1, где вышеуказанное соединение представлено следующей формулой [III]
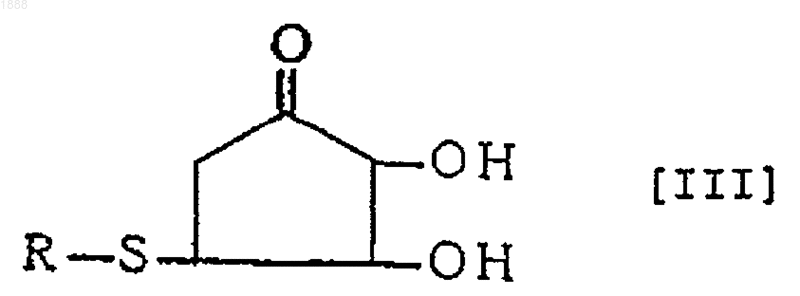
(в которой R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты).
4. Соединение или его оптически активный антипод или его соль по любому из пп.1-3, где R представляет собой тиолсодержащую аминокислоту или ее производное.
5. Соединение или его оптически активный антипод или его соль по п.4, где тиолсодержащая аминокислота представляет собой цистеин или глутатион.
6. Способ получения соединения, представленного формулой [I], или его оптически активного антипода или его соли
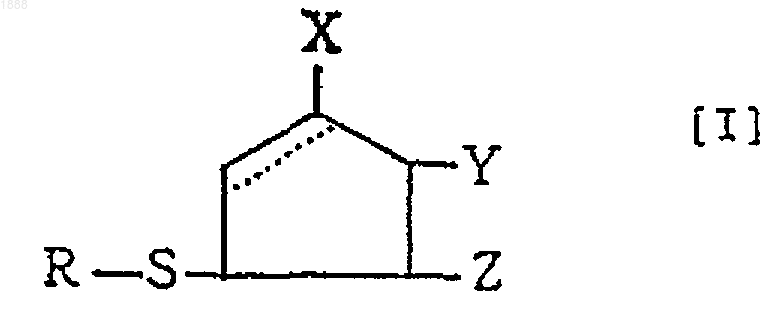
(в которой связь, показанная пунктирной линией в пятичленном кольце, обозначает, что пятичленное кольцо может быть любым циклопентеновым кольцом, имеющим двойную связь, и циклопентановым кольцом, в котором эта связь является насыщенной, и, в случае циклопентенового кольца, Х обозначает ОН, Y обозначает =О и Z обозначает Н, тогда как в случае циклопентанового кольца Х обозначает =О, Y обозначает ОН и Z обозначает ОН; R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты), характеризующийся тем, что 4,5-дигидрокси-2-циклопентен-1-он, представленный формулой [IV], или его оптически активный антипод или его соль
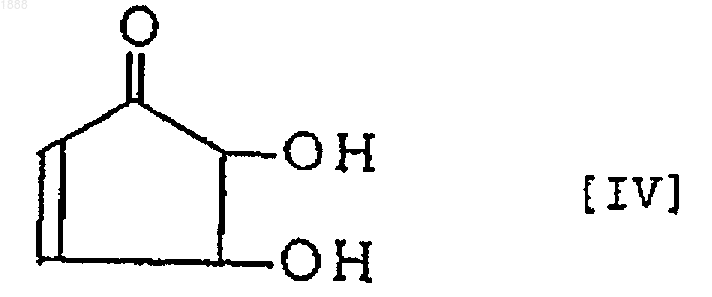
подвергают взаимодействию с тиолсодержащей аминокислотой.
7. Способ получения соединения, его оптически активного антипода или его соли по п.6, по которому реакцию проводят в кислых условиях и указанным соединением формулы [I] является соединение формулы [II]
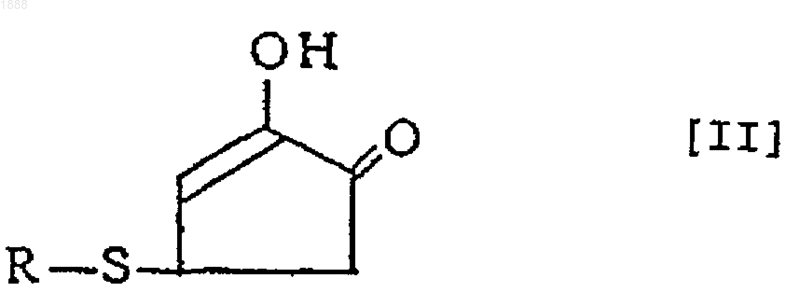
(в которой R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты).
8. Способ получения соединения, его оптически активного антипода или его соли по п.6, по которому реакцию проводят в нейтральных условиях и указанным соединением формулы [I] является соединение формулы [III]
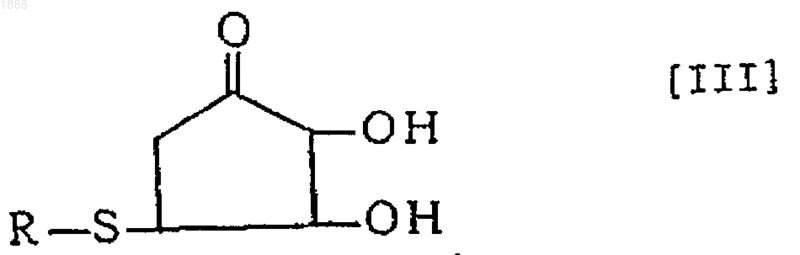
(в которой R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты).
9. Способ получения соединения, его оптически активного антипода или его соли по любому из пп.6-8, в котором R представляет собой тиолсодержащую аминокислоту или ее производное.
10. Способ получения соединения, его оптически активного антипода или его соли по п.9, в котором тиолсодержащая аминокислота представляет собой цистеин или глутатион.
11. Фармацевтический препарат, который характеризуется содержанием, по меньшей мере, одного соединения формулы [I] или его оптически активного антипода или его соли в качестве эффективного компонента
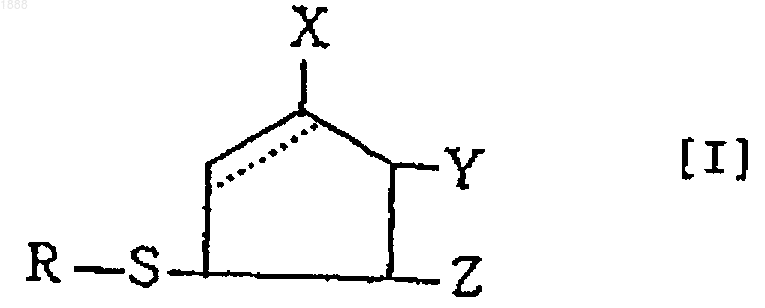
(в которой связь, показанная пунктирной линией в пятичленном кольце, обозначает, что пятичленное кольцо может быть любым циклопентеновым кольцом, имеющим двойную связь, и циклопентановым кольцом, в котором эта связь является насыщенной, и, в случае циклопентенового кольца, Х обозначает ОН, Y обозначает =О и Z обозначает Н, тогда как в случае циклопентанового кольца Х обозначает =О, Y обозначает ОН и Z обозначает ОН; R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты).
12. Фармацевтический препарат по п.11, содержащий, по меньшей мере, одно соединение формулы [II] или его оптически активный антипод или его соль в качестве эффективного компонента
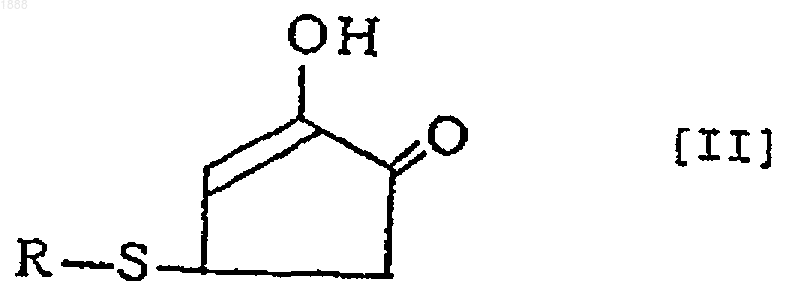
(в которой R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты).
13. Фармацевтический препарат по п.11, содержащий, по меньшей мере, одно соединение формулы [III] или его оптически активный антипод или его соль в качестве эффективного компонента
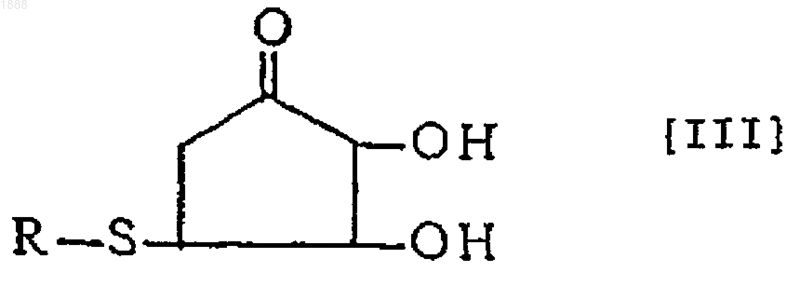
(в которой R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты).
14. Фармацевтический препарат по любому из пп.11-13, в котором R представляет собой тиолсодержащую аминокислоту или ее производное.
15. Фармацевтический препарат по п.14, в котором тиолсодержащая аминокислота представляет собой цистеин или глутатион.
16. Фармацевтический препарат по любому из пп.11-15 в качестве биофилаксического агента, агента для лечения сахарного диабета, агента для предупреждения сахарного диабета, противоракового агента, индуцирующего апоптоз агента, агента, действующего против патогенных микробов, агента для лечения гиперлипемии, агента для предупреждения гиперлипемии, агента для улучшения функции печени или агента для индуцирования белка теплового шока.
17. Фармацевтический препарат по п.16, где биофилаксический агент выбран из группы, состоящей из антиаллергического агента, противоревматического агента, противовоспалительного агента, профилактического противовоспалительного агента, индуктора интерферона, ингибитора продуцирования фактора некроза опухоли, профилактического агента для предупреждения продуцирования фактора некроза опухоли, стимулятора продуцирования интерлейкина-10, ингибитора продуцирования моноксида азота, индуктора продуцирования антигена Fas, иммуномодулятора, ингибитора продуцирования IgE, терапевтического агента для аутоиммунных заболеваний и ингибитора сверхчувствительности замедленного типа.
18. Фармацевтический препарат по п.16, где агентом против патогенных микробов является антибактериальный или антивирусный агент.
19. Фармацевтический препарат по п.18, где антивирусным агентом является антивирусный агент в отношении вируса приобретенного иммунодефицита человека или в отношении вируса гепатита типа С.
20. Фармацевтический препарат по п.18, где антивирусным агентом является антивирусный агент для человека, для животных или для растений.
Текст
1 Данное изобретение относится к соединениям, применимым в области фармацевтических препаратов, имеющих физиологическую активность, такую как противораковое действие, а также к способу получения таких соединений. Предпосылки создания изобретения Фармацевтические препараты, которые использовались в клинической терапии, включают в себя многие агенты, такие как противораковые агенты, антибиотические вещества,иммунопотенциаторы, иммуномодуляторы и т.д. (такие как алкилирующие агенты, антиметаболиты и алкалоиды растений), но едва ли можно сказать, что такая лекарственная терапия уже полностью разработана. Среди таких агентов, как простагландин А и J, имеющих , -ненасыщенный карбонил в пятичленном кольце, простагландины, полученные из природных веществ, сообщалось как о веществах, которые могут применяться в качестве безопасных противораковых агентов благодаря ингибированию ими синтеза ДНК, и были синтезированы различные их производные(см. Japanese Laid-Open Patent Publication Sho62/96438). Целью данного изобретения является разработка соединений, обладающих физиологическим действием, таким как противораковое действие, и обеспечение способа получения указанных соединений и фармацевтических препаратов, содержащих такие соединения. Авторы данного изобретения провели интенсивное исследование для достижения упомянутой цели и обнаружили, что соединение формулы [I] (далее называемое "соединением данного изобретения"), образуется в результате взаимодействия 4,5-дигидрокси-2-циклопентен 1-она (далее называемого просто "циклопентеноном"), формулы [IV], с соединением, содержащим SH-группу, и что вышеупомянутое соединение данного изобретения обладает сильной физиологической активностью и применимо для лечения и/или предупреждения заболеваний, являющихся чувствительными к указанному соединению, вследствие чего была достигнута цель данного изобретения. Данное изобретение может быть резюмировано следующим образом. Так, первым аспектом данного изобретения является соединение следующей структурной формулы [I] или его оптически активному аналогу или соли: в которой связь, показанная пунктирной линией в пятичленном кольце, обозначает, что пятичленное кольцо может быть любым циклопентеновым кольцом, имеющим двойную связь, и циклопентановым кольцом, в котором эта связь является насыщенной, и, в случае циклопенте 001888=O и Z обозначает Н, тогда как в случае циклопентанового кольца Х обозначает =О, Y обозначает ОН и Z обозначает ОН; R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты). Вариантом первого аспекта данного изобретения является соединение формулы [II] или его оптически активный аналог или соль:(в которой R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты). Другим вариантом первого аспекта данного изобретения является соединение формулы[III] или его оптически активный аналог или соль:(в которой R обозначает аминокислотный или пептидный остаток соответствующей тиолсодержащей аминокислоты). Вторым аспектом данного изобретения является способ получения соединения формулы[I] или его оптически активного аналога или соли, указанных в первом аспекте данного изобретения, в котором соединение, выбранное из 4,5-дигидрокси-2-циклопентен-1-она формулы[IV] или его оптически активный аналог или соль, подвергают взаимодействию с соединением, содержащим SH-группу: В предпочтительном варианте первого и второго аспектов данного изобретения тиолсодержащая аминокислота представляет собой тиолсодержащую аминокислоту или ее производное. Третьим аспектом данного изобретения является фармацевтический препарат, который характеризуется содержанием, по меньшей мере, одного соединения, выбранного из соединения формулы [I] в первом аспекте данного изобретения или его оптически активного аналога или соли, в качестве эффективного компонента. В предпочтительном варианте третьего аспекта данного изобретения вышеупомянутый фармацевтический препарат представляет собой биофилаксический агент (агент биоиммунитета)(такой как иммуномодулятор, антиаллергический агент или противоревматический агент),лекарственное средство для сахарного диабета,противораковый препарат, индуктор апоптоза или агент против патогенных микробов (такой как противовирусный агент или антибактериальный агент). 3 Краткое описание фигур Фиг. 1 показывает масс-спектр СМ 1. Фиг. 2 показывает 1H-ЯМР-спектр СМ 1. Фиг. 3 показывает спектр УФ-поглощения СМ 1. Фиг. 4 показывает 1H-ЯМР-спектр СМ 2. Фиг. 5 показывает 13 С-ЯМР-спектр СМ 1. Фиг. 6 показывает спектр ИК-поглощения СМ. Фиг. 7 показывает зависимость между временем удерживания и поглощением. Фиг. 8 показывает 1H-ЯМР-спектр GM. Фиг. 9 показывает 13 С-ЯМР-спектр GM. Фиг. 10 показывает масс-спектр GM. Фиг. 11 показывает спектр УФ-поглощения GM. Фиг. 12 показывает спектр ИК-поглощенияGM. Фиг. 13 показывает картину элюирования примера тиопроизводных циклопентанона. Фиг. 14 показывает зависимость между временем реакции и поглощением при 215 нм при использовании L-цистеина. Фиг. 15 показывает зависимость между временем реакции и поглощением при 215 нм при использовании глутатиона. Фиг. 16 показывает хроматограмму продукта реакции в примере данного изобретения. Фиг. 17 показывает масс-спектр пика при 2,99 минутах на фиг. 4. Фиг. 18 показывает спектр УФпоглощения реакционного раствора сразу после растворения. Фиг. 19 показывает спектр УФпоглощения реакционного раствора после реакции в течение 50 минут. Фиг. 20 показывает спектр УФпоглощения реакционного раствора сразу после растворения при использовании глутатиона. Фиг. 21 показывает спектр УФпоглощения реакционного раствора после реакции в течение 50 минут при использовании глутатиона. Фиг. 22 показывает 13 С-ЯМР-спектр продукта реакции. Фиг. 23 показывает зависимость между временем удерживания и поглощением. Фиг. 24 показывает 1H-ЯМР-спектр GD. Фиг. 25 показывает 13 С-ЯМР-спектр GD. Фиг. 26 показывает масс-спектр GD. Фиг. 27 показывает спектр ИК-поглощенияGD. Фиг. 28 показывает ингибирующую активность СМ в отношении роста раковых клеток. Фиг. 29 показывает ингибирующую активность СМ в отношении роста раковых клеток. Фиг. 30 показывает зависимость между количеством GM и количеством продуцируемого фактора некроза опухолей. Фиг. 31 показывает зависимость между количеством GM и степенью увеличения отека ног. 4 Фиг. 32 показывает зависимость между концентрацией NО 2- и концентрацией GM в среде. Фиг. 33 показывает зависимость между временем инкубации и числом жизнеспособных клеток. Фиг. 34 показывает влияние GM на рост клеток Jurkat. Фиг. 35 показывает влияние GM на рост клеток Molt-3. Фиг. 36 показывает экспрессию антигенаFas в клетках Jurkat. Фиг. 38 показывает изменение доли клеток, экспрессирующих антиген Fas. Фиг. 39 показывает зависимость между дозой GM и уровнем сахара в крови. Фиг. 40 показывает зависимость между дозой GM и уровнем инсулина в сыворотке. Фиг. 41 показывает зависимость между дозой GM и уровнем холестерина в сыворотке. Фиг. 42 показывает зависимость между дозой GM и уровнем триглицеридов в сыворотке. Фиг. 43 показывает зависимость между дозой GM и уровнем свободных жирных кислот в сыворотке. Фиг. 44 показывает зависимость между концентрацией GM и жизнеспособностью клеток. Фиг. 45 показывает зависимость между концентрацией GM и количеством производимого р 24. Фиг. 46 показывает ингибирующую активность GM в отношении аллергии замедленного типа. Фиг. 47 показывает КД (круговой дихроизм) п-диметиламинобензоилпроизводного (-)циклопентенона и стереоструктуру(+)циклопентенона. Варианты осуществления изобретения Данное изобретение конкретно проиллюстрировано следующим образом. Циклопентенон формулы [IV], используемый в данном изобретении, включает оба изомера, которые имеют цис- и транс-конфигурации гидроксильных групп в положениях 4 и 5. В данном изобретении может использоваться любое соединение из цис-циклопентенона, транс-циклопентенона и смеси циси транс-циклопентенона. Возможно также использование их оптически активных аналогов. цис-Циклопентенон может быть получен химическим синтезом [Helvetica Chimica Acta,volume 55, pages 2838-2844 (1972)]. трансЦиклопентенон может быть получен либо химическим синтезом [Carbohydrate Res., volume 247, pages 217-222 (1993)], либо нагреванием 5 уроновой кислоты, такой как глюкуроновая кислота, производного уроновой кислоты, такого как глюкуронолактон, или содержащего их вещества (PCT/JP 97/03052). В данном изобретении можно также использовать нагретый продукт как таковой или частично очищенный продукт или очищенный продукт. Например, при применении D-глюкуроновой кислоты в качестве уроновой кислоты и нагревании ее 1% раствора при 121 С в течение четырех часов циклопентенон получают в виде обработанного нагреванием вещества. Циклопентенон в этом обработанном нагреванием веществе экстрагируют растворителем и экстракт концентрируют. Затем этот концентрированный экстракт разделяют колоночной хроматографией на силикагеле, элюированную фракцию циклопентенона концентрируют и циклопентенон экстрагируют хлороформом из этого концентрата, и экстракт концентрата подвергают колоночной хроматографии с нормальной фазой, при которой выделяют циклопентенон,содержащийся в обработанном нагреванием веществе. Физические свойства циклопентенона будут приведены ниже. В некоторых случаях проводили масс-спектрометрический анализ циклопентенона спектрометром DX302 (производимого Nippon Denshi). Далее, измерение ЯМР с использованием тяжелого хлороформа в качестве растворителя проводили спектрометромJNM-A 500 (производимого Nippon Denshi). Удельное вращение измеряли поляриметромDIP-370 (производимого Nippon Bunko); ультрафиолетовый спектр поглощения измеряли спектрофотометром UV-2500 (производимого(ИК) измеряли инфракрасным спектрофотометром FTIR-8000 (производимого Shimadzu). МС m/z 115 [М+Н]+. 1H-ЯМР (CDCl3):4,20 (1 Н, J=2,4 Гц, 5-Н),4,83 (1H, м, 4-Н), 6,30 (1H, дд, J=1,2, 6,1 Гц, 2 Н), 7,48 (1H, дд, J=2,1, 6,1 Гц, 3-Н). При этом, величину химического сдвига 1H-ЯМР давали на основании того, что величина химического сдвига СНСl3 была 7,26 м.д. Оптическое вращение: []D20 0 (с 1,3, вода). УФ: макс 215 нм (вода). ИК (КВr-метод): поглощения отмечали при 3400, 1715, 1630, 1115, 1060, 1025 см-1. Когда выделенный циклопентенон подвергают оптическому разрешению, получают (-)4,5-дигидрокси-2-циклопентен-1-он и (+)-4,5 дигидрокси-2-циклопентен-1-он. Циклопентенон, полученный синтетическим способом, может быть также подвергнут оптическому разрешению. Например, циклопентенон растворяют в этаноле. Затем к этому этанольному раствору добавляют смесь гексан/этанол (94/6) с получе 001888 6 нием раствора циклопентенона. Циклопентенон может быть оптически разделен, подвергая пробы этого раствора ВЭЖХ с применением, например, Chiral Pack AS (производимого DaicelChemical Industries), при условии, что температура колонки была 40 С и подвижной фазой была смесь гексан/этанол (94/6). Оптическое вращение оптически разрешенного (-)-транс-4,5-дигидрокси-2-циклопентен-1-она [далее называемого (-)-циклопентеноном]равно []D20 -105 (с 0,30, этанол), тогда как оптическое вращение оптически разрешенного (+)-транс-4,5-дигидрокси-2-циклопентен-1 она [далее называемого (+)-циклопентеноном] равно []D20 +104 (с 0,53, этанол). При этом,оптическое вращение измеряли вышеупомянутым поляриметром типа DIP-370 (производимым Nippon Bunko). После этого каждый из (-)-циклопентенона и (+)-циклопентенона подвергали структурному анализу с применением масс анализа и ядерного магнитного резонанса (ЯМР), измерению спектра УФ-поглощения и измерению спектра ИКпоглощения по уже упомянутому способу. В результате оба оптически активных вещества дали результат, одинаковый с результатом для циклопентенона перед оптическим разрешением. Каждый из оптически разрешенных (-)циклопентенона и (+)-циклопентенона превращали в п-диметилбензоилпроизводное, спектр кругового дихроизма (КД) измеряли дисперсиметром типа J-720 (производимого NipponBunko) и для определения конфигурации к результату применяли правило хиральности дибензоата [J. Am. Chem. Soc., volume 91, pages 3989-3991 (1969)]. КД п-диметиламинобензоилпроизводного(-)-циклопентанона и стереоструктуры (-)циклопентенона показаны на фиг. 47. На этой фигуре ордината показывает молярный круговой дихроизм, тогда как абсцисса показывает длину волны (нм). При этом, вышеупомянутая стереоструктура является такой, как приведенная ниже формула [V]:(+)-циклопентанона и стереоструктуры (+)циклопентенона показаны на фиг. 48. На этой фигуре ордината показывает молярный круговой дихроизм, тогда как абсцисса показывает длину волны (нм). При этом, вышеупомянутая стереоструктура является такой, как приведенная ниже формула [VI]: 7 Как показано на фиг. 47 и 48, в формуле[V] и формуле [VI], (-)-циклопентенон представляет собой (-)-(4R,5S)-транс-4,5-дигидрокси-2-циклопентен-1-он, тогда как (+)-циклопентенон представляет собой (+) -(4S,5R)-транс 4,5-дигидрокси-2-циклопентен-1-он. Вышеупомянутые циклопентеноны или их оптически активный аналог могут быть получены любым способом, т.е. они могут быть получены по способу, описанному в этом описании,или способами химического синтеза; и транс- и цис-циклопентенон, их смеси или оптически активные вещества могут быть также использованы в данном изобретении. Примерами соли циклопентенона или его оптически активного аналога являются фармацевтически приемлемые соли и они могут быть получены известными способами превращения. Когда циклопентенон, его оптически активный аналог и/или его соль подвергают взаимодействию с соединением, содержащим SHгруппу, соединение данного изобретения формулы [I] получают в реакционном растворе. Когда циклопентенон, его оптически активный аналог и/или его соль подвергают взаимодействию с соединением, содержащим SHгруппу, таким как аминокислота, содержащаяSH-группу, или ее производное, в кислых условиях соединение формулы [II] (далее называемое тиопроизводным циклопентенона) получают в реакционном растворе. Для тиолсодержащей аминокислоты вообще нет ограничений, примерами являются аминокислота, содержащая SH-группу, и производное аминокислоты, содержащее SH-группу. Примерами аминокислоты, содержащей SHгруппу, являются цистеин и гомоцистеин. Примерами производного аминокислоты,содержащей SH-группу, являются производные вышеупомянутых аминокислот, такие как производные цистеина, пептиды, содержащие цистеин, и пептиды, содержащие производные цистеина. Не существует особых ограничений для пептида, содержащего цистеин, пока цистеин является формирующим компонентом в этом пептиде. Пептид, содержащий цистеин, в соответствии с данным изобретением, содержит вещества от низкомолекулярных, таких как олигопептиды (например, глутатион), до высокомолекулярных, таких как белок. Пептид, содержащий цистин или гомоцистин, может быть также использован, как указанный пептид, содержащий цистеин или гомоцистеин данного изобретения, в условиях, в которых он образует пептид, содержащий цистеин или гомоцистеин образуется в течение реакции, например, в комбинации с восстановительной обработкой. При этом, пептид, содержащий цистеин, включает в себя пептид, который содержит также сахарид,липид и т. д. Кроме того, он может быть также солью, ангидридом кислоты, сложным эфиром и т. д. различных вышеупомянутых веществ. 8 Суммируя сказанное, можно сказать, что циклопентенон взаимодействует с тиолсодержащей аминокислотой в кислых условиях с образованием тиопроизводного циклопентенона. Способы очистки и выделения тиопроизводного циклопентенона или его оптически активного аналога, которое получают путем взаимодействия циклопентенона, его оптически активного аналога и/или его соли с тиолсодержащей аминокислотой, такой как аминокислота,содержащая SH-группу или ее производное,могут быть известными, такими как химический и физический способы. Такие общепринятые известные способы, как гель-фильтрация, фракционирование при помощи фракционирующего молекулярного мембранного фильтра, экстракция растворителем, фракционная перегонка и различные хроматографические способы с применением ионообменной смолы и т.д., могут быть использованы для очистки и выделения тиопроизводных циклопентенона или его оптически активного аналога или его соли. Например, когда циклопентенон и цистеин подвергаются взаимодействию при рН 4 и при 60 С в течение 16 часов тиопроизводное циклопентенона формулы [VII] образуется в реакционном растворе и, при помощи колоночной хроматографии с нормальной фазой продукты реакции,содержащие указанное производное, могут быть очищены и выделено тиопроизводное циклопентенона. Далее, когда циклопентенон и глутатион подвергаются взаимодействию в кислых условиях, например, в реакционном растворе образуется тиопроизводное циклопентенона формулы [VIII] и, в результате обращенно-фазовой колоночной хроматографии или т.п. продукты реакции, содержащие это производное, могут быть очищены/и выделено тиопроизводное циклопентенона. Когда циклопентенон, его оптически активный аналог и/или его соль подвергают в нейтральных условиях взаимодействию с тиолсодержащей аминокислотой, например аминокислотой, содержащей SH-группу, или ее производным, в реакционном растворе образуется соединение формулы [III] (далее называемое тиопроизводным циклопентенона). Не существует конкретного ограничения для вышеупомянутой тиолсодержащей аминокислоты, и могут быть приведены примеры тиолсодержащей аминокислоты. Вышеупомянутая реакция циклопентенона, его оптически актив 9 ного аналога и/или его соли с тиолсодержащей аминокислотой, предпочтительно может проводиться при нейтральном рН. Способы очистки и выделения тиопроизводного циклопентенона или его оптически активного аналога или его соли, которое получают реакцией циклопентенона, его оптически активного аналога и/или его соли с тиолсодержащей аминокислотой, могут быть известными способами, такими как химический и физический способы. Такие общепринятые известные способы, как гель-фильтрация, фракционирование при помощи фракционирующей по молекулярной массе мембраны, экстракция растворителем,фракционная перегонка и различные хроматографические способы с применением ионообменной смолы и т.д., могут быть использованы для очистки и выделения тиопроизводных циклопентенона или его оптически активного аналога или его соли. Например,при взаимодействии циклопентенона и цистеина при рН 7 и при 37 С в течение 30 мин в реакционном растворе образуется тиопроизводное циклопентенона формулы [IX] и, при помощи обращенно-фазовой колоночной хроматографии продуктов реакции, содержащих это производное, может быть очищено и выделено тиопроизводное циклопентенона. Далее, при взаимодействии циклопентенона и глутатиона, например, в нейтральных условиях, в реакционном растворе образуется тиопроизводное циклопентенона формулы [X], и при помощи обращенно-фазовой колоночной хроматографии или т.п. продуктов реакции, содержащих это производное, может быть очищено и выделено вышеупомянутое тиопроизводное циклопентенона. Разделение оптически активных аналогов соединения данного изобретения может проводиться механическим разделением рацемической смеси, преимущественной кристаллизацией, разделением кристаллизацией в виде диастереомерных солей или в виде соединений включения, динамическим разделением с использованием ферментов или микроорганизма, разделением при помощи хроматографии и т.д. В случае разделения хроматографией могут быть использованы газовая хроматография,жидкостная хроматография, тонкослойная хроматография и т.д., и может быть применена хиральная стационарная фаза, которая пригодна для каждого из этих способов. Способ с применением хиральной стационарной фазы, способ с применением хирального 10 элюата, разделения в виде диастереомера и т.д. могут быть использованы в оптическом разделении при помощи жидкостной хроматографии. Стационарная фаза амидного типа, фаза типа мочевины, фаза типа лигандного обмена,стационарная фаза с применением полисахаридполисахарид-производного, белковая стационарная фаза, полиметакрилатная стационарная фаза, полиметакриламидная стационарная фаза и т.д. могут быть использованы в качестве хиральной стационарной фазы. Что касается элюирующей жидкости, жидкость типа гексана, спирта, водного (буфер) типа и т.д. могут быть подходящим образом использованы с учетом сочетания с вышеупомянутой стационарной фазой. Что касается соли соединения данного изобретения или его оптически активного аналога, приводятся примеры солей, которые являются приемлемыми в качестве фармацевтических, и могут быть получены реакциями превращения при помощи известных способов. Соединение данного изобретения, его оптически активный аналог или его соль обладает физиологическими активностями, такими как противораковая активность, активность ингибирования роста раковых клеток, индуцирующая апоптоз активность, активность ингибирования топоизомеразы II, активность индукции дифференциации раковых клеток, противоревматическая активность, активность ингибирования хронического ревматизма суставов, активность индукции продуцирования антигена Fas, антибактериальная активность, противовирусная активность, активность улучшения функции печени, активность индукции белка теплового шока, активность нормализации компонентов крови, активность, усиливающая иммунитет против рака, противовоспалительная активность, активность ингибирования экспрессии фактора некроза опухолей, активность ингибирования продуцирования моноксида азота, иммуномодулирующая активность, такая как активность ингибирования сверхчувствительности замедленного типа, активность ингибирования трансформации лимфоцитов, активность ингибирования СКЛ-реакции (реакции смешанной культуры лимфоцитов), активность ингибирования продуцирования IgE и активность ингибирования каррагенанового отека и, вследствие этих активностей, фармацевтический агент, содержащий в качестве эффективного компонента, по меньшей мере, одно соединение, выбранное из соединения данного изобретения, его оптически активного аналога и его соли, применим в качестве лекарственного средства, действующего на биофилаксическую функцию(функцию биоиммунитета), такого как фармацевтический препарат, действующий на функцию продуцирования антител, противовоспалительный агент, антиаллергический агент и индуктор интерферона, лекарственного средства, 11 действующего на метаболизм сахаридов, такого как лекарство для сахарного диабета, и лекарственного средства, действующего на патогенные организмы, такого как антибактериальный агент и антивирусный агент. Таким образом, фармацевтический агент, полученный данным изобретением, вполне применим в качестве лекарственного средства для заболеваний, обнаруживающих чувствительность к соединению данного изобретения, его оптическому аналогу или его соли, т.е. в качестве лекарственного средства для лечения или предупреждения, например,рака, вирусных заболеваний, ревматизма, сахарного диабета, аллергии, аутоиммунных заболеваний, воспаления и т.д. Соединение данного изобретения, его оптически активный аналог или его соль обладает супрессирующим действием на рост клеток и противораковым действием в отношении раковых клеток, таких как клетки HL-60 промиелоцитарного лейкоза человека, клетки MOLT-3 острого лимфобластного лейкоза человека,клетки рака легкого А-549. При использовании, по меньшей мере, одного из соединений, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, обладающего противораковой активностью, в качестве эффективного ингредиента и приготовленного в виде фармацевтического препарата путем сочетания с известными фармацевтическими носителями,можно приготовить противораковый агент. Обычно, по меньшей мере, одно из соединений,выбранное из соединения данного изобретения,его оптически активного аналога или его соли,сочетают с фармацевтически приемлемым жидким или твердым носителем и, если необходимо, добавляют к нему диспергирующий агент,эмульгатор, буфер, стабилизатор, наполнитель,связывающее вещество, дезинтегрирующий агент, смачивающее вещество и т.д. с получением противоракового препарата, который может быть твердым, таким как таблетки, гранулы,разбавляемые порошки, порошки, капсулы и т.д., или жидким, таким как растворы, суспензии, эмульсии и т.д. Далее он может быть в виде сухого препарата, который может быть переведен в жидкость добавлением подходящего носителя перед использованием. Фармацевтический носитель может быть выбран в зависимости от вышеупомянутого способа введения и формы препарата. В случае пероральных препаратов, могут быть использованы крахмал, лактоза, сахар, маннит, карбоксиметилцеллюлоза, кукурузный крахмал, неорганические соли и т.д. При приготовлении пероральных препаратов они могут дополнительно содержать связывающие вещества, дезинтегрирующие агенты, поверхностно-активные агенты, смачивающие вещества, промоторы жидкого состояния, корректоры вкуса, окрашивающие агенты, ароматизаторы, и т.д. 12 С другой стороны, в случае парентеральных препаратов, они могут быть приготовлены общепринятыми способами, в которых, по меньшей мере, одно из соединений, выбранное из соединения данного изобретения, его оптически активного аналога или его соли, которое является эффективным ингредиентом данного изобретения, растворяют или суспендируют в разбавителе, таком как дистиллированная вода для инъекции, физиологический солевой раствор, водный раствор глюкозы, растительное масло для инъекции, кунжутное масло, арахисовое масло, соевое масло, кукурузное масло,пропиленгликоль, полиэтиленгликоль, и т.д., с последующим добавлением к ним, если необходимо, бактерицидов, стабилизаторов, изотоничных агентов, аналгезирующих веществ и т.д. Противораковый препарат данного изобретения вводят подходящим путем в зависимости от формы препарата. Не существует конкретного ограничения и для способа введения, и агент может вводиться перорально, наружно или посредством инъекции. Инъекционные препараты вводят, например, внутривенно, внутримышечно, подкожно, внутрикожно и т.д., тогда как препараты для наружного применения включают в себя суппозитории и т.д. Доза противоракового препарата определяется, соответственно, формой препарата, способом введения, целью применения и возрастом, весом тела и симптомом подлежащего лечению пациента и не является постоянной, но,обычно, количество, по меньшей мере, одного из соединений, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате,равно от 0,1 мкг до 200 мг/кг в день (для взрослых). Конечно, эта доза может варьироваться в зависимости от различных состояний и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как, в других случаях, может быть необходима доза больше вышеуказанной. Фармацевтический препарат данного изобретения может быть непосредственно введен перорально, кроме того, он может быть добавлен к любой пище или напитку, так что этот агент может употребляться на рутинной основе. Соединение данного изобретения, его оптически активный аналог или его соль обладает противораковым действием и, в низких концентрациях, обнаруживает способность индуцировать дифференциацию раковых клеток, вследствие чего он применим в качестве индуктора дифференциации (демалигнизирующего агента) для раковых клеток. Индуктор дифференциации раковых клеток, содержащий, по меньшей мере,одно из соединений, выбранных из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного ингредиента, может быть приготовлен в виде фармацевтических препаратов согласно выше 13 упомянутому способу для противораковых агентов и может быть введен способом, сходным со способом для противораковых агентов. Вышеупомянутый индуктор для дифференциации раковых клеток может быть использован в способе индукции дифференциации раковых клеток. Так, при использовании, по меньшей мере, одного из соединений, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного ингредиента можно индуцировать дифференциацию раковых клеток, и такой способ применим для выяснения механизма индукции дифференциации раковых клеток, для скрининга на индукторы дифференциации и т.д. Соединение данного изобретения или его оптически активный аналог или его соль имеет антибактериальное действие и, при использовании, по меньшей мере, одного соединения, выбранного из таких соединений, в качестве эффективного компонента, и приготовлении его в виде фармацевтического препарата комбинированием с известными фармацевтическими носителями может быть приготовлен антибактериальный агент. Вышеупомянутая фармацевтическая композиция может быть приготовлена так же, как в случае вышеупомянутого противоракового агента, и может быть введена таким же образом, что и в случае противоракового агента. Доза антибактериального агента определяется, соответственно, формой препарата, способом введения, целью применения и возрастом,весом тела и симптомом подлежащего лечению пациента и не является постоянной, но, обычно,количество, по меньшей мере, одного из соединений, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате, равно от 10 мкг до 20 мг/кг в день (для взрослых). Конечно,эта доза может варьироваться в зависимости от различных состояний и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как в других случаях может быть необходима доза больше вышеуказанной. Фармацевтический препарат данного изобретения может быть непосредственно введен перорально, кроме того, он может быть добавлен к любому пищевому продукту или напитку, так что агент может употребляться на рутинной основе. Кроме того, он может вводиться вместе с этанолом, глицином, ацетатом натрия, аскорбиновой кислотой, эфирами жирных кислот и глицерина, солью, ЭДТА и другими антибиотическими веществами. Антибактериальный препарат данного изобретения, содержащий, по меньшей мере,одно из соединений, выбранное из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного ингредиента может использоваться в качестве антисептического агента для улучшения кон 001888 14 сервирования пищевых продуктов или напитков. Кроме того, соединение, выбранное из этих соединений, добавляют к пищевому продукту или напитку, в результате чего оно может быть использовано в антисептическом способе для пищевых продуктов и напитков. Количество соединения данного изобретения, его оптически активного аналога или его соли, которое должно быть добавлено к пищевому продукту или напитку, может варьироваться в зависимости от типа пищевого продукта или напитка для достижения конкретной цели. Одним из способов применения антибактериального препарата данного изобретения является способ, в котором этот агент добавляют к пищевому продукту или напитку при помощи подходящего способа. Хотя общепринятым способом является добавление его/их во время стадий приготовления этого пищевого продукта или напитка, может быть использован также способ, в котором пищевой продукт погружают в раствор, содержащий соединение данного изобретения, его оптически активный аналог или его соль. Можно также использовать способ добавления его к пищевому продукту вместе со способом погружения пищевого продукта в раствор. При использовании антибактериального препарата данного изобретения в качестве антисептического агента может быть дополнительно усовершенствовано консервирование пищевых продуктов и напитков. В случае замороженной пищи и замороженного десерта, рост загрязняющих микроорганизмов в стадии обработки перед замораживанием может быть подавлен,вследствие чего может быть получен очень благоприятный результат в смысле гигиены. Антибактериальный препарат данного изобретения является эффективным как в отношении грамположительных, так и в отношении грамотрицательных бактерий и является очень эффективным в отношении бактерий, вызывающих пищевое отравление, например, в отношении устойчивых к лекарственным средствам бактерий,таких как митициллинрезистентные Staphylococcus aureus и Salmonella, продуцирующий энтеротоксин Staphylococcus aureus, Bacillus cereus типов, вызывающих рвоту и понос, и энтерогеморрагическая Escherichia coli 0-157. Он эффективен также в отношении hiochi бактерий. Далее, он проявляет антибактериальное действие в отношении микроорганизмов, вызывающих заболевания, которые обусловлены микроорганизмами, такими как Legionella pneumophila(NCTC 11637), Campylobacter jejuni (ATCC 29428) и т.д. Он является также эффективным в отношении микроорганизмов, таких как дрожжи и грибки. При этом, стерилизация одежды, постельного белья и т.д. может проводиться с применением препарата данного изобретения, и при проведении разбрызгивания антибактериального препарата данного изобретения или вытирания, антибактериальным препаратом данного изобретения можно стерилизовать (как с удалением, так и с убиванием бактерий) вещи,которые подлежат стерилизации. Например, при его добавлении к воде для кондиционирования воздуха строений офисов может быть предотвращена болезнь легионеров. Антибактериальный препарат данного изобретения обладает антибактериальной активностью в отношении бактерий зубного кариеса и бактерий периодонтального заболевания, и поэтому могут быть изготовлены препараты для полости рта, содержащие антибактериальный агент данного изобретения. Форма интраорального препарата может быть известной,такой как жидкость или паста. Примером интраорального препарата является препарат для чистки зубов. Препарат для чистки зубов может быть в известной форме, такой как жидкость,паста или порошок. Не существует особого ограничения для количества соединения данного изобретения, его оптически активного аналога или его соли в этом средстве гигиены и, если в нем содержится эффективная концентрация в отношении бактерий зубного кариеса или периодонтального заболевания, этого будет достаточно. К препарату для чистки зубов могут быть добавлены известные добавки, такие как увлажняющие агенты, поверхностно-активные агенты,связывающие вещества, отдушки, подслащивающие агенты и т.д. Могут быть обеспечены антибактериальные косметические изделия с использованием антибактериального средства данного изобретения. Примерами антибактериальных косметических изделий данного изобретения являются основные формы косметических изделий, таких как крем, косметическое молочко, лосьон, очищающий лицо материал и косметическая маска; косметические изделия для макияжа, такие как губная помада и крем-основа; мыло для тела; и мыло, содержащие эффективное количество, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли. Оно применимо также для волос и может быть приготовлено в виде косметических изделий для ухода за волосами, в том числе, изделий для волос,таких как тоник для волос, жидкость для волос,лосьон для укладки волос, препарат для опрыскивания волос, крем для волос и лак для волос; и гигиено-косметические средства для волос,такие как шампунь, ополаскиватель и препарат для обработки волос. Его количество в космети 001888 16 ческих изделиях может подходящим образом определяться в зависимости от его антибактериальной активности. Что касается других ингредиентов, могут быть использованы ингредиенты, которые обычно сочетаются с косметическими изделиями. Антибактериальный косметический продукт эффективно действует на микроорганизмы, вызывающие атопический дерматит, а также обнаруживает значимое действие в отношении улучшения и предупреждения атопического дерматита. Также может быть получено средство для ванн с использованием антибактериального агента данного изобретения. Средство для ванн данного изобретения может быть приготовлено в форме порошка, гранул, твердого вещества,жидкости и т.д., содержащих эффективное количество, по меньшей мере, одного соединения,выбранного из соединения данного изобретения, его оптически активного аналога или его соли. Сочетаемое количество входящего в состав средства для ванн может соответствующим образом определяться в зависимости от желаемой антибактериальной активности. Что касается других ингредиентов, входящих в состав средства для ванн, могут использоваться ингредиенты, обычно сочетаемые со средствами для ванн. Средство для ванн данного изобретения эффективно действует на микроорганизмы, вызывающие атонический дерматит, а также оно обнаруживает значимый эффект улучшения и предупреждения атонического дерматита. Оно эффективно для уничтожения микроорганизмавозбудителя в ванной комнате. Далее, пищевой продукт или напиток, содержащий, по меньшей мере, одно соединение,выбранное из соединения данного изобретения,его оптически активного аналога или его соли,успешно применим для улучшения и/или предупреждения пищевого отравления, энтерогастрита и т.д. Индуктор апоптоза данного изобретения содержит, по меньшей мере, одно соединение,выбранное из соединения данного изобретения,его оптически активного аналога или его соли, в качестве эффективного ингредиента. Он может быть приготовлен в виде фармацевтических препаратов таким же образом, что и в вышеупомянутом случае противораковых агентов, и введен так же, как и в противораковых агентах. Доза в качестве индукторов апоптоза конкретно не указывается, но может быть определена подходящим образом в зависимости от дозированной лекарственной формы, способа введения, цели применения и возраста, веса тела, состояния и т.д. пациента, которому вводят этот индуктор. Однако, обычно количество, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате для взрослых, равно 0,1 мкг 100 мг/кг в день. Как само собой разумеется, эта 17 доза может варьироваться в зависимости от различных факторов и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как, в других случаях,может быть необходимой доза больше вышеуказанной. Агент данного изобретения может вводиться перорально как таковой и, кроме того, агент может приниматься ежедневно после добавления его к обычной пище и/или напитку. Считается, что, в противоположность некрозу, который является патогенной гибелью клеток, апоптоз представляет собой смерть клеток, которая исходно запрограммирована в гене самой клетки. Таким образом, ген, который программирует апоптоз, активируется определенными внешними или внутренними причинами,вследствие чего на основе этого гена продуцируется белок гена запрограммированной смерти клеток и затем сама клетка разрушается и убивается полученным белком запрограммированной смерти. Индуктор апоптоза данного изобретения является вполне применимым, так как он способен индуцировать такой апоптоз в желаемых тканях и клетках и способен исключать ненужные клетки или патогенные клетки из живых организмов в природном состоянии. Индуктор апоптоза данного изобретения может быть использован в способе индукции апоптоза. Так, при использовании, по меньшей мере, одного из соединений, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного ингредиента можно индуцировать апоптоз, и такой способ применим для выяснения механизма индукции апоптоза и для скрининга индукторов апоптоза и ингибиторов индукторов апоптоза. Соединение данного изобретения или его оптически активный аналог или его соль обладает противоревматической активностью и при использовании, по меньшей мере, одного соединения, выбранного из таких соединений, в качестве эффективного компонента и приготовлении в виде фармацевтического препарата путем объединения с известными фармацевтическими носителями, может быть приготовлен противоревматический агент. Вышеупомянутый фармацевтический препарат может быть приготовлен таким же образом, что и в случае противораковых агентов, и введен так же, как и в случае противоракового агента. Доза в качестве противоревматического препарата конкретно не указывается, но может быть определена подходящим образом в зависимости от дозированной лекарственной формы, способа введения, цели применения и возраста, веса тела, состояния и т.д. пациента, которому вводят этот индуктор. Однако обычно количество, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его 18 соли, содержащееся в препарате для взрослых,равно 0,1 мкг - 200 мг/кг в день. Как само собой разумеется, эта доза может варьироваться в зависимости от различных факторов и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как в других случаях может быть необходимой доза больше вышеуказанной. Препарат данного изобретения может вводиться перорально как таковой и, кроме того, агент может приниматься ежедневно после добавления его к обычной пище и/или напитку. Далее, соединение данного изобретения, его оптически активный аналог или его соль могут быть использованы в качестве материала для этого фармацевтического препарата данного изобретения. Соединение данного изобретения, его оптически активный аналог или его соль имеет разнообразную физиологическую активность,такую как противовоспалительная активность в отношении артрита и т.д., активность ингибирования каррагенанового отека, активность ингибирования продуцирования фактора некроза опухолей, активность увеличения продуцирования интерлейкина-10, активность ингибирования продуцирования моноксида азота, активность индуцирования продуцирования антигенаFas, иммуномодулирующая активность, такая как активность ингибирования сверхчувствительности замедленного типа, активность ингибирования трансформации лимфоцитов, активность ингибирования СКЛ-реакции (реакции смешанной культуры лимфоцитов), активность ингибирования продуцирования IgE и т.д. Таким образом, лекарственное средство, такое как противовоспалительный агент, ингибитор продуцирования фактора некроза опухолей или агент, предотвращающий продуцирование фактора некроза опухолей, усилитель продуцирования интерлейкина-10, иммуномодулятор, ингибитор продуцирования моноксида азота, индуктор продуцирования антигена Fas, иммуномодулятор, ингибитор продуцирования IgE, ингибитор сверхчувствительности замедленного типа и антиаллергический агент, содержащее, по меньшей мере, одно соединение, выбранное из соединения данного изобретения, его оптически активного аналога или его соли, может быть приготовлено в виде фармацевтических препаратов таким же образом, как в случае вышеупомянутого противоревматического агента, и может быть введено так же, как описано выше. Доза этих препаратов конкретно не указывается, но может быть определена подходящим образом в зависимости от дозированной лекарственной формы, способа введения, цели применения и возраста, веса тела, состояния и т.д. пациента, которому вводят этот индуктор. Однако, обычно количество, по меньшей мере,одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате 19 для взрослых, равно 0,1 мкг - 200 мг/кг в день. Как само собой разумеется, эта доза может варьироваться в зависимости от различных факторов и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как, в других случаях может быть необходимой доза больше вышеуказанной. Например, в случае противовоспалительного препарата и ингибитора продуцирования фактора некроза опухолей количество одного или нескольких соединений, выбранных из соединения данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате, равно предпочтительно 10 пг - 50 мг/кг в день для взрослого, тогда как в случае ингибитора продуцирования моноксида азота количество одного или нескольких соединений, выбранных из соединения данного изобретения,его оптически активного аналога или его соли,содержащееся в препарате, равно предпочтительно 0,1 мкг - 20 мг/кг в день для взрослого. В зависимости от цели применения, количество эффективного компонента в препарате может быть регулируемым. Препарат данного изобретения может вводиться перорально как таковой и, кроме того,агент может приниматься также ежедневно после добавления его к обычной пище и/или напитку. Ревматизм представляет собой аутоиммунное заболевание, при котором имеет место препятствие в периостеальных клетках и хрящевых клетках, и антиаллергический агент данного изобретения применим также в качестве терапевтического агента для аутоиммунных заболеваний. Соединение данного изобретения, его оптически активный аналог и его соль ингибирует продуцирование фактора некроза опухолей, который, как считают, является прямой причиной воспаления в органоспецифических аутоиммунных заболеваниях, таких как хронический ревматоидный артрит или воспалительные заболевания, и усиливает образование интерлейкина 10, который представляет собой ингибирующий ТhI цитокин. Таким образом, симптомы воспаления, такие как ревматизм, который является органоспецифическим аутоиммунным заболеванием, в частности, хронический ревматоидный артрит, улучшаются; маркеры воспаления,такие как величина С-реактивного белка (CRP),величина ревматоидного фактора (RF) и скорость оседания эритроцитов (оседание крови),сильно уменьшаются и осложнения, такие как дисбазия (расстройство ходьбы), также значимо улучшаются. Фактор некроза опухолей был обнаружен как фактор, который индуцирует геморрагический некроз в месте опухоли, и, в настоящее время, его считают цитокином, который широко участвует в биоиммунитете на основе воспаления и иммунной функции. Отсутствие успеха в 20 регуляции продуцирования этого фактора некроза опухолей вызывает многочисленные неудобства у хозяина, и избыток или немодулируемое продуцирование фактора некроза опухолей связаны со многими заболеваниями, в том числе хроническим ревматоидным артритом,остеоартритом, подагрическим артритом, сепсисом, септическим шоком, эндотоксиновым бактериально-токсическим шоком, сепсисом, вызываемым грамотрицательными бактериями,синдромом токсического шока, церебральной малярией, хронической пневмонией, болезнью трансплантат против хозяина, реакцией отторжения трансплантата, гриппом и другими лихорадочными состояниями и мышечной болью,вызываемыми инфекционными заболеваниями,вторичной кахексией, вызываемой инфекцией или злокачественной опухолью, вторичной кахексией, вызываемой синдромом приобретенного иммунодефицита человека (СПИДом), СПИДом, ассоциированным со СПИДом синдромом,образованием келоидов, язвенным колитом,множественным склерозом, аутоиммунным сахарным диабетом и системной красной волчанкой [Molecular Medicine, volume 33, pages 10101020 и pages 1182-1189 (1996)]. Ингибитор продуцирования фактора некроза опухолей данного изобретения применим для терапии заболеваний, которые опосредуются или ухудшаются фактором некроза опухолей. Далее, данное изобретение обеспечивает способ регуляции продуцирования фактора некроза опухолей, в котором, по меньшей мере, одно соединение, выбранное из соединения данного изобретения,его оптически активного аналога или его соли,используют в качестве эффективного компонента. Кроме того, данное изобретение обеспечивает пищевой продукт или напиток, содержащий,по меньшей мере, одно соединение, выбранное из соединения данного изобретения, его оптически активного аналога или его соли, который улучшает симптом заболевания или который предупреждает заболевание, опосредованное или ухудшаемое фактором некроза опухолей. Моноксид азота (далее сокращаемый какNO) представляет собой основной фактор эндотелий-зависимого расслабляющего фактора(1987)]. Данное изобретение обеспечивает лекарственное средство, содержащее по меньшей мере одно соединение, выбранное из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного компонента для лечения или предупреждения заболеваний, требующих ингибирования образования NO. He существует особого ограничения для заболеваний, требующих ингибирования продуцирования NO, и примерами их являются системная (общая) гипотензия, вызываемая токсическим шоком или терапией определенного цитокина, понижение в реакции кровяного давления, аутоиммунные заболевания, 21 воспаление, артрит, ревматоидный артрит, сахарный диабет, воспалительные болезни кишечника, недостаточность функции кровеносных сосудов, повреждения тканей, сердечнососудистая ишемия, чувствительность к боли,церебральная ишемия, заболевания, обусловленные ангиогенезом, рак и т.д. Эти заболевания включают в себя заболевания, которые упоминаются в Japanese Laid-Open Patent Publications Hei-09/504524; 09/505288; 08/501069; 08/512318 и 06/508849. Ингибитор продуцирования NO, содержащий, по меньшей мере, одно соединение, выбранное из соединения данного изобретения,его оптически активного аналога или его соли, в качестве эффективного компонента, применим для исследования механизма образования NO и механизма биологической активности NO и,кроме того, он может быть использован для скрининга веществ, участвующих в механизме образования NO. Соединение данного изобретения, его оптически активный аналог или его соль имеет активность ингибирования образования NO в продуцирующих NO клетках. Например, при добавлении эндотоксина (липосахарида илиLPS) к штамму макрофагальных клеток экспрессируется индуцируемая(NOS) и NO секретируется в среду, тогда как при добавлении LPS в присутствии одновременно соединения данного изобретения, его оптически активного аналога или его соли продуцирование NO ингибируется. Когда продуцирование NO индуцируется LPS, скорость выживания клеток уменьшается вследствие цитопатической активности NO, но, когда соединение данного изобретения, его оптически активный аналог или его соль добавляют во время обработки LPS, продуцирование NO уменьшается и повреждение клеток также супрессируется. Ангиогенез является существенным для роста твердой карциномы, и фактор ангиоэндотелиального роста/фактор васкулярного эндотелиального роста (VEGF) играет важную роль в этой стадии. В различных раковых клеткахVEGF индуцируется NO. Когда соединение данного изобретения, его оптически активный аналог или его соль ингибирует продуцированиеNO, продуцирование VEGF раковых клеток также ингибируется и, в результате, ингибируется ангиогенез вокруг раковых тканей. Когда соединение данного изобретения, его оптически активный аналог или его соль вводят мышам, в которых образован твердый рак подкожной трансплантацией раковых клеток, образование кровеносных сосудов вокруг раковых тканей становится недостаточным и рак отделяется от них. Нитрозоамины являются рядом соединений, которые синтезируются присоединением нитрозогруппы к вторичному амину, известны несколько сотен нитрозоаминов. Многие из них 22 повреждают ДНК и являются канцерогенными для животных. Сообщалось, что нитрозоамины имеют в значительной степени отношение к образованию рака, также и у человека, и обычно продуцируются в желудке реакцией нитрита с амином. Даже при физиологических условиях нейтрального рН NO взаимодействует с амином с образованием нитрозамина. Кроме того, продуцирование NO увеличивается у пациентов,инфицированных восточной печеночной двуусткой, и у пациентов, страдающих от цирроза печени, который тесно связан с раком иммунологически. В соответствии с этим, когда увеличение продуцирования NO подавляется введением соединения данного изобретения, его оптически активного аналога или его соли, можно предотвратить образование рака, в частности, в группе высокого риска. Таким образом, соединение данного изобретения, его оптически активный аналог или его соль проявляет противораковое действие в двух стадиях ингибирования онкогенеза и также ингибирования ангиогенеза в раковых тканях. Далее, NO индуцирует отек, который отмечают как характерный признак в воспалительных повреждениях, т.е. проницаемость кровеносных сосудов [Maeda, et al., Japanese Journal(1994)], и также индуцирует биосинтез простагландинов, которые являются медиаторами воспаления [Salvemini, et al., Proceedings of NationalAcademy of Sciences, U.S.A., volume 90, pages 7240-7244 (1993)]. С другой стороны, считается,что NO быстро реагирует с супероксидными радикалами и образующийся пероксинитрит вызывает повреждения воспалительных клеток и тканей. При поступлении иммунных клеток в орган и высвобождении из них цитокина продуцирование NO индуцируется. Инсулинзависимый сахарный диабет является заболеванием, вызываемым специфическим разрушением Р-клеток островков Лангерганса и это разрушение производится NO. Кроме того, суставная жидкость повреждений пациентов, страдающих от хронического ревматизма суставов, костно-суставного ревматизма, подагрического артрита и артрита,сопровождающегося болезнью Бехчета, содержит более высокие концентрации NO, чем суставная жидкость в нормальных суставах таких пациентов или в суставах здоровых людей. При введении соединения данного изобретения, его оптически активного аналога или его соли таким пациентам продуцирование NO в этих повреждениях ингибируется и симптом облегчается. Во время церебральной ишемии и после повторной инфузии продуцирование NO увеличивается и в результате повреждаются ткани мозга. При введении соединения данного изобретения, его оптически активного аналога или его соли пациенту во время церебральной ише 23 мии повреждение тканей мозга уменьшается и прогноз улучшается. Поверхностный клеточный антиген, который назван Fas антигеном (антигеном АРО-1 или CD95) привлек к себе внимание как молекула индуцирования апоптоза [Cell, volume 66,pages 233-243 (1991); J. Exp. Med., volume 169,pages 1747-1756 (1989); J. Biol. Chem., volume 267, pages 10709-10715 (1992) и J. Immunology,volume 184, pages 1274-1279 (1992)]. Антиген Fas экспрессируется в иммунных клетках, таких как клетки тимуса, Т-клетки, цитотоксические Т-клетки, В-клетки и NK-клетки. Против инвазии чужеродного не аутоантигена иммунная система индуцирует иммунореакцию,посредством которой этот не аутоантиген устраняется. Однако он не обнаруживает иммунореакции, но устанавливается иммунологическая самонеотвечаемость. Это происходит потому,что стволовые клетки лимфоцитов, обладающие аутореактивностью, подвергаются удалению клонов, которое является негативным отбором,посредством которого устранение происходит в результате смерти клеток, вызываемой апоптозом. Однако, когда эти клетки не подвергаются апоптозу вследствие некоторой аномалии в живом организме, такой как генетический дефицит антигена Fas, аутореактивные Т-клетки, например, накапливаются в периферических зонах. В нормальном живом организме аутотолерантность доступна даже для В-клеток, которые являются клетками, ответственными за иммунитет, и аутореактивные В-клетки обычно погибают вследствие апоптоза, но, когда эти аутореактивные В-клетки не подвергаются апоптозу вследствие аномалии, такой как генетический дефицит антигена Fas, аутореактивные В-клетки накапливаются в периферических зонах. Кроме того, в случае суставного ревматизма вышеупомянутое отклонение от нормы в аутореактивных лимфоцитах и отклонение в обороте синовиальных клеток являются в некоторой степени причинами этих заболеваний. Индуктор продуцирования антигена Fas, в котором, по меньшей мере, одно соединение данного изобретения, его оптически активный аналог или его соль является эффективным компонентом, применим для индукции апоптоза ненужных клеток для конституции живого организма, которые не выбрасываются из живого организма из-за нарушения оборота и аутореактивных лимфоцитов, и может быть использован в способе индукции продуцирования антигенаFas. Препарат, содержащий, по меньшей мере,одно соединение данного изобретения, его оптически активный аналог или его соль в качестве эффективного компонента, применим также в качестве агента для предупреждения или терапии заболеваний, сопровождающихся аномальным продуцированием антигена Fas. В данном изобретении нет конкретного ограничения в отношении заболеваний, сопровождающихся 24 аномальным продуцированием антигена Fas, и примерами этого нарушения являются суставной ревматизм и аутоиммунные заболевания,вызываемые аутореактивными Т-клетками и аутореактивными В-клетками, и т.д., в том числе заболевания, упоминаемые в описании WО 97/0965. Соединение данного изобретения, его оптически активный аналог или его соль имеет иммуномодулирующую активность, такую как стимулирующая активность продуцирования интерлейкина-10, ингибирующая активность сверхчувствительной реакции замедленного типа, ингибирующая активность реакции смешанной культуры лимфоцитов, ингибирующая активность продуцирования IgE и ингибирующая активность каррагенанового отека, и иммуномодулятор, содержащий, по меньшей мере,одно соединение данного изобретения, его оптически активный аналог или его соль в качестве эффективного компонента, применим в качестве агента для терапии или предупреждения заболеваний, вызываемых аномалией (нарушением) иммунной системы и иммунного фактора. Таким образом, в результате уменьшения продуцирования интерлейкина-10 активируется Тh1 и индуцируется воспаление Тh1 доминантного аутоиммунитета. Это воспаление участвует в органоспецифических аутоиммунных заболеваниях, таких как нефрит и гепатит, а также в отторжении трансплантата и аллергическом контактном дерматите. Иммуномодулятор данного изобретения усиливает продуцирование интерлейкина-10 и ингибирует активность Тh1,вследствие чего он применим для терапии и предупреждения таких заболеваний. Трансформация лимфоцитов является реакцией, в которой митоген связывается с рецептором на поверхности лимфоцита с активацией этого лимфоцита, вследствие чего усиливаются деление и рост лимфоцита. Реакция смешанной культуры лимфоцитов является реакцией, в которой лимфоциты, полученные из животных одного и того же вида, но различных штаммов,подвергают смешанному культивированию, при котором индуцируется активация лимфоцитов вследствие противоречия основных тканеадаптируемых антигенов и усиливаются деление и рост лимфоцитов. Вышеупомянутый иммуномодулятор ингибирует эти реакции и применим, в частности, для терапии или профилактики хронических аутоиммунных заболеваний,вызываемых аномальной стимуляцией лимфоцитов, таких как хронический нефрит, хронический колит, сахарный диабет типа I и хронический суставной ревматизм, и также применим в ингибировании отторжения трансплантата. Каррагенановая модель отека стоп является реакцией, в которой каррагенан, являющийся индуктором воспаления, инъецируют подкожно в лапки для индукции воспалительных клеток,таких как макрофаги и нейтрофилы, в результа 25 те чего проницаемость кровеносных сосудов увеличивается воспалительными факторами,продуцируемыми этими клетками, вызывая отек. Ингибирующее действие вышеупомянутого иммуномодулятора в отношении отека применимо для терапии или предупреждения заболеваний, требующих контроля стимуляции проницаемости кровеносных сосудов, таких как хронический суставной ревматизм. В аллергических заболеваниях, таких как астма и атопический дерматит, высвобождение химических медиаторов из мастоцитов играет важную роль в аллергической реакции. Эта реакция индуцируется при связывании IgE с рецепторами на клеточной мембране с образованием перекрестного сшивания, и иммуномодулятор данного изобретения ингибирует продуцирование IgE и вполне применим для облегчения симптомов и/или предупреждения заболеваний, опосредованных или ухудшаемых продуцированием IgE, таких как аллергические заболевания, вызываемые IgE, в том числе бронхиальной астмы, аллергического ринита, атонического дерматита, аллергического конъюнктивита, крапивницы, анафилактического шока и т.д. Кроме того, иммуномодулятор данного изобретения ингибирует сверхчувствительную реакцию замедленного типа и применим для терапии и предупреждения заболеваний, сопровождающихся аллергией замедленного типа, таких как контактная аллергия, аллергический контактный дерматит, бактериальная аллергия,грибковая аллергия, вирусная аллергия, лекарственная аллергия, тиреоидит и аллергический энцефалит. В результате патологических исследований в отношении сахарного диабета, проведенных в последние годы, сообщалось, что нормальные жировые клетки играют важную роль в нормальном системном действии инсулина и что, для благополучного прогресса сахаридного метаболизма, нормальные жировые клетки являются необходимыми [Jikken Idaku, volume 14,pages 61-68 (1996)]. Соединение данного изобретения, его оптически активный аналог или его соль обладает способностью индуцирования дифференциации предшественника жировых клеток, такого как предшественник фибробластов, и индуцирует дифференциацию этих клеток в жировые клетки. Таким образом, при введении соединения данного изобретения, его оптически активного аналога или его соли количество нормальных жировых клеток увеличивается, вследствие чего симптом сахарного диабета ослабляется. Соединение данного изобретения, его оптически активный аналог или его соль обладает гипогликемической активностью и теперь можно приготовить агент для терапии или предупреждения сахарного диабета, содержащий, по меньшей мере, одно соединение, выбранное из соединения данного изобретения, его оптически 26 активного аналога или его соли, в качестве эффективного компонента. Таким образом, при использовании, по меньшей мере, одного соединения, выбранного из таких соединений, и приготовлении его в виде фармацевтического препарата путем объединения с известными фармацевтическими носителями, теперь можно приготовить средство для терапии или профилактики сахарного диабета. Вышеупомянутый фармацевтический препарат может быть приготовлен так же, как в случае вышеупомянутого противоракового агента, и может вводиться так же, как в случае вышеупомянутых лекарственных средств. Доза в качестве агента для терапии или предупреждения сахарного диабета конкретно не указывается, но может быть определена подходящим образом в зависимости от дозированной лекарственной формы, способа введения,цели применения и возраста, веса тела, состояния и т.д. пациента, которому вводят этот индуктор. Однако, обычно количество, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате для взрослых, равно 10 пг - 200 мг/кг в день. Указанная доза может варьироваться в зависимости от различных факторов и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как в других случаях, может быть необходимой доза выше вышеуказанной. Агент данного изобретения может вводиться перорально как таковой и,кроме того, этот агент может приниматься также ежедневно после добавления к обычной пище и/или напитку. Далее, соединение данного изобретения,его оптически активный аналог или его соль могут быть использованы в качестве материала для пищевого продукта или напитка для улучшения или предупреждения сахарного диабета. При приеме продукта, содержащего соединение данного изобретения, его оптически активный аналог или его соль, улучшается состояние при сахарном диабете и количество сахара в моче значительно уменьшается. Кроме того, заметно ослабляются осложнения, такие как гипогонадизм. Далее, улучшается также гиперлипемия. Соединение данного изобретения, его оптически активный аналог или его соль обладает активностью улучшения гиперлипемии или активностью снижения свободных жирных кислот в сыворотке, и при использовании, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного компонента и приготовлении его в виде фармацевтического препарата путем объединения с известными фармацевтическими носителями, теперь можно приготовить средство для лечения или профилактики гиперлипемии. Приготовление такого препарата может проводиться 27 так же, как в случае вышеупомянутого терапевтического или профилактического средства для сахарного диабета, может вводиться так же, как терапевтическое или профилактическое средство для сахарного диабета. Кроме того, соединение данного изобретения, его оптически активный аналог или его соль могут быть использованы в качестве материала для пищевого продукта или напитка для улучшения или предупреждения гиперлипемии. При приеме продукта, содержащего соединение данного изобретения, его оптически активный аналог или его соль, гиперлипемия ослабляется и уровень липидов в крови значительно уменьшается. Кроме того, когда соединение данного изобретения, его оптически активный аналог или его соль, обладающие способностью индуцировать дифференциацию предшественника жировой клетки в жировую клетку, используют в качестве эффективного компонента и в приготовлении фармацевтических препаратов, объединяя с известными фармацевтическими носителями, можно приготовить средство для индуцирования дифференциации предшественника жировых клеток в жировые клетки. Приготовление такого препарата может проводиться так же, как в случае вышеупомянутого терапевтического или профилактического средства для сахарного диабета, и может вводиться так же как в случае средства для терапии или профилактики сахарного диабета. Далее, соединение данного изобретения,его оптически активный аналог или его соль обладают ингибирующей активностью в отношении продуцирования фактора некроза опухолей и применимы для терапии или предупреждения не инсулинзависимого сахарного диабета,вызываемого фактором некроза опухолей [Nature, volume 389, pages 610-614 (1997)]. Соединение данного изобретения, его оптически активный аналог или его соль обладает антивирусной активностью и при использовании, по меньшей мере, одного соединения, выбранного из соединения данного изобретения,его оптически активного аналога или его соли, в качестве эффективного компонента и приготовлении его в виде фармацевтического препарата путем объединения с известными фармацевтическими носителями, теперь можно приготовить антивирусный агент. Приготовление антивирусного агента может проводиться так же, как в случае вышеупомянутого противоракового агента, и он может вводиться так же, как в случае вышеупомянутых лекарственных средств. Доза антивирусного агента конкретно не указывается, но может быть определена подходящим образом в зависимости от дозированной лекарственной формы, способа введения, цели применения и возраста, веса тела, состояния и т.д. пациента, которому вводят этот индуктор. Однако обычно количество, по меньшей мере,одного соединения, выбранного из соединения 28 данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате для взрослых, равно 0,1 мкг - 20 мг/кг в день. Как само собой разумеется, эта доза может варьироваться в зависимости от различных факторов и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как в других случаях может быть необходима доза выше вышеуказанной. Препарат данного изобретения может вводиться перорально как таковой, а также может приниматься ежедневно после добавления к обычной пище и/или напитку. Кроме того, соединение данного изобретения, его оптически активный аналог или его соль могут быть использованы в качестве материала для антивирусного пищевого продукта или напитка. Соединение данного изобретения, его оптически активный аналог или его соль обладает антивирусной активностью против ДНК-вируса,РНК-вируса, ретровируса и вироида. Таким образом, оно может быть использовано в качестве антивирусного агента для человека и животных, которые подвергаются вирусным заболеваниям (например, для домашних животных, домашних птиц и разводимых животных, таких как рыба и креветки), в качестве антивирусного агента для растений, например,для вирусных заболеваний сельскохозяйственных продуктов и продуктов садоводства/овощеводства (например, цветов и овощей), и в качестве антивирусного агента для полезных живых существ. Примерами ДНК-вируса, инфицирующего этих животных, являются поксвирусы, герпесвирусы, аденовирус, вирус гепатита В, папилломавирусы, вирусы полиомы, вирус ЭпштейнаБарр и бакуловирус, тогда как примером ДНКвируса, инфицирующего растения, является вирус мозаики цветной капусты. Примерами РНКвируса, инфицирующего животных, являются ротавирус, вирус краснухи, вирус Японского энцефалита, вирус денге, вирус ньюкаслской болезни птиц, вирус кори, вирус эпидемического паротита, вирус чумы, вирус гриппа, вирус везикулярного стоматита, вирус полиомиелита человека, вирус гепатита А и вирус гепатита С,тогда как РНК-вирусом, инфицирующим растения, являются вирус табачной мозаики, вирус карликовости пшеницы, вирус полосатости риса и вирус кольцевой пятнистости табака. Примерами ретровируса являются вирус Т-клеточного лейкоза взрослых и вирус синдрома приобретенного иммунодефицита человека и примером вироидов является вироид веретеновидности клубней картофеля. Соединение данного изобретения, его оптически активный аналог или его соль эффективны для терапии и профилактики вирусных заболеваний животных (не человека) и птиц,таких как курица и индейка, и холоднокровных животных, таких как рыба, и такое соединение 29 обладает антивирусной активностью в отношении следующих не относящихся к человеку вирусов. Они представляют собой sciruid вирус герпеса типа 1, cavlid вирус герпеса типа 1, лагоморфный вирус герпеса типа 1, phasianid вирус герпеса типа 1, phasianid вирус герпеса типа 2, вирус герпеса типа 1 индеек, anatid вирус герпеса типа 1, вирус герпеса типа 1 полосатой зубатки, вирус герпеса типа 3 лошадей, вирус герпеса типа 1 крупного рогатого скота, вирус герпеса типа 3 крупного рогатого скота, вирус герпеса типа 4 крупного рогатого скота, вирус герпеса типа 1 свиней, вирус герпеса типа 2 свиней,вирус герпеса типа 1 мышиных, cebid вирус герпеса типа 1, cebid вирус герпеса типа 2, tupalid вирус герпеса типа 1, вирус герпеса типа 1 собак, вирус герпеса типа 1 кошек, вирус герпеса типа 1 лошадей и вирус герпеса типа 2 лошадей. Вирусные болезни птиц, такие как болезнь Марека, могут предупреждаться и/или лечиться соединением, используемым в данном изобретении, при помощи способа, известного в ветеринарии или разведении, в котором антивирусный агент данного изобретения вводят птицам инъекцией или добавляют к корму или воде для питья. Далее, при добавлении соединения, используемого в данном изобретении, непосредственно в водоем, резервуар с водой, сливной танк или воду, морскую воду и т.д. в зоне разведения или смешивании с кормом следующие болезни могут так же предотвращаться и/или излечиваться. Это вирусные болезни рыбы, живущей в узком секторе, таком как бассейн, водный резервуар, сливной танк, или в зоне разведения,инфицированной вирусом герпеса, таким как вирус малой зубатки, вирус герпеса соломонов и вирус нерки, и их примерами являются инфекционное вызывающее некроз заболевание кроветворных органов, инфекционные болезни вируса герпеса или инфекционное вызывающее некроз заболевание поджелудочной железы рыб из семейства лососевых, вирусная геморрагическая септицемия радужной форели, весенняя виремия карпа, кистозная лимфангиома различных рыб, вирусная вызывающая некроз болезнь эритроцитов морской рыбы и анадромной рыбы,рабдовирусное заболевание камбалообразных и т.п., язва морды торафугу (разновидности перчаточной рыбы) и т.д. В некоторых случаях,точная регуляция введения соединения, используемого в данном изобретении, и антивирусного агента данного изобретения естественным образом зависит от необходимости для каждого подвергаемого лечению животного, типа обработки и оценки животновода. Животные, которым вводят антивирусный агент данного изобретения, способный сохранять их здоровье, вследствие чего улучшение коэффициента выживаемости, скорости роста,частоты отложения икры и т.д. являются значительными. 30 Соединение данного изобретения, его оптически активный аналог или его соль, используемые в данном изобретении, ингибируют синтез вирусных белков и ингибируют также синтез вирусного генома и, следовательно, проявляют сильное антивирусное действие. Кроме того, они селективно убивают клетки, инфицированные этими вирусами. Например, даже в пациентах, страдающих от вируса иммунодефицита человека (далее сокращаемого как ВИЧ), все CD4-позитивные клетки не инфицируются ВИЧ, а только часть их инфицирована ВИЧ. Антивирусный агент данного изобретения ингибирует продуцирование ВИЧ в этих инфицированных клетках, в то же самое время, селективно убивает инфицированные клетки и индуцирует резистентность к вирусу у неинфицированных клеток, вследствие чего можно удалить ВИЧ из этих клеток. Соединение данного изобретения, его оптически активный аналог или его соль обладает способностью улучшать функцию печени и активностью индукции белка теплового шока. Агент для улучшения функции печени и агент для индуцирования белка теплового шока, содержащие, по меньшей мере, одно соединение,выбранное из соединения данного изобретения,его оптически активного аналога или его соли,могут быть приготовлены в виде фармацевтического препарата так же, как в случае вышеупомянутого антивирусного агента, и могут вводиться таким же образом, что и в случае антивирусного агента. Доза в качестве агента для улучшения функции печени и для индуцирования белка теплового шока конкретно не указывается, но может быть определена подходящим образом в зависимости от дозированной лекарственной формы, способа введения, цели применения и возраста, веса тела, состояния и т.д. пациента,которому вводят этот индуктор. Однако обычно количество, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате для взрослых,равно 0,1 мкг - 20 мг/кг в день. Как само собой разумеется, эта доза может варьироваться в зависимости от различных факторов и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как,в других случаях, может быть необходима доза выше вышеуказанной. Агент данного изобретения может вводиться перорально как таковой, а также может приниматься ежедневно после добавления к обычной пище и/или напитку. Кроме того, по меньшей мере, одно из соединений,выбранное из соединения данного изобретения,его оптически активного аналога или его соли,может быть использовано в качестве материала для пищевого продукта или напитка с целью улучшения функции печени или для индуцирования белка теплового шока. 31 При приеме соединения данного изобретения, его оптически активного аналога или его соли нарушение в функции печени улучшается и величины GOT (глутамин-оксалацетаттрансаминазы, трансферазы) и GPT (аланинаминотрансферазы) становятся нормальными. Кроме того, соединение данного изобретения, его оптически активный аналог или его соль обладает активностью индуцирования белка теплового шока 70 кДа (БТШ 70) и т.д. и обладает антивирусной активностью в отношении РНК-вируса и ДНК-вируса, такого как вирус гепатита, вирус СПИДа, вирус гриппа, вирус везикулярного стоматита и вирус герпеса. Белок теплового шока участвует в иммунитете против рака, и эти соединения также эффективны в иммунитете против рака. Кроме того, указанные соединения обладают биозащитной активностью, такой как антивоспалительная активность. При приеме соединения данного изобретения,его оптически активного аналога или его соли вирусные заболевания, такие как простуда или грипп, могут предупреждаться и излечиваться. При этом, белок теплового шока представляет собой общее название для белка, синтез которого индуцируется, когда клетка или индивидуум подвергается внезапному изменению температуры, которое выше, чем нормальная температура до степени около 5-10 С, и он широко распространен в прокариотах и высших эукариотах. Примерами известного белка теплового шока являются БТШ 90, БТШ 70, убиквитин и БТШ 26. Среди них БТШ 70 является типом молекулярного белка-"наставника" и он связывается с белком, укладка которого является неполной или выполнена неполностью, для помощи образованию стереоструктуры. Аминокислотная последовательность этого белка теплового шока хорошо сохранялась в ходе эволюции и БТШ 70 является идентичным белку DnaKEscherichia coli. В человеке имеется около десяти генов БТШ 70 и некоторые из них экспрессируются структурно, тогда как другие индуцируются различными стимуляторами. Кроме теплового шока, синтез белка теплового шока индуцируется различными химическими веществами и клеточным затруднением, таким как окисление. С. Amici, et al. сообщали [Journal of Virology, volume 68, pages 6890-6899 (1994)], что,когда клетки животных, инфицированные вирусом Sendai, инкубируют в присутствии простагландина A1, имеющего , Р-ненасыщенную карбонильную группу, синтез БТШ 70 и БТШ 90 индуцируется и что, во время синтеза БТШ 70,синтез вирусного белка ингибируется. Далее, А.(1996)], что, как и в случае простагландина A1,2-циклопентен-1-он индуцирует синтез БТШ 70 и ингибирует синтез белка вируса везикулярного стоматита. 32 Способность соединения данного изобретения индуцировать БТШ 70 отмечается при 10 мкМ и становится максимальной при 20-30 мкМ, и можно сказать, что это очень высокая индуцирующая способность, в сравнении с тем,что для индукции 2-циклопентен-1-оном БТШ 70 требуется концентрация нескольких сотен мкМ. Так как соединение данного изобретения,его оптически активный аналог или его соль обладает высокой индуцирующей способностью в отношении белка теплового шока, он обладает антивирусной активностью в отношении ДНКвируса, РНК-вируса, ретровируса и вироида. Примеры таких вируса и вироида приведены выше. Кроме того, соединение данного изобретения, его оптически активный аналог или его соль обладает активностью ингибирования роста раковых клеток, которые трансформированы геном рака, и обладает активностью предупреждения канцерогенеза, вызываемого геном рака. Например, вирус папилломы является ДНК-вирусом, принадлежащим к семействуPapovaviridae и роду Papillomavirus, и, что касается вируса папилломы человека (HPV), известен, например, HPV типа 16, который является возбудителем рака шейки матки. Соединение данного изобретения, его оптически активный аналог или его соль обладает активностью ингибирования роста клеток, которые превращаются в раковые клетки геном рака Е 7 HPV типа 16. Таким образом, ингибирующий агент роста раковых клеток, которые превращаются в раковые клетки вирусом, может быть обеспечен применением, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного компонента,в результате чего малигнизирование геном рака может быть предотвращено. При этом, соединение данного изобретения, его оптически активный аналог или его соль обладает активностью ингибирования канцерогенеза в двух стадиях в качестве инициатора и стимулятора, и теперь может быть обеспечен ингибирующий агент в отношении химического малигнизирования, содержащий, по меньшей мере, одно соединение, выбранное из вышеупомянутых соединений, в качестве эффективного компонента. Таким образом, может быть обеспечен пищевой продукт или напиток для предупреждения канцерогенеза, содержащий, по меньшей мере, одно соединение, выбранное из соединения данного изобретения, его оптически активного аналога или его соли. Соединение данного изобретения, его оптически активный аналог или его соль обладает активностью ингибирования продуцированияIgE и сверхчувствительной реакции замедленного типа и при использовании, по меньшей 33 мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного компонента и в приготовлении его в виде фармацевтического препарата путем объединения с известными фармацевтическими носителями, может быть приготовлен антиаллергический агент. Приготовление этого препарата может проводиться так же, как в случае вышеупомянутого противоракового агента. При этом,антиаллергический агент данного изобретения может быть введен подходящим способом введения в зависимости от дозированной лекарственной формы. Не существует конкретного ограничения для пути введения, и введение может выполняться перорально или наружным способом или посредством инъекции. Например, таблетки, пилюли, гранулы, разбавляемый порошок, жидкость, суспензия, сироп и капсулы могут быть введены перорально. Инъекция может быть, например, внутривенной, внутримышечной, подкожной или внутрикожной. Мазь, крем и т.д. могут вводиться чрескожно. Суппозитории могут быть введены ректально. Могут быть также приготовлены водные или неводные глазные капли, и примерами глазных капель для введения в глаз являются глазная мазь, наносимая кисточкой жидкость, разбрызгивающийся препарат и вставляющийся препарат. Для ингаляции, используют раствор или суспензию эффективного компонента в обычных фармацевтических носителях и применяют, например, в виде аэрозольного спрея для ингаляции. Можно также вводить сухой и порошкообразный эффективный компонент при помощи устройства для ингаляции или т.п., так что компонент может непосредственно вступать в контакт с легкими. Доза в качестве антиаллергического препарата конкретно не указывается, но может быть определена подходящим образом в зависимости от дозированной лекарственной формы, способа введения, цели применения и возраста, веса тела, состояния и т.д. пациента, которому вводят этот индуктор. Однако обычно количество, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли, содержащееся в препарате для взрослых,равно 10 пг - 50 мг/кг в день. Как само собой разумеется, эта доза может варьироваться в зависимости от различных факторов и, следовательно, в некоторых случаях может быть достаточной доза меньше вышеуказанной, тогда как в других случаях может быть необходима доза выше указанной. Препарат данного изобретения может вводиться перорально как таковой и,кроме того, этот агент может приниматься также ежедневно после добавления к обычной пище и/или напитку. Препарат для ингибирования продуцирования IgE и сверхчувствительной реакции за 001888 34 медленного типа, содержащий, по меньшей мере, одно соединение, выбранное из соединения данного изобретения, его оптически активного аналога или его соли, в качестве эффективного компонента, может быть приготовлен в виде фармацевтического препарата так же, как и в случае вышеупомянутого антиаллергического агента, и может вводиться таким же способом,что и в случае антиаллергического агента. Далее, соединение данного изобретения,его оптически активный аналог или его соль могут быть использованы в качестве материала для антиаллергического пищевого продукта или напитка. При приеме соединения данного изобретения, его оптически активного аналога или его соли симптомы заболеваний, вызываемых продуцированием IgE и сверхчувствительной реакцией замедленного типа, ослабляются и,кроме того, вышеупомянутое соединение обладает превосходной превентивной активностью в отношении таких заболеваний. Антиаллергический препарат данного изобретения ингибирует продуцирование IgE и является очень ценным для улучшения и/или лечения в случае заболеваний, которые опосредуются или ухудшаются продуцированием IgE,таких как аллергические заболевания, вызываемые IgE, в том числе бронхиальной астмы, аллергического ринита, атонического дерматита,аллергического конъюнктивита, крапивницы и анафилактического шока. Он также ингибирует сверхчувствительную реакцию замедленного типа и применим для терапии и предупреждения заболеваний, сопровождающихся сверхчувствительной реакцией замедленного типа, таких как контактная аллергия, аллергический контактный дерматит, бактериальная аллергия,грибковая аллергия, вирусная аллергия, лекарственная аллергия, тиреоидит и аллергический энцефалит. Соединение данного изобретения, его оптически активный аналог или его соль обладает физиологическими активностями, такими как противораковая активность, активность ингибирования роста раковых клеток, индуцирующая апоптоз активность, активность ингибирования топоизомеразы II, активность индукции дифференциации раковых клеток, противоревматическая активность, активность ингибирования хронического ревматизма суставов, активность индукции продуцирования антигена Fas, антибактериальная активность, антивирусная активность, активность улучшения функции печени,активность индукции белка теплового шока,активность нормализации компонентов крови,активность, усиливающая иммунитет против рака, противовоспалительная активность, активность ингибирования экспрессии фактора некроза опухолей, активность ингибирования продуцирования моноксида азота, иммуномодулирующая активность, такая как активность ингибирования сверхчувствительной реакции 35 замедленного типа, активность ингибирования трансформации лимфоцитов, активность ингибирования СКЛ-реакции (реакции смешанной культуры лимфоцитов), активность ингибирования продуцирования IgE и активность ингибирования каррагенанового отека и, вследствие этих активностей, пищевой продукт или напиток, содержащий, по меньшей мере, одно соединение, выбранное из соединения данного изобретения, его оптически активного аналога или его соли, применим в качестве функционального пищевого продукта или функционального напитка, имеющего вышеупомянутые различные физиологические активности. При этом, в приготовлении пищевого продукта или напитка данного изобретения можно использовать обработанный нагреванием продукт, содержащий циклопентенон или частично очищенный циклопентенон, или очищенный циклопентенон из обработанного нагреванием продукта, и может быть использовано соединение, содержащее SH-группу, и соединение данного изобретения, которое продуцируется во время стадий приготовления. Таким образом, пищевой продукт или напиток, в котором содержится, по меньшей мере,одно соединение, выбранное из соединения данного изобретения (которое является продуктом реакции материала, выбранного из содержащего циклопентенон обработанного нагреванием продукта и частично очищенного циклопентенона и очищенного циклопентенона из обработанного нагреванием продукта, с соединением, содержащим SH-группу), его оптически активного аналога или его соли, продукт или напиток, в котором растворено это соединение и/или к которому добавлено это соединение,охватываются термином пищевой продукт или напиток данного изобретения. Не существует конкретного ограничения для способа приготовления пищевого продукта и напитка данного изобретения, но могут быть применены варка, обработка и обычно применяемые способы приготовления пищевого продукта и напитка, при условии, что в полученном пищевом продукте или напитке содержится эффективное количество, по меньшей мере, одного соединения, выбранного из соединения данного изобретения, его оптически активного аналога или его соли. В приготовлении пищевого продукта или напитка обработка нагреванием может быть проведена во время любой из стадий, в результате чего циклопентенон содержится в обработанном нагреванием продукте с последующей реакцией с соединением, имеющим SH-группу,или, альтернативно, обрабатываемое нагреванием вещество, которое содержит соединение данного изобретения, может быть добавлено к соединению, содержащему SH-группу. Можно также добавлять пищевой продукт, напиток или их материал к обработанному нагреванием ве 001888 36 ществу, содержащему соединение данного изобретения, так что соединение данного изобретения в этом обработанном нагреванием продукте может быть разбавлено. Добавление можно проводить либо единовременно, либо разделением на несколько временных точек. Таким образом, пищевой продукт или напиток, обладающие новой физиологической активностью,могут быть приготовлены легко и удобно. Не существует конкретного ограничения в отношении формы пищевого продукта или напитка данного изобретения, пока в них содержится, к ним добавляется и/или в них растворяется, по меньшей мере, одно соединение, выбранное из соединения данного изобретения,его оптически активного аналога или его соли,имеющее физиологические активности, такие как противораковая активность, антибактериальная активность, индуцирующая апоптоз активность, антивирусная активность и активность улучшения функции печени. Так, эта форма включает в себя формы, которые могут приниматься перорально, такие как таблетки,гранулы, капсулы, гель и золь. Пищевой продукт или напиток данного изобретения содержит соединение данного изобретения, его оптически активный аналог или его соль, имеющие физиологические активности и, вследствие различных физиологических активностей вышеупомянутого соединения, таких как противораковая активность, антибактериальная активность, индуцирующая апоптоз активность, антивирусная активность и активность улучшения функции печени, он представляет собой полезный для здоровья пищевой продукт или напиток, обладающий предотвращающим канцерогенез действием и ингибирующим рак действием, а также улучшающим симптомы действием, превентивным действием в отношении заболеваний, обнаруживающих чувствительность к соединению данного изобретения, его оптически активному аналогу или его соли, таких как вирусные заболевания, сахарный диабет, ревматизм, аллергия и аутоиммунные заболевания, или улучшающим функцию печени действием, и, кроме того, он является пищевым продуктом или напитком, который применим для поддержания стойкости живого организма или, в частности, для поддержания здоровья желудка и ассоциированных органов. Кроме того, благодаря его антибактериальной активности, пищевой продукт или напиток очень хорошо сохраняется. Не наблюдали токсичности в соединении данного изобретения, его оптически активном аналоге или его соли, даже при введении дозы,эффективной для получения этих физиологических активностей. Например, в случае перорального введения не наблюдали случая смерти у крыс при одном пероральном введении 1000 мг/кг любого из соединений, представленных 37 формулами [VII], [VIII], [IX] и [X], а также их оптически активных аналогов или их соли. Таким образом, соединение данного изобретения, его оптически активный аналог или его соль являются очень полезными соединениями в широких областях фармацевтических препаратов, пищевом продукте, напитке и т.д.,вследствие их многообразных физиологических функций. Такое соединение данного изобретения может быть приготовлено даже в виде пищевого продукта или напитка как продукт реакции циклопентенона с соединением, имеющимSH-группу, таким как SH-содержащая аминокислота и ее производные, в том числе цистеинсодержащие аминокислотные производные, и применение таких получаемых искусственно соединений также включено в данное изобретение. Примеры Данное изобретение иллюстрируется при помощи следующих далее примеров, хотя данное изобретение не ограничивается этими примерами. В некоторых случаях "%", используемый в примерах, обозначает "% по весу", "мас.D-глюкуроновую кислоту (G 5269; производимую Sigma) (10 г) растворяют в 1 л воды,нагревают при 121 С в течение четырех часов и концентрируют в вакууме до приблизительно 10 мл. Концентрат смешивают с 40 мл верхнего слоя смеси 3:2:2 бутилацетата, уксусной кислоты и воды и центрифугируют. Полученный супернатант концентрируют в вакууме до приблизительно 10 мл. Вышеупомянутый экстракт наносят на силикагель (BW-300SP; 2 х 28 см; производимыйFuji Silycia) для колоночной хроматографии и разделяют с использованием верхнего слоя смеси 3:2:2 бутилацетат/уксусная кислота/вода при скорости тока 5 мл/мин при давлении 0,2 кг/см 2 с применением компрессора. Фракционирование проводят с объемом одной фракции 10 мл и часть каждой фракции анализируют тонкослойной хроматографией, при которой циклопентенон высокой чистоты содержится в 61 ой - 80-ой фракциях. Эти фракции собирают,концентрируют в вакууме, экстрагируют 40 мл хлороформа и экстракт концентрируют в вакууме с получением 100 мг циклопентенона. Эту фракцию разделяют при помощи ВЭЖХ с нормальной фазой с использованием колонки Palpack type S (производимой TakaraShuzo) и при проведении детектирования по поглощению в ультрафиолете при 215 нм обнаруживают чистоту 98%. Полученный циклопентенон (113,9 мг) растворяют в 2,85 мл этанола. К этому этанольному раствору добавляют 3,85 мл смеси гексан/этанол (94/6) с получением раствора циклопентенона (17 мг/мл). Его фильтруют через 38 фильтр 0,5 мкм с получением раствора пробы для ВЭЖХ с оптическим разрешением. Этот раствор пробы наносят на ВЭЖХ с оптическим разрешением, каждую из фракций(-)-циклопентенона в более раннем пике и (+)циклопентенона в более позднем пике собирают и выпаривают досуха в вакууме с получением 43,2 мг (-)-циклопентенона и 43,0 мг (+)циклопентенона. Условия для ВЭЖХ с оптическим разрешением. Колонки: Chiral Pack AS (производимая(2,55 мг). Каждый из (-)-циклопентенона и (+)циклопентенона, полученных здесь, содержит 1% энантиомера и, следовательно, их подвергают опять оптическому разделению. В результате, получают 19,7 мг (-)-циклопентенона, не содержащего энантиомера, из 30,0 мг (-)циклопентенона более раннего пика, тогда как из 37,4 мг (+)-циклопентенона более позднего пика получают 27,7 мг (+)-циклопентенона, не содержащего энантиомера. При этом, время элюирования в ВЭЖХ с оптическим разрешением (-)-циклопентенона и (+)-циклопентенона 33 мин и 40 мин соответственно. Пример 1.(1) Водный раствор (1 М) (100 мкл) циклопентенона и 100 мкл 1 М гидрохлорида Lцистеина (производимого Nacalai Tesque; 10313), доведенного до рН 4 при помощи NaOH,смешивают и подвергают реакции при 60 С в течение 16 ч. Реакционную смесь фильтруют через фильтр 0,5 мкм Cosmo Nice Filter (производимый Nacalai Tesque; 440-84), фильтрат наносят на ВЭЖХ с применением колонки CapsulePack Column C18 SG120 (6 мм х 250 мм; производимой Shiseido) с использованием 0,1% водного раствора трифторуксусной кислоты (производимой Nacalai Tesque; 349-01) в качестве подвижной фазы при скорости тока 0,5 мл/мин и детектирование проводят при поглощении 210 нм, при котором основные пики наблюдают при 19,1 и 19,5 мин. Их фракционируют и концентрируют досуха в вакууме с выделением двух диастереомеров, т.е. СМ 1 (19,1 мин) и СМ 2(2) Структура продукта реакции циклопентенона с L-цистеином. Анализ масс СМ 1 и СМ 2, выделенных в примере 1-(1), проводят с применением массспектрометра DX302 (производимого NipponDenshi). Затем их растворяют в 0,1 н. раствореDCl в тяжелой воде и их структуры анализируют при помощи ядерного магнитного резонансаshi) используют в качестве устройства ядерного магнитного резонанса. Спектр поглощения в ультрафиолете (УФ) измеряют при помощи спектрофотометра УФ-2500 (производимогоH-ЯМР 2,31 (1 Н, дд, J=20,0, 1,5 Гц, 5 Н), 2,87 (1H, дд, J=20,0, 6,0 Гц, 5-Н), 3,01 (1H,дд, J=15,0 6,5 Гц, 1'-H), 3,11 (1H, дд, J=15,0, 4,5 Гц, 1'-Н), 4,00 (1H, м, 4-Н), 4,20 (1H, дд, J=6,5,4,5 Гц, 2'-Н), 6,46 (1H, д, J=3,0 Гц 3-Н). В приведенных выше результатах, величины химических сдвигов для 1H-ЯМР выражают,когда величину HOD определяют как 4,65 м.д. Далее, СМ 1 растворяют в 0,1 н. раствореDCl в тяжелой воде и 13 С-ЯМР измеряют при помощи JNM-A500. 13 С-ЯМР 30,3 (1'-С), 39,4 (4-С), 42,0 (5 С), 53,4 (2'-С), 132,8 (3-С), 154,6 (2-С), 171,1 (3'С), 205,5 (1-С). В приведенных выше результатах, величины химических сдвигов для 13 С-ЯМР выражают,когда величину диоксана определяют как 67,4 м.д. При этом, номера соотнесения пиков 1HЯМР и 13 С-ЯМР являются такими, как показано в формуле [VII]. Затем спектр поглощения в инфракрасной области спектра (ИК) смеси СМ 1 и СМ 2 в равных количествах (далее называемой СМ) измеряют при помощи инфракрасного спектрофотометра (FTIR-8000PC; производимого Shimadzu). Получен следующий результат. ИК KBrмакс см-1 3000, 1705, 1625, 1201. Применяют способ коэффициента диффузного отражения. На основании этих данных выяснено, что один из СМ 1 и СМ 2 имеет структуру[VIII], тогда как другой имеет структуру [IX]. 40 Фиг. 1 показывает масс-спектр СМ 1; фиг. 2 показывает 1H-ЯМР-спектр СМ 1; фиг. 3 показывает спектр УФ-поглощения СМ 1; фиг. 4 показывает 1H-ЯМР-спектр СМ 2; фиг. 5 показывает 13 С-ЯМР-спектр СМ 1 и фиг. 6 показывает спектр ИК-поглощения СМ. На фиг. 1 абсцисса указывает величины m/z, тогда как ордината указывает относительную интенсивность (%). На фиг. 2, 4 и 5 абсцисса указывает величину химического сдвига (м.д.), тогда как ордината указывает интенсивность сигнала. На фиг. 3 абсцисса указывает длину волны (нм), тогда как ордината указывает поглощение. На фиг. 6, абсцисса указывает волновое число (см-1), тогда как ордината указывает коэффициент пропускания. Пример 2.(1) Водный раствор (1 М) (100 мкл) циклопентенона и 500 мкл 200 мМ водного раствора глутатиона (восстановленного типа; производимого Nacalai Tesque; 170-10) (рН 3,0) смешивают и подвергают реакции при 60 С в течение пяти часов. Реакционный раствор фильтруют через фильтр 0,5 мкм Cosmo Nice Filter и фильтрат разделяют посредством ВЭЖХ при следующих условиях. Колонка: TSK гель ODS-80Ts (5 мкм) 20 мм х 25 см. Подвижная фаза: А 0,1% водный раствор ТФУ. В 0,1% ТФУ/50% водный раствор ацетонитрила. Скорость тока: 7,5 мл/мин. Градиент: подвижная фаза А в течение 10 мин - от подвижной фазы А к А:В=1:1 в течение 55 мин - от А:В = 1:1 к подвижной фазе В в течение 15 мин. Детектирование: поглощение при 220 нм. Приведенный выше реакционный раствор(200 мкл) наносят на ВЭЖХ, пики с временем удерживания 35,7 и 36,1 мин собирают и каждый из них концентрируют досуха в вакууме с выделением двух диастереомеров, т.е. GM1 иGM2 был 3,0 мг. Фиг. 7 показывает их хроматограммы. Таким образом, фиг. 7 показывает зависимость между временем удерживания и поглощением,где абсцисса указывает время удерживания (минуты), тогда как ордината указывает поглощение при 220 нм.(2) Анализируют структуру смеси (далее называемой GM) одинаковых количеств GM1 иGM2, полученных в примере 2-(1). Спектр ядерного магнитного резонанса (ЯМР) измеряют при помощи JNM-A500 (производимого Nippon Denshi); масс-спектр (МС) измеряют при помощи масс-спектрометра DX302 (производимого Nippon Denshi); УФ-спектр измеряют при помощи спектрофотометра UV-2500 (производимого Shimadzu) и спектр поглощения в инфракрасной области (ИК-спектр) измеряют при помощи инфракрасного спектрофотометра(2-С), около 173 (3'-С, 7'-С, 8'-С, 10'-С), 205,8 (1 С). Пробу растворяют в 0,1 н. растворе DCl в тяжелой воде и величину химического сдвига диоксана выражают как 67,4 м.д. При этом, номера соотнесения для пиков 1FAB-MS m/z 404 [М+Н]+, 426 (M+Na)+. Глицерин используют в качестве матрикса. УФ макс 251 нм (вода). ИК KBrмакс см-1 2949, 1710, 1660, 1539,1404, 1203. Используют способ коэффициента диффузного отражения. Этот результат показан на фиг. 8-12. Фиг. 8 показывает 1H-ЯМР-спектр GM, где абсцисса указывает величину химического сдвига (м.д.), тогда как ордината указывает интенсивность сигналов; фиг. 9 показывает 13 СЯМР GM, где абсцисса указывает величину химического сдвига, тогда как ордината указывает интенсивность сигналов; фиг. 10 показывает масс-спектр GM, где абсцисса указывает величину m/z, тогда как ордината указывает относительную интенсивность (%); фиг. 11 показывает УФ-спектр GM, где абсцисса указывает длину волны (нм), тогда как ордината указывает поглощение; и фиг. 12 показывает ИК-спектр поглощения GM, где абсцисса указывает волновые числа (см-1), тогда как ордината указывает коэффициент пропускания (%). На основании приведенных выше результатов выяснено, что GM1 и GM2 являются диастереомерами 2-гидрокси-4-глутатион-S-ил-2 циклопентен-1-она и что один из них имеет структуру, показанную [XI], тогда как другой имеет структуру, показанную [XII].(1) Циклопентенон и гидрохлорид Lцистеина (производимого Nacalai Tesque; 10313) растворяют в забуференном фосфатом солевом растворе (рН 7,2) до конечной концентрации каждого из них 10 мМ, с последующей реакцией при 37 С в течение 30 мин. Реакционную смесь фильтруют через фильтр 0,5 мкмTesque; 440-84), фильтрат наносят на ВЭЖХ с применением 0,1% водного раствора трифторуксусной кислоты (производимой NacalaiTesque; 349-01) в качестве подвижной фазы при скорости тока 1 мл/мин с использованием TSKгеля ODS 80 Ts (4,6 мм х 250 мм; производимого Tosoh) и детектирование проводят измерением поглощения при 210 нм, при котором пики циклопентенона и L-цистеина уменьшались,тогда как основные пики при 4,0 и 4,3 мин вновь появлялись. Этот результат показан на фиг. 13. Таким образом, фиг. А показывает зависимость между временем элюирования и поглощением при 210 нм, где абсцисса указывает время элюирования(минуты), тогда как ордината показывает поглощение при 210 нм. При этом, на фиг. 13, 3,1 мин - положение элюирования для L-цистеина, тогда как 4,9 минуты - положение циклопентенона.(2) Циклопентенон и гидрохлорид Lцистеина растворяют в забуференном фосфатным буфером солевом растворе (рН 7,2) до конечной концентрации каждого из них 100 мкМ и изменения в поглощении при 215 нм при 37 С с течением времени измеряют спектрофотометром UV-2200 (производимым Shimadzu). В результате, поглощение уменьшалось с течением времени реакции и, после 500 с, было почти постоянным. Этот результат показан на фиг. 14,Таким образом, фиг. 14 показывает зависимость между временем реакции и поглощением при 215 нм с использованием L-цистеина, где абсцисса указывает время реакции (секунды), тогда как ордината указывает поглощение при 215 нм. При проведении той же самой процедуры с использованием глутатиона (восстановленного типа; продаваемого Nacalai Tesque; 170-10) вместо гидрохлорида L-цистеина поглощение при 215 нм уменьшалось с течением времени реакции и, после 2000 с оно было почти постоянным. Этот результат показан на фиг. 15. Таким 43 образом, фиг. 15 показывает зависимость между временем реакции и поглощением при 215 нм с использованием глутатиона, где абсцисса указывает время реакции (секунды), тогда как ордината указывает поглощение при 215 нм.(3) Циклопентенон и гидрохлорид Lцистеина растворяют в забуференном фосфатным буфером солевом растворе (рН 7,2) до конечной концентрации каждого из них 10 мкМ с последующей реакцией при 37 С в течение 30 мин. Реакционную смесь фильтруют через фильтр 0,5 мкм Cosmo Nice Filter (производимый Nacalai Tesque; 440-84) и фильтрат используют для масс анализа посредством жидкостной хроматографии высокого разрешения с использованием TSK-геля ODS 80 Ts (4,6 мм х 250 мм; производимого Tosoh) и API 300 (производимого РЕ SCIEX) при скорости тока 1 мл/мин с применением 0,1% водного раствора уксусной кислоты в качестве подвижной фазы. Анализ масс проводят в режиме положительно заряженного иона. В результате наблюдают сигналm/z = 236,1 [М+Н]+ и молекулярная масса вещества, которое было заново получено, равна- 235. Этот результат показан на фиг. 16 и 17. Так фиг. 16 показывает хроматограмму продукта реакции, который является одним из примеров данного изобретения, где абсцисса указывает время удерживания (минуты), тогда как ордината указывает общую интенсивность иона(относительную величину). Фиг. 17 показывает масс-спектр фракции, элюированной при 2,99 минутах на фиг. 16, где абсцисса указывает m/z,тогда как ордината указывает интенсивность иона (относительную величину). При этом, в масс-спектре фракций, элюированных при 3,15 и 3,24 мин на фиг. 16, также наблюдают сигнал(4) Циклопентенон и гидрохлорид Lцистеина растворяют в забуференном фосфатом солевом растворе (рН 7,2) до конечной концентрации каждого из них 100 мМ и подвергают взаимодействию при 37 С в течение 50 мин. Спектры поглощения в ультрафиолете измеряют до и после реакции при помощи спектрофотометра UV-2200 (производимого Shimadzu). Этот результат приведен на фиг. 18 и 19. Так фиг. 18 показывает спектр поглощения ультрафиолета реакционного раствора сразу же после растворения, тогда как фиг. 19 показывает спектр поглощения ультрафиолета реакционного раствора после реакции в течение 50 мин. На фиг. 18 и 19 абсцисса указывает длину волны(нм), тогда как ордината указывает поглощение. Ту же самую операцию проводят с использованием глутатиона вместо гидрохлорида Lцистеина. Результат показан на фиг. 20 и 21. Так фиг. 20 показывает спектр поглощения ультрафиолета реакционного раствора сразу же после растворения, тогда как фиг. 21 показывает спектр поглощения ультрафиолета реакционно 001888 44 го раствора после реакции в течение 50 мин с использованием глутатиона. На фиг. 20 и 21 абсцисса указывает длину волны (нм), тогда как ордината указывает поглощение.(5) Раствор (60 мкл) 1,4 М циклопентенона в тяжелой воде, 80 мкл 1 М раствора L-цистеина в тяжелой воде и забуференного фосфатом солевого раствора (рН 7,2), приготовленного с использованием 160 мкл тяжелой воды, смешивают и проводят реакцию при 37 С в течение трех часов. Спектр 13 С-ядерного магнитного резонанса (ЯМР) реакционного раствора измеряют при помощи JNM-A500 (производимого(3-С), около 80 и около 81 (2-С), около 173 (3 С), около 215 и около 217 (1-С). При этом, номера соотнесения для пиков в 13 С-ЯМР являются такими, как показано в формуле [XIII]. С-ЯМР этого продукта реакции показан на фиг. 22. На фиг. 22 абсцисса указывает величины химического сдвига (м.д.), тогда как ордината указывает интенсивность сигнала. Поскольку продукт в этой реакции является смесью четырех типов диастереомеров, обнаружено максимально четыре сигнала для каждого атома углерода, и химическая структура продукта реакции, который образуется в этом реакционном растворе, является структурой тиопроизводного циклопентанона, иллюстрированная приведенной выше формулой [IX]. В результате очевидно, что химическая структура продукта реакции, имеющего время элюирования пика 4,0-4,3 мин фиг. 13, образованного реакцией циклопентенона с цистеином,представляет собой тиопроизводное циклопентанона, представленное формулой [IX], приведенной выше. Вышеупомянутый продукт реакции, имеющий пик со временем элюирования 4,0-4,3 мин, фракционируют с получением тиопроизводного циклопентанона (далее называемого CD), представленного приведенной выше формулой [IX]. Пример 4.Tesque; 170-10) и 1340 мкл забуференного фосфатом солевого раствора (рН 7,2) смешивают и проводят реакцию при 37 С в течение одного часа. Реакционный раствор (700 мкл) фильтруют через фильтр 0,5 мкм Cosmo Nice и продукт реакции (далее называемый GD1) циклопенте 45 нона с глутатионом разделяют при помощи ВЭЖХ при следующих условиях. Колонка: TSK gel ODS-80Ts (5 мкм), 20 мм х 25 см (производимый Tosoh). Подвижная фаза: А - 0,1% водный раствор трифторуксусной кислоты (ТФУ; производимойMerck; 8262); В - водный раствор 0,1% ТФУ/50% ацетонитрил (производимый Nacalai Tesque; 004-30). Скорость тока: 9 мл/минуту. Градиент: подвижная фаза А в течение 40 минут - от подвижной фазы А до В в течение 40 минут - после этого подвижная фаза В. Детектирование: поглощение при 220 нм. Описанный выше реакционный раствор(500 мкл) наносят на ВЭЖХ и пик, имеющий время удерживания 27,7 мин, фракционируют и лиофилизуют с выделением 5 мг GD. Хроматограмма показана на фиг. 23. Таким образом, фиг. 23 показывает зависимость между временем удерживания и поглощением, где абсцисса указывает время удерживания (минуты),тогда как ордината указывает поглощение при 220 нм.(2) Анализируют структуру GD1, полученного в примере 4-(1). Спектр ядерного магнитного резонанса измеряют при помощи JNMА 500 (производимого Nippon Denshi); массспектр (МС) измеряют при помощи массспектрометра DX302 (производимого Nippon(УФ) измеряют при помощи спектрофотометраUV-2500 (производимого Shimadzu) и спектр поглощения в инфракрасной области (ИК) измеряют при помощи инфракрасного спектрофотометра FTIR-8000PC (производимого Shimadzu). Результат является следующим. 1(2-С), около 173 (3'-C, 7'-C, 8'-С, 10'-C), 214,9 (1 С). Пробу растворяют в тяжелой воде и величину химического сдвига диоксана выражают как 67,4 м.д. При этом, номера соотнесения для пиков в 1 46 Глицерин используют в качестве матрикса. УФ: конечное поглощение. ИК KBrмакс см-1 3275, 1749, 1654, 1541,1203, 1145. Используют способ коэффициента диффузного отражения. Результаты показаны на фиг. 24-27. Так,фиг. 24 показывает 1H-ЯМР-спектр GD, где абсцисса указывает величины химического сдвига(м.д.), тогда как ордината указывает интенсивность сигнала; фиг. 25 показывает 13 С-ЯМР GD,где абсцисса указывает величины химического сдвига (м.д.), тогда как ордината указывает интенсивность сигнала; фиг. 26 показывает массспектр GD, где абсцисса указывает величиныm/z, тогда как ордината указывает относительную интенсивность (%); и фиг. 27 показывает спектр ИК-поглощения GD, где абсцисса указывает волновое число (см-1), тогда как ордината указывает коэффициент пропускания (%). На основании приведенного выше результата выяснено, что GD представляет собой 2,3 дигидрoкси-4-глутатион-S-ил-циклопентанон,показанный в виде [X] выше. При этом, GD является смесью четырех типов диастереомеров и каждый диастереомер выделяют из GD. Пример 5.(1) Каждый из 0,5 мл 0,2 мМ СМ, 0,8 мМ СМ или 1,6 мМ СМ добавляют к 4,5 мл средыRPMI 1640, содержащей 10% фетальную телячью сыворотку и 2,5 х 105 клеток HL-60 (промиелоцитарная лейкозная клетка) (АТСС CCL240), и инкубируют при 37 С в течение 24 ч или 48 ч в присутствии 5% газообразного диоксида углерода и измеряют количество жизнеспособных клеток. В результате показано, что СМ имеет интенсивную активность ингибирования роста раковых клеток. Кроме того, апоптические тела включения были обнаружены в этих клетках при каждой из ингибирующих рост клеток концентраций. Результат показан на фиг. 28. Так фиг. 28 показывает зависимость между концентрацией добавленной пробы (т.е. концентрацией СМ в среде) и числами жизнеспособных клеток, где абсцисса указывает концентрацию (мкМ) СМ,тогда как ордината указывает числа жизнеспособных клеток (х 105/5 мл), содержащихся в 5 мл культуральной жидкости. На фиг. 28 открытый квадратобозначает случай, когда СМ добавляют с последующим культивированием в течение 24 ч; черный квадратобозначает случай, когда СМ добавляют с последующим культивированием в течение 48 ч открытый треугольникобозначает случай, когда проба не добавлена, с последующим культивированием в течение 24 ч; и черный треугольникобозначает случай, когда проба не добавлена, с последующим культивированием в течение 48 ч.(2) В каждую из лунок 96-луночного микротитрационного планшета добавляют 8, 40, 200 или 1000 мкМ водный раствор GM или 10 мкл воды в качестве контроля. HL-60 (АТСС CCL240) суспендируют в среде RPMI 1640, содержащей 10% фетальную телячью сыворотку, до получения концентрации 5 х 104 клеток/мл и каждые 90 мкл ее помещают в каждую лунку вышеупомянутого микротитрационного планшета и инкубируют при 37 С в течение 48 ч в присутствии 5% диоксида углерода. Инкубирование проводят еще в течение четырех часов после добавления 10 мкл раствора (5 мг/мл) 3(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида (МТТ; производимого Sigma) в забуференном фосфатом солевом растворе и состояние роста клеток наблюдают под микроскопом. Далее, добавляют 100 мкл 2-пропанола,содержащего 0,04 н. хлористо-водородную кислоту, с последующим перемешиванием и измеряют поглощение при 590 нм. В результате не обнаруживают роста клеток в секции планшета, куда добавляют 40 мкМGM (конечная концентрация: 4,0 мкМ). Таким образом, было выяснено, что GM полностью ингибирует рост клеток HL-60 в концентрации 4,0 мкМ. Между тем в клетках образуются апоптические тела при каждой из ингибирующих рост клеток концентраций.(3) В каждую лунку 96-луночного микротитрационного планшета добавляют 100, 200 или 400 мкМ водный раствор GM или 10 мкл воды в качестве контроля и активность ингибирования роста HL-60 измеряют по способу,упомянутому в примере 5-(2). Однако степень роста клеток выражают как отношение (%) поглощения при 590 нм секции планшета с добавленной пробой к поглощению секции планшета с добавленной водой (контроля). Результат приведен в таблице 1. Таблица 1(4) Клетки HL-60 (ATCC CCL240), которые инкубируют при 37 С в среде RPMI 1640(производимой Nissui), содержащую 10% фетальную телячью сыворотку (производимуюGibco), суспендируют в указанной выше среде с получением концентрации 2,5 х 105 клеток/4,5 мл. К этой суспензии добавляют 0,5 мл 100 мкМ водного раствора GM (конечная концентрация: 10 мкМ) с последующим инкубированием при 37 С в присутствии 5% газообразного диоксида углерода в течение 24 ч, 48 ч и 72 ч. Инкубированные клетки окрашивают Трипановым Синим и число жизнеспособных и мертвых клеток считают, причем, число жизнеспособных клеток и жизнеспособность клеток 48 значимо снижены в секции, к которой добавляют 10 мкМ GM, в сравнении с контролем, где добавляют воду. При наблюдении культивируемых клеток под оптическим микроскопом обнаруживают агрегацию ядер, уменьшение в размере клеток и образование апоптических тел. Далее, из этих клеток экстрагируют ДНК и наносят ее на агарозный гель для электрофореза,после чего наблюдают фрагментацию ДНК до хроматина. Такой феномен не наблюдается в контроле, где добавляют воду. Этот результат показан на фиг. 29. Таким образом, фиг. 29 показывает зависимость между временем инкубации и числами жизнеспособных клеток в инкубированной жидкости, когда 10 мкМ GM добавляют к культуральной жидкости HL-60, где абсцисса указывает время инкубации (часы), тогда как ордината указывает числа жизнеспособных клеток (х 105 клеток/5 мл) в инкубированной жидкости. На фиг. 29 открытый квадратуказывает случай, где добавляют 10 мкМ GM, тогда как открытый кружок (О) указывает контроль, где добавляют воду.(5) В каждую лунку 96-луночного микротитрационного планшета добавляют 4,12, 12,3,37,0, 111, 333 или 1000 мкМ водный раствор GD или 10 мкл воды в качестве контроля. HL-60(ATCC CCL-240) суспендируют в среде RPMI 1640, содержащей 10% фетальную телячью сыворотку, до получения концентрации 5 х 104 клеток/мл и каждые 90 мкл ее помещают в каждую лунку вышеупомянутого микротитрационного планшета с последующим инкубированием при 37 С в течение 48 ч в присутствии 5% газообразного диоксида углерода. Инкубирование проводят еще в течение четырех часов после добавления 10 мкл раствора 5 мг/мл 3-(4,5 диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида (МТТ; производимого Sigma) в забуференном фосфатом солевом растворе и состояние роста клеток наблюдают под микроскопом. Тем временем, добавляют 100 мкл 2-пропанола,содержащего 0,04 н. НСl, с последующим хорошим перемешиванием и измеряют поглощение при 590 нм. В результате, рост клеток не обнаружен в секции планшета, где добавляют 37,0 мкМ GD(конечная концентрация: 3,70 мкМ). Таким образом, было выяснено, что GD полностью ингибирует рост клеток HL-60 в концентрации 3,70 мкМ. Между тем в клетках образовались апоптические тела при каждой из ингибирующих рост клеток концентраций.(6) Циклопентенон и гидрохлорид Lцистеина растворяют в забуференном фосфатом солевом растворе (рН 7,2) до конечной концентрации каждого из них 55 мМ и 80 мМ соответственно и подвергают взаимодействию при 37 С в течение 15 мин при рН 7,2. Часть реакционного раствора анализируют при помощи обращенно-фазовой ВЭЖХ с применением колонкиTSK-геля ODS 80 Ts (4,6 мм x 250 мм; производимого Tosoh) при скорости тока 1 мл/минуту с использованием 0,1% водного раствора трифторуксусной кислоты в качестве подвижной фазы,причем циклопентенон не был обнаружен. Этот реакционный раствор является раствором, содержащим 55 нМ CD. Активность ингибирования роста раковых клеток измеряют для 100, 200 или 400 мкМ водных растворов GD или CD так же, как в примере 5-(4). Однако степень роста клеток выражают как отношение (%) поглощения при 590 нм секции, к которой добавляют пробу, к поглощению контроля, где добавляют воду. Результат показан в таблице 2. Таблица 2CD 40 мкМ 2,1 5,3 20 мкМ 5,8 56,2 10 мкМ 47,2 89,0 Как показано в таблице 2, GD и CD обладают активностью ингибирования роста раковых клеток. Апоптические тела образуются в этих клетках при каждой из концентраций,вследствие чего рост клеток ингибируется. Таким образом, как показано в примере 5,каждое из соединений обнаружило активность ингибирования роста раковых клеток и активность индуцирования апоптоза. Каждый из диастереомеров показывает одно и то же действие. Пример 6.GM разбавляют физиологическим солевым раствором до заданной концентрации и подвергают следующим тестам.BALB/c (вес тела: около 20 г) восьминедельного возраста. После этого, GM (5 мг/кг/день) инъецируют подкожно в течение пяти последовательных дней в одно и то же место. С другой стороны, таким же образом инъецируют подкожно физиологический солевой раствор контрольной группе. После двух недель раковые ткани, образованные в брюшной полости этих мышей, вырезают и измеряют их вес. В сравнении с контрольной группой, группа, которой вводят GM, обнаруживает значимое ингибирующее действие на рост рака. CM, CD и GD также дают такие же результаты.(2) Мышиные лейкозные клетки Р-388 (1,1 х 106 клеток/мышь) инъецируют внутрибрюшинно самкам мышей DBA/2 (вес тела: около 20 г) семинедельного возраста. После этого внутрибрюшинно инъецируют GM, CM, GD илиCD (10 мг/кг/день) в течение последовательных пяти дней. Тем временем, контрольной группе таким же образом инъецируют внутрибрюшинно физиологический солевой раствор. В каждой из двух групп, состоящих из восьми мышей 50 мышей, средние величины дней выживания и макробиотический коэффициент. В сравнении с контрольной группой, средние величины дней выживания увеличиваются в каждой из обработанных пробой групп, вследствие чего был отмечен значимый макробиотический эффект. Системы с применением мышей Sarcoma180/1CR, мышей IMC/CDF1 и мышей EAC/DDY показывают также такой же макробиотический эффект. Таким образом, как показано в приведенном выше примере 6, GM, CM, GD и CD обнаруживают противораковое действие. Каждый из диастереомеров также показывает такое же действие. Пример 7.Bacillus subtilis IFO 3021 инкубируют (с применением посевной культуры) в течение ночи в чувствительной бульонной среде (производимой Nissui). Измеряют поглощение при 600 нм и рассчитывают числа жизнеспособных клеток из предварительно построенной калибровочной кривой, показывающей зависимость между числами жизнеспособных клеток и поглощением при 600 нм. Жидкость посевной культуры разбавляют свежей чувствительной бульонной средой до концентрации 1 х 106 клеток/мл и каждые 180 мкл ее помещают в каждую лунку 96-луночного микротитрационного планшета. Каждые 20 мкл водного раствора GM(4 или 2 мг/мл) или воды добавляют в каждую лунку с последующим стационарным культивированием при 37 С в течение одной ночи (основное инкубирование). Тем временем, часть жидкости посевной культуры разбавляют стерилизованной водой, распределяют на агаровую среду с чувствительным бульоном для чашек и инкубируют при 37 С в течение одной ночи и колонии считают для измерения точного числа жизнеспособных клеток. Культуральную жидкость в каждой из лунок разбавляют стерилизованной водой, распределяют на агаровую среду с чувствительным бульоном для чашек и инкубируют при 37 С в течение одной ночи и колонии считают для измерения точного числа жизнеспособных клеток. В результате, числа жизнеспособных клеток в секции планшета, к которой добавляют 4 мг/мл GM (конечная концентрация: 400 мкг/мл),были 4,4 х 107 клеток/мл и были ниже, чем в секции с добавлением воды, где эти числа были 1,3 х 108 клеток/мл. Таким образом, GM обладает активностью ингибирования роста вышеупомянутого микроорганизма при концентрации 400 мкг/мл. СМ, GD, CD или каждый из их диастереомеров и диастереомер GM показывают одинаковые результаты. Кроме того, эти соединения обладают также одинаковой антибактериальной активностью в отношении других микробов.Sigma) инъецируют внутрибрюшинно (10 мкг/мышь) самкам мышей CDF1 восьминедельного возраста (купленным в Nippon SLC в семинедельном возрасте с весом тела 20 г, с последующим предварительным выращиванием в течение одной недели на месте) и готовят модели эндотоксинового шока. GM вводят перорально в дозе 100 и 1000 мг/кг при тридцати минутах перед введением LPS. Спустя один час после введения LPS берут кровь из этих мышей,сыворотку отделяют и количество факторанекроза опухолей в этой сыворотке измеряют с применением коммерчески доступного набора для ELISA (производимого Endogen). Результат показан в таблице 3. Так, образование фактора некроза опухолей значимо ингибируется в группе с введением 1000 мг/кг GM в сравнении с контролем, которому вводят дистиллированную воду. Группа(2) Парафиновое масло (Cosmo Bio) (2 мл) вводят внутрибрюшинно самкам мышей CDF1 восьминедельного возраста для индуцирования брюшных макрофагов (М ). Спустя одну неделю после введения парафинового масла вводят внутрибрюшинно вливанием 4 мл среды RPMI1640 (Gibco), хорошо массируют и извлекают с получением брюшных клеток. Брюшные клетки промывают средойRPMI-1640, содержащей 10% фетальную телячью сыворотку (FCS; High-Clone), для доведения концентрации клеток до 1 х 106 клеток/мл. Полученный таким образом клеточный раствор высевают на 24-луночный планшет и инкубируют в СO2-термостате при 37 С в течение двух часов. Неприкрепленные клетки, содержащиеся в жидкости супернатанта после инкубирования,удаляют и прикрепленные клетки используют в качестве брюшных М. В каждую лунку планшета добавляют 800 мкл среды RPMI-1640, содержащей 10% фетальную телячью сыворотку, затем 100 мкл 1,10, 100 и 1000 мкМ GM, растворенного в физиологическом солевом растворе (производимом Otsuka Pharmaceutical), добавляют в лунку и инкубирование проводят в СО 2-термостате при 37 С в течение одного часа. После инкубирования добавляют 100 мкл 100 нг/мл LPS (производимого Sigma) и инкубирование проводят еще в течение 24 ч. После завершения инкубирования жидкость супернатанта извлекают и количество TNF-, образованного в ней, определяют при помощи ком 52 мерчески доступного набора ELISA (производимого Endogen). Результат показан на фиг. 30. Таким образом, фиг. 30 показывает зависимость между количеством GM и продуцированным количеством фактора некроза опухолей, где ордината указывает продуцированное количество фактора некроза опухолей (пг/мл), тогда как абсцисса указывает концентрацию GM (мкМ) . При этом,диаграмма в виде столбцов показывает случай, в котором не добавляют GM.GM в концентрации не менее 10 мкМ значимо ингибирует продуцирование фактора некроза опухолей брюшными макрофагами мышей,индуцированных LPS. Как показано в примере 8, GM обладает активностью ингибирования продуцирования фактора некроза опухолей. CM, GD, CD или каждый из их диастереомеров и каждый диастереомер GM также показывает подобные результаты. Пример 9. Модели индуцированного каррагенаном отека стоп, которые были моделью животного с хроническим суставным ревматизмом, готовят следующим образом с использованием самцов крыс Lewis [купленных в Seac-Yoshitomi в пятинедельном возрасте (вес тела: около 130 г) с последующим предварительным выращиванием в течение одной недели на месте] и проводят оценку испытуемых лекарственных средств. Крысам, которые голодали с 18 ч перед началом эксперимента, перорально вводят 10 мл/кг GM, который готовят с дистиллированной водой (производимой Otsuka Pharmaceutical) с получением 10 и 100 мг/мл. После 0,5 ч от введения тест-лекарства 100 мкл/крысу 1% суспензии каррагенана (производимого Wako) в физиологическом солевом растворе (производимом Otsuka Pharmaceutical) инъецируют в правую лапку для индуцирования отека стопы. Спустя три часа после инъекции каррагенана объем правой лапки крысы измеряют при помощи устройства для измерения объема стоп (производимого UGO BASILE). При этом измеренную величину выражают путем расчета степени увеличения от объема правой лапки каждой крысы, измеренного перед введением каррагенана. Результат показан на фиг. 31. Так, фиг. 31 показывает зависимость между количествомGM и степенью увеличения отека стоп, где ордината указывает степень увеличения (%), тогда как абсцисса показывает дозу GM (мг/кг).GM имеет значимую активность ингибирования при дозе 100 мг/кг и более высокой дозе.CM, GD, CD или каждый из их диастереомеров и каждый диастереомер GM также показывает такой же результат. 53 Пример 10. Ингибирующую активность GM в отношении продуцирования NO и в отношении повреждения клеток измеряют следующим образом с использованием штамма макрофагальных мышиных клеток RAW264.7 (АТСС TIB 71) и LPS. Модифицированную по способу Дульбекко среду Игла (производимую Life TechnologiesOriental; 25030-149), не содержащую фенолового красного, содержащую 5 мл 10% фетальной телячьей сыворотки (производимой Gibco), содержащую 1,5 х 106 клеток RAW 264.7, инкубируют в шестилуночном планшете для культуры ткани в присутствии 5% газообразного диоксида углерода при 37 С в течение 12 ч, добавляют 50 мкл 50 мкг/мл LPS (производимого Sigma), затем в каждую лунку добавляют по 50 мкл каждого из 250 мкМ GM или 100 мкМ GM, инкубирование продолжают далее еще в течение 12 часов и, после этого, измеряют NO2-, образующийся окислением NO в среде, и количество жизнеспособных клеток. При этом секцию планшета, где не добавляют LPS, и секцию, где не добавляют GM, готовят в качестве контролей. Для измерения NO2- 100 мкл инкубированной жидкости супернатанта отделяют из каждой лунки, добавляют 10 мкл раствора 50 мг/мл 2,3 диаминонафталина (производимого DojindoLaboratories; 341-07021) (раствора в 0,62 н. хлористо-водородной кислоте) смесь отстаивают 15 минут, затем добавляют 5 мкл 2,8 н. водного раствора гидроксида натрия и измеряют флюоресценцию полученного нафталинтриазола при помощи Titertec Fluoroscan II (продаваемогоDainippon Pharmaceutical) при длине волны возбуждения 355 нм и длине волны измерения 460 нм. Все эксперименты проводят в двух сериях,контрольную величину секции, к которой не добавляют LPS, вычитают из ее средней величины и проводят сравнение в виде относительной величины каждой секции к величине секции, к которой добавляют LPS. Результат показал, что GM ингибирует продуцирование NO, индуцированное LPS в клетках RAW 264.7, и, кроме того, ингибирует повреждение клеток RAW 264.7, вызываемоеLPS. Результаты показаны на фиг. 32 и 33. Фиг. 32 показывает зависимость между концентрацией GM и концентрацией NO2- в культуральной жидкости, где ордината указывает относительную величину (%) концентрации NO2-. Фиг. 33 показывает зависимость между временем инкубирования и числами жизнеспособных клеток в присутствии GM, где абсцисса указывает время инкубирования (часы), тогда как ордината указывает число жизнеспособных клеток (х 105/5 мл), содержащихся в 5 мл культуральной жидкости. На фиг. 33 открытый квадратуказы 001888 54 вает случай, где не добавляют LPS; открытый ромбуказывает случай, где добавляют LPS; открытый кружок (О) указывает случай, где добавляют 2,5 мкМ GM и LPS; и черный квадрат указывает случай, где добавляют 1 мкМ GM и LPS. Таким образом, GM обнаруживает ингибирующее действие в отношении продуцированияNO. CM, GD, CD или каждый из их диастереомеров и каждый диастереомер GM показывают также подобные результаты. Пример 11. Клетки DSEK (клеточный штамм, хранящийся в Department Second Internal Medicine,Integrated Medical Center, Saitama College ofMedicine), которые являются штаммом фибробластов, разработанным из синовиальной мембраны пациента, страдающего от хронического суставного ревматизма, инкубируют в модифицированной по способу Искоб среде Дульбекко(FBS, производимой Gibco, 26140-079) при 37 С в присутствии 5% газообразного диоксида углерода до конфлюэнтности и затем эти клетки собирают снятием трипсином-ЭДТА (производимым Gibco, 25300-054). Клетки суспендируют в вышеупомянутой среде до получения 25000 клеток/мл и каждые 100 мкл помещают в каждую лунку 96-луночного микротитрационного планшета. Спустя пять дней после инкубирования, когда было почти достигнуто состояние конфлюэнтности, среду выбрасывают и затем добавляют вышеупомянутую среду, содержащую 2.5,5,10,20 или 30 мкМ GM. После инкубирования в течение 24, 48 или 72 ч добавляют 10 мкл премикса WST-1 (производимого TakaraShuzo, MK400) с последующей реакцией при 37 С в течение четырех часов. Величину, полученную вычитанием поглощения при 650 нм(А 650) из поглощения при 450 нм (А 450), определяют как степень роста клеток. Результат показан в таблице 4. Таблица 4 Концентрация(мкМ) 24 ч 48 ч 0 0,846 1,270 2,5 0,768 1,133 5 0,621 0,942 10 0,420 0,486 20 0,238 0,185 30 0,241 0,196 В обоих случаях инкубирования в течение 24 и 48 ч рост клеток ингибируется в секциях,где добавляют 5 мкМ или более GM, в сравнении с контролем, где добавляют воду, и в секции, где добавляют 10 мкМ GM, отмечают образование апоптических тел. В секции, где добавляют 20 мкМ или более, жизнеспособные клетки едва ли можно было заметить. 55 Таким образом, GM обнаруживает апоптоз-индуцирующее действие и ингибирующее рост действие на синовиальные клетки. CM, GD,CD или каждый из их диастереомеров и каждый диастереомер GM показывают также подобные результаты. Пример 12.Molt-3 (ATCC CRL-1552), которые были клеточным штаммом Т-клеточного лейкоза человека, инкубируют в среде RPMI-1640 (производимой Gibco BRL), содержащей 10% фетальную телячью сыворотку (FCS, производимую BioWhittaker) при 37 С в присутствии 5% СО 2 и клетки затем суспендируют в вышеупомянутой среде, содержащей 0, 5, 10 или 20 мкМ GM с получением чисел клеток 5 х 105 клеток/мл с последующим инкубированием в течение 24 ч. Клеточный рост измеряют по МТТ-способу[Mosmann, et al., J. Immun. Methods, volume 65,pages 55-63 (1983)], в котором степень роста клеток определяют по поглощению при 560 нм. Был получен результат, заключающийся в том, что в обоих клеточных штаммах рост клеток ингибируется до степени 50% и не менее 75% в секциях, где добавляют 10 и 20 мкМ GM,соответственно, в сравнении с контролем, где добавляют воду. В случае 5 мкМ или менее GM,не было значимого действия на рост клеток. Таким образом, GM ингибирует, зависимым от концентрации образом, рост клетокJurkat и клеток Molt-3, которые являются штаммами клеток Т-клеточного лейкоза. Результаты представлены на фиг. 34 и 35. Фиг. 34 показывает влияние GM на рост клетокGM на рост клеток Molt-3. На фиг. 34 и 35 абсцисса указывает концентрацию GM (мкМ), тогда как ордината указывает поглощение при 560 нм.Fas (индукция продуцирования) в клетках Jurkat и клетках Molt-3 измеряют следующим образом. В содержащей 10% фетальную телячью сыворотку RPMI-1640, содержащей 0, 1, 5, 10 или 20 мкМ циклопентенона или GМ, 5 х 105 клеток/мл клеток Jurkat или клеток Molt-3 инкубируют при 37 С в течение 24 ч в присутствии 5% СО 2 и затем их подвергают двухстадийному иммуноокрашиванию с использованием антитела противFas (производимого Boehringer-Ingelheim) в соответствии со способом Мункера [Munker, R:Ann. Hematol., volume 70, pages 15-17 (1995)]. Интенсивность флюоресценции окрашенных 1 х 104 клеток измеряют при помощи проточного цитометра (Orthocytron; производимогоOrtho Diagnostic Systems) и рассчитывают долю клеток, обнаруживающих заранее определенную или более высокую интенсивность флюоресценции, которые являются экспрессирующими антиген Fas клетками. 56 Результаты показывают, что, в обоих клеточных штаммах, доля клеток, экспрессирующих антиген Fas, увеличивалась зависимым от концентрации образом при добавлении 1-10 мкМ GM, и при добавлении 20 мкМ GM выход является почти таким же, что и в случае добавления 10 мкМ. Эти результаты показаны на фиг. 36 и 37. Так, фиг. 36 показывает экспрессию антигенаFas в клетках Molt-3, тогда как фиг. 37 показывает экспрессию в клетках Jurkat. На фиг. 36 и 37 абсцисса указывает концентрацию GM(мкМ), тогда как ордината указывает долю (%) экспрессирующих антиген Fas клеток, посредством которой было отмечено индуцирующее действие GM на продуцирование антигена Fas.(3) Клетки Molt-3 инкубируют в течение 1,3, 6, 12 или 24 ч после добавления 10 мкМ GM таким же образом, как в примере 12- (2), и затем долю клеток, экспрессирующих антиген Fas,измеряют тем же самым способом, каким измеряют в примере 12-(2). Результаты показывают, что при добавлении 10 мкМ GM доля экспрессирующих антигенFas клеток увеличивается спустя 12 ч после инкубирования и дополнительное увеличение отмечается после 24 ч. Этот результат показан на фиг. 38. Так,фиг. 38 показывает изменение в доле экспрессирующих антиген Fas клеток при проведении инкубирования после добавления 10 мкМ GM к клеткам Molt-3, где абсцисса указывает время инкубирования (часы), тогда как ордината указывает долю (%) экспрессирующих антиген Fas клеток. Таким образом, как упоминалось выше в примере 12, было получено действие GM, индуцирующее экспрессию антигена Fas. CM, GD,CD или каждый из их диастереомеров и каждый диастереомер GM показывают также подобные результаты. Пример 13. Мышей КК-А 7 (самцов; в возрасте четырех недель) покупают из Clea Japan и, после выкармливания в лаборатории до возраста десяти недель, GM вводят перорально в течение 21 дня и исследуют его влияние на содержание сахара,инсулина и липидов в крови. Дозы GM были 30,100 и 300 мг/кг. Сахар крови уменьшался в каждой из групп с введением GM (фиг. 39). Инсулин в сыворотке снижается в каждой из групп с введением GM (фиг. 40). Что касается липидов в сыворотке, общий холестерин в сыворотке уменьшается в получавшей GM группе (фиг. 41), триглицериды в сыворотке уменьшаются в получавшей GM группе (фиг. 42) и свободные жирные кислоты в сыворотке уменьшаются в получавшей GM группе (фиг. 43). Так фиг. 39 показывает соотношение между дозой GM и сахаром в крови, где ордината указывает величину глюкозы в сыворотке(мг/дл), тогда как абсцисса указывает дозу GM(мг/кг). Фиг. 40 показывает зависимость между дозой GM и инсулином в сыворотке, где ордината указывает величину инсулина в сыворотке(мкЕ/мл), тогда как абсцисса указывает дозу GM(мг/кг). Фиг. 41 показывает зависимость между дозой GM и величиной общего холестерина в сыворотке, где ордината указывает величину общего холестерина (мг/дл), тогда как абсцисса указывает дозу GM (мг/кг). Фиг. 42 показывает зависимость между дозой GM и величиной триглицеридов в сыворотке, где ордината указывает величину триглицеридов в сыворотке(мг/дл), тогда как абсцисса указывает дозу GM(мг/кг). Фиг. 43 показывает зависимость между дозой GM и величиной свободных жирных кислот в сыворотке (мк.экв./л), тогда как абсцисса указывает дозу GM (мг/кг). В рисунках,иозначают, что значимости во множественном сравнительном тесте Turkey для группы, в которой не вводят GM, были р 0,05 и р 0,01, соответственно. При этом животных группируют на четыре группы (каждая группа состоит из десяти животных) и четырем группам вводят физиологический солевой раствор (5 мл/кг) или 30, 100 или 300 мг/5 мл/кг GM. Каждое тест-вещество вводят перорально один раз в день в течение 21 дня, и в конечный день введения животных анестезируют эфиром спустя четыре часа после введения тест-вещества и кровь собирают из артерии нижней части живота. Инсулин в сыворотке измеряют при помощи иммуноферментного анализа (коммерчески доступный набор;Pure Chemicals). Сахар, триглицериды и свободные жирные кислоты и в сыворотке измеряют при помощи автоматизированного анализатораACS-ACOD-способу соответственно. Общий холестерин в сыворотке измеряют с применением автоматизированного анализатора (типа 7070, производимого Hitachi) по холестериноксидаза-DAOS-способу. На основании приведенных выше результатов было обнаружено, что GM обладает действием снижения сахара, инсулина и липидов крови. CM, GD, CD или каждый из их диастереомеров и каждый диастереомер GM показывают также подобные результаты. Пример 14.(1) Среду RPMI-1640 (5 мл), содержащую 10% фетальную телячью сыворотку, которая содержит 2 х 105 клеток/HL-60 (AТСС CCL240), помещают в каждую лунку шестилуночного планшета, инкубируют при 37 С в течение 24 ч в присутствии 5% СO2, затем добавляют в лунки GM до его конечной концентрации 0, 0.5,1.0, 3.0, 5.0, 10.0 или 20.0 мкМ и инкубирование продолжают в течение еще восьми часов. После завершения инкубирования число клеток считают и клетки извлекают центрифу 001888 58 гированием и промывают PBS (забуференный фосфатный физиологический раствор) с получением GM-обработанных клеток. Тем временем, готовят также клетки, которые нагревают при 45 С в течение десяти минут с последующим таким же инкубированием. Клетки, обработанные таким образом, подвергают электрофорезу в SDS-PAGE (додецилсульфат натрия - полиакриламидный гель) по способу, упомянутому в "Molecular Cloning"[Cold Spring Harbor Laboratory Press, (1989)]. Обработанные клетки суспендируют в буфере для проб для электрофореза в SDS-PAGE до конечной концентрации 2,5 х 106 клеток/мл, полученную клеточную суспензию обрабатывают при 100 С в течение десяти минут и каждые 5 мкл ее наносят на две пластины гелей SDSPAGE (5% концентрирующий гель; 10% разделяющий гель) для проведения электрофореза. Один из гелей окрашивают Кумасси Бриллиантовым Синим R250, тогда другой гель подвергают блоттингу на поливинилидендифторидной блоттинг-мембране (Immobilon, производимой Millipore, номер по каталогу IPVH000-10). Мембрану подвергают блокированию при 4 С в течение одной ночи с Block Асе (производимымUK-В 25). Блокированной мембране дают взаимодействовать с моноклональным антителом HSP 72/73 (Ab-1) (производимым Oncogen ResearchProducts, номер по каталогу HSP01), которое специфически реагирует с индуцированным нагреванием белком теплового шока 70 кДа, и промывают TBS, содержащим 0,05% Твин 20, с последующим промыванием TBS. После этого ей дают и реагировать с конъюгированным с пероксидазой вторичным антителом HRPкроличьим антимышиным IgG (H+L) (производимым Zymed Laboratories, номер по каталогу 61-6520) и промывают так же, как в вышеописанной операции. Мембранам, которые обрабатывают первичными и вторичными антителами,дают реагировать с Renaissance (хемилюминесцентным реагентом, производимым DupontNEN, номер по каталогу NEL-100) и фотосенсибилизируют с рентгеновской пленкой для детектирования индукции белка теплового шока 70 кДа. Результаты показали, что при добавленииGM отмечалась индукция белка теплового шока 70 кДа. Интенсивность индукции показана в таблице 5. В таблице 5 "+" указывает степень интенсивности индукции и чем больше количества "+", тем больше интенсивность индукции."-" означает, что индукции не было, и означает, что индукция была слабой. Таблица 5 Обработанные клетки Индукция белка теплового шока Нагретые при 45 С в Из таблицы 5 очевидно, что GM обладает способностью индукции БТШ 70.(2) CM добавляют к инкубированным клеткам до конечной концентрации 0, 10, 20, 30,40 или 50 мкМ и экспрессию БТШ 70 измеряют по способу, упомянутому в примере 14-(1). Результат показал, что СМ индуцирует белок теплового шока 70 кДа. Интенсивность индукции показана в таблице 6. В таблице 6 "+" указывает степень интенсивности индукции и чем больше количества "+", тем больше интенсивность индукции. "-" означает, что индукции не было, и означает, что индукция была слабой. Обработанные клетки Нагретые при 45 С в течение 10 мин 0 мкМ GM 5 мкМ GM 10 мкМ GM 20 мкМ СМ 30 мкМ GM 40 мкМ GM 50 мкМ GM Таблица 6 Индукция белка теплового шока Таким образом, как показано в примере 14,GM и СМ обнаруживают действие индуцирования белка теплового шока. GD, CD или каждый из их диастереомеров и каждый диастереомерGM и СМ также обнаруживают подобный результат. Пример 15.B (где не менее 90% клеток CEM-SS были инфицированы ВИЧ-1III B; далее эти клетки называются СЕМ-3 В), инкубирование проводят в течение одного дня, число жизнеспособных клеток и число мертвых клеток считают и рассчитывают коэффициент выживаемости. Результат показал, что при добавлении GM до конечной концентрации 0, 4 или 8 мкМ коэффициент выживаемости не уменьшается в клетках CEM-SS,тогда как в клетках СЕМ-3 В коэффициент выживаемости значимо уменьшается в зависимости от концентрации добавленного GM. Кроме того, в случае добавления 16 мкМ, коэффициент выживаемости клеток CEM-SS также уменьшается, но коэффициент выживаемости клеток СЕМ-ЗВ уменьшается сильнее. Это означает,что GM обнаруживает действие против ВИЧ. 60 Этот результат представлен на фиг. 44. Таким образом, фиг. 44 показывает зависимость между концентрацией добавленного GM и коэффициентом выживаемости клеток, где абсцисса указывает концентрацию GM (мкМ), тогда как ордината указывает коэффициент выживаемости (%) после инкубирования в течение одного дня. Открытый квадрат указывает случай, где используют клетки CEM-SS, тогда как черный кружок указывает случай, где используют клетки СЕМ-ЗВ.(2) Измеряют концентрацию антигена р 24,содержащегося в супернатантной жидкости в культуре после инкубирования клеток СЕМ-ЗВ,упомянутых в примере 15-(1), в течение одного дня. Результаты показывают, что концентрация р 24 уменьшается в зависимости от концентрации добавленного GM, что указывает на действие против ВИЧ. Результат показан на фиг. 45. Таким образом, фиг. 45 показывает зависимость между концентрацией добавленного GM и количеством образованного р 24 в супернатантной жидкости культуры, где абсцисса указывает количество добавленного GM (мкМ), тогда как ордината указывает количество образованного р 24 (нг/мл). Таким образом, как показано в примере 15 выше, GM обнаруживает селективное цитоцидное (разрушающее клетки) действие в отношении ВИЧ-инфицированных клеток, проявляя антивирусное действие в отношении ВИЧ. CM,GD, CD и каждый из их диастереомеров и каждый диастереомер GM обнаруживают также подобный результат. Пример 16.(1) Трансформацию Escherichia coli HB101 проводят контрольной плазмидой pcD2-Y, экспрессирующей устойчивый к G418 ген [Mol.Cell. Biol., volume 7, pages 2745-2752 (1987)] и плазмидой pcD2-16E7, которая способна экспрессировать как Е 7 HPV 16 type, так и устойчивый к С 418 ген [Jpn. J. Cancer Res., volume 82,pages 1340-1343 (1991)], затем проводят инкубирование в среде с L-бульоном и плазмиду экстрагируют из собранных клеток и очищают ультрацентрифугированием в градиенте плотности хлорида цезия с получением векторной плазмиды для введения гена. Клетки NIH 3 Т 3 инкубируют при 37 С 13 условиях 5% CO2 в модифицированной по способу Дульбекко среде Игла, содержащей 10% фетальную телячью сыворотку. Очищенную плазмиду (10 мкг) вводят в клетки NIH 3 Т 3 при помощи катионной липосомы (TransiT LT-1, производимой TakaraShuzo), клетки отбирают при 37 С в условиях 5% СО 2 в течение двух недель в модифицированной по способу Дульбекко среде Игла, содержащей 10% фетальную телячью сыворотку,которая содержала 0,4 мг/мл G418 (Gibco), и полученные колонии клонируют с установлением девяти штаммов клеток NIH 3 Т 3, в которые
МПК / Метки
МПК: A61P 29/00, C07C 323/50, A61K 31/10
Метки: основе, циклопентанонов, препараты, получения, способ, производные, фармацевтические
Код ссылки
<a href="https://eas.patents.su/30-1888-proizvodnye-ciklopentanonov-sposob-ih-polucheniya-i-farmacevticheskie-preparaty-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Производные циклопентанонов, способ их получения и фармацевтические препараты на их основе</a>
Предыдущий патент: Производные иминоазаантрациклинона для лечения амилоидоза
Следующий патент: Косметическое средство для удаления ороговевших пробок
Случайный патент: Способ переноса полипептидов в клетки












