Этинильные производные в качестве модуляторов метаботропного глутаматного рецептора
Номер патента: 24993
Опубликовано: 30.11.2016
Авторы: Линдеманн Лотар, Ешке Георг, Штадлер Хайнц, Рюхер Даниэль, Риччи Антонио, Виейра Эрик
Формула / Реферат
1. Этинильное производное формулы IA
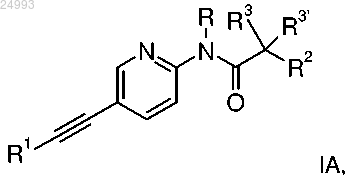
где R1 представляет собой фенил, который возможно замещен галогеном;
R представляет собой водород или C1-4-алкил;
R2 представляет собой водород, C1-4-алкил, C1-4-алкоксигруппу, CF3 или S-C1-4-алкил;
R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу;
или его фармацевтически приемлемая соль присоединения кислоты, оптический изомер или их рацемическая смесь,
за исключением соединения N-(5-((1Н-пирроло[2,3-В]пиридин-2-ил)этинил)пиридин-2-ил)ацетамида.
2. Этинильное производное формулы IA по п.1, представляющее собой
2,2-диметил-N-(5-фенилэтинилпиридин-2-ил)пропионамид;
N-(5-фенилэтинилпиридин-2-ил)бутирамид;
(5-фенилэтинилпиридин-2-ил)амид пентановой кислоты;
3-метил-N-(5-фенилэтинилпиридин-2-ил)бутирамид;
(5-фенилэтинилпиридин-2-ил)амид (RS)-2-метилпентановой кислоты;
2-метилсульфанил-N-(5-фенилэтинилпиридин-2-ил)ацетамид;
2-метокси-N-(5-фенилэтинилпиридин-2-ил)ацетамид;
N-[5-(3-фторфенилэтинил)пиридин-2-ил]-2,2-диметилпропионамид;
2-метокси-2-метил-N-(5-фенилэтинилпиридин-2-ил)пропионамид;
N-[5-(3-фторфенилэтинил)пиридин-2-ил]-2-метокси-2-метилпропионамид;
N-[5-(2,5-дифторфенилэтинил)пиридин-2-ил]-2-метокси-2-метилпропионамид или
N-[5-(3-хлорфенилэтинил)пиридин-2-ил]-3,3,3-трифтор-2,2-диметилпропионамид.
3. Этинильное производное формулы IB
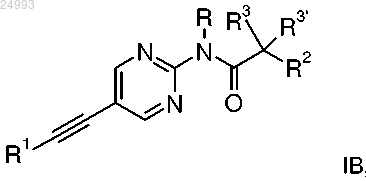
где R1 представляет собой фенил, который возможно замещен галогеном;
R представляет собой водород или C1-4-алкил;
R2 представляет собой водород, C1-4-алкил, C1-4-алкоксигруппу, CF3 или S-C1-4-алкил;
R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу;
или его фармацевтически приемлемая соль присоединения кислоты, оптический изомер или их рацемическая смесь.
4. Этинильное производное формулы IB по п.3, представляющее собой 2,2-диметил-N-(5-фенилэтинилпиримидин-2-ил)пропионамид или 2,2,N-триметил-N-(5-фенилэтинилпиримидин-2-ил)пропионамид.
5. Этинильное производное формулы ID
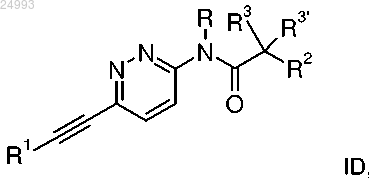
где R1 представляет собой фенил, который возможно замещен галогеном;
R представляет собой водород или C1-4-алкил;
R2 представляет собой водород, C1-4-алкил, C1-4-алкоксигруппу, CF3 или S-C1-4-алкил;
R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу;
или его фармацевтически приемлемая соль присоединения кислоты, оптический изомер или их рацемическая смесь.
6. Этинильное производное формулы ID по п.5, представляющее собой
2,2-диметил-N-(6-фенилэтинилпиридазин-3-ил)пропионамид или
N-[6-(3-хлорфенилэтинил)пиридазин-3-ил]-2,2-диметилпропионамид.
7. Применение соединения по любому из пп.1-6 в качестве аллостерического модулятора метаботропного глутаматного рецептора 5 подтипа (mGluR5).
8. Фармацевтическая композиция для аллостерической модуляции метаботропного глутаматного рецептора 5 подтипа, включающая по меньшей мере одно из соединений по любому из пп.1-6 или его фармацевтически приемлемую соль.
9. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения или профилактики заболеваний, связанных с аллостерическими модуляторами метаботропного глутаматного рецептора 5 подтипа.
10. Применение соединения по любому из пп.1-6 для лечения или профилактики шизофрении, когнитивных расстройств, синдрома ломкой Х-хромосомы или аутизма.
Текст
ЭТИНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ МЕТАБОТРОПНОГО ГЛУТАМАТНОГО РЕЦЕПТОРА Настоящее изобретение относится к этинильным производным формул IA, IB и ID где R1 представляет собой фенил, который возможно замещен галогеном; R представляет собой водород или C1-4-алкил; R2 представляет собой водород, C1-4-алкил, C1-4-алкоксигруппу,CF3 или S-C1-4-алкил; R3/R3' независимо друг от друга представляют собой водород, C1-4 алкил или C1-4-алкоксигруппу; или их фармацевтически приемлемой соли присоединения кислоты, рацемической смеси или их соответствующему энантиомеру и/или оптическому изомеру и/или стереоизомеру, за исключением соединения N-(5-1 Н-пирроло[2,3-В]пиридин-2 ил)этинил)пиридин-2-ил)ацетамида. Обнаружили, что соединения формул IA, IB и ID представляют собой аллостерические модуляторы метаботропного глутаматного рецептора 5 подтипа (mGluR5). Настоящее изобретение относится к этинильным производным формул IA, IB и ID где R1 представляет собой фенил, который возможно замещен галогеном;R представляет собой водород или C1-4-алкил;R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу; или их фармацевтически приемлемой соли присоединения кислоты, рацемической смеси или их соответствующему энантиомеру и/или оптическому изомеру и/или стереоизомеру,за исключением соединенияN-(5-1 Н-пирроло[2,3-В]пиридин-2-ил)этинил)пиридин-2 ил)ацетамида. Неожиданно обнаружили, что соединения общих формул IA, IB и ID представляют собой аллостерические модуляторы метаботропного глутаматного рецептора 5 подтипа (mGluR5). В центральной нервной системе (ЦНС) передача нервных импульсов осуществляется за счет взаимодействия между нейротрансмиттером, который испускается нейроном, с нейрорецептором. Глутамат является основным нейромедиатором возбуждения в головном мозге, и он играет особую роль в различных функциях центральной нервной системы (ЦНС). Рецепторы глутамат-зависимых стимулов подразделяются на две основные группы. Рецепторы первой основной группы, собственно, ионотропные рецепторы, формируют контролируемые лигандом ионные каналы. Метаботропные глутаматные рецепторы (mGluR) относятся ко второй основной группе, и, кроме того, они принадлежат к семейству рецепторов, сопряженных с G-белком. В настоящее время известно восемь различных членов этого семейства mGluR, и некоторые из них даже имеют подтипы. На основании гомологии их последовательности, механизмов передачи сигнала и селективности агонистов эти восемь рецепторов можно подразделить на три подгруппы: mGluFR1 иmGluR8 относятся к III группе. Лиганды метаботропных глутаматных рецепторов, принадлежащих к первой группе, можно применять для лечения или профилактики острых и/или хронических неврологических расстройств, таких как психоз, эпилепсия, шизофрения, болезнь Альцгеймера, когнитивного расстройства и нарушения памяти,а также хронической и острой боли. Одним из показаний для лечения в связи с этим является ограниченная функция головного мозга,вызванная операцией с отключением или трансплантацией, плохим кровоснабжением головного мозга,повреждениями спинного мозга, травмами головы, гипоксией при беременности, остановкой сердца и гипогликемией. Другими показаниями к лечению являются ишемия, хорея Гентингтона, амиотрофический боковой склероз (ALS), деменция, вызванная СПИДом, глазные травмы, ретинопатия, идиопатический паркинсонизм или медикаментозный паркинсонизм, а также состояния, которые приводят к глутамат-дефицитным функциям, таким как, например, мышечные спазмы, конвульсии, мигрень, недержание мочи, никотиновая зависимость, опиатная зависимость, тревожность, рвота, дискинезия и депрессии. Расстройства, которые полностью или частично опосредованы mGluR5, представляют собой, например, острые, травматические и хронические дегенеративные процессы в нервной системе, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Гентингтона, амиотрофический боковой склероз и множественный склероз, психические заболевания, такие как шизофрения и тревожность, депрессия, боль и наркомания (Expert Opin. Ther. Patents (2002), 12, (12. Новым направлением для разработки селективных модуляторов является поиск соединений, которые действуют по аллостерическому механизму, модулируя рецептор путем связывания с сайтом, отличным от того, который представляет собой высококонсервативный ортостерический сайт связывания. Недавно было обнаружено, что аллостерические модуляторы mGluR5 представляют собой новые фармацевтические сущности, которые обеспечивают обсуждаемую привлекательную альтернативу. Аллостерические модуляторы были описаны, например, в следующих источниках: WO 2008/151184, WO 2006/048771, WO 2006/129199, WO 2005/04479; а также: Molecular Pharmacology, 40, 333-336, 1991; TheJournal of Pharmacology and Experimental Therapeutics, Vol. 313, No. 1, 199-206, 2005. В последние годы были достигнуты существенные успехи в понимании патофизиологии некоторых заболеваний развития головного мозга, дающие основание предполагать, что синтез белка в синапсах запускается путем активации метаботропных глутаматных рецепторов I группы. Такие расстройства включают синдром ломкой Х-хромосомы, аутизм, идиопатический аутизм, комплекс туберозного склероза, нейрофиброматоз 1 типа или синдром Ретта (Annu. Rev. Med., 2011, 62, 31.1-31.19; Neurosdence 156,2008, 203-215). Из предшествующего уровня техники известны позитивные аллостерические модуляторы. Они представляют собой соединения, которые сами непосредственно не активируют рецепторы, но существенно усиливают агонист-стимулированные отклики, повышают действенность и максимальную эффективность. Связывание таких соединений повышает сродство глутамат-сайтовых агонистов к их внеклеточному N-концевому сайту связывания. Таким образом, аллостерическая модуляция представляет собой привлекательный механизм для усиления надлежащей физиологической активации рецептора. Имеется недостаток селективных аллостерических модуляторов для рецептора mGluR5. Существующие модуляторы рецептора mGluR5, как правило, не обладают удовлетворительной растворимостью в воде и характеризуются низкой биодоступностью при оральном введении. Таким образом, сохраняется необходимость в соединениях, которые позволяют преодолеть эти недостатки, и которые с достаточной эффективностью обеспечивают селективное аллостерическое модулирование рецептора mGluR5. Соединения по изобретению отличаются тем, что они обладают ценными терапевтическими свойствами. Их можно применять при лечении или профилактике расстройств, связанных с аллостерическими модуляторами рецептора mGluR5. Наиболее предпочтительными назначениями для этих соединений, которые представляют собой аллостерические модуляторы, являются шизофрения и когнитивное расстройство. Настоящее изобретение относится к соединениям формул IA, IB и ID, a также к их фармацевтически приемлемым солям, в случае, когда это применимо, к смесям энантиомеров или диастереомеров или их энантиомерно или диастереомерно чистым формам, к таким соединениям в виде фармацевтически активных веществ, к способу их получения, а также к применению для лечения или профилактики расстройств, связанных с аллостерическими модуляторами рецептора mGluR5, таких как шизофрения, когнитивное расстройство, синдром ломкой Х-хромосомы или аутизм, а также к фармацевтическим композициям, содержащим соединения по изобретению. Ниже следующие определения общих терминов, используемые в настоящем описании, применяются независимо от того, встречается ли обсуждаемый термин отдельно или в сочетании. В данном тексте термин "низший алкил" обозначает насыщенную, т.е. алифатическую углеводородную группу, включающую линейную или разветвленную углеродную цепь, состоящую из 1-4 атомов углерода. Примерами "алкильной" группы являются метил, этил, н-пропил и изопропил. Термин "алкокси" обозначает группу -O-R', в которой R' представляет собой низший алкил, определенный выше. Термин "этинил" обозначает группу -СС-. Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая соль присоединения кислоты" охватывает соли с неорганическими и органическими кислотами, такими как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п. Одним из воплощений настоящего изобретения является соединение формулы IAR представляет собой водород или C1-4-алкил;R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу; или его фармацевтически приемлемая соль присоединения кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или стереоизомер. Примерами соединения формулы IA являются следующие вещества: 2,2-диметил-N-(5 фенилэтинилпиридин-2-ил)пропионамид, N-(5-фенилэтинилпиридин-2-ил)бутирамид, (5-фенилэтинилпиридин-2-ил)амид пентановой кислоты, 3-метил-N-(5-фенилэтинилпиридин-2-ил)бутирамид, (5 фенилэтинилпиридин-2-ил)амид (RS)-2-метилпентановой кислоты, 2-метилсульфанил-N-(5-фенилэтинилпиридин-2-ил)ацетамид, 2-метокси-N-(5-фенилэтинилпиридин-2-ил)ацетамид, N-[5-(3-фторфенилэтинил)пиридин-2-ил]-2,2-диметилпропионамид,2-метокси-2-метил-N-(5-фенилэтинилпиридин-2-ил) пропионамид,N-[5-(3-фторфенилэтинил)пиридин-2-ил]-2-метокси-2-метилпропионамид,N-[5-(2,5 дифторфенилэтинил)пиридин-2-ил]-2-метокси-2-метилпропионамид или N-[5-(3-хлорфенилэтинил)пи-2 024993 ридин-2-ил]-3,3,3-трифтор-2,2-диметилпропионамид. Еще одним воплощением настоящего изобретения является соединение формулы IBR представляет собой водород или C1-4-алкил;R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу; или его фармацевтически приемлемая соль присоединения кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или стереоизомер. Конкретными примерами соединений формулы IB являются следующие соединения: 2,2-диметилN-(5-фенилэтинилпиримидин-2-ил)пропионамид или 2,2,N-триметил-N-(5-фенилэтинилпиримидин-2 ил)пропионамид. Еще одним воплощением настоящего изобретения является соединение формулы IDR представляет собой водород или C1-4-алкил;R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу; или его фармацевтически приемлемая соль присоединения кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или стереоизомер. Примерами соединения формулы ID являются следующие вещества: 2,2-диметил-N-(6 фенилэтинилпиридазин-3-ил)-пропионамид илиN-[6-(3-хлорфенилэтинил)-пиридазин-3-ил]-2,2 диметилпропионамид. Получение соединения по настоящему изобретению можно проводить параллельными или сходящимися путями синтеза. Способы синтеза соединений по настоящему изобретению представлены на следующих далее схемах 1-5. Навыки, которые требуются для проведения реакций и очистки полученных продуктов, известны специалистам в данной области техники. Заместители и индексы, использованные в следующем далее описании способов, имеют значение, раскрытое в данном тексте выше. Соединения по изобретению можно получать способами, представленными ниже, способами, представленными в примерах, или аналогичными способами. Подходящие условия реакций для конкретных реакционных стадий известны специалисту в данной области техники. Последовательность реакций не ограничена той, которая приведена на схемах, а, наоборот, в зависимости от исходных веществ и их относительной реакционной способности, последовательность реакционных стадий можно легко изменять. Исходные вещества либо имеются в продаже, либо их можно получить способами, аналогичными способам, приведенным ниже, способами, описанными в источниках, на которые даны ссылки в описании или в примерах, или способами, известными в данной области техники. Получение соединения по изобретению далее описано более подробно в схемах 1-5 и в примерах 116.W представляет собой N или СН. Этинильное соединение формулы I можно получить, например, с помощью сочетания по Соногашира подходящего амина 1 с подходящим образом замещенным арилацетиленом 2 с получением соответствующего этинильного соединения 3. Сочетание этинильного соединения 3 с подходящим образом замещенным хлоридом кислоты 4 с основанием, таким как пиридин, в растворителе, таком как дихлорметан, или сочетание с подходящим образом замещенной кислотой 5 с основанием, таким как основание Хунига, и пептид-конденсирующим реагентом, таким как HATU или TBTU, в растворителе, таком как диметилформамид (DMF), дают целевое этинильное соединение общей формулы I. Можно также ввести заместитель R на более поздней стадии путем алкилирования соединения формулы I, где R=H. Схема 2W представляет собой N или СН. Вообще говоря, последовательность стадий, используемая для синтеза соединений формулы I, также можно модифицировать в конкретных случаях, например, сначала проводя амидное сочетание с образованием подходящим образом замещенного амидного производного 6, а затем проводя сочетание по Соногашира с подходящим образом замещенным арилацетиленом 2, по аналогии со способами, описанными на схеме 1. Введение заместителя R можно также осуществлять в различные моменты в последовательности синтетических стадий путем алкилирования соответствующего промежуточного продукта, где Производное этинилпиримидина формулы IB можно получить с помощью сочетания по Соногашира подходящим образом замещенного арилацетилена 2 с 5-бром-2-метилсульфанилпиримидином 7 с получением соответствующих метансульфанильных производных 8. Окисление тиоэфира с помощью окислителя, такого как mCPBA, в растворителе, таком как дихлорметан (DCM), дает соответствующе сульфонильное производное 9. Реакция сульфонильного производного с подходящим образом замещенным амином 10 в присутствии основания, такого как триэтиламин, в растворителе, таком как тетрагидрофуран (THF), дает целевой (5-фенилэтинилпиримидин-2-ил)амин 11. Сочетание соединения 11 с подходящим образом замещенным хлоридом кислоты 4 с основанием, таким как пиридин, в растворителе, таком как дихлорметан, или сочетание с подходящим образом замещенной кислотой 5 с основанием, таким как основание Хунига, и пептид-конденсирующим агентом, таким как гексафторфосфонат О-(7 азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) или тетрафторборат 2-(1 Н-бензотриазол-1-ил)1,1,3,3-тетраметилурония (TBTU), в растворителе, таком как диметилформамид (DMF), дают целевое производное этинилпиримидина общей формулы IB. Схема 4W представляет собой N или СН. В некоторых случаях можно также осуществить селективную реакцию дигалогенированного соединения 12 с производным ацетилена 2 с получением аддукта 13. Амидогруппу можно затем непосредственно ввести путем нуклеофильного присоединения (Y = предпочтительно Cl, F) или с помощью катализируемого палладием сочетания (по Бухвальду) (Y = предпочтительно Br или I). Группу R можно ввести либо непосредственно на стадии сочетания, либо путем алкилирования соединения общей формулыI-1. Разумеется, в зависимости от X и Y' последовательность реакций можно изменять, сначала вводя амидную группу, а затем проводя реакцию Соногашира (X = Cl, Br, I предпочтительно Br, I), чтобы ввести ацетиленовую группу.W представляет собой N или СН. Соединения формулы I можно получить путем сочетания по Соногашира подходящим образом замещенного амидного производного 6 с этинилтриметилсиланом 14 с получением соответствующих 5 триметилсиланилэтинильных производных 15. Сочетание по Соногашира с in situ десилилированием 15 и подходящим образом замещенным арилгалогенидом 16 дает целевые соединения формулы I (схема 5). Перечень примеров Экспериментальная часть Пример 1. 2,2-Диметил-N-(5-фенилэтинилпиридин-2-ил)пропионамидTHF. Добавляли 2-амино-5-иодпиридин (3 г, 13,6 ммоль) и фенилацетилен (2,79 г, 27,3 ммоль, 2,0 экв.) при комнатной температуре. Добавляли триэтиламин (5,58 мл, 40,9 ммоль, 3 экв.), трифенилфосфин (111 мг, 0,41 ммоль, 0,03 экв.) и иодид меди(I) (70 мг, 0,41 ммоль, 0,03 экв.) и эту смесь перемешивали в течение 2 ч при 65 С. Реакционную смесь охлаждали и экстрагировали насыщенным раствором NaHCO3 и три раза этилацетатом. Органические слои объединяли, высушивали над сульфатом натрия и выпаривали досуха. Неочищенный продукт суспендировали в дихлорметане, фильтровали и полученное твердое вещество выпаривали досуха. Целевой 5-фенилэтинилпиридин-2-иламин (1,6 г, выход 62%) получали в виде светло-желтого твердого вещества, MS: m/e = 195,3 (М+Н+). Стадия 2: 2,2-диметил-N-(5-фенилэтинилпиридин-2-ил)пропионамид 5-Фенилэтинилпиридин-2-иламин (65 мг, 0,33 ммоль) (пример 1, стадия 1) растворяли в дихлорметане (3 мл). Добавляли пиридин (52 мг, 53 мкл, 0,67 ммоль, 2 экв.) и пивалоилхлорид (48 мг, 50 мкл, 0,40 ммоль, 1,2 экв.) и эту смесь перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь экстрагировали 1 н. раствором HCl и дважды дихлорметаном. Органические экстракты объединяли, высушивали над сульфатом натрия и выпаривали досуха. Неочищенный продукт очищали флэшхроматографией на колонке с силикагелем, элюировали смесью гептан:дихлорметан 50:50. Целевой 2,2 диметил-N-(5-фенилэтинилпиридин-2-ил)пропионамид (40 мг, выход 43%) получали в виде светложелтого твердого вещества, MS: m/e = 279,3 (М+Н+). Пример 2. N-(5-Фенилэтинилпиридин-2-ил)бутирамид Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 265,3 Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 279,3 Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 279,3 Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 293,3 5-Бромпиридин-2-амин (1 г, 5,78 ммоль) растворяли в DMF (40 мл) и вносили HATU (2,64 г, 6,94 ммоль, 1,2 экв.). Через 15 мин при комнатной температуре добавляли основание Хунига (6,0 мл, 34,7 ммоль, 6 экв.) и 2-(метилтио)уксусную кислоту (736 мг, 6,94 ммоль, 1,2 экв.). Эту смесь перемешивали в течение 72 ч при комнатной температуре. Реакционную смесь выпаривали и экстрагировали три раза насыщенным раствором Na2CO3 и три раза этилацетатом. Органические слои экстрагировали три раза 1 н. раствором HCl и выпаривали досуха. Неочищенный продукт суспендировали в пентане, фильтровали и полученное твердое вещество выпаривали досуха. ЦелевойN-(5-бромпиридин-2-ил)-2 метилсульфанилацетамид (312 мг, выход 21%) получали в виде желтого твердого вещества, MS: m/e = 258,9/260,8 (М+Н+). Стадия 2: 2-метилсульфанил-N-(5-фенилэтинилпиридин-2-ил)ацетамид Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 283,1 Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 258,0/259,9 (М+Н+), таким же способом, как описано в примере 1, стадия 2, из 2-амино-5 бромпиримидина и пивалоилхлорида. Стадия 2: 2,2-диметил-N-(5-фенилэтинилпиримидин-2-ил)пропионамид Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 280,1 (М+Н+), таким же способом, как описано в примере 1, стадия 1, из N-(5-бромпиримидин-2-ил)-2,2 диметилпропионамида (пример 7, стадия 1) и фенилацетилена. Пример 8. 2,2,N-Триметил-N-(5-фенилэтинилпиримидин-2-ил)пропионамидTHF и добавляли 5-бром-2-метилсульфанилпиримидин (840 мг, 4,1 ммоль) и фенилацетилен (410 мкл,4,1 ммоль, 1 экв.) при комнатной температуре. Добавляли триэтиламин (1,36 мл, 12,3 ммоль, 3 экв.), трифенилфосфин (28 мг, 0,12 ммоль, 0,03 экв.) и иодид меди(I) (19 мг, 0,08 ммоль, 0,03 экв.) и эту смесь перемешивали в течение 3 ч при 65 С. Реакционную смесь охлаждали и экстрагировали один раз насыщенным раствором NaHCO3 и три раза этилацетатом. Органические слои объединяли, высушивали над сульфатом натрия, фильтровали и выпаривали досуха. Неочищенный продукт очищали флэшхроматографией на силикагеле (гептан:этилацетат 100:050:50). Целевой 2-метилсульфанил-5 фенилэтинилпиримидин получали в виде светло-желтого твердого вещества (400 мг, 44%), MS: m/e = 227,3 (М+Н+). 2-Метилсульфанил-5-фенилэтинилпиримидин (360 мг, 1,60 ммоль) (пример 8, стадия 1) растворяли в 20 мл дихлорметана и несколькими порциями при 0-5 С добавляли 3-хлорпербензойную кислоту (870 мг, 3,50 ммоль, 2,2 экв.). Реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Вносили насыщенный раствор NaHCO3 и эту смесь экстрагировали три раза этилацетатом. Органические экстракты высушивали над сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт очищали флэш-хроматографией на силикагеле (дихлорметан). Целевой 2-метансульфонил-5 фенилэтинилпиримидин получали в виде белого твердого вещества (400 мг, 97%), MS: m/e = 259,2 2-Метансульфонил-5-фенилэтинилпиримидин (100 мг, 0,38 ммоль) (пример 8, стадия 2), метиламин гидрохлорид (52 мг, 0,77 ммоль, 2 экв.) и Et3N (220 мкл, 1,55 ммоль, 4 экв.) суспенидровали в 1 мл THF и перемешивали в течение 1 ч при 65 С. Реакционную смесь концентрировали в вакууме и полученный остаток очищали флэш-хроматографией, непосредственно нанося неочищенное вещество на колонку с силикагелем, элюировали смесью (гептан:этилацетат 100:00:100). Целевой метил-(5 фенилэтинилпиримидин-2-ил)амин получали в виде белого твердого вещества (38 мг, 47%), MS: m/e = 210,2 (М+Н+). Стадия 4: 2,2,N-триметил-N-(5-фенилэтинилпиримидин-2-ил)пропионамид Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 294,0 К суспензии 3-хлор-6-(фенилэтинил)пиридазина (CAS 77778-15-5) (200 мг, 0,93 ммоль) и пиваламида (113 мг, 1,12 ммоль, 1,2 экв.) в 4 мл толуола добавляли карбонат цезия (364 мг, 1,12 ммоль, 1,2 экв.). Эту суспензию нагревали в течение 20 ч при 120 С и затем остужали до комнатной температуры. Вносили этилацетат (10 мл) и нерастворимые соли отфильтровывали. После концентрирования в вакууме полученный остаток очищали флэш-хроматографией, элюировали гептаном, а затем градиентом гептан 60% этилацетат/гептан, с получением 19 мг (7%) указанного в заголовке соединения в виде светложелтого твердого вещества, MS: m/e = 280,2 (М+Н+). Пример 10. 2-Метокси-N-(5-фенилэтинилпиридин-2-ил)ацетамид Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 267,0 Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e = 257,1/259,0 Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 297,2 5-Фенилэтинилпиридин-2-иламин (100 мг, 0,515 ммоль) (пример 1, стадия 1) растворяли в дихлорметане (5 мл) и добавляли 2-метокси-2-метилпропионовую кислоту (91 мг, 0,77 ммоль, 1,5 экв.), 2-бром 1-этилпиридиний тетрафторборат (CAS 878-23-9) (211 мг, 0,77 ммоль, 1,5 экв.) и основание Хунига (0,26 мл, 1,54 ммоль, 3 экв.). Эту смесь перемешивали в течение 14 ч при комнатной температуре. Реакционную смесь экстрагировали насыщенным раствором Na2CO3 и дихлорметаном. Органический слой высушивали над сульфатом натрия и выпаривали досуха. Неочищенный продукт очищали в ходе препаративной ВЭЖХ с получением целевого 2-метокси-2-метил-N-(5-фенилэтинилпиридин-2-ил)пропионамида Указанное в заголовке соединение получали в виде бесцветного масла таким же способом, как описано в примере 12, из 2-амино-5-иодпиридина и 2-метокси-2-метилпропионовой кислоты. Стадия 2: 2-метокси-2-метил-N-(5-триметилсиланилэтинилпиридин-2-ил)пропионамид Указанное в заголовке соединение получали в виде желтого масла, MS: m/e = 290,8 (М+Н+), таким же способом, как описано в примере 1, стадия 1, из N-(5-иодпиридин-2-ил)-2-метокси-2 метилпропионамида (пример 13, стадия 1) и триметилсилилацетилена. Стадия 3: N-[5-(3-фторфенилэтинил)пиридин-2-ил]-2-метокси-2-метилпропионамид(90 мг, 0,31 ммоль) растворяли в THF (8 мл). Добавляли 1-фтор-3-иодбензол (83 мг, 0,37 ммоль, 1,2 экв.),Et3N (130 мкл, 0,93 ммоль, 3 экв.), бис-(трифенилфосфин)палладий(II)дихлорид (11 мг, 15 мкмоль, 0,05 экв.) и иодид меди(I) (1,8 мг, 10 мкмоль, 0,03 экв.) в атмосфере азота и эту смесь нагревали до 70 С. При 70 С вносили по каплям 1 М раствор TBAF в THF (370 мкл, 0,37 ммоль, 1,2 экв.). Реакционную смесь перемешивали в течение 1 ч при 70 С, фильтровали через целит и полученный фильтрат выпаривали досуха. Неочищенный продукт очищали флэш-хроматографией на колонке с силикагелем, элюировали смесью гептан:этилацетат 100:090:10. Целевой N-[5-(3-фторфенилэтинил)пиридин-2-ил]-2-метокси-2 метилпропионамид (64 мг, выход 66%) получали в виде желтого масла, MS: m/e = 313,0 (М+Н+). Пример 14. N-[5-(2,5-Дифторфенилэтинил)пиридин-2-ил]-2-метокси-2-метилпропионамид Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 331,0 Указанное в заголовке соединение получали в виде желтого масла: m/е = 359,4 (М+Н+), таким же способом, как описано в примере 12, из 2-амино-5-иодпиридина и 3,3,3-трифтор-2,2-диметилпропановой кислоты. Стадия 2: N-[5-(3-хлорфенилэтинил)пиридин-2-ил]-3,3,3-трифтор-2,2-диметилпропионамид Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e = 365,5/367,5 Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 214,2/216,2 (М+Н+), таким же способом, как описано в примере 1, стадия 2, из 3-амино-6-хлорпиридазина Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 314,5/316,5 (М+Н+), таким же способом, как описано в примере 1, стадия 1, из N-(6-хлор-пиридазин-3 ил)-2,2-диметилпропионамида (пример 16, стадия 1) и 3-хлорфенилацетилена. Биологический анализ и полученные данные Анализ внутриклеточной мобилизации Са 2+. Получали моноклональную клеточную линию HEK-293, стабильно трансфецированную с помощью кДНК, кодирующей человеческий рецептор mGlu5a; для экспериментов с позитивными аллостерическими модуляторами mGlu5 (PAMs) выбрали клеточную линию с низким уровнем экспрессии рецептора и низкой конститутивной активностью рецептора, чтобы осуществить дифференциацию агонистической активности в зависимости от активности РАМ. Клетки выращивали согласно стандартным методикам(Freshney, 2000) в среде Игла, модифицированной Дульбекко, с высоким содержанием глюкозы, с добавлением 1 мМ глютамина, 10% (об/об) инактивированной нагреванием сыворотки крови плодов коровы,пенициллина/стрептомицина, 50 мкг/мл гигромицина и 15 мкг/мл бластицидина (все реагенты для культивирования клеток и антибиотики производства Invitrogen, Базель, Швейцария). Примерно за 24 ч до эксперимента 5104 клеток/лунку высевали на черных 96-луночных планшетах с прозрачным дном, покрытых поли-D-лизином. Клетки нагружали с помощью 2,5 мкм Fluo-4AM в нагружающем буфере (1HBSS, 20 мМ HEPES) в течение 1 ч при 37 С и промывали пять раз нагружающим буфером. Клетки перемещали в систему Functional Drug Screening System 7000 (Hamamatsu, Париж,Франция), добавляли 11 полулогарифмических серийных разведений тестируемых соединений при 37 С и инкубировали клетки в течение 10-30 мин, осуществляя запись флюоресценции в режиме он-лайн. По окончании этой стадии преинкубации к клеткам добавляли агонист L-глутамата в концентрации, соответствующей ЕС 20 (как правило, около 80 мкм), осуществляя запись флюоресценции в режиме он-лайн. Чтобы учесть ежедневные вариации в реактивности клеток, величину ЕС 20 глутамата определяли непосредственно перед каждым экспериментом путем записи полной кривой зависимости "доза-отклик" для глутамата. Отклик определяли как разницу между пиковой и базальной флюоресценцией (т.е. флюоресценцией без добавления L-глутамата), нормализованную к максимальному стимулирующему эффекту, полученному при насыщающих концентрациях L-глутамата. Графики строили в процентах от максимальной стимуляции с помощью программы XLfit, предназначенной для построения кривых, которая итеративно отображает данные по алгоритму Левенберга-Марквардта. Использовали уравнение для односайтового конкурентного анализа: у = А+B-A)/(1+x/C)D, где у представляет собой процентную долю от максимального стимулирующего эффекта, А - минимальное значение у, В - максимальное значение у, С ЕС 50, х представляет собой log 10 от концентрации конкурирующего вещества, и D - наклон кривой (коэффициент Хилла). По этим кривым были рассчитаны: величина ЕС 50 (концентрация, при которой достигается половина от максимальной стимуляции) и коэффициент Хилла, а также максимальный отклик в процентах от максимального стимулирующего эффекта, полученного при насыщающих концентрациях(т.е. перед внесением L-глутамата в концентрации ЕС 20), являлись индикатором агонистической активности; отсутствие таких сигналов свидетельствовало об отсутствии агонистической активности. Подавление сигнала, наблюдаемое после добавления ЕС 20-концентрации L-глутамата, указывало на ингибиторную активность тестируемого соединения. В списке представленных выше примеров приведены соответствующие результаты для соединений,причем все они имеют значение ЕС 50100 нМ. Соединения по изобретению и их фармацевтически приемлемые соли можно применять в качестве лекарственных средств, например, в форме лекарственных препаратов. Фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Кроме того, введение можно проводить ректально, например, в форме суппозиториев, или парентерально, например, в форме растворов для инъекций. Соединения по изобретению и их фармацевтически приемлемые соли можно процессировать с фармацевтически инертными, неорганическими или органическими наполнителями для производства фармацевтических препаратов. В качестве подобных наполнителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.п. Подходящими наполнителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.; при этом в зависимости от природы действующего вещества, в случае мягких желатиновых капсул наполнитель, как правило, не требуется. Подходящими наполнителями для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар,глюкоза и т.п. В случае водных растворов для инъекции, приготовленных из растворимых воде солей соединений по изобретению, можно использовать адъюванты, такие как спирты, полиолы, глицерин,растительные масла и т.п., но, как правило, в них нет необходимости. Подходящими наполнителями для суппозиториев являются, например, природные или отвержденные жиры, воски, жиры, полужидкие или жидкие полиолы и т.п. Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать дополнительные терапевтически значимые вещества. Как упоминалось ранее, лекарственные средства, содержащие соединение по изобретению или его фармацевтически приемлемую соль и терапевтически инертный наполнитель, также являются объектом настоящего изобретения, равно как и способ изготовления таких лекарственных средств, который включает приведение одного или более соединений по изобретению или их фармацевтически приемлемых солей и, по желанию, одного или более иных терапевтически значимых веществ, в галенову лекарственную форму совместно с одним или более терапевтически инертным носителем. Кроме того, как упоминалось ранее, применение соединений формул IA, IB и ID для изготовления лекарственных средств, эффективных для профилактики и/или лечения перечисленных выше заболеваний, также является объектом настоящего изобретения. Дозировку можно варьировать в широких пределах, и, разумеется, ее подбирают с учетом индивидуальных требований в каждом конкретном случае. В целом, эффективная доза для орального или парентерального введения находится в диапазоне 0,01-20 мг/кг/в сутки, при этом доза 0,1-10 мг/ кг/ в сутки предпочтительна для всех описанных выше показаний к применению. Соответственно, суточная доза для взрослого человека весом 70 кг находится в диапазоне 0,7-1400 мг в сутки, предпочтительно между 7 и 700 мг в сутки. Фармацевтические композиции, включающие соединения по настоящему изобретению ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Этинильное производное формулы IA где R1 представляет собой фенил, который возможно замещен галогеном;R представляет собой водород или C1-4-алкил;R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу; или его фармацевтически приемлемая соль присоединения кислоты, оптический изомер или их рацемическая смесь,за исключением соединения N-(5-1 Н-пирроло[2,3-В]пиридин-2-ил)этинил)пиридин-2-ил)ацетамида. 2. Этинильное производное формулы IA по п.1, представляющее собой 2,2-диметил-N-(5-фенилэтинилпиридин-2-ил)пропионамид;N-[5-(3-хлорфенилэтинил)пиридин-2-ил]-3,3,3-трифтор-2,2-диметилпропионамид. 3. Этинильное производное формулы IB где R1 представляет собой фенил, который возможно замещен галогеном;R представляет собой водород или C1-4-алкил;R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу; или его фармацевтически приемлемая соль присоединения кислоты, оптический изомер или их рацемическая смесь. 4. Этинильное производное формулы IB по п.3, представляющее собой 2,2-диметил-N-(5 фенилэтинилпиримидин-2-ил)пропионамид или 2,2,N-триметил-N-(5-фенилэтинилпиримидин-2 ил)пропионамид. 5. Этинильное производное формулы ID где R1 представляет собой фенил, который возможно замещен галогеном;R представляет собой водород или C1-4-алкил;R3/R3' независимо друг от друга представляют собой водород, C1-4-алкил или C1-4-алкоксигруппу; или его фармацевтически приемлемая соль присоединения кислоты, оптический изомер или их рацемическая смесь. 6. Этинильное производное формулы ID по п.5, представляющее собой 2,2-диметил-N-(6-фенилэтинилпиридазин-3-ил)пропионамид илиN-[6-(3-хлорфенилэтинил)пиридазин-3-ил]-2,2-диметилпропионамид. 7. Применение соединения по любому из пп.1-6 в качестве аллостерического модулятора метаботропного глутаматного рецептора 5 подтипа (mGluR5). 8. Фармацевтическая композиция для аллостерической модуляции метаботропного глутаматного рецептора 5 подтипа, включающая по меньшей мере одно из соединений по любому из пп.1-6 или его фармацевтически приемлемую соль. 9. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения или профилактики заболеваний, связанных с аллостерическими модуляторами метаботропного глутаматного рецептора 5 подтипа. 10. Применение соединения по любому из пп.1-6 для лечения или профилактики шизофрении, когнитивных расстройств, синдрома ломкой Х-хромосомы или аутизма.
МПК / Метки
МПК: A61K 31/44, A61K 31/50, C07D 237/22, A61K 31/505, C07D 239/42
Метки: глутаматного, этинильные, производные, метаботропного, качестве, модуляторов, рецептора
Код ссылки
<a href="https://eas.patents.su/16-24993-etinilnye-proizvodnye-v-kachestve-modulyatorov-metabotropnogo-glutamatnogo-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Этинильные производные в качестве модуляторов метаботропного глутаматного рецептора</a>
Предыдущий патент: Загущающие виниловые сополимеры
Следующий патент: Экстракция поликарбоновой кислоты
Случайный патент: Композиция для улучшения эффективности гербицидов












