4-оксо-1,4-дигидро-3-хинолинкарбоксамиды как антивирусные агенты
Номер патента: 4043
Опубликовано: 25.12.2003
Авторы: Тернер Стивен Рональд, Вэйлланкорт Валери А., Стробач Джозеф Волтер, Таисривонгс Сувит, Скотт Аллен, Шнуте Марк Э.
Формула / Реферат
1. Соединение формулы I
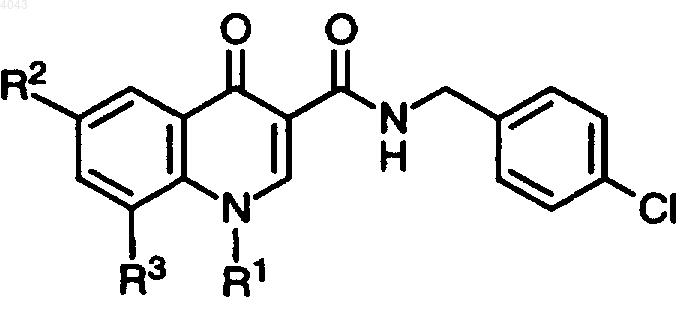
где R1 представляет собой C1-7алкил, необязательно замещенный гидрокси или NR4R5;
R2 представляет собой C1-7алкил, замещенный гидрокси или NR4R5;
R3 представляет собой H, F или C1-7алкокси;
R4 и R5 вместе с N представляют собой 5- или 6-членный гетероциклический фрагмент, имеющий 1-3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, в котором сера может быть замещена одним (1) или двумя (2) атомами кислорода; и его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой C1-4алкил, необязательно замещенный гидрокси; R2 представляет собой C1-5алкил, замещенный гидрокси или морфолином; и R3 представляет собой H или F.
3. Соединение по п.1, которое представляет собой
(a) N-(4-хлорбензил)-6-(3-гидрокси-1,1-диметилпропил)-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоксамид;
(b) N-(4-хлорбензил)-1-метил-6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид;
(c) N-(4-хлорбензил)-1-(2-гидроксиэтил)-6-(3-гидроксипропил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид;
(d) N-(4-хлорбензил)-6-(3-гидроксипропил)-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоксамид;
(e) 1-(трет-бутил)-N-(4-хлорбензил)-6-(3-гидроксипропил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид;
(f) N-(4-хлорбензил)-6-[(1,1-диоксо-1',4-тиазинан-4-ил)метил]-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоксамид;
(g) N-(4-хлорбензил)-1-метил-4-оксо-6-[(1-оксо-1',4-тиазинан-4-ил)метил]-1,4-дигидро-3-хинолинкарбоксамид;
или их фармацевтически приемлемую соль.
4. Соединение по п.1, которое представляет собой любое из соединений (a), (b), (c), (d), (f) и (g), перечисленных в п.3, или их фармацевтически приемлемую соль.
5. Соединение по п.1, которое представляет собой любое из соединений (b), (d), (f) и (g), перечисленных в п.3, или их фармацевтически приемлемую соль.
6. Соединение по п.1, которое представляет собой N-(4-хлорбензил)-1-метил-6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид или его фармацевтически приемлемую соль.
7. Соединение по п.1 или 2, где R3 не является F.
8. Соединение по п.1, которое представляет собой N-(4-хлорбензил)-8-фтор-1-метил-6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид или его фармацевтически приемлемую соль.
9. Фармацевтическая композиция, которая содержит соединение по любому из предшествующих пунктов и фармацевтически приемлемый носитель.
10. Применение соединения по любому из пп.1-8 для производства лекарственного средства для лечения инфекций, вызываемых вирусом герпеса.
11. Применение по п.10, где вирус герпеса является вирусом простого герпеса типа 1, вирусом простого герпеса типа 2, вирусом ветряной оспы, цитомегаловирусом, вирусом Эпштейна-Барр, вирусом герпеса человека типа 6, вирусом герпеса человека типа 7 или вирусом герпеса человека типа 8.
12. Применение по п.10, где вирус герпеса является цитомегаловирусом человека.
13. Соединение, применяемое в качестве синтетического промежуточного соединения при получении соединения по п.6, которое имеет структуру диэтил 2-{[метил-4-(4-морфолинилметил)анилино]метилен}малоната.
14. Соединение, применяемое в качестве синтетического промежуточного соединения при получении соединения по п.6, которое имеет структуру этил 1-метил-6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксилата.
15. Соединение, применяемое в качестве синтетического промежуточного соединения при получении соединения по п.6, которое имеет структуру 1-метил-6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоновой кислоты.
16. Способ получения соединения по п.6, включающий в себя стадии
a) нагревания смеси диэтилэтоксиметиленмалоната и N-(4-метиламинобензил)морфолина с получением соединения по п.13;
b) добавления раствора продукта со стадии (a) в толуоле к смеси пятиокиси фосфора и метансульфокислоты с получением соединения по п.14;
c) превращение продукта со стадии (b) в соединение по п.15;
d) перемешивание продукта со стадии (c) с карбонилдиимидазолом и диметилформамидом; и
e) взаимодействие 4-хлорбензиламина со смесью со стадии (d).
17. Способ лечения инфекций, вызванных вирусами герпеса, который включает в себя введение больному, в случае необходимости, эффективного количества соединения формулы I, которая представлена в п.1.
18. Способ по п.17, где указанными вирусами герпеса являются вирус простого герпеса типа 1, вирус простого герпеса типа 2, вирус ветряной оспы, цитомегаловирус, вирус Эпштейна-Барр, вирусы герпеса человека типа 6, вирусы герпеса человека типа 7 или вирусы герпеса человека типа 8.
19. Способ по п.17, где указанными вирусами герпеса являются вирус простого герпеса типа 1, вирус простого герпеса типа 2, вирус ветряной оспы, цитомегаловирус, вирус Эпштейна-Барр, вирусы герпеса человека типа 7 или вирусы герпеса человека типа 8.
20. Способ по п.17, где указанным вирусом является цитомегаловирус человека.
21. Способ по п.17, где эффективное количество соединения по п.1 вводят перорально, парентерально или местно.
22. Способ по п.17, где эффективное количество соединения по п.1 составляет приблизительно от 0,1 до 300 мг/кг веса тела.
23. Способ по п.17, где эффективное количество соединения по п.1 составляет приблизительно от 1 до 30 мг/кг веса тела.
Текст
1 Область изобретения Настоящее изобретение относится к производным 4-оксо-1,4-дигидро-3-хинолинкарбоксамида, точнее сказать к (4-хлорбензил)-4 оксо-1,4-дигидро-3-хинолинкарбоксамиду формулы I. Указанные соединения применяют в качестве антивирусных агентов, в частности в качестве агентов против вирусов группы герпеса. Предпосылки к созданию изобретения Вирусы герпеса представляют собой большое семейство вирусов, содержащих двухцепочечную молекулу ДНК. Они являются причиной большинства обычных вирусных заболеваний у человека. Было показано, что восемь вирусов герпеса, вирусы типов 1 и 2 (HSV-1 и(VZV), цитомегаловирус человека (HCMV), вирус Эпштейна-Барр (EBV) и вирусы герпеса человека 6, 7 и 8 (HHV-6, HHV-7 и HHV-8) инфицируют человека.HSV-1 и HSV-2 вызывают герпетические поражения на губах и половых органах соответственно. Они также иногда вызывают инфекции глаза и головного мозга. HCMV вызывает поражения у инфицированных во время родов младенцев и ряд заболеваний у иммунологически"скомпрометированных" больных, таких заболеваний, как ретинит, пневмония и заболевание желудочно-кишечного тракта. VZV является агентом, вызывающим ветрянку и опоясывающий лишай. EBV вызывает инфекционный мононуклеоз. Он также может вызывать лимфомы у иммунологически "скомпрометированных" больных и связан с лимфомой Бркита, носоглоточной карциномой и болезнью Ходжкина.HHV-6 является агентом, вызывающим розеолу и может быть связан с рассеянным склерозом и синдромом хронической усталости. Связь вируса HHV-7 с заболеванием не ясна, но он может быть вовлечен в некоторые случаи розеолы.HHV-8 связан с саркомой Капоши, с полостными лимфомами и множественной миеломой. Соединения настоящего изобретения отличаются от всех других гидроксихинолиновых фармацевтических агентов тем, что уникальное положение заместителя в виде хлора у Nфенилметила формулы I является решающим для проявления антивирусных активностей. Указанные соединения применяют в лечении или профилактике вышеперечисленных инфекций, вызываемых вирусом герпеса, в частности цитомегаловирусной инфекции человека. Уровень техники В патенте США 5891878 описано использование соединений структуры 1 для лечения болезненного состояния, которое можно модулировать путем ингибирования продукции фосфодиэстеразы IV или фактора некроза опухоли где R1 может означать алкил(1-6), алкил(1-6) циклоалкил, алкил(1-6)гетероцикл, алкил(1-6) арил или алкил(1-6)гетероарил, каждый необязательно замещен галогеном, алкокси, гидрокси,CN, СO2 Н или соответствующим эфиром или амидом, алкилом(1-6), NR9R10, SO2NR2;R3 может означать фенил, пиридил, фурил,пиразинил, пиридазинил, пиримидинил или циклоалкил(3-10), который может быть необязательно замещен галогеном, алкокси(1-6), ОН,CN, СO2 Н и соответствующими эфирами или амидами, алкилом(1-6), галогеналкилом(1-6),NR9R10, SO2NR2, арилом, гетероарилом, циклоалкилом, гетероцикло или может быть конденсирован со вторым карбоциклическим или гетероциклическим кольцом;R4-7 может означать водород, галоген, алкокси(1-6), гидрокси, CN, СO2 Н, СO2 алкил(1-6),СОNНалкил(1-6), СОNдиалкил(1-6), NR9R10 или алкил(1-6), в котором алкил может быть замещен галогеном, алкокси(1-6), гидрокси, CN,СO2 алкилом(1-6), СОNНалкилом(1-6), СОNдиалкилом(1-6), NR9R10, SO2NR2; любые два смежных заместителя R4-7 могут образовывать 5-7-членное кольцо, содержащее 0, 1 или 2 гетероатома;n может равняться от 0 до 3. В патенте США 5175151 описаны соединения структуры 2 как антивирусные и антигипертензивные агенты где R1 может означать алкил, алкенилгалоген,(CH2)nCO2R, или (CH2)nNR6R7, где R6 и R7 представляют собой водород или алкил;R5 может означать водород, алкил, арил,аралкил, гетероарил, гетероалкил или алкокси. Патент фактически представляет более ограни 3 ченную область, которая не включает 3 карбоксамиды. В международной заявке РСТ WO 97/14682 описаны соединения, применяемые в качестве антагонистов гонадотропинвысвобождающего гормона согласно общей структуре 3 где R1 представляет собой заместитель согласно формуле XNR5R6, где X означает алкилен или алкильную группу, необязательно замещенную галогеном, R5 означает аралкильный заместитель, и R6 означает алкильный заместитель;R3 представляет собой галогенаралкильный заместитель; иR4 представляет собой карбонильную группу, необязательно эстерифицированную или амидированную, для которой NHCH2Ph указан в описании. В патенте США 5328887 описаны соединения с целью их применения в процессе теплопередачи, который включает в себя субструктуру 4, где R может означать необязательно замещенную углеводородную группу; R' может представлять собой необязательно замещенный карбоксамид; и хинолиновое кольцо может быть необязательно замещено. В международной заявке РСТ WO 98/23608 описаны соединения структуры 5R может представлять собой азот, содержащий гетероарильный заместитель или гуанидиновый заместитель;R' может представлять собой водород, алкил(1-4) или фенилалкил(1-4);W представляет собой C1-3 алкил, где алкильная группа замещена либо одним, либо двумя неводородными заместителями, которые могут включать в себя фенил, замещенный галогеном; иY может означать различные производные карбоксилата, производные сульфоната, производные фосфата и гетероциклы, однако не может представлять собой водород. В международной заявке РСТ WO 99/32450 описаны соединения структуры 6 которые применяют в качестве антивирусных агентов. Краткое описание сущности изобретения Настоящее изобретение относится к соединению формулы IR2 представляет собой С 1-7 алкил, замещенный гидрокси или NR4R5;R4 и R5 вместе с N означают 5- или 6 членный гетероциклический фрагмент, имеющий 1-3 гетероатома, выбранных из группы,состоящей из азота, кислорода и серы, в котором сера может быть замещена одним (1) или двумя (2) атомами кислорода; и его фармацевтически приемлемым солям. В другом аспекте настоящее изобретение также относится к- фармацевтической композиции, которая содержит фармацевтически приемлемый носитель и эффективное количество соединения формулы I,- способу лечения и профилактики инфекций, вызванных вирусом герпеса у млекопитающих, включая человека, и- применению соединения формулы I для приготовления лекарственного средства с целью лечения и профилактики инфекций, вызванных вирусом герпеса, у млекопитающих, включая человека. Подробное описание изобретения В описании настоящего изобретения содержание атома углерода различных углеводородсодержащих фрагментов указывают с помощью кода, означающего минимальное и максимальное число атомов углерода во фрагменте,т.е. код Ci-j означает фрагмент, содержащий от целого числа "i" до целого числа "j" углеродных атомов включительно. Таким образом, например, (С 1-3)алкил относится к алкилу, содержащему от одного до трех атомов углерода включительно, или метилу, этилу, пропилу и изопропилу с прямыми или разветвленными цепями. 5 Соединения настоящего изобретения называют согласно номенклатуре IUPAC илиCAS. Термин "C1-7", "C1-5" и "С 1-4"алкил относится к алкильной группе, имеющей от одного до семи, от одного до пяти и от одного до четырех атомов углерода соответственно, такой, например, как метил, этил, пропил, бутил, пентил,гексил, гептил и их изомеры. Гетероциклический 5- или 6-членный фрагмент включает в себя тиадиазолил, тиазолил, 1,1-диоксотиазолил, 1-оксотиазолил, бензотиазолил, пиридинил, имидазолил, индолил,пирролил, морфолинил, тиофенил и 2-оксооксазолил. Соединения настоящего изобретения могут быть представлены в виде фармацевтически приемлемых солей."Фармацевтически приемлемые соли" относятся к таким солям, которые обладают биологическими активностями и свойствами, присущими исходному соединению, и которые не являются в биологическом отношении и в других отношениях нежелательными. Млекопитающее относится к человеку и животным. Следующие части A-D описывают получение соединений формулы I настоящего изобретения. Все исходные материалы получают способами, описанными в этих частях, способами,хорошо известными рядовым специалистам в области органической химии или могут быть приобретены коммерческим путем. Все конечные соединения настоящего изобретения получают способами, описанными в этих частях, или способами, аналогичными тем, которые хорошо известны рядовым специалистам в области органической химии. Все различные варианты,используемые в указанных частях, описаны ниже в тексте или в формуле изобретения. В части А структуру А-1, этиловый эфир 4-гидрокси-6-йод-3-хинолинкарбоновой кислоты, получают путем нагревания 4-йоданилина с диэтиловым эфиром этоксиметиленмалоновой кислоты вначале приблизительно при 150 С,затем кипячения с обратным холодильником с дифениловым эфиром. Аминолиз соединения А 1 с помощью 4-хлорбензиламина приблизительно при 160 С приводит к амиду А-2. Сочетание А-2 с пропаргиловым спиртом в присутствии палладия и меди приводит к А-3. Алкилирование азота пиридона проводят с помощью карбоната калия и необязательно замещенного алкилгалогенида, получая при этом соединение структуры А-4. Гидрирование алкина газообразным водородом в присутствии платинового катализатора приводит к соединению структуры А-5. В части В структуру В-1,2-фтор-5 йодбензойную кислоту получают карбонизацией аниона 4-фторйодбензола. Взаимодействие В-1 с карбонилдиимидазолом с последующей обработкой полученного ацилимидазолида этиловым эфиром триметилсилилмалоновой кислоты и последующее декарбоксилирование приводит к -кетоэфиру В-2. Кетоэфир превращают в хинолиноны В-3 последовательной обработкой триэтилортоформиатом,амином и третбутоксидом калия. Аминолиз эфира проводят с помощью 4-хлорбензиламина, получая при этом соединение структуры В-4. Сочетание с пропаргиловым спиртом осуществляют в присутствии палладиевого и медного катализатора, что приводит к соединению структуры В-5. Гидрирование тройной связи с использованием газообразного водорода и платинового катализатора приводит к гидроксипропильным производным В-6. В части С карбоновую кислоту С-1, 3 метил-3-(4-нитрофенил)бутановую кислоту,полученную карбонилированием соответствующего реактива Гриньяра, восстанавливают до соответствующего спирта с помощью борана. Полученный спирт С-2 защищают с образованием бензилового эфира соединения и соответствующую функциональную нитрогруппу восстанавливают до анилина С-3. Нагревание С-3 с диэтиловым эфиром этоксиметиленмалоновой кислоты с последующим термолизом с дифениловым эфиром при кипячении с обратным холодильником приводит к 4-гидроксихинолину С-4. Аминолиз соединения С-4 с помощью 4 хлорбензиламина приблизительно при 190 С приводит к амиду С-5, который затем алкилируют у азота пиридона с помощью алкилгалогенида и карбоната калия с получением соедине 7 ния С-6. Снятие защиты - бензилового эфира - в условиях гидрирования приводит к желаемому гидроксиалкил-4-хинолонкарбоксамиду формулы I настоящего изобретения. В части D катализируемое палладием карбонилирование 6-йод-4-гидроксихинолин-3 карбоксамида А-2 (см. часть А) приводит к соответствующему эфиру D-1, который затем восстанавливают с помощью LAH (алюмогидрида лития) с получением спирта D-2. Алкилирование азота пиридона с помощью алкилгалогенида и карбоната калия приводит к соединению структуры D-3. Обработкой D-3 метансульфонилхлоридом с последующим замещением соответствующим первичным или вторичным амином получают соединения структуры D-4,где R4 и R5 обозначены так, как описано выше. В части Е соответствующее соединение формулы D-4 (см. часть D), где NR2 означает тиоморфолин, взаимодействует с метахлорнадбензойной кислотой с получением сульфоксида (Е-1) и сульфона (Е-2). Часть F иллюстрирует отдельный способ получения соединения формулы I настоящего изобретения. В части F N-метиланилин F-1 получают согласно опубликованному способу(Miocque, М.; Vierfond, J.M. Bull.Soc.Chim.Fr.,1970, 1901-1907). Затем соединение F-1 подвергают взаимодействию с этиловым эфиром этоксиметилмалоновой кислоты с получением соединения F-2, которое нагревают в смеси с реагентом Этона, получая при этом хинолон F-3. Омыление F-3 в щелочных условиях приводит к 8 карбоновой кислоте F-4. Последующее сочетание F-4 с 4-хлорбензиламином, вызванное опосредованно КДИ (CDI), приводит к F-5. Указанный способ в дальнейшем подробно описывают в примере 3b настоящего изобретения. Специалистам в данной области очевидно,что описанные процессы синтеза приводятся только для примера и что специалистам в области органической химии известны альтернативные способы синтеза. Примерами настоящего изобретения являются:(h) N-(4-хлорбензил)-8-фтор-1-метил-6-(4 морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид; или их фармацевтически приемлемые соли. Предпочтительными соединениями настоящего изобретения являются:(g) N-(4-хлорбензил)-8-фтор-1-метил-6-(4 морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид; или их фармацевтически приемлемые соли. Наиболее предпочтительными соединениями настоящего изобретения являются:(e) N-(4-хлорбензил)-8-фтор-1-метил-6-(4 морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид; или их фармацевтически приемлемые соли. Самым предпочтительным соединением настоящего изобретения являетсяN-(4 хлорбензил)-1-метил-6-(4-морфолинилметил)-4 оксо-1,4-дигидро-3-хинолинкарбоксамид или его фармацевтически приемлемая соль. Кроме того, особенное значение представляют собой следующие соединения как синтетические промежуточные соединения при получении предпочтительного соединения формулы(c) 1-метил-6-(4-морфолинилметил)-4 оксо-1,4-дигидро-3-хинолинкарбоновая кислота. Соединения настоящего изобретения и их фармацевтически приемлемые соли применяют в качестве антивирусных агентов. Таким образом, указанные соединения используют для борьбы с вирусными инфекциями у животных,включая человека. В частности, данные соединения проявляют антивирусную активность против вируса герпеса, цитомегаловируса(CMV). Указанные соединения также проявляют активность против других вирусов герпеса,таких как вирус ветряной оспы, вирус Эпштейна-Барр, вирус простого герпеса и вирус герпеса человека типа 8 (HHV-8). Кроме того, в то время как многие соединения настоящего изобретения обладают активностью против CMV-полимеразы, указанные соединения могут быть активными против цитомегаловируса согласно данному или другому механизму действия. Таким образом, описанная далее способность этих соединений проявлять активность против CMV-полимеразы приведена 10 не в целях ограничения настоящего изобретения особым механизмом действия. Активность соединений настоящего изобретения определяют с помощью одного или более методов анализа, описанных далее. Все эти методы анализа свидетельствуют об активности соединений и, таким образом, о возможности использования их в качестве антивирусных агентов. Анализ HCMV-полимеразы проводят, используя сцинтилляционный экспресс-анализBSA и 90 нМ 3H-dTTP. Анализ проводят в присутствии или в отсутствие CHAPS (3-[(3 холамидопропил)диметиламмонио]-1-пропансульфоната) при конечной концентрации 2 мМ.HCMV-полимеразу разбавляют буфером для разбавления фермента, содержащим 50% глицерин, 250 мМ NaCl, 10 мМ HEPES (рН 7,5), 100 мкг/мл BSA и 0,01% азида натрия. HCMVполимеразу, которая экспрессируется в SF-9 клетках, инфицированных рекомбинантным бациловирусом, и которую очищают согласно описанным в литературе способам, добавляют в концентрации 10% (или 10 мкл) конечного реакционного объема, т.е. 100 мкл. Соединения разбавляют в 50% ДМСО и по 10 мкл добавляют в каждую лунку. Контрольные лунки содержат эквивалентную концентрацию ДМСО. Если не указано особо, реакцию инициируют путем добавления 6 нМ биотинилированного поли(dA)-олиго(dT) темплата/праймера к реакционным смесям, содержащим фермент, субстрат и испытуемые соединения. Планшеты инкубируют при 25 или 37 С на водяной бане и реакцию останавливают путем добавления 40 мкл 0,5 М ЭДТА (рН 8) в каждую лунку. Реакции заканчивают в пределах временного цикла, в течение которого включение субстрата является линейным и варьирует в зависимости от фермента и данных условий, т.е. в течение 30 мин для HCMV-полимеразы. 10 мкл гранул стрептавидина-SPA (20 мг/мл в PBS/10% глицерине) добавляют после окончания реакции. Планшеты инкубируют в течение 10 мин при 37 С, затем температуру доводят до комнатной и просчитывают на Packard Topcount. Затем выстраивают линейную зависимость и рассчитывают IC50 с помощью компьютерной программы. Модифицированный вариант вышеуказанного анализа HCMV-полимеразы выполняют так, как описано выше, но со следующими изменениями: соединения разбавляют в 100% ДМСО до конечного разбавления буфером для анализа. В предыдущем анализе соединения разбавляют в 50% ДМСО. К буферу, используемому для анализа полимеразы, добавляют 4,5 мМ дитиотреитола (ДТТ). Также используют различные партии CMV-полимеразы, которые,по-видимому, проявляют большую активность,что приводит к более быстрой полимеразной реакции. Результаты тестирования соединений настоящего изобретения в данном анализе показаны в табл. 1 ниже. Другие варианты анализа вирусной полимеразы выполняют с помощью процедур, подобных тем, которые описаны выше. Эти соединения согласно изобретению вводят в состав фармацевтической композиции,содержащей соединение в комбинации с подходящим наполнителем, композиции, применяемой для борьбы с вирусными инфекциями. Фармацевтические композиции, содержащие соединение, пригодное для использования его в качестве антивирусного агента, получают определенными способами, и они содержат наполнители, которые хорошо известны в данной области. Обычным перечнем таких способов и ингредиентов является Remington's Pharmaceutical Sciences by E.W.Martin (Mark Publ.Co., 15thEd., 1975), который включен в данный текст в виде ссылки. Соединения настоящего изобретения вводят парентерально (например, путем внутривенной, внутрибрюшинной или внутримышечной инъекции), местно, перорально или ректально, в зависимости от того, используют ли препарат для лечения внутренних или внешних инфекций. Для лечения внутренних инфекций композиции вводят перорально или парентерально в дозах, рассчитанных на свободное основание,приблизительно от 0,1 до 300 мг/кг, предпочтительно от 1,0 до 30 мг/кг веса тела млекопитающего, и используют для человека в дозированной лекарственной форме, вводимой от одного до четырех раз в день в количестве от 1 до 1000 мг на единичную дозу. Для парентерального введения или для введения в виде капель, например для лечения глазных инфекций, соединения находятся в водном растворе в концентрации приблизительно от 0,1 до 10%, более предпочтительно приблизительно от 0,1 до 7%. Раствор может содержать другие ингредиенты, такие как эмульгаторы, антиоксиданты или буферы. Точный режим введения соединений и композиций, описанных в данном тексте, будет зависеть от потребностей индивидуального субъекта, который подвергается лечению, от типа лечения и, конечно, от показаний лечащего врача. Таблица 1IС 50 (мкмоли) для полимеразы Пример Обозначение "-" относится к тем опытам, в которых определения не проводили. Соединения и способы их получения согласно изобретению будут лучше оценены в сочетании со следующими примерами, которые рассматриваются как иллюстративные и не ограничивающие область изобретения. Пример 1. N-(4-хлорбензил)-6-(3-гидрокси-1,1-диметилпропил)-1-метил-4-оксо-1,4 дигидро-3-хинолинкарбоксамид. К суспензии 3-метил-3-(4-нитрофенил) бутановой кислоты (16,2 г) (J.Amer.Chem.Soc.,1981, 103, 7768-7773. и J.Amer. Chem.Soc., 1948,370-371) в ТГФ (THF) (70 мл) добавляют 103 мл раствора 1,0 М борана/ТГФ. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь выливают в воду (500 мл). Водный слой насыщают карбонатом калия и экстрагируют дихлорметаном(3500 мл). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют в вакууме с получением 16,16 г спирта в виде твердого вещества желтого цвета. Спирт (9,41 г) растворяют в ТГФ (100 мл). Гидрид натрия(60% масляная дисперсия; 5,40 г) добавляют с последующим добавлением бромистого бензила(16,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь распределяют между водой(400 мл) и дихлорметаном (400 мл). Водный слой экстрагируют дихлорметаном (2400 мл). Объединенные органические слои промывают насыщенным раствором соли (400 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный продукт в виде масла желтого цвета очищают колоночной хроматографией, получая при этом 8,86 г (64%) соединения,защищенного бензильной группой, в виде масла желтого цвета. Этот материал (8,51 г) суспендируют в растворе смеси 1/1 концентрированная(19,22 г). Реакционную смесь нагревают до 70 С и перемешивают в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют воду (400 мл). рН водного слоя подводят до рН 12 с помощью гидроокиси аммония и затем экстрагируют дихлорметаном (2400 мл). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют в ва 13 кууме. Полученный продукт в виде масла коричневого цвета очищают колоночной хроматографией (дихлорметан; дихлорметан/метанол,98/2) с получением 1,306 г (17%) амина в виде масла желтого цвета. Этот материал (1,306 г) объединяют с диэтиловым эфиром этоксиметиленмалоновой кислоты (0,98 мл) и нагревают до 120 С в течение 2 ч. Реакционную смесь очищают колоночной хроматографией (дихлорметан; дихлорметан/метанол, 98/2) с получением 2,044 г (96%) промежуточного малоната в виде масла желтого цвета. Этот материал (2,007 г) растворяют в дифениловом эфире (10 мл) и нагревают с обратным холодильником с удалением этанола через ловушку Дина-Старка в течение 30 мин. Реакционную смесь охлаждают до комнатной температуры и добавляют гептан и этилацетат. Реакционную смесь оставляют при комнатной температуре в течение ночи. Образовавшийся осадок отфильтровывают и растирают с этилацетатом с получением 0,572 г (32%) эфира в виде твердого продукта не совсем белого цвета. Эфир (0,517 г) и 4-хлорбензиламин (1,60 мл) смешивают и нагревают до 190 С в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют гептан и этилацетат. Реакционную смесь оставляют в морозильной камере в течение 3 дней. Образовавшийся осадок отфильтровывают и перекристаллизовывают из смеси этилацетат/гептан с получением 0,479 г (75%) амида в виде твердого продукта не совсем белого цвета. К раствору амида (0,565 г) в ДМФА (DMF) (5 мл) добавляют карбонат калия (0,473 г) с последующим добавлением йодметана (0,21 мл). Реакционную смесь нагревают до 90 С и перемешивают в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией (дихлорметан; дихлорметан/метанол, 98/2). Фракции, гомогенные по данным ТСХ, объединяют и концентрируют в вакууме с получением твердого продукта бледно-желтого цвета, который перекристаллизовывают из смеси этилацетат/гептан, получая при этом 0,471 г (81%) N-метилпиридона в виде твердого продукта белого цвета. Раствор пиридона (0,350 г) в этаноле (50 мл) гидрируют над палладиевой чернью (35 мг) в течение 45 мин. Реакционную смесь фильтруют через целит и концентрируют в вакууме. Полученный твердый продукт желтого цвета перекристаллизовывают из этилацетата, получая при этом 0,225 г(78%) указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета. Физические характеристики: Т.пл. 135-138 С; 1 Н ЯМР (300 МГц, ДМСО-d6)10,47, 8,85,8,26, 7,92, 7,79, 7,42-7,35, 4,57, 4,27, 4,04, 3,20,1,90, 1,35; С ЯМР (75 МГц, ДМСО-d6)176,0,165,0, 149,0, 146,7, 139,1, 138,5, 131,9, 131,7,129,6, 128,9, 128,8, 127,8, 126,9, 122,3, 118,0,110,8, 58,2, 46,6, 41,9, 41,6, 37,0, 29,5; МС (ESI+) для m/z 413 (М+Н)+; ИК (дрейф) 2919, 1916, 1659, 1612, 1555,1533, 1494, 1431, 1360, 1352, 1085, 813, 806, 797,682 см-1. Состав элементов: (с поправкой на 0,17% воды): С, 66,39; Н, 6,16; N, 6,65; Сl, 8,39. Получение 1. N-[(4-Хлорфенил)метил]-4 гидрокси-6-йод-3-хинолинкарбоксамид. 4-йоданилин (8,60 г) и диэтиловый эфир этоксиметиленмалоновой кислоты (7,90 мл) нагревают при 130 С в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют 60 мл дифенилового эфира. Раствор нагревают при 250 С в течение 1,5 ч с удалением этанола с помощью ловушки Дина-Старка. Реакционную смесь охлаждают до комнатной температуры и образовавшийся твердый продукт фильтруют, промывают гексанами и сушат,получая при этом 11,20 г этилового эфира 4 гидрокси-6-йодхинолин-3-карбоновой кислоты. Смесь этого эфира (0,58 г) и 4-хлорбензиламина(4,0 мл) нагревают при 180 С в течение 1,5 ч. Реакционную смесь охлаждают и выливают в 50 мл диэтилового эфира. Образовавшееся твердое вещество фильтруют, растирают с этилацетатом и вновь фильтруют, получая при этом желаемый продукт (0,50 г). Физические характеристики: Т.пл. 297-299 С; 1 Н ЯМР (300 МГц, ДMCO-d6) 12,71, 10,27,8,76, 8,50, 8,02, 7,50, 7,38, 7,33, 4,52; ИК (mull) 3151, 3078, 3039, 1631, 1610,1572, 1563, 1545, 1527, 1512, 1491, 1433, 1351,1303, 799 см-1. МС (ES) 438,9 (М+Н), 460,9 (M+Na), 436,9N-(4-хлорбензил)-4-гидрокси-6 йод-3-хинолинкарбоксамида из способа получения 1 (30,0 г), Et3N (19,1 мл), МеОН (110,6 мл), Pd(OAc)2 (431 мг) и 1,3-бис(дифенилфосфин)пропана (791,9 мг) в 375 мл безводного ДМФА перемешивают при комнатной температуре до тех пор, пока все не растворится. СО(газ) медленно барботируют через раствор в течение 2 дней и температуру реакционной смеси поддерживают при 70 С. Реакционную смесь охлаждают до комнатной температуры. Продукт осаждают добавлением 160 мл 1N HCl к реакционной смеси. Твердый продукт оранжевого цвета выпадает в осадок и его собирают. Твердый продукт растирают с EtOAc, фильтруют и промывают СН 2 Сl2 с получением 23,8 г (93%) 15 указанного в заголовке соединения в виде твердого продукта не совсем белого цвета. Физические характеристики: Т.пл. 290-292 С; 1 Н ЯМР (300 МГц, ДMCO-d6)12,96,10,26, 8,83, 8,25, 7,80, 7,39, 4,57, 3,9; ИК (дрейф) 3222, 1724, 1646, 1619, 1574,1544, 1512, 1489, 1404, 1359, 1288, 1277, 1242,1210, 738 см-1; МС высокого разрешения (FAB) 371,0794. Состав элементов: С, 61,54; Н, 3,88; N,7,51. Получение 3. N-(4-Хлорбензил)-4-гидрокси-6-(гидроксимефил)-3-хинолинкарбоксамид. В высушенной на пламени 3-горлой круглодонной колбе емкостью 1 л растворяют метил 3-[(4-хлорбензил)амино]карбонил-4-гидрокси-6-хинолинкарбоксилат из способа получения 2 (3,0 г) в 700 мл перегнанного ТГФ. Суспензию нагревают до 67 С для растворения исходного материала. Реакционную смесь охлаждают до комнатной температуры и затем охлаждают на бане со льдом до 10 С. Алюмогидрид лития(552,2 мг) добавляют одной порцией. Реакционную смесь перемешивают при 25 С и с помощью масс-спектроскопии контролируют превращение в желаемый продукт. Реакцию гасят добавлением 2 мл воды, 2 мл 15% NaOH и 2 мл воды к реакционной смеси. Реакционную смесь фильтруют для удаления соли алюминия, которая выпала в осадок. Фильтрат конденсируют,получая при этом остаток желтовато-зеленого цвета. Остаток адсорбируют на силикагеле и хроматографируют, проводя элюирование смесью 2% МеОН в СН 2 Сl2 (1 л), 3% МеОН в СН 2 Сl2 (2 л), 4% МеОН в СН 2 Сl2 (2 л), 5% МеОН в СН 2 Сl2 (1 л), 6% МеОН в СН 2 Сl2 (1 л) и 7% МеОН в СН 2 Сl2 (2 л). Желаемый продукт элюируется смесью 4-7% МеОН в СН 2 Сl2. Фракции, гомогенные по данным ТСХ, конденсируют и получают 1,85 г (67%) указанного в заголовке соединения в виде желтых кристаллов. Физические характеристики: Т.пл. 288-289 С; 1 Н ЯМР (300 МГц, ДMCO-d6)12,71,10,48, 8,74, 8,21, 7,71, 7,66, 7,39, 5,38, 4,63, 4,56; МС (ESI) 343,3 (М+Н)+, 341,3 (М-Н)-. Пример 2. N-(4-Хлорбензил)-6-(гидроксиметил)-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоксамид.N-(4-хлорбензил)-4-гидрокси-6(гидроксиметил)-3-хинолинкарбоксамида из способа получения 3 (300 мг), K2 СО 3 (485,1 мг) и СН 3I (0,11 мл) в 4 мл безводного ДМФА нагревают при 90 С в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и 16 разбавляют водой, чтобы растворить любые образовавшиеся соли и осадить продукт. Неочищенный продукт адсорбируют на силикагеле и хроматографируют, применяя в качестве элюента смесь 3% МеОН в СН 2 Сl2. Фракции, гомогенные по данным ТСХ, объединяют и конденсируют, получая при этом 154,2 мг (49%) указанного в заголовке соединения в виде твердого вещества белого цвета. Физические характеристики: Т.пл. 168-170 С; 1 Н ЯМР (300 МГц, ДМСО-d6)10,45, 8,87,8,30, 7,80, 7,38, 5,42, 4,66, 4,57, 4,02; МС (ESI) 357,2 (М+Н)+, 355,3 (М-Н)-. Состав элементов: С, 63,73; Н, 4,62; N,7,70. Пример 3 а. N-(4-Хлорбензил)-1-метил-6(4-морфолинилметил)-4-оксо-1,4-дигидро-3 хинолинкарбоксамид.(0,061 мл) и ДМАП (DМАР) (8,1 мг) в 6,7 мл безводного ДМФА охлаждают до 0 С. Метансульфонилхлорид (0,12 мл) добавляют по каплям. Реакционную смесь перемешивают при комнатной температуре приблизительно в течение 2-3 ч. Добавляют морфолин (0,34 мл). Продукт осаждают добавлением воды. Неочищенный продукт адсорбируют на силикагеле и хроматографируют, проводя элюирование смесью 2% МеОН в СН 2 Сl2. Фракции, гомогенные по данным ТСХ, объединяют и конденсируют с получением 70,1 мг (42%) указанного в заголовке соединения в виде твердого вещества белого цвета. Физические характеристики: Т.пл. 188-190 С; 1 Н ЯМР (300 МГц, ДМСО)10,43, 8,87,8,25, 7,81, 7,38, 4,56, 4,02, 3,63, 3,58, 2,28; ИК (дрейф) 1654, 1606, 1568, 1554, 1501,1364, 1348, 1342, 1316, 1134, 1111, 1005, 825,808, 800 см-1; МС (ESI) 426,3 (М+Н)+, 424,2 (М-Н)-. Состав элементов: С, 64,61; Н, 5,54; N,9,73. Получение 4. N-(4-Хлорбензил)-4-гидрокси-6-(3-гидрокси-1-пропинил)-3-хинолинкарбоксамид. К смеси N-(4-хлорбензил)-4-гидрокси-6 йод-3-хинолинкарбоксамида из способа получения 1 (0,494 г) в Et2NH (12,9 мл) добавляютCuI (10,8 мг) и (Ph3P)2 PdCl2 (39,7 мг). Для растворения реагентов добавляют ДМФА (2 мл). К этому раствору добавляют пропаргиловый спирт (0,066 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 17 дней. Реакционную смесь концентрируют, удаляя при этом Et2NH. Полученный остаток распределяют между СН 2 Сl2 (3 х) и водой. Выпавшее из слоя СН 2 Сl2 твердое вещество коричневого цвета фильтруют и собирают, получая при этом чистый продукт, как это показано с помощью ЯМР. Органические слои объединяют, сушат над Na2SO4 и концентрируют, получая при этом остаток коричневого цвета. Остаток помещают в высокий вакуум для удаления остаточного ДМФА. Остаток адсорбируют на силикагеле и хроматографируют, проводя элюирование смесью 2% МеОН в СН 2 Сl2 и 3% МеОН в СН 2 Сl2. Фракции, гомогенные по данным ТСХ,объединяют, конденсируют и перекристаллизовывают из смеси EtOAc/гексаны с получением твердого продукта кремового цвета. Два сбора продукта дают 325,4 мг (79%) желаемого продукта в виде твердого вещества желтоватокоричневого цвета. Физические характеристики: Т.пл. 248-250 С; 1 Н ЯМР (300 МГц, ДМСО) 12,85, 10,31,8,78, 8,22, 7,78, 7,70, 7,38, 5,39, 4,55, 4,33; ИК (дрейф) 3161, 3073, 3003, 2960, 2914,1656, 1614, 1557, 1517, 1487, 1299, 1014, 1006,826, 805 см-1; МС (ESI) 367,0 (М+Н)+, 365,1 (М-Н)-. Состав элементов: С, 65,23; Н, 4,24; N,7,60. Получение 5.N-(4-Хлорбензил)-1-(2 гидроксиэтил)-6-(3-гидрокси-1-пропинил)-4 оксо-1,4-дигидро-3-хинолинкарбоксамид. В колбу, содержащую N-(4-хлорбензил)-4 гидрокси-6-(3-гидрокси-1-пропинил)-3-хинолинкарбоксамид из способа получения 4(0,37 г), добавляют карбонат калия (2,75 г) и бромэтанол (0,71 мл). Колбу плотно закрывают колпачком и нагревают до 100 С. Через 4 ч реакционную смесь охлаждают до комнатной температуры и распределяют между дихлорметаном, содержащим метанол, и водой. Органический слой промывают двумя дополнительными порциями воды, насыщенным раствором соли, сушат и концентрируют при пониженном давлении. Остаток адсорбируют на силикагеле и хроматографируют на силикагеле, проводя элюирование смесью от 2 до 10% метанола в дихлорметане, получая при этом 0,09 г указанного в заголовке соединения в виде твердого продукта белого цвета. Физические характеристики: 1 Н ЯМР (300 МГц, ДМСО-d6)10,2, 8,8,8,3, 7,9, 7,8, 7,4, 5,4, 5,0, 4,5, 4,3, 3,7 м.д.; МС (ESI) m/z 433 (M+Na+)-. Пример 3b. Соединение примера 3a получают альтернативным способом следующим образом:Chim.Fr., 1970, 1901-1907), N-(4-метиламинобензил)морфолин (957 г) и диэтиловый эфир этоксиметиленмалоновой кислоты (938 мл),ополаскивая этанолом по мере необходимости. Раствор медленно нагревают приблизительно до 108 С с дистилляцией этанола как побочного продукта при атмосферном давлении. Дистилляцию продолжают до тех пор, пока не останется 5% исходного материала морфолина, как это определено с помощью ТСХ (силикагельGF; 5% метанол/метиленхлорид). Раствор охлаждают до комнатной температуры и остаток этанола удаляют дистилляцией в вакууме и в виде азеотропной смеси с толуолом. Сушка в высоком вакууме приводит к 1778 г (102% выход) указанного в заголовке соединения F-2 в виде масла желтого цвета. 1 Н ЯМР (400 МГц CDCl3) м.д. 7,76 (с, 1 Н),7,20 (м, 4 Н), 4,15 (м, 4 Н), 3,70 (м, 4 Н), 3,50 (с,2 Н), 3,33 (с, 3H), 2,45 (м, 4 Н) и 1,30 (м, 6 Н). 13 С ЯМР (100 МГц CDCl3) м.д. 167,19,167,03, 148,72, 145,90, 135,63, 130,12, 121,69,98,23, 67,00, 62,66, 60,89, 60,27, 53,60, 40,26,14,41 и 14,15. Получение F-3. Этил 1-метил-6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксилат. В 12-литровую 3-горлую колбу загружают пятиокись фосфора (294 г) и метансульфокислоту (1792 мл). Смесь нагревают до 50 С при перемешивании для растворения пятиокиси фосфора. Раствор кислоты охлаждают до комнатной температуры и добавляют раствор F-2(780,5 г) в толуоле (780,5 мл) в течение 2 ч, поддерживая при этом температуру при 60 С. После 1 ч при 48-59 С реакция заканчивается, как это показано с помощью ТСХ (силикагель GF; 5% метанол/метиленхлорид). Раствор охлаждают до 0-5 С и медленно добавляют воду (780 мл) при 36 С. рН суспензии доводят до 9,510,5 добавлением 10 М водного раствора гидроокиси натрия (3365 мл) при 36 С. Затем добавляют воду (9330 мл) и метиленхлорид (6900 мл) и продукт экстрагируют в органический слой. Водный слой экстрагируют метиленхлоридом(3500 мл). Объединенные органические слои промывают водой (4000 мл). Удаление растворителя дистилляцией приводит к 665 г (97% выход) указанного в заголовке соединения F-3 в виде бледно-желтых кристаллов. 1 Н ЯМР (400 МГц CDCl3) м.д. 8,42 (м, 2 Н),7,40 (м, 1 Н), 7,39 (м, 1 Н), 4,38 (кв, 2 Н), 3,88 (с, 19 3H), 3,68 (м, 4 Н), 3,62 (с, 2 Н), 2,47 (м, 4 Н) и 1,42F-3 (755 г), этанол (3776 мл), воду (3776 мл) и 50% гидроокись натрия (831 мл). При перемешивании в атмосфере азота смесь нагревают с обратным холодильником и поддерживают в этих условиях до тех пор, пока F-3 не израсходуется, что показано с помощью ТСХ (силикагель GF; 15% метанол в метиленхлориде, уф). После 1 ч при кипячении с обратным холодильником реакция завершается. Этанол удаляют дистилляцией в вакууме и водный слой экстрагируют метил-трет-бутиловым эфиром (7550 мл). Затем рН водного слоя снижают до 3,8-4,2 с помощью 6 М соляной кислоты (2700 мл). Полученную бесцветную суспензию охлаждают до 03 С при перемешивании. Указанное в заголовке соединение F-4 фильтруют на стеклянной воронке с крупнозернистым спекшимся фильтром и промывают водой, охлажденной до температуры от 0 до 3 С (375 мл). Продукт сушат при 40 С в вакууме в атмосфере азота до тех пор,пока не останется 0,3% воды. Выход F-4 в виде бесцветных кристаллов составляет 599 г(86,6%). Остаточная вода составляет 0,245% по весу. 1 Н ЯМР (400 МГц D2O) м.д. 8,70 (с, 1 Н),8,39 (с, 1 Н), 8,11 (м, 1 Н), 8,02 (м, 1 Н), 4,83 (с,3H), 4,66 (с, 2 Н), 4,05 (м, 4 Н) и 3,49 (м, 4 Н). 13 С ЯМР (100 МГц D2O) м.д. 178,06,168,84, 150,95, 141,26, 137,44, 129,16, 127,42,125,39, 119,65, 107,47, 64,09, 59,89, 51,85 и 42,64. Получение F-5. N-(4-Хлорбензил)-1-метил 6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3 хинолинкарбоксамид. В 22-литровую 3-горлую колбу загружают соединение F-4 (827 г), 1,1'-карбонилдиимидазол (CDI) (443 г) и диметилформамид (4960 мл). Смесь медленно нагревают до 60 и до 70 С при перемешивании в атмосфере азота. Твердые вещества постепенно растворяются, в то время как двуокись углерода равномерно выделяется. После добавления двух дополнительных 22 г порций CDI в течение приблизительно 4 ч исходный материал оказывается израсходованным, как это показано с помощью ТСХ (силикагель GF; 6% метанол в метиленхлориде, уф). Поскольку продукт получения F-4 реагирует,получается желтовато-коричневый раствор, который в конечном счете превращается в суспензию, так как ацилимидазолид кристаллизуется. К суспензии добавляют 4-хлорбензиламин (333 мл) в пределах 11 мин с выделением тепла (от 20 64 до 75 С). После растворения имидазолида происходит кристаллизация продукта. Перемешивание продолжают при температуре от 64 до 80 С до тех пор, пока процесс не закончится,что определяется с помощью ТСХ (силикагельGF; 6% метанол в метиленхлориде; уф). Для завершения реакции добавляют дополнительно 16,7 мл 4-хлорбензиламина. По окончании реакции суспензию охлаждают до 25 С и добавляют охлажденную до температуры 0-5 С воду(4600 мл) . Смесь охлаждают до 0-3 С и фильтруют на стеклянной воронке с крупнозернистым спекшимся фильтром. Отжатый осадок на фильтре промывают охлажденной до 0-3 С водой (2550 мл) и сушат в вакуумном шкафу при 40 С в атмосфере азота. Выход неочищенного указанного в заголовке соединения в виде бледно-желтых кристаллов составляет 947 г (81,3% выход). Чистота, определяемая с помощью ВЭЖХ, составляет 97,4%, исходя из площади пика. Неочищенное указанное в заголовке соединение перекристаллизовывают из горячего этанола по мере необходимости. 1 Н ЯМР (400 МГц CDCl3) м.д. 10,46 (широкий с, 1 Н), 8,77 (с, 1 Н), 8,41 (с, 1 Н), 7,80 (м,1 Н), 7,49 (м, 1 Н), 7,30 (м, 4 Н), 4,64 (д, 2 Н), 3,95 К раствору N-(4-хлорбензил)-1-(2-гидроксиэтил)-6-(3-гидрокси-1-пропинил)-4-оксо-1,4 дигидро-3-хинолинкарбоксамида из способа получения 5 (0,20 г) в небольшом количестве смеси ТГФ:метанол добавляют окись платины(0,01 г). Смесь помещают в атмосферу водорода. Через 2 ч смесь фильтруют через целит с промываниями смесью ТГФ:метанол. Фильтрат концентрируют при пониженном давлении. Остаток адсорбируют на силикагеле и хроматографируют на силикагеле, проводя элюирование смесью от 4 до 16% метанола в дихлорметане. Содержащие продукт фракции концентрируют при пониженном давлении, получая при этом 0,14 г указанного в заголовке соединения в виде твердого вещества белого цвета. Физические характеристики: 1 Н ЯМР (300 МГц, ДМСО-d6) 10,5, 8,7, 8,1,7,8, 7,7, 7,4, 5,0, 4,5, 3,7, 3,4, 2,7, 1,7; МС (ESI) m/z 415 (М+Н+).N-(4-Хлорбензил)-6-(3 гидрокси-1-пропинил)-1-метил-4-оксо-1,4 дигидро-3-хинолинкарбоксамид. Суспензию 6,90 г N-(4-хлорбензил)-4 гидрокси-6-(3-гидрокси-1-пропинил)-3-хинолинкарбоксамида из способа получения 4,10,4 г карбоната калия и 2,3 мл йодистого метила в ДМФА перемешивают при 90 С в течение 4 ч, затем охлаждают и разбавляют 350 мл воды. Образовавшийся твердый продукт фильтруют,хорошо промывают водой и сушат в вакууме. Флэш-хроматография твердого вещества на силикагеле с использованием в качестве элюента смеси 3-5% метанола в дихлорметане приводит к 6,02 г указанного в заголовке соединения в виде твердого вещества. Физические характеристики: 1 Н ЯМР (CDCl3+CD3OD)4,03, 4,45, 4,6,7,3, 7,6, 7,8, 8,5, 8,8 м.д.; МС высокого разрешения 381,1006. Пример 5. N-(4-Хлорбензил)-6-(3-гидроксипропил)-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоксамид. Смесь 0,50 г N-(4-хлорбензил)-6-(3 гидрокси-1-пропинил)-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоксамида из способа получения 6 и 50 мг катализатора 5% платины на угле в 20 мл смеси 1:1 ТГФ:метанол перемешивают при 1 атм. водорода в течение 3 ч, затем фильтруют через диатомовую землю. Фильтрат концентрируют при пониженном давлении и твердый остаток подвергают флэш-хроматографии на силикагеле с применением в качестве элюента смеси 4-5% метанола в дихлорметане,получая при этом 0,45 г указанного в заголовке соединения в виде твердого вещества желтого цвета. Дальнейшую очистку осуществляют путем перекристаллизации твердого вещества из 15 мл ацетонитрила. Физические характеристики: 1 Н ЯМР (CDCl3+CD3OD)1,9, 2,9, 3,6, 4,0,4,6, 7,3, 7,5, 7,7, 8,3, 8, 8 м.д.; МС высокого разрешения 385,1310. Получение 7. 2-Фтор-5-йодбензойная кислота. К раствору 16,8 мл диизопропилэтиламина в 200 мл ТГФ, охлажденному при -78 С, при перемешивании в атмосфере аргона добавляют по каплям 67 мл 1,6 М раствора бутиллития в гексане. Раствор оставляют нагреваться до 0 С и затем вновь охлаждают до -78 С. К этому раствору добавляют по каплям 11,5 мл 4 фторйодбензола в 10 мл ТГФ. Раствор перемешивают при -78 С в течение 90 мин, затем быстро переносят с помощью трубочки в кашицу из эфира с сухим льдом. Смесь оставляют нагреваться до комнатной температуры, затем экс 004043 22 трагируют 300 мл 0,3 М NaOH. Водную фазу охлаждают на льду и подкисляют 40 мл 6 н. HCl. Осадок экстрагируют двумя порциями эфира и органическую фазу сушат (MgSO4) и концентрируют при пониженном давлении. Перекристаллизация остатка из смеси этилацетат-гексан приводит к 19,57 г указанного в заголовке соединения в виде игл белого цвета. Вторую порцию, составляющую 3,78 г, получают путем перекристаллизации остатка из маточной жидкости. Физические характеристики: 1 Н ЯМР (CDCl3)6,97, 7,88, 8,33 м.д. Состав элементов: С, 31,57; Н, 1,59. Получение 8. Этил 3-(2-фтор-5-йодфенил)3-оксопропаноат. К перемешиваемому раствору 5,32 г 2 фтор-5-йодбензойной кислоты из способа получения 7 в 20 мл ТГФ в атмосфере аргона добавляют 3,9 г карбонилдиимидазола. В отдельной колбе 2,8 мл хлортриметилсилана добавляют к смеси 3,74 г этилмалоната калия в 20 мл ацетонитрила. Смесь перемешивают в атмосфере аргона в течение 18 ч, затем охлаждают до 0 С для того, чтобы добавить по каплям 6,6 млDBU. Смесь перемешивают при 0 С в течение 3 ч, затем добавляют через трубочку раствор ацилимидазолида, приготовленный ранее. Через 2 ч смесь распределяют между эфиром и избытком разбавленной HCl и органическую фазу промывают разбавленной HCl и насыщенным раствором соли и сушат (MgSO4). Удаление растворителя при пониженном давлении приводит к продукту в виде бесцветного масла, которое подвергают флэш-хроматографии на силикагеле,применяя в качестве элюента смесь 10% этилацетата в гексане, получая при этом 5,07 г указанного в заголовке соединения в виде плотных розоватых призм. Физические характеристики: 1 Н ЯМР (CDCl3)1,34, 4,27, 5,82, 6,89, 7,7,8,2 м.д.; ИК 1624, 1485, 1419, 1245, 1193, 1070,1028, 813 см-1. Получение 9. Этил 1-(трет-бутил)-6-йод-4 оксо-1,4-дигидро-3-хинолинкарбоксилат. Раствор 2,36 г этил 3-(2-фтор-5-йодфенил)3-оксопропаноата из способа получения 8,2,0 мл триэтилортоформиата и 15 мл уксусного ангидрида кипятят с обратным холодильником в атмосфере аргона в течение 2 ч, затем растворители отгоняют при пониженном давлении. К остатку в виде масла добавляют 10 мл сухого трет-бутанола и 0,74 мл трет-бутиламина и раствор перемешивают при 80 С в течение 2 ч. Затем добавляют трет-бутилат калия (0,87 г) и перемешивание продолжают при 80 С в атмосфере аргона в течение 18 ч. Затем смесь охлаждают и распределяют между разбавленной HCl и смесью хлороформ-метанол. Органическую фазу сушат (MgSO4) и концентрируют при по 23 ниженном давлении. Флэш-хроматография остатка на силикагеле с применением в качестве элюента смеси 2-4% метанола в дихлорметане приводит к 1,32 г указанного в заголовке соединения в виде твердого вещества не совсем белого цвета. Физические характеристики: 1 Н ЯМР (CDCl3)1,42, 1,87, 4,4, 7,7, 7,9,8,9 м.д.; МС высокого разрешения 400, 0414. Состав элементов: С, 48,05; Н, 4,50; N,3,52. Получение 10. 1-(трет-Бутил)-N-(4-хлорбензил)-6-йод-4-оксо-1,4-дигидро-3-хинолинкарбоксамид. Суспензию 1,11 г этил 1-(трет-бутил)-6 йод-4-оксо-1,4-дигидро-3-хинолинкарбоксилата из способа получения 9 в 2,0 мл 4 хлорбензиламина нагревают при 160 С в атмосфере аргона в течение 18 ч, затем охлаждают до комнатной температуры и растирают с 1 н.HCl. Твердый продукт фильтруют, хорошо промывают водой и сушат в вакууме. Флэшхроматография с применением в качестве элюента смеси 20% этилацетата в дихлорметане дает в результате 1,22 г указанного в заголовке соединения в виде твердого вещества белого цвета. Физические характеристики: 1H ЯМР (CDCl3)1,89, 4,6, 7,3, 7,7, 7,9,8,9, 9,22, 10,4 м. д.; ИК 1664, 1536, 1468, 1342, 1180 см-1. Состав элементов: С, 51,27; Н, 4,19; N,5,62. Получение 11. 1-(трет-Бутил)-N-(4-хлорбензил)-6-(3-гидрокси-1-пропинил)-4-оксо-1,4 дигидро-3-хинолинкарбоксамид. К перемешиваемой суспензии 1,15 г 1(трет-бутил)-N-(4-хлорбензил)-6-йод-4-oкco-1,4 дигидро-3-хинолинкарбоксамида из способа получения 10, 156 мг йодида меди(I) и 66 мг дихлор-бис(трифенилфосфин)палладия(II) в 23 мл диэтиламина в атмосфере аргона добавляют 0,16 мл пропаргилового спирта. Смесь перемешивают при комнатной температуре в течение 18 ч, затем концентрируют при пониженном давлении. Остаток распределяют между водой и смесью хлороформ/метанол и органическую фазу сушат (MgSO4) и концентрируют при пониженном давлении. Флэш-хроматография остатка на силикагеле с применением в качестве элюента смеси 2-4% метанола в дихлорметане дает в результате 977 мг твердого вещества желтовато-коричневого цвета. Перекристаллизация из этанола приводит к получению 850 мг указанного в заголовке соединения в виде твердого вещества бежевого цвета. Физические характеристики: 1 Н ЯМР (CDCl3)1,92, 4,47, 4,6, 7,3, 7,7,8,0, 8,5, 9,19, 10,5 м.д.; МС высокого разрешения 423,1466. Смесь 303 мг 1-(трет-бутил)-N-(4-хлорбензил)-6-(3-гидрокси-1-пропинил)-4-оксо-1,4 дигидро-3-хинолинкарбоксамида из способа получения 11 и 15 мг окиси платины в 10 мл смеси 1:1 ТГФ-метанол перемешивают в условиях 1 атмосферы газообразного водорода в течение 3 ч, затем фильтруют через диатомовую землю и концентрируют при пониженном давлении. Смесь очищают флэш-хроматографией на силикагеле, применяя в качестве элюента смесь 2-3% метанола в дихлорметане, получая при этом 294 мг указанного в заголовке соединения. Физические характеристики: 1 Н ЯМР (CDCl3)1,89, 1,9, 2,9, 3,7, 4,6,7,3, 7,5, 7,9, 8,4, 9,21, 10,6 м.д.; ИК 1658, 1596, 1548, 1484, 1349, 1184, 810,731 см-1; МС высокого разрешения 427,1762. Пример 7. N-(4-Хлорбензил)-1-метил-4 оксо-6-(4-тиоморфолинилметил)-1,4-дигидро-3 хинолинкарбоксамид. Метансульфонилхлорид (0,193 мл) добавляют к раствору N-(4-хлорбензил)-6-(гидроксиметил)-1-метил-4-оксо-1,4-дигидро-3-хинолинкарбоксамида (357 мг) из примера 2,DМАР (20 мг) и 2,4,6-коллидина (0,33 мл) в безводном ДМФА (20 мл). Смесь перемешивают при комнатной температуре в течение 2 ч и выливают в воду (60 мл). Образовавшийся осадок фильтруют, промывают водой (20 мл) и перекристаллизовывают из ацетонитрила, получая при этом 0,328 г (74%) указанного в заголовке соединения в виде твердого вещества белого цвета. Физические характеристики: Т.пл. 215-219 С; 1 Н ЯМР (ДМСО-d6)10,42, 8,87, 8,23,7,80, 7,42-7,34, 4,56, 4,02, 3,66, 2,62; 13 С ЯМР (ДМСО-d6) 175,4, 164,4, 148,7,139,0, 138,7, 135,3, 133,7, 131,3, 129,1, 128,3,126,7, 125,6, 117,6, 110,5, 61,8, 54,3, 41,4, 41,2,27,2; ИК (дрейф) 2915, 1655, 1605, 1574, 1551,1502, 1364, 1339, 1316, 1132, 826, 808, 801, 726,661 см-1; МС (ESI+) m/z 442 (М+Н)+; 25 Состав элементов для С 23H24ClN3O2S: С,62,18; Н, 5,46; N, 9,47; Сl, 8,40; S, 7,02. Примеры 8-9.N-(4-Хлорбензил)-1-метил-4-оксо-6-(4 тиоморфолинилметил)-1,4-дигидро-3-хинолинкарбоксамид (221 мг) из примера 7 растворяют в сухом СН 2 Сl2 (5 мл) и раствор охлаждают до 0 С. Раствор mСРВА (258 мг) в сухом СН 2 Сl2 (5 мл) добавляют по каплям, поддерживая при этом температуру раствора в диапазоне 0-2 С. Реакционную смесь перемешивают при 0 С в течение 2 ч и затем оставляют нагреваться до комнатной температуры. Реакцию гасят насыщенным раствором NaHSO3 (2 мл) и перемешивают еще 1 ч. Разбавление водой (10 мл) приводит к образованию осадка белого цвета,который фильтруют. Неочищенное твердое вещество представляет собой смесь двух продуктов, которые очищают колоночной хроматографией (элюирование смесью МеОН/СН 2 Сl2, от 1/49 до 3/97), получая при этом 37 мг (16%) соединения из примера 8 и 54 мг (24%) соединения из примера 9 в виде твердых веществ белого цвета. Пример 8. Физические характеристики: Т.пл. 245-247 С; 1 Н ЯМР (ДMCO-d6)10,42, 8,88, 8,26,7,83, 7,42-7,34, 4,56, 4,03, 3,85, 3,11, 2,90; ИК (дрейф) 1916, 1662, 1610, 1569, 1539,1498, 1326, 1317, 1289, 1268, 1123, 1107, 805,796, 661 см-1. Состав элементов для С 23 Н 24 СlN3O4S: С,58,05; Н, 5,06; N, 8,78; Сl, 7,55. Пример 9. N-(4-Хлорбензил)-1-метил-4 оксо-6-[(1-оксо-1',4-тиазинан-4-ил)метил]-1,4 дигидро-3-хинолинкарбоксамид. Физические характеристики: Т.пл. 249-251 С; 1 Н ЯМР (ДМСО-d6)10,42, 8,87, 8,26,7,82, 7,42-7,34, 4,56, 4,02, 3,74, 2,91-2,83, 2,742,62; ИК (дрейф) 2818, 2351, 1974, 1932, 1656,1604, 1574, 1551, 1500, 1363, 1336, 1054, 1027,838, 809 см-1. Состав элементов для С 23 Н 24 СlN3 О 3S: С,60,09; Н, 5,30; N, 9,03; Сl, 7,90. Пример 10. N-(4-Хлорбензил)-8-фтор-1 метил-6-(4-морфолинилметил)-4-оксо-1,4 дигидро-3-хинолинкарбоксамид.(3 мл) добавляют K2 СO3 (71,2 мг) с последующим добавлением СН 3I (0,026 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, затем выливают в воду (40 мл) для осаждения продукта. Твердый продукт собирают, адсорбируют на силикагеле и хроматографируют (элюирование смесью 1% МеОН в СН 2 Сl2 (2 л. Фракции, гомогенные по данным ТСХ, объединяют и концентрируют, получая при этом 55,3 мг указанного в заголовке соединения в виде твердого вещества белого цвета. Физические характеристики: Т.пл. 187-189 С; 1 Н ЯМР (300 МГц, ДМСО-d6)10,28, 8,77,8,09, 7,65, 7,38, 4,56, 4,17, 3,58, 2,38; ИК (дрейф) 1659, 1603, 1578, 1556, 1550,1543, 1499, 1366, 1348, 1278, 1134, 1117, 865,809, 797 см-1. МС высокого разрешения (FAB), рассчитанный для C23H23ClFN3O3+H1 444,1490, найденный 444,1484. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I где R1 представляет собой C1-7 алкил, необязательно замещенный гидрокси или NR4R5;R2 представляет собой С 1-7 алкил, замещенный гидрокси или NR4R5;R4 и R5 вместе с N представляют собой 5 или 6-членный гетероциклический фрагмент,имеющий 1-3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, в котором сера может быть замещена одним (1) или двумя (2) атомами кислорода; и его фармацевтически приемлемая соль. 2. Соединение по п.1, где R1 представляет собой C1-4 алкил, необязательно замещенный гидрокси; R2 представляет собой C1-5 алкил, замещенный гидрокси или морфолином; и R3 представляет собой Н или F. 3. Соединение по п.1, которое представляет собой(g) N-(4-хлорбензил)-1-метил-4-оксо-6-[(1 оксо-1',4-тиазинан-4-ил)метил]-1,4-дигидро-3 хинолинкарбоксамид; или их фармацевтически приемлемую соль. 4. Соединение по п.1, которое представляет собой любое из соединений (а), (b), (с), (d), (f) и (g), перечисленных в п.3, или их фармацевтически приемлемую соль. 5. Соединение по п.1, которое представляет собой любое из соединений (b), (d), (f) и (g),перечисленных в п.3, или их фармацевтически приемлемую соль. 6. Соединение по п.1, которое представляет собой N-(4-хлорбензил)-1-метил-6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид или его фармацевтически приемлемую соль. 7. Соединение по п.1 или 2, где R3 не является F. 8. Соединение по п.1, которое представляет собой N-(4-хлорбензил)-8-фтор-1-метил-6-(4 морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксамид или его фармацевтически приемлемую соль. 9. Фармацевтическая композиция, которая содержит соединение по любому из предшествующих пунктов и фармацевтически приемлемый носитель. 10. Применение соединения по любому из пп.1-8 для производства лекарственного средства для лечения инфекций, вызываемых вирусом герпеса. 11. Применение по п.10, где вирус герпеса является вирусом простого герпеса типа 1, вирусом простого герпеса типа 2, вирусом ветряной оспы, цитомегаловирусом, вирусом Эпштейна-Барр, вирусом герпеса человека типа 6,вирусом герпеса человека типа 7 или вирусом герпеса человека типа 8. 12. Применение по п.10, где вирус герпеса является цитомегаловирусом человека. 13. Соединение, применяемое в качестве синтетического промежуточного соединения при получении соединения по п.6, которое име 28 ет структуру диэтил 2-[метил-4-(4-морфолинилметил)анилино]метиленмалоната. 14. Соединение, применяемое в качестве синтетического промежуточного соединения при получении соединения по п.6, которое имеет структуру этил 1-метил-6-(4-морфолинилметил)-4-оксо-1,4-дигидро-3-хинолинкарбоксилата. 15. Соединение, применяемое в качестве синтетического промежуточного соединения при получении соединения по п.6, которое имеет структуру 1-метил-6-(4-морфолинилметил)-4 оксо-1,4-дигидро-3-хинолинкарбоновой кислоты. 16. Способ получения соединения по п.6,включающий в себя стадииa) нагревания смеси диэтилэтоксиметиленмалоната и N-(4-метиламинобензил)морфолина с получением соединения по п.13;b) добавления раствора продукта со стадии(а) в толуоле к смеси пятиокиси фосфора и метансульфокислоты с получением соединения по п.14;c) превращение продукта со стадии (b) в соединение по п.15;d) перемешивание продукта со стадии (с) с карбонилдиимидазолом и диметилформамидом; иe) взаимодействие 4-хлорбензиламина со смесью со стадии (d). 17. Способ лечения инфекций, вызванных вирусами герпеса, который включает в себя введение больному, в случае необходимости,эффективного количества соединения формулыI, которая представлена в п.1. 18. Способ по п.17, где указанными вирусами герпеса являются вирус простого герпеса типа 1, вирус простого герпеса типа 2, вирус ветряной оспы, цитомегаловирус, вирус Эпштейна-Барр, вирусы герпеса человека типа 6,вирусы герпеса человека типа 7 или вирусы герпеса человека типа 8. 19. Способ по п.17, где указанными вирусами герпеса являются вирус простого герпеса типа 1, вирус простого герпеса типа 2, вирус ветряной оспы, цитомегаловирус, вирус Эпштейна-Барр, вирусы герпеса человека типа 7 или вирусы герпеса человека типа 8. 20. Способ по п.17, где указанным вирусом является цитомегаловирус человека. 21. Способ по п.17, где эффективное количество соединения по п.1 вводят перорально,парентерально или местно. 22. Способ по п.17, где эффективное количество соединения по п.1 составляет приблизительно от 0,1 до 300 мг/кг веса тела. 23. Способ по п.17, где эффективное количество соединения по п.1 составляет приблизительно от 1 до 30 мг/кг веса тела.
МПК / Метки
МПК: C07D 215/56, A61K 31/47, A61P 31/22
Метки: 4-оксо-1,4-дигидро-3-хинолинкарбоксамиды, антивирусные, агенты
Код ссылки
<a href="https://eas.patents.su/15-4043-4-okso-14-digidro-3-hinolinkarboksamidy-kak-antivirusnye-agenty.html" rel="bookmark" title="База патентов Евразийского Союза">4-оксо-1,4-дигидро-3-хинолинкарбоксамиды как антивирусные агенты</a>
Предыдущий патент: Новые соединения аминопирролина, способ их получения и содержащие их фармацевтические композиции
Следующий патент: Содержащая амброксол пастилка
Случайный патент: Новые формы метилового эфира 2-циано-3,12-диоксоолеан-1,9(11)-диен-28-овой кислоты (cddo-me)



















