Уреидопиперидиновые производные как селективные антагонисты nk3 – рецепторов человека
Номер патента: 3613
Опубликовано: 26.06.2003
Авторы: Оломбар Ален, Пройетто Винченцо, Эдмонд-Аль Ксавье, Ван Брук Дидье
Формула / Реферат
1. Соединение формулы
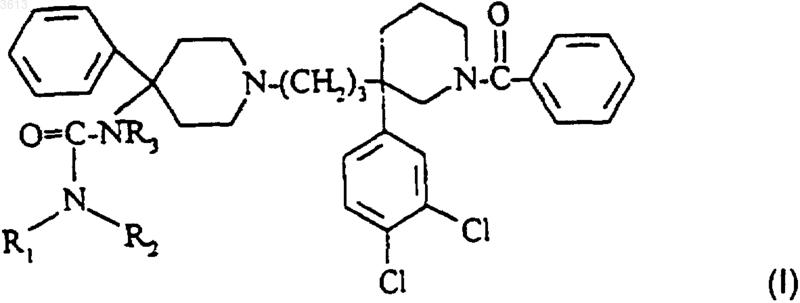
где каждый из R1 и R2 независимо друг от друга представляет собой водород или (C1-C3)алкил;
R3 представляет собой водород;
а также его соли с минеральными или органическими кислотами и его сольваты.
2. Соединение по п.1 в форме (+)-изомера в (R)-конфигурации.
3. 1-Бензоил-3-(3,4-дихлорфенил)-3-[3-[4-(N',N'-диметилуреидо)-4-фенилпиперидин-1-ил]пропил]пиперидин и его соли и сольваты.
4. 1-Бензоил-3-(3,4-дихлорфенил)-3-[3-[4-(N',N'-диметилуреидо)-4-фенилпиперидин-1-ил]пропил]пиперидин в форме (+)-изомера и его сольваты.
5. Способ получения соединения формулы (I) по п.1, его солей и его сольватов, отличающийся тем, что
а1) соединение формулы
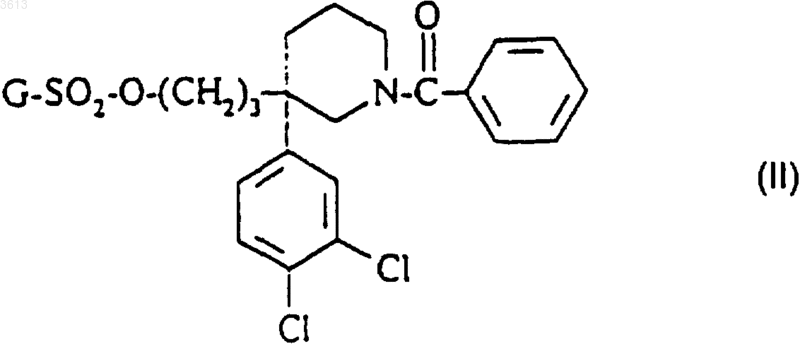
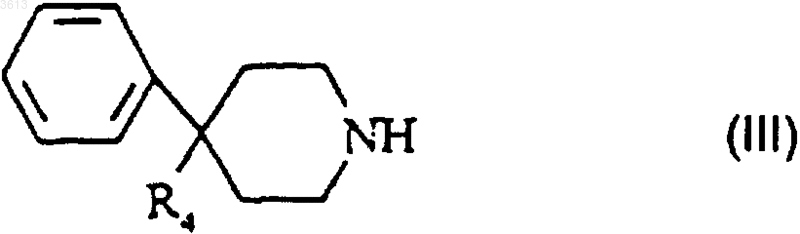
в которой G представляет собой метильную, фенильную, толильную или трифторметильную группу, обрабатывают пиперидиновым производным формулы
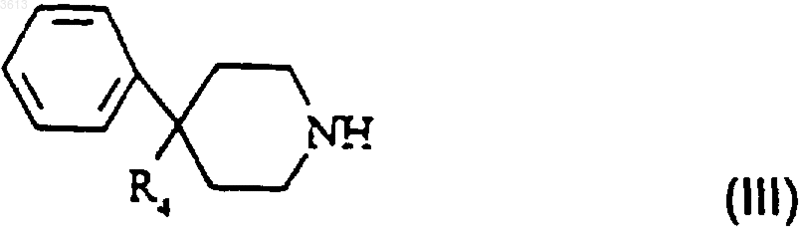
в которой R4 представляет собой группу NR3CONR1R2 или группу COOH, при этом R1, R2 и R3 такие, как определено в п.1;
б1) когда R4= COOH, полученное таким образом соединение формулы
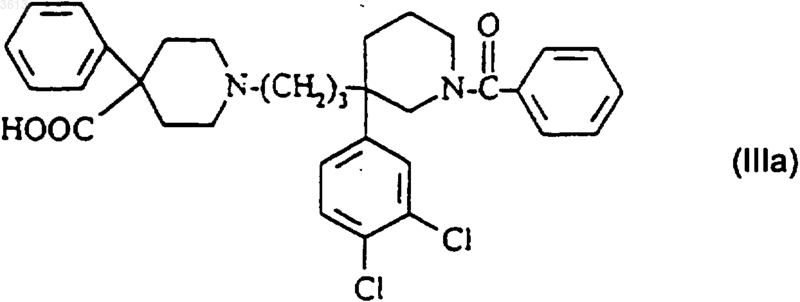
превращают в соединение формулы (I);
в1) полученное таким образом на стадии (а1) или на стадии (б1) соединение возможно превращают в одну из его солей или сольватов.
6. Способ получения соединения формулы (I) по п.1, его солей и сольватов, отличающийся тем, что
а2) соединение формулы
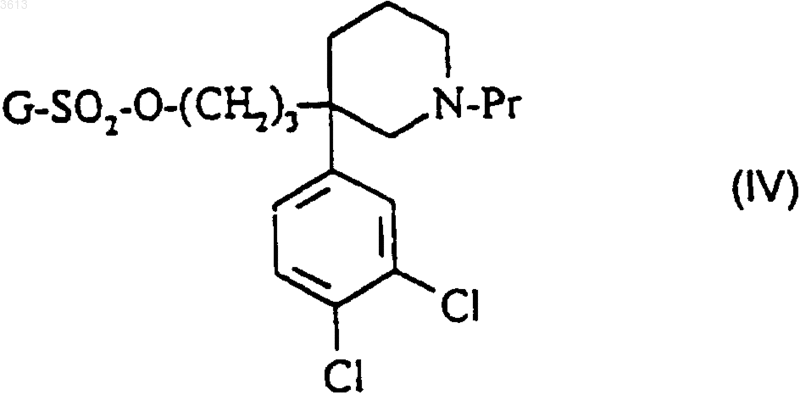
в которой G такой, как определено п.5, а Pr представляет собой защитную группу, выбранную из тритильной, трет-бутоксикарбонильной или бензилоксикарбонильной группы, обрабатывают пиперидиновым производным формулы
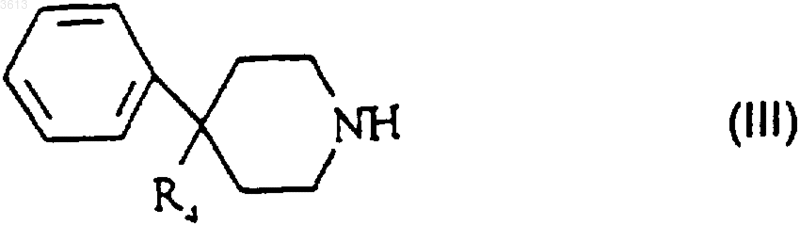
в которой R4 представляет собой группу NR3CONR1R2 или группу COOH;
б2) защитную группу Pr полученного таким образом соединения формулы
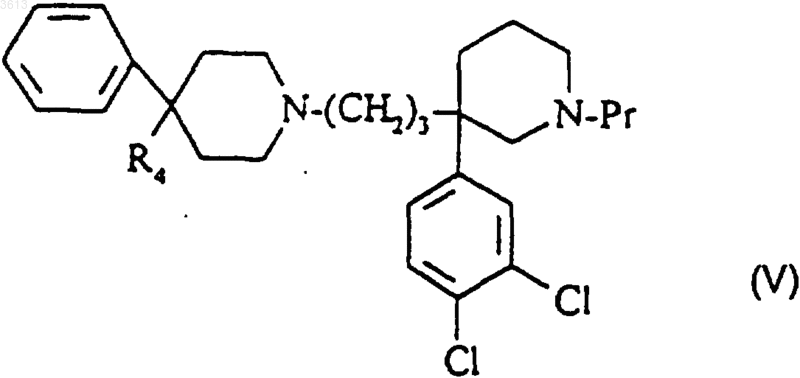
селективно удаляют;
в2) полученное таким образом соединение формулы
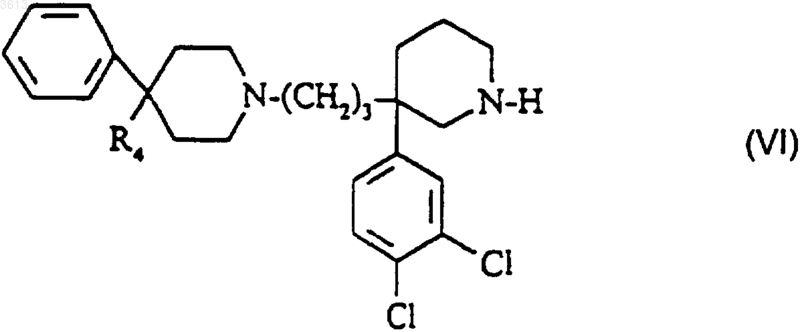
обрабатывают бензоилгалогенидом;
г2) когда группа R4 = COOH, полученное таким образом соединение формулы
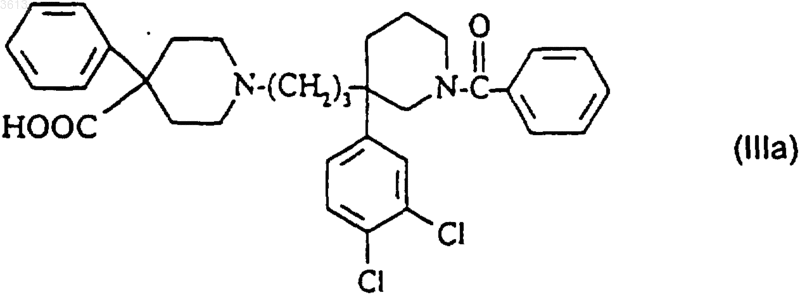
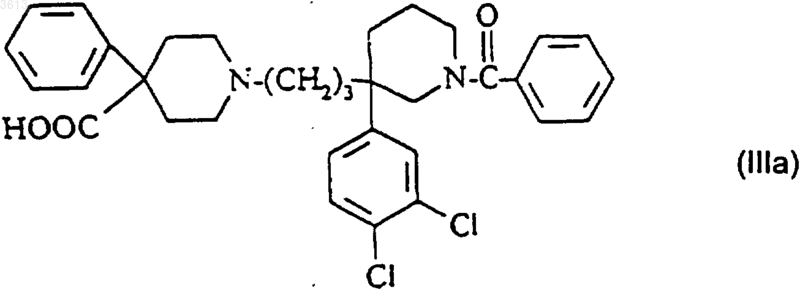
превращают в соединение формулы (I);
д2) полученное таким образом на стадии (в2) или на стадии (г2) соединение возможно превращают в одну из его солей или сольватов.
7. Способ получения соединения формулы (I) по п.1, его солей и его сольватов, отличающийся тем, что
а3) окисляют спирт формулы

б3) полученный таким образом альдегид формулы
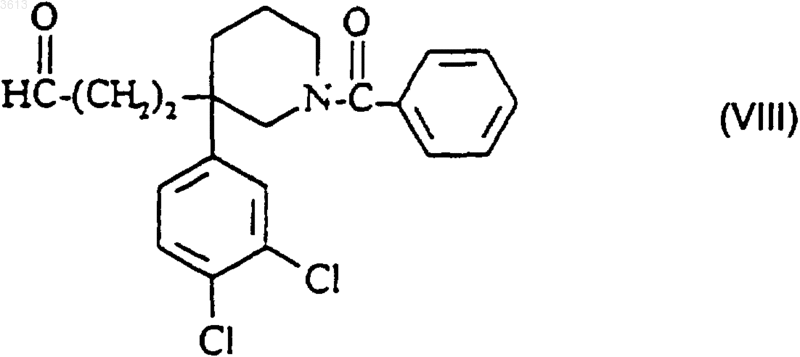
обрабатывают пиперидиновым производным формулы
в которой R4 такой, как определено в п.6;
в3) когда R4= COOH, полученное таким образом соединение формулы
превращают в соединение формулы (I);
г3) полученное таким образом на стадии (б3) или на стадии (в3) соединение возможно превращают в одну из его солей или сольватов.
8. Способ получения соединения формулы (I) по п.1, его солей и его сольватов, отличающийся тем, что
а4) соединение формулы
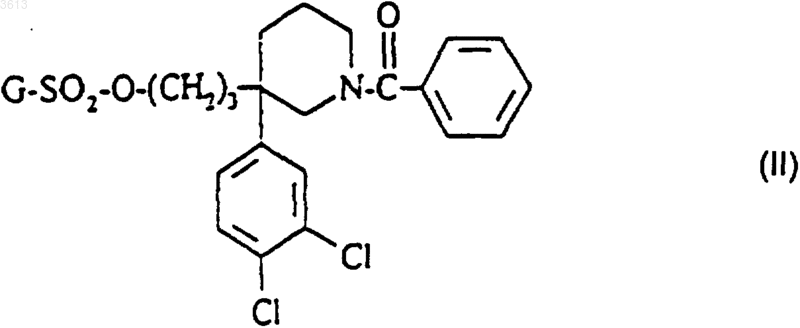
где G представляет собой метильную, фенильную, толильную или трифторметильную группу обрабатывают в присутствии основания трет-бутиловым эфиром (4-фенилпиперидин-4-ил)карбаминовой кислоты формулы
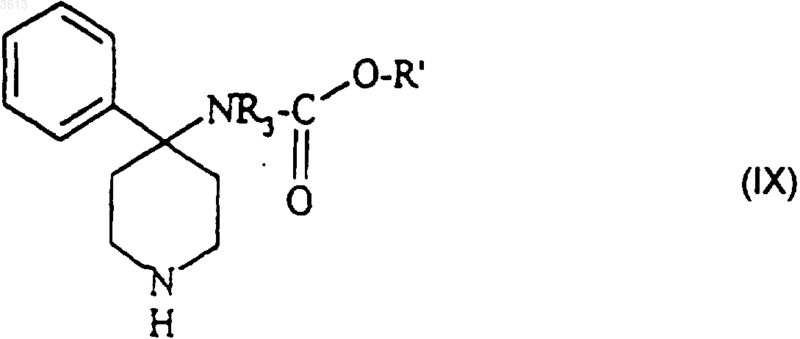
в которой R' = (C1-C6)алкил;
б4) с полученного таким образом соединения формулы
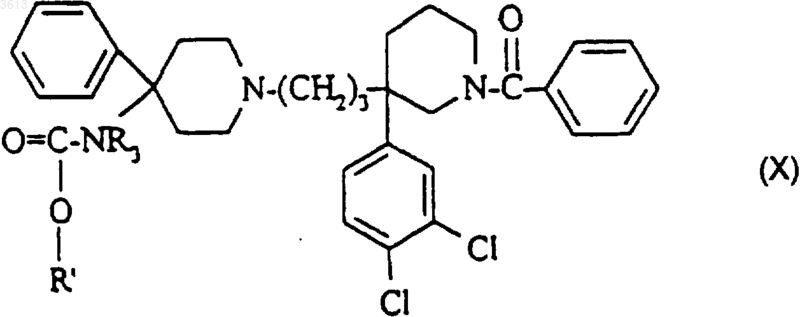
снимают защиту, воздействуя кислотой;
в4) полученное таким образом соединение формулы
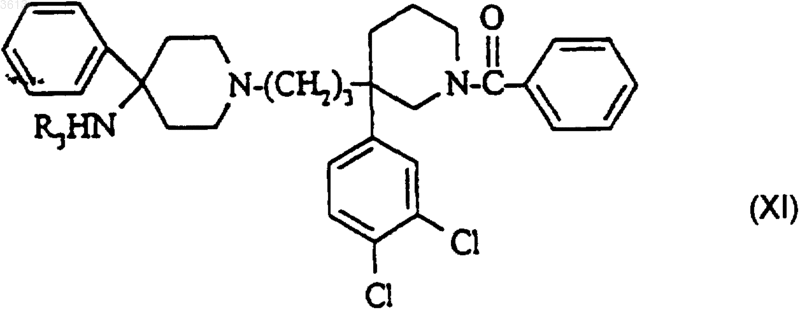
сначала обрабатывают реакционно-способным производным угольной кислоты в присутствии или в отсутствие основания, затем амином формулы NR1R2 для получения желаемого соединения формулы (I).
9. Способ по п.5 или 8 получения соединения формулы (I), имеющего (R)-конфигурацию, его солей и его сольватов, отличающийся тем, что в качестве исходного материала используют соединение формулы
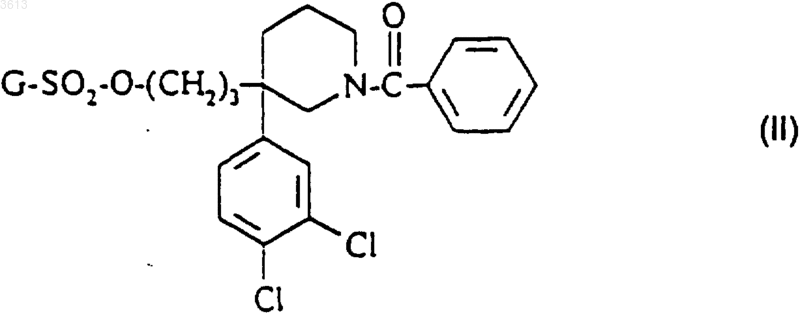
в которой G такой, как определено п.5, в форме (+)-изомера.
10. Способ по п.7 получения соединения формулы (I), имеющего (R)-конфигурацию, его солей и его сольватов, отличающийся тем, что в качестве исходного материала используют спирт формулы
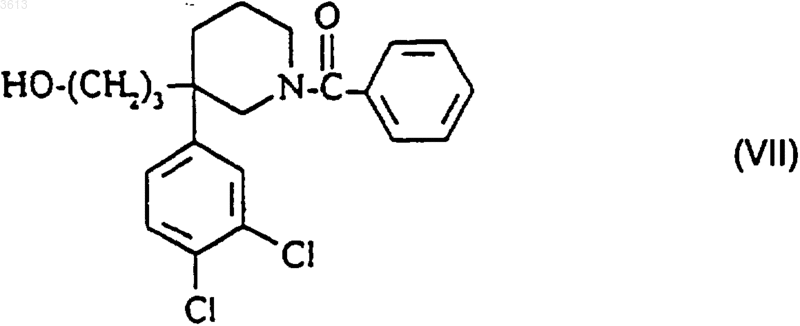
в форме (+)-изомера.
11. Соединение формулы
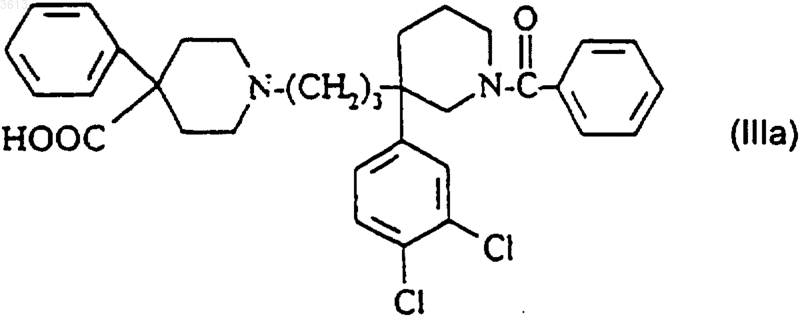
в рацемической форме или в оптически чистой форме, а также его соли.
12. Фармацевтическая композиция, содержащая в качестве активного начала соединение по любому из пп.1-4 или одну из его фармацевтически приемлемых солей и сольватов.
13. Применение соединения формулы (I) или одной из его фармацевтически приемлемых солей и сольватов для приготовления лекарственных средств, предназначенных для лечения любой патологии, в которую вовлечены нейрокинин B и NK3-рецепторы человека.
14. Применение по п.13 для приготовления лекарственных средств, предназначенных для лечения респираторных расстройств.
15. Применение по п.13 для приготовления лекарственных средств, предназначенных для лечения заболеваний центральной нервной системы.
16. Применение по п.13 для приготовления лекарственных средств, предназначенных для лечения боли.
17. Применение по п.13 для приготовления лекарственных средств, предназначенных для лечения расстройств желудочно-кишечной системы.
Текст
1 Объектом настоящего изобретения являются новые соединения - селективные антагонисты NK3-рецепторов человека для приготовления лекарственных средств, полезных в лечении психических заболеваний, заболеваний психосоматического происхождения, гипертензии и, в общих чертах, любой патологии центральной или периферической нервной систем,при которой в межнейронной регуляции играют роль нейрокинин В и NK3-рецепторы, способ их получения и содержащие их в качестве активного начала фармацевтические композиции. Заболевание психосоматического происхождения означает заболевания, первопричина которых находится в центральной нервной системе, и их периферические патологические эффекты. В последние годы было проведено большое число научных исследований на тахикининах и их рецепторах. Тахикинины распространены как в центральной нервной системе, так и в периферической нервной системе. Известные к настоящему времени рецепторы тахининина подразделяют на три типа: NK1, NK2 и NK3. Вещество Р (substance P, SP) представляет собой эндогенный лиганд NK1-рецепторов, нейрокинин А (NKA) является лигандом NK2 рецепторов, и нейрокинин В (NKB) является лигандом NK3-рецепторов.NK1-, NK2- и NK3-рецепторы обнаружены у различных видов. NK3-рецепторы, например,были идентифицированы у морских свинок,крыс и обезьян (Вr. J. Pharmacol., 1990, 99, 767773; Neurochem. Int., 1991,18, 149-165); также они были идентифицированы у человека (FEBSLetters, 1992, 299 (1), 90-95). В обзоре С.А. Maggi и др. представлены исследования тахикининовых рецепторов и их антагонистов и описаны фармакологические исследования и применения для лечения людей(J. Autonomic. Pharmacol., 1993, 13, 23-93). В заявке на патент ЕР-А-0 673 928 описывается семейство соединений-антагонистовCongress Pharmacol., Milan, 1995 June 16-19). Объектом заявки на патент WO 97/10211 являются соединения формулы в которой В, R1', R2' и Ar1 имеют различные значения. Эти соединения описаны как обладающие очень высокой аффинностью к NK3 рецепторам человека. В настоящее время обнаружены соединения непептидной природы, которые обладают очень высокой аффинностью к NK3-рецепторам человека и выраженной специфичностью по отношению к вышеуказанным рецепторам плюс хорошей биодоступностью при пероральном введении. Более того, соединения по настоящему изобретению обладают хорошей фармакологической активностью у животных, явно превышающей активность (+)-N-[1-[3-[1-бензоил-3(3,4-дихлорфенил)пиперид-3-ил]пропил]-4-фенилпиперид-4-ил]-N-метилацетамида. Эти соединения могут быть использованы для приготовления лекарственных средств, полезных в лечении психических заболеваний, или заболеваний психосоматического происхождения и всех заболеваний центральной или периферической нервной систем, при которых в межнейронных регуляциях играют роль нейрокинин В и NK3-рецепторы. Под очень высокой аффинностью к NK3 рецепторам человека авторы понимают аффинность, характеризуемую константой ингибирования Ki, которая обычно не превышает 510-9 М. В исследованиях по связыванию с лигандом константу ингибирования Ki определяют из отношения Ченга-Прусова (Cheng-Prusoff) (Receptor Binding in Drug Research, eds. R.A. O'BRIEN. Marcel Dekker, New York, 1986):IC50 - концентрация, которая ингибирует связывание с лигандом на 50%. Под выраженной специфичностью по отношению к NK3-рецепторам человека авторы понимают тот факт, что константа ингибирования (Ki) для NK3-рецепторов человека обычно,по меньшей мере, в 100 раз ниже константы ингибирования (Ki) для NK2-рецепторов илиNK3-рецепторов других видов. Объектом настоящего изобретения являются соединения формулы- каждый из R1 и R2 независимо друг от друга представляет собой водород или (С 1-С 3) алкил;- R3 представляет собой водород или (С 1 С 3)алкил; а также их соли с минеральными или органическими кислотами и их сольваты. Соединения формулы (I) по изобретению состоят как из оптически чистых изомеров, так и из рацемических смесей. Могут быть образованы соли соединений формулы (I). Эти соли включают в себя соли с минеральными или органическими кислотами,дающими возможность осуществить подходящее разделение или кристаллизацию соединений формулы (I), такими как пикриновая кислота или щавелевая кислота, либо с оптически активной кислотой, например миндальной или камфорсульфоновой, либо с кислотами, которые образуют фармацевтически приемлемые соли,такие как гидрохлорид, гидробромид, сульфат,гидросульфат, дигидрофосфат, метансульфонат,малеат, фумарат, сукцинат, нафталин-2-сульфонат, гликонат, глюконат, цитрат, изотионат,бензолсульфонат, п-толуолсульфонат, бензоат. Предпочтительны фармацевтически приемлемые соли. Согласно настоящему изобретению предпочтительны соединения формулы (I), в которых каждый из R1 и R2 независимо представляет собой водород или (С 1-С 3)алкил. В особенности предпочтительны соединения, в которых каждый из R1 и R2 независимо представляет собой водород или метил. В частности, предпочтительны соединения формулы (I), в которых R3 представляет собой водород. Согласно настоящему изобретению предпочтительны оптически чистые соединения формулы (I) и, в особенности, предпочтительны(+)-изомеры в (R)-конфигурации. Таким образом, согласно одному из своих аспектов настоящее изобретение относится, в частности, к 1-бензоил-3-(3,4-дихлорфенил)-3[3-[4-(N',N'-диметилуреидо)-4-фенилпиперидин 1-ил]пропил]пиперидину, а также к его солям и сольватам. Особенно предпочтительным является (+)-изомер этого соединения. Кроме того, предпочтительными являются 1-бензоил-3-(3,4-дихлорфенил)-3-[3-[4-(N'-метилуреидо)-4-фенилпиперидин-1-ил]пропил] 4 пиперидин и 1-бензоил-3-(3,4-дихлорфенил)-3[3-[(4-уреидо)-4-фенилпиперидин-1-ил]пропил] пиперидин, в особенности предпочтительны вышеупомянутые соединения в форме (+)изомера. Объектом настоящего изобретения также является способ получения соединения формулы (I), его солей и его сольватов. Этот способ характеризуется тем, что а 1) соединение формулы в которой G представляет собой метильную,фенильную, толильную или трифторметильную группу, обрабатывают пиперидиновым производным формулыNR3CONR1R2 или группу СООН, при этом R1,R2 и R3 такие, как определены выше для (I); б 1) когда R4=СООН, полученное таким образом соединение формулы превращают в соединение формулы (I). Полученное таким образом на стадии (а 1) или на стадии (б 1) соединение возможно превращают в одну из его солей или сольватов. Стадию (а 1) способа по данному изобретению проводят в инертном растворителе, таком как N,N-диметилформамид, ацетонитрил, метиленхлорид, толуол, изопропанол или смесь этих растворителей, в присутствии или в отсутствие основания. В случае использования основания его выбирают из числа органических оснований,таких как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, либо из карбонатов или бикарбонатов щелочных металлов,таких как калия карбонат, натрия карбонат или натрия бикарбонат. В отсутствие основания реакцию осуществляют при использовании избытка соединения формулы (III) и возможно в присутствии иодида щелочного металла, такого как калия или натрия иодид. Реакция протекает при температуре между температурой окружающей среды и 100 С. На стадии (б 1), в том случае, когда использованное на стадии (а 1) данного способа соединение (III) содержит карбоксильную группу СООН,превращение в уреидогруппуNHCONR1R2 протекает классическим образом через промежуточное образование изоцианатной группы -N-С=O, с которой взаимодействует соответствующий амин NR1R2. При необходи 5 мости полученное соединение алкилируют с помощью (С 1-С 3)алкилгалогенида для того, чтобы получить соединение по изобретению, в котором R3= (С 1-С 3)алкил. Согласно одному из вариантов данного способа: а 2) соединение формулы в которой G такой, как определено выше, а Pr представляет собой защитную группу, выбранную из тритильной, тpeт-бутиоксикарбонильной или бензилоксикарбонильной группы, обрабатывают пиперидиновым производным формулыNR3CONR1R2 или группу СООН; б 2) защитную группу Рr полученного таким образом соединения формулы селективно удаляют; в 2) полученное таким образом соединение формулы обрабатывают бензоилгалогенидом; г 2) когда группа R4 = СООН, полученное таким образом соединение формулы превращают в соединение формулы (I). Полученное таким образом на стадии (в 2) или на стадии (г 2) соединение возможно превращают в одну из его солей или сольватов. Снятие защиты на стадии (б 2) может быть выполнено при использовании известных специалистам способов, например, в кислой среде. Согласно другому варианту данного способа: а 3) окисляют спирт формулы б 3) полученный таким образом альдегид формулы обрабатывают пиперидиновым производным формулы в которой R4 такой, как определено выше; в 3) когда R4= COOH, полученное таким образом соединение формулы превращают в соединение формулы (I). Полученное таким образом на стадии (б 3) или на стадии (в 3) соединение возможно превращают в одну из его солей или сольватов. В соответствии с последним вариантом способа реакцию окисления на стадии (а 3) осуществляют с использованием, например, оксалилхлорида, диметилсульфоксида и триэтиламина, в растворителе, таком как дихлорметан,при температуре между -78 С и комнатной температурой. На стадии (б 3) соединение формулы(III) подвергают взаимодействию в присутствии кислоты, такой как уксусная кислота, в спиртовом растворителе, таком как метанол, с целью образования имина in situ, который восстанавливают химически, используя, например, цианоборгидрид натрия, или каталитически, используя водород и катализатор, такой как палладий на угле либо никель Ренея Raney. Согласно еще одному варианту данного способа: а 4) соединение формулы обрабатывают в присутствии основания эфиром (4-фенилпиперидин-4-ил)карбаминовой кислоты, предпочтительно тpeт-бутиловым эфиром, формулы в которой R' = (С 1-С 6)алкил; б 4) с полученного таким образом соединения формулы 7 в 4) полученное таким образом соединение формулы сначала обрабатывают реакционноспособным производным угольной кислоты в присутствии или в отсутствие основания, затем амином формулы NR1R2 для получения желаемого соединения формулы (I). Полученное соединение возможно превращают в одну из его солей или сольватов. В этом последнем способе возможно объединение одной или более чем одной стадии. Так, например, стадии (а 4) и (б 4) могут быть объединены для непосредственного получения соединения (XI) из соединения (II). Кроме того,возможно объединение всех стадий способа по изобретению, то есть возможно проведение процесса без выделения промежуточных соединений формул (X) и (XI). Используемое на стадии (а 4) основание выбирают из числа гидроксидов щелочных металлов, таких как натрия гидроксид или калия гидроксид, либо из числа карбонатов или бикарбонатов щелочных металлов, таких как калия карбонат или калия бикарбонат. Предпочтительно используют калия карбонат. Для осуществления снятия защиты на стадии (б 4) используют сильную кислоту, такую как соляная кислота, трифторуксусная кислота или муравьиная кислота. Среди реакционноспособных производных угольной кислоты предпочтительны 1,1'-карбонилдиимидазол, фосген или п-нитрофенилхлорформиат. Особенно предпочтительным является 1,1'-карбонилдиимидазол, и в этом случае реакция протекает в отсутствие основания. При использовании фосгена или пнитрофенилхлорформиата реакцию осуществляют в присутствии органического основания,такого как N,N-диизопропилэтиламин, N-метилморфолин или, предпочтительно, триэтиламин. И наконец, в соответствии с другим вариантом производное 4-фенилпиперидина формулы подвергают взаимодействию с соединением формулы (II) для непосредственного получения соединения формулы (XI) с последующим осуществлением процедуры стадии (в 4) для получения соединения формулы (I). Соединения формулы (I) выделяют в форме свободных оснований или солей, используя классические методики. 8 Таким образом, когда соединение формулы (I) получают в форме свободного основания,то образование соли достигается посредством обработки выбранной кислотой в органическом растворителе. Соответствующую соль, которую выделяют с использованием стандартных методик, получают путем обработки свободного основания, растворенного в простом эфире, таком как, например, диэтиловый эфир, или в спирте,таком как пропан-2-ол, или в ацетоне, или в дихлорметане, или в этилацетате, раствором выбранной кислоты в одном из этих растворителей. Например, таким образом получают следующие соли: гидрохлорид, гидробромид,сульфат, гидросульфат, дигидрофосфат, метансульфонат, оксалат, малеат, фумарат, сукцинат,гликонат, глюконат, цитрат, изотионат, бензоат,нафталин-2-сульфонат, бензолсульфонат и птолуолсульфонат. По окончании реакции соединения формулы (I) могут быть выделены в форме одной из их солей, например гидрохлорида; в этом случае при необходимости свободное основание может быть получено путем нейтрализации вышеупомянутой соли с помощью минерального или органического основания, такого как натрия гидроксид или триэтиламин, либо с помощью щелочного карбоната или бикарбоната, такого как натрия или калия карбонат либо бикарбонат. Соединения формул (II), (IV) и (VII) получают, используя известные способы, в частности способы, описанные в заявках на патент ЕРА-0474561 и ЕР-А-0673928. Пиперидины формул (III) и (IX) известны или их получают в соответствии с известными способами, такими как способы, описанные в ЕР-А-0673928 или WO 96/23787. Разделение рацемических смесей соединений формулы (I) дает возможность выделения энантиомеров. Однако предпочтительным является осуществление разделения надвое рацемических смесей, начиная с промежуточного соединения, полезного для получения соединения формулы (I), как описано в заявках на патент ЕР-А-0 474 561, ЕР-А-0 512 901, ЕР-А-0 591 040 и ЕР-А-0 673 928. Особенно предпочтительно применение в качестве исходного материала соединения формулы (II), формулы (IV) или формулы (VII) в оптически чистой форме. Таким образом, согласно другим аспектам,объектом настоящего изобретения является стереоспецифический способ получения соединения формулы (I), имеющего (R)-конфигурацию,его солей и его сольватов, при котором в качестве исходного материала используют соединение формулы в которой G такой, как определено выше, в форме (+)-изомера и затем реакцию продолжают в соответствии со стадией (б 1) или же в соответствии со стадиями (а 4) - (в 4), как описано выше. Кроме того, объектом настоящего изобретения является другой стереоспецифический способ получения соединения формулы (I) в(R)-конфигурации, его солей и его сольватов,при котором в качестве исходного материала используют спирт формулы в форме (+)-изомера и затем реакцию продолжают в соответствии со стадиями (а 3) - (в 3),описанными выше. Кроме того, объектом настоящего изобретения является соединение формулы а также его соли; в рацемической форме или в оптически чистой форме как основное промежуточное соединение для получения соединения формулы(I). Вышеупомянутые соединения формулы (I) также включают в себя соединения, в которых один или более чем один атом водорода или углерода заменен его радиоактивным изотопом,например тритием или углеродом-14. Такие меченые соединения полезны для научных, метаболических или фармакокинетических исследований и биохимических тестов в качестве лигандов к рецепторам. Аффинность соединений формулы (I) к тахикининовым рецепторам оценивают in vitro с помощью нескольких биохимических тестов,используя радиоактивно меченые лиганды: 1) Связывание [125I]-BH-SP (вещество Р,меченное иодом-125 с помощью реагента Болтона-ХантераNK1 рецепторами коры головного мозга крысы, подвздошной кишки морской свинки и лимфобластов человека (D.G. Payan et al., J. Immunol.,1984, 133, 3260-3265). 2) Связывание [125I]-His-NKA с NK2 рецепторами двенадцатиперстной кишки крысы или подвздошной кишки морской свинки. 3) Связывание [125I]-His [MePhe7] NKB сNK3-рецепторами коры головного мозга крысы,коры головного мозга морской свинки и коры головного мозга песчанки, а также с клониро 003613X. Emonds-Alt et al., (Eur. J. Pharmacol., 1993,250, 403-413). Соединения по изобретению в значительной степени ингибируют связывание [125I]-His[MePhe7] NKB с NK3-рецепторами коры головного мозга морской свинки и песчанки, а также с клонированными NK3-рецепторами человека: константа ингибирования Ki в общем составляет менее чем 510-9 М. Для тех же соединений обнаружено, что константа ингибирования (Ki) для NK3-рецепторов коры головного мозга крысы обычно больше чем 10-8 М и что константа ингибирования (Ki) для NK2-рецептора двенадцатиперстной кишки крысы и NK1-рецепторов коры головного мозга крысы в большинстве случаев превышает или равна 10-7 М. Соединения по настоящему изобретению также оценивают in vivo на модельных животных. У песчанки путем введения в полосатое тело специфичного в отношении NK3-рецепторов агониста - сенктида индуцируют поведение вращения; обнаружено, что одностороннее введение сенктида в полосатое тело песчанки ведет к заметным круговым движениям в контралатеральном направлении, которые ингибируются соединениями по изобретению, вводимыми либо через брюшину, либо перорально. В этих тестах соединения по изобретению активны в дозах, варьирующих от 0,1 до 30 мг на кг. Этот результат показывает, что соединения по изобретению проходят через гематоэнцефалический барьер и что на уровне центральной нервной системы они могут блокировать действия, специфичные в отношении NK3-рецепторов. Таким образом, они могут быть использованы для лечения любой NKB-зависимой патологии центральной нервной системы, такой как психические расстройства, или любой патологии, центрально опосредованной NK3 рецептором, такой как психосоматические расстройства. На морских свинках, используя модель,описанную S. Daoui et al., в Am. J. Resp. Crit.Care Med., 1998, 158, 42-48, изучают влияние на бронхитную и кашлевую реакцию, вызванную лимонной кислотой. В этом тесте соединение из примера 10 показывает в 10 раз большую активность, чем осанетант. Соединения по настоящему изобретению обычно вводят в стандартной лекарственной форме. Вышеупомянутые единицы дозирования предпочтительно изготавливают в виде фармацевтических смесей, в которых активное начало смешано с фармацевтическим эксципиентом. В соответствии с другими аспектами настоящее изобретение охватывает фармацевтические композиции, содержащие в качестве ак 11 тивного начала соединение формулы (I) или одну из его фармацевтически приемлемых солей и сольватов. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы для лечения в суточных дозах от 0,01 до 100 мг на кг массы тела млекопитающего, предпочтительно в суточных дозах от 0,1 до 50 мг/кг. Для людей данная доза может изменяться предпочтительно от 0,5 до 4000 мг в день, особенно от 2,5 до 1000 мг, в зависимости от возраста субъекта, которому требуется лечение, или типа лечения: профилактического или терапевтического. Хотя эти дозировки представляют собой примеры усредненных состояний, в конкретных случаях могут оказаться целесообразными более высокие или более низкие дозы; такие дозировки также являются частью данного изобретения. В соответствии с обычной практикой целесообразная дозировка для каждого пациента устанавливается врачом согласно возрасту, массе тела и восприимчивости вышеупомянутого пациента. Согласно другим аспектам настоящее изобретение относится к применению соединений формулы (I) или одной из их фармацевтически приемлемых солей и сольватов для приготовления лекарственных средств, предназначенных для лечения любой патологии, в которую вовлечены нейрокинин В и NK3-рецепторы человека. Заболеваниями, для лечения которых могут быть использованы данные соединения и их фармацевтически приемлемые соли, являются,например, заболевания центральной нервной системы, такие как заболевания, связанные с дисфункцией дофаминэргической системы, например шизофрения, болезнь Паркинсона, заболевания, связанные с дисфункцией норадренэргической и серотонинэргической системы, например тревога, приступы паники, расстройства концентрации, изменения настроения, в частности депрессия, равно как и все типы эпилептических нарушений, в частности большие судорожные припадки, деменция, нейродегенеративные заболевания, и периферические заболевания, при которых участие центральной нервной системы и/или периферической нервной системы осуществляется через нейрокинин В,действующий как нейротрансмиттер или нейромодулятор, такие как соматические расстройства, связанные со стрессом, болью, мигренью,острым или хроническим воспалением, сердечно-сосудистые расстройства - гипертензия, в частности сердечная недостаточность, и ритмические расстройства, респираторные расстройства (астма, ринит, кашель, хронический обструктивный бронхит, аллергии, гиперчувствительность), расстройства желудочно-кишечной системы, такие как язва пищевода, колит, гастрит, расстройства, связанные со стрессом(кислотная секреция), рвота/тошнота (после химиотерапии или после операции, вследствие морской болезни или расстройств вестибулярного аппарата), пищевые аллергии, рвота, тошнота, морская болезнь, понос, расстройства мочевых путей (недержание, неврологический мочевой пузырь), расстройства иммунной системы(ревматоидный артрит) и, в общем, любая нейрокинин В-зависимая патология. Активные начала в фармацевтических композициях по настоящему изобретению для перорального, сублингвального, распылительного, подкожного, внутримышечного, внутривенного, трансдермального, местного или ректального введения могут быть введены животным и людям в стандартных формах введения в смесях с обычными фармацевтическими средами. Подходящие стандартные формы введения состоят из пероральных форм, таких как таблетки, желатиновые капсулы, порошки, гранулы и растворы или пероральные суспензии, из сублингвальных и трансбуккальных форм введения, аэрозолей, местных форм введения, имплантатов, подкожных, внутримышечных, внутривенных, интраназальных или внутриглазных форм введения и ректальных форм введения. Когда твердую композицию готовят в форме таблеток, к активному началу может быть добавлен увлажняющий агент, такой как лаурилсульфат натрия, микронизированный или иной, и все перемешивается с фармацевтическим носителем, таким как диоксид кремния,желатин, крахмал, лактоза, стеарат магния,тальк, аравийская камедь или им подобное. Таблетки могут быть покрыты оболочкой из сахарозы, различных полимеров или других подходящих материалов либо обработаны таким образом, что они приобретают способность к пролонгированному или замедленному действию и могут непрерывным образом высвобождать заранее определенное количество активного начала. Препарат в форме желатиновых капсул получают смешиванием активного начала с разбавителем, таким как гликоль или сложный эфир глицерина, и введением полученной смеси в мягкие и твердые желатиновые капсулы. Препарат в форме сиропа или эликсира может содержать активное начало в комбинации с подсластителем, предпочтительно бескалорийным, метилпарабен и пропилпарабен в качестве антисептика, а также интенсификатор вкуса и соответствующий краситель. Порошки или гранулы, диспергируемые в воде, могут содержать активное начало в смеси с диспергирующими агентами, увлажняющими агентами или суспендирующими агентами, такими как поливинилпирролидон, а также с подсластителями и агентами, осуществляющими коррекцию вкуса. 13 Для ректального введения используют суппозитории, которые готовят со связывающими агентами, которые растворяются при ректальной температуре, такими как масло какао или полиэтиленгликоли. Для парентерального, интраназального или внутриглазного введения используют водные суспензии, изотонические физиологические растворы или стерильные и инъецируемые растворы, которые содержат диспергирующие агенты и/или фармакологически совместимые растворяющие агенты, например пропиленгликоль или бутиленгликоль. Так, для приготовления водного инъецируемого раствора для внутривенного применения может быть использован сорастворитель,такой как спирт, например этанол, или гликоль,такой как полиэтиленгликоль или пропиленгликоль, и гидрофильное поверхностно-активное вещество, такое как Tween 80. Для приготовления инъецируемого масляного раствора для внутримышечного способа введения активное начало может быть растворено в триглицериде или глицериновом эфире. Для местного применения могут быть использованы кремы, мази и гели. Для трансдермального введения могут быть использованы пластыри в многослойных формах или в виде резервуара, в котором активное начало может находиться в спиртовом растворе. Для введения посредством распыления используют аэрозоль, содержащий, например,также триолеат сорбитана или олеиновую кислоту, а также трихлорфторметан, дихлорфторметан, дихлортетрафторэтан или любой другой биологически совместимый проталкивающий газ; также может быть использована система,содержащая активное начало одно или в комбинации с эксципиентом в форме порошка. Активное начало также может быть представлено в форме комплекса с циклодекстрином, например -, -, -циклодекстрином, 2 гидроксипропилциклодекстрином и метил-циклодекстрином. Активное начало также может быть приготовлено в форме микрокапсул или микросфер,возможно с одним или более чем одним носителем либо добавкой. Из форм с медленным высвобождением,полезных в случае длительного лечения, могут использоваться имплантаты. Они могут быть приготовлены в форме масляной суспензии или в форме суспензии микросфер в изотонической среде. В каждой единице дозирования активное начало формулы (I) присутствует в количествах,отрегулированных в соответствии с предполагаемыми суточными дозами. Обычно каждая единица дозирования подходящим образом отрегулирована в соответствии с дозировкой и 14 типом предполагаемого введения, например таблетками, капсулами и им подобным, саше,ампулами, сиропами и им подобным, каплями,таким образом, что данная единица дозирования содержит от 0,5 до 1000 мг активного начала,предпочтительно от 2,5 до 250 мг, для введения от одного до четырех раз в день. Кроме того, вышеупомянутые композиции могут содержать другие активные вещества,полезные для желаемой терапии, такие как бронходилататоры, противокашлевые средства,антигистаминные средства, противовоспалительные средства, кортикостероиды, противорвотные средства, химиотерапевтические агенты. Благодаря своей высокой аффинности кNK3-рецепторам человека и выраженной селективности, соединения по данному изобретению могут быть использованы в радиоактивно меченной форме в качестве лабораторных реагентов. Например, они позволяют охарактеризовать, идентифицировать и локализовать NK3 рецептор человека в тканевых срезах или NK3 рецептор у интактных животных с помощью авторадиографии. Кроме того, соединения по данному изобретению позволяют осуществлять селекцию или скрининг молекул по их аффинности к NK3 рецептору человека. Это осуществляется затем посредством реакции замещения радиоактивно меченного лиганда, объекта настоящего изобретения, из его комплекса с NK3-рецептором человека. При описании подготовительных стадий и примеров используются следующие сокращения: эфир: диэтиловый эфир; изоэфир: диизопропиловый эфир;AcOEt: этилацетат; Воc: трет-бутоксикарбонил; АсОН: уксусная кислота; Хлористо-водородный эфир: насыщенный раствор соляной кислоты в эфире; ВОР: бензотриазол-1-илокситрис(диметиламино)фосфония гексафтор-фосфат;DBU: 1,8-диазабицикло[5.4.0]ундец-7-ен; рН 2 буфер: буферный раствор, производимый фирмой Мерк (Merck, DARMSTADT);Eb: точка кипения; ТА: температура окружающей среды (комнатная); Н-диоксид кремния: силикагель 60 Н, производимый фирмой МеркLDA: диизопропиламид лития. Подготовительная стадия 1. 4-(N',N'Диметилуреидо)-4-фенилпиперидина п-толуолсульфонат. А) 4-Амино-1-бензил-4-фенилпиперидина дигидрохлорид. Исходным материалом является 4 ацетиламино-1-бензил-4-фенилпиперидин, полученный в соответствии с ЕР-А-0474561. 30 г 4-ацетиламино-1-бензил-4-фенилпиперидина и 58 мл концентрированной HCl в 135 мл воды кипятят с обратным холодильником в течение 48 ч. Смесь упаривают и затем переводят в EtOH 100 и толуол и еще раз упаривают. Полученную пену растворяют в 50 мл МеОН,далее оставляют кристаллизоваться, добавив 250 мл ацетона. Получают 20,5 г желаемого соединения. Б) 1-Бензил-4-(N',N'-диметилуреидо)-4 фенилпиперидина п-толуолсульфонат. 6 г полученного на предыдущей стадии соединения и 7,14 г триэтиламина смешивают при комнатной температуре в 50 мл 1,2-дихлорэтана. По каплям добавляют 1,9 г N,Nдиметилкарбамоилхлорида в 10 мл дихлорэтана и кипятят с обратным холодильником в течение 8 ч. Добавляют несколько капель триэтиламина и кипячение с обратным холодильником продолжают в течение дополнительных 3 ч. Проводят концентрирование в вакууме, остаток экстрагируют в DCM, органическую фазу промывают водой, 10%-ным раствором NaOH, водой и насыщенным раствором NaCl; высушивают над МgSO4, упаривают и остаток хроматографируют на диоксиде кремния, элюируя смесью DCM/MeOH от 99/1 (о/о) до 96/4 (о/о). Получают 1,8 г желаемого соединения. В) 4-(N',N'-Диметилуреидо)-4-фенилпиперидина п-толуолсульфонат. 1,8 г полученного на предыдущей стадии соединения растворяют в 150 мл EtOH 95. Добавляют 1,11 г п-толуолсульфокислоты и смесь гидрируют при 40 С при атмосферном давлении в присутствии 1 г 10% Pd/C. Смесь фильтруют на Celite, упаривают, дважды переводят в ацетон и упаривают. Растворяют в 25 мл ацетона,далее осаждают в 200 мл эфира для получения 1,86 г желаемого соединения в виде твердого вещества белого цвета, F = 120-122 С. Подготовительная стадия 2. 4-Фенил-4-(N'метилуреидо)пиперидина бензолсульфонат. А) 1-Бензилоксикарбонил-4-фенилпиперидин-4-карбоновая кислота. 16 3,77 г 4-фенилпиперидин-4-карбоновой кислоты, п-толуолсульфокислоту и 1,6 г гидроксида натрия растворяют в 40 мл воды и охлаждают во льду. Добавляют 1,70 г бензилхлорформиата в 10 мл ацетона и оставляют нагреваться до комнатной температуры в течение ночи. Водную фазу дважды промывают эфиром и затем подкисляют до рН 2, используя концентрированную НСl. Выпавшее в осадок твердое вещество белого цвета центрифугируют, промывают водой, далее высушивают в вакууме и растирают в смеси эфир-пентан (50/50; о/о), получая 3,05 г желаемого соединения в виде твердого вещества белого цвета, F = 142-144 С. Б) 1-Бензилоксикарбонил-4-изоцианато-4 фенилпиперидин. Готовят смесь, содержащую 50,89 г кислоты, полученной на предыдущей стадии, и 71,4 г тионилхлорида в 400 мл 1,2-дихлорэтана, и кипятят с обратным холодильником до окончания процесса выделения газа. Упаривают в вакууме,переводят в ацетон и еще раз упаривают для удаления газообразного SО 2. Полученное масло растворяют в 200 мл ацетона, охлаждают до 5 С во льду, далее при этой температуре по каплям добавляют 19,5 г азида натрия в 60 мл воды. По прошествии 2 ч при комнатной температуре ацетон упаривают, затем экстрагируют толуолом и промывают 5%-ным раствором NаНСО 3,водой и насыщенным раствором NaCl. Высушивают над Na2SO4, затем толуол упаривают до 30% начального объема и кипятят с обратным холодильником в течение 1 ч. В результате упаривания до сухого состояния получают масло оранжевого цвета, которое кристаллизуют, получая 54 г желаемого соединения. В) 1-Бензилоксикарбонил-4-(N'-метилуреидо)-4-фенилпиперидин. Растворяют 25 г соединения, полученного на предыдущей стадии, в 300 мл эфира и 300 млDCM и охлаждают во льду, затем реакционную смесь барботируют избытком газообразного метиламина. По прошествии одной ночи материал частично кристаллизуется. Упаривают до сухого состояния, повторно нагревают в AcOEt и оставляют кристаллизоваться при комнатной температуре, добавляя половину объема эфира. Получают 24 г желаемого соединения в виде кристаллов белого цвета. Г) 4-Фенил-4-(N'-метилуреидо)пиперидина бензолсульфонат. 23 г соединения с предыдущей стадии гидрируют в присутствии 9,9 г бензолсульфокислоты в 300 мл EtOH 95 с 1 г 5 % Pd/C при 40 С и атмосферном давлении. Катализатор отфильтровывают на Celite смесь упаривают до сухого состояния и остаток переводят в ацетон. Получают 22,4 г желаемого соединения, которое кристаллизуется в виде твердого вещества белого цвета, F = 227 С. Подготовительная стадия 3. 4-Фенил-4 уреидопиперидина бензолсульфонат. 17 Это соединение получают, действуя в соответствии с рабочим методом, описанным в подготовительной стадии 2, заменяя газообразный метиламин на газообразный аммиак на стадии (В), F = 235 С. Подготовительная стадия 4. 4-(N',N'Диэтилуреидо)-4-фенилпиперидина п-толуолсульфонат. А) 1-трет-Бутоксикарбонил-4-фенилпиперидин-4-карбоновая кислота. 100 г 4-фенилпиперидин-4-карбоновой кислоты и п-толуолсульфокислоту помещают в 800 мл диоксана, добавляют 150 мл воды и 109,7 г K2 СО 3. Нагревают до 60 С и затем по каплям добавляют 60,7 г (Вос)2O в 100 мл диоксана. Оставляют на 4 ч при 60 С с перемешиванием, затем кипятят с обратным холодильником в течение 1 ч. Упаривают до сухого состояния,полученное твердое вещество переводят в воду,подкисляют до рН 3 с помощью добавления 2 н.HCl, затем добавляют эфир. Отфильтровывают образовавшиеся кристаллы, промывают их водой, затем эфиром. Упаривают эфирный фильтрат до сухого состояния, переводят остаток в эфир, отфильтровывают образовавшиеся кристаллы и для высушивания объединяют их с полученными ранее. Получают 71 г желаемого соединения. Б) 4-Изоцианато-4-фенил-1-трет-бутоксикарбонилпиперидин. 25 г кислоты, полученной на предыдущей стадии, помещают в 100 мл ацетона и добавляют 10,35 г триэтиламина. Охлаждают в ледяной бане, затем по каплям добавляют 8,7 г метилхлорформиата в 30 мл ацетона и поддерживают температуру ниже 5 С. После 30 мин перемешивания в ледяной бане по каплям добавляют 10,66 г азида натрия в 30 мл воды при температуре ниже 5 С, продолжают перемешивать в течение 30 минут, затем выливают на 500 мл ледяной воды. Экстрагируют 4 раза, используя 130 мл толуола, дважды промывают органическую фазу буфером с рН 2, используя насыщенный раствор NaCl, и высушивают над MgSO4. После фильтрования фильтрат нагревают до 90 С в масляной бане в течение 1 ч. Упаривают до сухого состояния, получая 18,9 г желаемого соединения. В) 4-(N',N'-Диэтилуреидо)-4-фенил-1(трет-бутоксикарбонил)пиперидин. 6,05 г соединения с предыдущей стадии помещают в 50 мл ацетона и при комнатной температуре по каплям добавляют 1,16 г диэтиламина в 3 мл ацетона. Упаривают до сухого состояния и затем переводят остаток в эфир. Дважды промывают буфером с рН 2, используя насыщенный раствор NaCl, затем высушивают над MgSO4 и упаривают до сухого состояния. Остаток переводят в ацетон и упаривают до сухого состояния, получая 7,2 г желаемого соединения. 18 Г) 4-(N',N'-Диэтилуреидо)-4-фенилпиперидин. 7,1 г соединения с предыдущей стадии растворяют в 100 мл МеОН и добавляют 20 мл концентрированной HCl. После перемешивания в течение одной ночи при комнатной температуре упаривают до сухого состояния. Остаток переводят в 10%-ный раствор NaOH и затем трижды экстрагируют в DCM. Органическую фазу трижды промывают 10%-ным растворомNaOH, затем насыщенным раствором NaCl, высушивают над MgSO4 и упаривают до сухого состояния. Получают 5,1 г желаемого соединения. Д) 4-(N',N'-Диэтилуреидо)-4-фенилпиперидина п-толуолсульфонат. 5,1 г соединения с предыдущей стадии помещают в 10 мл ацетона и по каплям добавляют 3,52 г п-толуолсульфокислоты в 3 мл ацетона. Упаривают до сухого состояния, после чего остаток переводят в AcOEt. К образовавшейся смоле добавляют 5 мл МеОН. Упаривают до сухого состояния, затем остаток переводят вEt2O и оставляют перемешиваться на ночь. Упаривают до сухого состояния, затем высушивают в термостате, получая 7,7 г желаемого соединения, F = 95 С. Промежуточные соединения, представленные в приведенной ниже табл. 1, получают, следуя рабочему способу, описанному в разделе подготовительная стадия 4. Таблица 1 Подготовительная стадия 8. N-Метил-N-(4 фенилпиперидин-4-ил)пирролидин-1-карбоксамид. А) Бензиловый эфир 4-фенил-4(пирролидин-1-илкарбониламино)пиперидин-1 карбоновой кислоты. 5 г соединения, полученного на подготовительной стадии 2 (стадия Б), помещают в 150 мл эфира и добавляют 1,05 г пирролидина, разбавленного 25 мл эфира. Разбавляют 100 мл DCM,затем перемешивают при комнатной температуре в течение 30 мин. Упаривают до сухого состояния, затем переводят в эфир. Отфильтровывают продукт, который кристаллизуется, полу 19 чая 5,23 г желаемого соединения в виде твердого вещества белого цвета. Б) Бензиловый эфир 4-фенил-4-(пирролидин-1-илкарбонил-(N-метил)амино)пиперидин-1-карбоновой кислоты. Используя ледяную баню, растворяют 2,5 г соединения, полученного на предыдущей стадии, в 10 мл безводного THF. Добавляют 4,9 мл 1,5 М LDA в циклогексане и оставляют нагреваться до комнатной температуры. По каплям добавляют 0,8 мл метилиодида в 1 мл THF и оставляют перемешиваться в течение ночи при комнатной температуре. Упаривают, экстрагируют эфиром и органическую фазу промывают водой, 2 н. HCl, водой, затем 5 %-ным растворомNаНСО 3, водой и насыщенным раствором NaCl. Далее органическую фазу высушивают надMgSO4, фильтруют и упаривают до сухого состояния. Полученное масло хроматографируют на диоксиде кремния, элюируя DCM, затемDCM/CH3CN (98/2; о/о). Получают 1,3 г желаемого соединения. В) N-Метил-N-(4-фенилпиперидин-4-ил) пирролидин-1-карбоксамид. 1,2 г соединения, полученного на предыдущей стадии, растворяют в 25 мл ЕtOН и 25 мл диметоксиэтана, затем добавляют 0,5 г 5 %-ногоPd/C и гидрируют при 40 С под атмосферным давлением в течение 4 ч. Фильтруют через Celite, затем фильтрат упаривают до сухого состояния, получая 0,75 г желаемого соединения. Пример 1. (I), HCl: -NR3CONR1R2 =-NНСОN(СН 3)2. 3 г 1-бензоил-3-(3,4-дихлорфенил)-3-(3 метансульфонилоксипропил)пиперидина, полученного согласно WO 97/10 211, растворяют в 5 мл DMF. Добавляют 2,2 г K2 СО 3, затем 1,897 г 4-(N',N'-диметилуреидо)-4-фенилпиперидина,свободного от соли соединения с подготовительной стадии 1. Реакционную среду нагревают при перемешивании в течение 2 ч при 80 С в колбе, заткнутой пробкой с CaCl2. Упаривают до сухого состояния, экстрагируют DCM, затем органическую фазу трижды промывают насыщенным раствором NaCl. Высушивают надMgSO4, затем остаток упаривают и хроматографируют на Н-диоксиде кремния, элюируя DCM,затем смесью DCM/метанол (от 100/2 до 95/5; о/о). Остаток переводят в хлористоводородный эфир и образовавшийся осадок отделяют центрифугированием. Получают 1,318 г желаемого соединения, F = 165 С с разложением. ЯМР:(млн-1): от 1.0 до 2.7: m: 12H; от 2.7 до 4.5: m: 16H; 6.25: s: 1H; от 7.0 до 7.9: m: 13 Н; 10.1: s: 1 Н. Согласно протоколу из примера 1 соединения по изобретению, приведенные в таблице 2, получают в результате взаимодействия 4 фенил-4-уреидопиперидина в форме п-толуолсульфоната, полученного на вышеприведенных подготовительных стадиях, с 1-бензоил-3-(3,4 дихлорфенил)-3-(3-метансульфонилокси 003613 20 пропил)пиперидином, как в форме рацемата, так и в форме (+)-изомера в зависимости от желания получить соединение (I) в форме рацемата или в форме (+)-изомера. Таблица 2 ЯМР соединения из примера 2:(млн-1): от 0.8 до 2.7: m: 18H; от 2.7 до 4.4: m: 14 Н; от 5.8 до 6.2: 2s: 1 Н; от 7.0 до 7.8: m: 13 Н; 10.1: s: 1 Н. ЯМР соединения из примера 3:(млн-1): от 1.5 до 2.8: m: 16H; от 2.8 до 4.5: m: 14 Н; 6.1:s: 1 Н; от 7.0 до 7.8: m: 13 Н; 10.1: s: 1 Н. ЯМР соединения из примера 4:(млн-1): от 1.1 до 2.7: m: 18H; от 2.5 до 4.5: m: 14 Н; от 6.2 до 6.6: m: 1 Н; oт 7.0 до 7.8: 3s: 13H; 10.15: s: 1H. ЯМР соединения из примера 5:(млн-1): от 1.1 до 2.8: m: 18H; от 2.8 до 4.5: m: 14H; 6.5:s: 1H; от 7.1 до 7.9: m: 13H; 10.0: s: 1H. ЯМР соединения из примера 6:(млн-1): от 1.1 до 2.75: m: 12H; от 2.75 до 4.5: m: 18 Н; 6.65: s: 1 Н; от 7.05 до 7.8: m: 13 Н; 10.1: s: 1 Н. ЯМР соединения из примера 7:(млн-1): от 1.1 до 4.5: m: 33H; от 7.0 до 7.8: m: 13H; от 10.0 до 10.9: 2s: 1H. Пример 8. (I), HCl: -NR3CONR1R2 =-NHCONH2, (+)-изомер. А) 1-Бензоил-3-(3,4-дихлорфенил)-3-(2 формилэтил)пиперидин, (+)-изомер. 5,24 г оксалилхлорида в 75 мл DCM в атмосфере азота охлаждают до -60 С. По каплям при температуре -60 С добавляют 8,05 г DMSO в 10 мл DCM и оставляют перемешиваться в продолжение 10 мин. По каплям при температуре -60 С добавляют 13,5 г 1-бензоил-3-(3,4 дихлорфенил)-3-(3-гидроксипропил)пиперидина, (+)-изомера, полученного согласно ЕР-А-0 673 928, в 30 мл DCM и 10 мл ДМСО. После 20 мин перемешивания при температуре -50 С добавляют 20,8 г триэтиламина и оставляют нагреваться до комнатной температуры в течение 11/2 ч. Экстрагируют DCM, затем органическую 21 фазу промывают 2 н. HCl, водой, 5 %-ным раствором NаНСО 3, насыщенным раствором NaCl,высушивают над Na2SO4 и упаривают под вакуумом. Желаемый продукт кристаллизуется из смеси пентан/диэтиловый эфир, F =102-104 С.D = +36,8 (с=0,5; МеОН). Б) 1-[3-[1-Бензоил-3-[3,4-дихлорфенилпиперидин-3-ил]пропил]-4-фенилпиперидин-4 карбоновая кислота, (+)-изомер. При комнатной температуре смешивают 2,05 г 4-фенилпиперидин-4-карбоновой кислоты и 3,9 г соединения, полученного на предыдущей стадии, в 50 мл МеОН; добавляют 0,63 гNaBH3CN и 5 мл воды, затем по каплям 0,6 г АсОН. Через два часа происходит кристаллизация твердого вещества белого цвета. Образовавшиеся кристаллы отделяют центрифугированием, промывают в метаноле, затем в эфире,получая 3,8 г желаемого соединения, F = 244 С.D = +28,4 (с=0,5; DCM/MeOH: 50/50; о/о). В) 1-Бензоил-3-(3,4-дихлорфенил)-3-[3-(4 изоцианато-4-фенилпиперид-1-ил)-1-пропил] пиперидин, (+)-изомер. Смесь, содержащую 5,79 г соединения, полученного на предыдущей стадии, и 4,76 г тионилхлорида в 100 мл дихлорэтана, кипятят с обратным холодильником. Через 2 ч, когда перестает выделяться какой-либо газ, реакционную смесь упаривают, затем переводят в ацетон и упаривают под вакуумом. Остаток растворяют в 100 мл ацетона, охлаждают во льду и затем быстро добавляют 1,3 г азида натрия в 15 мл воды. По прошествии 1 ч при комнатной температуре выпаривают ацетон, затем остаток переводят в смесь толуол/DCM. Органическую фазу промывают 2 н. NaOH, насыщенным растворомDCM при 45 С, после чего толуол доводят до температуры дефлегмации в течение 30 мин. Полученный продукт непосредственно используют на следующей стадии. Г) Через 100 мл раствора в толуоле, полученного на предыдущей стадии, барботируют газообразный аммиак, охлаждают в ледяной бане. Через несколько минут смесь оставляют нагреваться до комнатной температуры, затем через 2 ч выпаривают растворитель, остаток переводят в воду, затем в AcOEt. Осадок, образующийся между двумя фазами, отфильтровывают, затем органическую фазу декантируют и промывают водой, 10 %-ным раствором K2 СО 3,водой и насыщенным раствором NaCl. Высушивают над Na2SO4 и упаривают. Образовавшуюся смолу хроматографируют на Н-диоксиде кремния, элюируя смесью DCM/MeOH в соотношении от 98/2 (о/о) до 95/5 (о/о). Полученный продукт растворяют в ацетоне, добавляют насыщенный раствор газообразного НСl в AcOEt и образовавшийся осадок отделяют центрифугированием. Получают 1,2 г желаемого соедине 003613 22 ния в виде твердого вещества белого цвета, F = 192-194 С.-NНСОN(СН 3)ОСН 3, (+)-изомер. Это соединение получают согласно способу, описанному в примере 8, путем приведения во взаимодействие на стадии Г метоксиметиламина гидрохлорида с соединением, полученным на предыдущей стадии, F = 165 С.-NНСОN(СН 3)2, (+)-изомер. 5,4 г 4-(N',N'-диметилуреидо)-4-фенилпиперидина п-толуолсульфоната, полученного на подготовительной стадии 1, и 5 г 1-бензоил-3(3,4-дихлорфенил)-3-(2-формилэтил)пиперидина, (+)-изомера, полученного в примере 8 на стадии А, растворяют в 50 мл метанола. Добавляют 0,7 мл уксусной кислоты, затем через 5 мин добавляют 0,8 г NaBH3CN в 10 мл метанола и оставляют перемешиваться при комнатной температуре в течение ночи, после чего содержимое реакционной смеси выливают на 150 мл 10%-ного раствора Nа 2 СО 3. ЭкстрагируютAcOEt, органическую фазу промывают водой,затем высушивают над МgSO4 и упаривают. Остаток подвергают хроматографии на Ндиоксиде кремния, элюируя DCM, затем смесьюDCM/MeOH (от 100/1 до 100/7; о/о). Полученный продукт переводят в хлористоводородный эфир и образовавшиеся кристаллы отделяют центрифугированием. Получают 6,38 г ожидаемого соединения.D=+22,9(с=1; МеОН). ЯМР:(млн-1): от 1.1 до 2.7: m: 12H; от 2.7 до 4.4: m: 16H; 6.25: s: 1H; от 7.0 до 7.8: m: 13H; 10.4: s: 1H. Следуя рабочему способу из примера 10,получают соединения по изобретению в (R)конфигурации, описанные в таблице 3. Таблица 3 ЯМР соединения из примера 11:(млн-1): от 1.0 до 2.6: m: 15H; от 2.65 до 4.4: m: 10 Н; 6.0:s: 1 Н; 6.85: s: 1 Н; от 7.0 до 7.8: m: 13 Н; 10.15: s: 1 Н. ЯМР соединения из примера 12:(млн-1): 1.0 до 2.7: m: 12H; от 2.5 до 4.4: m: 18H; 6.8: s: 1H; от 6.9 до 7.75: m: 13H; 10.4: s: 1H. Пример 13. (I), HCl: -NR3CONR1R2 =-NНСОN(СН 3)2, (-)-изомер. А) 1-Бензоил-3-(3,4-дихлорфенил)-3-(2 формилэтил)пиперидин, (-)-изомер. Это соединение получают из 1-бензоил-3(3,4-дихлорфенил)-3-(3-гидроксипропил)пиперидина, (-)-изомера, в соответствии со стадией А из примера 8.D=-35,8 (с=0,5; МеОН). Б) Желаемое соединение получают согласно протоколу из примера 10.D=-21,6 (с=0,5; МеОН). ЯМР соединения из примера 13:(млн-1): от 1.1 до 2.8: m: 12H; от 2.8 до 4.6: m: 16 Н; 6.3:s: 1H; от 7.1 до 7.9: m: 13H; 10.1: s: 1H. Из соединения, полученного в примере 13 на стадии А, получают соединения по изобретению в (S)-конфигурации, описанные ниже в табл. 4. Таблица 4 ЯМР соединения из примера 14:(млн-1): от 1.05 до 2.6: m: 12H; от 2.6 до 4.4: m: 10 Н; 5.5:se: 2 Н; 6.8: s: 1H; от 7.0 до 7.8: m: 13H; 9.9: s: 1H. ЯМР соединения из примера 15:(млн-1): от 1.0 до 2.6: m: 15H; от 2.75 до 4.4: m: 10 Н; 5.9:(CH3)2, (+)-изомер. А) (X): R3 = Н; R' = третВu Готовят смесь, содержащую 300 мл (+)-1 бензоил-3-(3,4-дихлорфенил)-3-(3-бензолсульфонилоксипропил)пиперидина,полученного согласно WO 97/10211, 110 мл метилизобутилкетона и 28,8 г трет-бутилового эфира (4 фенилпиперидин-4-ил)карбаминовой кислоты, в которую далее добавляют 17,28 г карбоната калия и 17 мл воды; смесь нагревают до 70 С в течение 5 ч. Смесь охлаждают до 50 С, затем добавляют 270 мл воды и оставляют охлаждаться до комнатной температуры. Декантируют органическую фазу, высушивают над сульфатом магния и концентрируют. Получают 69,82 г желаемого соединения в виде масла желтого цвета. Чистота по данным ВЭЖХ: 90%. ЯМР: 1.2 млн-1: s: 9 Н; 1.8-2.4 млн-1: m: 12H; 2.8-3.6 млн-1: m: 10 Н; 7-7.6 млн-1: m: 13 Н. 24 Б) (XI): R3 = Н Смешивают 61 г соединения с предыдущей стадии в виде раствора в 200 мл толуола и 120 мл метилизобутилкетона, затем в течение 30 мин добавляют 39 мл соляной кислоты. Смесь оставляют для выравнивания ее температуры с комнатной, затем перемешивают в течение 11/2 ч. Водную фазу экстрагируют, используя 200 млAcOEt, к которым далее добавляют 49 мл 10 н.NaOH. Проводят двойную экстракцию, используя 200 мл толуола, затем толуольную фазу дважды промывают 100 мл воды и в нее добавляют 20 мл концентрированной HCl в 100 мл воды. Водную фазу декантируют и к ней добавляют 22 мл 10 н. NaOH. Смесь экстрагируют 200 мл дихлорметана, высушивают над сульфатом магния, фильтруют и концентрируют. Получают 49,4 г желаемого соединения. Чистота по данным ВЭЖХ: 96 %. ЯМР: 0.8-1.6 млн-1: m: 12H; 2-3.6 млн-1: m: 10 Н; 7-7.6 млн-1: m: 13 Н. В) Готовят смесь, содержащую 27,5 г карбонилдиимидазола в 275 мл DCM. Ее охлаждают до -5 С и к ней в течение 45 мин добавляют раствор 44,48 г соединения с предыдущей стадии в 100 мл DCM таким образом, чтобы температура не превышала 0 С. После перемешивания в течение 2 ч в течение 20 мин при -5 С добавляют 14,57 г газообразного диметиламина. Смесь оставляют нагреваться до комнатной температуры, после чего добавляют 350 мл воды. Органическую фазу декантируют и трижды промывают 100 мл воды. Высушивают над сульфатом магния, фильтруют и концентрируют. Получают 53,6 г желаемого соединения в виде масла желтого цвета. Чистота по данным ВЭЖХ: 96,2 %. Пример 17. 0,93 г фумаровой кислоты растворяют при нагревании в 35 мл этанола и к этому раствору добавляют 5 г соединения из примера 16 в 15 мл этанола. Через 15 мин происходит выпадение в осадок соли, и смесь оставляют перемешиваться на 12 ч при комнатной температуре. Образовавшуюся соль отделяют фильтрованием, промывают 10 мл этанола. Еще раз проводят фильтрование с высушиванием под вакуумом. Получают 4,87 г желаемого соединения. Чистота по данным ВЭЖХ: 99 %. Пример 18. Смешивают раствор 5 г соединения из примера 16 в 10 мл ацетона и раствор 0,9 г янтарной кислоты в 40 мл ацетона. После перемешивания в течение 12 ч при комнатной температуре образовавшуюся соль отфильтровывают, чтобы получить 4,87 г желаемого соединения. Чистота по данным ВЭЖХ: 98,2 %. Пример 19. Смешивают раствор 8,02 г соединения из примера 16 в 25 мл ацетона и раствор 1,57 г бензойной кислоты в 15 мл ацетона. После перемешивания в течение 3 ч при комнатной температуре образовавшуюся соль отфильтровывают, высушивают под вакуумом при 50 С, получая 7,48 г желаемого соединения. Чистота по данным ВЭЖХ: 99 %. Пример 20. Готовят раствор 14,8 г соединения из примера 16 в 30 мл дихлорметана, который подкисляют до рН 1 путем добавления раствора хлористоводородного эфира. После перемешивания в течение 30 мин при комнатной температуре раствор концентрируют и переводят в 50 мл изопропилового эфира. Образовавшуюся соль отфильтровывают, высушивают под вакуумом при 50 С, получая 13,94 г желаемого соединения. Чистота по данным ВЭЖХ: 94,5 %. Пример 21. Соединение из примера 16 Прежелатинизированный крахмал Лактозы моногидрат Магния стеарат Заполнение для капсулы 3 25 мг 78 мг Сколько требуется 1,7 мг 220 мг Пример 22. Соединение из примера 16 Лактозы моногидрат Магния стеарат Очищенная вода Заполнение для капсулы 3 100 мг Сколько требуется 1,7 мг Сколько требуется 170 мг где каждый из R1 и R2 независимо друг от друга представляет собой водород или (С 1-С 3)алкил;R3 представляет собой водород; а также его соли с минеральными или органическими кислотами и его сольваты. 2. Соединение по п.1 в форме (+)-изомера в (R)-конфигурации. 3. 1-Бензоил-3-(3,4-дихлорфенил)-3-[3-[4(N',N'-диметилуреидо)-4-фенилпиперидин-1 ил]пропил]пиперидин и его соли и сольваты. 4. 1-Бензоил-3-(3,4-дихлорфенил)-3-[3-[4(N',N'-диметилуреидо)-4-фенилпиперидин-1 ил]пропил]пиперидин в форме (+)-изомера и его сольваты. 5. Способ получения соединения формулы в которой G представляет собой метильную, фенильную, толильную или трифторметильную группу, обрабатывают пиперидиновым производным формулыNR3CONR1R2 или группу СООН, при этом R1,R2 и R3 такие, как определено в п.1; б 1) когда R4= СООН, полученное таким образом соединение формулы превращают в соединение формулы (I); в 1) полученное таким образом на стадии(а 1) или на стадии (б 1) соединение возможно превращают в одну из его солей или сольватов. 6. Способ получения соединения формулы в которой G такой, как определено п.5, а Pr представляет собой защитную группу, выбранную из тритильной, трет-бутоксикарбонильной или бензилоксикарбонильной группы, обрабатывают пиперидиновым производным формулыNR3CONR1R2 или группу СООН; б 2) защитную группу Рr полученного таким образом соединения формулы селективно удаляют; в 2) полученное таким образом соединение формулы обрабатывают бензоилгалогенидом; г 2) когда группа R4 = СООН, полученное таким образом соединение формулы превращают в соединение формулы (I); д 2) полученное таким образом на стадии(в 2) или на стадии (г 2) соединение возможно превращают в одну из его солей или сольватов. 7. Способ получения соединения формулы б 3) полученный таким образом альдегид формулы 28 сначала обрабатывают реакционноспособным производным угольной кислоты в присутствии или в отсутствие основания, затем амином формулы NR1R2 для получения желаемого соединения формулы (I). 9. Способ по п.5 или 8 получения соединения формулы (I), имеющего (R)-конфигурацию,его солей и его сольватов, отличающийся тем,что в качестве исходного материала используют соединение формулы обрабатывают пиперидиновым производным формулы в которой R4 такой, как определено в п.6; в 3) когда R4 = COOH, полученное таким образом соединение формулы превращают в соединение формулы (I); г 3) полученное таким образом на стадии(б 3) или на стадии (в 3) соединение возможно превращают в одну из его солей или сольватов. 8. Способ получения соединения формулы где G представляет собой метильную, фенильную, толильную или трифторметильную группу обрабатывают в присутствии основания трет-бутиловым эфиром (4-фенилпиперидин-4 ил)карбаминовой кислоты формулы в которой R' = (С 1-С 6)алкил; б 4) с полученного таким образом соединения формулы снимают защиту, воздействуя кислотой; в 4) полученное таким образом соединение формулы в которой G такой, как определено п.5, в форме (+)-изомера. 10. Способ по п.7 получения соединения формулы (I), имеющего (R)-конфигурацию, его солей и его сольватов, отличающийся тем, что в качестве исходного материала используют спирт формулы в рацемической форме или в оптически чистой форме, а также его соли. 12. Фармацевтическая композиция, содержащая в качестве активного начала соединение по любому из пп.1-4 или одну из его фармацевтически приемлемых солей и сольватов. 13. Применение соединения формулы (I) или одной из его фармацевтически приемлемых солей и сольватов для приготовления лекарственных средств, предназначенных для лечения любой патологии, в которую вовлечены нейрокинин В и NK3-рецепторы человека. 14. Применение по п.13 для приготовления лекарственных средств, предназначенных для лечения респираторных расстройств. 15. Применение по п.13 для приготовления лекарственных средств, предназначенных для лечения заболеваний центральной нервной системы. 16. Применение по п.13 для приготовления лекарственных средств, предназначенных для лечения боли. 17. Применение по п.13 для приготовления лекарственных средств, предназначенных для лечения расстройств желудочно-кишечной системы.
МПК / Метки
МПК: A61P 25/00, C07D 211/26, A61K 31/445
Метки: уреидопиперидиновые, селективные, производные, рецепторов, человека, антагонисты
Код ссылки
<a href="https://eas.patents.su/15-3613-ureidopiperidinovye-proizvodnye-kak-selektivnye-antagonisty-nk3-receptorov-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Уреидопиперидиновые производные как селективные антагонисты nk3 – рецепторов человека</a>
Предыдущий патент: Твердая форма целекоксиба, имеющего повышенную биодоступность
Следующий патент: Фосфорнокислая соль ароматического диамина
Случайный патент: Способ лечения псориаза



















