Способ лечения псориаза
Номер патента: 22314
Опубликовано: 30.12.2015
Авторы: Вити Франческа, Барони Серджо, Беллинвия Сальваторе
Формула / Реферат
1. Способ лечения псориаза, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I
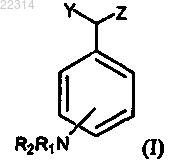
где R1 и R2 представляют собой H;
Y представляет собой Н;
Z представляет собой -CH(OR3)COOH и
R3 представляет собой H или С1-6алкил; или
его фармацевтически приемлемой соли или стереизомера.
2. Способ по п.1, где соединение вводится местно.
3. Способ по п.1, где соединение выбрано из группы, состоящей из
2-метокси-3-(4'-аминофенил)пропионовой кислоты (соединение 34);
2-этокси-3-(4'-аминофенил)пропионовой кислоты (соединение 39) и
2-гидрокси-3-(4'-аминофенил)пропионовой кислоты (соединение 21).
4. Способ по п.1, где R3 представляет собой Н.
5. Способ по п.1, где R3 представляет собой метил.
6. Способ по п.1, где R3 представляет собой метил, этил, пропил или изопропил.
Текст
Настоящее изобретение направлено на способ лечения псориаза, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I где R1 и R2 представляют собой H; Y представляет собой H; Z представляет собой -CH(OR3)COOH и R3 представляет собой H или C1-6 алкил; или его фармацевтически приемлемой соли или стереизомера.(71)(73) Заявитель и патентовладелец: НОГРА ФАРМА ЛИМИТЕД (IE) Уровень техники Было обнаружено, что аспирин оказывает хемопревентивные эффекты при раке ободочной кишки(колоректальный рак), однако механизм, за счет которого он проявляет данные эффекты, может быть комплексным. Одной мишенью активности хемопревентивных препаратов против раковых заболеваний, таких как колоректальный рак, и солидные раковые опухоли, и аденокарциномы (такие как карцинома груди, простаты, легкого и гепатоцеллюлярная карцинома) может быть исправление репликации ДНК. Безошибочность репликации ДНК является следствием точности полимеразы, ее активности по исправлению ошибок, и/или эффективность системы репарации ошибок после репликации. Неэффективность безошибочной репликации может быть ключом к развитию рака человека. Хемопревентивные препараты, которые увеличивают такую эффективность в колоректальных клетках, могут значительно снижать угрожающие жизни проявления рака и понизить смертность, обусловленную раком. Повышенное образование активных форм кислорода (АФК) является общим основополагающим механизмом многих патологий, так как было показано, что они повреждают различные компоненты клетки, включая белки, липиды и ДНК. Свободные радикалы, в особенности супероксид (O(2)-), могут генерироваться в достаточно больших количествах для преодоления эндогенных систем защитных ферментов, таких как супероксиддисмутаза (СОД). Повышенное образование АФК приводит к прооксидантному состоянию, также известному как окислительный стресс. Повышенные уровни АФК и маркеров окислительного стресса систематически обнаруживают при таких сердечно-сосудистых заболеваниях,как атеросклероз или гипертония, и также исследования, включающие модели на животных, показывают,что антиоксидантные миметики супероксиддисмутазы обладают потенциальным новым терапевтическим подходом для профилактики и лечения хронического обструктивного заболевания легких. Также хорошо подтверждена взаимосвязь между нарушенным антиоксидантным статусом, показателями окислительного повреждения и другими клиническими состояниями, такими как сахарный диабет, расстройства сердечной деятельности, такие как ишемическая болезнь, различными дегенеративными расстройствами (например, старение) и потеря волос. Свободные радикалы, такие как супероксиды,также были включены в ряд кожных патологических состояний, включая фотоповреждение, общее старение кожи, контактные дерматиты и морщинистость. Однако существует ограниченное количество лекарственных средств, пригодных для лечения, например, окислительного повреждения. Сущность изобретения Настоящее изобретение относится к способу лечения псориаза, включающему введение нуждающемуся в этом пациенту эффективного количества соединения формулы IR3 представляет собой Н или C1-6 алкил; или его фармацевтически приемлемой соли или стереизомера. Предпочтительно соединение вводится местно. В одном варианте осуществления соединение выбрано из группы, состоящей из 2-метокси-3-(4'аминофенил)пропионовой кислоты (соединение 34); 2-этокси-3-(4'-аминофенил)пропионовой кислоты(соединение 39) и 2-гидрокси-3-(4'-аминофенил)пропионовой кислоты (соединение 21). В другом варианте осуществления изобретения R3 в соединении формулы I представляет собой Н. В еще одном варианте осуществления изобретения R3 в соединении формулы I представляет собой метил. В следующем варианте осуществления изобретения R3 в соединении формулы I представляет собой метил, этил, пропил или изопропил. Псориаз может быть отнесен к группе аутоиммунных нарушении и к группе дерматологических патологических состояний. Данные и другие аспекты и преимущества настоящего изобретения будут понятны при рассмотрении следующих фигур, подробного описания и формулы изобретения. Краткое описание чертежей Изобретение может быть понято более полно на основании следующих графических материалов. На фиг. 1 отображены свойства описанных здесь соединений по акцептированию супероксидных радикалов. На фиг. 2 отображены свойства описанных здесь соединений по акцептированию супероксидных радикалов. На фиг. 3 отображены изменения в скорости мутаций клеток НСТ 116 А 2.1 при инкубации с различными концентрациями (мМ) описанных здесь соединений. На фиг. 4 отображены изменения в скорости мутаций клеток НСТ 116 А 2.1 при инкубации с различными концентрациями (мМ) описанных здесь соединений. На фиг. 5 отображены изменения клеточного цикла в клетках НСТ 116 и НТ 29 при обработке описанным здесь соединением. На фиг. 6 отображен эффект на клеточную пролиферацию в клетках НСТ 116, НСТ 116+chr3, HT29 и Lovo с использованием описанного здесь соединения. Подробное описание В частности, изобретение основано на открытии того, что определенные соединения, описанные здесь, обладают потенциалом акцептирования супероксидных радикалов и/или обладают способностью улучшать правильность репликации в раковых клетках, например в колоректальных раковых клетках. То есть возможность лечения псориаза соединениями формулы I может быть обусловлена их способностью в снижении свободных радикалов кислорода у пациента. Перед дальнейшим раскрытием настоящего изобретения здесь приведены некоторые термины, использованные в описании, примерах и прилагаемой формуле изобретения. Данные определения следует рассматривать в свете остального описания и понимать с точки зрения специалиста в области техники. Если не указано иное, все используемые здесь технические и научные термины имеют такое же значение, которое знакомо специалисту в данной области техники."Пациент", "субъект" или "организм хозяина", который должен быть подвергнут обработке предусмотренным способом, могут означать как человека, так и не относящееся к человеку животное, например мелкое млекопитающее, такое как мышь или крыса, и включая лошадь, корову, собаку, кошку и т.д. Термин "терапевтическое средство" является принятым в данной области техники и означает любое химическое вещество, которое является биологически, физиологически или фармакологически активным веществом, которое действует локально и/или системно у субъекта. Примеры терапевтических средств,также называемых "лекарства", описаны в хорошо известных литературных источниках, таких как MerckIndex, Настольном справочнике врача и The Pharmacological Basis of Therapeutics, и они включают, без ограничения, лекарственные средства; витамины; минеральные добавки; вещества, используемые для терапии, профилактики, диагностики, лечения или облегчения заболевания или расстройства; вещества,которые действуют на структуру или функцию организма; или пролекарства, которые становятся биологически активными или более активными после того, как они помещены в физиологическую среду. Термин "терапевтический эффект" является принятым в данной области техники и означает локальный и/или системный эффект у животного, в частности млекопитающих, и более конкретно людей,вызванный фармакологически активным веществом. Таким образом, термин означает любое вещество,предназначенное для использования для диагностики, лечения, облегчения, терапии или профилактики заболевания или улучшения желаемого физического или умственного развития и/или состояний у животного или человека. Фраза "терапевтически эффективное количество" означает такое количество данного вещества, которое приводит к некоторому желаемому локальному или системному эффекту при приемлемом соотношении выгода/риск, применительно к любому лечению. Терапевтически эффективное количество такого вещества будет варьироваться в зависимости от субъекта и состояния заболевания, которое необходимо вылечить, веса и возраста субъекта, тяжести состояния болезни, способа приема и т.п., что может быть легко определено специалистом в данной области техники. Например, некоторые композиции настоящего изобретения могут быть введены в достаточном количестве для обеспечения эффекта при приемлемом соотношении выгода/риск, применительно к такому лечению. Термин "терапия" является принятым в данной области техники и означает лечение, а также улучшение по меньшей мере одного симптома любого патологического состояния или заболевания. Термин "алкил" является принятым в данной области техники и включает насыщенные алифатические группы, включая неразветвленные алкильные группы и разветвленные алкильные группы. В некоторых вариантах осуществления неразветвленные или разветвленные алкилы имеют около 30 или менее атомов углерода в главной цепи (например, C1-C30 для неразветвленной цепи, C3-C30 для разветвленной цепи), и, в качестве альтернативы, около 20 или менее, например, от 1 до 6 атомов углерода. Термин "алкил" также определен как включающий алкилы, замещенные галогенами. Термины орто, мета и пара являются принятыми в данной области техники и означают 1,2-, 1,3- и 1,4-дизамещенные бензолы соответственно. Например, названия 1,2-диметилбензол и ортодиметилбензол являются синонимами. Некоторые соединения, используемые в настоящем изобретении, могут существовать в конкретных геометрических или стереоизомерных формах. Кроме этого, соединения настоящего изобретения также могут быть оптически активными. Настоящее изобретение предусматривает все такие соединения, включая цис-и транс-изомеры, R- и S-энантиомеры, диастереомеры, (D)-изомеры, (L)-изомеры, их рацемические смеси и другие их смеси, попадающие в объем изобретения. Дополнительные асимметрические атомы углерода могут присутствовать в заместителе, таком как алкильная группа. Все такие изомеры, а также их смеси, должны быть включены в настоящее изобретение. Следует понимать, что "замещение" или "замещен" включает предполагаемое условие, что такое замещение соответствует допустимой валентности замещаемого атома и заместителя, и что замещение приводит к стабильному соединению, например, которое самопроизвольно не подвергается превращению, такому как перегруппировка, циклизация, элиминирование или другой реакции. Для целей настоящего изобретения, химические элементы определены в соответствии с Периодической таблицей элементов, версия CAS, Handbook of Chemistry and Physics, 67th Ed., 1986-87, на внутренней обложке. Термин "фармацевтически приемлемая соль" является принятым в данной области техники и означает относительно нетоксические кислото-аддитивные соли неорганических и органических кислот соединений, например, включая такие соединения, которые используются в настоящем изобретении при включении их в композиции. Термин "фармацевтически приемлемый носитель" является принятым в данной области техники и означает фармацевтически приемлемый материал, композицию или среду, такие как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или материал для инкапсулирования, участвующий в переносе или транспортировке любой предусматриваемой композиции или ее компонента от одного органа или части тела к другому органу или части тела. Каждый носитель должен быть приемлемым, в смысле совместимым с предусматриваемой композицией и ее компонентами и не наносить ущерб пациенту. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошковая трагантовая камедь; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как кокосовое масло и воски для суппозитория; (9) масла, такие как арахисовое масло, хлопковое масло, масло подсолнечника, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этилалурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфатного буфера и (21) другие нетоксические приемлемые вещества, применяемые в фармацевтических композициях. Соединения Соединения, предусматриваемые для использования в способе настоящего изобретения, включают соединения, представленные формулой I, или их фармацевтически приемлемые соли или стереоизомеры:R3 представляет собой H или С 1-6 алкил. В одном варианте осуществления соединение выбрано из группы, состоящей из 2-метокси-3-(4'-аминофенил)пропионовой кислоты (соединение 34); 2-этокси-3-(4'аминофенил)пропионовой кислоты (соединение 39) и 2-гидрокси-3-(4'-аминофенил)пропионовой кислоты (соединение 21). В другом варианте осуществления изобретения R3 в соединении формулы I представляет собой Н. В еще одном варианте осуществления изобретения R3 в соединении формулы I представляет собой метил. В следующем варианте осуществления изобретения R3 в соединении формулы I представляет собой метил, этил, пропил или изопропил. В других вариантах осуществления остаток NR1R2 может быть в 4' положении или может быть в 3' положении. Типичные предусматриваемые здесь соединения включают или их фармацевтически приемлемые соли. Предусматриваемые здесь соединения включают рацемические смеси и стереоизомеры соединений,например: -2-метокси-3-(4'-аминофенил)пропионовая кислота (соединение 34) "34" (рацемическая форма); -2-этокси-3-(4'-аминофенил)пропионовая кислота (соединение 39). Например, соединения, используемые в способе настоящего изобретения, могут быть энантиомерами следующих рацемических смесей:(-)-2-R-метокси-3-(4-аминофенил)пропионовая кислота (соединение 34). Другие рацемические смеси предусматриваемых соединений включают, например, -2-гидрокси 3-(4'-аминофенил)пропионовую кислоту (соединение 21). Способы получения предусматриваемых соединений, например, могут быть найдены в WO 2007/010516 и WO 2007/010514, каждый из которых настоящим полностью включен посредством ссылки. Терапевтическое применение В настоящем изобретении предусматривается способ лечения пациента, страдающего от заболевания, при котором полезным является снижение свободных радикалов кислорода, например, такое аутоиммунное нарушение и дерматологическое патологическое состояние, как псориаз, включающий введение описанного здесь соединения формулы I. Например, предусматривается способ лечения псориаза, где способ включает введение эффективного количества композиции, содержащей описанное соединение формулы I (например, соединения 21,34 или 39). Такая композиция может быть введена местно. Окислительный стресс может быть, например,результатом. В основном, терапевтически эффективное количество активного компонента будет находиться в диапазоне примерно от 0,1 до примерно 100 мг/кг, необязательно от примерно 1 до примерно 100 мг/кг, необязательно примерно от 1 до 10 мг/кг. Вводимое количество будет зависеть от переменных факторов, таких как тип и степень заболевания, или симптомы, которые необходимо излечить, общее состояние здоровья конкретного пациента, относительная биологическая активность связывающегося белка, к которому осуществляется доставка, состав связывающегося белка, наличие и вид вспомогательного вещества в композиции, и способ введения. Начальная введенная доза может быть увеличена выше верхней границы для быстрого достижения необходимой концентрации в крови или ткани, или начальная доза может быть меньше оптимальной, и суточная доза может постепенно увеличиваться в течение курса лечения в зависимости от конкретной ситуации. Доза для человека может быть оптимизирована,например, в ходе обычного исследования с увеличением дозы фазы I, начиная с 0,5 до 20 мг/кг. Частота введения дозы может изменяться в зависимости от таких факторов, как способ введения, количество дозировки и состояния заболевания, которое необходимо вылечить. Типичные частоты введения дозы включают один раз в день, один раз в неделю и один раз в две недели. Предусматриваются препараты или композиции, содержащие описанное соединение, и они обычно содержат соединение и фармацевтически приемлемый носитель. Композиции, содержащие соединения формулы I, могут быть введены различными способами, в зависимости от их предполагаемого применения, что известно в области техники. Например, если композиции предназначены для перорального введения, то они могут быть получены в виде таблеток, капсул,гранул, порошков или сиропов. Предпочтительно композиции могут быть введены местно. С другой стороны, композиции могут быть введены парентерально в виде инъекций (внутривенно, внутримышечно или подкожно), препаратов для капельного вливания или суппозиториев. Такие композиции могут быть получены традиционными способами, и, при необходимости, композиции могут быть смешаны с любыми обычными добавками, такими как эксципиент, связующее вещество, дезинтегрирующий агент, лубрикант, корригирующее вещество, солюбилизирующий компонент, суспендирующая добавка, эмульгатор или покрытие. В композициях рассматриваемого изобретения в полученных препаратах могут присутствовать ув-4 022314 лажняющие вещества, эмульгаторы и лубриканты, такие как лаурилсульфат натрия и стеарат магния, а также окрашивающие добавки, регуляторы высвобождения, покрытия, подсластители, вкусовые и ароматизирующие добавки, консерванты и антиоксиданты. Рассматриваемые композиции могут быть пригодны для перорального, назального, местного(включая буккальное и сублингвальное), ректального, вагинального, аэрозольного и/или парентерального введения. Композиции могут удобно находиться в виде единичной дозированной формы и могут быть получены любыми способами, хорошо известными в области фармацевтики. Количество композиции,которое может быть объединено с веществом носителя для получения единичной дозы, изменяется в зависимости от субъекта, которого необходимо вылечить, и конкретного способа введения. Способы получения таких препаратов включают стадию смешения композиций рассматриваемого изобретения с носителем и, необязательно, одним или несколькими вспомогательными компонентами. В общем случае, препараты получают за счет однородного и тщательного смешения агентов с жидкими носителями, или мелкодисперсными твердыми носителями, или обоими носителями, и затем, при необходимости, за счет придания формы продукту. Препараты, пригодные для перорального введения, могут быть в форме капсул, облаток, пилюлей,таблеток, пастилок (с использованием ароматизированной основы, обычно сахарозы и камеди или трагаканта), порошков, гранул, или в виде растворов или суспензий в водной или неводной жидкости, или в виде эмульсии типа "масло в воде" или "вода в масле", или в виде эликсира или сиропа, или в виде пастилок (с использованием инертной основы, такой как желатин и глицерин или сахароза и камель), каждая из которых содержит заранее определенное количество используемой в них композиции в качестве активного компонента. Композиции настоящего изобретения также могут быть введены в виде болюса,электуария или пасты. В твердых дозированных формах для перорального введения (капсулы, таблетки, пилюли, таблетки с пленочным покрытием, таблетки с сахарным покрытием, порошки, гранулы и т.п.), используемая композиция смешивается с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или фосфат дикальция, и/или любыми компонентами из следующих: (1) наполнители или разбавители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или салициловая кислота; (2) связывающие вещества, такие, например, как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь; (3) увлажнители, такие как глицерин; (4) дезинтегрирующие агенты,такие как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) замедлители схватывания раствора, такие как парафин; (6) ускорители всасывания, такие как четвертичные аммонийные соединения; (7) смачивающие агенты, например, такие как, ацетиловый спирт и глицеролмоностеарат; (8) абсорбенты, такие как каолин и бентонитовая глина; (9) лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и (10) окрашивающие агенты. В случае капсул, таблеток и пилюль композиции также могут содержать буферные вещества. Твердые композиции похожего типа также могут использоваться в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п. Препараты и композиции могут включать микронизированные кристаллы описанных соединений. Микронизация может быть проведена отдельно на кристаллах соединений или на смеси кристаллов и части или всех фармацевтических эксципиентов или носителей. Средний размер частиц микронизированных кристаллов описанных соединений, например, может быть примерно от 5 до примерно 200 мкм или примерно от 10 до примерно 110 мкм. Таблетка может быть получена прессованием или формованием, необязательно, с одним или несколькими вспомогательными компонентами. Прессованные таблетки могут быть получены с использованием связывающего вещества (например, желатин или гидроксипропилметилцеллюлоза), лубриканта,инертного разбавителя, консерванта, дезинтегранта (например, натрия гликолят крахмала или поперечно-сшитая натрийкарбоксиметилцеллюлоза), поверхностно-активного или диспергирующего агента. Формованные таблетки могут быть получены формованием смеси используемой композиции, смоченной инертным жидким разбавителем, в подходящей машине. Таблетки и другие твердые дозированные формы, такие как таблетки с пленочным покрытием, таблетки с сахарным покрытием, капсулы, пилюли и гранулы, необязательно, могут быть сделаны или получены с покрытиями или оболочками, такими как энтеросолюбильное покрытие, и другими покрытиями, хорошо известными в области фармацевтических композиций. Жидкая дозированная форма для перорального введения включает фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо используемой композиции,жидкие дозированные формы могут содержать обычно используемые в области техники инертные разбавители, такие, например, как вода или другие растворители, солюбилизирующие средства и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, пшеничных зародышей, оливковое, касторовое и кунжутные масла), глицерин, тетрагидрофурило-5 022314 вый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана, циклодекстрины и их смеси. Помимо используемой композиции суспензии могут содержать суспендирующие агенты, такие, например, как этоксилированые изостеариловые спирты, полиоксиэтиленсорбитол и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси. Препараты для ректального или вагинального введения могут присутствовать в виде суппозиториев, которые могут быть получены за счет смешения используемой композиции с одним или несколькими подходящими нераздражающими эксципиентами или носителями, например, включающими кокосовое масло, полиэтиленгликоль, суппозиторный воск или салицилат, и которые являются твердыми при комнатной температуре, но жидкими при температуре тела и следовательно будут плавиться в полости организма и высвобождать активный компонент. Препараты, которые пригодны для вагинального введения,также включают пессарии, тампоны, крема, гели, пасты, пены или спреи, содержащие такие носители,которые известны как подходящие в данной области техники. Дозированные формы для трансдермального или местного введения используемой композиции включают порошки, спреи, мази, пасты, крема, лосьоны, гели, растворы, пластыри и средства для ингаляций. Активный компонент может быть смешан при стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут потребоваться. Мази, пасты, кремы и гели, помимо используемой композиции, могут содержать эксципиенты, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка, или их смеси. Порошки и спреи помимо используемой композиции могут содержать эксципиенты, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси данных веществ. Дополнительно спреи могут содержать различные пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Помимо этого, композиции и соединения настоящего изобретения могут быть введены с помощью аэрозоля. Это осуществимо за счет получения водного аэрозоля, липосомальной композиции или твердых частиц, содержащих соединение. Могут быть использованы неводные (например, фторуглеродный пропеллент) суспензии. Могут быть использованы ультразвуковые ингаляторы, так как они минимизируют механическое воздействие на агент, что может приводить к деградации содержащихся в используемых композициях соединений. Обычно водный аэрозоль получают за счет смешения водного раствора или суспензии используемой композиции вместе с традиционным фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы варьируются в зависимости от требований конкретной используемой композиции, но обычно включают неионные поверхностно-активные вещества (твины, плюроники или полиэтиленгликоли), нетоксичные белки, такие как сывороточный альбумин, сложные эфиры сорбитана,олеиновая кислота, лецитин, аминокислоты, такие как глицин, буферные вещества, соли, сахара или сахарные спирты. Аэрозоли в основном получают из изотонических растворов. Фармацевтические композиции настоящего изобретения, пригодные для парэнтерального введения,содержат используемую композицию в комбинации с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями, или стерильные порошки, которые могут быть преобразованы в стерильные растворы или дисперсии для инъекций непосредственно перед использованием, которые могут содержать антиоксиданты, буферные вещества, бактериостатические средства, растворы, которые делают состав изотоничным крови предполагаемого пациента, или суспендирующие или загущающие компоненты. Примеры подходящих водных и неводных носителей, которые могут быть использованы в фармацевтических композициях, используемых в настоящем изобретении, включают воду, этанол, полиолы(такие как глицерин, пропиленгликоль, полиэтиленгликоль, и т.п.), и их подходящие смеси, растительные масла, такие как оливковое масло, и органические сложные эфиры для инъекций, такие как этилолеат и циклодекстрины. Подходящая текучесть может быть выдержана, например, за счет использования веществ для покрытия, таких как лецитин, за счет выдерживания требуемого размера частиц в случае дисперсий, и за счет использования поверхностно-активных соединений. Эффективность лечения рассматриваемыми композициями может быть определена различными способами, известными специалисту в данной области техники. Примеры Пример 1. Акцептирование супероксидных радикалов Соединения 17 и 39 исследуют на их способность к акцентированию супероксидных радикалов (О 2-),высвобожденных активированными нейтрофилами (ПМН) с использованием стандартизированного анализа O2-. Вкратце, 1 106 свежевыделенных нейтрофилов активируют с форболмиристатацетатом (РМА) в отсутствие или в присутствии соединений (каждое 5 мМ). Через 30 мин после активации измеряют высвобождение О 2- с помощью усиленной люцигенином хемилюминесценции на люминометре. В качестве контроля используют 5-ASA (5-аминосалициловую кислоту) и супероксиддисмутазу (СОД). Эксперименты проводят трижды. При 5 мМ соединение 17 действует как сильный акцептор супероксидных радикалов (5% контроля),являясь таким же по активности, как смесь супероксиддисмутазы и каталазы. Соединение 39 имеет аналогичные акцепторные свойства, как и 5-ASA, как показано на фиг. 1. Пример 2. Акцептиронание супероксидных радикалов Соединения 14 и 34 исследуют на их способность к акцентированию супероксидных радикалов (O2-),высвобожденных активированными нейтрофилами (ПМН) с использованием стандартизированного анализаO2-, аналогично примеру 1. В качестве доноров О 2- используют активированные нейтрофилы (ПМН). Вкратце, 1 106 свежевыделенных нейтрофилов активируют со 100 нМ форболмиристатацетата (РМА). Высвобождение измеряют через каждые 15 мин в течение 90-минутного периода с помощью усиленной люцигенином хемилюминесценции на люминометре. В качестве контроля используют как неактивированные ПМН, так и активированные супероксиддисмутазой ПМН (2000 ед/мл СОД). Эксперименты проводят трижды. При исследуемых концентрациях оба соединения проявляют значительные акцепторные свойства. На фиг. 2 А отражены результаты для соединения 14, и на фиг. 2 В отражены результаты для соединения 34. Пример 3. Правильность репликации Для исследования, будут ли соединения улучшать правильность репликации, используют анализ,основанный на усиленном зеленом флуоресцентном белке, для определения изменений в скорости мутаций при инкубации с различными концентрациями соединений. Вкратце, 1 103 EGFP-негативных клеток НСТ 116 А 2. 1 сортируют в 24-луночные планшеты FACS Aria. Через 24 ч клетки обрабатывают соединениями в течение 7 дней, и фракцию мутантных форм измеряют с помощью проточной цитометрии. Соединение 17 влияет на клеточный рост уже при низких концентрациях, начиная от 1,25 мМ. Неожиданно, соединение 17 приводит к 50% снижению промежуточных мутантных клеток (популяция M1) при концентрации 5 мМ. Более того, соединение 17 приводит примерно к 30% снижению дефинитивных мутантных клеток (популяция М 2) при концентрация в диапазоне от 2,5 до 5 мМ (фиг. 3 А). Фиг. 3 В показывает, что соединение 28 не оказывает значительных изменений при концентрациях до 1 мМ. Соединение 39 снижает клеточный рост при 20 мМ, но не снижает фракцию мутантных формM1 или М 2. Наоборот, обработка 20 мМ соединения 39 приводит к увеличению M1 (фиг. 3 С), по сравнению с эффектом аспирина. Среди исследованных соединений 17, 28 и 39, соединение 17 проявляет положительные эффекты на правильность репликации клеток НСТ 116, скрывая (примерно) 13 повторов. Данный эффект наблюдается не только в промежуточной фракции мутантных клеток M1, но также и в дефинитивных мутантных клетках М 2. Соединение 17 также является сильнейшим акцептором. По-видимому, такое снижение M1 или М 2 не зависит от ареста в S-фазе (как это наблюдается с 5-ASA; Luctani G, Gastroenterology 2007). Пример 4. Для определения различий в скорости мутаций при инкубации с различными концентрациями описанных соединений, и для исследования, будут ли соединения улучшать правильность репликации, используют аналогичный примеру 3 анализ, основанный на усиленном зеленом флуоресцентном белке. Для определения в скорости мутаций при (примерно) 13 повторах при инкубации с различными концентрациями соединений используют анализ, основанный на усиленном зеленом флуоресцентном белке. Вкратце, 1103 EGFP-негативных клеток НСТ 116 А 2.1 сортируют в 24-луночные планшеты FACS Aria. Через 24 ч клетки обрабатывают соединениями в течение 7 дней. Общее количество клеток (с) и фракцию EGFP-положительных клеток (фракция мутантных клеток (MF измеряют с помощью; проточной цитометрии. Скорость мутации (m/(CA)13/поколение (gen) оценивают по m=MF/(gen+1) и gen=log2(с/1000 эффективность клонирования). Различают промежуточные мутантные (M1) и дефинитивные мутантные (М 2) клетки. Как показано на фиг. 4, соединение 39 значительно снижает число клеток M1, что отражает популяцию клеток непосредственно после полимеразной ошибки в MMR-дефицитных клетках НСТ 116, начиная с концентрации 10 до 40 мМ (р 0,05). Также имеется значительное снижение в постоянной мутантной популяции М 2 при 40 мМ. Пример 5. Анализ клеточного цикла Для анализа изменения клеточного цикла клеток НСТ 116 и НТ 29 применяют окрашивание БДУ при 72-часовой обработке соединением 39. Данные отражают средние значения 3 независимых экспериментов ( означает р 0,05 по сравнению с контролем). Соединение 39 (10-40 мМ) не вызывает значительного изменения в распределении клеточной популяции по фазам митотического цикла клеток НСТ 116. Клетки НТ 29 показали умеренное увеличение популяции в фазе G2 (изменяясь от 6,7 до 13,6%, р 0,05), что сопровождалось снижением популяции в фазе Пример 6. Пролиферация клеток Изучают ингибирующий эффект соединения 34 на клеточную пролиферацию с использованием МТТ-теста. Вкратце, 5103 клетки НСТ 116, HCT116+chr3, HT29 и Lovo инкубируют в течение 72 ч в 96 луночных планшетах с различными концентрациями. Соединение 34 растворимо в IMDM. Готовят исходные растворы по 100 мМ и рН доводят до 7,4. На фиг. 6 показано, что соединение 34 имеет IC50 при 30-40 мМ в зависимости от типа клеток. Эквиваленты Изобретение может быть осуществлено в других конкретных формах без отклонения от его сущности или существенных особенностей. Следовательно, предшествующие варианты осуществления во всех отношениях должны рассматриваться как пояснительные, а не как ограничивающие описанное здесь изобретение. Таким образом, объем изобретения указан с помощью прилагаемой формулой изобретения,а не предшествующего описания, и все изменения, которые подпадают под значение и диапазон, эквивалентные формуле изобретения, должны быть включены здесь. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения псориаза, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы IR3 представляет собой H или С 1-6 алкил; или его фармацевтически приемлемой соли или стереизомера. 2. Способ по п.1, где соединение вводится местно. 3. Способ по п.1, где соединение выбрано из группы, состоящей из 2-метокси-3-(4'-аминофенил)пропионовой кислоты (соединение 34); 2-этокси-3-(4'-аминофенил)пропионовой кислоты (соединение 39) и 2-гидрокси-3-(4'-аминофенил)пропионовой кислоты (соединение 21). 4. Способ по п.1, где R3 представляет собой Н. 5. Способ по п.1, где R3 представляет собой метил. 6. Способ по п.1, где R3 представляет собой метил, этил, пропил или изопропил.
МПК / Метки
МПК: A61P 17/00, A61P 9/10, A61K 31/136, A61P 25/28, A61K 31/196, A61K 31/343, A61K 31/357, A61K 31/166, A61P 35/00, A61P 25/16
Метки: псориаза, лечения, способ
Код ссылки
<a href="https://eas.patents.su/11-22314-sposob-lecheniya-psoriaza.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения псориаза</a>
Предыдущий патент: Концентрированный шампунь
Следующий патент: Кольцевой световод для осветителя и оптический сканер
Случайный патент: Соединения, специфичные к меланокортиновым рецепторам












