Антагонисты рецепторов возбудительной аминокислоты
Номер патента: 1769
Опубликовано: 27.08.2001
Авторы: Домингес-Фернандес Кармен, Монн Джеймс А., Вэлли Мэттью Дж.
Формула / Реферат
1. Соединение формулы
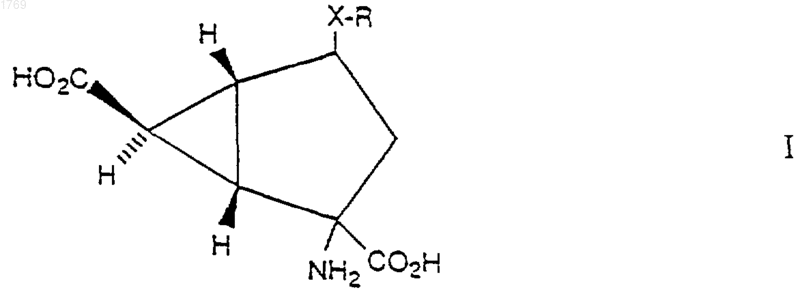
где Х представляет связь, S, SO или SO2; и R представляет С1-6-алкильную группу; фенильную группу, которая не замещена или замещена одним или двумя заместителями, выбранными независимо из галогена, C1-4-алкильной и C1-4-алкоксигруппы; или фенил (C1-4)-алкильную или дифенил (C1-4)-алкильную группу, в которой фенил может быть не замещен или замещен одним или двумя заместителями, выбранными независимо из атома галогена, C1-4-алкильной и C1-4-алкоксигруппы,
или его нетоксичные метаболически лабильные эфиры или амиды или его фармацевтически приемлемые соли.
2. Соединение по п.1, в котором R представляет 2-нафтил; фенил, который не замещен или замещен одним или двумя заместителями, выбранными независимо из галогена, С1-4-алкильной или C1-4-алкоксигруппы; пиримидильную группу; бензильную группу или 2-тиофенилметильную группу.
3. Соединение по п.1, в котором R представляет 2-нафтил, фенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 3,4-дифторфенил, пентафторфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 3,4-дихлорфенил, 2,5-дихлорфенил, 2-бромфенил, 3-бромфенил, 4-бромфенил, 2-метилфенил, 3-метилфенил, 4-метилфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 3-трифторметилфенил и 4-трифторметилфенил.
4. Соединение по любому из пп.1-3, которое имеет стереохимию, представленную ниже
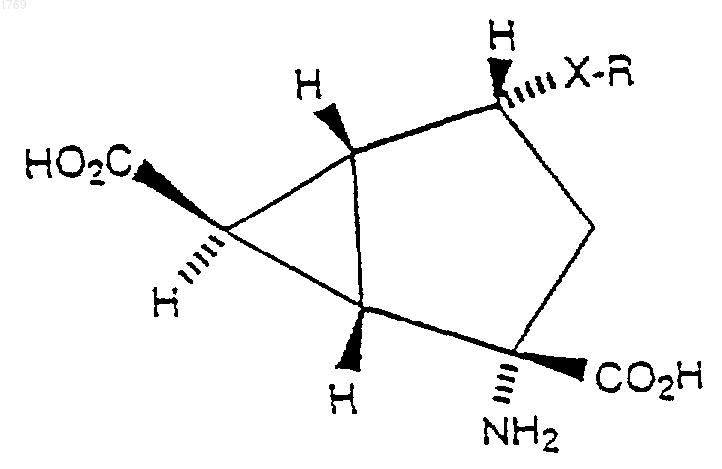
5. Соединение по любому из пп.1-4, в котором Х представляет S.
6. Соединение по любому из пп.1-4, в котором Х представляет связь.
7. Способ получения соединения формулы I, который включает:
гидролиз соединения формулы
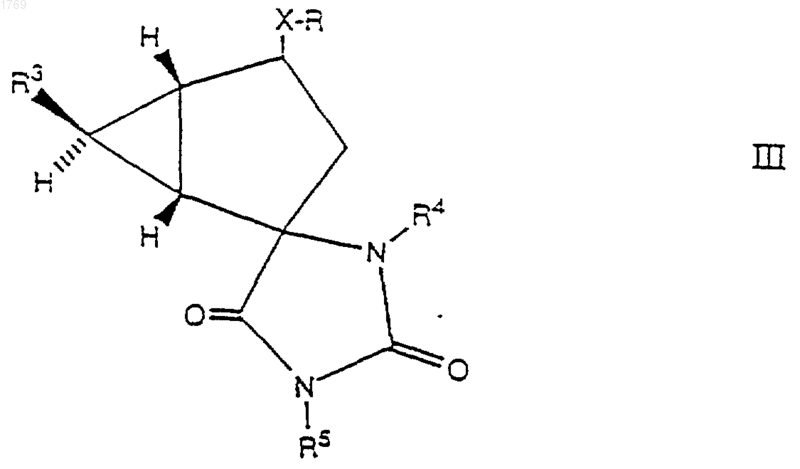
в которой R3 представляет карбоксильную группу или этерифицированную карбоксильную группу, и R4 и R5, каждый независимо, представляет атом водорода, С2-6-алканоильную группу, С1-4-алкильную группу, С3-4-алкенильную группу или фенил (С1-4)-алкильную группу, в которой фенил не замещен или замещен галогеном, С1-4-алкилом или С1-4-алкоксигруппой, или его соли; после чего, если необходимо и/или желательно,
(I) растворение соединения формулы I;
(II) превращение соединения формулы I в его нетоксичный метаболически лабильный сложный эфир или амид и/или
(III) превращение соединения формулы I или его нетоксичного метаболически лабильного эфира или амида и его фармацевтически приемлемую соль.
8. Фармацевтический препарат, который включает соединение по п.1 и фармацевтически приемлемый носитель, разбавитель или эксципиент.
9. Применение соединения по любому из пп.1-6 для производства медицинских средств для использования в качестве модуляторов одной или нескольких функций рецепторов метаботропного глутамата.
Текст
1 В центральной нервной системе (ЦНС) млекопитающих передача нервных импульсов контролируется путем взаимодействия между нейротрасмиттером, который высвобождается передающей нервной клеткой (посылающим нейроном), и поверхностным рецептором на принимающей нервной клетке (принимающем нейроне), что вызывает возбуждение принимающей нервной клетки. L-Глутамат, который является наиболее обильным трансмиттером в ЦНС, опосредует основной путь возбуждения у млекопитающих и называется возбудительной аминокислотой (ВАК). Рецепторы, которые реагируют на глутамат, называются рецепторами возбудительной аминокислоты (ВАК-рецепторами) (См. Watkins and Evans, Ann. Rev.and Honore, Trans. Pharm. Sci., 11, 25. 1990). Возбудительные аминокислоты имеют огромное физиологическое значение, участвуя в различных физиологических процессах, таких как долговременная потенциация (усвоение и память),развитие синаптической гибкости (пластичности) , регуляция моторики, дыхание, сердечнососудистая регуляция и чувственное восприятие. Рецепторы возбудительной аминокислоты разделяют на два общих типа. Рецепторы, которые соединяются напрямую с открытием катионных каналов в клеточной мембране нервных клеток, называются ионотропными. Этот тип рецепторов подразделяется, по меньшей мере,на три подтипа, которые определяются по деполяризирующим действиям селективных агонистов N-метил-D-аспартата (NMDA), -амино-3 гидрокси-5-метилизоксазол-4-пропионовой кислоты (АМРА) и каиновой кислоты (КК). Второй общий тип рецепторов представляет собойG-белок или вторичный мессенджер-связанный рецептор метаботропной возбудительной аминокислоты. Этот второй тип соединяется со множеством систем вторичных мессенджеров,что приводит к повышенному фосфоинозитидному гидролизу, активации фосфолипазы D или С, увеличению или понижению образования кАМФ и изменениям в функции ионного канала(Schoepp and Conn., Trends in Pharmacol. Sci.,14,13 (1993. Оба типа рецепторов, как оказывается, не только опосредуют нормальную синаптическую передачу по путям, проводящим возбуждение, но также принимают участие в видоизменении синаптических связей в период развития и в течение жизни (Schoepp, Bockaertand Sladeczek, Trends in Pharmacol. Sci., 11, 508,1990; McDonald and Johnson, Brain Research Reviews, 15, 41, 1990). Избыточная или соответствующая стимуляция рецепторов возбудительной аминокислоты приводит к повреждению нервной клетки или к ее потере вследствие механизма, извест 001769 2 ного как эксайтотоксичность (excitotoxicity). Этот процесс, как полагают, опосредует нервное истощение при различных состояниях. Из-за медицинских последствий такого нервного истощения важной терапевтической задачей является ослабление этих дегенеративных неврологических процессов. Рецепторы метаботропного глутамата представляют собой высоконеоднородное семейство рецепторов глутамата, что связано с множественностью путей вторичных мессенджеров. Функция этих рецепторов заключается в модуляции предсинаптического высвобождения глутамата и предсинаптической чувствительности нервной клетки к глутаматному возбуждению. Соединения, которые модулируют функцию этих рецепторов, в частности, агонисты и антагонисты глутамата, полезны для лечения острых и хронических нейродегенеративных состояний, а также в качестве антипсихотических, противосудорожных, болеутоляющих,анксиолитических, антидепрессантных и противорвотных средств. Настоящее изобретение предлагает соединения формулы где X представляет связь, S, SO или SO2; и R представляет C1-8-алкильную группу; фенильную группу, которая не замещена или замещена одним или двумя заместителями, выбранными независимо из галогена, C1-4-алкильной и C1-4 алкоксигруппы; или фенил (C1-4)-алкильную или дифенил(С 1-4)-алкильную группу, в которой фенил может быть не замещен, или замещен одним или двумя заместителями, выбранными независимо из атома галогена, C1-4-алкильной иC1-4-алкоксигруппы или его нетоксичные метаболические лабильные эфиры или амиды; или его фармацевтически приемлемые соли. Следует отметить, что соединения формулы I содержат, по меньшей мере, пять асимметрических атомов углерода, причем три из них находятся в циклопропановом кольце и два - в циклопентановом кольце. Настоящее изобретение включает все стереоизомерные формы соединений формулы I, в том числе каждый индивидуальный энантиомер и их смеси. Предпочтительные соединения формулы I имеют конфигурацию, представленную ниже: Наиболее предпочтительной является конфигурация формулы Ib. Понятие "необязательно замещенный", которое используется в данном описании, означает, что может присутствовать один или несколь 3 ко заместителей, причем указанные заместители выбираются из атомов и групп, которые, когда они присутствуют в соединении формулы I, не препятствуют соединению формулы I проявлять свойства модулятора функций рецептора метаботропного глутамата. Примерами атомов и групп, которые могут быть заместителями, являются галоген, C1-6 алкил, C1-6-алкоксигруппа, фенил. Примерами необязательно замещенных ароматических групп являются 2-нафтил, фенил, 2-фторфенил, 3-фторфенил, 4-фторфенил,2,4-дифторфенил, 3,4-дифторфенил, пентафторфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил,2,4-дихлорфенил,3,4-дихлорфенил,3,5 дихлорфенил, 2-бромфенил, 3-бромфенил, 4 бромфенил, 2-метилфенил, 3-метилфенил, 4 метилфенил, 2-метоксифенил, 3-метоксифенил,4-метоксифенил,2,3-диметоксифенил,2,5 диметоксоифенил, 3,4-диметоксифенил, 3,5 диметоксифенил, 2-трифторметилфенил, 3 трифторметилфенил, 4-трифторметилфенил, 2 фтор-3-трифторметилфенил, 3-трифторметил-4 фторфенил, 3-трифторметил-5-фторфенил, 2 фтор-5-трифторметилфенил. Если не оговорено особо, то понятие "алкил" означает линейную или разветвленную алкильную группу. Примерами таких C1-6 алкильных групп являются C1-4-алкильные группы, такие как метил, этил, пропил, изопропил, бутил и изобутил. Примером значения R, когда он представляет собой необязательно замещенную гетероароматическую группу, является 2-пиримидил. Когда R является необязательно замещенной ароматической группой, он предпочтительно представляет 2-нафтильную группу или фенильную группу, которые могут быть незамещенными или замещенными одним или двумя заместителями, выбираемыми независимо из атома галогена, C1-4-алкила и C1-4-алкоксигруппы. Примерами значений R, когда он представляет собой необязательно замещенную ароматическую группу, являются 2-нафтил, фенил,2-фторфенил, 3-фторфенил, 4-фторфенил, 3,4 дифторфенил, пентафторфенил, 2-хлорфенил, 3 хлорфенил, 4-хлорфенил, 3,4-дихлорфенил, 2,5 дихлорфенил, 2-бромфенил, 3-бромфенил, 4 бромфенил, 2-метилфенил, 3-метилфенил, 4 метилфенил, 2-метоксифенил, 3-метоксифенил,4-метоксифенил, 3-трифторметилфенил и 4 трифторметилфенил. Примерами значений R, когда он представляет собой замещенную C1-6-алкильную группу, являются фенил-(C1-4)-алкильная и дифенил-(C1-4)-алкильная группы, в которых фенил может быть незамещенным или замещенным одним или двумя атомами галогена, (C1-4)алкилами и (C1-4)-алкоксигруппами, например,бензил, 2-фенилэтил, 2-фенилпропил и 2 тиофенилметил. 4 Предпочтительную группу соединений формулы I составляют соединения, в которых R представляет собой C1-6-алкильную группу; фенильную группу, которая может быть незамещенной или замещенной одним или двумя заместителями, выбираемыми независимо из галогена, C1-4-алкила и C1-4-алкоксигруппы; или фенил-(C1-4)-алкильную или дифенил (C1-4)алкильную группы, в которых фенил может быть не замещен или замещен одним или двумя заместителями, выбираемыми из галогена,(C1-4)-алкила и (C1-4)-алкоксигруппы. Настоящее изобретение включает фармацевтически приемлемые соли соединений формулы I. Эти соли могут быть образованы с кислотной или основной частью молекулы и могут представлять собой кислотно-аддитивные, первичные, вторичные, третичные или четвертичные аммониевые соли, соли щелочных или щелочно-земельных металлов, обычно кислотноаддитивные получают реакцией кислоты с соединением формулы I. Соли щелочных и щелочно-земельных металлов получают реакцией гидроксидной формы соли желаемого металла с соединением формулы I. Кислоты, которые обычно используются для получения таких солей, включают неорганические кислоты, такие как соляная, бромистоводородная, иодистоводородная, серная и фосфорная кислоты, а также органические кислоты,такие как паратолуолсульфоновая, метансульфоновая, щавелевая, парабромфенилсульфоновая, угольная, янтарная, лимонная, бензойная и уксусная кислоты, а также родственные неорганические и органические кислоты. К таким фармацевтически приемлемым солям, следовательно, относятся сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты,аммонийные соли, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты,деканоаты, каприлаты, акрилаты, формиаты,изобутираты, капринаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты,себацаты, фумараты, гиппураты, бутин-1,4 диоаты, гексан-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -гидроксибутираты, гликолаты, малеаты,тартраты, метансульфонаты, пропансульфонаты,нафталин-1-сульфонаты,нафталин-2 сульфонаты, манделаты, магниевые, тетраметиламмониевые, калиевые, триметиламмониевые,натриевые, метиламмониевые, кальциевые соли и аналогичные соли. Фармацевтически приемлемые метаболически лабильные сложные эфиры и амиды соединений формулы I представляют собой сложные эфиры и амиды соединений формулы I, которые гидролизуются in vivo, давая указанное 5 соединение формулы I и фармацевтически приемлемый спирт или амин. Примерами таких метаболически лабильных сложных эфиров являются эфиры, образуемые C1-6-спиртами, в которых спиртовый фрагмент может быть необязательно замещен C1-8-алкоксигруппой, например, метанолом, этанолом, пропанолом и метоксиэтанолом. Примерами метаболически неустойчивых амидов являются амиды, образуемые аминами, такими как метиламин. В соответствии с другим аспектом настоящее изобретение предлагает способ получения соединения формулы I, который включает: где R1 представляет атом водорода или ацильную группу, a R2 представляет карбоксильную группу или этерифицированную карбоксильную группу, или его соли; где R3 представляет карбоксильную группу или этерифицированную карбоксильную группу, и каждый из R4 и R5 независимо представляет атом водорода, С 2-6-алканоильную группу,C1-4-алкильную группу, С 3-4-алкенильную группу или фенил-(С 1-4)-алкильную группу, в которых фенил или не замещен, или замещен атомом галогена, C1-4-алкилом или C1-4-алкоксигруппой, или его соли; или(в) снятие защитной группы в соединении формулы в которой R6 представляет атом водорода или группу, защищающую азот, а каждый из R7 и R8 независимо представляет атом водорода или группу, защищающую карбоксил, или его соли; после чего, если необходимо и/или желательно,(I) растворение соединения формулы I;(II) превращение соединения формулы I в нетоксичный метаболически лабильный сложный эфир или амид; и/или(III) превращение соединения формулы I или его нетоксичного метаболически лабильного эфира или амида в его фармацевтически приемлемую соль. Методы защиты карбоксильной группы и аминогруппы в общем виде описаны в книгахWiley and Sons, NY, 1991. Примерами карбоксизащитных групп для R7 и R8 являются алкильные группы, такие как метил, этил, трет.-бутил и трет.-амил; аралкильные группы, такие как бензил, 4-нитробензил, 4-метоксибензил, 3,4 диметоксибензил, 2,4-диметоксибензил, 2,4,6 триметоксибензил, 2,4,6-триметилбензил, бензгидрил и тритил; силильные группы, такие как триметилсилил и трет.-бутилдиметилсилил; а также аллильные группы, такие как аллил и 1(триметилсилилметил)проп-1-ен-3-ил. Примерами амино-защитных групп для R6 являются ацильные группы, такие как группы формулыR11CO, где R11 представляет C1-6-алкил, С 3-10 циклоалкил, фенил (C1-6)-алкил, фенил, C1-6 алкокси, фенил (C1-6)-алкокси или С 3-10 циклоалкокси, где фенильная группа может быть необязательно замещена одним или двумя заместителями, независимо выбранными из амино-, гидрокси-, нитрогрупп, атома галогена,(C1-6)-алкила, (C1-6)-алкоксигруппы, карбоксильной группы, (C1-6)-алкоксикарбонильной группы, карбамоильной группы, (C1-6)-алканоиламино группы, (C1-6)-алкилсульфониламино группы, фенилсульфониламиногруппы,толуолсульфониламино группы и(C1-6)фторалкильной группы. Предпочтительными значениями R1 являются атом водорода и (С 2-6)-алканоильные группы, такие как ацетил. Предпочтительными значениями R2 и R3,когда они представляют собой этерифицированную карбоксильную группу, являются (C1-6)алкоксикарбонильные группы, такие как этоксикарбонильная группа.R4 и R5 предпочтительно представляют собой атом водорода. Соединения формулы II гидролизуются в присутствии кислоты, такой как соляная кислота или серная кислота, или основания, такого как гидроксид щелочного металла, например,гидроксид натрия. Гидролиз удобно проводить в водном растворителе, например, в воде, и при температуре в интервале от 50 до 200 С. Соединения формулы III удобно гидролизовать в присутствии основания, например, гидроксида щелочного металла, такого как гидроксид лития, натрия или калия, или гидроксида щелочно-земельного металла, такого как гидроксид бария. Подходящей реакционной средой является вода. Температура обычно находится в интервале от 50 до 150 С. Защитные группы в соединениях формулыIV могут быть сняты обычными методами. Так,алкильная защитная группа может быть удалена с карбоксильной группы путем гидролиза. Гидролиз может быть осуществлен при нагревании соединения формулы IV в присутствии или основания, например гидроксида щелочного металла, такого как гидроксид лития, натрия или 7 калия, или гидроксида щелочно-земельного металла, такого как гидроксид бария, или кислоты,такой как соляная кислота. Гидролиз удобно проводить при температуре от 10 до 300 С. Аралкильная защитная группа карбоксила может быть снята путем гидрирования. Гидрирование удобно проводить при взаимодействии соединения формулы IV с водородом в присутствии в качестве катализатора металла VIII Группы, например, палладиевого катализатора,такого как палладий на угле. Подходящими растворителями для реакции являются спирты, такие как этанол. Реакцию обычно проводят при температуре от 0 до 100 С. Ацильная аминозащитная группа также может удобно удаляться путем гидролиза, по методике, описанной для снятия алкильной защиты с карбоксильной группы. Соединения формулы II могут быть получены реакцией соединения формулы V с цианидом щелочного металла, такого как цианид лития, натрия или калия, и галогенидом аммония, таким как хлорид аммония. Найдено,что успешно можно проводить реакцию под воздействием ультразвука. Так, галогенид аммония смешивают с окисью алюминия хроматографического сорта в присутствии подходящего растворителя, такого как ацетонитрил. Затем на смесь воздействуют ультразвуком, после чего добавляют соединение формулы V и смесь снова обрабатывают ультразвуком. Добавляют цианид щелочного металла и смесь снова подвергают воздействию ультразвука. Полученная смесь диастереоизомерных аминонитрилов может затем подвергаться реакции с ацилирующим агентом, таким как ацетилхлорид, в присутствии подходящего основания,например, амина, такого как диизопропилэтиламин, и в присутствии подходящего растворителя, такого как дихлорметан, с образованием смеси диастереомерных ациламинонитрилов. Необходимый диастереоизомер может быть выделен из смеси, например, с помощью хроматографии. Соединения формулы III могут быть получены реакцией соединения V с цианидом щелочного металла, таким как цианид лития, натрия или калия, и карбонатом аммония в водном спирте, таком как водный этанол. Реакцию удобно проводить при температуре в интервале от 35 до 150 С. При желании соединения формулы III могут затем алкилироваться или ацилироваться, например, с использованием соответствующего соединения формулы R4Cl и/илиR5Cl. Соединения формулы V, где Х представляет собой S, могут быть получены при взаимодействии соединения формулы VI с тиолом формулы RSH. Реакцию предпочтительно проводят в присутствии основания, например, в присутствии третичного амина, такого как триэтиламин. Подходящими растворителями для этой реакции являются простые эфиры, такие как тетрагидрофуран. Реакцию обычно проводят при температуре в интервале от 0 до 100 С. Соединения формулы V, в которых Х представляет собой связь, получают реакцией соединения формулы VI с металлорганическим реагентом, таким как соединение формулы RLi,RMgX или RZnX, где Х представляет атом галогена, такой как хлор или бром, в присутствии медного катализатора, такого как йодид меди (I) или аддукт бромида меди (I) и S(СН 3)2. Подходящими растворителями для этой реакции являются простые эфиры, такие как диэтиловый эфир и тетрагидрофуран. Реакцию обычно проводят при температуре в интервале от -40 до 10 С. Соединения формулы VI могут быть получены реакцией соединения формулы VII с иодтриметилсиланом в присутствии триэтиламина с получением силил-енолового простого эфира с последующим взаимодействием силиленолового эфира с ацетатом палладия. Соединения формулы VII являются известными соединениями и могут быть получены реакцией 2 циклопентен-1-она с карбоксизащищенным(диметилсульфуранилиден)ацетатом. Подходящими растворителями для этой реакции являются ароматические углеводороды, такие как толуол. Желаемый диастереоизомерный продукт может быть выделен с помощью хроматографии. Соединения формулы IV могут быть получены путем введения защитной группы в соединение формулы I, например, реакцией со спиртом, таким как этанол, в присутствии дегидратирующего агента, такого как тионилхлорид. Соединения формулы IV, в котором Х представляет атом серы, может быть превращено в соответствующее соединение формулы IV, в котором Х представляет собой SO или SO2, при взаимодействии с надкислотой, такой как мхлорнадоксибензойная кислота. Соединения формул II, III и IV считаются новыми и составляют дополнительные аспекты изобретения. Конкретные дозы соединения, применяемого в соответствии с настоящим изобретением,будут, конечно, определяться в зависимости от сопутствующих обстоятельств с учетом свойств 9 вводимого соединения, способа введения, конкретного состояния, которое должно быть подвергнуто лечению, и аналогичных факторов. Соединения могут вводиться различными способами, включая оральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный или внутриназальный способы. Альтернативно, соединения могут вводиться путем непрерывного вливания. Обычная ежедневная доза составляет приблизительно от 0,01 до 100 мг/кг активного соединения настоящего изобретения. Предпочтительно ежедневные дозы составляют приблизительно от 0,05 до 50 мг/кг, более предпочтительно приблизительно от 0,1 до 25 мг/кг. Показано, что различные физиологические функции подвержены влиянию избыточной или неподходящей стимуляции передачи возбудительной аминокислоты. Считается, что соединения формулы I настоящего изобретения обладают способностью лечить большое число неврологических нарушений у млекопитающих,связанных с этим состоянием, в том числе острые неврологические нарушения, такие как церебральная недостаточность после сердечной хирургии с шунтированием и имплантации, шока, церебральной ишемии, травмы спинного мозга, травмы головы, перинатальной гипоксии,остановки сердца и гипогликемического нервного расстройства. Соединения формулы I, как полагают, обладают способностью лечить хронические неврологические нарушения, такие как болезнь Альцгеймера, хорея Хатингтона, боковой амиотрофический склероз (болезнь Шарко), слабоумие, вызванное СПИДом, глазное нарушение и ретинопатия, расстройство познавательной способности и идиопатическая и вызванная лекарствами болезнь Паркинсона. Настоящее изобретение также предлагает способы лечения таких заболеваний, которые включают введение пациенту, нуждающемуся в лечении, эффективного количества соединения формулы I, или его фармацевтически приемлемых метаболически лабильных сложных эфиров или амидов, или его фармацевтически приемлемых солей. Соединения формулы I настоящего изобретения, как считают, также обладают способностью лечить различные другие неврологические нарушения у млекопитающих, которые связаны с глутаматной дисфункцией, включая мышечные спазмы, конвульсии, мигреневые головные боли, недержание мочи, синдром отвыкания от никотина, психоз (такой как, шизофрения) толерантность к наркотикам и синдром их отмены, тревожное состояние, хроническая боль и поздняя дискинезия. Соединения формулы I также полезны в качестве антидепрессантов и обезболивающих агентов. Таким образом, настоящее изобретение также предлагает способ лечения таких заболеваний, который включает введение пациенту, нуждающе 001769 10 муся в лечении, эффективного количества соединения формулы I или его фармацевтически приемлемых метаболически лабильных сложных эфиров или амидов, или его фармацевтически приемлемых солей. Для демонстрации способности соединений формулы I воздействовать на рецепторы возбудительной аминокислоты были проведены эксперименты. Сродство к рецепторам метаботропного глутамата показано с помощью селективного вытеснения 1S,3R-ACPD-чувствительного [3 Н]-глутамата, связывающегося с мембранами клеток головного мозга крыс. Связывание[3 Н]-глутамата проводят с неочищенными мембранами передней части головного мозга крыс в соответствии с методикой, описанной в статьях(1992) и Wright et al., J. Neurochemistry 63, 938945, 1994. Найдено, что все испытанные по этой методике соединения, за исключением соединения примера 8, имеют IC50 менее 10 мкМ. Например, найдено, что соединение примера 1 имеет IС 50 0,242 мкМ. Соединение примера 8,которое не находится в наиболее предпочтительной стереоизомерной конфигурации формулы Ib, является по существу неактивным. На основании исследований опосредуемых рецептором изменений во внутриклеточных вторичных мессенджерах, рецепторы метаботропного глутамата сопряжены или с повышенным гидролизом фосфоинозитида или с уменьшениями образования сАМР, стимулируемого форсколином. Было найдено, что соединения настоящего изобретения являются модуляторами функции рецептора метаботропного глутамата. Более конкретно, они являются антагонистами или агонистами рецепторов метаботропного глутамата, что определяется по их влиянию на системы вторичных мессенджеров. Например, соединения могут быть испытаны на их способность предотвращать стимулируемое форсколином (30 мкМ) ингибирование образования сАМР mGluR-агонистами (1S,3R-ACPD,20 мкМ), с использованием срезов гиппокампа крыс, как это описано в работе D.D. Schoepp,B.G. Johnson, Neurochemistry International 22,277-283 (1993), и ненервными клетками человека, экспрессирующими mGluR2 (D.D. Schoepp etal., Neuropharmacology, 34, 834-850, 1995). Перед применением соединения настоящего изобретения предпочтительно приготавливаются соответствующих препаратов. Таким образом, еще одним аспектом настоящего изобретения является фармацевтический препарат,включающий соединение формулы I и фармацевтически приемлемый носитель, разбавитель или заполнитель. Фармацевтические препараты настоящего изобретения получают по известным методикам с использованием хорошо известных и легкодоступных ингредиентов. При изготовлении композиций настоящего изобретения активный ингредиент обычно смешивают 11 с носителем или разбавляют их носителем, или заключают в носитель, и они могут иметь форму капсул, саше, бумаги и других контейнеров. Когда носитель выполняет функцию разбавителя, он может быть твердым, полутвердым или жидким материалом, который действует как носитель, эксципиент или как среда для активного ингредиента. Композиции могут иметь форму таблеток, пилюль, порошков, лепешек,саше, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей, мазей, содержащих,например, до 10 вес.% активного соединения,мягких и твердых желатиновых капсул, свечей,стерильных растворов для инъекций и порошков в стерильных упаковках. Некоторыми примерами подходящих носителей, эксципиентов и разбавителей являются лактоза, декстроза, сахароза, сорбит, маннит,крахмалы, камедь, аравийская камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическая целлюлоза,поливинилпирролидон, целлюлоза, водный сироп, метилцеллюлоза, метил- и пропилгидроксибензоаты, тальк, стеарат магния и минеральное масло. Препараты могут дополнительно содержать смазывающие агенты, смачивающие агенты, эмульгирующие и суспендирующие агенты, консерванты, подслащивающие агенты и корригенты. С использованием методик, известных в данной области, композиции настоящего изобретений могут быть изготовлены таким образом, чтобы они обеспечивали быстрое,постепенное или замедленное выделение активного ингредиента после его приема пациентом. Композиции предпочтительно готовят в виде стандартной лекарственной фирмы, причем каждая лекарственная форма содержит приблизительно от 5 до 500 мг, более предпочтительно приблизительно от 25 до 300 мг активного ингредиента. Понятие стандартная лекарственная форма относится к физически дискретной стандартной форме, пригодной для единичного дозирования лекарственного средства для человека или другого млекопитающего, причем каждая стандартная форма содержит предопределенное количество активного материала, которое рассчитано так, чтобы обеспечить получение необходимого терапевтического эффекта,в смеси с приемлемым фармацевтическим носителем, разбавителем или наполнителем. Следующие примеры препаратов являются только иллюстративными и никоим образом не ограничивают объем изобретения. Препарат 1. Готовят твердые желатиновые капсулы с использованием следующих ингредиентов: Количество 12 Представленные выше ингредиенты смешивают и полученной смесью (по 460 мг) заполняют твердые желатиновые капсулы. Препарат 2. Готовят таблетки с использованием приведенных ниже ингредиентов: Количество(мг/таблетка) Активный ингредиент 250 Целлюлоза микрокристаллическая 400 Диоксид кремния, тонко измельченный 10 Стеариновая кислота 5 Всего 665 мг Компоненты смешивают и прессуют с получением таблеток, каждая весом 665 мг. Препарат 3. Готовят аэрозольный раствор, содержащий следующие компоненты: вес.% Активный ингредиент 0,25 Этанол 29,75 Пропеллант 22 (хлордифторметан) 70,00 Всего 100 Активное соединение смешивают с этанолом и смесь добавляют к порции Пропелланта 22, охлаждают до -30 С и переносят в заполняющее устройство. Затем в контейнер из нержавеющей стали вводят необходимое количество смеси и разбавляют остатком пропелланта. На контейнере устанавливают распылительный клапан. Препарат 4. Таблетки, каждая из которых содержит 60 мг активного ингредиента, готовят из следующих компонентов: Активный ингредиент 60 мг Крахмал 45 мг Целлюлоза микрокристаллическая 35 мг Поливинилпирролидон 4 мг Натрий-карбоксиметилкрахмал 4,5 мг Стеарат магния 0,5 мг Тальк 1 мг Всего 150 мг Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш (U.S.) и тщательно смешивают. Полученный порошок смешивают с раствором Поливинилпирролидона и пропускают через сито 14 меш (U.S.). Полученные таким образом гранулы сушат при 50 С и пропускают через сито 18 меш (U.S.). Натрий-карбоксиметилкрахмал, стеарат магния и тальк пропускают через сито 60 меш (U.S.) и затем добавляют к гранулам и после смещения прессуют на таблетирующей машине, получая таблетки, каждая весом 150 мг. Препарат 5. Капсулы, каждая из которых содержит 80 мг лекарственного средства, готовят из следующих компонентов: Активный ингредиент 80 мг Крахмал 59 мг Целлюлоза микрокристаллическая 59 мг Стеарат магния 2 мг Всего 200 мг Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито 45, и полученной смесью заполняют твердые желатиновые капсулы по 200 мг в каждую капсулу. Препарат 6. Свечи, каждая из которых содержит по 225 мг активного ингредиента, готовят из следующих компонентов: Активный ингредиент 225 мг Глицериды насыщенных жирных кислот 2000 мг Всего 2225 мг Активный ингредиент пропускают через сито 60 меш (U.S.) и суспендируют в глидеридах насыщенных жирных кислот, которые предварительно расплавляют при минимально необходимом нагревании. Затем смесь выливают в форму для свечей с номинальной емкостью 2 г и охлаждают. Препарат 7. Суспензии, каждая из которых содержит по 50 мг лекарственного средства на 5 мл дозы,готовят из следующих компонентов: Активный ингредиент 50 мг Натрийкарбоксиметилцеллюлоза 50 мг Сироп 1,25 мл Раствор бензойной кислоты 0,10 мл Корригирующие добавкиq.v. Очищенная вода до суммарного объема 5 мл Лекарственное средство пропускают через сито 45 меш (U.S.) и смешивают с натрийкарбоксиметилцеллюлозой и сиропом с образованием однородной пасты. Небольшим количеством воды разбавляют раствор бензойной кислоты, корригирующие добавки и краситель и при перемешивании добавляют к пасте. Затем добавляют достаточное количество воды до получения необходимого объема. Препарат 8. Препарат для внутривенного введения готовят следующим образом: Активный ингредиент 100 мг Маннит 100 мг 5 н. раствор гидроксида натрия 200 мл Очищенная вода до суммарного объема 5 мл 14 Приведенные далее примеры иллюстрируют соединения настоящего изобретения и способы их синтеза. Пример 8 включен в списание только для пояснения метода синтеза. Используются следующие сокращения:EtOH - этанол; ТСХ -тонкослойная хроматография, ВЭЖХ - высокоэффективная жидкостная хроматография: м-ХНБК - м-хлорнадбензойная кислота; FDMS -масс-спектроскопия с десорбцией полем. Синтез 1. Карбоэтоксиметилдиметилсульфонийбромид. Раствор этилбромацетата (265 г) и диметилсульфида (114 г) в ацетоне (500 мл) перемешивают при комнатной температуре. Через три дня из реакционной смеси отфильтровывают названное соединение. Температура плавления 88-90 С. Синтез 2. Этиловый эфир (1SR,5RS,6SR)2-оксобицикло[3.1.0]гексан-6-карбоновой кислоты. Суспензию карбоэтоксиметилдиметилсульфонийбромида (45,5 г, 198,6 ммол) в толуоле обрабатывают 1,8-диазабицикло [5.4.0] ундец-7-еном (30,2 г, 198,4 ммол). Полученную смесь перемешивают при комнатной температуре. Через один час реакционную смесь обрабатывают 2-циклопентен-1-оном (19,57 г, 238,4 ммол). Еще через 18 ч реакционную смесь добавляют к 1 н. раствору соляная кислота/хлорид натрия. Полученную смесь экстрагируют диэтиловым эфиром. Объединенные эфирные экстракты сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Остаток очищают хроматографированием на силикагеле, используя в качестве элюента смесь этилацетат - гексаны с линейным градиентом от 10% этилацетат/гексаны до 50% этилацетат /гексаны,получают 22,81 г (68%) названного соединения. Температура плавления 36-38 С. Масс-спектр (десорбция полем) м/z = 168(а) Этиловый эфир 1SR,5RS,6SR-2 оксобицикло[3.1.0]гекс-3-ен-6-карбоновой кислоты. К раствору этилового эфира 1SR,5RS,6SR2-оксо-бицикло[3.1.0]-гексан-6-карбоновой кислоты (42 г, 250 ммол) и триэтиламина (75 г, 750 ммол, ) в безводном CH2Cl2 (1000 мл) при температуре 0 С по каплям добавляют иодтриметилсилан (75 г, 375 ммол). Полученную реакционную смесь оставляют нагреваться до комнатной температуры с перемешиванием в течение ночи. Реакционную смесь промывают водным 15 раствором NH4Cl (3 раза) и рассолом, сушат МgSO4 и концентрируют в вакууме, получают сырой силиленоловый эфир. Продукт обрабатывают безводным CH3CN (600 мл), обрабатывают одной порцией Pd(OAc)2 (61,7 г, 275 ммол) и перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляютEt2O (600 мл) и фильтруют через слой целита(Celite). Фильтрат концентрируют в вакууме,получают сырой продукт, который очищают методом ВЭЖХ (элюент 10% EtOAc/гексаны 50% EtOAc/гексаны), получают 38,22 г (92%) названного соединения. Т. пл. 75-77 С. Масс-спектр (десорбция полем): М+ = 166(б) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-(фенилтио)бицикло[3.1.0]гексан-6-карбоновой кислоты. Раствор продукта стадии (а) (0,96 г, 5,8 ммол) в ТГФ (100 мл) обрабатывают тиофенолом (0,77 г, 6,7 ммол) и затем одной каплей триэтиламина. Реакционную смесь оставляют перемешиваться при комнатной температуре до завершения реакции (данные ТСХ). Затем реакционную смесь распределяют между EtOAc и 0,5 н. НСl, органическую фазу отделяют, сушатMgSO4 и концентрируют. Полученное масло очищают с помощью ВЭЖХ (элюент 10%(2,60 г, 40 ммол ) в Н 2O (100 мл) и EtOH (100 мл) и полученную смесь нагревают при 55 С в течение ночи. Продукт фильтруют, промывают смесью EtOH:H2O (50:50, 100 мл) и сушат на воздухе, получают 5,0 г (72%) названного соединения. Масс-спектр (десорбция полем) M1 = 347. Элементный анализ. Вычислено, %: С 56,03; Н 5,53; N 7,69; S 8,80.(г) Суспензию продукта стадии (в) (2,9 г,8,4 ммол) кипятят с обратным холодильником с 5 н. раствором NaOH (10 мл) в течение 72 ч. Ох 001769 16 лажденный водный раствор промывают этилацетатом, затем подкисляют НСl до рН между 1 и 3. Образующийся осадок отфильтровывают,промывают Н 2O и 2-РrОН и сушат на воздухе,получают 1,43 г (58%) названного соединения. Масс-спектр (десорбция полем) М+ = 293. Элементный анализ. Вычислено, %: С 49,02; Н 4,41: N 4,08; S 9,35.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-3-хлорфенил)тио)бицикло[3.1.0]гексан 6-карбоновая кислота. По методике примера 1(б), но с использованием 2,19 г (13,2 ммол) продукта примера 1(а) и 1,91 г (13,2 ммол) 3-хлортиофенола и с последующим растиранием в гексане, получают 3,74 г(б) Этиловый эфир 1SR,2RS,4SR,5SR,6SR2-спиро-5'-гидантоин-4-3-хлорфенил)тио)бицикло [3.1.0]гексан-6-карбоновой кислоты По методике примера 1(в), но с использованием продукта стадии (а) (3,7 г, 11,7 ммол),(NH4)2CO3 (4,5 г, 57,9 ммол) и KCN (1,5 г, 23,2 ммол) и с последующим фильтрованием продукта и перекристаллизацией из EtOH, получают 0,3 г (7%) названного соединения. Т. пл. 256-258 С. Масс-спектр (десорбция полем) М+ = 380. Элементный анализ. Вычислено, %: С 53,45; Н 5,43; Сl 8,30; N 6,56; S 7,51.(в) По методике примера 1(г), но с использованием продукта стадии (б) (0,29 г, 0,76 ммол) и 2 н. раствора NaOH (20 мл), при кипячении с обратным холодильником в течение 16 ч и после обработки реакционной массы получают 0,20 г (80%) названного соединения. Масс-спектр (десорбция полем) М+ = 327 и 329. Элементный анализ. Вычислено, %: С 51,30; Н 4,31; N 4,27; S 9,78. 17 По методике примера 1(б), но с использованием 2,19 г (13,2 ммол) продукта примера 1(а) и 1,91 г (13,2 ммол) 2-хлортиофенола, с последующим растиранием в гексане получают 3,78 г(б) Этиловый эфир 1SR,2RS,4SR,5SR,6SR2-спиро-5'-гидантоин-4-2-хлорфенил)тио)бицикло[3 .1.0]гексан-6-карбоновой кислоты. По методике примера 1(в), но с использованием продукта стадии (а) (3,7 г, 11,7 ммол),(NН 4)2 СО 3 (4,5 г, 57,9 ммол ) и KCN (1,5 г, 23,2 ммол), с последующим фильтрованием продукта и перекристаллизацией из EtOH получают 1,6 г (36%) названного соединения. Т. пл. 211-213 С. Масс-спектр (десорбция полем) М+ = 380. Элементный анализ. Вычислено, %: С 53,45; Н 5,43; N 6,56; S 7,51.(в) По методике примера 1(г), но с использованием продукта стадии (б) (0,51 г, 1,3 ммол) и 2 н. раствора NaOH (15 мл), при кипячении с обратным холодильником в течение 48 ч и после обработки реакционной смеси получают 0,30 г (70%) названного соединения. Т. пл.250 С. Масс-спектр (десорбция полем) М+ = 327 и 329. Элементный анализ. Вычислено, %: С 49,38; Н 4,83; N 4,11; S 9,42.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-4-хлорфенил)тио)бицикло[3.1.0]гексан 6-карбоновой кислоты. По методике примера 1(б), но с использованием 2,19 г (13,2 ммол) продукта примера 1(б) Этиловый эфир 1SR,2RS,4SR,5SR,6SR2-спиро-5'-гидантоин-4-4-хлорфенил)тио)бицикло[3.1.0]гексан-6-карбоновой кислоты. По методике примера 1 (в), но с использованием продукта стадии (а) (3,6 г, 11,6 ммол), 001769(NН 4)2 СО 3 (4,5 г, 57,9 ммол) и KCN (1,5 г, 23,2 ммол) и с последующим фильтрованием продукта и перекристаллизацией из EtOH, получают 1,9 г (43%) названного соединения. Т. пл. 256-258 С. Масс-спектр (десорбция полем) М+ = 380. Элементный анализ. Вычислено, %: С 53,11; Н 4,56; N 7,29; S 8,34.(в) По методике примера 1(г), но с использованием продукта стадии (б) (0,60 г, 1,6 ммол) и 2 н. раствора NaOH (15 мл), при кипячении с обратным холодильником в течение 16 ч и после обработки реакционной массы получают 0,045 г (9%) названного соединения. Т. пл.250 С. Масс-спектр (десорбция полем) М+ = 327 и 329. Элементный анализ. Вычислено, %: С 49,40; Н 4,56; N 4,11; S 9,42.(а) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-аминоацетил-4-(фенилтио)бицикло[3.1.0] гексан-2,6-карбоновой кислоты. Суспензию продукта примера 1 (1,0 г, 3,4 ммол) в EtOH (100 мл) обрабатывают при 0 СSOCl2 (2,0 г, 17,0 ммол) и затем кипятят с обратным холодильником в течение 30 ч. Реакционную смесь концентрируют досуха при пониженном давлении, остаток растворяют в CH2Cl2 и при 0 С добавляют i-Pr2NEt (2,2 г, 17,0 ммол) и АсСl (0,8 г, 10,2 ммоля). После проведения реакции при комнатной температуре в течение 3 ч смесь распределяют между Et2O и 1 н. НСl и органическую фазу сушат (МgSO4). Смесь подвергают хроматографированию (50% гексаны/(0,36 г, 1,2 ммол) в СН 2 Сl2 (20 мл) по каплям добавляют к раствору продукта стадии (а) (0,45 г, 1,2 ммол) в CH2Cl2 (50 мл) при температуре-78 С и полученную смесь перемешивают при температуре -78 С в течение 2 ч. Реакционную смесь гасят водным раствором тиосульфита натрия и распределяют между EtOAc и Н 2 О. Продукт экстрагируют EtOAc, сушат MgSO4 и концентрируют с получением масла, которое очи 19 щают хроматографированием (элюент: от 50%(в) Раствор продукта стадии (б) (0,50 г, 1,2 ммол) в 5 н. НСl (25 мл) кипятят с обратным холодильником в течение ночи. Реакционную смесь упаривают досуха и затем обрабатывают Н 2 О. Продукт при рН=2 наносят на катионообменную смолу Dowex 50 Х 8-100 и элюируют смесью 5% пиридин/Н 2 О,получают 0,18 г (выход - 48%) названного соединения. Т. пл.250 С. Масс-спектр (десорбция полем) М+ = 310. Элементный анализ. Вычислено, %: С 52,82: Н 5,02; N 4,40; S 10,07.(0,45 г, 1,4 ммол) в СН 2 Сl2 (10 мл) по каплям добавляют к раствору продукта Примера 5(а)(0,45 г, 1,2 ммол ) в CH2Cl2 (20 мл) при температуре 5 С, и полученную смесь оставляют нагреваться до комнатной температуры с перемешиванием в течение ночи. Реакционную смесь распределяют между CH2Cl2 и 1 н. NaOH. Продукт экстрагируют СН 2 Сl2, сушат К 2 СО 3 и концентрируют, получают 0,47 г (выход - 92%) названного соединения. Т. пл. 75-78 С. Масс-спектр (десорбция полем) М 1=424. Элементный анализ. Вычислено, %: С 56,73; Н 5,95; N 3,31; S 7,57. С 20 Н 25NO7S. Найдено, %: С 56,95; Н 6,21; N 3,29; S 7,29.(б) Названное соединение получают по методике примера 5 (в), но с использованием продукта стадии (а) (0,36 г, 0,85 ммол) и 5 н. НСl (25 мл). Реакционную смесь упаривают досуха и затем растворяют в Н 2 О. Продукт при рН=2 наносят на катионообменную смолу Dowex 50 Х 8-100 и элюируют смесью 5% пиридин/Н 2 О,получают 0,12 г (43%) названного соединения. Т. пл.250 С. Масс-спектр (десорбция полем) М+ = 326. Элементный анализ. Вычислено, %: С 50,98; Н 4,74; N 4,25; S 9,72.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-2-метоксифенил)тио)бицикло[3.1.0] гексан-6-карбоновой кислоты. По методике примера 1(б), но с использованием 2,0 г (12 ммол) продукта примера 1(а) и 1,68 г (12 ммол) 2-метокситиофенола и с последующей кристаллизацией из смеси петролейный эфир/эфир получают 2,73 г (выход - 74%) названного соединения. Т. пл. = 102-104 С. Масс-спектр (десорбция полем) М+ = 306. Элементный анализ. Вычислено, %: С 62,72; Н 5,92; S 10,46.[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (2,60 г, 8,49 ммол),(NН 4)2 СО 3 (2,00 г, 25,6 ммол) и KCN (0,83 г,12,7 ммол) и с последующим гидролизом NaOH(2,40 г, 60,0 ммол), этерификацией SOCl2 (10,0 г,85 ммол) и очисткой методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 75% EtOAc/гексаны),получают 1,45 г (выход - 45%) названного соединения. Масс-спектр (десорбция полем) M+ = 379. Элементный анализ. Вычислено, %: С 58,74; Н 6,75; N 3,61; S 7,23.(в) Продукт стадии (б) (0,50 г, 1,30 ммол) перемешивают в растворе 1 н. NaOH и ТГФ (1:1,общий объем 20 мл) при комнатной температуре в течение ночи. Полученную реакционную смесь упаривают в вакууме и обрабатываютH2 О. Продукт при рН=10 наносят на анионообменную смолу Bio-Rad AG 1-X8 и элюируют 50%-ной уксусной кислотой, получают продукт в виде белого твердого вещества. После сушки в вакууме при 80 С получают 0,37 г (выход 88%) названного соединения. Т. пл.250 С (разл.). Масс-спектр (десорбция полем) М+ = 323. Элементный анализ. Вычислено, %: С 55,71; Н 5,30; N 4,33; S 9,92. 21 По методике примера 1(б), но с использованием 2,0 г (12 ммол) продукта примера 1(а) и 1,37 г (12 ммол) 2-фуранилметилтиола и с последующей очисткой методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 50% EtOAc/гексаны),получают 3,27 г (выход - 97%) названного соединения. Масс-спектр (десорбция полем) М+ = 280. Элементный анализ. Вычислено, %: С 59,98; Н 5,75; S 11,44.[3.1.0]гексан-2,6-дикарбоновой кислоты. Названное соединение получают, обрабатывая сначала продукт стадии (а) (3,14 г, 11,2 ммол) по методикам примера 1(в) [с использованием (NH4)2 СО 3 (2,03 г, 26 ммол) и KCN (0,85 г, 13 ммол)] и примера 1(г) [с использованием 1 М NaOH]. Значение рН реакционной смеси доводят до 1 с помощью водного раствора НСl и затем упаривают досуха. Сырой гидрохлорид аминодикислоты суспендируют в очень чистомEtOH (200 мл) и охлаждают до 0 С. К этой суспензии по каплям добавляют SOCl2 (13,2 г, 112 ммол) и полученную реакционную смесь кипятят с обратным холодильником в течение 24 ч. Реакционную смесь упаривают досуха и полученные твердые вещества распределяют между 10%-ным раствором NaHCO3/EtOAc. Продукт экстрагируют EtOAс. Все органические фазы объединяют, промывают рассолом, сушат К 2 СО 3 и концентрируют, полученное масло очищают методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 90% EtOAc/гексаны), получают названное соединение (0,46 г, 1,30 ммол), выход - 12%. Масс-спектр (десорбция полем) М+ = 353. Элементный анализ. Вычислено, %: С 57,04; Н 6,62; N 3,91; S 8,96.(в) Названное соединение получают по методике примера 7 (в), но с использованием продукта стадии (б) (0,25 г, 0,71 ммол). После анионообменной хроматографии получают 0,21 г (100%) названного соединения. Т. пл.150 С (разл). Масс-спектр (десорбция полем) М 1=298. Элементный анализ. Вычислено, %: С 50,09; Н 5,36; N 4,49; S 10,29. 22 По методике примера 1(б), но с использованием 3,3 г (20 ммол) продукта примера 1(а) и 2,48 г (20 ммол) о-тиокрезола кристаллизацией из смеси гексаны/EtOAc получают 5,00 г (выход[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (4,80 г, 16,5 ммол),(NH4)2 СО 3 (3,87 г, 49,6 ммол) и KCN (1,61 г,24,8 ммол) с последующим гидролизом NaOH(19,60 г, 165,0 ммол), после очистки методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 75%(в) По методике примера 7(в), но с использованием продукта стадии (б) (0,75 г, 2,06 ммол) и выделяя продукт осаждением при рН=3, получают 0,54 г (выход - 86%) названного соединения. Т. пл.250 С (разл). Масс-спектр (десорбция полем) М+ = 307. Элементный анализ. Вычислено, %: С 58,62; Н 5,57; N 4,56,C15H17NO4S. Найдено, %: С 58,66; Н 5,51;(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-3-фторфенил)тио)-бицикло [3.1.0] гексан-6-карбоновой кислоты. По методике примера 1(б), но с использованием 3,3 г (20 ммол) продукта примера 1 (а) и 2,56 г (20 ммол) 3-фтортиофенола с последующей кристаллизацией из петролейного эфира получают 5,16 г (выход - 88%) названного соединения. Т. пл. 59-61 С. Масс-спектр (десорбция полем) М+ = 294. Элементный анализ. Вычислено, %: С 61,21; Н 5,14; S 10,89.[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (5,00 г, 17,0 ммол), 23(4,00 г, 100,0 ммол)и этерификацией SOCl2 (20,2 г, 170 ммол), после очистки методом ВЭЖХ(в) По методике примера 7(в), но с использованием продукта стадии (б) (0,25 г, 0,68 ммол) и выделяя продукт осаждением при рН = 3, получают 0,18 г (выход - 85%) названного соединения. Т. пл. 225 С (разл.). Масс-спектр (десорбция полем) М+ = 311. Элементный анализ. Вычислено. %: С 54,01; Н 4,53; N 4,50.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-(бензилтио)бицикло[3.1.0]гексан-6 карбоновой кислоты. По методике примера 1(б), но с использованием 2,0 г (12 ммол) продукта примера 1 (а) и 1,50 г (12 ммол) бензилмеркаптана с последующей кристаллизацией из смеси петролейный эфир/эфир получают 2,27 г (выход - 65%) названного соединения. Т. пл. = 78-80 С. Масс-спектр (десорбция полем) М+ = 290. Элементный анализ. Вычислено, %: С 66,18; Н 6,25; S 11,04.(б) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-амино-4-(бензилтио)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (2,15 г, 7,4 ммол),(NН 4)2 СО 3 (1,16 г, 14,8 ммол) и KCN (0,72 г,11,1 ммол) с последующим гидролизом NaOH(2,50 г, 62,4 ммол) и этерификацией SOCl2 (8,9 г, 74 ммол), после очистки методом ВЭЖХ(в) По методике примера 7(в), но с использованием продукта стадии (б) (0,31 г, 0,85 ммол) 24 и выделяя продукт осаждением при рН=3, получают 0,22 г (выход - 85%) названного соединения. Т. пл. 250 С (разл.). Масс-спектр (десорбция полем) М+ = 307. Элементный анализ. Вычислено, %: С 58,62; Н 5,57; N 4,56.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-2-фторфенил)тио)бицикло[3.1.0]гексан 6-карбоновой кислоты. По методике примера 1(б), но с использованием 3,3 г (20 ммол) продукта примера 1(а) и 2,56 г (20 ммол) 2-фтортиофенола с последующей кристаллизацией из петролейного эфира получают 5,20 г (выход - 88%) названного соединения. Т. пл. 63-66 С. Масс-спектр (десорбция полем) М+ = 294. Элементный анализ. Вычислено, %: С 61,21; Н 5,14; S 10,89.[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (5,00 г, 17,0 ммол),(NH4)2CO3 (4,00 г, 51,0 ммол) и KCN (1,66 г,25,5 ммол) с последующим гидролизом NaOH(20,2 г, 170 ммол), после очистки методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 75%(в) По методике примера 7(в), но с использованием продукта стадии (б) (0,25 г, 0,68 ммол) и выделяя продукт осаждением при рН=3, получают 0,24 г (112%) названного соединения. Т. пл.250 С (разл.). Масс-спектр (десорбция полем) М 1=312. Элементный анализ. Вычислено, %: С 51,91; Н 4,79; N 4,32.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-4-метилфенил)тио)бицикло[3.1.0]гек 25 метилфенил)тио)бицикло[3.1.0]гексан-6-карбоновой кислоты. По методике примера 1(б), но с использованием 2,0 г (12 ммол) продукта примера 1(а) и 1,50 г (12 ммол) п-тиокрезола с последующей кристаллизацией из смеси петролейный эфир/эфир получают 1,85 г (выход - 53%) названного соединения. Т. пл. = 84-86 С. Масс-спектр (десорбция полем) М+ = 290. Элементный анализ. Вычислено, %: С 66,18; Н 6,25; S 11,04.[3.1.0] гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (2,55 г, 8,78 ммол),(NH4)2 СО 3 (2,06 г, 26,3 ммол) и KCN (0,86 г,13,2 ммол) с последующим гидролизом NaOH(10,47 г, 87,8 ммол), после очистки методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 75%(в) По методике примера 7(в), но с использованием продукта стадии (б) (0,25 г, 0,69 ммол) и выделяя продукт осаждением стадии (б) (0,25 г, 0,69 ммол) и,выделяя продукт осаждением при рН = 3, получают 0,20 г (94%) названного соединения. Т. пл. 240 С (разл.). Элементный анализ. Вычислено, %: С 58,62; Н 5,57; N 4,56.(а) Этиловый эфир 1SR,4SR,5RS,6SR-2 оксо-4-метилбицикло[3.1.0.]гексан-6-карбоновой кислоты. К суспензии иодида меди (I) (1,25 ммол) в безводном диэтиловом эфире (6 мл) при 0 С добавляют метиллитий (1,6 М). Раствор перемешивают в течение 30 мин при 0 С и затем по каплям при температуре 0 С добавляют раствор этилового эфира 1SR,5RS,6SR-2-oкcoбициклo[3.1.0]-гeкc-3-eн-6-кapбoнoвoй кислоты (0,84 ммол) в диэтиловом эфире (2 мл). Смесь перемешивают еще в течение часа при температуре 0 С и затем гасят насыщенным раствором хлорида аммония и экстрагируют диэтиловым эфиром. Объединенные органические фазы сушатMgSO4 фильтруют и упаривают досуха. После очистки сырого продукта флэш-хроматографией(гексан/этилацетат, 4:1) получают названное соединение в виде бесцветного масла, выход 76%. Спектр 1 ЯMP(CDCl3, , м.д.): 4,1 (кв, 2 Н,CH2), 2,5 (м, 1 Н, Н 4), 2,35-2,19 (м, 3 Н, H1, H3d,Н 5), 2,1 (т, 1 Н, Н 6), 1,65 (д, 1 Н, Н 3u), 1,19 (т,3 Н, СН 3), 1,10 (д, 3 Н, СН 3). Спектр 13 С ЯМР(б) Смесь этиловых эфиров (1SR,2SR,4SR,5RS,6SR)- и (1SR,2RS,4SR,5RS,6SR)-2-амино-2 циано-4-метилбицикло[3.1.0]гексан-6-карбоновой кислоты. Гетерогенную смесь окиси алюминия (14 г,Merk, тип 90 для колоночной хроматографии,нейтральная, активность I) и хлорида аммония(26 ммол) в ацетонитриле (50 мл) обрабатывают ультразвуком в течение 30 мин. Затем добавляют раствор продукта стадии (а) (2,19 ммол) в ацетонитриле (5 мл) и после обработки ультразвуком еще в течение 2 ч добавляют 2,19 ммол;KCN. Смесь обрабатывают ультразвуком в течение ночи и затем отфильтровывают окись алюминия и фильтрат упаривают досуха. Получают названную смесь диастереомерных аминонитрилов. Эту смесь используют на следующей стадии без дополнительной очистки.(в) Этиловый эфир (1SR,2SR,4SR,5RS,6SR2-ацетамидо-2-циано-4-метилбицикло[3.1.0] гексан-6-карбоновой кислоты. К раствору продукта стадии (б) (1,25 ммол) в сухом СН 2 Сl2 при 0 С добавляют диизопропиламин (1,37 ммол) и полученную смесь перемешивают в течение 15 мин. Затем добавляют ацетилхлорид (1,37 ммол) и после перемешивания при комнатной температуре в течение 5 ч реакционную смесь гасят водой и экстрагируют CH2Cl2. Объединенные органические экстракты сушат МgSO4 и упаривают, получают масло. Полученную смесь ацетилированных аминонитрилов разделяют колоночной хроматографией (гексан/этилацетат, 1:1), используют силикагель 230-400 меш (Merk). Выход - 30%. Спектр 1 НЯМР (CDCl3, , м.д.): 6,15 (с,1 Н, NH), 4,1 (кв, 2 Н, J=7,1 Гц, СН 2 СН 3), 2,7 (дд,1 Н, J=2,8 Гц, H1), 2,55 (д, 1 Н, J=15 Гц, H3u),2,45 (м, 1 Н, Н 4), 2,15-1,95 (м, 5 Н, СН 3 СО, Н 6,Н 5), 1,55 (дд, 1 Н, J=7,8 Гц, J=15 Гц), 1,25 (м,6 Н). Спектр 13 С ЯМР(СDСl3, , м.д.): 171,16; 169,97; 121,09; 61,28; 55,05; 42,26; 34,94; 34,62; 34,29; 23,03; 22,04; 21,15; 14,15. ИК-спектр (КВr): 3284, 2245, 1730, 1655 см-1. 27 г) Смесь продукта стадии (с) (0,8 ммол) и 5 н. раствора НСl (10 мл) кипятят с обратным холодильником в течение ночи. Полученный раствор упаривают досуха, получают белое твердое вещество. Названное соединение выделяют в виде цвиттер-иона после ионообменной хроматографии на Dowex 50 Х 8 50-100 меш с использованием в качестве элюента смеси пиридин-вода 10%. Выход 31%. Т. пл. 300 С. Спектр 1H ЯМР (D2O, пиридин, , м.д.): 2,2(а) Этиловый эфир (1SR,4SR,5RS,6SR)-2 оксо-4-фенилбицикло[3.1.0]гексан-6-карбоновой кислоты. По методике примера 14(а), но с использованием фениллития (1,8 М) в циклогексановом эфире (12,5 ммол) получают названное соединение. Выход - 70%. Спектр 1H ЯМР (CDCl3, , м.д.): 7,11-7,4(б) Смесь этиловых эфиров (1SR,2SR,4SR,5RS,6SR)- и (1SR,2RS,4RS,5RS,6SR)-2 амино-2-циано-4-фенилбицикло[3.1.0]гексан-6 карбоновой кислоты. По методике примера 14(б), но с использованием продукта стадии (а) получают названную смесь диастереомерных аминонитрилов. Эту смесь используют на следующей стадии без дополнительной очистки.[3.1.0]гексан-6-карбоновой кислоты. По методике примера 14(в), но с использованием продукта стадии (6) получают названное соединение. Выход - 20%. Спектр 1H ЯМР (CDCl3, , м.д.): 7,4-7,2 (м,5 Н, Ph); 6,35 (с, 1 Н, NH); 4,2 (кв, 2 Н, J=7,2 Гц,СН 2 СН 3), 3,65 (д, 1 Н, J=8,4 Гц, Н 4), 2,9 (дд, 1 Н,J=2,8 Гц, J=6,1 Гц, H1), 2,85 (д, 1 Н, J=15,0 Гц,H3u), 2,4 (дд, 1 Н, J=3,3 Гц, J=6,1 Гц, Н 5), 2,0 (с,3 Н, СН 3), 1,9 (дд, 1 Н, J=8,4 Гц, J=15,0 Гц, H3d),1,78 (т, 1 Н, J=3,3), 1,29 (т, 3 Н, J=7,2 Гц, СН 3). Спектр 13 С ЯМР (CDCl3, , м.д.): 170,89; 170,34; 142,25; 128,56; 127,12; 127,06; 119,66; 61,20; 55,08; 44,84; 43,22; 35,68; 32,59; 22,66; 22,01; 14,06. ИК-спектр (КВr): 3317, 2260, 1727, 1880,1299, 1184 см-1. г) По методике примера 14(г), но с использованием продукта стадии (в) получают названное соединение. Выход - 67%. Спектр 1H ЯМР (D2O, пиридин, , м.д.): 7,05-6,8 (м, 5 Н, Ph), 2,95 (д, 1 Н, J=8,2 Гц, Н 4),2,29 (дд, 1 Н, J=3,0 Гц, J=6,1 Гц, H1), 2,1 (д, 1 Н,J=14,3 Гц, H3u), 1,7 (дд, 1 Н, J=2,8 Гц, J=6,1 Гц,Н 5), 1,52 (м, 1 Н, H3d); 1,45 (т, 1 Н, J=2,8, H6). Спектр 13 С ЯМР (D2O, пиридин, , м.д.): 180,95; 180,30; 144,11; 126,77; 125,87; 124,38; 65,27; 44,07; 42,77; 34,97; 31,07; 24,32. ИКспектр (КВг): 3445, 3196 см-1. Пример 16. 1SR,2SR,4SR,5RS,6SR-2-Амино-4-бензилбицикло[3.1.0]гексан-2,6-дикарбоновая кислота.(а) Этиловый эфир (1SR,4SR,5RS,6SR)-2 оксо-4-бензилбицикло[3.1.0]гексан-6-карбоновой кислоты. К суспензии СuВrS(СН 3)2 (12 ммол) в безводном диэтиловом эфире (14 мл) при -30 С при перемешивании добавляют по каплям раствор бензилмагнийхлорида (1 М) в диэтиловом эфире(24 ммол). Полученную смесь перемешивают в течение 15 мин и затем медленно добавляют смесь этилового эфира 1SR,5RS,6SR-2-оксобицикло[3.1.0]гексан-6-карбоновой кислоты (4,8 ммол) и триметилсилилхлорида (9,6 ммол) в безводном ТГФ (7 мл). Смесь энергично перемешивают при температуре -30 С в течение 30 мин, затем гасят насыщенным раствором хлорида аммония и экстрагируют диэтиловым эфиром. Объединенные экстракты сушат MgSO4 и упаривают досуха, получают масло, которое очищают колоночной хроматографией (гексан/ этилацетат, 4:1), получают названное соединение в виде бесцветного масла, выход - 50%. Спектр 1H ЯМР (CDCl3, , м.д.): 7,39-7,15(б) Смесь этиловых эфиров (1SR,2SR,4SR,5RS,6SR)- и (1SR,2RS,4RS,5RS,6SR)-2-амино-2 циано-4-бензилбицикло[3.1.0]-гексан-6-карбоновой кислоты. По методике примера 14(б), но с использованием продукта стадии (а) получают названную смесь диастереомерных аминонитрилов. Эту смесь используют на следующей стадии без дополнительной очистки. 29 По методике примера 14(в), но с использованием продукта стадии (б) получают названное соединение. Выход - 20%. Спектр 1H ЯМР (CDCl3, , м.д.): 7,35-7,20(м, 5 Н, Ph); 6,69 (с, 1 Н, NH); 4,1 (кв, 2 Н,СН 2 СН 3), 2,90 (м, 2 Н), 2,80 (дд, 1 Н, J=3,0 Гц,J=6,2 Гц, H1), 2,55 (м, 2 Н), 2,05 (дд, 1 Н), 1,90 (с,3 Н, СН 3 СО), 1,65 (т, 1 Н), 1,45 (дд, 1 Н, J=7,9 Гц,J=14,9 Гц, H3d), 1,23 (т, 3 Н, СН 3 СН 2). Спектр 13 С ЯМР (CDCl3, , м.д.): 171,25; 170,39; 139,29; 129,21; 128,77; 126,59; 120,87; 61,30; 54,88; 42,20; 40,83; 39,16; 34,48; 32,50; 22,93; 21,88; 14,22. ИК-спектр (КВr): 3316, 2240, 1726, 1659,1294, 1185 см-1. г) По методике примера 14(г), но с использованием продукта стадии (в) получают названное соединение в виде белого твердого вещества. Выход - 47%. Спектр 1H ЯМР (D2O, пиридин, , м.д.): 7,30-7,05 (м, 5 Н, Ph), 2,93 (д, 2 Н, J=7,9 Гц, ), 2,65(а) Этиловый эфир (1SR,4SR,5RS,6SR)-2 оксо-4-(4-фторфенил)бицикло[3.1.0]гексан-6 карбоновой кислоты. По методике примера 16 (а), но с использованием п-фторфенилмагнийбромида (1 М) в ТГФ (24 ммол) получают названное соединение. Выход - 50%. Спектр 1H ЯМР(СDСl3, , м.д.): 7,05-6,80(б) Смесь этиловых эфиров (1SR,2SR,4SR,5RS,6SR)- и (1SR,2RS,4SR,5RS,6SR)-2-амино-2 циано-4-(4-фторфенил)бицикло[3.1.0]-гексан-6 карбоновой кислоты. По методике примера 14(б), но с использованием продукта стадии (а) получают названную смесь диастереомерных аминонитрилов. Эту смесь используют на следующей стадии без дополнительной очистки. 30 По методике примера 14(в), но с использованием продукта стадии (б) получают названное соединение. Выход - 30%. Спектр 1H ЯМР (CDCl3, , м.д.): 7,38-7,30(дд, 1 Н, J=2,8 Гц, J=6,09 Гц, H1), 2,81 (д, 1 Н,J=15,0 Гц, H3u), 2,38 (дд, 1 Н, J=3,3 Гц, J=6,09 Гц, H5), 2,0 (с, 3 Н, СН 3 СО), 1,9 (дд, 1 Н, J=8,5 Гц, J=15,04 Гц, Н 6),1,3(т, 3 Н, СН 3 СН 2). Спектр 13 С ЯМР (CDCl3, , м.д.): 170,81; 170,11; 164,0; 138,10; 128,95: 115,80; 119,63; 61,51; 55,26; 44,53; 43,72: 35,81; 32,61; 22,98; 22,20; 14,27. ИК-спектр (КВr): 3433, 2245, 1726, 1646 см-1. г) По методике примера 14(г), но с использованием продукта стадии (в) получают названное соединение в виде белого твердого вещества. Выход 42%. Т. пл. 300 С. Спектр 1H ЯМР (D2O, пиридин, , м.д.): 7,1-6,9 (м, 2 Н, Аr), 6,65 (т, 2 Н, Аr), 3,1 (д, 1 Н,J=6,9 Гц), 2,45 (м, 1 Н), 2,25-1,95 (м, 3 Н), 1,7(а) Диэтиловый эфир (1SR,2RS,4SR,5SR,6SR)-2-ацетиламино-4-3-фторфенил)тио)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты. Раствор продукта примера 10(б) (1,38 г,3,76 ммол) в СН 2 Сl2 (35 мл) обрабатывают последовательно при 0 С диизопропилэтиламином(1,46 г, 11,3 ммол) и ацетилхлоридом (0,59 г,7,50 ммол). Полученную реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают до завершения реакции(данные ТСХ). Реакционную смесь распределяют между Et2O и 1 н. НСl и продукт экстрагируют Et2O. Все органические фазы сушат (MgSO4). Смесь подвергают хроматографированию (элюент: 10% EtOAc/гексаны - 50% EtOAc/гексаны),получают 1,47 г (3,44 ммол, 92%) названного соединения. Масс-спектр (десорбция полем) М+ = 409. Элементный анализ. Вычислено, %: С 57,40; Н 6,02 N 3,35; S 7,66.C20H24FNO5S0,5H2O. Найдено, %: С 57,29; Н 6,09; N 3,25; S 11,11. б) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-ацетиламино-4-3-фторфенил)сульфи 31 нил)бицикло[3.1.0]гексан-2,6-карбоновой кислоты. м-Хлорнадбензойную кислоту (0,24 г, 0,76 ммол) одной порцией добавляют к раствору продукта стадии (а) (0,31 г, 0,76 ммол) в CH2Cl2(20 мл) при температуре -78 С и полученную смесь перемешивают при температуре -78 С в течение 4 ч. Реакционную смесь распределяют между 1 н. NaOH и Et2O. Продукт экстрагируютEt2O, сушат MgSO4 и концентрируют до масла,которое очищают препаративной ТСХ (элюент: от 10% EtOAc/гексаны до 100% EtOAc), получают 0,27 г (0,63 ммол, 84%) названного соединения. Масс-спектр (десорбция полем) М+ = 425. Элементный анализ. Вычислено, %: С 56,46; Н 5,69; N 3,29; S 7,54. С 20 Н 24FNO6S. Найдено, %: С 56,70; Н 5,72; N 3,41; S 7,30. в) Раствор продукта стадии (б) (0,21 г, 0,49 ммол) в 2 н. НСl (25 мл) нагревают с обратным холодильником в течение ночи. Реакционную смесь упаривают досуха и затем обрабатывают Н 2O. Продукт при рН=2 наносят на катионообменную смолу Dowex 50 Х 8-100 и элюируют смесью 5% пиридин/Н 2O, получают 1,45 г (0,39 ммол, 76%) названного соединения. Т. пл.250 С(разл). Масс-спектр (десорбция полем) М 1 = 328. Элементный анализ. Вычислено, %: С 48,44; Н 4,70; N 4,03.(а) Диэтиловый эфир (1SR,2RS,4SR,5SR,6SR)-2-аминоацетил-4-2-метоксифенил)тио) бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 18 (а), но с использованием продукта примера 7 (б) (0,60 г, 1,58 ммол), i-Pr2EtN (0,60 г, 4,5 ммол) и ацетилхлорида (0,24 г, 3,0 ммол) с последующей очисткой ВЭЖХ (элюент: от 10% EtOAc/гексаны до 90% 32 онную смесь оставляют нагреваться до комнатной температуры при перемешивании в течение ночи. Реакционную смесь распределяют между 1 н. NaOH и Et2O, продукт экстрагируют Et2O,промывают рассолом, сушат МgSO4. После упаривания досуха продукт очищают препаративной ТСХ (элюент: от 10% EtOAc/гексаны до 67% EtOAc/гексаны), получают 0,44 г (0,97 ммол, выход - 85%) названного соединения. Масс-спектр (десорбция полем) М 1 = 454. Элементный анализ. Вычислено, %: С 55,07; Н 6,05; N 3,06; S 7,00.C21H27NO8S0,25H2O. Найдено, %: С 55,12; Н 6,09: N 2,91; S 6,82. в) Раствор продукта стадии (б) (0,36 г, 0,79 ммол) в 2 н. НСl (25 мл) кипятят с обратным холодильником в течение 72 ч. Реакционную смесь упаривают досуха и затем обрабатывают Н 2O. Добавлением NaOH доводят рН до 14 и твердые вещества отфильтровывают и отбрасывают. Добавлением 3 н. НСl рН доводят до 3 и выпадающий в осадок продукт отфильтровывают и сушат в вакууме при температуре 80 С в течение ночи, получают 0,17 г (0,48 ммол, 61%) названного соединения. Т. пл.270 С. Масс-спектр (десорбция полем) М 1 = 356. Элементный анализ. Вычислено, %: С 50,06; Н 4,90; N 3,89.(а) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-аминоацетил-4-2-фторфенил)тио)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 18(б), но с использованием продукта примера 12 (с) (1,25 г, 3,44 ммол), i-Pr2EtN (1,33 г, 10,3 ммол) и ацетилхлорида (0,41 г, 5,16 ммол) с последующей очисткой ВЭЖХ (элюент: от 10% EtOAc/гексаны до 90% EtOAc/гексаны) получают 1,17 г (2,86 ммол, выход - 92%) названного соединения. Масс-спектр (десорбция полем) М+ = 409. Элементный анализ. Вычислено, %: С 58,67; Н 5,91; N 3,42; S 7,83.C20H24FNO5S. Найдено, %: С 58,40; Н 6,01; N 3,22; S 7,55. б) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-аминоацетил-4-2-фторфенил)сульфинил)бицикло[3.1.0]гексан-2,6-карбоновой кислоты. По методике примера 18(б), но с использованием продукта стадии (а) (0,30 г, 0,73 ммол) и м-хлорнадбензойной кислоты (0,28 г, 0,88 ммол) с последующей очисткой препаративной ТСХEtOAc/гексаны), получают 0,24 г (0,56 ммол,выход - 77%) названного соединения. Масс-спектр (десорбция полем) М+ = 425. Элементный анализ. Вычислено, %: С 56,46; Н 5,69; N 3,29; S 7,54. С 20 Н 24FNО 6S. Найдено, %: С 56,27; Н 5,67; N 3,06: S 7,44. в) Названное соединение получают по методике примера 19(в), но с использованием продукта стадии (б) (0,16 г, 0,38 ммол) и 2 н. НСl (25 мл). После осаждения продукта из раствора(а) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-аминоацетил-4-2-фторфенил)сульфонил)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 19(б), но с использованием продукта примера 20(а) (0,79 г, 1,93 ммол) и м-хлорнадбензойной кислоты (1,33 г,4,24 ммол) с последующей очисткой препаративной ТСХ (элюент: от 50% EtOAc/гексаны до 100% EtOAc), получают 0,73 г (1,66 ммол, выход - 86%) названного соединения. Масс-спектр (десорбция полем) М 1 = 442. Элементный анализ. Вычислено, %: С 64,41; Н 5,48; N 3,17; S 7,26.C20H24FNO7S. Найдено, %: С 64,29: Н 5,64; N 3,18; S 7,02. б) Названное соединение получают по методике примера 19 (в), но с использованием продукта стадии (а) (0,60 г, 1,36 ммол) и 2 н. НСl(25 мл). После осаждения продукта из раствора 34 По методике примера 18(а), но с использованием продукта примера 9(б) (2,0 г, 5,5 ммол),i-Pr2EtN (2,13 г, 16,5 ммол) и ацетилхлорида(0,66 г, 8,3 ммол) с последующей очисткой ВЭЖХ (элюент: от 10% EtOAc/гексаны до 50%C21H27FNO5S. Найдено, %: С 62,48; Н 7,01; N 3,53; S 7,57. б) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-аминоацетил-4-2-метилфенил)сульфонил)бицикло[3.1.0]гексан-2,6-карбоновой кислоты. По методике примера 19(б), но с использованием продукта стадии (а) (1,14 г, 2,81 ммол) и м-хлорнадбензойной кислоты (2,21 г, 7,0 ммол) с последующей очисткой с помощью препаративной ВЭЖХ (элюент: от 10% EtOAc/гексаны до 50% EtOAc/гексаны), получают 1,20 г (2,74 ммол, выход - 98%) названного соединения. Масс-спектр (десорбция полем) М+ = 437. Элементный анализ. Вычислено, %: С 57,65; Н 6,22; N 3,20; S 7,33.C21H27NO7S. Найдено, %: 57,54; Н 6,23; N 3,14; S 7,06. в) Названное соединение получают по методике примера 19(в), но с использованием продукта стадии (б) (1,05 г, 2,4 ммол) и 2 н. НСl (30 мл). После осаждения продукта из раствора при рН=3 получают 0,71 г (2,1 ммол, выход - 88%) названного соединения. Т. пл. 275 С. Масс-спектр (десорбция полем) M1 = 340. Элементный анализ. Вычислено, %: С 53,09; Н 5,05; N 4,13.(а) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-аминоацетил-4-4-метилфенил)тио)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примере 18(а), но с использованием продукта примера 13(б) (1,25 г, 3,44 ммол) i-Pr2EtN (1,33 г, 10,3 ммол) и ацетилхлорида (0,41 г, 5,16 ммол) с последующей очисткой с помощью ВЭЖХ (элюент: от 10%C21H27FNO5S. Найдено, %: С 62,20; Н 6,90; N 3,34: S 8,02. б) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-аминоацетил-4-4-метилфенил)сульфо 35 нил)бицикло[3.1.0]гексан-2,6-карбоновой кислоты. По методике примера 19(б), но с использованием продукта стадии (а) (0,86 г, 2,12 ммол) и м-хлорнадбензойной кислоты (1,66 г, 5,3 ммол) с последующей очисткой с помощью препаративной ВЭЖХ (элюент: от 10% EtOAc/гексаны до 50% EtOAc/гексаны), получают 0,90 г (2,06 ммол, выход - 97%) названного соединения. Масс-спектр (десорбция полем) М+ = 437. Элементный анализ. Вычислено, %: С 57,65, Н 6,22; N 3,20;S 7,33.C21H27NO7S. Найдено, %: С 57,54; Н 6,37; Н 3,22, S 7,15. в) Названное соединение получают по методике примера 19 (в), но с использованием продукта стадия (б) (0,76 г, 1,74 ммол) и 2 н. НСl(30 мл). После осаждения продукта из раствора при рН=3 получают 0,71 г (2,1 ммол, выход 88%) названного соединения. Т. пл.270 С. Масс-спектр (десорбция полем) М 1 = 340. Элементный анализ. Вычислено, %: С 53,09; Н 5,05; N 4,13.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-3-метилфенил)тио)бицикло[3.1.0] гексан-6-карбоновой кислоты. По методике примера 1(б), но с использованием 3,32 г (20 ммол) продукта примера 1(а) и 2,48 г (20 ммол) м-тиокрезола растиранием с петролейным эфиром получают 5,25 г (18,1 ммол, выход - 90%) названного соединения. Т. пл. - 63-65 С. Масс-спектр (десорбция полем) М+ = 290. Элементный анализ. Вычислено, %: С 66,18; Н 6,25; S 11,04.[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (4,30 г, 14,8 ммол),(NН 4)2 СО 3 (3,47 г, 44,4 ммол) и KCN (1,45 г,22,2 ммол) с последующим гидролизом NaOH(17,60 г, 148,0 ммол), после очистки методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 90%(в) Названное соединение получают по методике примера 7 (в), но с использованием продукта стадии (б) (1,20 г, 3,30 ммол). Продукт выделяют осаждением при рН=3, получают 0,90 г (2,9 ммол, выход - 89%) названного соединения. Т. пл 250 С. Масс-спектр (десорбция полем) М+ = 307. Элементный анализ. Вычислено, %: С 58,62; Н 5,57; N 4,56; S 10,43.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-(2-фенилэтилтио)бицикло[3.1.0]гексан-6 карбоновой кислоты. По методике примера 1(б), но с использованием 3,32 г (20 ммол) продукта примера 1 (а) и 3,03 г (22,2 ммол) фенетилмеркаптана кристаллизацией из смеси гексаны/EtOAc получают 3,86 г (12,7 ммол, выход - 63%) названного соединения. Т. пл. - 53-55 С. Масс-спектр (десорбция полем) М+ = 304. Элементный анализ. Вычислено, %: С 67,08; Н 6,62; S 10,53. С 17 Н 20 О 3S. Найдено, %: С 67,33; Н 6,49; S 11,08.(б) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-амино-4-(2-фенилэтилтио)бицикло[3.1.0] гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (3,70 г, 12,2 ммол),(NН 4)2 СО 3 (2,85 г, 36,5 ммол) и KCN (1,19 г,18,3 ммол) с последующим гидролизом NaOH(14,52 г, 132,0 ммол), после очистки методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 90%(в) Названное соединение получают по методике примера 7(в), но с использованием продукта стадии (б) (0,54 г, 1,68 ммол). Продукт выделяют осаждением при рН=3, получают 0,42 г (1,3 ммол, выход - 78%) названного соединения. Т. пл 275 С. Масс-спектр (десорбция полем) М+ = 321. Элементный анализ. Вычислено, %: С 59,79; Н 5,96; N 4,36; S 9.98.(а) Диэтиловый эфир 1SR,2RS,4SR,5SR,6SR-2-аминоацетил-4-(2-фенилэтилсульфонил)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 18(а), но с использованием продукта примера 25(б) (0,32 г, 0,85 ммол), iPr2NEt (0,22 г, 1,7 ммол) и ацетилхлорида (0,10 г, 1,3 ммол) с последующей очисткой препаративной ТСХC21H27NO5S1,0H2O. Найдено, %: С 60,28; Н 6,80; N 3,25; S 7,14. б) Названное соединение получают в две стадии из продукта стадии (а) последовательно по методикам примера 19(б) [используя продукт стадии (а) (0,12 г, 0,29 ммол) и м-хлорнадбензойную кислоту (0,22 г, 0,73 ммол)] и 19 (с). После выделения продукта осаждением при рН=3, получают 0,04 г (0,12 ммол, выход - 40%) названного соединения. Т. пл. 245 С (разл). Масс-спектр (десорбция полем) М 1 = 354. Элементный анализ. Вычислено, %: С 54,38; Н 5,42; N 3,96; S 9,07.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-(2-фенилпропилтио)бицикло[3.1.0]гексан-6-карбоновой кислоты. По методике примера 1(б), но с использованием 3,32 г (20 ммол) продукта примера 1(а) и 3,34 г (22,2 ммол) фенилпропилмеркаптана с последующей кристаллизацией из смеси петролейный эфир/Et2O получают 4,36 г (13,7 ммол,выход - 68%) названного соединения. Т. пл. - 60-62 С. Масс-спектр (десорбция полем) М+ = 318. Элементный анализ. Вычислено, %: С 67,89; Н 6,96; S 10,07. С 18 Н 22O3S. Найдено, %: С 67,77; Н 7,14; S 10,42.[3.1.0] гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (4,20 г, 13,2 ммол),(NН 4)2 СО 3 (3,12 г, 39,6 ммол) и KCN (1,30 г,19,8 ммол) с последующим гидролизом NaOH(15,70 г, 132,0 ммол), после очистки методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 90%(в) Названное соединение получают по методике примера 7 (в), но с использованием продукта стадии (б) (0,27 г, 0,69 ммол). Продукт выделяют осаждением при рН=3, получают 0,21 г (0,63 ммол, выход - 91%) названного соединения. Т. пл 260 С (разл.). Масс-спектр (десорбция полем) М+ = 335. Элементный анализ. Вычислено, %: С 60,87; Н 6,31; N 4,18; S 9,56.(а) Этиловый эфир 1SR,4RS,5SR,6SR-2 оксо-4-3-метоксифенил)тио)бицикло[3.1.0] гексан-6-карбоновой кислоты. По методике примера 1(б), но с использованием 3,32 г (20 ммол) продукта примера 1(а) и 2,80 г (20 ммол) 3-метоксибензолтиола, растиранием с петролейным эфиром получают 5,30 г[3.1.0]гексан-2,6-дикарбоновой кислоты. По методике примера 8(б), но с использованием продукта стадии (а) (5,15 г, 16,8 ммол),(NH4)2CO3 (3,93 г, 50,4 ммол) и KCN (1,64 г,25,2 ммол) с последующим гидролизом NaOH(20,0 г, 168,0 ммолей), после очистки методом ВЭЖХ (элюент: от 10% EtOAc/гексаны до 25%(в) Названное соединение получают по методике примера 7 (в), но с использованием продукта стадии (б) (0,50 г, 1,32 ммол). Продукт выделяют осаждением при рН=3, получают 0,31(а) Этиловый эфир 1SR,5RS,6SR-4-фенил 2-оксобицикло[3.1.0]гекс-3-ен-6-карбоновой кислоты. К раствору этилового эфира 4-фенил-2 оксобицикло [3.1.0]гексан-6-карбоновой кислоты (получают по методике примера 15 (а (4,37 ммол) и триэтиламина (26,5 ммол) в безводном СН 2 Сl2 (18 мл) при температуре 0 С по каплям добавляют иодтриметилсилан (5 г, 25 ммол). Полученную реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают 6 ч. Реакционную смесь промывают водным раствором NaHCO3 и рассолом, сушатMgSO4 и концентрируют в вакууме. Полученное масло пропускают через короткую колонку, наполненную силикагелем (EtOAc/гексан, 1:4),получают масло, которое используют без дополнительной очистки. Продукт обрабатывают безводным СН 3 СN (50 мл), обрабатывают одной порцией Pd(OAc)2 (1,1 г, 4,9 ммол) и перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь разбавляют эфиром и фильтруют через слой целита (Celite). Фильтрат концентрируют в вакууме, получают сырой продукт, который очищают методом быстрой хроматографии (элюент СН 2 Сl2). Выход 54%. Спектр 1H ЯМР (CDCl3, , м.д.): 7,65 (м,2 Н), 7,47 (м, 3 Н), 5,99 (с, 1 Н), 4,17 (м, 2 Н), 3,27(м, 1 Н), 2,71 (м, 1 Н), 2,37 (м, 1 Н), 1,22 (м, 3 Н). Спектр 13 С ЯМР (CDCl3, , м.д.): 202,5; 171,1: 168,5; 131,7; 129,2; 127,0; 121,4; 61,6; 58,6; 43,9; 31,2; 28,6; 14,2. б) Этиловый эфир 1SR, 4RS, 5RS, 6SR-2 оксо-4-фенилбицикло[3.1.0]гексан-6-карбоновой кислоты. К раствору продукта стадии (а) (231 ммол) в EtOH (150 мл) добавляют 110 мл Pd на древесном угле (10%). Реакция проводится при давлении водорода 1,406 кг/см 2 (20 фунт/ кв.дюйм) при комнатной температуре в течение 45 мин. Катализатор отфильтровывают через целит, получают названное соединение, которое очищают флэш-хроматографией (элюент: гексан/этилацетат, 4:1). Выход - 76%. Спектр 1H ЯМР (CDCl3, , м.д.): 7,39-7,24C15H16O3. Найдено, %: С 73,66; Н 6,27. в) Смесь этиловых эфиров 1SR,2SR,4SR,5RS,6SR- и 1SR,2RS,4SR,5RS,6SR-2-амино-2 циано-4-фенилбицикло[3.1.0]гексан-6-карбоновой кислоты. По методике примера 14(б), но с использованием продукта стадии (б) получают названную смесь диастереомерных аминонитрилов. Эту смесь используют на следующей стадии без дополнительной очистки. г) Этиловый эфир 1SR,2SR,4SR,5RS,6SR2-aцетамидо-2-циано-4-фенилбицикло[3.1.0] гексан-6-карбоновой кислоты. По методике примера 14(в), но с использованием продукта стадии (в) получают названное соединение. Выход - 34%. Спектр 1 Н ЯМР (СDСl3, , м.д.): 7,37-7,23(м, 5 Н), 6,28 (с, 1 Н), 4,14 (кв, 2 Н), 3,91 (м, 1 Н),3,11 (м, 1 Н), 2,76 (м, 1 Н), 2,42 (м, 1 Н), 1,96 (м,1 Н), 1,41 (м, 1 Н), 1,27 (т, 3 Н). Спектр 13 С ЯМР (CDCl3, , м.д.): 171,1; 170,6; 139,3; 128,6; 127,1; 126,7; 119,4; 61,2; 55,5; 42,0; 39,5; 32,6; 30,3; 22,7; 19,0; 14,0. д) По методике примера 14(г), но с использованием продукта стадии (г) получают названное соединение в виде белого твердого вещества. Выход - 62%. Спектр 1H ЯМР (D2O, KOD, , м.д.): 7,957,84 (м, 5 Н), 4,27 (с, 1 Н), 2,87 (м, 1 Н), 2,65 (с,1 Н), 2,56 (с, 1 Н), 2,26 (с, 1 Н), 1,73 (с, 1 Н). Пример 30. 1SR,2SR,4RS,5RS,6SR-2 Амино-4-бензилбицикло[3.1.0]гексан-2,6-дикарбоновая кислота.(а) Этиловый эфир 1SR,5RS,6SR-4-бензил 2-оксобицикло[3.1.0]гек-3-ен-6-карбоновой кислоты. Названное соединение получают по методике примера 1(а), но с использованием в качестве исходного соединения этилового эфира 4 бензил-2-оксобицикло[3.1.0]гексан-6-карбоновой кислоты (получают по методике примера 16(б) Этиловый эфир 1SR,4RS,5RS,6SR-2 оксо-4-бензилбицикло[3.1.0]гексан-6-карбоновой кислоты. Названное соединение получают по методике примера 1(б), но с использованием продукта стадии (а). Выход - 82%.(м, 5 Н), 4,12 (м, 2 Н), 2,75 (м, 3 Н), 2,33 (м, 1 Н),2,26 (м, 1 Н), 2,09 (м, 2 Н), 1,71 (м, 1 Н), 1,23 (м,3 Н). Спектр 13 С ЯМР (CDCl3, , м.д.): 210,0; 170,2; 138,9; 128,54; 128,50; 126,4; 61,2; 39,5; 38,0; 36,7; 36,6; 32,9; 23,9; 14,11. в) Смесь этиловых эфиров 1SR,2SR,4RS,5RS,6SR- и 1SR, 2RS,4RS, 5RS, 6SR-2-амино-2 циано-4-фенилбицикло[3.1.0]-гексан-6-карбоновой кислоты. По методике примера 14(б), но с использованием продукта стадии (б) получают названную смесь диастереомерных аминонитрилов. Эту смесь используют на следующей стадии без дополнительной очистки. г) Этиловый эфир 1SR,2SR,4RS,5RS,6SR2-ацетамидо-2-циано-4-фенилбицикло[3.1.0] гексан-6-карбоновой кислоты. По методике примера 14(в), но с использованием продукта стадии (в) получают названное соединение. Выход - 42%. Спектр 1H ЯМР (CDCl3, , м.д.): 7,27-7,16(с, 3 Н), 1,75 (м, 1 Н), 1,19 (м, 4 Н), 1,05 (м, 1 Н). Спектр 13 С ЯМР (CDCl3, , м.д.): 171,1; 170,1; 139,1; 129,1; 126,5; 119,4; 61,1; 55,5; 39,8; 38,9; 38,2; 33,3; 30,6; 22,8; 18,3, 14,1. д) По методике примера 14 (г), но с использованием продукта стадии (г) получают названное соединение в виде белого твердого вещества. Выход - 40%. Спектр 1H ЯМР (D2O, KOD, , м.д.): 7,967,82 (м, 5 Н), 3,31-3,16 (м, 3 Н), 2,47 (м, 2 Н), 2,18 где Х представляет связь, S, SO или SO2; и R представляет С 1-6-алкильную группу; фенильную группу, которая не замещена или замещена одним или двумя заместителями, выбранными независимо из галогена, C1-4-алкильной и C1-4 алкоксигруппы; или фенил (C1-4)-алкильную или дифенил (C1-4)-алкильную группу, в которой фенил может быть не замещен или замещен одним или двумя заместителями, выбранными независимо из атома галогена, C1-4-алкильной иC1-4-алкоксигруппы,или его нетоксичные метаболически лабильные эфиры или амиды или его фармацевтически приемлемые соли. 42 2. Соединение по п.1, в котором R представляет 2-нафтил; фенил, который не замещен или замещен одним или двумя заместителями,выбранными независимо из галогена, С 1-4 алкильной или C1-4-алкоксигруппы; пиримидильную группу; бензильную группу или 2 тиофенилметильную группу. 3. Соединение по п.1, в котором R представляет 2-нафтил, фенил, 2-фторфенил, 3 фторфенил, 4-фторфенил, 3,4-дифторфенил,пентафторфенил, 2-хлорфенил, 3-хлорфенил, 4 хлорфенил, 3,4-дихлорфенил, 2,5-дихлорфенил,2-бромфенил, 3-бромфенил, 4-бромфенил, 2 метилфенил, 3-метилфенил, 4-метилфенил, 2 метоксифенил, 3-метоксифенил, 4-метоксифенил, 3-трифторметилфенил и 4-трифторметилфенил. 4. Соединение по любому из пп.1-3, которое имеет стереохимию, представленную ниже 5. Соединение по любому из пп.1-4, в котором Х представляет S. 6. Соединение по любому из пп.1-4, в котором Х представляет связь. 7. Способ получения соединения формулыI, который включает гидролиз соединения формулы в которой R3 представляет карбоксильную группу или этерифицированную карбоксильную группу, и R4 и R5, каждый независимо, представляет атом водорода, С 2-6-алканоильную группу, С 1-4-алкильную группу, С 3-4-алкенильную группу или фенил (С 1-4)-алкильную группу,в которой фенил не замещен или замещен галогеном, С 1-4-алкилом или С 1-4-алкоксигруппой, или его соли; после чего, если необходимо и/или желательно,(I) растворение соединения формулы I;(II) превращение соединения формулы I в его нетоксичный метаболически лабильный сложный эфир или амид и/или(III) превращение соединения формулы I или его нетоксичного метаболически лабильного эфира или амида и его фармацевтически приемлемую соль. 8. Фармацевтический препарат, который включает соединение по п.1 и фармацевтически приемлемый носитель, разбавитель или эксципиент. 9. Применение соединения по любому из пп.1-6 для производства медицинских средств для использования в качестве модуляторов одной или нескольких функций рецепторов метаботропного глутамата.
МПК / Метки
МПК: A61K 31/196, A61P 25/00
Метки: антагонисты, рецепторов, аминокислоты, возбудительной
Код ссылки
<a href="https://eas.patents.su/22-1769-antagonisty-receptorov-vozbuditelnojj-aminokisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты рецепторов возбудительной аминокислоты</a>
Предыдущий патент: Пирометаллургический способ обработки металлсодержащих материалов
Следующий патент: Производные бензимидазола и их применение для лечения вирусных инфекций
Случайный патент: Звукоизолирующий элемент и способ изготовления звукоизолирующего элемента












