Ингибиторы 11-бета-гидроксистероид дегидрогеназы 1, фармацевтическая композиция на их основе и их применение
Формула / Реферат
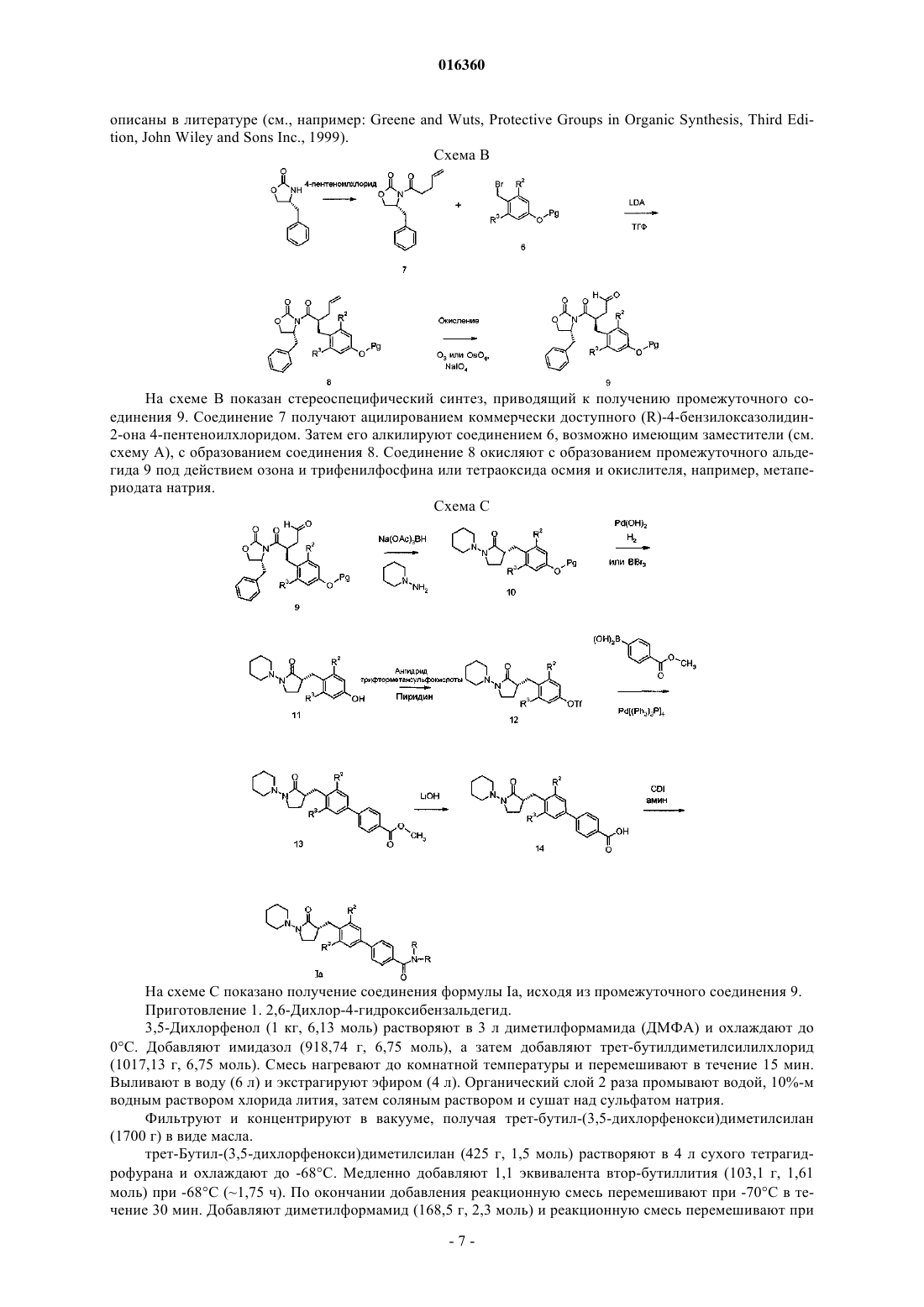
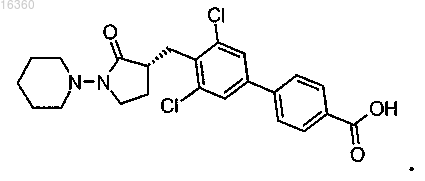
1. Соединение структурной формулы
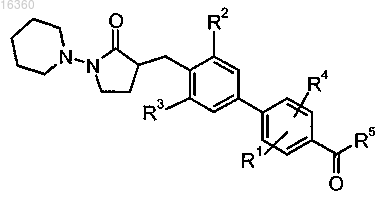
или его фармацевтически приемлемая соль,
где R1 представляет собой -H;
R2 представляет собой -галоген;
R3 представляет собой -галоген;
R4 представляет собой -H;
R5 представляет собой
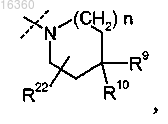
где пунктирной линией обозначена точка присоединения к положению заместителя, обозначенного R5;
где n равно 1;
R9 представляет собой -OH или -CH3 (необязательно замещенный 1-3 атомами галогена);
R10 представляет собой -H и
R22 представляет собой -H.
2. Соединение по п.1, в котором R1 представляет собой -H; R2 представляет собой -хлор; R3 представляет собой -хлор и R4 представляет собой -Н, или его фармацевтически приемлемая соль.
3. Соединение по п.1 или 2, в котором R5 представляет собой
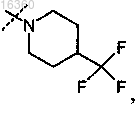
или его фармацевтически приемлемая соль.
4. Соединение по п.1, которое представляет собой (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-пиперидин-1-илпирролидин-2-он, или его фармацевтически приемлемая соль.
5. Соединение по п.1, которое представляет собой (R)-3-[3,5-дихлор-4'-(4-гидроксипиперидин-1-карбонил)бифенил-4-илметил]-1-пиперидин-1-илпирролидин-2-он, или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция, включающая соединение по любому из пп.1-5 или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель.
7. Применение соединения по любому из пп.1-5 или фармацевтически приемлемой соли указанного соединения в терапии.
8. Применение соединения по любому из пп.1-5 или фармацевтически приемлемой соли указанного соединения для приготовления лекарственного средства.
9. Промежуточное соединение для синтеза соединений по п.4 или 5, где указанное промежуточное соединение представляет собой
Текст
ИНГИБИТОРЫ 11-БЕТА-ГИДРОКСИСТЕРОИД ДЕГИДРОГЕНАЗЫ 1,ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ обладающим антагонистической активностью по отношению к 11-HSD первого типа. В другом примере реализации настоящее изобретение относится к фармацевтической композиции,включающей соединения формулы I, а также к применению соединений в терапии и для приготовления лекарственного средства. Кроме того, настоящее изобретение относится к промежуточному соединению для синтеза указанных выше соединений формулы I, где указанное промежуточное соединение представляет собой соединение структуры(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 016360 По настоящей заявке испрашивается приоритет согласно предварительной заявке на патент США 60/745565, поданной 25 апреля 2006 года. Изобретение относится к соединениям, которые являются ингибиторами 11 гидроксистероид дегидрогеназы типа 1 ("11HSD1"), к фармацевтическим композициям на их основе, к применению этих соединений и композиций для лечения людей и животных, к новым промежуточным продуктам, применимым для получения ингибиторов. Настоящие соединения обнаруживают эффективное и селективное ингибирование 11HSD1 и как таковые применимы для лечения нарушений, реагирующих на модуляции 11HSD1, таких как диабет, метаболический синдром, когнитивные расстройства и тому подобное. Глюкокортикоиды, действующие в печени, жировой ткани и мускулатуре, являются важными регуляторами метаболизма глюкозы, жиров и белков. Хронический избыток глюкокортикоидов связан с устойчивостью к инсулину, висцеральным ожирением, гипертензией, дислипидемией, которые также представляют классические признаки метаболического синдрома. 11HSD1 катализирует превращение неактивного кортизона в активный кортизол, что в результате приводит к развитию метаболического синдрома. Экспериментальные данные, полученные на грызунах и человеке, связывают 11HSD1 с метаболическим синдромом. Имеющиеся сведения позволяют предположить, что лекарственное средство,специфически ингибирующее 11HSD1 у больных диабетом 2 типа будет понижать уровень глюкозы в крови посредством уменьшения печеночного глюконеогенеза, уменьшать центральное ожирение, улучшать атерогенные липопротеиновые фенотипы, понижать кровяное давление и уменьшать резистентность к инсулину. Воздействие инсулина на мышцы будет усилено и секреция инсулина островковыми бета-клетками будет также увеличена. Опытные данные, полученные при исследованиях на человеке и животных, также показывают, что избыток глюкокортикоидов снижает познавательную функцию. Недавно полученные результаты показывают, что инактивация 11HSD1 улучшает функционирование памяти как у человека, так и у мышей. Было показано, что ингибитор 11HSD1 карбеноксолон улучшает познавательную функцию у здоровых людей пожилого возраста и диабетиков 2 типа и инактивация 11HSD1 гена вызывает уменьшение возрастных нарушений у мышей. Недавно было показано, что селективное ингибирование 11HSD1 фармацевтическим средством улучшает сохранение памяти у мышей. Вещества, которые ингибируют 11HSD1, были описаны в последнее время в ряде публикаций. В международной публикации заявки WO 2004/056744 раскрыты производные адамантил ацетамидов в качестве ингибиторов 11HSD, в международной публикации заявки WO 2005/108360 раскрыты в качестве ингибиторов 11HSD1 производные пирролидин-2-она и пиперидин-2-она и в международной публикации заявки WO 2005/108361 раскрыты производные адамантил пирролидин-2-она в качестве ингибиторов 11HSD1. Несмотря на наличие ряда способов лечения заболевания, в которое вовлечена 11-HSD1, современная терапия имеет ряд недостатков, включающих низкую или недостаточную эффективность, недопустимые побочные действия и противопоказания для определенных групп больных. Таким образом, сохраняется потребность в совершенствовании способов лечения путем использования альтернативных или улучшенных препаратов, которые ингибируют 11HSD1, и лечении заболеваний, где ингибирование 11HSD1 может дать положительный эффект. Настоящее изобретение обеспечивает такой вклад в данную область техники, благодаря тому, что обнаружен новый класс соединений, обладающих мощной и селективной ингибиторной активностью по отношению к 11HSD1. Настоящее изобретение отличается в части предложенных структур и их активностей. Сохраняется потребность в новых методах лечения диабета, метаболического синдрома и когнитивных расстройств. Удовлетворение этих потребностей и является задачей данного изобретения. Настоящее изобретение относится к соединению, структура которого представлена формулой: или его фармацевтически приемлемой соли, где R1 представляет собой -H; где пунктирной линией обозначена точка присоединения к положению заместителя, обозначенногоR22 представляет собой -H. В предпочтительном варианте в указанном выше соединении или его фармацевтически приемлемой соли R1 представляет собой -H;R4 представляет собой -H. В еще одном предпочтительном варианте в указанном выше соединении или его фармацевтически приемлемой соли R5 представляет собой В другом предпочтительном варианте указанное выше соединение представляет собой (R)-3-[3,5 дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-пиперидин-1-илпирролидин-2 он или его фармацевтически приемлемую соль. В другом предпочтительном варианте указанное выше соединение представляет собой (R)-3-[3,5 дихлор-4'-(4-гидроксипиперидин-1-карбонил)бифенил-4-илметил]-1-пиперидин-1-илпирролидин-2-он или его фармацевтически приемлемую соль. Еще один вариант осуществления изобретения относится к описанным здесь новым промежуточным соединениям, предназначенным для приготовления (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-пиперидин-1-илпирролидин-2-она и(R)-3-[3,5-дихлор-4'-(4 гидроксипиперидин-1-карбонил)бифенил-4-илметил]-1-пиперидин-1-илпирролидин-2-она или приемлемых с фармацевтической точки зрения солей указанных соединений, где указанное промежуточное соединение представляет собой Пациенты, страдающие диабетом 2 типа, часто приобретают "инсулиновую резистентность", которая приводит к аномальному гомеостазу глюкозы и гипергликемии, приводящим к более тяжелому течению болезни и преждевременной смертности. Аномальный гомеостаз глюкозы связан с ожирением, гипертензией и изменениями в липидном, липопротеиновом и аполипопротеиновом метаболизме. Больные 2 типом диабета имеют повышенный риск развития сердечно-сосудистых осложнений, например атеросклероза, ишемической болезни сердца, удара, заболевания периферических сосудов, гипертензии, нефропатии, невропатии и ритинопатии. Следовательно, терапевтический контроль за гомеостазом глюкозы,метаболизмом липидов, ожирением и гипертензией важен для контролирования и лечения диабета. Многие пациенты, которые имеют резистентность к инсулину, но не страдают диабетом 2 типа,также находятся в группе риска развития "синдрома X", или "метаболического синдрома". Метаболический синдром характеризуется резистентностью к инсулину, сопровождается аномальным ожирением,гиперинсулинемией, высоким кровяным давлением, низкими уровнями HDL (альфа-липопротеинов высокой плотности), высокими уровнями VLDL (липопротеинов очень низкой плотности), гипертензией,атеросклерозом, ишемической болезнью сердца и хронической почечной недостаточностью. Эти пациенты имеют повышенный риск развития упомянутых выше сердечно-сосудистых осложнений, либо у них развивается клинический сахарный диабет. Предлагаемые соединения вследствие ингибирующего действия на 11HSD1 применимы для лечения широкого ряда состояний и нарушений, в которых улучшение состояния может быть достигнуто за счет ингибирования 11HSD1. Эти нарушения и состояния определяются здесь как "диабетические нарушения" и "нарушения, вызываемые метаболическим синдромом". Только специалист в данной области может отличить "диабетические нарушения" и "нарушения, вызываемые метаболическим синдромом" при вовлечении активности 11HSD1 либо в патофизиологию нарушения, либо в гомеостатический ответ на нарушение. Таким образом, предлагаемые соединения могут найти применение, например,для предупреждения, лечения или облегчения заболеваний и состояний, относящихся к симптомам или последствиям "диабетических нарушений" и "нарушений, вызываемых метаболическим синдромом"."Диабетические нарушения" и "нарушения, вызываемые метаболическим синдромом" включают, но не ограничены, диабеты, диабеты 1 и 2 типа, гипергликемию, гиперинсулинемию, прекращение деятельности бета-клеток, усиление деятельности бета-клеток при восстановлении ответной реакции первой фазы, гипергликемию, вызванную приемом пищи, предотвращение апоптоза, нарушение уровня глюкозы натощак, метаболический синдром, гипогликемию, гипер-/гипокалиемию, нормализацию уровней глю-2 016360 кагона, улучшенное соотношение LDL/HDL, снижение аппетита между приемами пищи, расстройства,связанные с приемом пищи, потерю в весе, синдром поликистоза яичников (PCOS), ожирение, вызванное диабетом, латентные аутоиммунные диабеты взрослых (LADA), инсулит, трансплантацию островковых клеток, диабет у детей, гестационный диабет, поздние осложнения диабета, микро-/макроальбуминурию,нефропатию, ретинопатию, невропатию, диабетические язвы ноги, снижение перистальтики кишечника вследствие введения глюкагона, синдром короткой кишки, антидиарею, увеличенную желудочную секрецию, пониженный кровоток, эректильную дисфункцию, глаукому, послеоперационный стресс, улучшение при повреждении ткани, вызванном реперфузией кровотока после ишемии, ишемическое сердечное повреждение, застойную сердечную недостаточность, сердечную недостаточность, удар, инфаркт миокарда, аритмию, преждевременную смерть, антиапоптоз, заживление раны, ухудшенную переносимость глюкозы (IGT), синдром резистентности к инсулину, метаболический синдром, синдром X, гиперлипидемию, дислипидемию, гипертриглицеридемию, гиперлипопротеинемию, гиперхолестеринемию,артериосклероз, включая атеросклероз, глюкагоному, острый панкреатит, сердечно-сосудистые заболевания, гипертензию, кардиальную гипертрофию, желудочно-кишечные нарушения, ожирение, диабет как следствие ожирения, диабетическую дислипидемию и т.д. Таким образом, объектом настоящего изобретения является применение соединения описанной выше структуры или фармацевтически приемлемой соли указанного соединения в терапии. Еще одним объектом настоящего изобретения является применение соединения описанной выше структуры или фармацевтически приемлемой соли указанного соединения для приготовления лекарственного средства. В дополнение, настоящее изобретение относится к фармацевтической композиции, которая включает соединение указанной выше структуры или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель. Фармацевтическая композиция согласно настоящему изобретению предназначена для ингибирования активности 11HSD1, ингибирования медиаторной активности 11HSD1 в передаче клеточной реакции, для уменьшения тяжести диабета у млекопитающих, для лечения диабетических и других метаболических синдромов у млекопитающих, предупреждения и лечения диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, удара, невропатии и для заживлении ран. Общие термины, используемые для описания соединений в этом документе, имеют обычно приписываемое им значение. В этом документе термины "(C1-C3) алкил", "(C1-C4)алкил" или "(C1-C6)алкил" касаются прямой цепи или разветвленной цепи насыщенных алифатических групп обозначенного числа углеродистых атомов, таких как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и т.п. Термин "(C1-C6)алкокси" представляет собой C1-C6-алкильную группу, присоединенную через атом кислорода, и включает такие фрагменты, как, например, метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа и подобные им группы. Термин "галоген" означает фтор, хлор, бром и йод. Термин "(C3C8)циклоалкил" означает насыщенное или частично насыщенное карбоциклическое кольцо, включающее от 3 до 8 атомов углерода, обычно от 3 до 7 атомов углерода. Примеры (C3-C8)циклоалкила включают, но не ограничены, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и подобные им радикалы. В настоящем документе термин "необязательно замещенный" или "возможные заместители" означает, что рассматриваемые группы либо не имеют замещений, либо имеют замещения одним или несколькими указанными заместителями. Если рассматриваемые группы имеют замещения более чем одним заместителями, то заместители могут быть как одинаковыми, так и различными. Кроме того, использование терминов "независимо", "независимо являются" и "независимо выбраны из" означает, что рассматриваемые группы могут быть как одинаковыми, так и различными. Некоторые из определенных выше терминов могут появляться в структурных формулах более одного раза, в этом случае каждый термин должен быть определен независимо от других. Следует понимать, что морские свинки, собаки, кошки, крысы, мыши, хомяки и приматы, включая человека, являются примерами пациентов и охватываются термином "пациент". Предпочтительные пациенты включают людей. Термин "пациент" включает сельскохозяйственных животных. Сельскохозяйственные животные представляют собой животных, выращиваемых для производства пищевых продуктов. Примерами сельскохозяйственных животных являются жвачные или "жвачные животные", например, коровы, быки, телки, бычки, овцы, буйволы, бизоны, козы и антилопы. Другие примеры сельскохозяйственных животных включают свиней и птицу (домашнюю птицу), например, кур, уток, индюшек и гусей. Предпочтительно пациент, подвергаемый лечению, представляет собой млекопитающее, в частности человека. В настоящем описании термины "лечение", "терапия" и "лечить" включают их общепринятое значение, т.е. действия, направленные на предотвращение, снижение риска возникновения или развития данного состояния или заболевания, предотвращение, ограничение, облегчение течения, улучшение состояния, замедление развития, остановку развития, отсрочку начала возникновения или обращение вспять прогрессирования или снижение тяжести заболевания или состояния у пациента, а также удержа-3 016360 ние на существующем уровне и/или лечение существующих симптомов заболевания, нарушения или патологического состояния, рассмотренного в настоящем описании, включая смягчение или облегчение симптомов или осложнений, или вылечивание или устранение заболевания, нарушения или состояния. В зависимости от необходимости предлагаемые способы включают медикаментозное лечение и/или профилактическую терапию. В соответствии с настоящим описанием термин "терапевтически эффективное количество" означает количество соединения, предлагаемого согласно настоящему изобретению, способное облегчить симптомы различных рассмотренных в настоящем описании патологических состояний. Разумеется, конкретная доза соединения, вводимая в соответствии с настоящим изобретением, должна быть определена в зависимости от конкретных обстоятельств, влияющих на пациента, включающих, например, тип вводимого соединения, путь введения, состояние здоровья пациента и тип патологического состояния, подвергаемого лечению. Термин "композиции" означает фармацевтическую композицию и предназначенную для определения фармацевтического продукта, включающего активный ингредиент (ингредиенты), включающий соединение (соединения), отвечающие формуле I, и инертный ингредиент (ингредиенты), составляющие носитель. Соответственно, фармацевтические композиции, предлагаемые согласно настоящему изобретению,включают любые композиции, приготовленные посредством смешивания соединения, предлагаемого согласно настоящему изобретению, и фармацевтически приемлемого носителя. Термин "подходящий растворитель" относится к любому растворителю или смеси растворителей,инертному по отношению к происходящей реакции, который в достаточной степени растворяет реагенты, создавая среду, в которой протекает нужная реакция. Термин "стандартная лекарственная форма" означает физически дискретные единицы, пригодные в качестве единичных доз, вводимых людям и другим животным, отличным от человека, и при этом каждая единица содержит заранее определенное количество активного материала, которое по расчетам должно вызвать желаемый терапевтический эффект, соединенное с подходящим фармацевтически приемлемым носителем. Соединения, предлагаемые согласно настоящему изобретению, могут иметь один или несколько хиральных центров и могут существовать в виде разнообразных стереоизомерных конфигураций. Вследствие наличия указанных хиральных центров, соединения, предлагаемые согласно настоящему изобретению, могут существовать в виде рацематов, в виде индивидуальных энантиомеров или смесей энантиомеров, а также в виде диастереомеров и смесей диастереомеров. Все указанные рацематы, энантиомеры,диастереомеры и их смеси, как очищенные, так и частично очищенные или неочищенные смеси, включены в область, защищаемую настоящим изобретением. Для примеров, представленных в настоящем описании, если имеется молекула, которая содержит хиральный центр или центры известной конфигурации,то ее стереохимию указывают в названии и в структурном представлении молекулы. Если стереохимия молекулы неизвестна илине определена, то ее стереохимию не указывают в названии и в структурном представлении молекулы. Примеры реализации настоящего изобретения включают рассмотренные ниже Примеры, и, несмотря на то, что рассматриваемый пример может отвечать хиральной или конформационной форме или представлять собой соль этой формы, другие примеры реализации настоящего изобретения включают все другие стереоизомерные или конформационные формы описываемых примеров, а также их фармацевтически приемлемые соли. Указанные примеры реализации включают любые выделенные энантиомеры, диастереомеры и/или конформеры рассматриваемых структур, а также любые смеси, содержащие более одной формы. Кроме того, диастереомеры могут образовываться, если в молекуле присутствует двойная связь или полностью или частично насыщенная циклическая система, или более одного центра асимметрии, или связь с ограниченным вращением вокруг нее. Следует понимать, что любые диастереомеры, в виде разделенных, чистых или частично очищенных диастереомеров или их смесей, также включены в область,защищаемую настоящим изобретением. Кроме того, некоторые из соединений, предлагаемых согласно настоящему изобретению, могут существовать в виде различных таутомерных форм, и в этом случае следует понимать, что любые таутомерные формы, которые могут образовывать указанные соединения,также включены в область, защищаемую настоящим изобретением. В настоящем описании термин "энантиомерно обогащенный" означает повышение доли одного энантиомера по сравнению с другим. Имеющийся удобный способ выражения достигаемой степени обогащения энантиомером представляет собой концепцию энантиомерного избытка, или "ее", в которой, как было показано, используют следующее уравнение: где E1 представляет собой количество первого энантиомера, а E2 представляет собой количество второго энантиомера. Таким образом, если исходное отношение двух энантиомеров равно 50:50, то есть равно отношению энантиомеров в рацемической смеси, и при этом может быть достигнуто энантиомер-4 016360 ное обогащение, достаточное для получения конечного отношения, равного 70:30, то значение ее по отношению к первому энантиомеру будет составлять 40%. В то же время, если конечное отношение будет равно 90:10, то значение ее по отношению к первому энантиомеру будет составлять 80%. Предпочтительными являются значения ее, превышающие 90%, еще более предпочтительными являются значения ее, превышающие 95%, и наиболее предпочтительными являются значения ее, превышающие 99%. Обычный специалист в данной области техники может легко определить значение степени энантиомерного обогащения при помощи стандартных методик и процедур, например посредством газовой хроматографии или жидкостной хроматографии высокого разрешения с использованием хиральной колонки. Принцип выбора соответствующей хиральной колонки, элюента и условий, необходимых для разделения энантиомерной пары, хорошо известен специалистам в данной области техники. Кроме того,конкретные стереоизомеры и энантиомеры соединений, отвечающих формуле I, могут быть приготовлены специалистом в данной области техники при помощи хорошо известных методик и способов, например, подобных описанным в публикации J. Jacques, et al., "Enantiomers, Racemates, and Resolutions", JohnWiley and Sons, Inc., 1981, и E.L. Eliel, S.H. Wilen, "Stereochemistry of Organic Compounds", (WileyInterscience 1994), и в европейской патентной заявкеEP-A-838448 от 29 апреля 1998 г. Примеры способов разделения включают способы перекристаллизации или хиральной хроматографии. Соединения, отвечающие формуле I, могут быть получены обычным специалистом в данной области техники при помощи различных способов, некоторые из которых указаны в методиках и схемах, рассмотренных ниже. Точный порядок операций, которые требуются для приготовления соединений, отвечающих формуле I, зависит от конкретного синтезируемого соединения, исходного соединения и относительной подвижности замещающих фрагментов. Необходимые реактивы или исходные материалы обычно доступны специалистам в данной области техники, а материалы, не имеющие широкого распространения на рынке, могут быть легко синтезированы специалистами в данной области техники по стандартным методикам, обычно применяемым в данной области техники, или по методикам и процедурам,описанным ниже. Нижеследующие схемы, синтезы, примеры и процедуры приведены для лучшего понимания настоящего изобретения и никоим образом не ограничивают область его применения. Специалисты в данной области техники должны понимать, что в предложенных методиках могут быть сделаны различные изменения, которые не изменяют объема и сущности настоящего изобретения. Все публикации, упомянутые в настоящем описании, доступны по уровню специалистам в той области техники, к которой принадлежит настоящее изобретение. Оптимальное время проведения реакций, указанных в схемах, синтезах, примерах и процедурах,может быть определено посредством традиционных хроматографических способов слежения за ходом реакции. Кроме того, реакции, применяемые согласно настоящему изобретению, предпочтительно проводить в инертной атмосфере, например, под аргоном, азотом. Выбор растворителя обычно некритичен,если применяемый растворитель инертен по отношению к происходящей реакции и растворяет реагенты в достаточной степени для осуществления реакции. Предпочтительно соединения выделяют и очищают перед их использованием в последующих реакциях. Некоторые соединения могут кристаллизоваться из реакционных растворов в процессе образования и затем их отделяют фильтрованием, или реакционный растворитель может быть удален экстракцией, испарением или декантацией. При необходимости промежуточные соединения и готовые продукты, отвечающие формуле I, могут быть дополнительно очищены при помощи традиционных методик, например при помощи перекристаллизации или хроматографии на твердых носителях, например силикагеле или оксиде алюминия. Опытные специалисты должны понимать, что не все заместители совместимы со всеми реакционными условиями. В такие соединения на определенном этапе синтеза при помощи способов, известных в данной области техники, могут быть введены защитные группы. Если не указано особо, термины и сокращения, используемые в предлагаемых схемах, синтезах,примерах и процедурах, имеют свои обычные значения. Например, в настоящем описании следующие термины имеют указанное значение: "psi" означает фунты на квадратный дюйм; "TCX (TLC)" означает тонкослойную хроматографию; "ЖХВР (HPLC)" означает жидкостную хроматографию высокого разрешения; "Rf" означает коэффициент удержания; "Rt" означает время удержания; означает части на миллион по стандартной шкале относительно сигнала тетраметилсилана; "МС (MS)" означает массспектрометрию, если не указано особо, термин "наблюдаемая масса (Observed Mass)" означает [M+H]."MS(APCi)" означает хемоионизационную масс-спектрометрию при атмосферном давлении, "УФ (UV)" означает ультрафиолетовую спектрометрию, "1H ЯМР (NMR)" означает спектрометрию протонного ядерного магнитного резонанса. "LCMS" означает жидкостную хроматографию-масс-спектрометрию,"GC/MS" означает газовую хроматографию/масс-спектрометрию. "IR" означает инфракрасную спектрометрию; при этом в ИК спектрах указаны только максимумы поглощения интересующих фрагментов, а не все максимумы поглощения. "RT" означает комнатную температуру.(DCE)" означает дихлорэтан, "DAST" означает трифторид (диэтиламино)серы, "EA/H" означает смесь этилацетата/гексанов, "Pd2(dba)3" означает бис(дибензилиденацетон)палладий, "BINAP" означает 2,2'бис(дифенилфосфино-1,1'-бинафталин), "NMP" означает N-метилпирролидин, "TMSCN" означает триметилсилилцианид, "TBAF" означает тетрабутиламмонийфторид, "Tf2O" означает трифторметансульфоновый ангидрид, "TBSO" означает трет-бутилдиметилсиланилокси, "OTf" означает трифторметансульфонат, MeTi(Oi-Pr)3 означает триизопропоксид метилтитана, "BBr3" означает трибромид бора, "PBr3" означает трибромид трехвалентного фосфора, "Pd(PPh3)4" означает тетракис(трифенилфосфин)палладий(0),"OAc" означает ацетат, "DME" означает диметилэтан, "Et2O" означает диэтиловый эфир, "(Ph3P)4Pd" означает тетракис(трифенилфосфин)палладий(0), "DMFDMA" означает диметилацеталь N,Nдиметилформамида, "Et3N" означает триэтиламин, "tBu" означает трет-бутил, "DIPEA" означает диизопропилэтиламин, "EDC" означает гидрохлорид-(3-диметиламинопропил)-3-этилкарбодиимида, "HOAc" означает уксусную кислоту, "boc" означает трет-бутоксикарбонил. В структуре "Ph" означает фенил,"Me" означает метил, "Et" означает этил, "Bn" означает бензил, "MeOH" означает метанол, "OTf" означает трифторметансульфонат, "TIPSO" означает триизопропилсиланилокси, "TBSO" означает третбутилдиметилсиланилокси. Представленные здесь примеры предназначены только для иллюстрации заявленного изобретения и в любом случае не должны быть истолкованы как ограничение притязаний. Соединения, полученные в Приготовлениях и Примерах, названы в соответствии с AutoNom 2.2 в ChemDraw Ultra или AutoNom 2001 в MDL ISIS/Draw версия 2.5 SP1 из MDL Information Systems, Inc., или в соответствии с ChemicalAbstracts Services. Спектры 1H ЯМР получали в указанных растворителях на спектрометре Varian INOVA 400 МГц. Для проведения жидкостной хроматографии-масс-спектрометрии (LCMS) применяли прибор AgilentHP1100, оборудованный масс-спектрометром (Agilent MSD SL). В качестве неподвижной фазы использовали Waters Xterra C18 (2,150 мм, 3,5 мкм); стандартный способ включал использование градиента 5100% ацетонитрила/метанола (50:50) с добавлением 0,2% формиата аммония в течение 3,5 мин, затем выдерживали при 100% В в течение 0,5 мин при температуре колонки, равной 50C, и расходе, равном 1,0 мл/мин. Другой стандартный способ включал использование градиента 5-100% ацетонитрила/метанола (50:50) с добавлением 0,2% формиата аммония в течение 7,0 мин, затем выдерживали при 100% В в течение 1,0 мин при температуре колонки, равной 50C, и расходе, равном 1,0 мл/мин. Дополнительный масс-спектрометрический анализ, проводимый на Agilent MSD (циклический прибор), представлял собой стандартный проточно-инъекционный анализ (FIA) в отсутствие колонки при скорости потока 80% MeOH с добавлением 6,5 мМ ацетата аммония, равной 0,5 мл/мин, выдерживаемой в течение 30 с. Схема A В соответствии со схемой A в фенол, необязательно замещенный, (1) вводят защитную группу (например, TBSCl), с получением соединения 2, и затем соединение 2 превращают в альдегид (3). Осуществляют реакцию соединения 3 с соединением, содержащим защитную группу (Pg) и уходящую группу(Lg) с образованием простого эфира 4. Pg может представлять собой -CH3 или -CH2-фенил, a Lg может представлять собой метилсульфонат или галоген. Предпочтительно соединение Lg-Pg представляет собой I-CH3 или Br-CH2-фенил. Полученный альдегид восстанавливают с образованием спирта (5) и затем превращают в соединение 6. Предпочтительно соединение 5 галогенируют при помощи PBR3 с образованием 2-бромметильного производного. Способы введения и снятия защитных групп в соединениях, которые образуют соединения, отвечающие формуле I, и в других соединениях, хорошо известны специалистам в данной области техники и На схеме B показан стереоспецифический синтез, приводящий к получению промежуточного соединения 9. Соединение 7 получают ацилированием коммерчески доступного (R)-4-бензилоксазолидин 2-она 4-пентеноилхлоридом. Затем его алкилируют соединением 6, возможно имеющим заместители (см. схему A), с образованием соединения 8. Соединение 8 окисляют с образованием промежуточного альдегида 9 под действием озона и трифенилфосфина или тетраоксида осмия и окислителя, например, метапериодата натрия. Схема C На схеме C показано получение соединения формулы Ia, исходя из промежуточного соединения 9. Приготовление 1. 2,6-Дихлор-4-гидроксибензальдегид. 3,5-Дихлорфенол (1 кг, 6,13 моль) растворяют в 3 л диметилформамида (ДМФА) и охлаждают до 0C. Добавляют имидазол (918,74 г, 6,75 моль), а затем добавляют трет-бутилдиметилсилилхлорид(1017,13 г, 6,75 моль). Смесь нагревают до комнатной температуры и перемешивают в течение 15 мин. Выливают в воду (6 л) и экстрагируют эфиром (4 л). Органический слой 2 раза промывают водой, 10%-м водным раствором хлорида лития, затем соляным раствором и сушат над сульфатом натрия. Фильтруют и концентрируют в вакууме, получая трет-бутил-(3,5-дихлорфенокси)диметилсилан(1700 г) в виде масла. трет-Бутил-(3,5-дихлорфенокси)диметилсилан (425 г, 1,5 моль) растворяют в 4 л сухого тетрагидрофурана и охлаждают до -68C. Медленно добавляют 1,1 эквивалента втор-бутиллития (103,1 г, 1,61 моль) при -68C (1,75 ч). По окончании добавления реакционную смесь перемешивают при -70C в течение 30 мин. Добавляют диметилформамид (168,5 г, 2,3 моль) и реакционную смесь перемешивают при-70C в течение 1 ч. Добавляют 1 М соляную кислоту в воду (3,5 л) и реакционную смесь оставляют нагреваться до комнатной температуры. Реакционную смесь выливают в эфир (5 л), промывают водой, затем соляным раствором. Сушат над сульфатом натрия и концентрируют в вакууме до получения оранжевого твердого вещества. Размешивают с холодным хлористым метиленом и фильтруют. Выход 250 г (80%) бледно-желтого твердого вещества. Приготовление 2. 2,6-Дихлор-4-метоксибензальдегид. 2,6-Дихлор-4-гидроксибензальдегид (120 г, 628,24 ммоль) и карбонат калия (173,65 г, 1256,5 ммоль) помещают в 900 мл диметилформамида и обрабатывают йодметаном (107 г, 753,9 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Отфильтровывают твердые вещества и выливают в 6 л воды. Отфильтровывают твердые вещества, несколько раз промывают водой, сушат на воздухе и растворяют в этилацетате. Промывают водой, а затем добавляют солевой раствор и затем сушат над сульфатом натрия. Фильтруют и концентрируют в вакууме приблизительно до объема 100 мл; при этом из раствора начинают выпадать твердые вещества. Фильтруют и затем фильтрат концентрируют с образованием второй порции твердых веществ. Промывают гексаном, объединяют все твердые вещества и сушат в вакууме. Выход 112,3 г беловатого твердого вещества: 1H ЯМР (400 МГц, CDCl3)10,41 (с, 1H), 6,90 (с, 2H), 3,87 (с, 3H). Приготовление 3. 2,6-Дихлор-4-бензилоксибензальдегид. Смесь 2,6-дихлор-4-гидроксибензальдегида (250 г, 1,3 моль) и карбоната калия (361,8 г, 2,62 моль) в 2 л диметилформамида обрабатывают бензилбромидом (268,64 г, 1,57 моль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Отфильтровывают твердые вещества и выливают в 12 л воды. Отфильтровывают твердое вещество, несколько раз промывают водой, сушат на воздухе и растворяют в этилацетате. Сушат над сульфатом магния, фильтруют и концентрируют в вакууме до 1,5 л. Оставляют на ночь, после чего фильтруют. Твердое вещество промывают минимальным количеством гексана и сушат в вакууме. Фильтрат концентрируют в вакууме и размешивают с гексаном, получая вторую порцию продукта, которую объединяют с первой порцией и получают 245 г белых кристаллов. Повторяя, получают третью порцию, равную 80 г, в виде светло-коричневатого порошка (общий выход: 88%). 1H ЯМР (400 МГц, ДМСО-d6)10,26 (с, 1H), 7,43 (м, 5H), 7,28 (с, 2H), 5,25 (с, 2H). Приготовление 4. (2,6-Дихлор-4-метоксифенил)метанол. 2,6-Дихлор-4-метоксибензальдегид (112 г, 546 ммоль) суспендируют в 1500 мл этанола и охлаждают на ледяной бане до 7C. Порциями добавляют боргидрид натрия (20,67, 546 ммоль), получая раствор. Ледяную баню убирают и перемешивают в течение 2 часов. Реакционную смесь осторожно добавляют в насыщенный раствор хлорида аммония (4 л) и перемешивают до полного тушения. Экстрагируют дихлорметаном (31 л) и объединенные органические экстракты сушат над сульфатом натрия. Фильтруют и концентрируют в вакууме с получением 113 г светло-коричневатого твердого вещества: 1H ЯМР (400 МГц, CDCl3)6,86 (с, 2H), 4,86 (с, 2H), 3,78 (с, 3H), 2,07 (с, 1H). Приготовление 5. (2,6-Дихлор-4-бензилоксифенил)метанол. Вышеназванное соединение получают по существу в соответствии с приготовлением 4. ЯМР(2,6-Дихлор-4-метоксифенил)метанол (113 г, 545,76 ммоль) растворяют в 1200 мл сухого ТГФ и охлаждают до 0C в атмосфере азота. В атмосфере азота добавляют PBr3 (59,1 г, 218,3 ммоль) и перемешивают при 0C в течение 30 мин. Выливают в насыщенный водный NaHCO3 и экстрагируют EtOAc. Сушат и концентрируют в вакууме. Выход 129,4 г продукта в виде беловатого твердого вещества. ЯМР(CDCl3)6,88 (с, 2H), 4,73 (с, 2H), 3,79 (с, 3H). Приготовление 7. 2-Бромметил-1,3-дихлор-5-бензилоксибензол. Вышеназванное соединение получали по существу в соответствии с приготовлением 6 с выходом 89%. Масс-спектр (m/z) : 347 (M+1). Приготовление 8. (R)-4-Бензил-3-пент-4-еноилоксазолидин-2-он. 12-л 3-горлую круглодонную колбу, оснащенную механической мешалкой, внутренним термометром, вводом азота и 1-л капельной воронкой, в течение 20 мин продувают азотом, затем добавляют (R)-4 бензил-2-оксазолидинон (250 г, 1,41 моль). Разбавляют тетрагидрофураном (THF) (1,8 л), затем охлаждают на бане ацетон/сухой лед до температуре в колбе -74C. Посредством канюли переносят 1,6 М гексанов раствор н-бутиллития (970 мл, 1,552 моль) в капельную воронку и добавляют по каплям к оксазолидиновому раствору с такой скоростью, чтобы температура в колбе не превышала -65C. По окончании дозировки колбу оставляют при охлаждении еще на 30 мин. 4-Пентеноилхлорид (175 мл, 1,585 моль) переносят в капельную воронку и добавляют по каплям к раствору аниона в течение 25 мин. Реакционную массу перемешивают 45 мин на охлаждающей бане. Затем убирают охлаждение и перемешивают реакционную смесь в течение 18 ч, при этом она медленно достигает комнатной температуры. Смесь разбавляют 1 н. водным раствором хлористо-водородной кислоты (1,5 л) и диэтиловым эфиром (1 л). После отделения слоев органический слой промывают водой (21 л), затем насыщенным соляным раство-8 016360 ром (1 л). Объединенные водные слои экстрагируют эфиром (1 л). Органические слои объединяют и сушат над сульфатом магния, фильтруют и упаривают до получения 390 г светло-желтого масла. Продукт очищают хроматографией через силикагель, используя смесь гексаны:этилацетат, выход 345 г (94,5%) прозрачного желтого масла. Приготовление 9. (R)-4-Бензил-3-[(S)-2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-он. В 12-л 3-горлой круглодонной колбе, оснащенной механической мешалкой, внутренним термометром, вводом азота и капельной воронкой в токе азота при охлаждении до 75C перемешивают (R)-4 бензил-3-пент-4-еноилоксазолидин-2-он (345 г, 1,33 моль) и THF (1,8 л). В капельную воронку помещают 1 М LiHMDS (1,6 л) и дозируют в реакционную массу с такой скоростью, чтобы температура смеси не превышала -60C. По окончании дозировки реакционную массу перемешивают при -25C 30 мин, затем охлаждают до температуры около -60C. При этой температуре прибавляют порциями твердый 2 бромметил-1,3-дихлор-5-бензилоксибензол в течение 5 мин. По окончании дозировки реактор помещают в ацетоновую баню с температурой -10C и поддерживают температуру реакционной смеси ниже 10C в течение 1 ч. Смесь охлаждают до 0C, далее нейтрализуют 2 л 1 н. водного раствора соляной кислоты. Смесь переносят в 22-л делительную воронку, разбавляют 2,5 л воды и 2 л эфира. Разделяют слои, водный слой экстрагируют эфиром. Объединенные органические слои сушат над сульфатом магния, фильтруют, после упаривания получают 800 г густого масла. Очищают хроматографией на силикагеле, используя элюент гексаны:этилацетат. Выход 597 г (86%) бесцветного масла. Приготовление 10. (R)-4-R)-4-Бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси-2,6-дихлорбензил)-4-оксомасляный альдегид. Смесь (R)-4-бензил-3-[(S)-2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-она (100 г, 190,68 ммоль) с дихлорметаном (800 мл) охлаждают до -74C. Через реакционную массу пропускают озон, полученный посредством A-113 генератора озона при интенсивности 75%, в токе воздуха со скоростью 5 кубических футов (142 л) в минуту до перехода цвета раствора в синий цвет (около 3 ч). Добавляют трифенилфосфин (60 г, 228,8 ммоль), растворенный в 200 мл дихлорметана, реакционную массу оставляют перемешиваться при комнатной температуре в течение ночи. Раствор упаривают в вакууме,очищают посредством хроматографии на силикагеле, используя градиент 20-50% этилацетата в гексанах. Выход 82,1 г (82%) титульного соединения в виде белой пенистой массы. Масс-спектр (m/z): 526 (M+). Альтернативная методика получения (R)-4-R)-4-бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси 2,6-дихлорбензил)-4-оксомасляного альдегида. Смесь (R)-4-бензил-3-[(S)-2-(4-бензилокси-2, 6-дихлорбензил)пент-4-еноил]оксазолидин-2-она (0,96 г, 1,8 ммоль), ТГФ (21 мл) и воды (7 мл) обработали 2,5% раствором тетраоксида осмия в трет-бутаноле(46 мг, 0,18 ммоль). Добавляют периодат натрия (1,17 г, 5,5 ммоль) и перемешивают реакционную массу при комнатной температуре 4 ч. Затем реакцию останавливают путем добавления воды и экстрагируют этилацетатом. Органическую фазу промывают водным 1 н. раствором тиосульфата натрия, затем насыщенным соляным раствором. Органический слой сушат над сульфатом магния, фильтруют, упаривают в вакууме. Неочищенный продукт подвергают очистке путем хроматографии на силикагеле, используя в качестве элюента гексаны:этилацетат. Упаривают в вакууме фракции, которые содержат продукт. Выход 0,46 г (48%) титульного соединения. Масс-спектр (m/z): 526 (M+). Приготовление 11. (R)-4-Бензил-3-[(S)-2-(4-метокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2 он. Смесь (R)-4-бензил-3-пент-4-еноилоксазолидин-2-она (5,0 г, 19,3 ммоль) перемешивают с 75 мл ТГФ в 250-мл круглодонной колбе при охлаждении до -75C. С помощью шприца в колбу вносят 2 М(14,5 мл) LDA (литийдиизопропиламид) с такой скоростью, чтобы температура реакционной смеси не поднималась выше -60C. По окончании дозировки смесь оставляют перемешиваться при -25C 30 мин. Затем охлаждают до -60C. При этой температуре добавляют 2-бромметил-1,3-дихлор-5-метоксибензол(1,16 г, 28,96 ммоль) в ТГФ (25 мл). По окончании дозировки реакционной смеси позволяют медленно нагреться до 0C и промежуточная реакция проходит при 0C в течение 4 ч. Реакцию гасят 30 мл водного раствора 1 н. соляной кислоты. Смесь переносят в 500-мл делительную воронку и разбавляют 100 мл воды и 100 мл эфира. Слои разделяют, водный слой экстрагируют эфиром. Объединенные органические слои сушат над сульфатом натрия, фильтруют и концентрируют, получают густое масло. Последнее подвергают очистке методом хроматографии на силикагеле, элюент гексаны:этилацетат. Выход 6,65 г (76%) продукта в виде бледно-желтого масла. Приготовление 12. (R)-4-R)-4-Бензил-2-оксооксазолидин-3-ил)-3-(4-метокси-2,6-дихлорбензил)-4 оксомасляный альдегид. Смесь (R)-4-бензил-3-[(S)-2-(4-метокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-она (6,65 г,14,87 ммоль), ТГФ (140 мл) и воды (45 мл) обработали 2,5% раствором тетраоксида осмия в третбутаноле (378 мл, 1,487 ммоль). Добавляют периодат натрия (9,55 г, 44,63 ммоль) и перемешивают реакционную массу при комнатной температуре 4 ч. Смесь разбавляют водой и экстрагируют этилацетатом. Водные слои промывают 1 н. раствором тиосульфата натрия, затем насыщенным раствором соли. Орга-9 016360 нические слои сушат над сульфатом магния, фильтруют, концентрируют в вакууме. Сырой продукт очищают хроматографированием через силикагель, в качестве элюента используют гексаны:этилацетат. Упаривают фракции, содержащие продукт, в вакууме. Получают 3,35 г (49%) желаемого продукта. Массспектр (m/z): 451 (M+). Приготовление 16. Гидрохлорид (R)-3-(2,6-дихлор-4-метоксибензил)-1-пиперидин-1-илпирролидин-2-она. К раствору (R)-4-R)-4-бензил-3-[2-(4-метокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-она(0,90 г, 2 ммоль) в ТГФ (20 мл) при комнатной температуре добавляют 1-аминопиперидин (0,40 г, 4 ммоль) и уксусную кислоту (0,2 мл). Реакционную смесь перемешивают при комнатной температуре 20 мин, добавляют триацетоксиборгидрид натрия (1,69 г, 8 ммоль) и продолжают перемешивание при комнатной температуре 12 ч. Смесь делят посредством этилацетата (20 мл) и воды (20 мл). Органический слой отделяют, промывают три раза водой (каждый раз по 15 мл) и затем промывают насыщенным раствором соли. Затем органический слой сушат над сульфатом натрия, фильтруют и упаривают в вакууме. Очистка остатка посредством хроматографии на силикагеле, элюент 2:3 смесь гексан:этилацетат приводит к свободному основанию титульного соединения, после обработки 1 М HCl в эфире получают 0,34 г,(43%): масс-спектр (m/z) : 357 (M+). Приготовление 17. (R)-3-(2,6-Дихлор-4-гидроксибензил)-1-пиперидин-1-илпирролидин-2-он. Раствор гидрохлорида (R)-3-(2,6-дихлор-4-метоксибензил)-1-пиперидин-1-илпирролидин-2-она(0,27 г) в дихлорэтане (10 мл) охладили до -20C и затем добавили 1 М раствор трехбромистого бора в дихлорметане (2,5 мл). Реакционную смесь перемешивают при температуре -20C еще 1 ч и 12 ч при комнатной температуре. Смесь разделяют добавлением дихлорметана (20 мл) и насыщенного раствора бикарбоната натрия (15 мл). Органический слой отделяют. Сушка органического слоя над сульфатом натрия, фильтрование и упаривание в вакууме приводит к 0,18 г (76%) титульного соединения: массспектр МС (m/z): 343 (M+). Приготовление 13. 3,5-Дихлор-4-(2-оксо-1-пиперидин-1-илпирролидин-3-илметил)фениловый эфир(R)-трифторметансульфокислоты. Раствор (R)-3-(2,6-дихлор-4-гидроксибензил)-1-пиперидин-1-илпирролидин-2-она (1,02 г, 2,98 ммоль) и пиридина (2,4 г, 30 ммоль) в CH2Cl2 (20 мл) при 0C обрабатывают ангидридом трифторметансульфокислоты (2,69 г, 9,54 ммоль) в течение 1 ч. Реакционную массу разбавляют CH2Cl2 и промывают 1 н. HCl и водой. Органический слой сушат (Na2SO4), отгоняют растворитель, остаток очищают с помощью хроматографии на силикагеле. Выход 0,65 г (46%) титульного соединения. Масс-спектр МС (m/z): 475 (M+). Приготовление 14. Метиловый эфир (R)-3',5'-дихлор-4'-(2-оксо-1-пиперидин-1-илпирролидин-3 илметил)дифенил-4-карбоновой кислоты. Смесь 3,5-дихлор-4-(2-оксо-1-пиперидин-1-илпирролидин-3-илметил)фенилового эфира (R)трифторметансульфокислоты (0,236 г, 0,5 ммоль), 4-метоксикарбонилфенилбороновой кислоты (0,134 г,0,75 ммоль), карбоната натрия (0,158 г, 1,5 ммоль) в ТГФ (20 мл) и воде (5 мл) доводят до 60C. При 60C к смеси добавляют Pd(PPh3)4 (0,029 г, 0,025 ммоль), поднимают температуру смеси до 80C, перемешивают 3 ч. После охлаждения разбавляют этилацетатом, промывают водой и насыщенным раствором соли. Сушат органический слой (Na2SO4), растворитель отгоняют в вакууме, полученный сырой продукт очищают на колонке с силикагелем, градиент 25%-50% этилацетат в гексанах, выход 0,22 г (95%) титульного соединения. Масс-спектр (m/z): 461 (M+). Приготовление 15. (R)-3',5'-дихлор-4'-(2-оксо-1-пиперидин-1-илпирролидин-3-илметил)дифенил-4 карбоновая кислота. Раствор метилового эфира (R)-3',5'-дихлор-4'-(2-оксо-1-пиперидин-1-илпирролидин-3-илметил) дифенил-4-карбоновой кислоты (0,21 г) в ТГФ (10 мл) обрабатывают 5 н. NaOH (1 мл) и перемешивают при 60C 12 ч. Смесь распределяют в этилацетате и воде. Органический слой сушат (Na2SO4) и отгоняют растворитель в вакууме. Получают 0,19 г (93%) титульного соединения. Масс-спектр (m/z): 447 (M+). Пример 1. (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)дифенил-4-илметил]-1 пиперидин-1-илпирролидин-2-он. Раствор (R)-3',5'-дихлор-4'-(2-оксо-1-пиперидин-1-илпирролидин-3-илметил)дифенил-4-карбоновой кислоты (0,090 г, 0,2 ммоль) в CH2Cl2 (10 мл) обрабатывают 1,1'-карбонилдиимидазолом (0,065 г, 0,4 ммоль) и перемешивают 1 ч при комнатной температуре. Реакционную массу обрабатывают гидрохлоридом 4-трифторметилпиперидина (0,057 г, 0,3 ммоль) и диизопропилэтиламином (0,039 г, 0,3 ммоль) и перемешивают 12 ч при комнатной температуре. Очищают на колонке с силикагелем с градиентом от 25% до 75% этилацетата в гексанах. Получают 0,065 г (55%) титульного соединения. Масс-спектр (m/z): Раствор (R)-3',5'-дихлор-4'-(2-оксо-1-пиперидин-1-илпирролидин-3-илметил)дифенил-4-карбоновой кислоты (0,102 г, 0,228 ммоль) в CH2Cl2 (10 мл) обрабатывают 1,1'-карбонилдиимидазолом (0,074 г, 0,457 ммоль) и перемешивают 1 ч при комнатной температуре. Реакционную массу обрабатывают 4 гидроксипиперидином (0,065 г, 0,34 ммоль) и диизопропилэтиламином (0,044 г, 0,34 ммоль) и перемешивают 12 ч при комнатной температуре. Смесь очищают на колонке с силикагелем, элюент 100% этилацетат и 10% метанол в дихлорметане. Получают 0,107 г (89%) титульного соединения. Масс-спектр: (m/z): 530 (M+). В следующем разделе описан ферментативный и функциональный анализ, применяемый для оценки действия соединений, предлагаемых согласно настоящему изобретению. Ферментативный анализ 11-HSD типа 1. Активность человеческой 11-HSD типа 1 измеряли при помощи флуоресцентного анализа, оценивая выработку НАДФН (восстановленный никотинамидадениндинуклеотидфосфат). Твердые соединения растворяют в ДМСО до концентрации 10 мМ. Двадцать микролитров каждого раствора затем переносили в колонку 96-луночного полипропиленового планшета марки Nunc, где производят дальнейшее разбавление в 50 раз с последующим двукратным титрованием, десять раз в поперечном направлении планшета, с добавлением дополнительного количества ДМСО и использованием автоматизированной системы Tecan Genesis 200. Затем планшеты переносили в систему Tecan Freedom 200, снабженную 96 луночной головкой Tecan Temo и планшетным анализатором Ultra 384. Реагенты помещают в 96 луночные полипропиленовые планшеты Nunc и индивидуально распределяют по черным 96-луночным планшетам High Efficiency от Molecular Devices (емкость 40 (мкл/лунка: 9 мкл/лунка субстрата (2,22 мМ НАДФ, 55,5 мкМ кортизола, 10 мМ Трис, 0,25% Prionex, 0,1% Тритона X100), 3 мкл/лунка воды в лунки, содержащие соединение, или 3 мкл в контрольные и стандартные лунки, 6 мкл/лунка рекомбинантного человеческого фермента 11-HSD первого типа, 2 мкл/лунка раствора соединения. Для окончательного определения процентного ингибирования добавляли ряд лунок, которые представляли собой минимум и максимум определения: один набор содержал субстрат с 667 мкМ карбеноксолона (фон), а другой набор содержал субстрат и фермент, но не содержал тестируемого соединения (максимальный сигнал). Конечные концентрации в ДМСО составляли 0,5% для всех соединений, контрольных и стандартных. Затем планшеты на 15 с помещали в шейкер механической рукой Tecan, а затем закрывали и помещали в накопитель для инкубации в течение 3 ч при комнатной температуре. По завершении инкубации механическая рука извлекала каждый планшет по отдельности из накопителя и помещала их в положение, в котором производили добавление 5 мкл/лунка раствора карбеноксолона с концентрацией 250 мкМ для прекращения ферментной реакции. Затем планшеты встряхивали еще в течение 15 с, а затем помещали в анализатор планшетов Ultra 384 (355 ЕХ/460 ЕМ), при помощи которого определяли флуоресценцию НАДФН. Данные для приведенных в примерах соединений в 11HSD1 анализе показаны ниже: Соединения, предлагаемые согласно настоящему изобретению, можно исследовать на селективность по отношению к 11HSD2 при помощи теста, аналогичного описанному для 11-HSD1, но в котором используют фермент 11-HSD2. Испытание с использованием фермента 11-HSD2 может быть проведено при помощи способов, рассмотренных в настоящем описании, или способов, известных в данной области техники. Биологическое испытание на клетках гладкой мускулатуры аорты человека. Первичные клетки гладкой мускулатуры аорты человека (AoSMC) культивировали в питательной среде, содержащей 5% FBS (эмбриональная сыворотка телят) при количестве пассажей, равном 6, а затем гранулировали путем центрифугирования и суспендировали при плотности 9104 клеток/мл в среде для количественного определения, содержащей 0,5% FBS и 12 нг/мл hTNF для стимулирования экспрессии 11-HSD1. Клетки высевали на 96-луночные аналитические планшеты для выращивания тканевой куль- 11016360 туры с концентрацией 100 мкл/лунка (9103 клеток/лунка) и инкубировали в течение 48 ч при 37C, 5%CO2. После индуцирования клетки инкубировали в течение 4 ч при 37C, 5% CO2 в среде для анализа,содержащей тестируемые соединения, и добавляли 10 мкМ кортизона, растворенного в среде для анализа, при концентрации 10 мкл/лунка, и инкубировали в течение 16 ч при 37C, 5% CO2. Среду из каждой лунки переносили на планшет для последующего анализа кортизола методом конкурентного флуоресцентного иммуноанализа с временным резонансным разрешением. В растворе конъюгат аллофикоцианин(APC)-кортизол и свободный кортизол конкурируют за связывание комплекса мышиное антитело к кортизону/европий (Eu)-антимышиный IgG. Более высокие уровни свободного кортизола приводят к снижению переноса энергии от европия-IgG к комплексу АРС-кортизол, что снижает флуоресценцию APC. Интенсивности флуоресценции европия и APC измеряют, используя LJL Analyst AD. Возбуждение европия и APC измеряют, используя возбуждение при 360 нм и эмиссионные фильтры на 615 нм и 650 нм,соответственно. Параметры временного разрешения для европия составляли: время интегрирования 1000 мкс, задержка 200 мкс. Параметры APC составляли: время интегрирования 150 мкс, задержка 50 мкс. Интенсивности флуоресценции, измеренные для APC, модифицировали делением на значение флуоресценции Eu (APC/Eu). Это отношение затем использовали для определения неизвестной концентрации кортизола, которое осуществляли путем интерполяции с использованием стандартной кривой для кортизола, приведенной в соответствии с 4-параметрическим логистическим уравнением. Указанные концентрации затем использовали для определения активности соединений путем построения зависимости концентрации от % ингибирования, приведенной в соответствии с 4-параметрической кривой и показывающей IC50. Данные для приведенных в примерах соединений, полученные при биологическом испытании на гладкомышечных клетках человеческой аорты, показаны ниже: Ускоренный анализ конверсии кортизона in vivo. В общем случае соединения вводили мышам перорально, и спустя определенное время после введения соединения мышам делали подкожную инъекцию кортизона, и спустя еще некоторое время у мышей брали кровь на анализ. Отделяли сыворотку крови и анализировали методом жидкостной хроматографии-масс-спектрометрии/масс-спектрометрии, устанавливая уровень кортизона и кортизола, а затем устанавливали среднее содержание кортизола и процентное замедление в каждой группе испытуемых мышей. В частности, от Harlan Sprague Dawley были поставлены самцы мышей C57BL/6, средняя масса тела которых составляла 25 г. Точные массы определяли сразу после получения мышей, и затем мышей делили на группы на основании близких масс. Различные дозы соединений готовили в смесях 1 мас.% гидроксиэтилцеллюлозы (HEC), 0,25 мас.% полисорбата 80, 0,05 мас.% противовспенивателя Dow Corning 1510-US на основании средней массы, которую принимали равной 25 г. Соединения вводили перорально по 200 мкл каждому животному, а затем одному животному вводили подкожно 200 мкл кортизона в отношении 30 мг/кг спустя от 1 до 24 ч после введения соединения. Спустя 10 мин после стимулирования кортизоном каждое животное умерщвляли путем помещения на 1 мин в камеру, заполненнуюCO2, затем отбирали кровь путем пункции сердца в пробирки для отделения сыворотки. После полного сворачивания крови в пробирках их центрифугировали при 2500g, 4C в течение 15 мин, сыворотку переносили в лунки 96-луночных планшетов (блок пробирок Corning Inc, Costar 4410, 1,2 мл, полипропилен) и замораживали планшеты при -20C до начала анализа методом жидкостной хроматографиимасс-спектрометрии/масс-спектрометрии. Для анализа образцы сыворотки размораживали и осаждали белок добавлением ацетонитрила, содержащего внутренний стандарт d4-кортизола. Образцы перемешивали вихревым образом (на вортексе) и центрифугировали. Жидкость над осадком удаляли и сушили в токе теплого азота. Экстракты вновь растворяли в смеси метанол/вода (1:1) и вводили в систему для жидкостной хроматографии-масс-спектрометрии/масс-спектрометрии. Уровни кортизона и кортизола оценивали в режиме селективного мониторинга реакции с последующей ACPI ионизацией на тройном квадрупольном масс-спектрофотометре. Данные ускоренного анализа конверсии кортизона in vivo, полученные для приведенных в примерах соединений, приведены ниже: Фармацевтически приемлемые соли и общие способы их приготовления известны в данной области техники. См., например, P. Stahl, et al., Handbook of pharmaceutical salts: properties, selection and use,(VCHA/WILEY-VCH, 2002); S.M. Berge, et al., "Pharmaceutical Salts," Journal of Pharmaceutical Sciences,Vol. 66, No. 1, January 1977. Соединения, предлагаемые согласно настоящему изобретению, предпочтительно изготавливают в виде фармацевтических составов, вводимых различными способами. Наиболее предпочтительными являются составы для перорального введения. Такие фармацевтические составы и способы их приготовления хорошо известны в данной области техники. См., например, Remington: thescience and practice of pharmacy (A. Gennaro, et al., eds., 19th ed., Mack Publishing Co., 1995). Конкретная доза соединения, отвечающего формуле (I), или его фармацевтически приемлемой соли, необходимая для получения эффективного количества, определяемого согласно настоящему изобретению, зависит от конкретных обстоятельств и состояний, подвергаемых лечению. Выбор дозы, способа введения и частоты введения лучше всего поручить лечащему врачу. В общем случае приемлемые и эффективные дозировки для перорального или парентерального введения составляют приблизительно от 0,1 мг/кг/сутки приблизительно до 10 мг/кг/сутки, что означает приблизительно от 6 мг до 600 мг, и чаще от 30 мг до 200 мг для человека. Такие дозы вводят пациенту, нуждающемуся в лечении, от одного до трех раз в сутки или с такой частотой, которая требуется для лечения заболевания, выбираемого из заболеваний, рассмотренных в настоящем описании. Специалист в области приготовления рецептур может легко выбрать нужную форму и способ введения в зависимости от конкретных характеристик выбранного соединения, нарушения или состояния,подвергаемого лечению, стадии развития нарушения или состояния или других относящихся к данному вопросу факторов (Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990. Заявляемые соединения могут быть введены при помощи ряда способов. При проведении лечения пациента,страдающего рассмотренным в настоящем описании заболеванием или склонного к развитию рассмотренного в настоящем описании заболевания, соединение формулы (I) или его фармацевтически приемлемая соль могут быть введены в любой форме или любым способом, который позволяет сделать эффективное количество указанного соединения или соли биодоступным, включая пероральное и парентеральное введение. Например, активные соединения могут быть введены ректально, перорально, ингаляционно или подкожным, внутримышечным, внутривенным, трансдермальным, интраназальным, ректальным,офтальмологическим, топическим, сублингвальным, буккальным или другим способом. Для лечения рассмотренных в настоящем описании нарушений предпочтительным является пероральный способ введения. В тех случаях, когда пероральный способ введения невозможен или не является предпочтительным, состав может быть приготовлен в форме, пригодной для парентерального введения, например,внутривенного, внутрибрюшинного или внутримышечного введения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение структурной формулы или его фармацевтически приемлемая соль,где R1 представляет собой -H; где пунктирной линией обозначена точка присоединения к положению заместителя, обозначенногоR22 представляет собой -H. 2. Соединение по п.1, в котором R1 представляет собой -H; R2 представляет собой -хлор; R3 представляет собой -хлор и R4 представляет собой -Н, или его фармацевтически приемлемая соль. 3. Соединение по п.1 или 2, в котором R5 представляет собой или его фармацевтически приемлемая соль. 4. Соединение по п.1, которое представляет собой (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин 1-карбонил)бифенил-4-илметил]-1-пиперидин-1-илпирролидин-2-он, или его фармацевтически приемлемая соль. 5. Соединение по п.1, которое представляет собой (R)-3-[3,5-дихлор-4'-(4-гидроксипиперидин-1 карбонил)бифенил-4-илметил]-1-пиперидин-1-илпирролидин-2-он, или его фармацевтически приемлемая соль. 6. Фармацевтическая композиция, включающая соединение по любому из пп.1-5 или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель. 7. Применение соединения по любому из пп.1-5 или фармацевтически приемлемой соли указанного соединения в терапии. 8. Применение соединения по любому из пп.1-5 или фармацевтически приемлемой соли указанного соединения для приготовления лекарственного средства. 9. Промежуточное соединение для синтеза соединений по п.4 или 5, где указанное промежуточное соединение представляет собой
МПК / Метки
МПК: C07D 401/14, A61P 3/10, A61K 31/4545
Метки: основе, фармацевтическая, применение, дегидрогеназы, 11-бета-гидроксистероид, композиция, ингибиторы
Код ссылки
<a href="https://eas.patents.su/15-16360-ingibitory-11-beta-gidroksisteroid-degidrogenazy-1-farmacevticheskaya-kompoziciya-na-ih-osnove-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы 11-бета-гидроксистероид дегидрогеназы 1, фармацевтическая композиция на их основе и их применение</a>
Предыдущий патент: Безопасная личная карточка и способ ее использования
Случайный патент: Способ стабилизации альдегида