Ингибиторы 11-бета-гидроксистероид дегидрогеназы 1
Номер патента: 15516
Опубликовано: 31.08.2011
Авторы: Виннероски Леонард Лэрри, Мэбри Томас Эдвард, Сюй Яньпин, Ли Жэньхуа, Уоллэйс Оуэн Брендан
Формула / Реферат
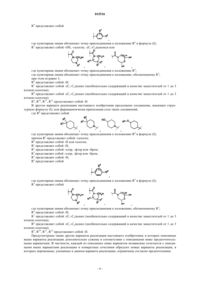
1. Соединение, имеющее структурную формулу
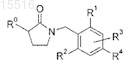
где R0 представляет собой
![]()
при этом пунктирная линия обозначает точку присоединения к положению R0;
причем Ra представляет собой -H или -галоген; Rb представляет собой -H или галоген; Rc представляет собой -H;
R1 представляет собой -галоген;
R2 представляет собой -галоген;
R3 представляет собой -H;
R4 представляет собой -OH, -галоген, -(C1-C6)алкокси или
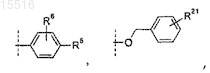
где пунктирная линия обозначаем точку присоединения к положению R4;
R5 представляет собой -H, -галоген, -C(O)OH, -C(O)O-(C1-C6)алкил, -фенил или
где пунктирная линия обозначает точку присоединения к положению, обозначенному R5;
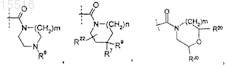
при этом m равно 1;
при этом n равно 1;
R6 представляет собой -H;
R7 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);
R8 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);
R9 представляет собой -H;
R20 представляет собой -H;
R21 представляет собой -H;
R22 представляет собой -H;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что R0 представляет собой
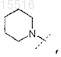
или его фармацевтически приемлемая соль.
3. Соединение по п.1, отличающееся тем, что R0представляет собой
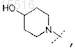
или его фармацевтически приемлемая соль.
4. Соединение по п.1, отличающееся тем, что R0 представляет собой
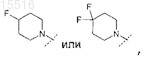
или его фармацевтически приемлемая соль.
5. Соединение по п.1, отличающееся тем, что R0 представляет собой

или его фармацевтически приемлемая соль.
6. Соединение по п.1, отличающееся тем, что R0 представляет собой
![]()
или его фармацевтически приемлемая соль.
7. Соединение по любому из пп.1-6, отличающееся тем, что R1 представляет собой -хлор, R2представляет собой -хлор и R3 представляет собой -H, или его фармацевтически приемлемая соль.
8. Соединение по любому из пп.1-7, отличающееся тем, что R4 представляет собой
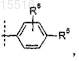
или его фармацевтически приемлемая соль.
9. Соединение по любому из пп.1-7, отличающееся тем, что R4 представляет собой
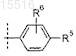
и R6представляет собой -H, или его фармацевтически приемлемая соль.
10. Соединение по п.8 или 9, отличающееся тем, что R5 представляет собой

где R8 представляет собой -(C1-C3)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена) или
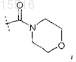
или его фармацевтически приемлемая соль.
11. Соединение по п.8 или 9, отличающееся тем, что R5 представляет собой
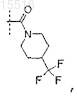
или его фармацевтически приемлемая соль.
12. Соединение по п.8 или 9, отличающееся тем, что R5 представляет собой

где R8представляет собой -(C1-C3)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена), или его фармацевтически приемлемая соль.
13. Соединение по п.8 или 9, отличающееся тем, что R5 представляет собой хлор или фтор, или его фармацевтически приемлемая соль.
14. Соединение по п.1, представляющее собой 3-циклогексил-1-{3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметил}пирролидин-2-он, или его фармацевтически приемлемая соль.
15. Соединение по п.1, представляющее собой 1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-пиперидин-1-илпирролидин-2-он, или его фармацевтически приемлемая соль.
16. Соединение по п.1, выбранное из группы, состоящей из
3-циклогексил-1-(2,6-дихлор-4-метоксибензил)пирролидин-2-она;
3-циклогексил-1-(2,6-дихлор-4-гидроксибензил)пирролидин-2-она;
метилового эфира 3',5'-дихлор-4'-(3-циклогексил-2-оксопирролидин-1-илметил)бифенил-4-карбоновой кислоты;
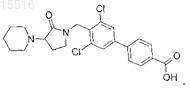
3',5'-дихлор-4'-(3-циклогексил-2-оксопирролидин-1-илметил)бифенил-4-карбоновой кислоты;
3-циклогексил-1-{3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметил}пирролидин-2-она;
3-циклогексил-1-[3,5-дихлор-4'-(4-изопропилпиперазин-1-карбонил)бифенил-4-илметил]пирролидин-2-она;
3-циклогексил-1-[3,5-дихлор-4'-(морфолин-4-карбонил)бифенил-4-илметил]пирролидин-2-она;
(R)-3-циклогексил-1-{3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметил}пирролидин-2-она;
(S)-3-циклогексил-1-{3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметил}пирролидин-2-она;
1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-(4-гидроксициклогексил) пирролидин-2-она;
метилового эфира 3',5'-дихлор-4'-(2-оксо-3-пиперидин-1-илпирролидин-1-илметил)бифенил-4-карбоновой кислоты;
1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-пиперидин-1-илпирролидин-2-она;
(R)-1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-пиперидин-1-илпирролидин-2-она;
(S)-1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-пиперидин-1-илпирролидин-2-она;
1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-(4-фторпиперидин-1-ил)пирролидин-2-она;
1-(3,5-дихлор-[1,1',4',1"]терфенил-4-илметил)-3-(4,4-дифторпиперидин-1-ил)пирролидин-2-она;
1-[3,5-дихлор-4'-(метиловый эфир 4-карбоновой кислоты)бифенил-4-илметил]-3-(4,4-дифторпиперидин-1-ил)пирролидин-2-она;
1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-(4,4-дифторпиперидин-1-ил)пирролидин-2-она и
3-(4-бромциклогексил)-1-(3,5-дихлор-4'-фторбифенил-4-илметил)пирролидин-2-она;
или его фармацевтически приемлемая соль.
17. Фармацевтическая композиция, которая содержит соединение по любому из пп.1-16, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
18. Применение соединения по любому из пп.1-16 или его фармацевтически приемлемой соли для лечения диабета 2 типа.
19. Применение соединения по любому из пп.1-16 или его фармацевтически приемлемой соли в получении лекарственного средства для лечения диабета 2 типа.
20. Промежуточное соединение для получения соединения по п.14, представляющее собой
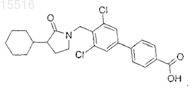
21. Промежуточное соединение для получения соединения по п.15, представляющее собой
Текст
Дата публикации и выдачи патента Номер заявки(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Настоящее изобретение описывает новые соединения формулы (I) обладающие активностью антагониста 11-HSD 1 типа, а также способы получения таких соединений. В другом варианте реализации настоящее изобретение описывает фармацевтические композиции, содержащие соединения формулы (I), а также способы применения таких соединений и композиций для лечения диабета, гипергликемии, ожирения, гипертензии, гиперлипидемии,метаболического синдрома и других заболеваний, связанных с активностью 11-HSD 1 типа. 015516 Настоящая заявка испрашивает приоритет согласно предварительной заявке США 60/745569,поданной 25 апреля 2006 г. Настоящее изобретение относится к ингибиторам 11 гидроксистероид дегидрогеназы 1 типа("11HSD1") и содержащим их фармацевтическим композициям, а также к применению этих соединений и композиций в лечении человека или животного, также к новым промежуточным соединениям, которые можно применять для получения таких ингибиторов. Соединения согласно настоящему изобретению демонстрируют мощное и селективное ингибирование 11HSD1 и, таким образом, полезны для лечения расстройств, на которые влияет модулирование 11HSD1, таких как диабет, метаболический синдром, когнитивные расстройства и т.д. Глюкокортикоиды, действующие в печени, жировой ткани и мышцах, представляют собой важные регуляторы метаболизма глюкозы, липидов и белков. Хронический избыток глюкокортикоидов связан с устойчивостью к инсулину, ожирением внутренних органов, гипертензией и дислипидемией, которые являются также классическими признаками метаболического синдрома. 11HSD1 катализирует превращение неактивного кортизона в активный кортизол и, как считают, участвует в развитии метаболического синдрома. Данные, полученные на крысах и людях, показывают, что 11HSD1 связана с метаболическим синдромом. Есть также свидетельства, указывающие на то, что лекарственные средства, которые специфически ингибируют 11HSD1, снижают уровень глюкозы в крови у больных диабетом 2 типа путем снижения глюконеогенеза в печени, облегчают центральное ожирение, улучшают фенотипы атерогенных липопротеинов, снижают кровяное давление и уменьшают устойчивость к инсулину. Усиливается действие инсулина на мышцы, также может повыситься секреция инсулина островковыми бетаклетками. Данные, полученные в исследованиях на животных и людях, указывают также на то, что избыток глюкокортикоидов нарушает когнитивную функцию. Полученные недавно результаты указывают на то, что инактивация 11HSD1 усиливает функцию памяти как у людей, так и у мышей. Было показано,что ингибитор 11HSD карбеноксолон улучшает когнитивную функцию у здоровых пожилых людей, а также у больных диабетом 2 типа, а инактивация гена 11HSD1 предотвращает возрастные нарушения у мышей. Недавно было показано, что селективное ингибирование 11HSD1 фармацевтическим агентом улучшает запоминание у мышей. В последние годы появился ряд публикаций, сообщающих об агентах, ингибирующих 11HSD1. См. международную заявку WO 2004/056744, в которой описаны адамантилацетамиды в качестве ингибиторов 11HSD, международную заявку WO 2005/108360, в которой описаны пирролидин-2-он и производные пиперидин-2-она в качестве ингибиторов 11HSD, и международную заявку WO 2005/108361, в которой описаны производные адамантил пирролидин-2-она в качестве ингибиторов 11HSD. Несмотря на количество способов лечения заболеваний, в которых участвует 11HSD1, современные способы терапии имеют один и более недостатков, включая низкую или неполную эффективность, неприемлемые побочные эффекты и противопоказания для определенных групп пациентов. Таким образом, существует потребность в улучшенных фармацевтических агентах, которые ингибируют 11HSD1 и способствуют лечению заболеваний, при которых может быть полезным ингибирование 11HSD1. Настоящее изобретение обеспечивает такой вклад в данную область, основанный на открытии того факта, что новый класс соединений обладает мощной и селективной ингибиторной активностью в отношении 11HSD1. Настоящее изобретение отличается определенными структурами и активностями. Существует непреходящая потребность в новых способах лечения диабета, метаболического синдрома и когнитивных расстройств, и цель настоящего изобретения - удовлетворить эту и другие потребности. В настоящем изобретении предложены соединения, представленные структурной формулой (I) или их фармацевтически приемлемые соли,где R0 представляет собой при этом пунктирная линия обозначает точку присоединения к положению R0; причем Ra представляет собой -H или -галоген; Rb представляет собой -H или галоген; Rc представляет собой -H; где пунктирная линия обозначает точку присоединения к положению R4; где пунктирная линия обозначает точку присоединения к положению, обозначенному R5; при этом m равно 1; при этом n равно 1;R7 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R8 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R22 представляет собой -H. Настоящее изобретение обеспечивает соединения формулы (I), которые полезны в качестве мощных и селективных ингибиторов 11HSD1. Кроме того, настоящее изобретение обеспечивает фармацевтические композиции, которые содержат соединение формулы (I) или его фармацевтическую соль и фармацевтически приемлемый носитель, разбавитель или наполнитель. Дополнительно, настоящее изобретение обеспечивает способ лечения метаболического синдрома, а также близких к нему расстройств,которые включают введение нуждающемуся в таком лечении пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Один вариант реализации настоящего изобретения предусматривает соединение формулы (I) или его фармацевтически приемлемую соль, подробно описанные выше. Хотя все соединения согласно настоящему изобретению являются полезными, некоторые из них представляют особенный интерес и являются предпочтительными. Ниже приведен список нескольких групп особенно предпочтительных соединений. В другом варианте реализации настоящего изобретения предложено соединение, имеющее структурную формулу (I), или его фармацевтически приемлемая соль,где R0 представляет собой где пунктирная линия обозначает точку присоединения к положению R0 в формуле (I); причем Ra представляет собой -галоген; Rb представляет собой -H или галоген; Rc представляет собой -H; где пунктирная линия обозначает точку присоединения к положению R4; где пунктирная линия обозначает точку присоединения к положению R4 в формуле (I); где пунктирная линия обозначает точку присоединения к положению, обозначенному R5; при этом m равно 1;R6 представляет собой -H, R7 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R8 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R22 представляет собой -H. Другой вариант реализации настоящего изобретения предусматривает соединение, имеющее структурную формулу (I), или его фармацевтически приемлемую соль,где R0 представляет собой где пунктирная линия обозначает точку присоединения к положению R0 в формуле (I); причем Ra представляет собой -галоген; Rb представляет собой -H или галоген; где пунктирная линия обозначает точку присоединения к положению R4 в формуле (I); где пунктирная линия обозначает точку присоединения к положению, обозначенному R5; при этом m равно 1;R7 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R8 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R20, R21, R22 представляют собой -H. В другом варианте реализации настоящего изобретения предложено соединение, имеющее структурную формулу (I), или его фармацевтически приемлемая соль,где R0 представляет собой где пунктирная линия обозначает точку присоединения к положению R0 в формуле (I); при этом Ra представляет собой галоген; где пунктирная линия обозначает точку присоединения к положению R4 в формуле (I); где пунктирная линия обозначает точку присоединения к положению R4; где пунктирная линия обозначает точку присоединения к положению, обозначенному R5; при этом m равно 1;R7 представляет собой -(C1-C4)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R8 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R9, R20, R21, R22 представляют собой -H. В другом варианте реализации настоящего изобретения предложено соединение, имеющее структурную формулу (I), или фармацевтически приемлемая соль таких соединений,где R0 представляет собой где пунктирная линия обозначает точку присоединения к положению R0 в формуле (I); причем Ra представляет собой -галоген; где пунктирная линия обозначает точку присоединения к положению R4 в формуле (I); где пунктирная линия обозначает точку присоединения к положению, обозначенному R5;R7 представляет собой -(C1-C4)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R8 представляет собой -(C1-C6)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена);R9, R20, R21, R22 представляют собой -H. Предусмотрены также другие варианты реализации настоящего изобретения, в которых описанные выше варианты реализации дополнительно сужены в соответствии с описанными ниже предпочтительными вариантами. В частности, каждый из описанных ниже вариантов независимо сочетается с описанными выше вариантами реализации и конкретные сочетания образуют новые варианты реализации, в которых переменные, указанные в данном варианте реализации, ограничены согласно предпочтениям.-4 015516 Предпочтительные варианты реализации данного изобретения представлены формулой где R8 представляет собой -(C1-C3)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена) или где R8 представляет собой -(C1-C3)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена). Предпочтительно R5 представляет собой хлор или фтор. Предпочтительно R6 представляет собой -H. Предпочтительно R7 представляет собой -(C1-C4)алкил (необязательно содержащий в качестве заместителей от 1 до 3 атомов галогена). Предпочтительно R8 в каждом случае независимо представляет собой -H. Предпочтительно R8 представляет собой -(C1-C3)алкил. Предпочтительно R8 в каждом случае независимо представляет собой -CH3. Предпочтительно R9 представляет собой -H. В другом варианте реализации настоящего изобретения предложено соединение, имеющее структурную формулу (I), или фармацевтически приемлемая соль таких соединений,где R0 представляет собой-6 015516 где пунктирная линия обозначает точку присоединения к положению R0 в формуле (I); где Ra представляет собой -галоген; Rb представляет собой -H или галоген; Rc представляет собой -H;R4 представляет собой -галоген, -OH, -O-CH3, где пунктирная линия обозначает точку присоединения к положению R4 в формуле (I);R5 представляет собой -H, -хлор, -фтор, -C(O)O-CH3, C(O)OH, где пунктирная линия обозначает точку присоединения к положению, обозначенному R5;R9, R20, R21, R22 представляют собой -H. Предпочтительным вариантом реализации являются соединения 3-циклогексил-1-3,5-дихлор-4'-[4(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметилпирролидин-2-он и 1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-пиперидин-1-илпирролидин-2-он. Другой вариант настоящего изобретения представляет собой новые промежуточные реакции, описанные в данной заявке,которые полезны для получения ингибиторов 11HSD1, имеющих формулу (I), и описанные в настоящей заявке варианты реализации. Другой вариант реализации настоящего изобретения представляет собой новые промежуточные соединения, описанные в данной заявке реакции, полезные для получения 3 циклогексил-1-3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметилпирролидин-2 она и 1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-пиперидин-1 илпирролидин-2-она или их фармацевтически приемлемых солей. У пациентов, страдающих диабетом 2 типа, часто развивается "инсулинорезистентность", которая приводит к нарушениям гомеостаза глюкозы и гипергликемии, которые, в свою очередь, приводят к повышенной заболеваемости и ранней смертности. Аномальный гомеостаз глюкозы связан с ожирением,повышенным кровяным давлением и изменениями в липидном, липопротеиновом и аполипопротеиновом метаболизме. У пациентов, страдающих диабетом 2 типа, весьма высока вероятность развития нарушений сердечно-сосудистой системы, например атеросклероза, ишемической болезни сердца, удара, заболеваний периферических сосудов, гипертензии, нефропатии, нейропатии и ретинопатии. Соответственно, гомеостаз глюкозы, метаболизм липидов, ожирение и гипертензия являются важными факторами ведения и лечения сахарного диабета. У многих пациентов с инсулинорезистентностью, но у которых не развивается диабет 2 типа, также высока вероятность развития "синдрома X-хромосомы" или "метаболического синдрома". Метаболический синдром характеризуется инсулинорезистентностью, сопровождаемой абдоминальным ожирением, гиперинсулинемией, высоким кровяным давлением, низкими уровнями ЛПВП (липопротеинов высокой плотности), высокими уровнями ЛПОНП (липопротеинов очень низкой плотности), гипертензией, атеросклерозом, коронарной болезнью сердца и хронической почечной недостаточностью. У этих пациентов высок риск развития перечисленных выше сердечно-сосудистых нарушений, либо у них может развиться сахарный клинический диабет. Поскольку предлагаемые соединения способны ингибировать 11HSD1, их можно применять для лечения широкого спектра состояний и нарушений, при которых ингибирование 11HSD1 может быть полезно. В настоящем описании такие нарушения и состояния называются "диабетическими нарушениями" и "нарушениями обмена веществ". Специалист в данной области техники способен идентифицировать "диабетические нарушения" и "нарушения обмена веществ" по активности 11HSD1, участвующей либо в патофизиологии нарушения, либо в гомеостатической реакции на нарушение. Таким образом,предлагаемые соединения можно применять, например, для предотвращения, лечения или облегчения заболеваний или состояний, или симптомов или последствий, связанных с "диабетическими нарушениями" и "нарушениями обмена веществ". Неограничивающие примеры "диабетических нарушений" и "нарушений обмена веществ" включают диабет, диабет 1 типа, диабет 2 типа, гипергликемию, гиперинсулинемию, прекращение деятельности бета-клеток, усиление функционирования бета-клеток путем восстановления ответной реакции первой фазы, гипергликемию после приема пищи, предотвращение апоптоза, пониженный уровень глюкозы натощак (impaired fasting glucose (IFG, метаболический синдром нарушения обмена веществ, гипоглике-7 015516 мию, гипер-/гипокалиемию, нормализацию уровней глюкагона, улучшение отношения ЛПНП/ЛПВП,снижение потребления пищи между регулярными приемами пищи, пищевые расстройства, снижение массы тела, синдром поликистозных яичников, ожирение как следствие диабета, латентный аутоиммунный диабет взрослых, инсулит, пересадку островковой ткани, диабет у детей, диабет, обусловленный беременностью, отсроченные осложнения диабета, микро-/макроальбуминурию, нефропатию, ретинопатию, нейропатию, изъязвление ступней при диабете, снижение перистальтики кишечника из-за введения глюкагона, синдром укороченной тонкой кишки, антидиарейные эффекты, повышение желудочной секреции, снижение кровотока, эректильную дисфункцию, глаукому, послеоперационный стресс, уменьшение повреждения ткани органов, вызванного реперфузией тока крови вследствие ишемии, ишемическое повреждение сердца, сердечную недостаточность, застойную сердечную недостаточность, удар, инфаркт миокарда, аритмию, преждевременную смерть, антиапоптоз, заживление ран, нарушение толерантности к глюкозе, синдромы инсулинорезистентности, метаболический синдром, синдром X-хромосомы, гиперлипидемию, дислипидемию, гипертриглицеридемию, гиперлипопротеинемию, гиперхолестеринемию,артериосклероз, включая атеросклероз, глюкагоному, острый панкреатит, сердечно-сосудистые заболевания, гипертензию, гипертрофию сердца, желудочно-кишечные нарушения, ожирение, диабет как следствие ожирения, диабетическую дислипидемию и т.д. Таким образом, настоящее изобретение также относится к способу лечения "диабетических нарушений" и "нарушений обмена веществ", который также включает снижение или устранение одного или нескольких нежелательных побочных эффектов, связанных с существующими способами лечения. Кроме того, настоящее изобретение относится к соединению формулы (I), или к фармацевтически приемлемой соли указанного соединения, или фармацевтической композиции, которая включает соединение формулы (I), или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель, разбавитель или наполнитель, применяемые для ингибирования активности 11-HSD1; применяемые для ингибирования клеточного ответа, опосредуемого активностью 11HSD1, у млекопитающего; применяемые для снижения гликемического уровня у млекопитающего; применяемые для лечения заболевания, связанного с избыточной активностью 11HSD1; применяемые для лечения диабетических и других нарушений обмена веществ у млекопитающего и применяемые для лечения диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, удара, нейропатии и для заживления ран. Таким образом, способы, предлагаемые согласно настоящему изобретению, включают профилактическое и терапевтическое введение соединения формулы (I). Кроме того, настоящее изобретение относится к применению соединения формулы (I) или фармацевтически приемлемой соли указанного соединения для приготовления лекарственного средства, подходящего для ингибирования активности 11HSD1; для приготовления лекарственного средства, подходящего для ингибирования клеточного ответа, опосредуемого активностью 11HSD1, у млекопитающего; для приготовления лекарственного средства, пригодного для снижения уровня гликемии у млекопитающего; для приготовления лекарственного средства, подходящего для лечения заболевания,связанного с избыточной активностью 11HSD1; для приготовления лекарственного средства, подходящего для лечения диабетических и других нарушений обмена веществ у млекопитающего; и для приготовления лекарственного средства, подходящего для предотвращения или лечения диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, удара, нейропатии и нарушения заживления ран. Настоящее изобретение также относится к способу лечения состояний, вызванных избыточной активностью 11HSD1, у млекопитающего; к способу ингибирования активности 11HSD1 у млекопитающего; к способу ингибирования клеточного ответа, опосредуемого активностью 11HSD1, у млекопитающего; к способу снижения уровня гликемии у млекопитающего; к способу лечения диабетических и других нарушений обмена веществ у млекопитающего; к способу предотвращения или лечения диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца,удара, невропатии и нарушения заживления ран; причем указанные способы включают введение млекопитающему, нуждающемуся в таком лечении, соединения формулы (I) в количестве, ингибирующем активность 11HSD1, или его фармацевтически приемлемой соли, или фармацевтической композиции,которая включает соединение формулы (I), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или наполнитель. Кроме того, настоящее изобретение относится к фармацевтической композиции, которая содержит соединение формулы (I), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или наполнитель, пригодной для применения в ингибировании активности 11-HSD1; к применению в ингибировании клеточных ответов, опосредуемых активностью 11HSD1; к применению в снижении уровня гликемии у млекопитающего; к применению в лечении диабетических и других нарушений обмена веществ у млекопитающего и к применению в предотвращении или лечении диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, удара, нейропатии и нарушения заживления ран. В другом варианте реализации настоящего изобретения осуществляют введение предлагаемых со-8 015516 единений в сочетании с одним или несколькими другими активными веществами в любых подходящих соотношениях. Указанные другие активные вещества могут быть выбраны, например, из противодиабетических средств, средств, предназначенных для лечения ожирения, гипотензивных средств, средств,предназначенных для лечения осложнений, вызываемых или связанных с диабетом, и средств, предназначенных для лечения осложнений и нарушений, вызываемых или связанных с ожирением. Ниже представлен список нескольких групп таких сочетаний. Следует понимать, что каждое из указанных средств можно применять в сочетании с другими указанными средствами, что позволяет получать дополнительные сочетания. Так, в других вариантах реализации настоящего изобретения, предлагаемые соединения можно вводить в сочетании с одним или несколькими противодиабетическими средствами. Подходящие противодиабетические средства включают инсулин, аналоги и производные инсулина,например, описанные в патентной заявке EP 792290 (Novo Nordisk A/S), например, NB29-тетрадеканоилдез-(B30)-человеческий инсулин, в патентных заявках EP 214826 и EP 705275 (Novo Nordisk A/S), например, AspB28-человеческий инсулин, в патенте США 5504188 (Eli Lilly), например, LysB28 ProB29 человеческий инсулин, в патентной заявке EP 368187 (Aventis), например, производные Lantus, GLP-1 и GLP-1, такие как описанные в международной патентной заявке WO 98/08871 (Novo Nordisk A/S), а также гипогликемические средства, активные при пероральном введении. Гипогликемические средства, активные при пероральном введении, предпочтительно включают имидазолины, сульфонилмочевины, бигуанидины, меглитиниды, оксадиазолидиндионы, тиазолидиндионы, активаторы инсулина, средства, усиливающие секрецию инсулина, например глимепирид, ингибиторы -глюкозидазы, средства, воздействующие на АТФ-зависимые калиевые каналы -клеток, например вещества, открывающие калиевые каналы, например, описанные в заявках WO 97/26265, WO 99/03861 иWO 00/37474 (Novo Nordisk A/S), или митиглинид, или блокатор калиевых каналов, например BTS67582, натеглинид, антагонисты глюкагона, например, описанные в заявках WO 99/01423 и WO 00/39088ALRT-268, LG-1268 или LG-1069. В другом варианте реализации предлагаемые соединения вводят в сочетании с инсулином или аналогом или производным инсулина, например NB29-тетрадеканоил-дез-(B30)-человеческим инсулином,AspB28-человеческим инсулином, LysB28 ProB29-человеческим инсулином, Lantus или смешанным препаратом, включающим одно или несколько указанных соединений. В еще одном варианте реализации настоящего изобретения предлагаемые соединения вводят в сочетании с сульфонилмочевиной, например глибенкламидом, глипизидом, толбутамидом, хлоропамидемом, толазамидом, глимепридом, гликазидом и глибуридом. В другом варианте реализации настоящего изобретения предлагаемые соединения вводят в сочетании с бигуанидом, например метформином. И в еще одном варианте реализации настоящего изобретения предлагаемые соединения вводят в сочетании с меглитинидом, например репаглинидом или натеглинидом. В еще одном варианте реализации настоящего изобретения предлагаемые соединения вводят в сочетании с активатором инсулина на основе тиазолидиндиона, например с троглитазоном, циглитазоном,пиоглитазоном, розиглитазоном, изаглитазоном, дарглитазоном, энглитазоном, CS-011/CI-1037 или T 174 или соединениями, описанными в WO 97/41097, WO 97/41119, WO 97/41120, WO 00/41121 и WO 98/45292 (Dr. Reddy's Research Foundation). В еще одном варианте реализации настоящего изобретения предлагаемые соединения могут быть введены в сочетании с активатором инсулина, таким как, например, GI 262570, YM-440, MCC-555,JTT-501, AR-H039242, KRP-297, GW-409544, CRE-16336, AR-H049020, LY510929, MBX-102, CLX-0940,GW-501516, или соединениями, описанными в заявках WO 99/19313, WO 00/50414, WO 00/63191,WO 00/63192, WO 00/63193, например рагаглитазаром (NN 622 или (-)DRF 2725) (Dr. Reddy's ResearchFoundation), и WO 00/23425, WO 00/23415, WO 00/23451, WO 00/23445, WO 00/23417, WO 00/23416,WO 00/63153, WO 63196, WO 00/63209, WO 00/63190 и WO 00/63189 (Novo Nordisk A/S). В другом варианте реализации настоящего изобретения предлагаемые соединения вводят в сочетании с ингибитором -глюкозидазы, например воглибозой, эмиглитатом, миглитолом или акарбозой. В другом варианте реализации настоящего изобретения предлагаемые соединения вводят в сочета-9 015516 нии со средством, воздействующим на АТФ-зависимые калиевые каналы -клеток, например толбутамидом, глибенкламидом, глипизидом, гликазидом, BTS-67582 или репаглинидом. В еще одном варианте реализации настоящего изобретения предлагаемые соединения можно вводить в сочетании с натеглинидом. В еще одном варианте реализации настоящего изобретения предлагаемые соединения вводят в сочетании с антилипидемическим средством или антигиперлипидемическим средством, например холестирамином, колестиполом, клофибратом, гемфиброзилом, ловастатином, правастатином, симвастатином,питавастатином, розувастатином, пробуколом, декстротироксином, фенофибратом или аторвастином. В еще одном варианте реализации настоящего изобретения предлагаемые соединения вводят в сочетании с соединениями, снижающими потребление пищи. В другом варианте реализации настоящего изобретения предлагаемые соединения вводят в сочетании с более чем одним из вышеуказанных соединений, например в сочетании с метформином и сульфонилмочевиной, например глибуридом; сульфонилмочевиной и акарбозом; натеглинидом и метформином; репаглинидом и метформином; акарбозой и метформином; сульфонилмочевиной, метформином и троглитазоном; инсулином и сульфонилмочевиной; инсулином и метформином; инсулином, метформином и сульфонилмочевиной; инсулином и троглитазоном; инсулином и ловастатином и т.д. Общие термины, используемые для описания рассматриваемых соединений, имеют обычное для них значение. В настоящем описании термины "(C1-C3)алкил", "(C1-C4)алкил" или "(C1-C6)алкил" относятся к неразветвленным или разветвленным насыщенным алифатическим группам, содержащим указанное количество атомов углерода, например к метилу, этилу, н-пропилу, изопропилу, н-бутилу, изобутилу, вторбутилу, трет-бутилу и подобным им радикалам. Термин "(C1-C6)алкокси" обозначает C1-C6-алкильную группу, присоединенную через атом кислорода, и включает такие фрагменты, как, например, метокси,этокси, н-пропокси, изопропокси и подобные им группы. Термин "галоген" означает фтор, хлор, бром и йод. Термин "(C3-C8)циклоалкил" означает насыщенное или частично насыщенное карбоциклическое кольцо, включающее от 3 до 8 атомов углерода, обычно от 3 до 7 атомов углерода. Неограничивающие примеры (C3-C8)циклоалкильных радикалов включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п. В настоящем описании термин "необязательно содержащий заместители" или "возможные заместители" означает, что рассматриваемые группы либо не имеют замещений, либо имеют замещения одним или несколькими указанными заместителями. Если рассматриваемые группы имеют замещения более чем одним заместителем, то заместители могут быть как одинаковыми, так и различными. Кроме того,использование терминов "независимо", "независимо являются" и "независимо выбраны из" означает, что рассматриваемые группы могут быть как одинаковыми, так и различными. Некоторые из определенных выше терминов могут появляться в структурных формулах более одного раза, и при таком появлении каждый термин должен быть определен независимо от других. Следует понимать, что термин "пациент" может относиться к морской свинке, собаке, кошке, крысе, мыши, хомяку или приматам, включая человека, и пр. Предпочтительно пациенты включают людей. Термин "пациент" охватывает сельскохозяйственных животных. Сельскохозяйственные животные представляют собой животных, выращиваемых для получения пищевых продуктов. Примерами сельскохозяйственных животных являются жвачные или "жвачные животные", например коровы, быки, телки,бычки, овцы, буйволы, бизоны, козы и антилопы. Другие примеры сельскохозяйственных животных включают свиней и птицу (домашнюю птицу), например кур, уток, индюшек и гусей. Предпочтительно пациент, подвергаемый лечению, представляет собой млекопитающее, в частности человека. В настоящем описании термины "лечение", "терапия" и "лечить", как используется в настоящем описании, включают их общепринятое значение, т.е. действия, имеющие целью предотвращение, снижение риска возникновения или развития данного состояния или заболевания, предотвращение, ограничение, облегчения течения, улучшение состояния, замедление развития, остановку развития, отсрочку начала возникновения или обращение вспять прогрессирования или снижение тяжести заболевания или состояния у пациента, а также удержание на существующем уровне и/или лечения существующих симптомов заболевания, нарушения или патологического состояния, рассмотренного в настоящем описании,включая смягчение или облегчение симптомов или осложнений, или вылечивание или устранение заболевания, нарушения или состояния. В зависимости от необходимости предлагаемые способы включают медикаментозное лечение и/или профилактическую терапию. В настоящем описании термин "терапевтически эффективное количество" означает количество соединения, предлагаемого согласно настоящему изобретению, способное облегчить симптомы различных рассмотренных в настоящем описании патологических состояний. Разумеется, конкретная доза соединения, вводимая в соответствии с настоящим изобретением, должна быть определена в зависимости от конкретных обстоятельств, влияющих на пациента, включающих, например, тип вводимого соединения,путь введения, состояние здоровья пациента и тип патологического состояния, подвергаемого лечению. Термин "композиция" обозначает фармацевтическую композицию и предназначен для определения фармацевтического продукта, содержащего активный ингредиент(ы), включающий соединение(я) фор- 10015516 мулы (I) и инертный ингредиент(ы), составляющие носитель. Соответственно фармацевтические композиции согласно настоящему изобретению включают любые композиции, приготовленные смешиванием соединения согласно настоящему изобретению и фармацевтически приемлемого носителя. Термин "подходящий растворитель" относится к любому растворителю или смеси растворителей,инертному по отношению к протекающей реакции, который в достаточной степени растворяет реагенты,создавая среду, в которой протекает нужная реакция. Термин "стандартная дозированная/лекарственная форма" означает физически раздельные единицы, подходящие для единичного дозирования, вводимые людям и другим животным, отличным от человека, при этом каждая единица содержит заранее определенное количество активного материала, которое по расчетам должно вызвать желаемый терапевтический эффект, вместе с подходящим фармацевтически приемлемым носителем. Соединения согласно настоящему изобретению могут иметь один или несколько хиральных центров и могут существовать в виде разнообразных стереоизомерных конфигураций. Вследствие существования указанных хиральных центров соединения согласно настоящему изобретению могут существовать в виде рацематов, в виде индивидуальных энантиомеров или смесей энантиомеров, а также в виде диастереомеров и смесей диастереомеров. Все указанные рацематы, энантиомеры, диастереомеры и их смеси, такие как очищенные, частично очищенные или неочищенные смеси, включены в область, защищаемую настоящим изобретением. Для примеров, представленных в настоящем описании, если имеется молекула, которая содержит хиральный центр или центры известной конфигурации, то ее стереохимию указывают в названии и в структурном представлении молекулы. Если стереохимия молекулы неизвестна или не определена, то ее стереохимию не указывают в названии и в структурном представлении молекулы. Примеры реализации настоящего изобретения включают рассмотренные ниже Примеры и, несмотря на то, что рассматриваемый пример может отвечать хиральной или конформационной форме или представлять собой соль этой формы, другие примеры реализации настоящего изобретения включают все другие стереоизомерные или конформационные формы описываемых примеров, а также их фармацевтически приемлемые соли. Указанные примеры реализации включают любые выделенные энантиомеры, диастереомеры и/или конформеры рассматриваемых структур, а также любые смеси, содержащие более одной формы. Кроме того, если в молекуле присутствует двойная связь или полностью или частично насыщенная циклическая система, или более одного центра асимметрии, или связь с ограниченным вращением вокруг нее, могут образовываться диастереомеры. Следует понимать, что любые диастереомеры, в виде разделенных, чистых или частично очищенных диастереомеров или их смесей, также включены в область,защищаемую настоящим изобретением. Кроме того, некоторые из соединений, предлагаемых согласно настоящему изобретению, могут существовать в виде различных таутомерных форм, и в этом случае следует понимать, что любые таутомерные формы,которые могут образовывать указанные соединения,также включены в объем настоящего изобретения. В настоящем описании термин "энантиомерный избыток" означает увеличение доли одного энантиомера по сравнению с другим. Имеющийся удобный способ выражения достигаемого энантиомерного избытка представляет собой концепцию энантиомерного избытка или "э.и.", в которой используют следующее уравнение: где E1 представляет собой количество первого энантиомера, а E2 представляет собой количество второго энантиомера. Таким образом, если исходное отношение двух энантиомеров равно 50:50, то есть равно отношению энантиомеров в рацемической смеси, и достигается энантиомерный избыток, достаточный для получения конечного отношения, равного 70:30, то значение э.и. по отношению к первому энантиомеру будет составлять 40%. В то же время, если конечное отношение будет равно 90:10, то значение э.и. по отношению к первому энантиомеру будет составлять 80%. Предпочтительными являются значения э.и., превышающие 90%, еще более предпочтительными являются значения э.и., превышающие 95%, и наиболее предпочтительными являются значения э.и., превышающие 99%. Специалист в данной области техники может легко определить значение энантиомерного избытка при помощи стандартных методик и процедур, например, посредством газовой хроматографии или жидкостной хроматографии высокого разрешения с использованием хиральной колонки. Принципы выбора соответствующей хиральной колонки, элюента и условий, необходимых для разделения энантиомерной пары, хорошо известны специалистам в данной области техники. Кроме того, конкретные стереоизомеры и энантиомеры соединений формулы (I) могут быть приготовлены специалистом в данной области техники при помощи хорошо известных методик и способов, например, подобных описанным в публикации J. Jacques, et al.,"Enantiomers, Racemates, и Resolutions", John Wiley и Sons, Inc., 1981, и E.L. Eliel, S.H. Wilen, "Stereochemistry of Organic Compounds" (Wiley-Interscience 1994), и в европейской патентной заявкеEP-A838448 от 29 апреля 1998 г. Примеры способов разделения включают способы перекристаллизации или хиральной хроматографии.- 11015516 Соединения формулы (I) могут быть приготовлены специалистом в данной области техники при помощи различных методик, некоторые из которых проиллюстрированы в методиках и схемах, рассмотренных ниже. Точный порядок операций, которые требуются для получения соединений формулы (I),зависит от конкретного синтезируемого соединения, исходного соединения и относительной подвижности замещаемых фрагментов. Необходимые реактивы или исходные материалы обычно доступны специалистам в данной области техники, а материалы, не имеющие широкого распространения на рынке,могут быть легко синтезированы специалистами в данной области техники по стандартным методикам,обычно применяемым в данной области техники, или по методикам и процедурам, описанным ниже. Приведенные ниже схемы, препараты, примеры и процедуры приведены для лучшего понимания настоящего изобретения и никоим образом не ограничивают область его применения. Специалисты в данной области техники должны понимать, что в предложенных методиках могут быть сделаны различные изменения, которые не изменяют объема и сущности настоящего изобретения. Все публикации,упомянутые в настоящем описании, доступны специалистам в той области техники, к которой принадлежит настоящее изобретение. Оптимальное время проведения реакций, указанных в схемах, препаратах, примерах и процедурах,может быть определено при помощи традиционных хроматографических способов отслеживания хода реакции. Кроме того, реакции, применяемые согласно настоящему изобретению, предпочтительно проводить в инертной атмосфере, например в токе аргона, азота. Выбор растворителя обычно некритичен,если применяемый растворитель инертен по отношению к проходящей реакции и растворяет реагенты в достаточной степени для осуществления реакции. Предпочтительно перед использованием в последующих реакциях соединения выделяют и очищают. Некоторые соединения можно кристаллизовать из реакционных растворов в процессе образования, и затем их отделяют фильтрованием, или реакционный растворитель может быть удален экстракцией, выпариванием или декантацией. При необходимости промежуточные соединения и готовые продукты формулы (I) можно дополнительно очищать при помощи традиционных методик, например при помощи перекристаллизации или хроматографии на твердых носителях, таких как силикагель или оксид алюминия. Опытные специалисты поймут, что не все заместители совместимы со всеми условиями реакций. В такие соединения можно вводить защитные группы или модифицировать их на определенном этапе синтеза методами, известными в данной области техники. Если не указано особо, термины и сокращения, используемые в предлагаемых схемах, синтезах,примерах и процедурах, имеют свои обычные значения. Например, в настоящем описании следующие термины имеют указанное значение: "psi" означает фунты на квадратный дюйм; "TCX (TLC)" означает тонкослойную хроматографию; "ВЭЖХ (HPLC)" означает высокоэффективную жидкостную хроматографию; "Rf" означает коэффициент удерживания; "Rt" означает время удерживания; означает части на миллион по стандартной шкале относительно сигнала тетраметилсилана; "MC (MS)" означает массспектрометрию, если не указано особо, термин "наблюдаемая масса (Observed Mass)" означает [M+H]."MS(APCi)" означает хемоионизационную масс-спектрометрию при атмосферном давлении, "УФ (UV)" означает ультрафиолетовую спектрометрию, "1H-ЯМР (NMR)" означает спектрометрию протонного ядерного магнитного резонанса. "LCMS" означает жидкостную хроматографию-масс-спектрометрию,"ГХ/МС" означает газовую хроматографию/масс-спектрометрию. "ИК" означает инфракрасную спектрометрию; при этом в ИК спектрах указаны только максимумы поглощения интересующих фрагментов, а не все максимумы поглощения. "КТ" означает комнатную температуру.[1,1'-бис-(дифенилфосфино)ферроцен)дихлорпалладий(II), "EDCI" означает гидрохлорид N-этил-N'-(3-диметиламинопрспил)карбодиимида, "DBU" означает 1,8-диазабицикло[5.4.0]ундецен-7, "TBSCl" означает трет-бутилдиметилсиланилоксиметилхлорид, "NBS" означает N-бромсукцинимид, "TsOH" означает п-толуолсульфокислоту, "ДХЭ (DCE)" означает дихлорэтан, "DAST" означает трифторид(диэтиламино)серы, "EA/H" означает смесь этилацетата/гексанов, "Pd2(dba)3" означает бис-(дибензилиденацетон)палладий, "BINAP" означает 2,2'-бис-(дифенилфосфино-1,1'-бинафталин, "NMP" означает N-метилпирролидин, "TMSCN" означает триметилсилилцианид, "TBAF" означает тетрабутиламмонийфторид, "Tf2O" означает трифторметансульфоновый ангидрид, "TBSO" означает трет-бутилдиметилсиланилокси, "OTf" означает трифторметансульфонат, MeTi(Oi-Pr)3 означает триизопропоксид метилтитана, "BBr3" означает трибромид бора, "PBr3" означает трибромид трехвалентного фосфора, "Pd(PPh3)4" означает тетракис(трифенилфосфин)палладий(0), "OAc" означает ацетат, "DME" означает диметилэтан, "Et2O" означает диэтиловый эфир, "(Ph3P)4Pd" означает тетракис(трифенилфосфин)палладий (0), "DMFDMA" означает диметилацеталь N,N-диметилформамида, "Et3N" означает триэтиламин, "tBu" означает трет-бутил, "DIPEA" означает- 12015516 диизопропилэтиламин, "EDC" означает гидрохлорид-(3-диметиламинопропил)-3-этилкарбодиимида,"HOAc" означает уксусную кислоту, "boc" означает трет-бутоксикарбонил. В структуре "Ph" означает фенил, "Me" означает метил, "Et" означает этил, "Bn" означает бензил, "MeOH" означает метанол, "OTf" означает трифторметансульфонат, "TIPSO" означает триизопропилсиланилокси, "TBSO" означает третбутилдиметилсиланилокси. Содержащиеся в настоящей заявке примеры приведены исключительно для иллюстрации изобретения и никоим образом не ограничивают его объем. Названия препаратов и примеров получены с использованием AutoNom 2.2 в ChemDraw Ultra или AutoNom 2000 в MDL ISIS/Draw версии 2.5 SP1 от компании MDL Information Systems, Inc. или обеспечены службой Chemical Abstracts. Для получения 1H-ЯМР спектров в указанных растворителях использовали спектрометр VarianINOVA 400 МГц. Для проведения жидкостной хроматомасс-спектрометрии использовали прибор AgilentHP1100, оборудованный масс-спектрометром (Agilent MSD SL). В качестве неподвижной фазы использовали Waters Xterra C18 (2,150 мм, 3,5 мкм) согласно стандартному способу использовали градиент от 5 до 100% ацетонитрила/метанола (50:50) с добавлением 0,2% формиата аммония в течение 3,5 мин, после чего проводили выдержку при 100% компонента B в течение 0,5 мин при температуре в колонке,равной 50C, и расходе 1,0 мл/мин. Другой стандартный способ предусматривает применение градиента от 5 до 100% ацетонитрила/метанола (50:50) с добавлением 0,2% формиата аммония в течение 7 мин,после чего проводили выдержку при 100% компонента В в течение 1,0 мин при температуре в колонке,равной 50C, и расходе 1,0 мл/мин. Дополнительно проводили MS анализ с помощью Agilent MSD (прибор с обратной связью) согласно стандартному методу проточно-инъекционного анализа (Flow injectionAnalysis, FIA) без колонки при расходе 80% MeOH и 6,5 мМ ацетата аммония, равном 0,5 мл/мл, при этом время анализа составляло 30 с. Схема А В схеме A к возможно несущему замещение фенолу (1) присоединяют защитную группу (например,TBSCl), в результате чего получают соединение 2, а затем соединение 2 превращают в альдегид (3). Проводят реакцию соединения 3 с соединением, содержащим защитную группу (Pg) и уходящую группу (Lg) с получением жирного соединения 4. Pg может представлять собой -CH3 или -CH2-фенил, Lg может представлять собой мезилат или галоген-. Предпочтительно соединение Lg-Pg представляет собой I-CH3 или Br-CH2-фенил. Альдегид восстанавливают до спирта (5), а затем превращают в соединение 6. Предпочтительно соединение 5 галогенируют PBr3 с получением 2-бромметил соединения. Присоединение и удаление защитных групп с соединений с образованием соединений формулы (I) и других хорошо известно специалистам в данной области и описано в литературе (см., например: Greene и Wuts, Protective Groups in Organic Synthesis, Third Edition, John Wiley и Sons Inc., 1999). Схема B В схеме C можно синтезировать соединение 10, следуя процедурам, описанным в литературе: J. В схеме D защищенный подходящим образом бензилгалогенид (6) превращают в соответствующий бензиламин в два этапа в ходе реакции, которую проводят с талимидом калия в растворителе, таком как ДМФ; амин освобождается после обработки гидразином в таком растворителе, как этанол. Схема E В схеме E проводят реакцию лактона (16) с содержащим подходящие заместители бензиламином в присутствии триметилалюминия с получением амида (17), который превращают в соответствующий бромид (18) путем обработки смесью бром/трифенилфосфин и основанием, таким как имидазол в растворителе, таком как дихлорметан. Лактам (19) образуется в результате обработки бромида (18) основанием,таким как диизопропилэтиламин в растворителе, таком как ТГФ, при нагревании. Фенол (20) образуется после обработки (19) трибромидом бора, а трифлат (21) образуется после обработки трифторметансульфоновым ангидридом и основанием, таким как пиридин. (21) подвергают реакции сочетания с препаратом фенилбороновой кислоты и катализатором, таким как тетракистрифенилфосфин палладия, в результате чего получают сложный эфир, который гидролизуют с получением кислоты (23). Кислоту (23) подвергают реакции сочетания с амином в стандартных условиях сочетания, таких как 1,1'-карбонилдиимидазол, с получением амида (24). Схема F В схеме F лактам (25) алкилируют замещенным подходящим образом бензилгалогенидом путем обработки основанием, таким как гидрид натрия, в растворителе, таком как ДМФ, с получением бромида(26). (26) подвергают реакции сочетания с использованием фенилбороновой кислоты и катализатор, та- 14015516 кой как тетракистрифенилфосфин палладия, в результате чего получают эфир, который гидролизуют с получением кислоты (28). Кислоту (28) подвергают реакции сочетания с амином в стандартных условиях сочетания амидов, таких как 1,1'-карбонилдиимидазол, с получением амида (29). Схема G В схеме G фенол (30) восстанавливают до соответствующего циклогексилового спирта (31) путем обработки водородом и подходящим катализатором, таким как оксид родия или алюминия, и растворителем, таким как этанол. Спирт защищают, получая в результате соответствующий трет-бутиловый дифенилсилиловый эфир (32) в стандартных условиях, а затем алкилируют бромацетонитрилом с использованием основания, такого как амид диизопропила лития, и растворителя, такого как ТГФ. Нитрил (33) обрабатывают водородом и подходящим катализатором, таким как гидрат PtO2, и нагревают. В результате получают циклический лактам (34). Лактам (34) алкилируют содержащим подходящие заместители галогенидом бензила путем обработки основанием, таким как гидрид натрия, в растворителе, таком какDMF, с получением (35). Фенол (36) образуется в результате обработки (35) водородом и подходящим катализатором, таким как 20% Pd(OH)2 на угле, а трифлат (37) образуется в результате обработки сульфоновым ангидридом и основанием, таким как пиридин. (37) подвергают реакции сочетания с использованием фенилбороновой кислоты и катализатора, такого как тетракистрифенилфосфин, в результате чего получают сложный эфир, который гидролизуют с получением кислоты (39). Кислоту (39) подвергают реакции сочетания с амином с использованием стандартных сред для проведения сочетания амидов, такие как 1,1'-карбонилдиимидазол, в результате чего получают амид (40). Защитную группу силила удаляют и получают спирт (41) в стандартных условиях, таких как обработка ТФА. Схема H В схеме H проводят реакцию коммерчески доступного этил 1-пиперидинацетата (42) основанием,таким как амид диизопропила лития, и алкилируют его в непротонном растворителе (предпочтительно в- 15015516 ТГФ) бромацетонитрилом, в результате чего получают соединение (43). Нитрил (43) восстанавливают и циклизуют и после обработки водородом и гидратом оксида платины при 50C получают (44). Соединение (44) обрабатывают основанием (предпочтительно NaH) и алкилируют (9), в результате чего получают (45). (45) подвергают реакции сочетания с использованием фенилбороновой кислоты и катализатора,такого как тетракистрифенилфосфин палладия, и получают сложный эфир, который гидролизуют с получением кислоты (46). Кислоту (46) подвергают реакции сочетания с амином в стандартной среде для сочетания амидов, такой как 1,1'-карбодиимидазол, в результате чего получают амид (47). Препарат 1. 2,6-Дихлор-4-гидроксибензальдегид. Растворяют 3,5 дихлорфенол (1 кг, 6,13 моль) в 3 л диметилформамида (ДМФ) и охлаждают до 0C. Добавляют имидазол (918,74 г, 6,75 моль), а затем трет-бутилдиметилсилилхлорид (1017,13 г, 6,75 моль). Нагревают смесь до комнатной температуры и перемешивают в течение 15 мин. Вливают в воду (6 л) и экстрагируют эфиром (4 л). Промывают органический слой водой 2 раза, 10% водным хлоридом лития, а затем соляным раствором, а затем сушат над сульфатом натрия. После фильтрования и концентрирования под вакуумом получают трет-бутил-(3,5-дихлорфенокси)диметилсиланом (1700 г) в виде масла. Растворяют трет-бутил(3,5-дихлорфенокси)диметилсилан (425 г, 1,5 моль) в 4 л сухого тетрагидрофурана и охлаждают до -68C. Медленно добавляют 1,1 экв. втор-бутиллития (103,1 г, 1,61 моль) при 68C (1,75 ч). После завершения добавления перемешивают реакционную смесь при -70C в течение 30 мин. Добавляют диметилформамид (168,5 г, 2,3 моль) и перемешивают реакционную смесь при -70C в течение 1 ч. Добавляют 1 М соляную кислоту в воде (3,5 л) и оставляют реакционную смесь нагреваться при комнатной температуре. Вливают реакционную смесь в простой эфир (5 л), промывают водой, а затем соляным раствором. Сушат над сульфатом натрия и концентрируют под вакуумом до получения оранжевого твердого вещества. Измельчают в порошок с холодным дихлорметаном, а затем фильтруют. В результате получают 250 г (80%) бледно-желтого твердого вещества. Препарат 2. 2,6-Дихлор-4-метоксибензальдегид. Смешивают 2,6-дихлор-4-гидроксибензальдегид (120 г, 628,24 ммоль) и карбонат калия (173,65 г,1256,5 ммоль) в 900 мл диметилформамида и добавляют йодметан (107 г, 753,9 ммоль). Перемешивают реакционную смесь при комнатной температуре в течение 3 ч. Отфильтровывают твердый осадок и вливают в 6 л воды. Отфильтровывают твердое вещество, промывают несколько раз водой, сушат на воздухе и растворяют в этилацетате. Промывают водой, а затем соляным раствором, затем сушат над сульфатом натрия. Фильтруют и концентрируют в вакууме до объема 100 мл, после чего твердые вещества начнут выпадать в осадок. Фильтруют, а затем концентрируют фильтрат для получения второго выхода. Промывают гексаном, смешивают все твердые продукты и сушат их в вакууме. В результате получают 112,3 г грязно-белого твердого вещества: 1H-ЯМР (400 МГц, CDCl3)10,41 (с, 1H), 6,90 (с, 2H), 3,87 (с, 3H). Препарат 3. 2,6-Дихлор-4-бензилоксибензальдегид. Добавляют к смеси 2,6-дихлор-4-гидроксибензальдегида (250 г, 1,3 моль) и карбоната калия(361,8 г, 2,62 моль) в 2 л диметилформамида бензилбромид (268,64 г, 1,57 моль). Перемешивают при комнатной температуре в течение 1 ч. Отфильтровывают твердые вещества и вливают в 12 л воды. Отфильтровывают твердые вещества, промывают несколько раз водой, сушат на воздухе и растворяют в этилацетате. Сушат над сульфатом магния, фильтруют и концентрируют в вакууме до объема 1,5 л. Оставляют для осаждения на ночь, после чего фильтруют. Промывают твердое вещество минимальным количеством гексана и сушат под вакуумом. Концентрируют фильтрат под вакуумом и растирают в порошок с гексаном. В результате получают второй выход продукта, который при последующем смешивании с первым выходом даст 245 г белых кристаллов. Операции повторяют еще раз и получают третью порцию продукта в виде 80 г светло-коричневого порошка (общий выход 88%): 1H-ЯМР (400 МГц, ДМСОd6)10,26 (с, 1H), 7,43 (м, 5H), 7,28 (с, 2H), 5,25 (с, 2H). Препарат 4. (2,6-Дихлор-4-метоксифенил)метанол. Суспендируют 2,6-дихлор-4-метоксибензальдегида (112 г, 546 ммоль) в 1500 мл этанола и охлаждают на бане со льдом до 7C. Добавляют порциями боргидрид натрия (20,67, 546 ммоль), в результате чего получают раствор. Удаляют из бани со льдом и перемешивают в течение 2 ч. Осторожно добавляют реакционную смесь к насыщенному раствору хлорида аммония (4 л) и перемешивают до полного гашения. Экстрагируют дихлорметаном (31 л) и сушат смешанные органические экстракты над сульфатом натрия. Фильтруют и концентрируют под вакуумом, в результате получают 113 г светло-коричневого твердого вещества: 1H-ЯМР (400 МГц, CDCl3)6,86 (с, 2H), 4,86 (с, 2H), 3,78 (с, 3H), 2,07 (с, 1H). Препарат 5. (2,6-Дихлор-4-бензилоксифенил)метанол. Указанное соединение можно получить способом, описанным для препарата 4. ЯМР (ДМСО-d6)7,38 (м, 4H), 7,33 (м, 1H), 7,12 (с, 2H), 5,14 (с, 2H), 5,05 (т, 1H), 4,59 (д, 2H). Препарат 6. 2-Бромметил-1,3-дихлор-5-метоксибензол. Растворяют (2,6-дихлор-4-метоксифенил)метанол (113 г, 545,76 ммоль) в 1200 мл сухого ТГФ и охлаждают до 0 в атмосфере азота. Добавляют PBr3 (59,1 г, 218,3 ммоль) в атмосфере азота и перемешивают при 0C в течение 30 мин. Вливают в насыщенный водный раствор NaHCO3 и экстрагируют EtOAc.- 16015516 Сушат и концентрируют под вакуумом, в результате получают 129,4 г продукта в форме грязно-белого твердого вещества. ЯМР (CDCl3)6,88 (с, 2H), 4,73 (с, 2H), 3,79 (с, 3H). Препарат 7. 2-Бромметил-1,3-дихлор-5-бензилоксибензол. Указанное соединение можно приготовить, следуя в основном способу, описанному для препарата 6. Выход 89%. МС (электроспрей) (m/z): 347 (M+1). Препарат 8. 3,5-Дихлор-4-метиланилин. Растворяют 1,3-дихлор-2-метил-5-нитробензол (0,50 г, 2,43 ммоль) в ДМФ и добавляют одной порцией дигидрат хлорида олова(II) (2,74 г, 12,1 ммоль). Перемешивают реакционную смесь в течение 1 ч,разбавляют этилацетатом и фильтруют через целит. Промывают фильтрат четыре раза водой и два раза соляным раствором, сушат над MgSO4, фильтруют и концентрируют. В результате получают темное масло. Очищают осадок путем хроматографии на силикагеле, с использованием градиента от 5 до 10% этилацетата в гексанах. В результате получают 342 мг (80%) указанного в заголовке продукта в форме белых хлопьев. Препарат 9. 5-Бром-1,3-дихлор-2-метилбензол. Готовят суспензию 3,5-дихлор-4-метиланилина в смеси 48% HBr (5 мл) и воды (5 мл) и нагревают при помощи термофена почти до точки кипения смеси. Охлаждают суспензию до комнатной температуры, а затем до 0C на бане со льдом и соляного раствора. Добавляют по каплям раствор нитрита натрия(109 мг, 1,58 ммоль) в воде (2 мл). После завершения добавления перемешивают реакционную смесь в течение еще 15 мин в холодной ванне. Добавляют раствор CuBr (1,08 г, 7,53 ммоль) в 48% HBr (2 мл) и нагревают реакционную смесь при быстром перемешивании до 50C в течение 1 ч. Охлаждают реакционную смесь до комнатной температуры, разбавляют EtOAc и удаляют водный слой. Промывают органический слой водой и соляным раствором, сушат MgSO4, фильтруют через целит и получают оранжевый остаток. Очищают осадок путем хроматографии на силикагеле, используя гексаны. В результате получают 164 мг (45%) продукта в форме желтого твердого вещества. Препарат 10. 5-Бром-2-(бромметил)-1,3-дихлорбензол. Нагревают до температуры кипения с обратным холодильником раствор 5-бром-1,3-дихлор-2 метилбензола (97 мг, 0,40 ммоль), N-бромсукцинимида (76 мг, 0,425 ммоль) и бензоилпероксида (16 мг,0,06 ммоль) в CCl4 (5 мл) в течение 3 ч в атмосфере N2. Охлаждают реакционную смесь до комнатной температуры и концентрируют до получения оранжевого осадка. Очищают осадок путем хроматографии на силикагеле, используя гексаны. В результате получают 112 мг (87%) продукта в форме белых кристаллов. Препарат 11. Этиловый эфир 3-циано-3-фенилпропионовой кислоты. Указанное соединение можно получить, следуя процедуре, описанной в J. Org. Chem., vol. 43,с. 4662 (1978). Препарат 12. 4-Гидрокси-2-фенилбутиронитрил. Указанное соединение можно получить, следуя процедуре, описанной в Synth. Commun.,vol. 28(18), с. 3305-3315 (1998). Препарат 13. 3-Фенилдигидрофуран-2-он. Указанное соединение можно получить, следуя процедуре, описанной в Synth. Commun.,vol. 28(18), с. 3305-3315 (1998). Препарат 14. 3-Циклогексилдигидрофуран-2-он. Перемешивают смесь 3-фенилдигидрофуран-2-она (9,0 г), родия-на-угле (5%, 3,62 г) и этанола(220 мл) на шейкере Парра при давлении 60 фунт/кв. дюйм и температуре 60C в течение 18 ч. Удаляют реакционную смесь из шейкера Парра и фильтруют ее через целит. После концентрирования фильтрата получают 8,6 г (92%) указанного соединения. Препарат 15. 3-Циклогексилпирролидин-2-он. Нагревают смесь 3-циклогексилдигидрофуран-2-она (32,2 г), гидроксида аммония (700 мл) и этанола (700 мл) при 230C в герметичной стальной бутылке в течение 18 ч. Охлаждают реакционную смесь и удаляют растворитель в вакууме. Отделяют осадок этилацетатом (500 мл) и HCl (1 N, 300 мл). Сушат органическую фазу над сульфатом натрия. После фильтрации и концентрирования перекристаллизовывают в смеси 1:3 этилацетат:гексан. В результате получают 30 г (94%) указанного соединения. Препарат 16. 2-(2,6-Дихлор-4-метоксибензил)изоиндол-1,3-дион. Перемешивают смесь фталимида калия (1,85 г, 10 ммоль), 2-бромметил-1,3-дихлор-5-метоксибензола (2,68 г, 10 ммоль) и ДМФ (20 мл) при 50C в течение 12 ч. Охлаждают реакционную смесь и разбавляют этилацетатом (60 мл), затем промывают три раза водой и один раз соляным раствором. После высушивания органической фазы над сульфатом натрия фильтруют и концентрируют ее под вакуумом. Очищают осадок путем хроматографии на силикагеле, используя смесь 1:3 этилацетат/гексан. В результате получают 2,74 г (82%) указанного соединения. MS: (m/z): 336 (M+H)+. Препарат 17. Гидрохлорид 2,6-дихлор-4-метоксибензиламина. Добавляют к раствору 2-(2,6-дихлор-4-метоксибензил)изоиндол-1,3-диона (2,74 г, 8,18 ммоль) в этаноле гидрат гидразина (0,61 г, 12,27 ммоль) при 70C в течение 12 ч. Охлаждают реакционную смесь- 17015516 и отфильтровывают осадок. Концентрируют фильтрат и разделяют осадок в этилацетате и воде. После сушки органической фазы над сульфатом натрия фильтруют и концентрируют ее под вакуумом. Добавляют к осадку этилацетат (20 мл) и HCl (4 N в диоксане, 5 мл). Белые кристаллы собирают путем фильтрации и сушат на воздухе. В результате получают 1,65 г (84%) указанного соединения. MS (m/z): 242(100 мл) триметил алюминий (2 M в толуоле, 16,6 мл, 33,2 ммоль) при комнатной температуре в течение 10 мин. К этой смеси добавляют раствор 3-циклогексилдигидрофуран-2-она (2,51 г, 14,94 ммоль) в толуоле (50 мл). Перемешивают реакционную смесь с обратным холодильником в течение 6 ч. Охлаждают реакционную смесь и гасят реакцию HCl (1 N, 50 мл). Разделяют смесь в этилацетате и HCl (1 N). Отделяют органический слой и промывают водой и соляным раствором. После сушки органической фазы над сульфатом натрия и фильтрации фильтрат концентрируют и получают 4,5 г (81%) указанного соединения в форме белого твердого вещества. MS (m/z): 374 (M+H)+. Препарат 19. 4-Бром-2-циклогексил-N-(2,6-дихлор-4-метоксибензил)бутирамид. Перемешивают смесь трифенилфосфина (3,16 г, 12,06 ммоль), брома (1,91 г, 12,06) и метиленхлорида (150 мл) при комнатной температуре в течение 20 мин. К этой смеси добавляют раствор имидазола(0,98 г, 14,48 ммоль), 2-циклогексил-N-(2,6-дихлор-4-метоксибензил)-4-гидроксибутирамида (4,5 г,12,06 ммоль) в метиленхлориде (100 мл). Перемешивают при комнатной температуре в течение 3,5 ч. Промывают реакционную смесь HCl (1 N), водой и соляным раствором. После сушки органического слоя над сульфатом натрия фильтруют и концентрируют под вакуумом. Очищают осадок путем хроматографии на силикагеле с использованием смеси 1:3 этилацетат/гексан. В результате получают 2,5 г указанного в заголовке соединения. MS (m/z): 436 (M+H)+. Препарат 20. 3,5-Дихлор-4-(3-циклогексил-2-оксопирролидин-1-илметил)фениловый эфир трифторметансульфоновой кислоты. При 0C добавляют к раствору 3-циклогексил-1-(2,6-дихлор-4-гидроксибензил)пирролидин-2-она(1,20 г, 3,52 ммоль) и пиридина (2,4 г, 30 ммоль) в CH2Cl2 (25 мл) ангидрид трифторметансульфоновой кислоты (2,98 г, 10,56 ммоль) в течение 1 ч. Разбавляют реакционную смесь CH2Cl2 и промывают 1 NHCl и водой. Сушат органический слой (Na2SO4) и удаляют растворитель. Очищают осадок путем хроматографии на силикагеле. В результате получают 0,82 г (49%) указанного в заголовке продукта. MS (m/z): 474 (M+). Препарат 21. Этиловый эфир (4-гидроксициклогексил)уксусной кислоты. Перемешивают смесь этилового эфира (4-гидроксифенил)уксусной кислоты (78,86 г), родия, оксида алюминия (40%, 31,87 г) и этанола (1 л) на гидрогенирующем шейкере Парра при давлении 60 фут/кв. дюйм и температуре 60C в течение 18 ч. Удаляют реакционную смесь из шейкера Парра. Фильтруют смесь через целит и концентрируют. В результате получают 81,25 г (99%) указанного в заголовке соединения. Препарат 22. Этиловый эфир [4-(трет-бутилдифенилсиланилокси)циклогексил]уксусной кислоты. Добавляют к смеси этилового эфира (4-гидроксициклогексил)уксусной кислоты (17,2 г, 100 ммоль),имидазола (8,16 г, 120 ммоль) и ДМФ (150 мл) тетрабутилдифенилсиллилхлорид (32,8 г, 120 ммоль) при комнатной температуре в течение 12 ч. Разбавляют реакционную смесь эфиром и промывают три раза водой. После сушки органического слоя над сульфатом натрия фильтруют и концентрируют. Очищают путем флэш-хроматографии с использованием 7% этилацетата в гексанах. В результате получают 32,5 г(80%) указанного соединения. MS (m/z): 411 (M+). Препарат 23. Этиловый эфир 2-[4-(трет-бутилдифенилсиланилокси)циклогексил]-3-цианопропионовой кислоты. Добавляют к раствору этилового эфира [4-(трет-бутилдифенилсиланилокси)циклогексил]уксусной кислоты (4,71 г, 11,49 ммоль) в ТГФ (40 мл) при -78C 1,6 М раствор диизопропиламида лития в ТГФ(7,18 мл, 14,36 ммоль) и перемешивают при -78C в течение 20 мин в атмосфере N2. Добавляют к реакционной смеси бромацетонитрил (1,71 г, 14,36 моль) и перемешивают при -78C в течение 2 ч. Нагревают реакционную смесь до комнатной температуры и перемешивают в течение 2 ч. Гасят реакцию 1 NHCl при 0C. Разбавляют реакционную смесь этилацетатом и промывают водой. Сушат органическую фазу (Na2SO4), удаляют растворитель под вакуумом и получают неочищенный продукт. Очищают полученный продукт градиентом от 25 до 40% этилацетата в гексанах и получают 2,62 г (50%) указанного в заголовке продукта. MS (m/z): 450 (M+1). Препарат 24. 3-[4-(трет-Бутилдифенилсиланилокси)циклогексил]пирролидин-2-он. Пропускают N2 через смесь этилового эфира 2-[4-(трет-бутилдифенилсиланилокси)циклогексил]-3 цианопропионовой кислоты (2,6 г) и гидрата PtO2 (0,8 г) в этаноле (30 мл), а затем перемешивают в атмосфере H2 (50 фунт на кв. дюйм) при 50C в течение 16 ч. Охлаждают реакционную смесь и фильтруют через целит. Удаляют растворитель из фильтрата под вакуумом. Неочищенный продукт очищают градиентом от 50% этилацетата в гексанах до 100% этилацетата. В результате получают 0,75 г (31%) указанно- 18015516 го в заголовке продукта. MS (m/z): 422 (M+). Препарат 25. 1-(4-Бензилокси-2,6-дихлорбензил)-3-[4-(трет-бутилдифенилсиланилокси)циклогексил]пирролидин-2-он. К раствору 3-[4-(трет-бутилдифенилсиланилокси)циклогексил]пирролидин-2-она (0,75 г, 1,78 ммоль) в ДМФ (25 мл) добавляют 60% гидрида натрия (0,11 г, 2,67 ммоль) и перемешивают при комнатной температуре в течение 15 мин в атмосфере N2. Охлаждают реакционную смесь до 0C, добавляют 2-бромметил-1,3-дихлор-5-бензилоксибензол (0,74 г, 2,13 ммоль) и перемешивают в течение 30 мин при 0C. Нагревают до комнатной температуры и перемешивают в течение 30 мин в атмосфере N2. Гасят реакцию водой и разбавляют смесь диэтиловым эфиром. Промывают органическую фазу три раза водой,сушат (Na2SO4) и удаляют растворитель in vacuo. Полученный неочищенный продукт очищают градиентом от 0 до 30% этилацетата в гексанах, в результате чего получают 1,2 г (99%) указанного в названии продукта. MS (m/z): 686 (M+). Препарат 26. 3-[4-(трет-Бутилдифенилсиланилокси)циклогексил]-1-(2,6-дихлор-4-гидроксибензил)пирролидин-2-он. Пропускают N2 и H2 через смесь 3-(4-бензилокси-2,6-дихлорбензил)-3-[4-(трет-бутилдифенилсиланилокси)циклогексил]пирролидин-2-она (1,15 г) и 20% гидроксида палладия(II) на угле (0,200 г) в этаноле (25 мл) и перемешивают в атмосфере H2 в течение 12 ч при комнатной температуре. Фильтруют смесь через целит. После концентрирования и фильтрации in vacuo получают 0,62 г (62%) указанного в заголовке продукта. MS (m/z): 596 (M+). Препарат 27. 4-3-[4-(трет-Бутилдифенилсиланилокси)циклогексил]-2-оксопирролидин-1-илметил-3,5-дихлорфениловый эфир трифторметансульфоновой кислоты. К смеси 3-[4-(трет-бутилдифенилсиланилокси)циклогексил]-1-(2,6-дихлор-4-гидроксибензил)пирролидин-2-она (0,62 г, 1,04 ммоль), пиридина (0,41 г, 5,21) и дихлорметана (15 мл) при 0C добавляют ангидрид трифторметансульфоновой кислоты (0,59 г, 2,08 ммоль). Перемешивают реакционную смесь в течение 1 ч при 0C и 1 ч при комнатной температуре. Удаляют избыток пиридина под вакуумом и добавляют к остатку дихлорметан, а затем промывают водой и насыщенным хлоридом аммония. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом и очищают продукт на колонке с силикагелем, используя в качестве элюента 20% этилацетат. В результате получают 0,61 г (80%) указанного в заголовке соединения. MS (m/z): 728 (M+). Препарат 28. Метиловый эфир 4'-3-[4-(трет-бутилдифенилсиланилокси)циклогексил]-2-оксопирролидин-1-илметил-3',5'-дихлорбифенил-4-карбоновой кислоты. Доводят смесь 4-3-[4-(трет-бутилдифенилсиланилокси) циклогексил]-2-оксопирролидин-1 илметил-3,5-дихлорфенилового эфира трифторметансульфоновой кислоты (0,61 г, 0,84 ммоль), 4 метоксикарбонилфенилбороновой кислоты (0,18 г, 1 ммоль), карбоната натрия (0,267 г, 2,52 ммоль) в ТГФ (15 мл) и воды (5 мл) до 60C. К этой смеси при 60C добавляют Pd(PPh3)4 (0,048 г, 0,04 ммоль). Увеличивают температуру реакционной смеси до 80C и перемешивают в течение 1 ч. Охлаждают реакционную смесь, разбавляют этилацетатом, промывают водой и соляным раствором. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом и очищают полученный продукт на колонке с силикагелем, используя в качестве элюента 25% этилацетата в гексанах. В результате получают 0,56 г (93%) указанного в заголовке продукта. MS (m/z): 714 (M+). Препарат 29. 4'-3-[4-(трет-Бутилдифенилсиланилокси)циклогексил]-2-оксопирролидин-1-илметил-3',5'-дихлорбифенил-4-карбоновая кислота. К раствору метилового эфира 4'-3-[4-(трет-бутилдифенилсиланилокси)циклогексил]-2-оксопирролидин-1-илметил-3',5'-дихлорбифенил-4-карбоновой кислоты (0,56 г) в ТГФ (5 мл) и метаноле (1 мл) добавляют 2 N LiOH (5 мл) и перемешивают при 50C в течение 2 ч. Охлаждают реакционную смесь,разбавляют этилацетатом (25 мл) и промывают 1 N HCl (10 мл). Сушат органическую фазу (Na2SO4) и удаляют растворитель in vacuo. В результате получают 0,55 г (99%) указанного соединения. MS (m/z): 700 (M+). Препарат 30. 3-[4-(трет-Бутилдифенилсиланилокси)циклогексил]-1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]пирролидин-2-он. К раствору 4'-3-[4-(трет-бутилдифенилсиланилокси)циклогексил]-2-оксопирролидин-1-илметил 3',5'-дихлорбифенил-4-карбоновой кислоты (0,35 г, 0,5 ммоль) в CH2Cl2 (20 мл) добавляют 1,1'-карбодиимидазол (0,162 г, 1,0 ммоль) и перемешивают в течение 45 мин при комнатной температуре. Добавляют к реакционной смеси гидрохлорид 4-трифторметилпиперидина (0,142 г, 0,75 ммоль) и диизопропилэтиламин (0,097 г, 0,75 ммоль) и перемешивают в течение 12 ч при комнатной температуре. Загружают смесь на колонку с силикагелем и промывают 25-50% этилацетатом в гексанах. В результате получают 0,21 г (50%) указанного соединения. MS (m/z): 835 (M+). Препарат 31. Этиловый эфир 3-циано-2-пиперидин-1-илпропионовой кислоты. К раствору этил 1-пиперидин ацетата (20,0 г, 0,117 моль) в ТГФ (200 мл) при -78C добавляют 2 М раствор диизопропиламида лития в смеси гептан/ТГФ/этилбензол (70,1 мл, 0,140 моль) и перемешивают при -78C в течение 20 мин в атмосфере N2. Добавляют к реакционной смеси бромацетонитрил (21,00 г,- 19015516 0,175 моль) и перемешивают при -78C в течение 15 мин. Нагревают реакционную смесь до комнатной температуры и перемешивают 4 ч. Гасят реакцию в насыщенном хлориде аммония. Разбавляют реакционную смесь этилацетатом и промывают водой. Сушат органическую фазу (Na2SO4), удаляют растворитель под вакуумом. Полученный в результате продукт очищают градиентом от 0 до 20% этилацетата в гексанах. Получают 6,74 г (27%) указанного в заголовке продукта. Rf=0,41 (3/1 гаксаны/этилацетат). MSэлектроспрей (m/z): 211 (M+1). Препарат 32. 3-Пиперидин-1-илпирролидин-2-он. Пропускают N2 через смесь этилового эфира 3-циано-2-пиперидин-1-илпропионовой кислоты(50 фунт/кв. дюйм) при 50C в течение 16 ч. Охлаждают реакционную смесь и фильтруют через фильтрHyflo. Удаляют растворитель из фильтрата под вакуумом. Очищают полученный продукт градиентом от 0 до 10% метанола в CH2Cl2. В результате получают 1,11 г (59%) указанного в заголовке продукта.CH2Cl2 (250 мл) при 0C добавляют метилбромацетат (17,37 г, 0,113 моль), нагревают до комнатной температуры и перемешивают 16 ч при комнатной температуре в атмосфере N2. Разбавляют реакционную смесь насыщенным NaHCO3 и водой и дважды экстрагируют смесью 3:1 хлороформ:изопропанол. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Очищают полученный сырой продукт градиентом от 0 до 5% метанола в CH2Cl2. В результате получают 14,22 г (65%) указанного в заголовке продукта. Rf=0,77 (9/1 CH2Cl2/метанол). ES (электроспрей) MS (m/z): 194 (M+). Препарат 34. Метиловый эфир (4-гидроксипиперидин-1-ил)уксусной кислоты. К раствору 4-гидроксипиперидина (20,0 г, 0,19 моль) и (CH3CH2)3N (24,0 г, 0,24 моль) в CH2Cl2(200 мл) при 0C добавляют метилбромацетат (30,21 г, 0,197 моль), нагревают до комнатной температуры и перемешивают 2 ч при комнатной температуре в атмосфере N2. Разбавляют реакционную смесь водой и экстрагируют смесью 3:1 хлороформ:изопропанол. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают 5% метанолом в CH2Cl2. В результате получают 20,13 г (59%) указанного продукта. Rf=0,13 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 174(M+). Препарат 35. Метиловый эфир [4-(трет-бутилдифенилсиланилокси)пиперидин-1-ил]уксусной кислоты. К раствору метилового эфира (4-гидроксипиперидин-1-ил)уксусной кислоты (10,0 г, 57,7 ммоль) и имидазола (4,71 г, 69,2 ммоль) в ДМФ (100 мл) добавляют трет-бутилдифенилсилилхлорид (19,04 г,69,3 ммоль) и перемешивают в течение 16 ч при комнатной температуре. Разбавляют реакционную смесь диэтиловым эфиром и промывают водой. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают 2% метанолом в CH2Cl2. В результате получают 17,38 г(M+). Препарат 36. Метиловый эфир 2-[4-(трет-бутилдифенилсиланилокси)пиперидин-1-ил]-3 цианопропионовой кислоты. К раствору метилового эфира 4-(трет-бутилдифенилсиланилокси)пиперидин-1-ил]уксусной кислоты (17,36 г, 42,2 ммоль) в ТГФ (100 мл) при -78C добавляют 2 М раствор диизопропиламида лития в смеси гептан/ТГФ/этилбензол (25,3 мл, 50,6 ммоль) и перемешивают при -78C в течение 15 мин в атмосфере N2. Нагревают реакционную смесь до -20C, а затем снова охлаждают до -78C. Добавляют к реакционной смеси бромацетонитрил (7,57 г, 63,2 ммоль) и перемешивают при -78C в течение 15 мин. Нагревают реакционную смесь до комнатной температуры и перемешивают в течение 2 ч. Добавляют в реакционную смесь кислоту и гасят в насыщенном NH4Cl. Разбавляют реакционную смесь этилацетатом и промывают водой. Сушат органический осадок (Na2SO4) и удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 0 до 100% этилацетата в гексанах. В результате получают 4,83 г (25%) указанного продукта. Rf=0,51 (1/1 гексаны/этилацетат). MS (электроспрей) (m/z): 451(M+). Препарат 37. 3-[4-(трет-Бутилдифенилсиланилокси)пиперидин-1-ил]пирролидин-2-он. К смеси метилового эфира 2-[4-(трет-бутилдифенилсиланилокси)пиперидин-1-ил]-3-цианопропионовой кислоты (3,32 г, 7,40 ммоль) и гексагидрата хлорида кобальта(II) (0,87 г, 3,65 ммоль) в ТГФ(60 мл) и воды (30 мл) 0C добавляют порциями боргидрид натрия (1,39 г, 36,7 ммоль), нагревают до комнатной температуры и перемешивают в течение 2 дней в атмосфере N2. Добавляют к реакционной смеси 28% гидроксида аммония (1 мл) и фильтруют через фильтр Hyflo. Удаляют растворитель из фильтрата под вакуумом, разбавляют осадок минимальным количеством воды и соляного раствора и трижды экстрагируют смесью 3:1 хлороформ:изопропанол. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 0 до 10% метанола вCH2Cl2/метанол). MS (электроспрей) (m/z): 423 (M+). Препарат 38. 1-(4-Бензилокси-2,6-дихлорбензил)-3-[4-(трет-бутилдифенилсиланилокси)пиперидин 1-ил]пирролидин-2-он. К раствору 3-[4-(трет-бутилдифенилсиланилокси)пиперидин-1-ил]пирролидин-2-она (0,25 г,0,59 ммоль) в ТГФ (6 мл) при -78C добавляют 1,6 М н-бутил лития в гексанах (0,37 мл, 0,59 ммоль) и перемешивают при -78C в течение 10 мин в атмосфере N2. Добавляют к реакционной смеси 5-бензилокси-2-бромметил-1,3-дихлорбензол (0,204 г, 0,59 ммоль), нагревают до комнатной температуры и перемешивают в течение 16 ч в атмосфере N2. Снова охлаждают реакционную смесь до -78C, добавляют 1,6 М н-бутил лития в гексанах (0,37 мл, 0,59 ммоль), нагревают до комнатной температуры и перемешивают в течение 2 ч. Гасят реакцию водой и проводят экстракцию этилацетатом. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 50 до 100% этилацетата в гексанах. Получают 0,263 г (65%) указанного в заголовке продукта.Rf=0,18 (3/1 этилацетат/гексаны). MS (электроспрей) (m/z): 687 (M+). Препарат 39. 8-(трет-Бутилдифенилсиланилокси)-2-(2,6-дихлор-4-гидроксибензил)-2-азаспиро[4,5]декан-1-он. Пропускают N2 и H2 через смесь 1-(4-бензилокси-2,6-дихлорбензил)-3-[4-(трет-бутилдифенилсиланилокси)пиперидин-1-ил]пирролидин-2-она (0,452 г, 0,65 ммоль) и 20% гидроксида палладия(II) на угле (90 мг) в ТГФ (10 мл) и этилацетате (10 мл) и перемешивают в атмосфере H2 в течение 16 ч при комнатной температуре. Добавляют к смеси сульфат натрия и фильтруют через Hyflo, удаляют растворитель из фильтрата под вакуумом. В результате получают 0,354 г (90%) указанного в заголовке продукта.Rf=0,45 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 597 (M+). Препарат 40. 4-3-[4-(трет-Бутилдифенилсиланилокси)пиперидин-1-ил]-2-оксопирролидин-1-илметил-3,5-дихлорфениловый эфир трифторметансульфоновой кислоты. К раствору 8-(трет-бутилдифенилсиланилокси)-2-(2,6-дихлор-4-гидроксибензил)-2-азаспиро[4,5]декан-1-она (0,351 г, 0,58 ммоль), пиридина (0,140 г, 1,77 ммоль) и 4-диметиламинопиридина (0,007 г,0,057 ммоль) в CH2Cl2 (12 мл) при 0C добавляют ангидрид трифторметансульфоновой кислоты (0,284 г,1,01 ммоль) и перемешивают в течение 1 ч при 0C в атмосфере N2. Разбавляют реакционную смесьCH2Cl2 и промывают водой. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 0 до 10% метанола в CH2Cl2. В результате получают 0,363 г (85%) указанного в заголовке продукта. Rf=0,66 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 729 (M+). Препарат 41. Через смесь 4-3-[4-(трет-бутилдифенилсиланилокси)пиперидин-1-ил]-2-оксопирролидин-1 илметил-3,5-дихлорфенилового эфира трифторметансульфоновой кислоты (0,357 г, 0,49 ммоль) и 4-метоксикарбонилфенилбороновой кислоты (0,106 г, 0,589 ммоль) в ТГФ (8 мл) и 2 М карбонате натрия(0,73 мл) пропускают N2. К реакционной смеси добавляют Pd(PPh3)4 (0,028 г, 0,024 ммоль) и нагревают ее до 80C в течение 1 ч в атмосфере N2. Реакционную смесь охлаждают и разбавляют этилацетатом, а затем разбавляют водой. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 50 до 85% этилацетата в гексанах. В результате получают 0,249 г (71%) указанного в заголовке продукта. Rf=0,16 (3/1 гаксаны/этилацетат). MS (m/z): 715 Добавляют к смеси препарата 41 (0,246 г, 0,344 ммоль) в ТГФ (15 мл) и метанола (3 мл) 2 М гидроксида лития (0,86 мл) и перемешивают в течение 16 ч при комнатной температуре. Нейтрализуют реакционную смесь 1 N HCl и экстрагируют этилацетатом и водой. Сушат органическую фазу (Na2SO4) и удаляют растворитель под вакуумом. В результате получают 0,245 г (100%) указанного в заголовке продукта. Rf=0,38 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 701 (M+). Препарат 43. 3-[4-(трет-Бутилдифенилсиланилокси)пиперидин-1-ил]-1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]пирролидин-2-он. К раствору препарата 42 (0,241 г, 0,34 ммоль) в CH2Cl2 (10 мл) добавляют 1,1'-карбонилдиимидазол(0,095 г, 0,58 ммоль) и перемешивают в течение 2 ч при комнатной температуре в атмосфере N2. Добавляют к реакционной смеси 4-(трифторметил)пиперидин HCl (0,130 г, 0,68 ммоль) и диизопропилэтила- 21015516 мин (0,18 г, 1,38 ммоль) и перемешивают в течение 6 ч при комнатной температуре в атмосфере N2. Разбавляют реакционную смесь этилацетатом и промывают водой. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 0 до 10% метанола в CH2Cl2. В результате получают 0,251 г (87%) указанного в заголовке продукта. Rf=0,60 (9/1 В схеме I, содержащей подходящие заместители, пиперидин алкилируют бромэтилацетатом в присутствии основания, такого как триэтиламин, с образованием сложного эфира (43). Проводят реакцию эфира (43) с основанием, таким как LDA и алкилируют его в непротонном растворителе (предпочтительно THF) бромацетонитрилом до нитрила, который восстанавливают и циклизуют с получением (44) после обработки водородом и гидратом оксида платины в метаноле при 50C. Соединение (44) обрабатывают основанием (предпочтительно NaH) и алкилируют содержащим подходящие заместители бензилгалогенидом с образованием (45). Обработка (45) водородом и подходящим катализатором, таким как 20%Pd(OH)2 на угле, дает соответствующий фенол, который обрабатывают ангидридом трифторметансульфоновой кислоты и основанием, таким как пиридин. В результате получают (46). Проводят реакцию сочетания (46) с применением реагента - фенилбороновой кислоты и катализатора, такого как тетракисфенилфосфин палладия. В результате получают сложный эфир, который гидролизуют с получением кислоты (47). Проводят реакцию сочетания кислоты (47) с амином в стандартных условиях сочетания аминов,таких как 1,1'-карбонилдиимидазол с получением амида (48). Препарат 44. Метиловый эфир 3-циано-2-(4,4-дифторпиперидин-1-ил)пропионовой кислоты. К раствору метилового эфира (4,4-дифторпиперидин-1-ил)уксусной кислоты (14,21 г, 73,6 ммоль)(препарат 33) в ТГФ (150 мл) при -78C добавляют 2 М раствор диизопропиламида лития в смеси гептан/ТГФ/этилбензол (44,2 мл, 88,4 ммоль) и перемешивают при -78C в течение 20 мин в атмосфере N2. Добавляют к реакционной смеси бромацетонитрил (13,25 г, 110,5 ммоль) и перемешивают при -78C в течение 15 мин. Нагревают реакционную смесь до комнатной температуры и перемешивают 4 ч. Вливают реакционную смесь в насыщенный NH4Cl. Разбавляют реакционную смесь этилацетатом и промывают водой. Сушат органический слой (Na2SO4) и удаляют растворитель под вакуумом. Полученный в результате сырой продукт очищают на диоксиде кремния с использованием градиента от 0 до 100% этилацетата в гексанах. В результате получают 3,74 г (22%) указанного продукта. Rf=0,50 (1/1 гексаны/этилацетат). MS (электроспрей) (m/z): 233(M+). Препарат 45. 3-(4,4-Дифторпиперидин-1-ил)пирролидин-2-он. К смеси метилового эфира 3-циано-2-(4,4-дифторпиперидин-1-ил)пропионовой кислоты (3,74 г,16,1 ммоль) и гексагидрата хлорида кобальта(II) (1,92 г, 8,07 ммоль) в ТГФ (50 мл) и воды (25 мл) при 0C добавляют порциями боргидрид натрия (3,05 г, 80,6 ммоль), нагревают до комнатной температуры и перемешивают в течение 2 дней в атмосфере N2. Добавляют к реакционной смеси 28% гидроксида аммония (2 мл) и фильтруют через фильтр Hyflo. Удаляют растворитель из фильтрата под вакуумом и разбавляют осадок минимальным количеством воды и соляного раствора, затем экстрагируют три раза смесью 3:1 хлороформ:изопропанол. Сушат органический слой Na2SO4 и удаляют растворитель под вакуумом. Очищают сырой продукт на диоксиде кремния с использованием градиента от 0 до 10% метанола в- 22015516 Препарат 46. 1-(2,6-Дихлор-4-гидроксибензил)-3-(4,4-дифторпиперидин-1-ил)пирролидин-2-он. Пропускают N2 и H2 через смесь 1-(4-бензилокси-2,6-дихлорбензил)-3-(4,4-дифторпиперидин-1 ил)пирролидин-2-она (3,10 г, 6,62 ммоль), 20% гидроксида палладия(II) на угле (310 мг) в ТГФ (25 мл) и этилацетата (100 мл) и перемешивают в атмосфере H2 в течение 6 ч при комнатной температуре. Добавляют к смеси сульфат натрия и фильтруют через фильтр Hyflo, удаляют растворитель из фильтрата под вакуумом. В результате получают 4,41 г материала, который после перекристаллизации из смеси этилацетат/CH2Cl2 дает 1,05 г (42%) указанного продукта, из-за присутствия дехлорированных примесей, образующихся в процессе снятия защиты. Rf=0,48 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 379 (M+). Препарат 47. 3,5-Дихлор-4-[3-(4,4-дифторпиперидин-1-ил)-2-оксопирролидин-1-илметил]фениловый эфир трифторметансульфоновой кислоты. К раствору 1-(2,6-дихлор-4-гидроксибензил)-3-(4,4-дифторпиперидин-1-ил)пирролидин-2-онаCH2Cl2 (20 мл) при 0C добавляют ангидрид трифторметансульфоновой кислоты (1,57 г, 5,5 6 ммоль) и перемешивают в течение 2 ч при 0C в атмосфере N2. Разбавляют реакционную смесь CH2Cl2 и промывают водой. Сушат органический слой с Na2SO4 и удаляют растворитель под вакуумом. Полученный сырой продукт очищают на диоксиде кремния с использованием 100% этилацетата. В результате получают 1,20 г (85%) указанного в заголовке продукта. Rf=0,41 (100% этилацетат). MS (электроспрей) (m/z): 511(M+). Препарат 48. 1-[3,5-Дихлор-4'-(4-карбоновая кислота)бифенил-4-илметил]-3-(4,4-дифторпиперидин 1-ил)пирролидин-2-он. Добавляют к смеси 1-[3,5-дихлор-4'-(4-карбоновой кислоты метиловый эфир)бифенил-4-илметил]3-(4,4-дифторпиперидин-1-ил)пирролидин-2-она (1,03 г, 2,08 ммоль) в ТГФ (50 мл) и метанола (5 мл) 2 М гидроксида лития (5,2 мл) и перемешивают в течение 16 ч при комнатной температуре. Нейтрализуют реакционную смесь 1 N HCl и экстрагируют этилацетатом и водой. Сушат органический слой при помощи Na2SO4 и удаляют растворитель под вакуумом. В результате получают 1,01 г (100%) указанного продукта. MS (электроспрей) (m/z): 483 (M+). Препарат 49. 3-(4-Метоксифенил)дигидрофуран-2-он. Указанное соединение можно получить, следуя процедуре, описанной в Synth. Commun. [SYNCAV], vol. 28(18), с. 3305-3315 (1998). Препарат 50. 3-(4-Метоксициклогексил)дигидрофуран-2-он. Перемешивают смесь 3-(4-метоксифенил)дигидрофуран-2-она (0,98 г), родия-на-угле (5%, 0,98 г) и этанола (50 мл) на гидрогенирующем шейкере Пара при давлении 60 фунт/кв. дюйм и температуре 60C в течение 18 ч. Удаляют реакционную смесь из шейкера Пара и фильтруют смесь через целит. В результате концентрирования фильтрата получают 0,92 г (90%) указанного соединения. Препарат 51. 3-(4-Метоксициклогексил)пирролидин-2-он. Нагревают смесь 3-(4-метоксициклогексил)дигидрофуран-2-она (0,91 г), гидроксида аммония(20 мл) и этанола (20 мл) при 230C в герметичной стальной бутылке в течение 12 ч. Охлаждают реакционную смесь и удаляют растворитель под вакуумом. Разделяют осадок в этилацетате (100 мл) и HCl (1 N,60 мл). Сушат органический слой над сульфатом натрия. После фильтрации и концентрирования перекристаллизация в смеси 1:3 этилацетат:гексан даст 0,71 г указанного в заголовке соединения. Препарат 52. 1-(4-Бром-2,6-дихлорбензил)-3-(4-метоксициклогексил)пирролидин-2-он. Добавляют к раствору 3-(4-метоксициклогексил)пирролидин-2-она (0,71 г, 3,6 ммоль) в ДМФ(20 мл) гидрид натрия (0,29 мл, 7,2 ммоль) и перемешивают при комнатной температуре в течение 10 мин в атмосфере N2. Добавляют к реакционной смеси 5-бром-2-бромметил-1,3-дихлорбензол (1,36 г,4,3 ммоль). Перемешивают смесь в течение 14 ч. Гасят реакцию водой и проводят экстракцию этилацетатом. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают 25% этилацетатом в гексанах. В результате получают 0,45 г указанного в заголовке соединения. Препарат 53. 1-(3,5-Дихлор-4'-фторбифенил-4-илметил)-3-(4-метоксициклогексил)пирролидин-2 он. Через смесь 1-(4-бром-2,6-дихлорбензил)-3-(4-метоксициклогексил)пирролидин-2-она (0,4 г,0,92 ммоль) и 4-фторфенилбороновой кислоты (0,19 г, 1,38 ммоль) в ТГФ (15 мл) и воде (5 мл) и карбонат натрия (0,29, 0,75 г) пропускают N2. Добавляют к реакционной смеси Pd(PPh3)4 (0,05 г, 0,046 ммоль) и нагревают до 80C в течение 2 ч в атмосфере N2. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают HCl (1 N) и водой. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают 35% этилацетатом в гексанах. В результате получают 0,45 г указанного в заголовке продукта. MS (m/z): 451 (M+). К раствору 4-бром-2-циклогексил-N-(2,6-дихлор-4-метоксибензил)бутирамида (2,0 г, 4,6 ммоль) в ТГФ (30 мл) добавляют диизопропилэтиламин (1,19 г, 9,19 ммоль) при 40C в течение 12 ч в условиях нагревания с обратным холодильником в течение 6 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают HCl (1 N) и водой. После высушивания органического слоя на сульфате натрия фильтруют и концентрируют под вакуумом. Очищают осадок путем хроматографии на силикагеле в смеси 1:4 этилацетат:гексан. В результате получают 1,3 г (80%) указанного соединения. MS (m/z): 356 (M+). Пример 2. 3-Циклогексил-1-(2,6-дихлор-4-гидроксибензил)пирролидин-2-он. К раствору 3-циклогексил-1-(2,6-дихлор-4-метоксибензил)пирролидин-2-она (1,3 г, 3,66 ммоль) в дихлорэтане (30 мл) при -20C добавляют трехбромистый бор (1,0 М в ДХМ, 18,3 мл) в течение 2 ч. Нагревают реакционную смесь до комнатной температуры и перемешивают в течение 12 ч. Гасят реакционную смесь метанолом и удаляют растворитель под вакуумом. Разделяют осадок в этилацетате и HCl(1 N). Промывают органический слой водой. После высушивания органического слоя фильтруют и концентрируют. В результате получают 1,2 г (99%) указанного соединения. MS (m/z): 342 (M+). Пример 3. Метиловый эфир 3',5'-дихлор-4'-(3-циклогексил-2-оксопирролидин-1-илметил)бифенил 4-карбоновой кислоты. Доводят смесь 3,5-дихлор-4-(3-циклогексил-2-оксопирролидин-1-илметил)фенилового эфира трифторметансульфоновой кислоты (0,80 г, 1,69 ммоль), 4-метоксикарбонилфенилбороновой кислоты(0,457 г, 2,53 ммоль), карбоната натрия (0,538 г, 5,07 ммоль) в ТГФ (20 мл) и воды (5 мл) до 60C. К этой смеси при 60C добавляют Pd(PPh3)4 (0,098 г, 0,084 ммоль), нагревают смесь до температуры 80C и перемешивают в течение 3 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой и соляным раствором. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный в результате сырой продукт очищают на колонке с силикагелем с использованием 20% этилацетата в гексанах. В результате получают 0,62 г (80%) указанного продукта. MS (m/z): 460 (M+). Пример 4. 3',5'-Дихлор-4'-(3-циклогексил-2-оксопирролидин-1-илметил)бифенил-4-карбоновая кислота. К раствору метилового эфира 3',5'-дихлор-4'-(3-циклогексил-2-оксопирролидин-1-илметил)бифенил-4-карбоновой кислоты (0,6 г) в ТГФ (15 мл) добавляют 5 N NaOH (5 мл) и перемешивают при 50C в течение 12 ч. Гасят реакцию HCl (1 N, 25 мл). Разделяют смесь в этилацетате и воде. Сушат органический слой (Na2SO4) и удаляют растворитель под вакуумом, в результате получают 0,56 г (96%) указанного в заголовке соединения. MS (m/z): 446 (M+). Пример 5. 3-Циклогексил-1-3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметилпирролидин-2-он. Растворяют 3',5'-дихлор-4'-(3-циклогексил-2-оксопирролидин-1-илметил)бифенил-4-карбоновую кислоту (0,207 г, 0,465 ммоль) в дихлорметане (15 мл) и добавляют 1,1'-карбонилдиимидазол (0,151 г,0,93 ммоль). Перемешивают в атмосфере аргона при комнатной температуре 1 ч, затем добавляют бисфторацетат N-2-фторэтилпиперазина (0,234 г, 0,651 ммоль) и диизопропилэтиламин (0,168 г, 1,3 ммоль).- 24015516 Перемешивают 1 ч, разбавляют реакционную смесь водой, разделяют фазы, а затем промывают последовательно насыщенным карбонатом натрия, водой и соляным раствором. Собирают органическую фазу,сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Очищают путем флэш-хроматографии с использованием 7% метанола в дихлорметане. В результате получают 0,2 г (77%) указанного соединения. MS (m/z): 560 (M+). Пример 6. 3-Циклогексил-1-[3,5-дихлор-4'-(4-изопропилпиперазин-1-карбонил)бифенил-4-илметил]пирролидин-2-он. Это соединение можно получить, следуя в основном процедуре, описанной для примера 5. MS Это соединение можно получить, следуя в основном процедуре, описанной для примера 5. MS Это соединение можно получить, следуя в основном процедуре, описанной для примера 5. MS Разделяют рацемический препарат 3-циклогексил-1-3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1 карбонил]бифенил-4-илметилпирролидин-2-она (пример 5) (0,224 г) на энантиомеры методом хиральной ВЭХЖ (колонка Chiralcel OJ-H 4,6150 мм, изократическая смесь 80:20 этанол:ацетонитрил с 0,2% диметилэтиламина, 0,6 мл/мин, УФ 260 нм). В результате получают 100 мг энантиомера 1 (99% н.э., уд.: 7,1 мин) и 95 мг энантиомера 2 (98% н.э., уд.: 11,5 мин). Добавляют к обоим энантиомерам HCl (1 N в каждый). В результате получают соль - гидрохлорид. Энантиомер 1 = препарат 9a. Энантиомер 2 = пример 10. Пример 11. 1-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-(4 гидроксициклогексил)пирролидин-2-он.(6 мл) ТФА (2 мл) при комнатной температуре в течение 1 ч, а затем при 55C в течение 12 ч. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают бикарбонатом натрия (насыщенным). Сушат- 25015516 органическую фазу (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают на колонке с силикагелем, используя градиент от 50% этилацетата в гексанах до 100% этилацетата. В результате получают 0,075 г (59%) указанного продукта. MS (m/z): 599 (M+). Препарат 12 а. 1-(4-Бром-2,6-дихлорбензил)-3-пиперидин-1-илпирролидин-2-он. Добавляют к раствору 3-пиперидин-1-илпирролидин-2-она (0,33 г, 1,96 ммоль) в ДМФ (6 мл) 60% гидрид натрия (0,12 г, 3,00 ммоль) и перемешивают при комнатной температуре в течение 15 мин в атмосфере N2. Охлаждают реакционную смесь до 0C, добавляют 5-бром-2-(бромметил)-1,3-дихлорбензол(0,70 г, 2,19 ммоль), перемешивают в течение 15 мин при 0C, нагревают до комнатной температуры и перемешивают в течение 3 ч в атмосфере N2. Гасят реакцию водой и разбавляют диэтиловым эфиром. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 0 до 5% метанола в CH2Cl2. В результате получают 0,718 г (90%) указанного в заголовке продукта. Rf=0,29 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 407 (M+). Препарат 13 а. 1-(3,5-Дихлор-4'-фторбифенил-4-илметил)-3-пиперидин-1-илпирролидин-2-он.(0,150 г, 0,37 ммоль) и 4-фторфенилбороновой кислоты (0,150 г, 1,07 ммоль) в толуоле (7 мл) и 2 М карбоната натрия (1,3 мл). Добавляют к реакционной смеси Pd(PPh3)4 (0,043 г, 0,037 ммоль) и нагревают до 90C в течение 4 ч в атмосфере N2. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой. Сушат органическую фазу (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 0 до 10% метанола в CH2Cl2. В результате получают 0,050 г (32%) указанного продукта. Rf=0,46 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 421 (M+). Пример 14. Метиловый эфир 3',5'-дихлор-4'-(2-оксо-3-пиперидин-1-илпирролидин-1 илметил)бифенил-4-карбоновой кислоты.(0,429 г, 1,06 ммоль) и 4-метоксикарбонилфенилбоной кислоты (0,57 г, 3,16 ммоль) в толуоле (15 мл) и 2 М карбоната натрия (3,7 мл). Добавляют к реакционной смеси Pd(PPh3)4 (0,061 г, 0,053 ммоль) и нагревают до 90C в течение 7 ч в атмосфере N2. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой. Сушат органическую фазу (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 0 до 10% метанола в CH2Cl2. В результате получают 0,19 г К раствору метилового эфира 3',5'-дихлор-4'-(2-оксо-3-пиперидин-1-илпирролидин-1 илметил)бифенил-4-карбоновой кислоты (0,190 г, 0,41 ммоль) в метаноле (15 мл) добавляют 5 N NaOH(0,82 мл), нагревают до температуры кипения с обратным холодильником и охлаждают и перемешивают при комнатной температуре в течение 16 ч. Удаляют растворитель под вакуумом. Полученный осадок нейтрализуют 1 N HCl. Разбавляют смесь этилацетатом и промывают водой. Сушат органический слой(Na2SO4), удаляют растворитель под вакуумом. Очищают сырой продукт градиентом от 0 до 10% метанола в CH2Cl2. В результате получают 0,106 г (58%) указанного продукта. Rf=0,50 (4/1 CH2Cl2/метанол).(0,056 г, 0,34 ммоль) и перемешивают в течение 1 ч при комнатной температуре в атмосфере N2. Добавляют к реакционной смеси 4-(трифторметил)пиперидин HCl (0,058 г, 0,31 ммоль) и диизопропилэтиламин (0,059 г, 0,46 ммоль) и перемешивают в течение 16 ч при комнатной температуре в атмосфере N2. Разбавляют реакционную смесь водой и экстрагируют CH2Cl2. Сушат органический слой (Na2SO4), удаляют растворитель под вакуумом. Полученный сырой продукт очищают градиентом от 0 до 10% метанола в CH2Cl2. В результате получают 0,092 г (73%) указанного продукта. Rf=0,50 (9/1 CH2Cl2/метанол). ES Разделяют рацемический препарат 1-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-пиперидин-1-илпирролидин-2-она на энантиомеры путем хиральной ВЭЖХ (колонка К раствору 3-пиперидин-1-илпирролидин-2-он (3,34 г, 19,8 ммоль) в ДМФ (35 мл) добавляют 60% гидрида натрия (1,19 г, 29,8 ммоль) и перемешивают при комнатной температуре в течение 15 мин в атмосфере N2. Охлаждают реакционную смесь до 0C, добавляют 2-бромметил-1,3-дихлор-5-бензилоксибензол (7,56 г, 21,8 ммоль), перемешивают в течение 15 мин при 0C, нагревают до комнатной температуры и перемешивают в течение 3 ч в атмосфере N2. Гасят реакцию водой и экстрагируют диэтиловым эфиром. Сушат органическую фазу (Na2SO4), удаляют растворитель под вакуумом. Полученный в результате сырой продукт очищают на оксиде кремния с использованием 0 до 10% метанола в CH2Cl2. В результате получают 8,01 г (93%) продукта, проводят дополнительную очистку путем растирания в порошок с диэтиловым эфиром. В результате получают 5,78 г (67%) указанного в заголовке продукта. Указанный продукт можно получить из метилового эфира (4,4-дифторпиперидин-1-ил)уксусной кислоты, следуя процедуре, применяемой для получения препарата 19a. В результате получают 3,25 г указанного в заголовке продукта. Rf=0,22 (1:1 этилацетат:гексан). MS (m/z): 469 (M+). Препарат 21a. 1-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-(4 гидроксипиперидин-1-ил)пирролидин-2-он.(10 мл) и воде (5 мл) трифторуксусную кислоту (5 мл), нагревают до температуры кипения с обратным холодильником и перемешивают в течение 4 ч в атмосфере N2. Охлаждают реакционную смесь и подкисляют 5 N NaOH. Разбавляют смесь этилацетатом и промывают водой. Сушат органическую фазу(Na2SO4) и удаляют растворитель под вакуумом. Полученный в результате сырой продукт очищают градиентом от 5 до 10% метанола в CH2Cl2. В результате получают 0,078 г (44%) указанного в заголовке продукта. Rf=0,34 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 598 (M+). Пример 22. 1-[3,5-Дихлор-4'-(4-трифторметилпиперидии-1-карбонил)бифенил-4-илметил]-3-(4 фторпиперидин-1-ил)пирролидин-2-он.N2. Гасят реакцию насыщенным NaHCO3, разбавляют этилацетатом и промывают водой. Сушат органическую фазу (Na2SO4), удаляют растворитель под вакуумом, в результате получают неочищенный продукт, который очищают градиентом 0-10% метанола в CH2Cl2, в результате чего получают 0,019 г (85%) указанного в заголовке продукта. Rf=0,56 (9/1 CH2Cl2/метанол). MS (электроспрей) (m/z): 600 (M+). Пример 23. 1-(3,5-Дихлор-[1,1';4',1]терфенил-4-илметил)-3-(4,4-дифторпиперидин-1-ил)пирролидин-2-он. Пропускают N2 через смесь 3,5-дихлор-4-[3-(4,4-дифторпиперидин-1-ил)-2-оксопирролидин-1 илметил]фенилового эфира трифторметансульфоновой кислоты (0,097 г, 0,19 ммоль), 4-бифенилбороновой кислоты (0,045 г, 0,23 ммоль) в ТГФ (5 мл) и 2 М карбоната натрия (0,29 мл). Добавляют к реакционной смеси Pd(PPh3)4 (0,011 г, 0,01 ммоль) и нагревают до 80C в течение 1 ч в атмосфере N2. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой. Сушат органическую фазу Na2SO4 и удаляют растворитель под вакуумом. Полученный в результате сырой продукт очищают на оксиде кремния с использованием 100% этилацетата. В результате получают 0,098 г (100%) указанного в заголовке продукта. Rf=0,44 (100% этилацетат). MS (m/z): 515 (M+). Пример 24. 1-[3,5-Дихлор-4'-(метиловый эфир 4-карбоновой кислоты)бифенил-4-илметил]-3-(4,4 дифторпиперидин-1-ил)пирролидин-2-он. Пропускают N2 через смесь 3,5-дихлор-4-[3-(4,4-дифторпиперидин-1-ил)-2-оксопирролидин-1 илметил]фенилового эфира трифторметансульфоновой кислоты (1,13 г, 2,21 ммоль), 4-метоксикарбонил фенилбороновой кислоты (0,48 г, 2,67 ммоль) в ТГФ (35 мл) и 2 М карбоната натрия (3,32 мл). Добавляют к реакционной смеси Pd(PPh3)4 (0,125 г, 0,108 ммоль) и нагревают до 80C в течение 1 ч в атмосфереN2. Охлаждают реакционную смесь, разбавляют этилацетатом и промывают водой. Сушат органический слой Na2SO4 и удаляют растворитель под вакуумом. Полученный в результате сырой продукт очищают на диоксиде кремния с использованием градиента от 20 до 100% этилацетата в гексанах. В результате получают 1,06 г (97%) указанного в заголовке продукта. Rf=0,34 (100% этилацетат). MS (m/z): 497(M+). Пример 25. 1-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-3-(4,4 дифторпиперидин-1-ил)пирролидин-2-он. К раствору 1-[3,5-дихлор-4'-(4-карбоновая кислота)бифенил-4-илметил]-3-(4,4-дифторпиперидин-1 ил)лирролидин-2-она (0,11 г, 0,22 ммоль) в CH2Cl2 (7 мл) добавляют 1,1'-карбонилдиимидазол (0,073 г,0,45 ммоль) и перемешивают в течение 2 ч при комнатной температуре в атмосфере N2. Затем добавляют к реакционной смеси 4-(трифторметил)пиперидин HCl (0,071 г, 0,68 ммоль) и диизопропилэтиламин(0,085 г, 0,66 ммоль) и перемешивают в течение 6 ч при комнатной температуре в атмосфере N2. Разбавляют реакционную смесь этилацетатом и промывают водой. Сушат органический слой Na2SO4 и удаляют растворитель под вакуумом. Полученный в результате сырой продукт очищают на диоксиде кремния с использованием 100% этилацетата, а затем путем ВЭЖХ. В результате получают 0,051 г (38%) указанного в заголовке продукта. Rf=0,35 (100% этилацетат). MS (электроспрей) (m/z): 618 (M+). Пример 26. 3-(4-Бромциклогексил)-1-(3,5-дихлор-4'-фторбифенил-4-илметил)пирролидин-2-он.(0,45 г, 1,0 ммоль) в ДХЭ (20 мл) добавляют трехбромистый бор при -20C в течение 2 ч в атмосфере азота. Медленно нагревают реакционную смесь до комнатной температуры и перемешивают в течение 12 ч. Гасят реакционную смесь метанолом и концентрируют. Очищают сырой продукт на колонке с силикагелем, используя градиент от 25 до 50% этилацетата в гексанах. В результате получают 0,096 г указанного в заголовке продукта. MS (m/z): 499 (M+). В следующем разделе описан ферментативный и функциональный анализ, применяемый для оценки соединений, предлагаемых согласно настоящему изобретению. Ферментативный анализ 11-HSD типа 1. Активность 11-HSD человека типа 1 измеряли, оценивая выработку НАДФН методом флуоресцентного анализа. Твердые соединения растворяли в ДМСО до концентрации 10 мМ. При помощи автоматизированной системы Tecan Genesis 200 двадцать микролитров каждого раствора затем переносят в столбец 96-луночного полипропиленового планшета марки Nunc, в котором производят дальнейшее разбавление в 50 раз с последующим двукратным титрованием, десять раз в поперечном направлении планшета, с добавлением дополнительного количества ДМСО. Затем планшеты переносят в системуTecan Freedom 200 с 96-луночной головкой Tecan Temo и планшетным анализатором Ultra 384. Реагенты помещают в 96-луночные полипропиленовые планшеты Nunc и индивидуально распределяют по черным 96-луночным планшетам High Efficiency от Molecular Devices (емкость 40 микролитров на лунку(мкл/лунка: 9 мкл/лунка субстрата (2,22 мМ НАДФ, 55,5 мкМ кортизола, 10 мМ Трис, 0,25% Prionex,0,1% Тритона X100), 3 мкл/лунка воды в лунки, содержащие соединение, или 3 мкл в лунки с контролями и стандартами, 6 мкл/лунка рекомбинантного фермента 11-HSD человека первого типа, 2 мкл/лунка раствора соединения. Для окончательного расчета процентного ингибирования добавляли ряд лунок,которые представляли собой минимум и максимум определения: один набор содержал субстрат с 667 мкМ карбеноксолона (фон), а другой набор содержал субстрат и фермент, но не содержал тестируемого соединения (максимальный сигнал). Затем планшеты на 15 с помещали в шейкер механической рукой Tecan, а затем закрывали и помещали в накопитель для инкубирования в течение 3 ч при комнатной температуре. По завершении инкубации механическая рука извлекала каждый планшет по отдельности из накопителя и помещала их в положение, в котором производили добавление 5 мкл/лунка раствора карбеноксолона с концентрацией 250 мкМ для прекращения ферментной реакции. Затем планшеты встряхивали еще в течение 15 с, а затем помещали в анализатор планшетов Ultra 384 (355EX/460EM),при помощи которого определяли флуоресценцию НАДФН. Соединения, предлагаемые согласно настоящему изобретению, можно исследовать на селективность по отношению к 11-HSD2 при помощи теста, аналогичного описанному для 11-HSD1, но в котором используют фермент 11-HSD2. Испытание с использованием фермента 11-HSD2 можно осуществить методами, рассмотренными в настоящем описании, или методами, известными в данной области техники. Исследование на клетках гладкой мускулатуры аорты человека. Вначале клетки гладкой мускулатуры аорты человека (AoSMC) культивируют в питательной среде,содержащей 5% FBS, выращивая среду до 6 пассажей, а затем осаждают путем центрифугирования и повторно суспендируют при плотности 9104 клеток/мл в среде для количественного определения, содержащей 0,5% FBS и 12 нг/мл hTNF для стимулирования экспрессии 11-HSD1. Клетки высевают на 96-луночные аналитические планшеты для выращивания тканевой культуры с концентрацией 100 мкл/лунка (9103 клеток/лунка) и инкубируют в течение 48 ч при 37C, 5% CO2. После индуцирования клетки инкубируют в течение 4 ч при 37C, 5% CO2 в среде для анализа, содержащей тестируемые соединения, затем добавляют 10 мкМ кортизона, растворенного в среде для анализа, в концентрации 10 мкл/лунка, и инкубируют в течение 16 ч при 37C, 5% CO2. Среду из каждой лунки переносят на планшет для последующего анализа кортизола методом конкурентного флуоресцентного иммуноанализа с временным резонансным разрешением. В растворе конъюгат аллофикоцианина (APC)-кортизол и свободный кортизол конкурируют за связывание комплекса мышиное антитело к кортизону/европий(Eu)-антимышиный IgG. Более высокие уровни свободного кортизола приводят к снижению переноса энергии от европия-IgG к комплексу APC-кортизол, что снижает флуоресценцию APC. Интенсивности
МПК / Метки
МПК: A61P 3/10, A61K 31/4015, C07D 207/26, A61K 31/4025, C07D 401/12
Метки: 11-бета-гидроксистероид, дегидрогеназы, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-15516-ingibitory-11-beta-gidroksisteroid-degidrogenazy-1.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы 11-бета-гидроксистероид дегидрогеназы 1</a>
Предыдущий патент: Непрерывный способ превращения природного газа в жидкие углеводороды
Следующий патент: Производные пиперазинилпиперидина в качестве антагонистов хемокинового рецептора
Случайный патент: Конъюгаты aβ иммуногенных пептидных носителей и способы их получения