Соединения акриламида в качестве лигандов h3-рецептора гистамина
Номер патента: 25136
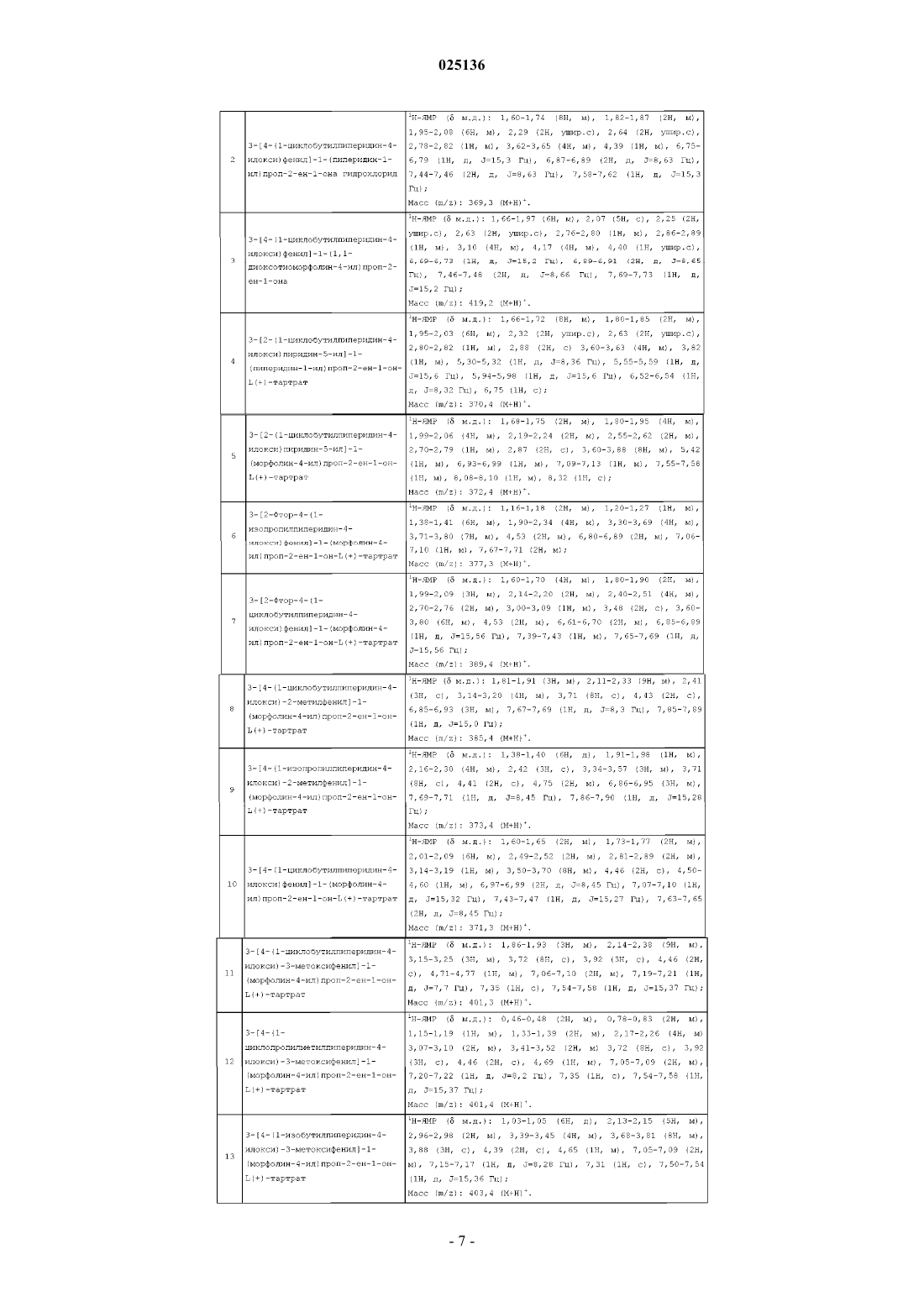
Опубликовано: 30.11.2016
Авторы: Нироджи Рамакришна, Схинде Анил Карбхари, Дварампуди Ади Редди, Джасти Венкатесварлу
Формула / Реферат
1. Соединение общей формулы (I)
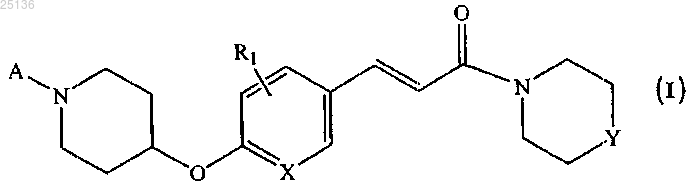
где R1 независимо выбран из водорода, галогена, C1-8алкила или C1-8алкокси;
A представляет собой C1-8алкил, C3-8циклоалкил или C3-8циклоалкилС1-8алкил;
X представляет собой CH или N;
Y представляет собой CH2, O или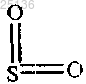 ;
;
или его фармацевтически приемлемые соли.
2. Соединение по п.1, которое выбрано из группы, состоящей из
3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она фурмарата;
3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(пиперидин-1-ил)проп-2-ен-1-она гидрохлорида;
3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(1,1-диоксотиоморфолин-4-ил)проп-2-ен-1-она гидрохлорида;
3-[2-(1-циклобутилпиперидин-4-илокси)пиридин-5-ил]-1-(пиперидин-1-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[2-(1-циклобутилпиперидин-4-илокси)пиридин-5-ил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[2-фтор-4-(1-изопропилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[2-фтор-4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-циклобутилпиперидин-4-илокси)-2-метилфенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-изопропилпиперидин-4-илокси)-2-метилфенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
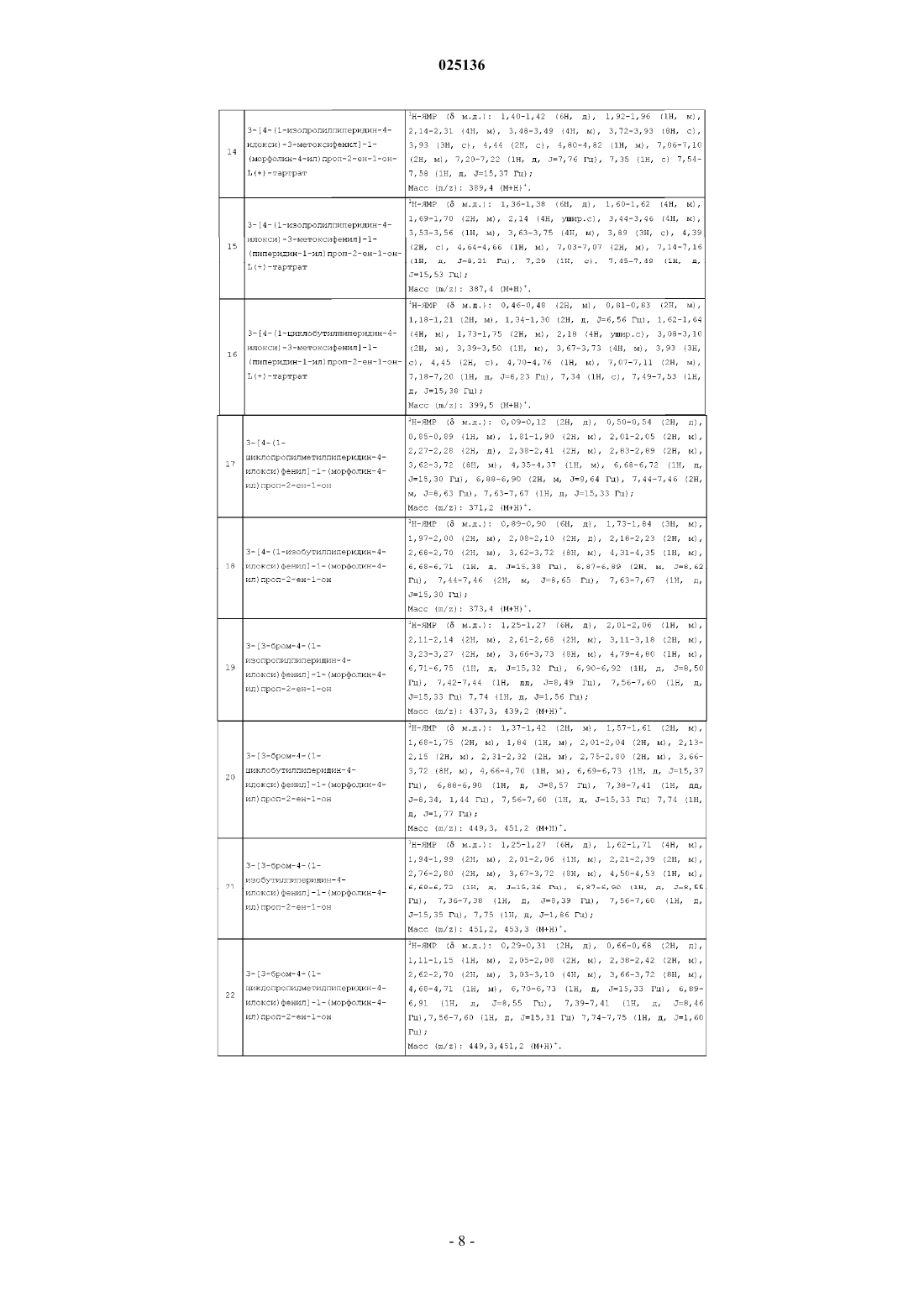
3-[4-(1-циклобутилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-циклопропилметилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-изобутилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-изопропилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-изопропилпиперидин-4-илокси)-3-метоксифенил]-1-(пиперидин-1-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-циклобутилпиперидин-4-илокси)-3-метоксифенил]-1-(пиперидин-1-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[4-(1-циклопропилметилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-изобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[3-бром-4-(1-изопропилпиперидин-4-илокси)фенил]- 1-(морфолин-4-ил)проп-2-ен-1-она;
3-[3-бром-4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[3-бром-4-(1-изобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[3-бром-4-(1-циклопропилметилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[6-(1-циклопропилметилпиперидин-4-илокси)пиридин-3-ил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[6-(1-изобутилпиперидин-4-илокси)пиридин-3-ил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата;
3-[2-хлор-4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[2-хлор-4-(1-изопропилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[2-хлор-4-(1-циклопропилметилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[2-хлор-4-(1-изобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(пиперидин-1-ил)проп-2-ен-1-она;
3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(1,1-диоксотиоморфолин-4-ил)проп-2-ен-1-она;
3-[2-(1-циклобутилпиперидин-4-илокси)пиридин-5-ил]-1-(пиперидин-1-ил)проп-2-ен-1-она;
3-[2-(1-циклобутилпиперидин-4-илокси)пиридин-5-ил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[2-фтор-4-(1-изопропилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[2-фтор-4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-циклобутилпиперидин-4-илокси)-2-метилфенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-изопропилпиперидин-4-илокси)-2-метилфенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-циклобутилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-циклопропилметилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-изобутилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-изопропилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[4-(1-изопропилпиперидин-4-илокси)-3-метоксифенил]-1-(пиперидин-1-ил)проп-2-ен-1-она;
3-[4-(1-циклобутилпиперидин-4-илокси)-3-метоксифенил]-1-(пиперидин-1-ил)проп-2-ен-1-она;
3-[6-(1-циклопропилметилпиперидин-4-илокси)пиридин-3-ил]-1-(морфолин-4-ил)проп-2-ен-1-она;
3-[6-(1-изобутилпиперидин-4-илокси)пиридин-3-ил]-1-(морфолин-4-ил)проп-2-ен-1-она
или их фармацевтически приемлемых солей.
3. Способ получения соединения формулы (I) по п.1, включающий
(а) восстановительное аминирование соединения формулы (1) соединением формулы (2)
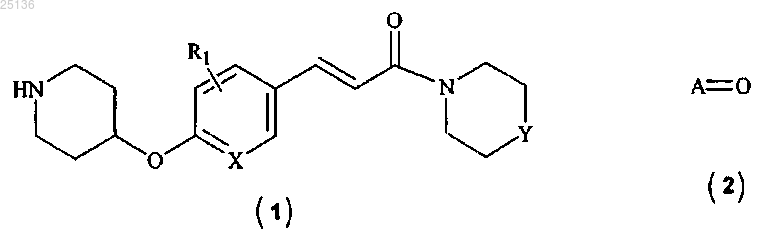
в присутствии подходящего растворителя и восстановителя с получением соединения формулы (I), где все заместители являются такими, как определено в п.1,
(b) необязательно преобразование соединения формулы (I) в его фармацевтически приемлемые соли.
4. Фармацевтическая композиция, содержащая соединение по любому из пп.1 и 2 и фармацевтически приемлемые эксципиенты, для лечения нарушений, опосредованных H3-рецептором гистамина.
5. Фармацевтическая композиция по п.4 для лечения клинических состояний, опосредованных H3-рецептором, таких как когнитивные расстройства при шизофрении, нарколепсия, ожирение, синдром дефицита внимания с гиперактивностью, боль или болезнь Альцгеймера.
6. Способ лечения когнитивных расстройств при шизофрении, нарколепсии, ожирении, синдрома дефицита внимания с гиперактивностью, боли или болезни Альцгеймера, включающий введение нуждающемуся в этом пациенту эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп.1 и 2.
7. Применение соединения по любому из пп.1 и 2 для производства лекарственного средства для лечения заболеваний, связанных с H3-рецептором гистамина.
8. Применение соединения по п.7 для лечения клинических состояний, таких как когнитивные расстройства при шизофрении, нарколепсия, ожирение, синдром дефицита внимания с гиперактивностью, боль или болезнь Альцгеймера.
Текст
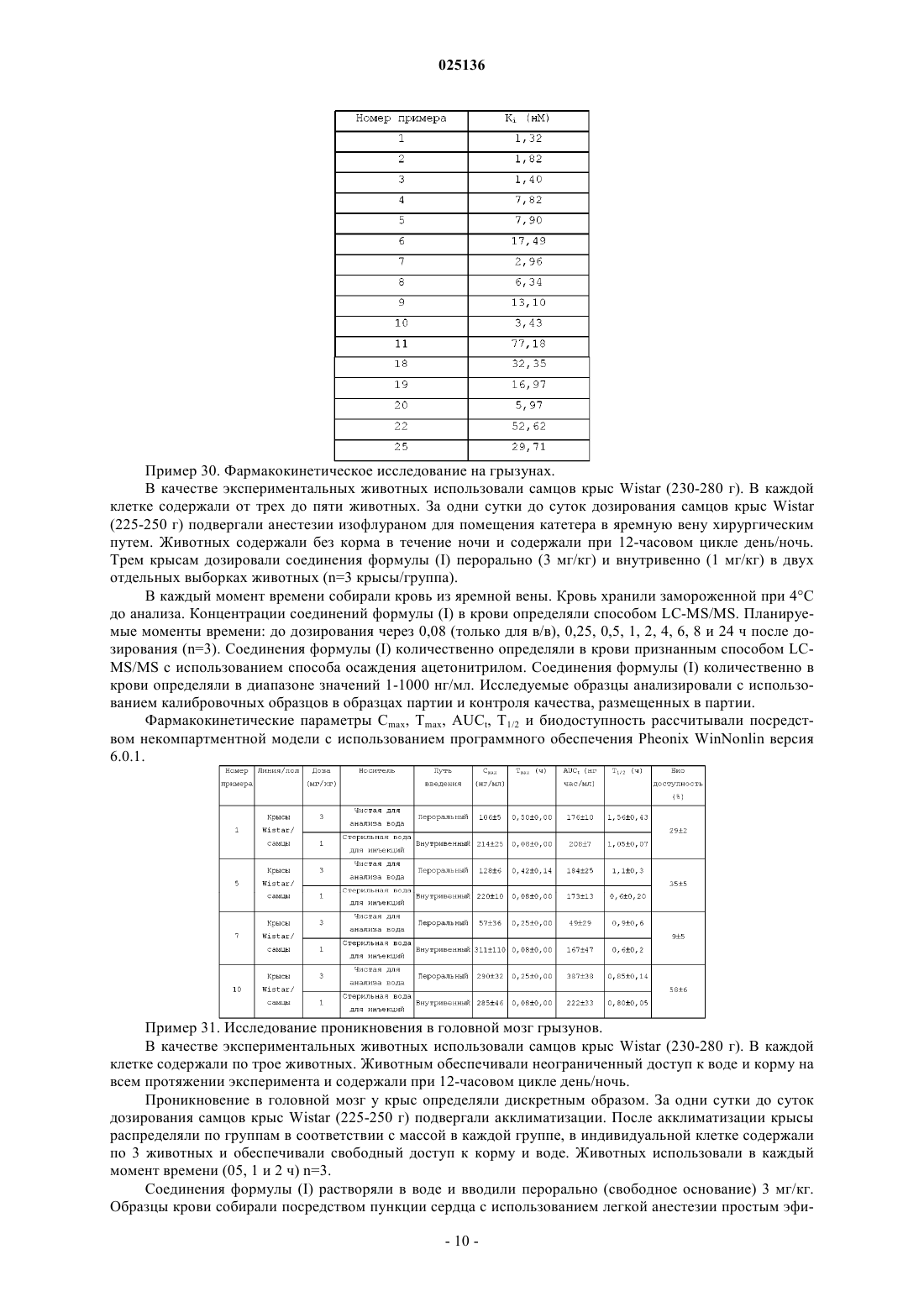
Изобретение относится к новым соединениям акриламида формулы (I) и их фармацевтически приемлемым солям и к способу их получения Соединения формулы (I) являются пригодными для лечения различных нарушений, которые связаны с Н 3-рецепторами гистамина.(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД (IN) Область изобретения Настоящее изобретение относится к новым соединениям акриламида формулы (I) и их фармацевтически приемлемым солям для лечения различных нарушений, которые являются родственными к H3 рецепторам гистаминаH3-рецептор гистамина представляет собой связанный с G-белком рецептор (GPCR) и один из четырех рецепторов семейства гистамина. H3-рецептор гистамина был идентифицирован в 1983 г., и в 1999 г. его клонировали и характеризовали. H3-рецептор гистамина экспрессируется в большом количестве в центральной нервной системе и в меньшем количестве - в периферической нервной системе. Литературные данные позволяют предположить, что лиганды H3-рецептора гистамина можно использовать для лечения когнитивных нарушений (British Journal of Pharmacology, 2008, 154(6), 11661181), деменции (Drug News Perspective, 2010, 23(2), 99-103), синдрома дефицита внимания с гиперактивностью, ожирения (Indian Journal of Pharmacology, 2001, 33, 17-28), шизофрении (Biochemical Pharmacology, 2007, 73(8), 1215-1224) и боли (Journal of Pharmacology and Experimental Therapeutics, 2011, 336(1), 30-37). В патентных публикациях WO 2007/137955, US 2009/0170869, US 2010/0029608, US 2010/0048580,WO 2009/100120, WO 2009/121812 и WO 2009/135842 описана серия соединений в качестве лигандов H3 рецепторов гистамина. Несмотря на то что были описаны некоторые лиганды H3-рецептора гистамина,до настоящего времени на рынок не было выведено соединение из этой области исследования, и до сих пор существует потребность и область для исследования новых лекарственных средств с новыми химическими структурами для лечения нарушений, связанных с H3-рецепторами гистамина. Сущность изобретения Настоящее изобретение относится к новым акриламидным лигандам H3-рецептора гистамина формулы (I) где в каждом случае R1 независимо выбран из водорода, галогена, алкила или алкокси;; или их фармацевтически приемлемым солям. Настоящее изобретение относится к применению терапевтически эффективного количества соединения формулы (I), к производству лекарственного средства для лечения различных нарушений, которые связаны с H3-рецепторами гистамина. В частности, соединения по настоящему изобретению являются пригодными для лечения различных нарушений, таких как когнитивные расстройства при шизофрении, нарколепсия, ожирение, синдром дефицита внимания с гиперактивностью, боль или болезнь Альцгеймера. В другом аспекте изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения формулы (I) или его/их фармацевтически приемлемых солей в смеси с фармацевтически приемлемым эксципиентом. Кроме того, в другом аспекте изобретение относится к способу получения соединения формулы (I) и его фармацевтически приемлемых солей. Характерные соединения по настоящему изобретению включают соединения, описанные ниже, и их фармацевтически приемлемые соли. Не следует рассматривать, что настоящее изобретение является ограниченным ими. Подробное описание изобретения Если не указано иное, следующие ниже термины, используемые в описании и формуле изобретения, имеют приведенные ниже значения. Термин "галоген" означает фтор, хлор, бром или йод. Термин "алкил" означает неразветвленную цепь или разветвленный углеводородный радикал, состоящий только из атомов углерода и водорода, содержащий ненасыщенную связь, содержащий от одного до восьми атомов углерода, и который присоединен к оставшейся части молекулы одинарной связью. Иллюстративные "алкильные" группы включают метил, этил, н-пропил, изопропил и т. п. Термин "алкокси" означает алкильную группу, присоединенную через кислородный мостик к оставшейся части молекулы. Иллюстративные "алкокси" группы включают метокси, этокси, пропилокси,изопропилокси и т. п. Термин "циклоалкил" означает неароматическое моноциклическое кольцо от 3 до 8 атомов углерода. Иллюстративные "циклоалкильные" группы означают циклопропил, циклобутил, циклопентил и т. п. Термин "циклоалкилалкил" означает неароматическое моноциклическое кольцо от 3 до 8 атомов углерода, присоединенных к алкильной группе. Иллюстративные "циклоалкилалкильные" группы включают циклопропилметил, циклобутилметил, циклопентилметил и т. п. Термин "фармацевтически приемлемые соли" означает, что вещество или композиция должна быть химически и/или токсикологически совместимой с другими ингредиентами, содержащимися в составе,которым будут лечить млекопитающее. Термин "терапевтически эффективное количество" определяют как количество соединения по настоящему изобретению, которое (i) лечит конкретное заболевание, состояние или нарушение, (ii) устраняет один или несколько симптомов конкретного заболевания, состояния или нарушения, (iii) отсрочивает начало появления одного или нескольких симптомов конкретного заболевания, состояния или нарушения, описываемого в настоящем документе. Коммерческие реагенты использовали без дополнительной очистки. Комнатная температура относится к 25-40C. Если не указано иное, все измерения масс-спектров проводили с использованием условий ESI. Спектры 1H-ЯМР регистрировали при 400 МГц на устройстве Bruker. В качестве растворителя использовали дейтированный хлороформ, метанол или диметилсульфоксид. В качестве внутреннего эталонного стандарта использовали TMS. Значения химического сдвига выражают в значениях миллионных долей . Следующие ниже сокращенные обозначения используют для мультиплетности для сигналов ЯМР: s- синглет, bs - уширенный синглет, d - дублет, t - триплет, q - квартет, qui - квинтет, h - гептет, dd - двойной дублет, dt - двойной триплет, tt - тройные триплеты, m - мультиплет. Хроматография относится к колоночной хроматографии, проводимой с использованием силикагеля 100-200 меш и проводимой в условиях азота под давлением (флэш-хроматография). Фармацевтические композиции. Для использования соединений формулы (I) в терапии, как правило, их необходимо формулировать в фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Фармацевтические композиции по настоящему изобретению можно формулировать общепринятым способом с использованием одного или нескольких фармацевтически приемлемых эксципиентов. Фармацевтически приемлемый эксципиент представляет собой носитель или разбавитель. Таким образом,активные соединения по изобретению можно формулировать для перорального, интраназального или парентерального (например, внутривенного, внутримышечного или подкожного) введения. Такие фармацевтические композиции и способы их получения хорошо известны в данной области (The Science andPractice of Pharmacy, D.B. Troy, 21st Edition, WilliamsWilkins, 2006). Доза активных соединений может изменяться в зависимости от факторов, таких как путь введения,возраст и масса пациента, природы и тяжести заболевания, подлежащего лечению, и аналогичных факторов. Таким образом, любая ссылка в настоящем документе на фармакологически эффективное количество соединений общей формулы (I) относится к указанным выше факторам. Способы получения. Соединения формулы (I) можно получать по схеме I, как представлено ниже. Схема I Восстановительное аминирование соединения формулы (1) соединением формулы (2) с получением соединения формулы (I). Эту реакцию предпочтительно проводить в растворителе, таком как тетрагидрофуран, толуол, этилацетат, дихлорметан, диметилформамид и т. п. или их смеси и предпочтительно с использованием дихлорметана. На реакцию можно оказывать влияние в присутствии восстановителя,такого как гидрид диизобутилалюминия, триацетоксиборогидрид натрия, диметилсульфидборана, бис(2 метоксиэтокси)алюмогидрид натрия, гидросульфит натрия, борогидрид натрия, цианоборогидрид натрия и дитионит натрия и предпочтительно с использованием триацетоксиборогидрида натрия. Реакцию проводят при комнатной температуре. Продолжительность реакции может находиться в диапазоне от 4 до 8 ч, предпочтительно в периоде от 5 до 7 ч. Соединения формулы (1) можно получать с использованием получений 1 и 2 или можно получать общепринятыми способами или посредством модификаций известным способом. Соединения формулы (2) могут являться коммерчески доступными или их можно получать общепринятыми способами или посредством модификаций известным способом. Фармацевтически приемлемые соли, являющиеся частью по настоящему изобретению, можно получать обработкой соединения формулы (I) 1-6 эквивалентами кислот, таких как соляная, бромистоводородная, серная, азотная, фосфорная кислота, янтарная, малеиновая, уксусная, фумаровая, лимонная,яблочная, винная, бензойная, паратолуоловая, паратолуолсульфоновая, метансульфоновая или нафталинсульфоновая кислота. Наиболее предпочтительные соли соединений формулы (I) представляют собой фумарат, L(+)-тартрат, гидрохлорид, оксалат и сульфат. Примеры Новые соединения по настоящему изобретению получали следующими ниже экспериментальными способами с использованием соответствующих веществ и подходящих условий. Получение 1. Получение 3-[4-(пиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она. Стадия (i). Получение трет-бутил-4-(4-формилфенокси)пиперидин-1-карбоксилата. Раствор 4-гидроксибензальдегида (20,1 г, 0,164 моль), карбоната калия (67,9 г, 0,492 моль) и третбутил-4-(толуол-4-сульфонилокси)пиперидин-1-карбоксилата (70 г, 0,197 моль) в ацетонитриле (1000 мл) перемешивали в течение 18 ч при 80C. За прохождением реакции наблюдали посредством тонкослойной хроматографии. После завершения реакции реакционную массу охлаждали до комнатной температуры и гасили в охлажденной воде (1000 мл). Соединение экстрагировали дихлорметаном (3500 мл). Получаемый слой дихлорметана промывали 10%-ным щелочным раствором (100 мл), водой (100 мл) и насыщенным солевым раствором (100 мл). Сушили органическую фазу над сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (50,3 г). Выход продукта 100%. 1H-ЯМР ( м.д.): 1,48 (9H, с), 1,76-1,83 (2H, м), 1,96-2,04 (2H, м), 3,36-3,41 (2H, м), 3,68-3,73 (2H, м),4,45-4,60 (1H, м), 6,96-7,02 (2H, м), 7,78-7,85 (2H, м), 9,89 (1H, с). Масс (m/z): 306,4 (М+Н)+. Стадия (ii). Получение 3-[4-(1-трет-бутилоксикарбонилпиперидин-4-илокси)фенил]проп-2-ен-1 овой кислоты. Раствор трет-бутил-4-(4-формилфенокси)пиперидин-1-карбоксилата (50,2 г, 0,164 моль, получаемого на указанной выше стадии), малоновой кислоты (50,6 г, 0,486 моль) и пиперидина (12,5 мл) в пиридине (250 мл) перемешивали в течение 8 ч при 110C в атмосфере азота. За прохождением реакции наблюдали посредством тонкослойной хроматографии. После завершения реакции реакционную массу концентрировали и получаемую взвесь растирали с н-гексаном (200 мл) и перемешивали в течение 30 мин. Получаемое таким образом твердое вещество промывали н-гексаномH-ЯМР ( м.д.): 1,47 (9H, с), 1,76-1,80 (2H, м), 1,90-1,96 (2H, м), 3,35-3,40 (2H, м), 3,67-3,72 (2H, м),4,53-4,60 (1H, м), 6,30-6,34 (1H, д, J=15,32 Гц), 6,89-6,95 (2H, д, J=8,64); 7,47-7,53 (2H, д, J=8,64 Гц), 7,717,75 (1H, д, J=15,33 Гц). Масс (m/z): 348,2 (М+Н)+. Стадия (iii). Получение 3-[4-(1-трет-бутилоксикарбонилпиперидин-4-илокси)фенил]-1-(морфолин 4-ил)проп-2-ен-1-она. К перемешиваемому раствору 3-[4-(1-трет-бутилоксикарбонилпиперидин-4-илокси)фенил]проп-2 ен-1-овой кислоты (38 г, 0,109 моль, получаемой на указанной выше стадии) и триэтиламина (38,4 мл,0,273 моль) в дихлорметане (500 мл) добавляли этилхлорформиат (13,6 мл, 0,142 моль) при 0C. Реакционную массу дополнительно перемешивали в течение 2 ч при 0-5C. К указанной выше реакционной массе добавляли морфолин (19,2 мл, 0,219 моль) при 0-5C и перемешивали получаемую смесь в течение 2 ч. За прохождением реакции наблюдали посредством тонкослойной хроматографии. После завершения реакции реакционную массу гасили добавлением воды (100 мл). Разделяли слои, и промывали органический слой насыщенным солевым раствором (100 мл) и сушили над сульфатом натрия. Органическую фазу концентрировали в вакууме с получением неочищенного остатка, который дополнительно очищалиH-ЯМР ( м.д.): 1,47 (9H, с), 1,76-1,81 (2H, м), 1,90-1,95 (2H, м), 3,32-3,39 (2H, м), 3,62-3,79 (10H,м), 4,49-4,55 (1H, м), 6,69-6,73 (1H, д, J=15,92 Гц), 6,88-6,94 (2H, д, J=8,64 Гц); 7,45-7,49 (2H, д, J=8,64 Гц), 7,64-7,68 (1H, д, J=15,92). Масс (m/z): 417,3 (М+Н)+. Стадия (iv). Получение 3-[4-(пиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она. Раствор 3-[4-(1-трет-бутилоксикарбонилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен 1-она (29,8 г, 0,071 моль) в дихлорметане (400 мл) обрабатывали трифторуксусной кислотой (55,6 мл,0,726 моль) при комнатной температуре. Реакционную массу перемешивали в течение 6 ч при комнатной температуре. За прохождением реакции наблюдали посредством тонкослойной хроматографии. После завершения реакции реакционную массу переливали в охлажденную воду (500 мл) и ощелачивали 40%ным щелочным раствором (pH9). Разделяли слои, экстрагировали водный слой дихлорметаном (2200 мл), и объединенную органическую фазу промывали водой (150 мл), насыщенным солевым раствором(150 мл) и сушили над сульфатом натрия. Органическую фазу концентрировали на роторно-вакуумном испарителе с получением указанного в заголовке соединения (21,2 г). Выход продукта: 90%. 1H-ЯМР ( м.д.): 1,63-1,72 (2H, м), 2,00-2,04 (2H, м), 2,71-2,77 (2H, м), 3,12-3,18 (2H, м), 3,73 (8H, м),4,39-4,44 (1H, м), 6,69-6,73 (1H, д, J=15,32 Гц), 6,89-6,91 (2H, д, J=8,64 Гц); 7,45-7,47 (2H, д, J=8,64 Гц),7,64-7,68 (1H, д, J=15,32 Гц). Масс (m/z): 317,3 (М+Н)+. Получение 2. Получение 1-(морфолин-4-ил)-3-[2-(пиперидин-4-илокси)пиридин-5-ил]проп-2-ен-1 она. Стадия (i). Получение трет-бутил-4-(5-бромпиридин-2-илокси)пиперидин-1-карбоксилата. К перемешиваемому раствору гидрида натрия (4,0 г, 60%-ная дисперсия в минеральном масле, 0,1 моль) в тетрагидрофуране (50 мл) добавляли трет-бутил-4-гидроксипиперидин-1-карбоксилат (15 г, 0,075 моль) в тетрагидрофуране (50 мл) при 10C в атмосфере азота. Реакционную массу перемешивали в течение 1 ч при комнатной температуре. Раствор 2,5-дибромпиридина (11,8 г, 0,05 моль) в тетрагидрофуране (50 мл) капельно добавляли к указанной выше реакционной массе при комнатной температуре и перемешивали в течение 4 ч при 65C. За прохождением реакции наблюдали посредством тонкослойной хроматографии. После завершения реакции реакционную массу гасили в охлажденной воде (600 мл) и экстрагировали соединение этилацетатом (3200 мл). Получаемый органический слой промывали водой,сушили над сульфатом натрия и концентрировали в вакууме. Получаемый таким образом остаток очищали флэш-хроматографией с использованием этилацетата:н-гексана в отношении 1:9 с получением указанного в заголовке соединения (15 г). Выход продукта: 84%. 1(25,6 мг, 0,084 ммоль) и карбоната калия (0,62 г, 4,4 9 ммоль) в DMF (15 мл) перемешивали в течение 3 ч при 140C. За протеканием реакции наблюдали посредством тонкослойной хроматографии. После завершения реакции реакционную массу гасили в охлажденной воде (30 мл) и экстрагировали продукт этилацетатом (315 мл). Получаемый органический слой промывали водой, сушили над сульфатом натрия и концентрировали в вакууме. Получаемый таким образом остаток очищали флэш-хроматографией с использованием этилацетата:н-гексана в отношении 1:1 с получением указанного в заголовке соединения (1,07 г). Выход продукта: 80%. 1(1,3 мл, 0,016 моль) при комнатной температуре. Реакционную массу перемешивали в течение 6 ч при комнатной температуре. За прохождением реакции наблюдали посредством тонкослойной хроматографии. После завершения реакции реакционную массу переливали в охлажденную воду (30 мл) и ощелачивали 40%-ным щелочным раствором (pH9). Разделяли слои, и водный слой дополнительно экстрагировали дихлорметаном (220 мл). Объединенную органическую фазу промывали водой (30 мл), насыщенным солевым раствором (30 мл) и сушили над сульфатом натрия. Органическую фаза концентрировали на роторно-вакуумном испарителе с получением указанного в заголовке соединения (0,48 г). Выход продукта: 90%. 1(1H, м), 6,33-6,37 (1H, д, J=15,96 Гц), 6,72-6,76 (2H, м), 7,62-7,67 (1H, м), 7,76-7,79 (1H, м), 8,24-8,25 (1H,м). Масс (m/z): 318,3 (М+Н)+. Пример 1. Получение соли фумаровой кислоты 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1(морфолин-4-ил)проп-2-ен-1-она. Стадия (i). Получение 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен 1-она. Триацетоксиборогидрид натрия (38,6 г, 0,18 моль) добавляли в единой партии к хорошо перемешиваемому раствору 3-[4-(пиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она (19,1 г, 0,060 моль, получаемому в получении 1) и циклобутанона (6,8 мл, 0,09 моль) в дихлорэтане (500 мл). Смесь дополнительно перемешивали при комнатной температуре в течение 6 ч. За прохождением реакции наблюдали посредством тонкослойной хроматографии. После завершения реакции реакционную массу гасили в воде (1000 мл) и ощелачивали 40%-ным щелочным раствором (pH9). Разделяли слои, и экстрагировали водный слой дихлорметаном (2200 мл). Объединенный органический слой промывали насыщенным солевым раствором (250 мл), сушили над сульфатом натрия, концентрировали в вакууме, и оставшуюся реакционную массу дополнительно очищали флэш-хроматографией с использованием метанола:триэтиламина:хлороформа в отношении 1,5:0,25:98,25 с получением указанного в заголовке соединения (17,4 г). Выход продукта: 77%. 1(2H, м), 7,64-7,68 (1H, д). Масс (m/z): 371,1 (М+Н)+. Стадия (ii). Получение соли фумаровой кислоты 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1(морфолин-4-ил)проп-2-ен-1-она. К перемешиваемому раствору 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4 ил)проп-2-ен-1-она (23,52 г, 0,063 моль) в метаноле (300 мл) добавляли раствор фумаровой кислоты (7,32 г, 0,063 моль) в 30 мл метанола. Получаемую таким образом прозрачную реакционную массу дополнительно перемешивали в течение 2-3 ч при комнатной температуре. Растворитель выпаривали с получением твердого вещества. Твердое вещество растирали простым диэтиловым эфиром (3100 мл) и сушили при пониженном давлении с получением указанного в заголовке соединения (29,54 г). Выход продукта: 95%. 1(2H, м), 3,14-3,19 (1H, м), 3,50-3,70 (8H, м), 4,50-4,60 (1H, м), 6,56 (2H, с), 6,97-6,99 (2H, д, J=8,45 Гц),7,07-7,10 (1H, д, J=15,32 Гц), 7,43-7,47 (1H, д, J=15,27 Гц), 7,63-7,65 (2H, д, J=8,45 Гц). Масс (m/z): 371,3 (М+Н)+. Примеры 2-28. Соединения примеров 2-28 получали следующими ниже способами, как описано в примере 1, с некоторыми незначительными изменениями Биологические анализы. Пример 29. Анализы связывания и функциональные анализы для H3-рецептора гистамина человека или крысы. Соединения можно оценивать следующими ниже способами. Материалы и способы. Источник рецептора: лобная кора головного мозга крысы или рекомбинантная кДНК человека, экспрессируемая в клетках CHO. Радиоактивный лиганд: [3H]-Rметилгистамин. Конечная концентрация лиганда - [3,0 нМ]. Неспецифическая детерминанта: Rметилгистамин (100 мкМ). Эталонное соединение: Rметилгистамин. Положительный контроль: Rметилгистамин. Условия инкубации. Тестируемые соединения или стандарт в увеличивающихся концентрациях инкубировали с рецепторами мембраны и радиоактивным лигандом в 5 мМ MgCl2 и 50 мМ TRIS-HCl (pH 7,4) в течение 60 мин при комнатной температуре. Реакцию останавливали быстрым фильтрованием в вакууме через фильтры из стекловолокна. Определяли радиоактивность на фильтрах и сравнивали с контрольными значениями для определения каких-либо взаимодействий тестируемого соединения(ий) с клонированным участком связывания рецептора человека или крысы. Пример 30. Фармакокинетическое исследование на грызунах. В качестве экспериментальных животных использовали самцов крыс Wistar (230-280 г). В каждой клетке содержали от трех до пяти животных. За одни сутки до суток дозирования самцов крыс Wistar(225-250 г) подвергали анестезии изофлураном для помещения катетера в яремную вену хирургическим путем. Животных содержали без корма в течение ночи и содержали при 12-часовом цикле день/ночь. Трем крысам дозировали соединения формулы (I) перорально (3 мг/кг) и внутривенно (1 мг/кг) в двух отдельных выборках животных (n=3 крысы/группа). В каждый момент времени собирали кровь из яремной вены. Кровь хранили замороженной при 4C до анализа. Концентрации соединений формулы (I) в крови определяли способом LC-MS/MS. Планируемые моменты времени: до дозирования через 0,08 (только для в/в), 0,25, 0,5, 1, 2, 4, 6, 8 и 24 ч после дозирования (n=3). Соединения формулы (I) количественно определяли в крови признанным способом LCMS/MS с использованием способа осаждения ацетонитрилом. Соединения формулы (I) количественно в крови определяли в диапазоне значений 1-1000 нг/мл. Исследуемые образцы анализировали с использованием калибровочных образцов в образцах партии и контроля качества, размещенных в партии. Фармакокинетические параметры Cmax, Tmax, AUCt, T1/2 и биодоступность рассчитывали посредством некомпартментной модели с использованием программного обеспечения Pheonix WinNonlin версия 6.0.1. Пример 31. Исследование проникновения в головной мозг грызунов. В качестве экспериментальных животных использовали самцов крыс Wistar (230-280 г). В каждой клетке содержали по трое животных. Животным обеспечивали неограниченный доступ к воде и корму на всем протяжении эксперимента и содержали при 12-часовом цикле день/ночь. Проникновение в головной мозг у крыс определяли дискретным образом. За одни сутки до суток дозирования самцов крыс Wistar (225-250 г) подвергали акклиматизации. После акклиматизации крысы распределяли по группам в соответствии с массой в каждой группе, в индивидуальной клетке содержали по 3 животных и обеспечивали свободный доступ к корму и воде. Животных использовали в каждый момент времени (05, 1 и 2 ч) n=3. Соединения формулы (I) растворяли в воде и вводили перорально (свободное основание) 3 мг/кг. Образцы крови собирали посредством пункции сердца с использованием легкой анестезии простым эфи- 10025136 ром, для сбора ткани головного мозга животных умерщвляли. Образцы головного мозга гомогенизировали и хранили замороженными при -20C до анализа. Концентрации соединений формулы (I) в крови и головного мозга определяли способом LC-MS/MS. Соединения формулы (I) количественно определяли в крови и гомогенате головного мозга известным способом LC-MS/MS с использованием способа осаждения ацетонитрилом. Соединения формулы(I) количественно определяли в диапазоне значений 1-1000 нг/мл в крови и гомогенате головного мозга. Исследуемые образцы анализировали с использованием калибровочных образцов в образцах партии и контроля качества, размещенных в партии. Рассчитывали величины отношений головного мозга к крови Пример 32. Модель выполнения задачи распознавания объекта. Усиливающие когнитивную способность свойства соединений по настоящему изобретению определяли с использованием модели когнитивной функции животных: модель выполнения задачи распознавания объекта. В качестве экспериментальных животных использовали самцов крыс Wister (230-280 г). В каждой клетке содержали по четыре животных. Животных содержали при 20%-ной депривации корма за одни сутки и при свободном доступе к воде на всем протяжении эксперимента и содержали при 12-часовом цикле день/ночь. Также крыс приучали к индивидуальным пространствам в течение 1 ч при отсутствии каких-либо объектов. Одна группа из 12 крыс получала носитель (1 мл/кг) перорально, и другая выборка животных получала соединение формулы (I) перорально или и/п за один час до ознакомления (T1) и испытания выбора(T2). Эксперимент проводили в "открытом поле" 505050 см, вытопленном из акрила. В фазе ознакомления (T1) крысы индивидуально помещали в "открытое поле" в течение 3 мин, в котором в двух смежных углах на расстоянии 10 см от стенок помещали два идентичных объекта (пластиковые бутылки, 12,5 см высотой 5,5 см диаметром), покрытые только желтой маскировочной лентой (a1 и a2). Через 24 ч после (T1) для теста испытания долговременной памяти тех же самых крыс помещали в туже самую арену,как их помещали в фазе T1. В фазе выбора (T2) крысам предоставляли возможность исследовать открытое поле в течение 3 мин при наличии одного знакомого объекта (a3) и одного нового объекта (b) (стеклянной бутылки янтарного цвета 12 см в высоту и 5 см в диаметре). Знакомые объекты были представлены в аналогичных текстурах, цветах и размерах. В течение испытания T1 и T2 отдельно секундомером регистрировали исследование каждого объекта (обозначаемого как обнюхивание, лизание, жевание или движение выбросами при направлении носа к объекту на расстоянии менее чем 1 см). Сидение на объекте не рассматривали как исследовательскую деятельность, тем не менее, это редко наблюдали.T1 представляет собой общее время, потраченное на знакомые объекты (a1+a2).T2 представляет собой общее время, потраченное на исследование знакомого объекта и нового объекта (a3+b). Тест распознавания объекта проводили, как описано Ennaceur A., Delacour J., 1988, A new one-trialtest for neurobiological studies of memory in rats. Behavioural data, Behav. Brain Res., 31, 47-59. Для некоторых репрезентативных соединений демонстрировали положительные эффекты, указывающие, таким образом, на повышенное распознавание нового объекта; увеличенное время исследования для нового объекта и более высокий индекс различения. Пример 33. Водный лабиринт. Устройство водного лабиринта состояло из круглого бассейна (диаметром 1,8 м, высотой 0,6 м),сконструированного из черного перспекса (TSE systems, Germany), наполненного водой (242C) и расположенного под широкоугольной видеокамерой для отслеживания животного. Платформу из перспекса 10 см 2, лежащую на 1 см ниже поверхности вода, помещали в центр одного из четырех воображаемых квадрантов, которые оставались одинаковыми для всех крыс. Черный перспекс, используемый в конструкции лабиринта и платформы, не обеспечивал ориентиров, относящихся к лабиринту, для направления реакции избегания. В отличие от этого помещение для обучения обеспечивало несколько существенных не относящихся к лабиринту визуальных ориентиров для облегчения формирования пространственной карты, необходимой для научению избегания. Применяли автоматическую систему отслеживания[Videomot 2 (5,51), TSE systems, Germany]. Эта программа анализирует видеоизображения, получаемые через цифровую камеру и платы получения изображения, которые определяли длину пути, скорость плавания и число вхождений и продолжительность времени плавания, затраченного в каждом квадранте водного лабиринта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) где R1 независимо выбран из водорода, галогена, C1-8 алкила или C1-8 алкокси;Y представляет собой CH2, O или или его фармацевтически приемлемые соли. 2. Соединение по п.1, которое выбрано из группы, состоящей из 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она фурмарата; 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(пиперидин-1-ил)проп-2-ен-1-она гидрохлорида; 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(1,1-диоксотиоморфолин-4-ил)проп-2-ен-1-она гидрохлорида; 3-[2-(1-циклобутилпиперидин-4-илокси)пиридин-5-ил]-1-(пиперидин-1-ил)проп-2-ен-1-он-L(+)тартрата; 3-[2-(1-циклобутилпиперидин-4-илокси)пиридин-5-ил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[2-фтор-4-(1-изопропилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[2-фтор-4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[4-(1-циклобутилпиперидин-4-илокси)-2-метилфенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[4-(1-изопропилпиперидин-4-илэкси)-2-метилфенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)-тартрата; 3-[4-(1-циклобутилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[4-(1-циклопропилметилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1 он-L(+)-тартрата; 3-[4-(1-изобутилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[4-(1-изопропилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[4-(1-изопропилпиперидин-4-илокси)-3-метоксифенил]-1-(пиперидин-1-ил)проп-2-ен-1-он-L(+)тартрата; 3-[4-(1-циклобутилпиперидин-4-илокси)-3-метоксифенил]-1-(пиперидин-1-ил)проп-2-ен-1-он-L(+)тартрата; 3-[4-(1-циклопропилметилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-изобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[3-бром-4-(1-изопропилпиперидин-4-илокси)фенил]- 1-(морфолин-4-ил)проп-2-ен-1-она; 3-[3-бром-4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[3-бром-4-(1-изобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[3-бром-4-(1-циклопропилметилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[6-(1-циклопропилметилпиперидин-4-илокси)пиридин-3-ил]-1-(морфолин-4-ил)проп-2-ен-1-онL(+)-тартрата; 3-[6-(1-изобутилпиперидин-4-илокси)пиридин-3-ил]-1-(морфолин-4-ил)проп-2-ен-1-он-L(+)тартрата; 3-[2-хлор-4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[2-хлор-4-(1-изопропилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[2-хлор-4-(1-циклопропилметилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[2-хлор-4-(1-изобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(пиперидин-1-ил)проп-2-ен-1-она; 3-[4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(1,1-диоксотиоморфолин-4-ил)проп-2-ен-1-она; 3-[2-(1-циклобутилпиперидин-4-илокси)пиридин-5-ил]-1-(пиперидин-1-ил)проп-2-ен-1-она; 3-[2-(1-циклобутилпиперидин-4-илокси)пиридин-5-ил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[2-фтор-4-(1-изопропилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[2-фтор-4-(1-циклобутилпиперидин-4-илокси)фенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-циклобутилпиперидин-4-илокси)-2-метилфенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-изопропилпиперидин-4-илокси)-2-метилфенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-циклобутилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-циклопропилметилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1 она; 3-[4-(1-изобутилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-изопропилпиперидин-4-илокси)-3-метоксифенил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[4-(1-изопропилпиперидин-4-илокси)-3-метоксифенил]-1-(пиперидин-1-ил)проп-2-ен-1-она; 3-[4-(1-циклобутилпиперидин-4-илокси)-3-метоксифенил]-1-(пиперидин-1-ил)проп-2-ен-1-она; 3-[6-(1-циклопропилметилпиперидин-4-илокси)пиридин-3-ил]-1-(морфолин-4-ил)проп-2-ен-1-она; 3-[6-(1-изобутилпиперидин-4-илокси)пиридин-3-ил]-1-(морфолин-4-ил)проп-2-ен-1-она или их фармацевтически приемлемых солей. 3. Способ получения соединения формулы (I) по п.1, включающий(а) восстановительное аминирование соединения формулы (1) соединением формулы (2) в присутствии подходящего растворителя и восстановителя с получением соединения формулы (I),где все заместители являются такими, как определено в п.1,(b) необязательно преобразование соединения формулы (I) в его фармацевтически приемлемые соли. 4. Фармацевтическая композиция, содержащая соединение по любому из пп.1 и 2 и фармацевтически приемлемые эксципиенты, для лечения нарушений, опосредованных H3-рецептором гистамина. 5. Фармацевтическая композиция по п.4 для лечения клинических состояний, опосредованных H3 рецептором, таких как когнитивные расстройства при шизофрении, нарколепсия, ожирение, синдром дефицита внимания с гиперактивностью, боль или болезнь Альцгеймера. 6. Способ лечения когнитивных расстройств при шизофрении, нарколепсии, ожирении, синдрома дефицита внимания с гиперактивностью, боли или болезни Альцгеймера, включающий введение нуждающемуся в этом пациенту эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп.1 и 2. 7. Применение соединения по любому из пп.1 и 2 для производства лекарственного средства для лечения заболеваний, связанных с H3-рецептором гистамина. 8. Применение соединения по п.7 для лечения клинических состояний, таких как когнитивные расстройства при шизофрении, нарколепсия, ожирение, синдром дефицита внимания с гиперактивностью,боль или болезнь Альцгеймера.
МПК / Метки
МПК: C07D 401/12, A61K 31/445, A61P 25/00, C07D 211/46
Метки: h3-рецептора, гистамина, лигандов, качестве, акриламида, соединения
Код ссылки
<a href="https://eas.patents.su/14-25136-soedineniya-akrilamida-v-kachestve-ligandov-h3-receptora-gistamina.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения акриламида в качестве лигандов h3-рецептора гистамина</a>
Предыдущий патент: Косметическая и/или фармацевтическая композиция для лечения воспаления кожи и связанных синдромов
Следующий патент: Раствор для диализа, включающий одно или более соединений креатина и способ его получения
Случайный патент: Косметическая композиция для фиксации волос и придания им блеска.