Способ получения промежуточного соединения для синтеза лекарственного средства
Номер патента: 22500
Опубликовано: 29.01.2016
Авторы: Ким Бонг Чанг, Ким Киу Йоунг, Ан Дзи Еун, Ли Хее Бонг, Ли Киу-Воонг
Формула / Реферат
1. Способ получения соединения формулы (2), отличающийся тем, что соединение формулы (4) подвергают реакции с соединением формулы (5)
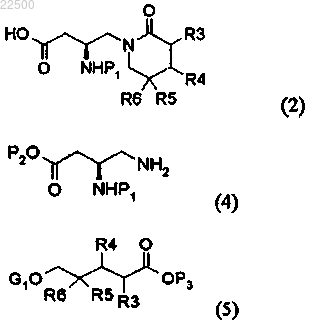
где R3 и R4 независимо представляют собой водород или C1-С4 алкил, R5 и R6 независимо представляют собой галоген, Р1 представляет собой аминозащитную группу, каждый из Р2 и Р3 независимо представляет собой бензильную группу, метильную группу, этильную группу, изопропильную группу или трет-бутильную группу и G1O представляет собой замещаемую группу, выбранную из группы, состоящей из трифлата, мезилата, тозилата, безилата и нонафлата.
2. Способ по п.1, который включает:
a) стадию присоединения при добавлении основания к смеси соединений формулы (4) и (5),
b) стадию циклизации добавлением кислоты для получения соединения формулы (2а)
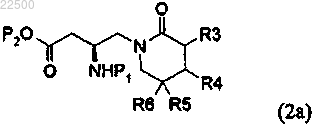
где R3, R4, R5, R6, P1 и Р2 являются такими, как определено в п.1, и
с) стадию гидролиза получаемого соединения формулы (2а) для получения соединения формулы (2).
3. Способ по п.1 или 2, отличающийся тем, что Р2 представляет собой трет-бутильную группу и Р3 представляет собой метильную или этильную группу.
4. Способ по п.1 или 2, отличающийся тем, что R3 и R4 представляют собой водород и R5 и R6 представляют собой фтор.
5. Способ по п.2, отличающийся тем, что на стадии (а) в качестве основания используют C1-C4 триалкиламин.
6. Способ по п.2, отличающийся тем, что на стадии (b) в качестве кислоты используют уксусную кислоту.
7. Способ по п.2, отличающийся тем, что в случае соединения формулы (2а), где P1 представляет собой Boc и Р2 представляет собой трет-бутил, гидролиз на указанной стадии (с) проводят в основных условиях для избирательного удаления только Р2 из защитных групп Р1 и Р2, обеспечивая соединение формулы (2).
8. Способ по п.7, отличающийся тем, что в качестве основания используют водный раствор гидроксида натрия.
9. Способ по п.1, где соединение формулы (5) получают способом, включающим:
а) стадию восстановления соединения формулы (7)

где R3, R4, R5, R6 и Р3 являются такими, как определено выше в п.1, и Р4 представляет собой бензильную группу, метильную группу, этильную группу, изопропильную группу или трет-бутильную группу;
для получения первичного спиртового соединения, и
b) стадию взаимодействия спиртового соединения, полученного выше, с соединением G1, которое выбирают из группы, состоящей из ангидрида трифторметансульфоновой кислоты (Tf2O), трифторметансульфонилхлорида (TfCl), метансульфонилхлорида (MsCl), толуолсульфонилхлорида (TsCl), бромбензолсульфонилхлорида (BsCl), (CF3(CF2)3SO2)F и (CF3(CF2)3SO2)2O, для получения соединения формулы (5).
10. Способ по п.9, отличающийся тем, что на стадии (а) восстановление проводят с использованием NaBH4.
11. Способ по п.1, где соединение формулы (4) получают способом, включающим:
a) стадию преобразования группы карбоновой кислоты соединения формулы (8) в сложноэфирную группу посредством введения группы Р2 для получения соединения формулы (9),
b) стадию избирательного восстановления сложноэфирной группы Р5, содержащейся в соединении формулы (9), для получения соединения формулы (10),
c) стадию введения замещаемой группы G2O в соединение формулы (10) для получения соединения формулы (11),
d) стадию взаимодействия соединения формулы (11) с азидным соединением для получения соединения формулы (12) и
e) стадию гидрирования соединения формулы (12) для получения соединения формулы (4);

где P1 и Р2 являются такими, как определено в п.1, Р5 представляет собой метильную группу, этильную группу, изопропильную группу или трет-бутильную группу и G2O представляет собой замещаемую группу.
12. Способ по п.11, отличающийся тем, что P1 представляет собой Boc, Р2 представляет собой изопропильную группу или трет-бутильную группу и G2O представляет собой трифлат или нонафлат.
13. Способ по п.1, где соединение формулы (4) получают способом, включающим:
а) стадию преобразования соединения карбоновой кислоты формулы (13) в активированный сложный эфир, который затем подвергают реакции с соединением амина для получения амидного соединения формулы (14),
b) стадию восстановления амидной группы соединения формулы (14) для получения соединения амина формулы (15) и
c) стадию дебензилирования или деаллилирования соединения амина формулы (15) для получения соединения формулы (4);
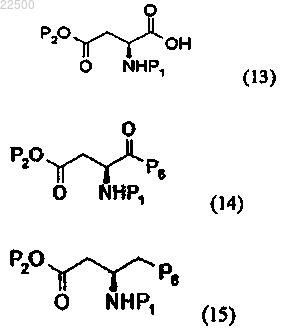
где Р1 и Р2 являются такими, как определено в п.1, Р6 представляет собой монобензиламин, дибензиламин, моноаллиламин или диаллиламин.
14. Способ по п.1, где соединение формулы (4) получают способом, включающим:
a) стадию преобразования соединения карбоновой кислоты формулы (13) в активированный сложный эфир, который затем подвергают реакции с соединением, являющимся источником азота, для получения амидного соединения формулы (16),
b) стадию восстановления амидной группы соединения формулы (16) для получения нитрильного соединения формулы (17) и
c) стадию гидрирования нитрильного соединения формулы (17) для получения соединения формулы (4);
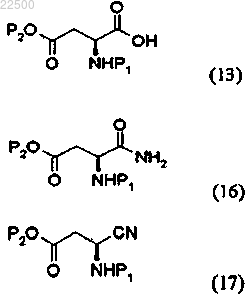
где P1 и Р2 являются такими, как определено в п.1.
15. Способ по п.14, отличающийся тем, что Р1 представляет собой Boc и Р2 представляет собой изопропил или трет-бутил.
16. Способ по п.14, отличающийся тем, что на стадии (а) в качестве активирующего средства используют хлороформиат или Boc2O.
17. Способ по п.14, отличающийся тем, что соединение-источник азота, используемое на стадии (а), представляет собой аммиачный газ или аммонийную соль.
18. Способ по п.14, отличающийся тем, что на стадии (b) восстановление проводят с использованием ангидрида трифторметансульфоновой кислоты и Et3N или циануровой кислоты и DMF.
19. Способ по п.14, отличающийся тем, что на стадии (с) гидрирование проводят с использованием металла, выбранного из палладия, хлорида никеля (I), оксида платины (IV) и гидроксида палладия.
20. Способ по п.14, отличающийся тем, что на стадии (с) гидрирование проводят с использованием гидроксида палладия, уксусной кислоты и водорода.
Текст
СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ ДЛЯ СИНТЕЗА ЛЕКАРСТВЕННОГО СРЕДСТВА Настоящее изобретение относится к новому способу получения соединения формулы (2) где P1, R3-R6 имеют значения, указанные в формуле изобретения, которое можно эффективно использовать в качестве промежуточного соединения для получения соединения формулы (1), проявляющего хорошую ингибирующую активность по отношению к ферменту дипептидилпептидазе IV.(71)(73) Заявитель и патентовладелец: Эл Джи ЛАЙФ САЙЕНСИЗ ЛТД. Область техники Настоящее изобретение относится к новому способу получения соединения формулы (2) в качестве основного промежуточного соединения для синтеза соединения формулы (1), которое проявляет хорошую ингибирующую активность в отношении дипептидилпептидазы IV (DPP-IV) и которое, таким образом, можно использовать в качестве лекарственного средства. Предшествующий уровень техники Соединение формулы (1) как соединение, которое описано в международной патентной публикацииWO 06/104356, проявляет хорошую ингибирующую активность в отношении фермента дипептидилпептидазы IV и, таким образом, его можно эффективно использовать для лечения и предупреждения заболеваний, вызванных действием дипептидилпептидазы IV, включая диабет (в частности, диабет II типа),ожирение и т.д. Способы получения соединения формулы (1) посредством соединения формулы (2) в качестве промежуточного соединения описаны в WO 06/104356. Касательно указанной выше ссылки, соединения формул (1) и (2) можно получать способами, например, такими, как раскрыто на следующей ниже реакционной схеме 1: Реакционная схема 1 Однако при крупномасштабном получении указанным выше способом трудно получать соединение формулы (2) с высокой оптической чистотой вследствие рацемизации стереогенного центра, в котором находится аминогруппа в соединении формулы (2) до известной степени, и, таким образом, также трудно получать соединение формулы (1) с высокой оптической чистотой. Описание изобретения Техническая задача Целью настоящего изобретения является новый способ получения соединения формулы (2) с высокой оптической чистотой в качестве основного промежуточного соединения для получения соединения формулы (1), которое можно использовать в виде лекарственного средства в качестве средства для ингибирования DPP-IV. Решение задачи Таким образом, настоящее изобретение относится к новому способу получения соединения формулы (2) в качестве основного промежуточного соединения, которое можно эффективно использовать для получения соединения формулы (1) в качестве средства для ингибирования DPP-IVR1 представляет собой водород или CF3,R2 выбран из группы, состоящей из водорода, замещенного или незамещенного C1-C10 алкила, замещенного или незамещенного C3-C10 циклоалкила, замещенного или незамещенного С 4-С 8 арила и замещенного или незамещенного С 3-С 7 гетероарила; и каждый из R3, R4, R5 и R6 представляет собой независимо водород, галоген или замещенный или незамещенный C1-C4 алкил. В приведенной выше формуле R3, R4, R5 и R6 являются такими, как определено выше, и P1 представляет собой аминозащитную группу. Предпочтительно P1 представляет собой Boc (бутилоксикарбонил), Cbz (бензилоксикарбонил) или Fmoc (9-флуоренилметилоксикарбонил) и более предпочтительноBoc. В приведенных выше формулах (1) и (2) если C1-C4 алкил замещен, то он может быть предпочтительно замещен галогеном и более предпочтительно фтором. 1. Получение соединения формулы (2) Способ получения соединения формулы (2) по настоящему изобретению характеризуется тем, что соединение формулы (4) подвергают реакции с соединением формулы (5), и дополнительно включает стадию удаления защитной группы карбоновой кислоты, полученной от соединения формулы (4) после реакции указанных двух соединенийP1, R3, R4, R5 и R6 являются такими, как определено выше; каждый из Р 2 и Р 3 представляет собой независимо бензильную группу, метильную группу, этильную группу, изопропильную группу или трет-бутильную группу;G1 выполняет функцию хорошо замещаемой группы совместно с кислородом. G1O представляет собой трифлат (трифторметансульфонат), мезилат, тозилат, безилат или нонафлат (нонафторбутансульфонат) и предпочтительно трифлат или нонафлат. Способом по настоящему изобретению получают соединение формулы (2) из соединения формулы(4) и соединения формулы (5) при посредстве соединения формулы (2 а), и он конкретно включает: а) стадию реакции связывания добавлением основания к соединению формулы (4) и соединению формулы (5),b) стадию циклизации добавлением кислоты для получения соединения формулы (2 а) иc) стадию удаления защитной группы карбоновой кислоты посредством гидролиза получаемого соединения формулы (2 а) для получения соединения формулы (2). Способ по настоящему изобретению можно представить в виде следующих ниже схем реакций 2 и 3. Реакционная схема 2 В приведенных выше схемах а представляет собой основание, такое как Et3N, основание Хунига и т.д.;b представляет собой кислоту, такую как АсОН и т.д., и органический растворитель, такой какCH2Cl2 и т.д.; с изменяется в зависимости от защитной группы и, как правило, выбрано из условий (1) сильная кислота, такая как H2SO4 и т.д., и CH2Cl2, водный NaOH, Boc2O и (2) NaOH, EtOH, H2O, кипячение с обратным холодильником, где P1 представляет собой Boc, и Р 2 представляет собой трет-бутильную группу,или является условием гидролиза с использованием основания, указанного в описанном выше условии(2), где P1 представляет собой Boc, и Р 2 представляет собой бензильную группу, метильную группу,этильную группу и изопропильную группу. R3, R4, R5, R6, P1, P2, Р 3 и G1 являются такими, как определено выше. Конкретно на стадии (а) незащищенный первичный амин соединения формулы (4) связывают с атомом углерода, содержащим замещаемую группу в соединении формулы (5), в основных условиях и удаляют -OG1. В этой реакции в качестве основания используют C1-C4 триалкиламин, предпочтительно триэтиламин или диизопропилэтиламин. В качестве растворителя реакции можно использовать обычные органические растворители, такие как дихлорэтан или дихлорметан, или циклические простые эфиры(например, тетрагидрофуран (THF) или диоксан). Для облегчения реакции используемое основание альтернативно служит в качестве растворителя. Реакцию можно проводить при любой температуре от 0 С до температуры кипячения с обратным холодильником. На стадии (b) соединение формулы (2 а) синтезируют путем циклизации вторичной аминогруппы соединения, полученного на указанной стадии (а), с внутренней сложноэфирной группой в кислых условиях. В этой реакции в качестве кислоты можно использовать неорганические кислоты, такие как хлористо-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.д., или органические кислоты, такие как муравьиная кислота, уксусная кислота, винная кислота и т.д., где, в частности, уксусная кислота является предпочтительной. На этой стадии можно использовать растворитель и температурные условия такие, как описано в указанной выше стадии (а). Указанные стадии (а) и (b) проводят непрерывным образом. На стадии (с) полученное на стадии (b) соединение формулы (2 а) подвергают гидролизу для получения соединения формулы (2). Конкретно в случае соединения формулы (2 а), где P1 представляет собойBoc и Р 2 представляет собой трет-бутильную группу, сначала можно использовать сильную кислоту, такую как серная кислота, хлористо-водородная кислота, фосфорная кислота, TFA (трифторуксусная кислота) и т.д., для удаления защитных групп, а затем Вос-защитную группу можно снова присоединять к аминогруппе в основных условиях для получения желаемого соединения формулы (2). Альтернативно,гидролиз в основных условиях, а не в кислых условиях, может приводить к избирательному удалению только Р 2 среди защитных групп P1 и Р 2, обеспечивая соединение формулы (2), и такой способ является более предпочтительным. Предпочтительно в качестве основания используют раствор гидроксида натрия. По завершении реакции соединение формулы (2) можно получать в виде твердого продукта путем подкисления с использованием кислоты. В случае соединения, где P1 представляет собой Boc и Р 2 представляет собой бензильную группу,метильную группу, этильную группу или изопропильную группу, гидролиз можно проводить посредством основания. Реакцию удаления защитных групп проводят с использованием Н 2/Pd-C, если P1 представляет собой Cbz, или с использованием Bu4N+F-, если P1 представляет собой Fmoc. Предпочтительно соединение формулы (2) можно получать с высоким выходом продукта, когда P2 представляет собой трет-бутильную группу или изопропильную группу, более предпочтительно третбутильную группу, и Р 3 представляет собой метильную группу или этильную группу. Кроме того, настоящее изобретение относится к способу получения соединений формул (4) и (5) в качестве исходных веществ, используемых для получения соединения формулы (2). 2. Получение соединения формулы (5) Соединение формулы (5) в качестве одного из исходных веществ, используемых для получения соединения формулы (2), можно получать из известного соединения формулы (7), которое можно получать из соединения формулы (6) способом, показанным на следующей ниже реакционной схеме 4, как описано в WO 06/104356. Способ получения соединения формулы (5) включает:a) стадию восстановления соединения формулы (7) для получения первичного спиртового соединения иb) стадию взаимодействия спиртового соединения, полученного на указанной выше стадии, с соединением G1, соответствующим доле G1O соединения формулы (2), для получения соединения формулы(5). Этот способ можно представить, как показано на следующей ниже реакционной схеме 5. Реакционная схема 4 В приведенной выше схеме а представляет собой этилакрилат (где Р 4 представляет собой этил), порошок Cu, TMEDA (тетраметилэтилендиамин) или THF;X представляет собой галоген, такой как Br, F или Cl и т.д.; Р 4 представляет собой бензильную группу, метильную группу, этильную группу, изопропильную группу или трет-бутильную группу; В приведенной выше схеме а представляет собой NaBH4 и EtOH или МеОН, или изо-PrOH;b представляет собой ангидрид трифторметансульфоновой кислоты (Tf2O), трифторметансульфонилхлорид (TfCl), метансульфонилхлорид (MsCl), толуолсульфонилхлорид (TsCl), бромбензолсульфонилхлорид (BsCl), (CF3(CF2)3SO2)F или (CF3(CF2)3SO2)2 О, пиридин или триалкиламин и CH2Cl2;R3, R4, R5, R6, Р 3, Р 4 и G1 являются такими, как определено выше. Конкретно на указанной выше стадии (а) добавляют боргидрид натрия (NaBH4) для избирательного восстановления только сложноэфирной группы, Р 4, защищающей карбоновую кислоту, для получения первичного спиртового соединения, которое затем на стадии (b) подвергают реакции с соединением G1,соответствующим доле G1O соединения формулы (2), т.е. с соединением G1, выбранным из группы, состоящей из ангидрида трифторметансульфоновой кислоты (Tf2O), трифторметансульфонилхлорида(BsCl), (CF3(CF2)3SO2)F и (CF3(CF2)3SO2)2O, в CH2Cl2 в качестве растворителя в присутствии пиридина или триалкиламина для получения соединения формулы (5). Например, когда G1O желаемого соединения формулы (2) представляет собой трифлат, реакцию проводят с использованием ангидрида трифторметансульфоновой кислоты для получения соединения формулы (5). 3. Получение соединения формулы (4) Между тем соединение формулы (4) в качестве оставшегося одного из исходных веществ для получения соединения формулы (2) можно получать любым из следующих ниже способов. Первый способ получения соединения формулы (4) включает:a) стадию преобразования группы карбоновой кислоты соединения формулы (8) в сложноэфирную группу посредством введения группы Р 2 для получения соединения формулы (9),b) стадию избирательного восстановления сложноэфирной группы Р 5, содержащейся в соединении формулы (9), для получения соединения формулы (10),c) стадию введения замещаемой группы G2O в соединение формулы (10) для получения соединения формулы (11),d) стадию взаимодействия соединения формулы (11) с азидным соединением для получения соединения формулы (12) иe) стадию гидрирования соединения формулы (12) для получения соединения формулы (4). Первый способ получения соединения формулы (4), как описано выше, включает способы введения аминогруппы в атом углерода, к которому присоединена сложноэфирная группа в соединении формулы(8), и его можно представить, как показано на следующей ниже реакционной схеме 6. Реакционная схема 6 В приведенной выше схеме а представляет собой DMAP, Boc2O (где Р 2 представляет собой трет-бутильную группу) и третBuOH ИЛИ THF;DMAc/MeOH, нагревание; е выбрано из условий (1) Н 2, Pd/C, МеОН или EtOH, (2) NaBH4, Pd/C, МеОН, (3) PPh3, H2O, THF и(4) триалкилфосфин или триалкилфосфит, H2O, THF; Р 5 представляет собой метильную группу, этильную группу, изопропильную группу или третбутильную группу;G2 представляет собой совместно с кислородом хорошую замещаемую группу, включающую трифлат, мезилат, тозилат, безилат, нонафлат и т.д.;P1 и Р 2 являются такими, как определено выше. На стадии (а) указанной реакции группу карбоновой кислоты соединения формулы (8) преобразуют в сложноэфирную группу посредством введения Р 2 для получения соединения формулы (9). В этой реакции в качестве растворителя используют трет-BuOH ИЛИ THF и используют каталитическое количество(0,530 мол.%) 4-диметиламинопиридина (DMAP). Например, если вводят Р 2, когда Р 2 представляет собой трет-бутильную группу, используют эквивалент Boc2O и реакцию проводят в диапазоне от комнатной температуры приблизительно до 40 С для получения желаемого сложноэфирного соединения формулы (9). На стадии (b) указанной реакции сложноэфирную группу, которая изначально содержится в соединении формулы (9), т.е. сложноэфирную группу, содержащуюся в положении Р 5, избирательно восстанавливают боргидридом натрия (NaBH4) для получения соединения формулы (10) в качестве первичного спирта. В этой реакции в качестве растворителя используют метанол или этанол. На стадии (с) указанной реакции замещаемую группу G2O вводят посредством реакции с ангидридом трифторметансульфоновой кислоты (Tf2O), трифторметансульфонилхлоридом (TfCl), метансульфонилхлоридом (MsCl), толуолсульфонилхлоридом (TsCl), бромбензолсульфонилхлоридом (BsCl), (CF3(CF2)3SO2)F или (CF3(CF2)3SO2)2 О в CH2Cl2 в качестве растворителя в присутствии пиридина или триалкиламина для получения соединения формулы (11). На стадии (d) указанной реакции соединение формулы (11) подвергают реакции с 1,0-2,0 эквивалентами азида натрия в условиях нагревания (от 60 до 80 С) для получения соединения формулы (12). Полученную таким образом азидную группу соединения формулы (12) можно преобразовывать в аминогруппу посредством реакции гидрирования при различных условиях реакции (е) для получения соединения формулы (4). В частности, когда P1 представляет собой Boc, Р 2 представляет собой изопропильную группу или трет-бутильную группу, и G2O представляет собой трифлат или нонафлат, соединение формулы (4) можно получать с высоким выходом продукта. Второй способ получения соединения формулы (4) включает:a) стадию преобразования соединения карбоновой кислоты формулы (13) в активированный сложный эфир, который затем подвергают реакции с соединением вторичного амина для получения амидного соединения формулы (14),b) стадию восстановления амидной группы соединения формулы (14) для получения соединения третичного амина формулы (15) иc) стадию подвергания соединения третичного амина формулы (15) реакции дебензилирования для получения соединения формулы (4). Этот способ можно представить, как показано на следующей ниже схеме 7. Реакционная схема 7 В приведенной выше схеме а выбрано из условий (1) изо-BuOCOCl, NMM (N-метилморфолин), Bn2NH или BnNH2, или диаллиламина, или аллиламина; и (2) изо-BuOCOCl, NMM, диаллиламин;b выбрано из условий (1) Os(CO)12, Ru(CO)12, RuCl2(СО)2(PPh3)2 или RuH2(СО)2(PPh3)2 в качестве катализатора реакции, Et3SiH, толуол, кипячение с обратным холодильником, (2) RuH(CO)(PPh3)3,Ru3(CO)12 или RuCl(PPh3)3 в качестве катализатора реакции, Ph2SiH2, PMHS (полидиметилсилоксан), THF или 2-Ме THF, 1,4-диоксан, сложный этиловый эфир, толуол, (3) 9-BBN (9-борабицикло[3,3,1]нонан),THF, кипячение с обратным холодильником и (4) ВН 3DMS или BH3THF, толуол, нагревание; Р 6 представляет собой монобензиламин, или дибензиламин, или моноаллиламин, или диаллиламин;P1 и Р 2 являются такими, как определено выше. На стадии (а) указанной реакции амидное соединение формулы (14) можно получать подходящим способом посредством преобразования соединения карбоновой кислоты формулы (13) в активированный сложный эфир действием изобутилхлорформиата и основания, а затем взаимодействия с вторичным амином, таким как Bn2NH, диаллиламин и т.д. На стадии (b) указанной реакции амидную группу амидного соединения формулы (14) можно восстанавливать различными способами, известными в соответствующей области техники, для получения соединения третичного амина формулы (15) (например, способы преобразования амидной группы в амин известны, как следует ниже: способ b-1: см., например, Tetrahydron Lett. 2001, 42, 1945; способ b-2: см.,например, Tetrahydron Lett. 1998, 39, 1017; способ b-3: см., например, Org. Lett. 1999, 1, 799 и TetrahydronLett. 1999, 40, 3673; способ b-3: см., например, Bioorg. Med. Chem. 2006, 14, 6586 и Chem. Eur. J. 2006, 12,6910, и Synthesis 2005, 2281). Например, в случае соединения формулы (14), где P1 представляет собой Boc, и Р 2 представляет собой трет-бутил, желаемое соединение формулы (15) можно получать при различных каталитических условиях указанного b-1. Кроме того, катализаторы и условия, описанные в указанном выше b-2, можно использовать для получения желаемого соединения формулы (15). В частности, когда Ph2SiH2 используют с катализатором Ru3(CO)12, реакцию можно проводить с использованием 0,530 мол.% Ru3(CO) и 5,0 эквивалентов Ph2SiH2 в присутствии растворителя THF при 80 С для получения желаемого соединения формулы (15). Скорость восстановления при условии b-3, как определено выше, несколько ниже (максимальная скорость 25%). При условии реакции b-4, как определено выше, можно получать наилучшие результаты в отношении выхода продукта, когда реакцию проводят с использованием 2,0 эквивалентов ВН 3DMS в толуольном растворителе при 50 С (14:15:15 а=11,4:61,2:10,7). В том числе соединение формулы (15 а) можно подвергать дебензилированию посредством гидрирования в присутствии катализаторов на основе Pd/C для получения соединения формулы (4), как определено выше. На стадии реакции (с) соединение формулы (15) можно дебензилировать, например, посредством реакции дебензилирования с использованием Н 2 и Pd/C для бензильной защитной группы или посредством реакции деарилирования с использованием PdCl2/1,3-диметилбарбитуровой кислоты для получения соединения формулы (4). Третий способ получения соединения формулы (4) включает:a) стадию преобразования соединения карбоновой кислоты формулы (13) в активированный сложный эфир, который затем подвергают реакции с соединением, являющимся источником азота, для получения амидного соединения формулы (16),b) стадию восстановления амидной группы амидного соединения формулы (16) для получения нитрильного соединения формулы (17) и с) стадию подвергания нитрильного соединения формулы (17) реакции гидрирования для получения соединения формулы (4). Этот способ можно представить, как показано на следующей ниже реакционной схеме 8. Реакционная схема 8 В приведенной выше схеме а выбрано из условий (1) EtOCOCl, NMM, NH3 (г) и (2) Boc2O, NH4HCO3, пиридин, DMF;b выбрано из условий (1) (CF3CO)2O, Et3N и (2) циануровая кислота, DMF; с выбрано из условий (1) Pd/C, Н 2, АсОН, 45 фунт/дюйм 2 (2) NiCl6H2O, NaBH4, (3) CF3CO2H,NaBH4, (4) PtO2, H2, AcOH, (5) PtO2, H2, EtOH, CHCl3, (6) Pd(OH)2, H2, MeOH:AcOH (1:1) илиP1 и Р 2 являются такими, как определено выше. Конкретно на стадии (а) группу карбоновой кислоты исходного соединения формулы (13) преобразуют в активированную сложноэфирную группу с использованием хлорформиата или Boc2O в качестве активирующего средства при основных условиях, а затем подвергают реакции с соединениемисточником азота, таким как аммиачный газ или аммонийная соль (например, бикарбонат аммония или карбонат аммония и т.д.) для получения амидного соединения формулы (16). В этом случае, когда в соединении формулы (13) P1 представляет собой Boc, и Р 2 представляет собой изопропильную группу или трет-бутильную группу, результат реакции является предпочтительным в отношении выхода продукта. На стадии (b) полученную таким образом амидную группу соединения формулы (16) подвергают реакции с ангидридом трифторметансульфоновой кислоты/Et3N или циануровой кислотой/DMF для получения соединения формулы (17), содержащего нитрильную группу (-CN). На стадии (с) гидрирование можно проводить с использованием металла, выбранного из палладия,хлорида никеля (I), оксида платины (IV) или гидроксида палладия, для получения соединения первичного амина формулы (4). Настоящее изобретение более подробно проиллюстрировано посредством следующих ниже примеров получений и примеров. Однако не следует понимать, что объем настоящего изобретения органичен каким-либо образом этими препаратами и примерами. Полезные эффекты изобретения Способом по настоящему изобретению можно получать соединение формулы (2) с высокой оптической чистотой в качестве промежуточного соединения для получения соединения формулы (1) с высокой оптической чистотой, которое можно использовать в качестве лекарственного средства для лечения или предотвращения заболеваний, включая диабет, вызванных активацией дипептидилпептидазы IV. Способ осуществления изобретения Получение 1. Синтез диэтил-2,2-дифторпентандиоата Для растворения этилбромдифторацетата (33,2 г) в тетрагидрофуране (94,0 г) добавляли этилакрилат (8,2 г) и порошок меди (10,9 г). После нагревания до 50 С капельно добавляли TMEDA (9,5 г) и затем перемешивали реакционную смесь в течение 3 ч при той же температуре. После исчезновения этилакрилата в качестве исходного вещества к реакционной смеси добавляли простой метил-трет-бутиловый эфир(МТВЕ, 73,7 г) с последующим капельным добавлением 10% водного раствора хлорида аммония (49,8 г) и затем перемешивали смесь в течение 30 мин. Оставшийся остаток меди удаляли фильтрацией через целит и добавляли простой метил-трет-бутиловый эфир (МТВЕ, 66,3 г) для разделения слоев. Выделенный органический слой последовательно промывали 10% водным раствором NH4Cl (66,3 г) и 3 н. водным раствором соляной кислоты (99,6 г) по порядку, а затем перегоняли при пониженном давлении до получения 55,0 г указанного в заголовке желаемого соединения. 1 14,8 г Соединения, полученного из указанного выше получения 1, растворяли в этаноле (20,4 г) и тетрагидрофуране (69,1 г), а затем охлаждали до 0 С. К полученному раствору постепенно медленно добавляли боргидрид натрия (NaBH4, 3,5 г) при поддержании внутренней температуры ниже 30 С. После подтверждения завершения реакции посредством 1 Н ЯМР реакционный раствор охлаждали до температуры 10 С и медленно добавляли 10% водный раствор хлорида аммония (77,7 г). Оставшееся соединение бора фильтровали через целит и перегоняли фильтрат при пониженном давлении для удаления тетрагидрофурана. Затем добавляли этилацетат (105,2 г) для разделения слоев и перегоняли органический слой при пониженном давлении до получения 10,8 г указанного в заголовке желаемого соединения. 1 К раствору 10,8 г соединения, полученного из указанного выше получения 2, растворенного в дихлорметане (100,2 г), добавляли пиридин (7,0 г), а затем охлаждали смесь до -5,0 С. После охлаждения медленно капельно добавляли ангидрид трифторметансульфоновой кислоты (20,1 г) при поддержании температуры реакционной смеси ниже 6,3 С. После перемешивания реакционной смеси в течение 30 мин капельно добавляли 1,5 н. раствор соляной кислоты при 0 С до разделения слоев. Выделенный водный слой дважды экстрагировали дихлорметаном (33,4 г) и объединяли экстракты с органическим слоем, выделенным из указанного выше раствора, а затем перегоняли при пониженном давлении до получения 19,7 г указанного в заголовке соединения в виде желтого масла. 1 К раствору 100,0 г соединения, полученного из указанного выше получения 2, растворенного в дихлорметане (300,0 мл), добавляли пиридин (65,7 г), а затем охлаждали смесь до -10,0 С. После охлаждения медленно капельно добавляли нонафторбутансульфоновый ангидрид (477,4 г). После перемешивания реакционной смеси в течение 3 ч капельно добавляли 1,0 н. раствор соляной кислоты (300,0 мл) до разделения слоев. Выделенный водный слой однократно экстрагировали дихлорметаном (500,0 мл) и объединяли экстракты с органическим слоем, выделенным из указанного выше раствора, а затем перегоняли при пониженном давлении до получения 177,5 г указанного в заголовке соединения. 1H ЯМР (500 МГц, CDCl3) : 1,26 (т, 3H, J=7,3 Гц), 2,30-2,36 (м, 2 Н), 2,58 (т, 2 Н, J=7,4 Гц), 4,16 (кв,2 Н, J=7,3 Гц), 4,57 (т, 2 Н, J=11 Гц). Пример 2-2. Синтез этил-4,4-дифтор-5-[(нонафторбутил)сульфонилокси]пентаноата К раствору 500,0 г соединения, полученного из указанного выше получения 2, растворенного в дихлорметане (1000,0 мл), добавляли триэтиламин (389,0 г), а затем охлаждали смесь до 0 С. После охлаждения медленно капельно добавляли перфторбутансульфонилхлорид (948,80 г). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре, перегоняли при пониженном давлении, растворяли в простом метил-трет-бутиловом эфире (МТВЕ, 3000,0 мл), а затем промывали трижды водой. Полученный таким образом органический слой подвергали дегидратации сульфатом магния, фильтровали через целит, а затем перегоняли при пониженном давлении до получения 960,0 г указанного в заголовке соединения. Пример 3. Синтез метил-(2S)-2-[(трет-бутоксикарбонил)амино]-4-оксопентаноата(DMAP, 62,0 г, 0,5 мол.%) при комнатной температуре, а затем перемешивали реакционную смесь в течение 23 ч при 40 С. По завершении реакции добавляли этилендихлорид (62,3 г) в трет-бутаноле, а затем перегоняли смесь при пониженном давлении до получения 30,7 г указанного в заголовке соединения.H ЯМР (400 МГц, CDCl3) : 1,45 (с, 9 Н), 1,47 (с, 9 Н), 2,71 (дд, J=4,8, 16,4 Гц, 1 Н), 2,88 (дд, J=4,4,16,4 Гц, 1 Н), 3,75 (с, 3H), 4,53 (м, 1 Н), 5,44 (ушир.д, J=8,0 Гц, 1 Н). Пример 4. Синтез трет-бутил-(3S)-3-[(трет-бутоксикарбонил)амино]-4-гидроксибутаноата 30,7 г Соединения, полученного из указанного выше примера 3, растворяли в этаноле (112,3 г) и после понижения внутренней температуры до 10,5 С медленно капельно добавляли боргидрид натрия(NaBH4, 5,7 г). Полученную реакционную смесь перемешивали при поддержании температуры ниже 22 С. После подтверждения завершения реакции посредством 1 Н ЯМР и TLC к реакционному раствору медленно капельно добавляли 3,0 н. раствора соляной кислоты (30,7 г) при внутренней температуре 10 С с последующим добавлением разбавленного 0,2% раствора соляной кислоты (100,0 г). Реакционный раствор доводили до рН 34, добавляя 9,0% водный раствор соляной кислоты, а затем дважды экстрагировали этилацетатом (100,0 г) и толуолом (44,0 г). Полученный таким образом органический слой перегоняли при пониженном давлении до получения 25,1 г указанного в заголовке соединения. 1 К 25,1 г соединения, полученного из указанного выше примера 4, добавляли дихлорметан (133,0 г) и триэтиламин (148,0 г), а затем охлаждали смесь до 0 С. К полученному реакционному раствору медленно капельно добавляли метансульфонилхлорид (11,8 г), разбавленный дихлорметаном (39,9 г) в течение 50 мин при поддержании внутренней температуры ниже 12 С. По завершении реакции реакционный раствор промывали 0,5 н. водным раствором соляной кислоты (120,0 г) и водой (100,4 г), а затем перегоняли при пониженном давлении до получения 31,5 г указанного в заголовке соединения. 1 Азид натрия (NaN3, 11,6 г) разбавляли диметилацетамидом (DMAc, 260,0 г). После повышения внутренней температуры до 80 С к нему добавляли раствор 31,5 г соединения, полученного из указанного выше примера 5, разбавленного диметилацетамидом (DMAc, 45,0 г). Реакцию проводили при 80 С в течение 2 ч. К реакционному раствору добавляли толуол (251,0 г) и воду (320,0 г) для разделения слоев. Полученный таким образом органический слой перегоняли при пониженном давлении до получения 24,0 г указанного в заголовке соединения. 1 К 21,0 г соединения, полученного из указанного выше примера 6, добавляли тетрагидрофуран (93,3 г) с последующим добавлением трифенилфосфина (PPh3, 21,0 г) при 40 С, смесь перемешивали в течение 2 ч при той же температуре, а затем добавляли к ней воду (3,8 г). Реакционный раствор перегоняли при пониженном давлении и полученное твердое вещество оксида трифенилфосфина растворяли в толуоле (26,0 г) и н-гексане (41,0 г), а затем фильтровали. Фильтрат доводили до рН 23 1,0 н. водным раствором соляной кислоты (110,0 г), а затем подвергали разделению слоев. Для удаления любого остаточного твердого вещества оксида трифенилфосфина полученный, как указано выше, водный слой промывали дихлорметаном (100,0 г), а затем доводили до рН 89 28% раствором водного аммиака (7,6 г). Полученный таким образом водный раствор экстрагировали дихлорметаном (100,0 г) и перегоняли при пониженном давлении до получения 8,5 г указанного в заголовке соединения в виде белого твердого вещества. 1THF (200 мл). После охлаждения до температуры ниже -5 С к реакционному раствору капельно добавля-8 022500 ли изобутилхлорформиат (13,0 мл, 0,10 моль) с последующим добавлением N-метилморфолина (12,0 мл,0,10 моль) и перемешивали реакционную смесь в течение 30 мин. К реакционной смеси капельно добавляли дибензиламин (21,1 мл, 0,11 моль), а затем перемешивали смесь в течение 3 ч и наблюдали за прохождением реакции посредством TLC (EtOAc:гексан=1:4). По завершении реакции реакционный раствор перемешивали с добавлением этилацетата (300,0 мл) и 1 н. соляной кислоты до разделения слоев и перегоняли при пониженном давлении до выпадения твердого осадка. Твердый осадок фильтровали и промывали этилацетатом (100 мл), а затем полученные при промывке осадки концентрировали, снова перегоняя при пониженном давлении. Остаточное вещество затем попускали через колонку с силикагелем для получения очищенного желаемого продукта (41,7 г, 0,89 моль). 1THF (50 мл). После охлаждения до температуры ниже -5 С к реакционному раствору капельно добавляли изобутилхлорформиат (2,26 мл, 17,3 моль) с последующим добавлением N-метилморфолина (1,90 мл,17,3 моль) и перемешивали реакционную смесь в течение 30 мин. К реакционной смеси капельно добавляли диаллиламин (2,35 мл, 19,0 моль), а затем перемешивали смесь в течение 3 ч и наблюдали за прохождением реакции посредством TLC (EtOAc:гексан=1:4). По завершении реакции реакционный раствор перемешивали с добавлением этилацетата (60 мл) и 1 н. соляной кислоты и после разделения слоев концентрировали, перегоняя при пониженном давлении. Затем остаточное вещество пропускали через колонку с силикагелем для получения очищенного желаемого продукта (6,0 г, 16,3 моль). 1 10,0 г Соединения, полученного из указанного выше примера 8, Ru3(CO)12 (136 мг, 1 мол.%) и дифенилсилана (19,7 мл, 106,7 ммоль) добавляли к тетрагидрофурану (50 мл) и перемешивали реакционную смесь при кипячении с обратным холодильником в течение 40 ч. Реакционный раствор экстрагировали этилацетатом (200 мл) и концентрировали, перегоняя при пониженном давлении. Затем остаточное вещество пропускали через колонку с силикагелем для получения очищенного желаемого продукта (4,7 г, 10,5 ммоль). 1 360,0 г Исходного вещества N-Boc-Asp(O-t-Bu)ОН совместно с Вос 2 О (353,0 г) и бикарбонат аммония (NH4HCO3, 123,9 г) добавляли к диметилформамиду (1174,6 г) и капельно добавляли пиридин (61,0 г) к смеси при комнатной температуре, а затем перемешивали реакционную смесь приблизительно в течение 3 ч. По завершении реакции к реакционной смеси добавляли воду (1440 мл) и толуол (1800 мл) и перемешивали в течение 30 мин до разделения слоев. Полученный таким образом органический слой перегоняли при пониженном давлении для удаления трет-бутанола и толуола для получения указанного в заголовке соединения, которое непосредственно использовали в последующей реакции. Пример 12. Синтез (S)-трет-бутил-3-(трет-бутоксикарбониламино)-3-цианопропаноата К соединению, полученному из примера 11, капельно добавляли диметилформамид (1019,5 г) с последующим добавлением цианурхлорида (112,0 г) в течение 1,5 ч при температуре ниже 25 С. Реакцион-9 022500 ный раствор перемешивали в течение 1 ч при комнатной температуре, а затем к нему добавляли 0,1 н. водный раствор гидроксида натрия (1850,0 г) и толуол (1860 мл) для разделения слоев. Полученный таким образом органический слой снова однократно промывали водой (700 мл), а затем перегоняли при пониженном давлении до получения 318,3 г указанного в заголовке соединения. 1 К 212,1 г соединения, полученного из указанного выше примера 12, добавляли уксусную кислоту(4000 мл) с последующим добавлением 20 мас.% Pd(OH)2 (1,1 г) при 40 С. Смесь перемешивали в течение 8 ч при поддержании внутренней температуры ниже 45 С и 3 атмосферных давлений водорода. По завершении реакции реакционный раствор перегоняли при пониженном давлении для удаления уксусной кислоты, разбавляли толуолом (640 л), а затем фильтровали через целит. К фильтрату добавляли 0,25 н. водный раствор соляной кислоты (1060 мл) для разделения слоев. Полученный таким образом водный слой ощелачивали водным раствором аммиака (543,1 г), а затем экстрагировали простым метил-третбутиловым эфиром (МТВЕ, 1000 мл). Полученный таким образом органический слой перегоняли при пониженном давлении до получения 185,0 г указанного в заголовке соединения. Пример 14. Синтез сложного трет-бутилового эфира 3-трет-бутоксикарбониламино-4-(5,5-дифтор 2-оксопиперидин-1-ил)масляной кислоты Триэтиламин (13,2 г) добавляли к 16,0 г соединения, полученного из указанного выше примера 1 или 2-1, или 2-2, и к 14,1 г соединения, полученного из указанного выше примера 7 или 13, а затем перемешивали смесь в течение 21 ч при 40 С. Затем добавляли дихлорметан (154,8 г) и уксусную кислоту(18,3 г) и перемешивали смесь в течение 5 ч при комнатной температуре. К полученному реакционному раствору добавляли 0,5 н. водного раствора соляной кислоты (116,8 г), а затем перемешивали смесь в течение 30 мин до разделения слоев. Полученный таким образом органический слой перегоняли при пониженном давлении до получения 23,6 г указанного в заголовке соединения. 1 23,6 г Соединения, полученного из указанного выше примера 14, добавляли к дихлорметану (20,0 г) с последующим добавлением Н 3 РО 4 (30,0 г) и перемешивали смесь в течение 16 ч при комнатной температуре. После подтверждения отделения всех трет-бутильных групп и трет-бутилоксикарбонильных групп реакционный раствор доводили до рН 7,08,0 10 н. водным пероксидом водорода и добавляли к нему Вос 2 О (16,0 г). По завершении добавления 10 н. водный пероксид водорода использовали для поддержания рН реакционного раствора при 8,09,0. После перемешивания в течение 3 ч полученный фосфат натрия фильтровали, а затем доводили фильтрат до рН 2,03,0 3,0 н. водным раствором соляной кислоты. Полученное твердое вещество фильтровали и сушили в атмосфере азота до получения 14,5 г указанного в заголовке соединения. 1H ЯМР (500 МГц, CDCl3) : 1,32 (с, 9 Н), 2,20-2,43 (м, 6 Н), 3,26-3,31 (м, 2 Н), 3,61 (м, 1 Н), 3,81 (м,1 Н), 4,02 (м, 1 Н), 6,73 (д, J=8,6 Гц, 1 Н), 12,16 (с, 1 Н). Для указанного в заголовке соединения, полученного из указанного выше примера, ВЭЖХ (высокоэффективной жидкостной хроматографией) измеряли его энантиомерные изомеры, т.е. S-форму и Rформу, а затем рассчитывали избыток энантиомерных изомеров (S-формы по сравнению с R-формой)(энантиомерный избыток, е.е.), где е.е.99%. С другой стороны, в случае сравнительного примера, полученного указанным выше способом на основании WO 06/104356, как описано ниже, избыток (е.е.) энантиомерных изомеров (S-формы по сравнению с R-формой) составлял 80%. На основании этого можно установить, что соединение формулы (2) с высокой оптической чистотой можно получать способом по настоящему изобретению. Сравнительный пример 1. Синтез сложного трет-бутилового эфира 3-трет-бутоксикарбониламино 4-(5,5-дифтор-2-оксопиперидин-1-ил)масляной кислоты К 10,0 г соединения, полученного из примера 1, добавляли 40 мл безводного раствора аммиака (7 М раствор в метаноле) и перемешивали смесь в течение 3 ч. Реакционный раствор перегоняли и капельно добавляли к нему 30 мл насыщенного метанолом раствора соляной кислоты. Реакционную смесь перемешивали при комнатной температуре, а затем перегоняли до получения 7,2 г указанного в заголовке соединения в виде белого твердого вещества. 1H ЯМР (500 МГц, CD3OD) : 2,35 (м, 2 Н), 2,59 (т, J=7,6 Гц, 2 Н), 3,49 (т, J=15,3 Гц, 2 Н), 3,68 (с, 3H). Сравнительный пример 1-2. Синтез сложного трет-бутилового эфира 3-трет-бутоксикарбониламино-4-(5,5-дифтор-2-оксопиперидин-1-ил)масляной кислоты К раствору соединения (1,93 г), полученного из указанного выше примера 4, растворенного в дихлорметане (20,0 г) и Н 2 О (4,0 г) добавляли NaBr (0,8 г) и TEMPO (11 мг, 1 мол.%). К полученному реакционному раствору медленно капельно добавляли раствор 5% NaOCl (11,5 г) и NaHCO3 (1,7 г), растворенный в Н 2 О (12,0 г), приблизительно в течение 2 ч при поддержании температуры ниже 5 С. По завершении капельного добавления реакционный раствор перемешивании в течение 30 мин до разделения слоев. К полученному таким образом органическому слою добавляли соединение (1,6 г), полученное из указанного выше сравнительного примера 1-1. После перемешивания в течение 15 мин при комнатной температуре к реакционному раствору добавляли NaBH(OAc)3 (2,23 г). После перемешивания приблизительно в течение 19 ч к реакционному раствору капельно добавляли 10% водный раствор NaHCO3 (20,0 г) и 0,5 н. водный раствор соляной кислоты (20,0 г) для разделения слоев. Полученный таким образом органический слой подвергали дегидратации в безводном MgSO4 до получения 2,0 г (выход продукта 73%) того же самого указанного в заголовке соединения, как в примере 14, в виде желтого твердого вещества. Для указанного в заголовке соединения, полученного из указанного выше примера, ВЭЖХ (высокоэффективной жидкостной хроматографией) измеряли его энантиомерные изомеры, т.е. S-форму и Rформу, а затем рассчитывали избыток (е.е.) энантиомерных изомеров (S-формы по сравнению с Rформой), где е.е.=80%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (2), отличающийся тем, что соединение формулы (4) подвергают реакции с соединением формулы (5) где R3 и R4 независимо представляют собой водород или C1-С 4 алкил, R5 и R6 независимо представляют собой галоген, Р 1 представляет собой аминозащитную группу, каждый из Р 2 и Р 3 независимо представляет собой бензильную группу, метильную группу, этильную группу, изопропильную группу или трет-бутильную группу и G1O представляет собой замещаемую группу, выбранную из группы, состоящей из трифлата, мезилата, тозилата, безилата и нонафлата. 2. Способ по п.1, который включает:a) стадию присоединения при добавлении основания к смеси соединений формулы (4) и (5),b) стадию циклизации добавлением кислоты для получения соединения формулы (2 а) где R3, R4, R5, R6, P1 и Р 2 являются такими, как определено в п.1, и с) стадию гидролиза получаемого соединения формулы (2 а) для получения соединения формулы(2). 3. Способ по п.1 или 2, отличающийся тем, что Р 2 представляет собой трет-бутильную группу и Р 3 представляет собой метильную или этильную группу. 4. Способ по п.1 или 2, отличающийся тем, что R3 и R4 представляют собой водород и R5 и R6 представляют собой фтор. 5. Способ по п.2, отличающийся тем, что на стадии (а) в качестве основания используют C1-C4 триалкиламин. 6. Способ по п.2, отличающийся тем, что на стадии (b) в качестве кислоты используют уксусную кислоту. 7. Способ по п.2, отличающийся тем, что в случае соединения формулы (2 а), где P1 представляет собой Boc и Р 2 представляет собой трет-бутил, гидролиз на указанной стадии (с) проводят в основных условиях для избирательного удаления только Р 2 из защитных групп Р 1 и Р 2, обеспечивая соединение формулы (2). 8. Способ по п.7, отличающийся тем, что в качестве основания используют водный раствор гидроксида натрия. 9. Способ по п.1, где соединение формулы (5) получают способом, включающим: а) стадию восстановления соединения формулы (7) где R3, R4, R5, R6 и Р 3 являются такими, как определено выше в п.1, и Р 4 представляет собой бензильную группу, метильную группу, этильную группу, изопропильную группу или трет-бутильную группу; для получения первичного спиртового соединения, иb) стадию взаимодействия спиртового соединения, полученного выше, с соединением G1, которое выбирают из группы, состоящей из ангидрида трифторметансульфоновой кислоты (Tf2O), трифторметансульфонилхлорида (TfCl), метансульфонилхлорида (MsCl), толуолсульфонилхлорида (TsCl), бромбензолсульфонилхлорида (BsCl), (CF3(CF2)3SO2)F и (CF3(CF2)3SO2)2O, для получения соединения формулы (5). 10. Способ по п.9, отличающийся тем, что на стадии (а) восстановление проводят с использованиемNaBH4. 11. Способ по п.1, где соединение формулы (4) получают способом, включающим:a) стадию преобразования группы карбоновой кислоты соединения формулы (8) в сложноэфирную группу посредством введения группы Р 2 для получения соединения формулы (9),b) стадию избирательного восстановления сложноэфирной группы Р 5, содержащейся в соединении формулы (9), для получения соединения формулы (10),c) стадию введения замещаемой группы G2O в соединение формулы (10) для получения соединения формулы (11),d) стадию взаимодействия соединения формулы (11) с азидным соединением для получения соединения формулы (12) иe) стадию гидрирования соединения формулы (12) для получения соединения формулы (4); где P1 и Р 2 являются такими, как определено в п.1, Р 5 представляет собой метильную группу, этильную группу, изопропильную группу или трет-бутильную группу и G2O представляет собой замещаемую группу. 12. Способ по п.11, отличающийся тем, что P1 представляет собой Boc, Р 2 представляет собой изопропильную группу или трет-бутильную группу и G2O представляет собой трифлат или нонафлат. 13. Способ по п.1, где соединение формулы (4) получают способом, включающим: а) стадию преобразования соединения карбоновой кислоты формулы (13) в активированный сложный эфир, который затем подвергают реакции с соединением амина для получения амидного соединения формулы (14),b) стадию восстановления амидной группы соединения формулы (14) для получения соединения амина формулы (15) иc) стадию дебензилирования или деаллилирования соединения амина формулы (15) для получения соединения формулы (4); где Р 1 и Р 2 являются такими, как определено в п.1, Р 6 представляет собой монобензиламин, дибензиламин, моноаллиламин или диаллиламин. 14. Способ по п.1, где соединение формулы (4) получают способом, включающим:a) стадию преобразования соединения карбоновой кислоты формулы (13) в активированный сложный эфир, который затем подвергают реакции с соединением, являющимся источником азота, для получения амидного соединения формулы (16),b) стадию восстановления амидной группы соединения формулы (16) для получения нитрильного соединения формулы (17) иc) стадию гидрирования нитрильного соединения формулы (17) для получения соединения формулы (4); где P1 и Р 2 являются такими, как определено в п.1. 15. Способ по п.14, отличающийся тем, что Р 1 представляет собой Boc и Р 2 представляет собой изопропил или трет-бутил. 16. Способ по п.14, отличающийся тем, что на стадии (а) в качестве активирующего средства используют хлороформиат или Boc2O. 17. Способ по п.14, отличающийся тем, что соединение-источник азота, используемое на стадии (а),представляет собой аммиачный газ или аммонийную соль. 18. Способ по п.14, отличающийся тем, что на стадии (b) восстановление проводят с использованием ангидрида трифторметансульфоновой кислоты и Et3N или циануровой кислоты и DMF. 19. Способ по п.14, отличающийся тем, что на стадии (с) гидрирование проводят с использованием металла, выбранного из палладия, хлорида никеля (I), оксида платины (IV) и гидроксида палладия. 20. Способ по п.14, отличающийся тем, что на стадии (с) гидрирование проводят с использованием гидроксида палладия, уксусной кислоты и водорода.
МПК / Метки
МПК: C07D 471/04, C07D 211/36, A61P 3/10, A61K 31/45
Метки: способ, лекарственного, средства, синтеза, соединения, получения, промежуточного
Код ссылки
<a href="https://eas.patents.su/14-22500-sposob-polucheniya-promezhutochnogo-soedineniya-dlya-sinteza-lekarstvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения промежуточного соединения для синтеза лекарственного средства</a>
Предыдущий патент: Способ получения экологически чистого высокооктанового бензина
Следующий патент: Агонисты gpr 119
Случайный патент: Применение макролидов для лечения флегмоны кишечника


















