Способ получения иминного промежуточного соединения
Номер патента: 9659
Опубликовано: 28.02.2008
Авторы: Верецкеине Донат Дьёрдьи, Якфальви Элемер, Шимиг Дьюла, Мемет Норберт, Краснаи Дьёрдь, Котаи Надь Петер, Надь Калман, Баркоци Йожеф, Грегорне Борош Ливия
Формула / Реферат
1. Способ получения [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталин-1-илиден]метиламина формулы
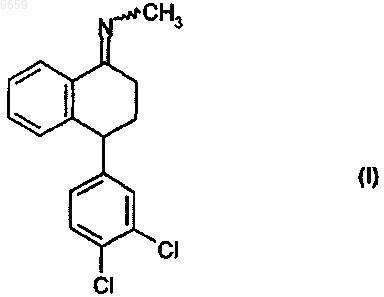
осуществлением реакции 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталин-1-она формулы
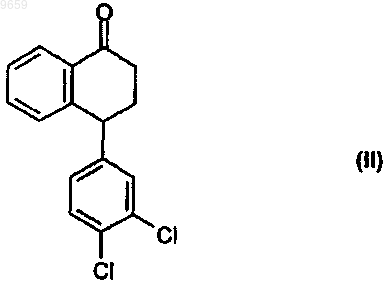
с монометиламином, при котором указанную реакцию проводят в присутствии тионилхлорида в растворителе типа простого эфира.
2. Способ по п.1, где в качестве растворителя типа простого эфира используют тетрагидрофуран, диоксан, диэтиловый эфир, диизопропиловый эфир или метил-трет-бутиловый эфир.
3. Способ по п.2, где в качестве растворителя типа простого эфира используют тетрагидрофуран.
4. Способ по любому из пп.1-3, где указанную реакцию проводят при температуре от -30 до +40шС.
5. Способ по п.4, где указанную реакцию проводят при температуре от -10 до+25шС.
6. Способ по п.1, где время реакции составляет от 0,5 до 5 ч.
7. Способ по п.6, где время реакции составляет от 1 до 3 ч.
8. Способ по п.1, в котором тионилхлорид используют в количестве 1,1-5,0 моль относительно
1 моль соединения формулы (II).
9. Способ по п.8, в котором тионилхлорид используют в количестве 1,5-2,0 моль относительно
1 моль соединения формулы (II).
10. Способ по любому из пп.1-9 получения смеси (+)- и (-)-энантиомеров соединения формулы (I), обогащенной (+)-энантиомером, который включает использование в качестве исходного вещества смеси (+)- и (-)-энантиомеров соединения формулы (II), обогащенной (+)-энантиомером.
11. Способ получения (+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина, который включает осуществление реакции 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталин-1-она формулы (II) с монометиламином в присутствии тионилхлорида в растворителе типа простого эфира и последующее осуществление каталитического гидрирования образовавшегося [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталин-1-илиден]метиламина формулы (I) в том же растворителе.
12. Способ по п.11, при котором в качестве растворителя типа простого эфира используют тетрагидрофуран, диоксан, диэтиловый эфир, диизопропиловый эфир или метил-трет-бутиловый эфир.
13. Способ по п.12, при котором в качестве растворителя типа простого эфира используют тетрагидрофуран.
14. Способ получения цис-(1S)(4S)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина и его фармацевтически приемлемых кислотно-аддитивных солей, предпочтительно гидрохлорида, при котором осуществляют реакцию 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталин-1-она формулы (II) с монометиламином в присутствии тионилхлорида в растворителе типа простого эфира; осуществляют каталитическое гидрирование образовавшегося [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2Н)-нафталин-1-илиден]метиламина формулы (I) в том же растворителе; разделяют полученный таким образом (+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин и, возможно, превращают (+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин в его фармацевтически приемлемую кислотно-аддитивную соль, предпочтительно гидрохлорид.
15. Способ по п.14, где в качестве растворителя типа простого эфира используют тетрагидрофуран, диоксан, диэтиловый эфира, диизопропиловый эфир или метил-трет-бутиловый эфир.
16. Способ по п.15, где в качестве растворителя типа простого эфира используют тетрагидрофуран.
Текст
009659 Область изобретения Изобретение относится к новому улучшенному способу получения соединения кетимина, которое является полезным фармацевтическим промежуточным соединением. Более подробно, изобретение относится к новому улучшенному способу получения [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)нафталин-1-илиден]метиламина формулы Соединение формулы (I) является ценным промежуточным соединением, которое можно использовать в фармацевтической промышленности при получении цис-(1S)(4S-N-метил-4-(3,4-дихлорфенил)1,2,3,4-тетрагидро-1-нафталинамин гидрохлорида (международное непатентованное название сертралин), являющегося высокоэффективным антидепрессантом. Предшествующий уровень техники Впервые получение соединения формулы (I) было описано в US 4536518. Согласно этому патенту 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-он (тетралон) формулы связывают с метиламином в присутствии тетрахлорида титана. Метиламин используют в шестикратном молярном избытке, и образующиеся метиламин хлоргидрат и диоксид титана удаляют из реакционной смеси фильтрованием. Недостаток данного способа заключается в том, что тетрахлорид титана является высоко агрессивным продуктом, с которым трудно работать. Реакцию согласно US 4855500 проводят в апротонном растворителе под давлением в присутствии молекулярного сита. Выход составляет 87%. Однако данный способ имеет недостаток, который состоит в том, что молекулярное сито очень дорогое, и реакция идет довольно медленно. По вышеизложенной причине способ, в котором используют молекулярное сито, не подходит для экономного производства требуемого соединения. Согласно ЕР 1047666 тетралон реагирует с метиламином в протонном растворителе при температуре от 50 до 110 С. Несмотря на использование высокой температуры и давления, конверсия в реакции не выше 95-98%. Существенный недостаток этого способа состоит в том, что реакцию следует проводить в специальном напорном аппарате. Согласно WO 00/26181 реакцию проводят в протонном растворителе в присутствии дегидратирующего агента и катализатора, содержащего сульфоновую кислоту, или цеолит, или силикат. Выход получаемого [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-илиден]метиламина составляет от 66 до 86%. Согласно способу, описанному в WO 01/36377, проводят реакцию смеси, содержащей 75-95% 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-она и 25-5% 4-(2,3-дихлорфенил)-3,4-дигидро-2 Ннафталин-1-она, в растворителе с метиламином в присутствии катализатора, который содержит сульфоновую кислоту, или цеолит, или силикат, либо в присутствии дегидратирующего агента под давлением при температуре от 50 до 70 С. Перечислено большое число растворителей. Продукт очищают кристаллизацией с получением соединения [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1 илиден]метиламина с чистотой выше 99%. Согласно способу, описанному в WO 02/096860, [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)нафталин-1-илиден]метиламин получают в реакции 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1 она с метиламином в амидсодержащем растворителе в условиях кислотного катализа. При таких условиях реакция идет довольно медленно и требует 10 ч. Согласно HU 98/01024 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-он реагирует с метиламином в низшем спирте с образованием [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1 илиден]метиламина. HU 98/01025 относится к способу восстановления, согласно которомуN-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина предпочтительно в растворителе эфирного типа, особенно в тетрагидрофуране. Краткое изложение сущности изобретения Задача изобретения состоит в упразднении вышеперечисленных недостатков известных способов и предложении нового способа получения [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1 илиден]метиламина формулы (I) в промышленных масштабах. Вышеизложенная задача решается предложенным способом по настоящему изобретению. Согласно настоящему изобретению разработан способ получения [4(S,R)-(3,4-дихлорфенил)-3,4 дигидро-1(2 Н)-нафталин-1-илиден]метиламина формулы(I) осуществлением реакции 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-она формулы (II) с монометиламином, при котором указанную реакцию проводят в присутствии тионилхлорида в растворителе типа простого эфира. Подробное описание изобретения Настоящее изобретение основано на неожиданном открытии того факта, что при проведении реакции без использования спиртового растворителя, тетрахлорида титана и молекулярного сита, как предлагается в известных методах, можно получить соединение формулы (I) за очень короткое время и с превосходным выходом 99,5%, проводя реакцию 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-она формулы (II) с монометиламином в присутствии тионилхлорида в растворителе типа простого эфира. В качестве растворителя типа простого эфира можно использовать предпочтительно тетрагидрофуран, диоксан, диэтиловый эфир, диизопропиловый эфир или метил-трет-бутиловый эфир, особенно тетрагидрофуран. Реакцию проводят при температуре от -30 до +40 С, предпочтительно от-10 до +25 С. Реакцию можно осуществлять при атмосферном давлении без нагревания. Реакционное время мало даже при таких мягких реакционных условиях и составляет 0,5-5,0 ч, предпочтительно 1-3 ч. Монометиламин используют в избытке относительно соединения формулы (II), обычно в 5-15 молярном избытке, предпочтительно в 10-12 молярном избытке. Тионилхлорид используют в количестве 1,1-5,0 моль, предпочтительно 1,5-2,0 моль, относительно 1 моль соединения формулы (II). Относительно формы осуществления настоящего изобретения предлагается получать смесь (+)- и -энантиомеров соединения формулы (I), обогащенную (+)-энантиомером, с использованием в качестве исходного материала смеси (+)- и (-)-энантиомеров соединения формулы (II), обогащенной[4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1 илиден]метиламин формулы (I) можно при желании путем каталитического гидрирования превратить в(+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин (рацемический сертралин). Согласно еще одному аспекту настоящего изобретения предложен способ получения(+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина, при котором осуществляют взаимодействие 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-она формулы (II) с монометиламином в присутствии тионилхлорида в растворителе типа простого эфира и затем каталитическое гидрирование образовавшегося таким образом [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1 илиден]метиламина формулы (I) в том же растворителе. В качестве растворителя типа простого эфира можно предпочтительно использовать тетрагидрофуран, диоксан, диэтиловый эфир, диизопропиловый эфир или метил-трет-бутиловый эфир, особенно тетрагидрофуран. Каталитическое гидрирование можно проводить предпочтительно в присутствии Pd/C катализатора,предпочтительно при атмосферном давлении и комнатной температуре. Полученный таким образом рацемический сертралин можно превратить в фармацевтически приемлемую кислотно-аддитивную соль, предпочтительно в гидрохлорид. Согласно еще одному аспекту настоящего изобретения предложен способ получения цис-(1S)(4S)N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина и его фармацевтически приемлемой кислотно-аддитивной соли, предпочтительно гидрохлорида, при котором осуществляют реакцию 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-она формулы (II) с монометиламином в присутствии тионилхлорида в растворителе типа простого эфира, каталитическое гидрирование полученного таким образом [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-илиден]метиламина формулы (I) в том же растворителе, затем разделение полученного таким образом (+/-)-цис-N-метил-4-(3,4-дихлорфенил)1,2,3,4-тетрагидро-1-нафталинамина и при желании превращение продукта в фармацевтически приемлемую кислотно-аддитивную соль, предпочтительно гидрохлорид. В качестве растворителя типа простого эфира можно использовать предпочтительно тетрагидрофуран, диоксан, диэтиловый эфир, диизопропиловый эфир или метил-трет-бутиловый эфир, особенно тетрагидрофуран. Разделение рацемического сертралина проводят известными методами, описанными в предшествующем уровне техники, предпочтительно используя оптически активную амигдалиновую кислоту. Существенное преимущество вышеописанной формы осуществления способа по настоящему изобретению состоит в том, что полученное согласно настоящему изобретению соединение формулы (I)-2 009659 можно непосредственно превратить в рацемический сертралин каталитическим гидрированием без смены растворителя, т.е. в том же самом растворителе, в смеси, образующейся в ходе его получения, после чего можно получить фармацевтически активный компонент цис-(1S)(4S)-N-метил-4-(3,4-дихлорфенил)1,2,3,4-тетрагидро-1-нафталинамин гидрохлорид путем разделения и солеобразовании, осуществленных известными методами. По сравнению со способами, описанными в предшествующем уровне техники, способ по настоящему изобретению имеет следующие преимущества: образование кетимина формулы (I) и каталитическое восстановление можно проводить в одном и том же растворителе; время реакции чрезвычайно мало, что представляет собой ценное технологическое преимущество с точки зрения производительности; реакцию можно проводить без использования высокого давления и высокой температуры; конверсия и выход очень высоки; получается продукт высокой чистоты. Кроме того, способ также можно без труда осуществлять в промышленных масштабах. Дальнейшие подробности настоящего изобретения можно найти в следующих примерах, которые не ограничивают объем защиты изобретения. Пример 1. Способ получения[4(S,R)-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1 илиден]метиламина. 4-(3,4-Дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-он массой 9 г (30,8 мМ) растворяли в 140 мл тетрагидрофурана. Раствор охлаждали до -10 С и вводили 12,6 г (400 мМ) газообразного метиламина. К реакционной смеси при перемешивании добавляли 4,2 мл (60 мМ) тионилхлорида при -10 С. После завершения добавления реакционную смесь перемешивали при комнатной температуре. Реакцию контролировали ГХ. Реакционную смесь перемешивали, пока количество исходного вещества не уменьшилось до уровня ниже 0,3%. Тетрагидрофурановую фазу отделяли от выпавшего в осадок гидрохлорида метиламина, выпаривали и остаток суспендировали в 20 мл холодного метанола. Полученные кристаллы сушили под инфракрасной лампой. Таким образом, получали 8,7 г требуемого соединения, выход 93%. Точка плавления: 147-148 С. ИКС (KBr): 1625, 1468, 1056, 764. 1 Н-ЯМР (CDCl3, i400): 8,20 (1 Н, dd, J1=7,3 Гц, J2=1,9 Гц), 7,3 m (2H), 7,19 (1H, d, J=2,0 Гц), 6,89 m(2H), 4,15 (1H, dd, J1=4,5 Гц, J2=6,8 Гц), 3,17 s (3H), 2,52 m (2H), 2,28 m (1H), 2,13 m (1H). Пример 2. Получение (+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина. 4-(3,4-Дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-он массой 9 г (30,8 мМ) растворяли в 140 мл тетрагидрофурана. Раствор охлаждали до -10 С и вводили 12,6 г (400 мМ) газообразного метиламина. К реакционной смеси при перемешивании добавляли 4,2 мл (60 мМ) тионилхлорида при -10 С. После завершения добавления реакционную смесь перемешивали при комнатной температуре. Реакцию контролировали ГХ. Реакционную смесь перемешивали, пока количество исходного вещества не уменьшилось до уровня ниже 0,3%. Тетрагидрофурановую фазу отделяли от метиламина частичным выпариванием. К 6,5 мл остаточного тетрагидрофуранового раствора добавляли 52 мл смеси 1:1 водного раствора хлорида калия и метанола и затем 1 г Pd/C катализатора (8% Pd, 28% С, 64% Н 2 О). Реакционную смесь при перемешивании промывали струей азота и затем гидрировали при атмосферном давлении и комнатной температуре. Гидрирование продолжали до тех пор, пока не был израсходован [4(S,R)-(3,4-дихлорфенил)3,4-дигидро-1(2 Н)-нафталин-1-илиден]метиламин. После завершения гидрирования реакционную смесь фильтровали и фильтрат подкисляли концентрированной водной соляной кислотой при комнатной температуре. Выпавшие в осадок кристаллы отфильтровывали. Таким образом, получали 8,6 г требуемого соединения, выход 82%. Точка плавления: 280-283 С. ИКС (KBr): 3340, 3021, 1469, 1396, 878. 1 Н-ЯМР (CDCl3, i400): 10,03 (1H, s), 9,93 (1H, s), 7,77 (1H, d, J=7,4 Гц), 7,41 (1H, d, J=1,9 Гц), 7,36(1H, d, J=8,2 Гц), 7,2 (3H, m), 6,87 (1H, d, J=7,5 Гц), 4,3 (1H, kv, J=4,9 Гц), 4,00 (1H, dd, J1=5,4 Гц,J2=8,4 Гц), 2,58 (3H, t, J=5,4 Гц), 2,3 (2H, m), 2,1(2H, m). Пример 3. Получение цис-(1S)(4S)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1 нафталинамин гидрохлорида (сертралина гидрохлорид). От (+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин гидрохлорида отделяли основание, которое затем подвергали повторному растворению с амигдалиновой кислотой. Сертралин в форме основания выделяли и превращали в гидрохлорид. Требуемое соединение получали с выходом 46%. Точка плавления: 243-245 С. Оптическое вращение: []D22=+37,7 (с=2, метанол). ИКС (KBr): 3340, 3021, 1469, 1396, 878. 1 Н-ЯМР (CDCl3, i400): 10,03 (1 Н, s), 9,93 (1H, s), 7,77 (1H, d, J=7,4 Гц), 7,41 (1H, d, J=1,9 Гц), 7,36 с монометиламином, при котором указанную реакцию проводят в присутствии тионилхлорида в растворителе типа простого эфира. 2. Способ по п.1, где в качестве растворителя типа простого эфира используют тетрагидрофуран,диоксан, диэтиловый эфир, диизопропиловый эфир или метил-трет-бутиловый эфир. 3. Способ по п.2, где в качестве растворителя типа простого эфира используют тетрагидрофуран. 4. Способ по любому из пп.1-3, где указанную реакцию проводят при температуре от -30 до +40 С. 5. Способ по п.4, где указанную реакцию проводят при температуре от -10 до+25 С. 6. Способ по п.1, где время реакции составляет от 0,5 до 5 ч. 7. Способ по п.6, где время реакции составляет от 1 до 3 ч. 8. Способ по п.1, в котором тионилхлорид используют в количестве 1,1-5,0 моль относительно 1 моль соединения формулы (II). 9. Способ по п.8, в котором тионилхлорид используют в количестве 1,5-2,0 моль относительно 1 моль соединения формулы (II). 10. Способ по любому из пп.1-9 получения смеси (+)- и (-)-энантиомеров соединения формулы (I),обогащенной (+)-энантиомером, который включает использование в качестве исходного вещества смеси(+)- и (-)-энантиомеров соединения формулы (II), обогащенной (+)-энантиомером. 11. Способ получения (+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина,который включает осуществление реакции 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-она формулы (II) с монометиламином в присутствии тионилхлорида в растворителе типа простого эфира и последующее осуществление каталитического гидрирования образовавшегося [4(S,R)-(3,4-дихлорфенил)3,4-дигидро-1(2 Н)-нафталин-1-илиден]метиламина формулы (I) в том же растворителе. 12. Способ по п.11, при котором в качестве растворителя типа простого эфира используют тетрагидрофуран, диоксан, диэтиловый эфир, диизопропиловый эфир или метил-трет-бутиловый эфир. 13. Способ по п.12, при котором в качестве растворителя типа простого эфира используют тетрагидрофуран. 14. Способ получения цис-(1S)(4S)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1 нафталинамина и его фармацевтически приемлемых кислотно-аддитивных солей, предпочтительно гидрохлорида, при котором осуществляют реакцию 4-(3,4-дихлорфенил)-3,4-дигидро-1(2 Н)-нафталин-1-она формулы (II) с монометиламином в присутствии тионилхлорида в растворителе типа простого эфира; осуществляют каталитическое гидрирование образовавшегося [4(S,R)-(3,4-дихлорфенил)-3,4-дигидро 1(2 Н)-нафталин-1-илиден]метиламина формулы (I) в том же растворителе; разделяют полученный таким образом (+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин и, возможно, превращают (+/-)-цис-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин в его фармацевтически приемлемую кислотно-аддитивную соль, предпочтительно гидрохлорид. 15. Способ по п.14, где в качестве растворителя типа простого эфира используют тетрагидрофуран,диоксан, диэтиловый эфира, диизопропиловый эфир или метил-трет-бутиловый эфир. 16. Способ по п.15, где в качестве растворителя типа простого эфира используют тетрагидрофуран. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07C 249/02, C07C 209/26, C07C 211/42, C07C 251/20
Метки: соединения, иминного, способ, получения, промежуточного
Код ссылки
<a href="https://eas.patents.su/5-9659-sposob-polucheniya-iminnogo-promezhutochnogo-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения иминного промежуточного соединения</a>
Предыдущий патент: Способ осуществления торгов (варианты)
Следующий патент: Стабильный пенистый крем для ухода за кожей









