Способы получения твердой дисперсии лекарственного средства и твердые дисперсии лекарственного средства, полученные этим способом
Номер патента: 18811
Опубликовано: 30.10.2013
Авторы: Битторф Кевин Джон, Гаспар Филипе, Кацтра Джеффри П.
Формула / Реферат
1. Способ получения твердой дисперсии лекарственного средства, включающий:
a) получение раствора или суспензии лекарственного средства в системе растворителей, где система растворителей включает один или более нелетучих растворителей, выбранных из группы, состоящей из ледяной уксусной кислоты и воды; и
b) распылительную сушку раствора или суспензии лекарственного средства с образованием твердой дисперсии, где лекарственное средство представляет собой соединение формулы
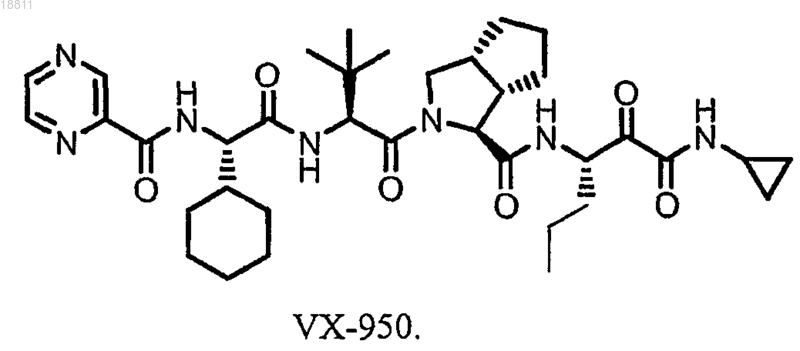
2. Способ по п.1, в котором нелетучий растворитель присутствует в количестве от примерно 0,1 до примерно 20 мас.%.
3. Способ по п.1, в котором система растворителей дополнительно включает один или более летучих растворителей, выбранных из хлористого метилена и ацетона.
4. Способ по п.1, в котором нелетучий растворитель включает ледяную уксусную кислоту.
5. Способ по п.3, в котором система растворителей включает хлористый метилен, ацетон и ледяную уксусную кислоту.
6. Способ по п.5, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты.
7. Способ по п.1, в котором нелетучий растворитель включает воду.
8. Способ по п.1, в котором система растворителей включает хлористый метилен, ацетон и воду.
9. Способ по п.8, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды.
10. Способ по п.1, в котором раствор или суспензия лекарственного средства дополнительно включает поверхностно-активное вещество, где поверхностно-активное вещество представляет собой лаурилсульфат натрия.
11. Способ по п.1, в котором раствор или суспензия лекарственного средства дополнительно включает сукцинат ацетата гидроксипропилметилцеллюлозы.
12. Способ по п.11, в котором твердая дисперсия представляет собой аморфную твердую дисперсию.
13. Способ по п.1, в котором раствор или суспензия лекарственного средства дополнительно включает смесь из двух полимеров: гидроксипропилметилцеллюлозы и сукцинат ацетата гидроксипропилметилцеллюлозы.
14. Способ по п.1, дополнительно включающий один или несколько полимеров, присутствующих в количестве от примерно 30 до примерно 70 мас.% твердой дисперсии.
15. Способ по п.1, в котором нелетучий растворитель присутствует в количестве от примерно 0,1 до примерно 20 мас.%.
16. Способ по п.3, в котором система растворителей включает комбинацию одного или более из летучих растворителей с одним или более из нелетучих растворителей.
17. Способ по п.16, в котором один или более из летучих растворителей включает хлористый метилен и ацетон.
18. Способ по п.16, в котором один или более из нелетучих растворителей включает ледяную уксусную кислоту.
19. Способ по п.16, в котором система растворителей включает хлористый метилен, ацетон и ледяную уксусную кислоту.
20. Способ по п.19, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты.
21. Способ по п.16, в котором нелетучий растворитель включает воду.
22. Способ по п.16, в котором система растворителей включает хлористый метилен, ацетон и воду.
23. Способ по п.22, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды.
24. Способ по п.11, в котором система растворителей включает ледяную уксусную кислоту.
25. Способ по п.11, в котором система растворителей включает воду.
26. Способ по п.11, в котором раствор или суспензия лекарственного средства дополнительно включает поверхностно-активное вещество, где поверхностно-активное вещество представляет собой лаурилсульфат натрия.
27. Способ получения твердой дисперсии лекарственного средства, включающий:
a) получение раствора или суспензии лекарственного средства, сукцинат ацетата гидроксипропилметилцеллюлозы и систему растворителей, включающую по меньшей мере один нелетучий растворитель, выбранный из группы, состоящей из ледяной уксусной кислоты и воды; и
b) распылительную сушку раствора или суспензии лекарственного средства с образованием твердой дисперсии, где лекарственное средство представляет собой соединение формулы
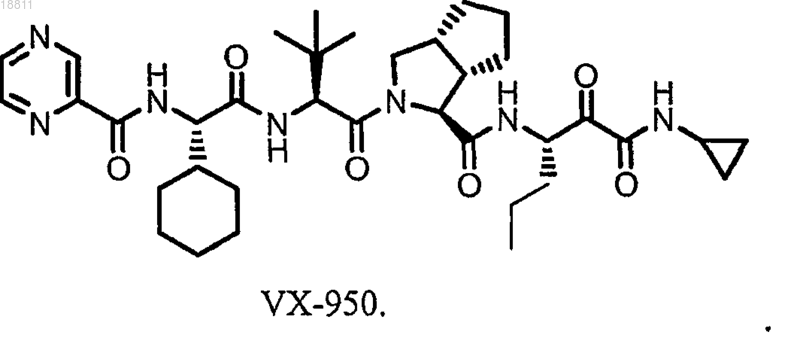
28. Способ по п.27, дополнительно включающий гидроксипропилметилцеллюлозу.
29. Способ по п.27, в котором сукцинат ацетата гидроксипропилметилцеллюлозы присутствует в количестве от примерно 30 до примерно 90 мас.% твердой дисперсии.
30. Способ по п.27, в котором система растворителей дополнительно включает один или более летучих растворителей, выбранных из хлористого метилена и ацетона.
31. Способ по п.30, в котором один или более из нелетучих растворителей присутствует в количестве от примерно 0,1 до примерно 20 мас.%.
32. Способ по п.30, в котором система растворителей включает комбинацию одного или более из летучих растворителей с одним или более нелетучим растворителем.
33. Способ по п.32, в котором один или более из летучих растворителей включает хлористый метилен и ацетон.
34. Способ по п.33, в котором система растворителей включает хлористый метилен, ацетон и нелетучий растворитель в процентном весовом соотношении примерно 75:24:1.
35. Способ по п.32, в котором нелетучий растворитель включает ледяную уксусную кислоту.
36. Способ по п.32, в котором система растворителей включает хлористый метилен, ацетон и ледяную уксусную кислоту.
37. Способ по п.36, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты.
38. Способ по п.32, в котором нелетучий растворитель включает воду.
39. Способ по п.32, в котором комбинация растворителей включает хлористый метилен, ацетон и воду.
40. Способ по п.39, в котором комбинация растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды.
41. Способ по п.27, в котором система растворителей включает ледяную уксусную кислоту.
42. Способ по п.27, в котором система растворителей включает воду.
43. Способ по п.27, в котором смесь дополнительно включает лаурилсульфат натрия.
44. Способ по п.1, включающий:
a) получение раствора содержащего VX-950 и растворитель, в котором растворитель включает по меньшей мере один нелетучий растворитель, выбранный из ледяной уксусной кислоты и воды, и раствор дополнительно включает целлюлозный полимер, выбранный из гидроксипропилметилцеллюлозы, и сукцинат ацетата гидроксипропилметилцеллюлозы;
b) распылительную сушку смеси с образованием твердой аморфной дисперсии, включающей VX-950 и целлюлозный полимер.
45. Способ по п.1, включающий:
a) получение смеси, содержащей VX-950 и растворитель, в котором растворитель включает ледяную уксусную кислоту, и смесь дополнительно включает по меньшей мере один целлюлозный полимер, выбранный из гидроксипропилметилцеллюлозы и сукцинат ацетата гидроксипропилметилцеллюлозы; и
b) распылительную сушку смеси с образованием твердой дисперсии, включающей VX-950.
46. Способ по п.1, включающий:
a) получение смеси, содержащей VX-950 и растворитель, в котором растворитель включает воду, и смесь дополнительно включает по меньшей мере один целлюлозный полимер, выбранный из гидроксипропилметилцеллюлозы и сукцинат ацетата гидроксипропилметилцеллюлозы, и
b) распылительную сушку смеси с образованием твердой дисперсии, включающей VX-950.
47. Способ по п.1, в котором VX-950 высушен распылением.
48. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.1.
49. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.27.
50. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.44.
51. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.45.
52. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.46.
Текст
СПОСОБЫ ПОЛУЧЕНИЯ ТВЕРДОЙ ДИСПЕРСИИ ЛЕКАРСТВЕННОГО СРЕДСТВА И ТВЕРДЫЕ ДИСПЕРСИИ ЛЕКАРСТВЕННОГО СРЕДСТВА, ПОЛУЧЕННЫЕ ЭТИМ СПОСОБОМ Описываются варианты способа получения твердой дисперсии лекарственного средства,включающие получение раствора или суспензии лекарственного средства в системе растворителей,где система растворителей включает один или более нелетучих растворителей, выбранных из группы, состоящей из ледяной уксусной кислоты и воды; и распылительную сушку раствора или суспензии лекарственного средства с образованием твердой дисперсии, где лекарственное средство представляет собой соединение формулы. Также описываются варианты твердой дисперсии лекарственного средства, обладающей противовирусной активностью и полученной в соответствии с предложенными способами.(71)(73) Заявитель и патентовладелец: ВЕРТЕКС ФАРМАСЬЮТИКАЛЗ ИНКОРПОРЕЙТЕД (US) Перекрестная ссылка на родственные зявки Настоящая заявка испрашивает на приоритет заявки США, регистрационный номер 60/784275, поданной 20 марта 2006, и заявки США регистрационный номер 60/871692, поданной 22 декабря 2006. Описания предшествующих заявок рассматриваются как часть (и включены в качестве ссылки) описания настоящей заявки. Область техники, к которой относится изобретение Настоящее изобретение относится к фармацевтическим композициям и способу их приготовления. Уровень техники В фармацевтической области техники известно, что слаборастворимые лекарственные средства часто демонстрируют низкую биологическую доступность или неравномерное всасывание, на степень указанной неравномерности влияют такие факторы, как уровень дозировки, степень сытости пациента и форма лекарственного средства. Твердые дисперсии лекарственного средства в матриксе могут быть приготовлены получением гомогенного раствора или расплава лекарственного средства и материала матрикса с последующим отверждением смеси при помощи охлаждения или удаления растворителя. Такие твердые дисперсии лекарственных средств часто демонстрируют улучшенную биологическую доступность при пероральном применении по сравнению с пероральными композициями, включающими недиспергированное лекарственное средство. Распылительная сушка представляет собой наиболее используемый промышленный способ, включающий образование частиц и высушивание, и может быть использована для получения твердых дисперсий лекарственных соединений. Она в высокой степени пригодна для непрерывного получения сухих твердых веществ в виде порошка или в форме гранул или агломерата из жидкого исходного сырья, такого как растворы, эмульсии и перекачиваемые суспензии. Таким образом, распылительная сушка представляет собой идеальный способ, в котором конечный продукт должен соответствовать точным стандартам качества, касающимся распределения размеров частиц, остаточному содержанию влаги, объемной плотности и размера частиц. Распылительная сушка обычно включает распыление жидкого исходного сырья в виде аэрозоля или капель и контакт капель с горячим воздухом или газом в сушильной камере. Аэрозоли обычно получают или при помощи центробежного (дискового), или соплового распылителя. Сущность изобретения Заявители обнаружили, что изменение растворителя, например, включая нелетучий растворитель или растворитель с высокой температурой кипения, в ходе распылительной сушки лекарственного средства VX-950 (например, твердой дисперсии лекарственного средства или терапевтического агента), может улучшать свойства полученного продукта (например, твердой дисперсии, такой как аморфная твердая дисперсия лекарственного средства или терапевтического агента). В некоторых случаях, включение нелетучего растворителя или растворителя с высокой температурой кипения в качестве компонента смеси растворителя в способе распылительной сушки может привести к увеличению времени, требуемого для отверждения и/или сушки полученных частиц, таким образом, в некоторых случаях приводя к получению улучшенных частиц, например, частиц, которые являются более крупными и/или плотными, и/или более сыпучими по сравнению с такими же частицами, которые были получены при использовании системы растворителей без нелетучего растворителя или растворителя с высокой температурой кипения. В некоторых случаях, включение нелетучего растворителя или растворителя с высокой температурой кипения в качестве компонента смеси растворителя в способе распылительной сушки может облегчать растворение компонента (например, поверхностно-активного вещества или полимера), который присутствует в исходном растворе (например, растворе или суспензии, подвергаемой распылительной сушке). Распылительную сушку можно использовать для получения твердой дисперсии, например при использовании гомогенного раствора, расплава или суспензии лекарственного средства и материала матрицы, с последующим отверждением смеси охлаждением или удалением растворителя. В одном аспекте способ распылительной сушки лекарственного средства VX-950 включает получение смеси лекарственного средства в пригодном растворителе или комбинации растворителей, где по крайней мере один растворитель представляет собой нелетучий растворитель или растворитель с высокой температурой кипения, с получением смеси лекарственного средства и растворителя, и последующую распылительную сушку смеси с получением аморфного продукта лекарственного средства. Полученный продукт лекарственного средства может, например, иметь объемную массу от примерно 0,25 до примерно 0,50, например от примерно 0,35 до примерно 0,45, например, примерно 0,37 или примерно 0,41. Полученный продукт лекарственного средства может, например, иметь d50 от примерно 35 до примерно 55, например, от примерно 40 до примерно 50, например, примерно 43 или примерно 47. Смесь может представлять собой или раствор, или суспензию. В некоторых вариантах осуществления способ распылительной сушки лекарственного средстваVX-950 включает получение смеси лекарственного средства в пригодном растворителе или комбинации растворителей, где по крайней мере один растворитель представляет собой нелетучий растворитель или растворитель с высокой температурой кипения, с получением смеси лекарственного средства и раство-1 018811 рителя, и последующую распылительную сушку смеси с получением аморфного продукта лекарственного средства, с обеспечением того, что лекарственное средство отличается от N-[2,4-бис(l,1-диметилэтил)5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида. Лекарственное средство представляет собой противовирусный аген,т используемый для лечения гепатита С (НерС), такой как ингибитор протеазы НерС, представляющий собой VX-950: В некоторых вариантах осуществления растворитель представляет собой комбинацию компонентов растворителя, включающую по крайней мере один нелетучий растворитель. Например, растворитель представляет собой комбинацию компонентов, которая включает одновременно летучий растворитель и нелетучий растворитель. Примеры пригодных летучих растворителей включают такие, которые растворяют или суспендируют лекарственное средство или сами по себе, или в комбинации с другим дополнительным растворителем. В некоторых предпочтительных примерах растворитель или комбинация растворителей полностью растворяют лекарственное средство. Примеры летучих растворителей включают хлористый метилен, ацетон, хлороформ и ТГФ. Примеры нелетучих растворителей включают органические кислоты, такие как ледяная уксусная кислота,ДМСО, ДМФА и воду. В некоторых вариантах осуществления нелетучий растворитель представляет собой компонент в системе растворителей. Например, нелетучий растворитель присутствует в качестве компонента в растворителе в количестве от примерно 0,1 до примерно 20 мас.% (например, от примерно 0,5 до примерно 3%, от примерно 1 до примерно 5%, от примерно 3 до примерно 15%, от примерно 4 до примерно 12% или от примерно 5 до примерно 10%). В некоторых предпочтительных вариантах осуществления система растворителя представляет собой комбинацию летучего растворителя или комбинацию растворителей, таких как хлористый метилен и ацетон, с нелетучим растворителем, таким как ледяная уксусная кислота. Например, система растворителя включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 3 до примерно 12% ледяной уксусной кислоты). В некоторых вариантах осуществления система растворителя включает ледяную уксусную кислоту. В некоторых вариантах осуществления система растворителя включает комбинацию ледяной уксусной кислоты по крайней мере с одним летучим растворителем, таким как ацетон и/или хлористый метилен (например, смесь ацетона и хлористого метилена). В некоторых вариантах осуществления смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). В некоторых предпочтительных вариантах осуществления система растворителя представляет собой комбинацию летучего растворителя или комбинацию растворителей, таких как хлористый метилен и ацетон, с нелетучим растворителем, таким как вода. Например, система растворителя включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 1 до примерно 5% воды). В некоторых вариантах осуществления система растворителя включает воду. В некоторых вариантах осуществления система растворителя включает комбинацию воды с по крайней мере одним летучим растворителем, таким как ацетон и/или хлористый метилен (например,смесь хлористого метилена и ацетона). В некоторых вариантах осуществления смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). В другом аспекте способ распылительной сушки включает образование твердой дисперсии лекарственного средства VX-950 и одного или нескольких полимеров, включающий образование или обеспечение смеси лекарственного средства и полимера(ов) в пригодном растворителе или комбинации растворителей, где по крайней мере один растворитель представляет собой нелетучий или высококипящий растворитель, с образованием смеси лекарственного средства, полимера(ов) и растворителя, и последующую распылительную сушку смеси с получением твердой дисперсии продукта лекарственного средства. Полученный продукт лекарственного средства может, например, иметь объемную массу от примерно 0,25 до примерно 0,50, например от примерно 0,35 до примерно 0,45, например, примерно 0,37 или примерно 0,41. Полученный продукт лекарственного средства может, например, иметь d50 от примерно 35 до примерно 55, например, от примерно 40 до примерно 50, например примерно 43 или примерно 47. Смесь может представлять собой или раствор, или суспензию. В предпочтительном варианте осуществления продукт твердой дисперсии представляет собой аморфную твердую дисперсию, например аморфную твердую дисперсию, которая в значительной степени не содержит кристаллического продукта лекарственного средства. Примеры полимеров для твердой дисперсии включают один или несколько водно-растворимый(х) полимер(ов) или частично водно-растворимый(х) полимер(ов). Воднорастворимые или частично воднорастворимые полимеры включают, но не ограничиваются перечисленным, производные целлюлозы (например гидроксипропилметилцеллюлоза (НРМС; также известная как гипромеллоза), гидроксипропилцеллюлоза (НРС или этилцеллюлозу; поливинлпирролидоны (PVP); полиэтиленгликоли (PEG); поливиниловые спирты (PVA); акрилаты, такие как полиметакрилат (например, Eudragid Е); циклодекстрины (например, -циклодекстрин) и сополимеры и их производные, включая, например, PVP-VA (поливинилпирролидон-винилацетат). В некоторых предпочтительных вариантах осуществления полимер представляет собой гидроксипропилметилцеллюлозу (НРМС), такую как HMPC60SH50, НРМС Е 50 или НРМСЕ 15. В некоторых вариантах осуществления полимер представляет собой рН-зависимый энтеросолюбильный полимер. Такие рН-зависимые энтеросолюбильные полимеры включают, но не ограничиваются перечисленным, производные целлюлозы (например, фталат ацетата целлюлозы (САР, фталаты гидроксипропилметилцеллюлозы (НРМСР), сукцинат ацетата гидроксипропилметилцеллюлозы (HPMCAS; также известные как сукцинат ацетата гипромелозы), карбоксиметилцеллюлозу (CMC) или ее соли (например, натриевую соль, такую как (CMC-Na; тримелитат ацетата целлюлозы (CAT), фталат ацетата гидроксипропилцеллюлозы (НРСАР), фталат ацетата гидроксипропилметилцеллюлозы (НРМСАР) и фталат ацетата метилцеллюлозы (МСАР) или полиметилакрилаты (например, Eudragit S). В некоторых предпочтительных вариантах осуществления полимер представляет собой ацетат сукцината гидроксипропилметилцеллюлозы (HPMCAS), например НРМС AS-HG. В другом варианте осуществления полимер(ы) представляет собой нерастворимый сшитый полимер, например поливинилпирролидон (например, Crospovidone). В другом варианте осуществления полимер(ы) представляет собой поливинилпирролидон (PVP). В некоторых вариантах осуществления полимер представляет собой смесь двух или более полимеров (например, комбинацию двух целлюлозных полимеров, таких как НРМС и HPMCAS). В некоторых вариантах осуществления полимер(ы) присутствует в количестве от примерно 30 до примерно 70 мас.% твердой дисперсии. Лекарственное средство представляет собой противовирусный агент, используемый для лечения НерС, такой как ингибитор протеазы НерС, представляющий собой VX-950: В некоторых вариантах осуществления растворитель представляет собой комбинацию компонентов растворителя, включающую по крайней мере один нелетучий растворитель. Например, растворитель представляет собой комбинацию компонентов, которая включает одновременно летучий растворитель и нелетучий растворитель. Примеры пригодных летучих растворителей включают такие, которые растворяют или суспендируют лекарственное средство или сами по себе, или в комбинации с другим дополнительным растворителем. В некоторых предпочтительных примерах растворитель или комбинация растворителей полностью растворяют лекарственное средство. Примеры летучих растворителей включают хлористый метилен, ацетон, хлороформ и ТГФ. Примеры нелетучих растворителей включают органические кислоты, такие как ледяная уксусная кислота,ДМСО, ДМФА и воду. В некоторых вариантах осуществления нелетучий растворитель представляет собой компонент в системе растворителей. Например, нелетучий растворитель присутствует в качестве компонента в растворителе в количестве от примерно 0,1 до примерно 20 мас.%, (например, от примерно 0,5 до примерно 3%, от примерно 1 до примерно 5%, от примерно 3 до примерно 15%, от примерно 4 до примерно 12% или от примерно 5 до примерно 10%). В некоторых предпочтительных вариантах осуществления система растворителя представляет собой комбинацию летучего растворителя или комбинацию растворителей, таких как хлористый метилен и ацетон, с нелетучим растворителем, таким как ледяная уксусная кислота. Например, система растворителя включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 3 до при-3 018811 мерно 12% ледяной уксусной кислоты). В некоторых вариантах осуществления смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). В некоторых предпочтительных вариантах осуществления система растворителя представляет собой комбинацию летучего растворителя или комбинацию растворителей, таких как хлористый метилен и ацетон, с нелетучим растворителем, таким как вода. Например, система растворителя включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 1 до примерно 5% воды). В некоторых вариантах осуществления смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). В другом аспекте способ включает:a) образование или обеспечение смеси слабо растворимого в воде лекарственного средства VX-950 по крайней мере одного полимера и системы растворителя, включающей по крайней мере один нелетучий растворитель; иb) распылительную сушку смеси с образованием твердой дисперсии, включающей слабо растворимое в воде лекарственное средство с получением дисперсии лекарственного средства. Полученная дисперсия может, например, иметь объемную массу от примерно 0,25 до примерно 0,50, например от примерно 0,35 до примерно 0,45, например, примерно 0,37 или примерно 0,41. Полученная дисперсия может, например, иметь d50 от примерно 35 до примерно 55, например, от примерно 40 до примерно 50, например, примерно 43 или примерно 47. Лекарственное средство представляет собой противовирусный агент, используемый для лечения НерС, такой как ингибитор протеазы НерС, представляющий собой VX-950: В некоторых вариантах осуществления растворитель представляет собой комбинацию растворителей, включающую по крайней мере один нелетучий растворитель. Например, растворитель представляет собой комбинацию компонентов, которая включает одновременно летучий растворитель и нелетучий растворитель. Примеры пригодных летучих растворителей включают такие, которые растворяют или суспендируют лекарственное средство или сами по себе, или в комбинации с другим дополнительным растворителем. В некоторых предпочтительных примерах растворитель или комбинация растворителей полностью растворяют лекарственное средство. Примеры летучих растворителей включают хлористый метилен, ацетон, хлороформ и ТГФ. Примеры нелетучих растворителей включают органические кислоты, такие как ледяная уксусная кислота, ДМСО, ДМФА и воду. В некоторых вариантах осуществления нелетучий растворитель представляет собой компонент в системе растворителей. Например, нелетучий растворитель присутствует в качестве компонента в растворителе в количестве от примерно 0,1 до примерно 20 мас.% (например, от примерно 0,5 до примерно 3%, от примерно 1 до примерно 5%, от примерно 3 до примерно 15%, от примерно 4 до примерно 12% или от примерно 5 до примерно 10%). В некоторых предпочтительных вариантах осуществления система растворителя представляет собой комбинацию летучего растворителя, или комбинацию растворителей, таких как хлористый метилен и ацетон, с нелетучим растворителем, таким как ледяная уксусная кислота. Например, система растворителя включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 3 до примерно 12% ледяной уксусной кислоты). В некоторых предпочтительных вариантах осуществления система растворителя включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 1 до примерно 5% воды). В предпочтительном варианте осуществления смесь растворителя включает процентное соотношение хлористого метилена к ацетону и нелетучему компоненту, которое составляет 75:24:1. В некоторых вариантах осуществления смесь растворителей также включает поверхностноактивное вещество, например, лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). Примеры полимеров для твердой дисперсии включают один или несколько водно-растворимый(х) полимер(ов). Водно-растворимые или частично водно-растворимые полимеры включают, но не ограничиваются перечисленным, производные целлюлозы (например, гидроксипропилметилцеллюлозу(НРМС), гидроксипропилцеллюлозу (НРС или этилцеллюлозу; поливинлпирролидоны (PVP); полиэтиленгликоли (PEG); поливиниловые спирты (PVA); акрилаты, такие как полиметакрилат (например,Eudragid E); циклодекстрины (например, -циклодекстрин) и сополимеры и их производные, включая,например, PVP-VA (поливинилпирролидон-винилацетат). В некоторых предпочтительных вариантах осуществления полимер представляет собой гидроксипропилметилцеллюлозу (НРМС), такую как HMPC60SH50, НРМС Е 50 или НРМСЕ 15. В некоторых вариантах осуществления полимер представляет собой рН-зависимый энтеросолюбильный полимер. Такие рН-зависимые энтеросолюбильные полимеры включают, но не ограничиваются перечисленным, производные целлюлозы (например, фталат ацетата целлюлозы (САР, фталаты гидроксипропилметилцеллюлозы (НРМСР), сукцинат ацетата гидроксипропилметилцеллюлозы (HPMCAS; также известные как сукцинат ацетата гипромелозы), карбоксиметилцеллюлозу (CMC) или ее соли (например, натриевую соль, такую как (CMC-Na; тримелитат ацетата целлюлозы (CAT), фталат ацетата гидроксипропилцеллюлозы (НРСАР), фталат ацетата гидроксипропилметилцеллюлозы (НРМСАР) и фталат ацетата метилцеллюлозы (МСАР) или полиметилакрилаты (например, Eudragit S). В некоторых предпочтительных вариантах осуществления полимер представляет собой ацетат сукцината гидроксипропилметилцеллюлозы (HPMCAS), например НРМС AS-HG. В другом варианте осуществления полимер(ы) представляет собой нерастворимый сшитый полимер, например поливинилпирролидон (например, Crospovidone). В другом варианте осуществления полимер(ы) представляет собой поливинилпирролидон (PVP). В некоторых вариантах осуществления полимер представляет собой смесь двух или более полимеров (например, комбинацию двух целлюлозных полимеров, таких как НРМС и HPMCAS). В некоторых вариантах осуществления полимер(ы) присутствует в количестве от примерно 30 до примерно 90 мас.% твердой дисперсии. В некоторых вариантах осуществления смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). В другом аспекте описание обеспечивает способ получения твердой дисперсии VX-950, включающий:a) образование или обеспечение раствора, целлюлозного полимера и растворителя, где растворитель представлен по крайней мере одним нелетучим компонентом растворителя (например, ледяной уксусной кислотой);b) распылительную сушку смеси с образованием твердой дисперсии, включающей VX-950 и целлюлозный полимер. Полученная дисперсия может, например, иметь объемную массу от примерно 0,25 до примерно 0,50, например от примерно 0,35 до примерно 0,45, например примерно 0,37 или примерно 0,41. Полученная дисперсия может, например, иметь d50 от примерно 35 до примерно 55, например от примерно 40 до примерно 50, например примерно 43 или примерно 47. В некоторых вариантах осуществления полимер представляет собой НРМС, HPMCAS или их смесь. В некоторых предпочтительных вариантах осуществления полимер представляет собой HPMCAS или смесь НРМС и HPMCAS. Примеры пригодных летучих растворителей включают такие, которые растворяют или суспендируют лекарственное средство само по себе или в комбинации с другим сорастворителем. В некоторых предпочтительных вариантах осуществления растворитель или комбинация растворителей полностью растворяют лекарственное средство. Примеры летучих растворителей включают хлористый метилен, ацетон, хлороформ и ТГФ. Примеры нелетучих растворителей включают органические кислоты, такие как ледяная уксусная кислота, ДМСО, ДМФА и воду. В некоторых вариантах осуществления нелетучий растворитель представляет собой компонент в системе растворителей. Например, нелетучий растворитель присутствует в качестве компонента в растворителе в количестве от примерно 0,1 до примерно 20 мас.% (например, от примерно 0,5 до примерно 3%, от примерно 1 до примерно 5%, от примерно 3 до примерно 15%, от примерно 4 до примерно 12% или от примерно 5 до примерно 10%). В некоторых предпочтительных вариантах осуществления система растворителя представляет собой комбинацию летучего растворителя или комбинацию растворителей, таких как хлористый метилен и ацетон, с нелетучим растворителем, таким как ледяная уксусная кислота или вода. Например, система растворителя включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 3 до примерно 12% ледяной уксуной кислоты). Например, система растворителя включает от пример-5 018811 но 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 1 до примерно 5% воды). В некоторых вариантах осуществления смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). В некоторых вариантах осуществления система растворителя включает смесь хлористого метилена,ацетона и уксусной кислоты. В некоторых вариантах осуществления система растворителя включает смесь хлористого метилена,ацетона и воды. В другом аспекте данное описание обеспечивает способ получения твердой дисперсии VX-950,включающий:a) образование или обеспечение смеси VX-950 с по крайней мере одним целлюлозным полимером и растворителем, где растворитель включает ледяную уксусную кислоту; иb) распылительную сушку смеси с образованием твердой дисперсии, включающей VX-950. Полученная дисперсия может, например, иметь объемную массу от примерно 0,25 до примерно 0,50, например от примерно 0,35 до примерно 0,45, например примерно 0,37 или примерно 0,41. Полученная дисперсия может, например, иметь d50 от примерно 35 до примерно 55, например от примерно 40 до примерно 50, например примерно 43 или примерно 47. В некоторых вариантах осуществления полимер представляет собой НРМС, HPMCAS или их смесь. В некоторых предпочтительных вариантах осуществления полимер представляет собой HPMCAS или смесь НРМС и HPMCAS. В другом аспекте данное описание обеспечивает способ получения твердой дисперсии VX-950,включающий: а) образование или обеспечение смеси VX-950 с по крайней мере одним целлюлозным полимером и растворителем, где растворитель включает воду; иb) распылительную сушку смеси с образованием твердой дисперсии, включающей VX-950. Полученная дисперсия может, например, иметь объемную массу от примерно 0,25 до примерно 0,50, например от примерно 0,35 до примерно 0,45, например примерно 0,37 или примерно 0,41. Полученная дисперсия может, например, иметь d50 от примерно 35 до примерно 55, например, от примерно 40 до примерно 50, например, примерно 43 или примерно 47. В некоторых вариантах осуществления полимер представляет собой НРМС, HPMCAS или их смесь. В некоторых предпочтительных вариантах осуществления полимер представляет собой HPMCAS или смесь НРМС и HPMCAS. В некоторых вариантах осуществления растворитель включает летучий растворитель или комбинацию растворителей, которая растворяет или суспендирует лекарственное средство и полимер. В некоторых примерах растворитель или комбинация растворителей полностью растворяет лекарственное средство и полимер. В некоторых вариантах осуществления растворитель включает смесь хлористого метилена и ацетона. В некоторых вариантах осуществления ледяная уксусная кислота присутствует в качестве компоненты в растворителе от примерно 0,1 до примерно 20 мас.% (например, от примерно 3 до примерно 15%, от примерно 4 до примерно 12% или от примерно 5 до примерно 10%). В некоторых вариантах осуществления система растворителя включает смесь хлористого метилена,ацетона и ледяной уксусной кислоты. В некоторых вариантах осуществления система включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 3 до примерно 12% ледяной уксусной кислоты). В некоторых вариантах осуществления смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). В некоторых предпочтительных вариантах осуществления растворитель включает смесь хлористого метилена и ацетона. В некоторых вариантах осуществления вода присутствует в качестве компонента в растворителе от примерно 0,1 до примерно 20 мас.% (например, от примерно 3 до примерно 15%, от примерно 4 до примерно 12% или от примерно 1 до примерно 10%). В некоторых вариантах осуществления система растворителя включает смесь хлористого метилена,ацетона и воды. В некоторых вариантах осуществления система растворителя включает смесь хлористого метилена,ацетона и ледяной уксусной кислоты. В некоторых вариантах осуществления система включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 1 до примерно 5% воды). В некоторых вариантах осуществления смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (SLS) или витамин Е, или его производные (например, витамин Е TPGS). В одном аспекте описание обеспечивает продукт, полученный на основе описанного здесь процесса. Например, твердая дисперсию лекарственного средства VX-950, такая как аморфная твердая дисперсия лекарственного средства VX-950. Например, обеспечивают аморфную твердую дисперсию, включающую лекарственное средство VX-950, по крайней мере один полимер и необязательно одно или несколько поверхностно-активных веществ, повышающих растворимость (например, SLS или витамин ЕTPGS). Дисперсия может повысить растворимость в воде лекарственного средства VX-950 при пероральной дозировке твердой дисперсии млекопитающему (например, крыса, собака или человек). В определенных аспектах, по крайней мере часть лекарственного средства VX-950 в твердой дисперсии находиться в аморфном состоянии (например, примерно 50%, по крайней мере примерно 55%, по крайней мере примерно 60%, по крайней мере примерно 65%, по крайней мере примерно 70%, по крайней мере примерно 75%, по крайней мере примерно 80%, по крайней мере примерно 85%, по крайней мере примерно 90%, по крайней мере примерно 95%, по крайней мере примерно 98% или по крайней мере примерно 99%). В предпочтительных вариантах осуществления, твердая дисперсия в основном или в значительной степени не содержит кристаллического лекарственного средства VX-950. В предпочтительном варианте осуществления, твердая дисперсия получена на основе описанного здесь процесса, включает от примерно 45 до примерно 85% VX-950, примерно от 5 до примерно 25% НРМС полимера, такого как HPMC60SH50, от примерно 5 до примерно 30% HPMCAS полимера, такого как HPMCAS-HG и от примерно 0,1 до примерно 10% поверхностно-активного вещества, такого как SLS или витамин Е или его производные (например Е TPGS), где НРМС и HPMCAS совместно составляют примерно 90%, примерно 95%, примерно 98%, примерно 99% или примерно 100% всего присутствующего полимера. В предпочтительном варианте осуществления, твердая дисперсия полученная по описанному здесь способу обладает предварительно определенной физической и/или химической стабильностью. Например, твердая дисперсия сохраняет примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 90%, примерно 95%, примерно 98% или примерно 99% аморфного VX-950 при хранении при 25 С в прочно закрытом от воды контейнере, например в сосуде из желтого стекла или контейнере из полиэтилена высокой плотности (HDPE). Как будет понятно, распылительная сушка может проводиться в присутствии инертного газа. В определенных вариантах осуществления способы, которые включают распылительную сушку, могут осуществляться в присутствии сверхкритической жидкости, которая включает диоксид углерода или смесь диоксида углерода."Плохо растворимое лекарственное средство", как используется здесь, означает лекарственные средства, которые в основном полностью не растворимы в воде или мало растворимы в воде. Термин применим к любому лечебному терапевтическому агенту, имеющему соотношение дозы(мг) к растворимости в воде (мг/мл) более чем 100 мл, где растворимость лекарственного средства представляет собой растворимость нейтральной (например, свободное основание или свободная кислота) форме в небуферизованной воде. Это определение включает, но не ограничивается лекарственными средствами, которые в значительной степени не растворимы в воде (менее чем 1,0 мкг/мл). Детали одного или более вариантов осуществления изобретения изложены в описании ниже. Другие характеристики, объекты и преимущества изобретения будут понятны из описания и формулы изобретения. Краткое описание чертежей Фиг. 1 представляет собой схематическое графическое представление способа производства распылительной сушкой, контроля, отбора проб и испытаний. Фиг. 2 представляет собой схематическое изображение процесса распылительной сушки. Фиг. 3 представляет собой таблицу, содержащую свойства твердых дисперсий VX-950, которые были подвергнуты распылительной сушке в системе растворителя, которая содержала воду. Фиг. 4 представляет собой графическое представление способа производства, контроля, отбора проб и испытаний. Подробное описание Способы распылительной сушки Распылительная сушка. Предпочтительный вариант осуществления настоящего изобретения включает аморфную твердую дисперсию, полученную распылительной сушкой, где смесь растворителя исходного материала включает по крайней мере один нелетучий растворитель (например, уксусную кислоту или воду). Таким образом, в другом варианте осуществления, настоящее изобретение обеспечивает сушку продукта, полученного путем распылительной сушки для удаления растворителя. Фармацевтическая композиция может быть получена путем распылительной сушки смеси, содержащей лекарственное средство VX-950, пригодный(е) полимер(ы) и подходящую систему растворителя. Распылительная сушка представляет собой способ, который включает распыление жидкой смеси, содер-7 018811 жащей, например, твердое вещество и растворитель, и удаление растворителя. Распыление можно осуществлять, например, через сопло или на вращающемся диске. Распылительная сушка представляет собой способ, который превращает жидкую загрузку в форму сухих частиц. Необязательно, может использоваться дополнительный способ сушки, такой как сушка в псевдоожиженном слое или вакуумная сушка, для удаления остаточных растворителей до фармацевтически приемлемого уровня. Обычно распылительная сушка включает контакт высокодиспергированной жидкой суспензии или раствора с достаточным объемом горячего воздуха или газа, приводящий к упариванию или высыханию жидких капель. Состав, подлежащий распылительной сушке, может представлять собой любой раствор, суспензию, грубую суспензию, взвесь, коллоидную суспензию или пасту, которая может быть распылена при использовании выбранного аппарата для распылительной сушки. В стандартной процедуре состав распыляют в поток теплого фильтрованного воздуха или газа, который испаряет растворитель и перемещает высушенный продукт в коллектор (например, циклон или непосредственно в рукав мембранного фильтра). Из отработанного воздуха затем выкачивают растворитель или, в качестве альтернативы, отработанный воздух отправляют в конденсатор для захвата и потенциальной рециркуляции растворителя. Для проведения распылительной сушки могут быть использованы коммерчески доступные типы приборов, например, коммерчески доступные распылительные сушки,производимые Buchi Ltd. и Niro (например, PSD линия распылительных сушек, производимых Niro) (см. патенты США 2004/0105820; 2003/0144257). Например, может использоваться сопло высокого давления,электроакустический пневмораспылитель, пневмораспылитель, центробежный распыливатель. При распылительной сушке обычно применяют загрузки материалов твердых веществ от примерно 0,5 до примерно 30% (т.е. лекарственное средство плюс эксципиенты), предпочтительно по крайней мере примерно 10%. В некоторых вариантах осуществления загрузки менее чем 10% могут привести к тонкой или пористой дисперсии или к низким объемным плотностям или неприемлемо продолжительным циклам обработки. В общем, верхний предел твердых загрузок определяются вязкостью (например, способность к закачиванию) полученного раствора и растворимостью компонентов раствора. В общем, вязкость раствора может определить размер частиц в полученном порошкообразном продукте. Технологические способы и способы распылительной сушки можно найти в Perry's Chemical Engineerinh Handbook, 6th Ed., R.H. Perry, D.W. GreenJ.O. Maloney, eds), McGraw-Hill book со. (1984); иMarshall "Atomization and Spray-Drying" 50, Chem. Ing. Prog. Monogr. Series 2 (1954). В общем, распылительную сушку проводят при температуре впуска от примерно 40 до примерно 200 С, например, от примерно 45 до примерно 150 С, предпочтительно от примерно 50 до примерно 100 С, например, при примерно 50 С. В общем, распылительную сушку проводят при температуре на выходе от примерно 15 до примерно 100 С, например, от примерно 20 до примерно 75 С, например, при примерно 27 С. Удаление растворителя может потребовать последующей стадии сушки, такой как сушка на противне, сушка в псевдоожиженном слое (например, при от примерно комнатной температуры до примерно 100 С, например при примерно 60 С), вакуумная сушка, индукционная сушка, сушка во вращающемся барабане или биконическая вакуумная сушка (например, при от примерно комнатной температуры до примерно 100 С например, при примерно 60 С или ниже). Сушка распылением в псевдоожиженном слое Другой предпочтительный вариант осуществления настоящего изобретения включает аморфную твердую дисперсию, полученную распылительной сушкой в псевдоожиженном слое, при которой смесь растворителей исходного материала включает по крайней мере один нелетучий растворитель (например,ледяную уксусную кислоту или воду). Соответственно, в другом варианте осуществления настоящее изобретение обеспечивает сушку продукта, полученного распылительной сушкой в псевдоожиженном слое, для удаления растворителя. При способе распылительной сушки в псевдоожиженном слое комбинируют технологические способы распылительной сушки и сушки в псевдоожиженном слое. Агломерированные порошки получают на основе объединенного псевдоожиженного слоя или ленты и многостадийного способа, в котором сырой порошок, полученный в ходе первой стадии осушки, образует агломераты, которые затем сушат и охлаждают в следующих стадиях. Кратко, сопло высокого давления, электроакустический пневмораспылитель, пневмораспылитель или центробежный распылитель распыляет загрузку внутрь распылительной сушки в направлении псевдоожиженного слоя. Агломерация, включающая более тонкий повторно используемый материал, проходит в распылительной сушке и агломерированные частицы падают в слой. Выход использованного воздуха осуществляется через свод, что вызывает дополнительную агломерацию в зоне распыления. Влажный материал может быть успешно высушен и способ представляет собой идеальный для сушки термочувствительных продуктов и достигается улучшенное сохранение аромата. Способ приводит к агломерированным свободно-текучим порошкам с минимальным размером частиц. В качестве примера, в распылительной сушке загрузку распыляют из центробежного распылителя,расположенного в верхней части сушильной камеры в осушающий воздух и в нижнюю часть сушильной камеры. Интенсивное образование псевдоожиженного слоя влажного порошка в псевдоожиженном слое,расположенном в основании камеры, плюс рециркулирование мелких частиц из циклонного приспособления приводит к распылительной сушке, проходящей в насыщенной порошком атмосфере. С частицами с более высоким содержанием влаги можно оперировать в сушильной камере в связи с достигаемым эффектом получения порошка, позволяющим обойти проблемы слипания порошка. Сушку можно проводить при более низких температурах порошка и использованного воздуха, таким образом, улучшая качество продукта, при этом достигая более высокой термической эффективности. На степень агломерации и,таким образом, распределения частиц по размеру можно влиять путем изменения условий обработки и места в сушильной камере, через которое рециркулируют частицы. Путем оптимизации условий обработки может быть получена дисперсия с характеристиками, благоприятными для последующей обработки (например, прямого прессования). Как и в случае обычной распылительной сушки, в способе FSD может использоваться нелетучий растворитель (например, ледяная уксусная кислота, ДМСО, ДМФА или вода). Несмотря на то, что варианты осуществления настоящего описания относятся к использованию нелетучих растворителей в распылительной сушке, необходимо понимать, что способы распылительной сушки в псевдоожиженном слое также применимы и могут использоваться в вариантах осуществления,описанных здесь. Подробное описание распылительной сушки в псевдоожиженном слое VX-950 приведено в предварительной заявке, поданной 22 декабря 2006, озаглавленной Распылительная сушка в псевдоожиженном слое, Attorney-Docket19079-016 Р 01. Растворители В общем случае, существует непосредственная взаимосвязь между объемной плотностью/поток и остаточным растворителем; чем выше объемная плотность/лучше поток, тем больше остаточного растворителя. В некоторых случаях, размером частиц и плотностью можно управлять путем изменения количества времени, затрачиваемого на отвердевание и/или высушивание частицы. Таким образом, включение нелетучего (или высококипящего) растворителя в смесь может обеспечить продукт в форме частиц, имеющий улучшенные свойства. Например, добавление ледяной уксусной кислоты или воды в систему растворителей, включающую летучие органические растворители, может обеспечить более крупные или более плотные частицы, по сравнению с продуктом в форме частиц без уксусной кислоты или воды. Более крупные и/или более плотные частицы могут обладать улучшенными реологическими свойствами,которые желательны для последующего составления частиц, например в пероральную форму дозировки,такую как таблетка или капсула. В некоторых вариантах осуществления система растворителей обеспечивает частицы, которые отвердевают через по крайней мере 5 с, по крайней мере 7 с, по крайней мере 10 с, по крайней мере 12 с, по крайней мере 15 с, по крайней мере 20 с или более. Дополнительно может быть выгодным оптимизировать поток порошка и объемную плотность и/или использовать вторичную сушку для удаления остаточного растворителя. В одном из вариантов осуществления настоящего изобретения твердая дисперсия представляет собой высушенную в псевдоожиженном слое. Для определенных вариантов осуществления для обеспечения оптимальных эффектов в определенной твердой дисперсии VX-950 была показана эффективной сушка в псевдоожиженном слое при от примерно 40 до примерно 80 С, например от примерно 40 до примерно 60 С, например при примерно 45 С в течение примерно 8 ч. В других вариантах осуществления для обеспечения приемлемых концентраций остаточного растворителя в конечном продукте было эффективным, например, использование HPMCAS в качестве полимера в твердой дисперсии, сушка в псевдоожиженном слое при 45 С в течение примерно 4 ч. В предпочтительных способах растворитель включает летучий растворитель и нелетучий растворитель. В некоторых вариантах осуществления растворитель включает смесь летучих растворителей. Предпочтительные растворители включают такие растворители, которые могут растворять одновременно VX950 и полимер (если присутствует) и/или поверхностно-активное вещество (если присутствует). Подходящие растворители включают растворители, описанные выше, например хлористый метилен, ацетон и т.д. В варианте осуществления, в котором VX-950 подвергают распылительной сушке или распылительной сушке в псевдоожиженном слое, предпочтительные растворители включают смесь хлористого метилена, ацетона и ледяной уксусной кислоты. В другом варианте осуществления, в котором VX-950 подвергают распылительной сушке или распылительной сушке в псевдоожиженном слое, предпочтительные растворители включают смесь хлористого метилена, ацетона и воды. В некоторых случаях растворитель может реагировать с материалом (например, представляющими интерес компонентами, например лекарственным средством или терапевтическим агентом), подвергаемым распылительной сушке. Таким образом, в некоторых вариантах осуществления предпочтительным является растворитель, который не реагирует с представляющим интерес соединением при подготовке раствора для загрузки, содержащим указанное соединение. Например, спирт может реагировать с представляющим интерес соединением (например, лекарственным средством, например, плохо растворимым лекарственным средством, например, VX-950) с образованием кеталей. Таким образом, предпочтителен растворитель, который не реагирует с представляющим интерес соединением (например, лекарственным средством, например, плохо растворимым лекарственным средством, например, VX-950) (в особенности,-9 018811 с образованием кеталей) при получении загрузочного раствора, содержащего указанное соединение. Такой растворитель не должен содержать ОН группу или сходный реакционно активный фрагмент. В связи с реакционной активностью определенных соединений (например, VX-950) предпочтительный растворитель для использования в системе растворителя в сочетании с описанием по получению загрузочного раствора, содержащего такое соединение, не является полиэтиленгликолем (например, PEG 8000) (т.е. не является полимером, имеющим гидроксильные фрагменты). В другом предпочтительном варианте осуществления нелетучий растворитель представляет собой воду. Примером процентно-массового соотношения хлористого метилена к ацетону к воде является соотношение 75:24:1. В некоторых случаях нелетучий растворитель (например, вода) может вносить вклад в растворение компонента, например поверхностно-активного вещества (например, SLS), который присутствует в смеси, подвергаемой распылительной сушке. В другом предпочтительном варианте осуществления нелетучий растворитель (например, вода) имеет более высокую объемную плотность. В некоторых вариантах осуществления нелетучий растворитель представляет собой компонент в смеси растворителей. Например, нелетучий растворитель присутствует в качестве компонента в растворителе в количестве от примерно 1 до примерно 20 мас.% (например, от примерно 1 до примерно 5%, от примерно 3 до примерно 15%, от примерно 4 до примерно 12% или от примерно 5 до примерно 10%). В другом варианте осуществления нелетучий растворитель (например, вода) присутствует в количестве от примерно 0 до примерно 5%, например, примерно 1%. В некоторых предпочтительных вариантах осуществления смесь растворителей представляет собой комбинацию летучего растворителя или комбинацию растворителей, таких как хлористый метилен и ацетон, с нелетучими растворителями, такими как вода и ледяная уксусная кислота. Например, смесь растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 1 до примерно 15% ледяной уксусной кислоты (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 3 до примерно 12% ледяной уксусной кислоты). В качестве еще одного примера смесь растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 1 до примерно 15% воды (например, от примерно 50 до примерно 70% хлористого метилена, от примерно 25 до примерно 30% ацетона и от примерно 1 до примерно 5% воды). Примером процентно-массового соотношения хлористого метилена к ацетону к нелетучему растворителю (например, вода) является соотношение 75:24:1. Из-за реакционной активности VX-950, предпочтительный полимер в вариантах осуществления,включающих VX-950, отличается от полиэтиленгликоля (например, PEG 8000) (т.е. другой, чем полимер,имеющий свободные гидроксильные фрагменты). Растворитель, размер частиц и диапазон температуры сушки могут быть модифицированы для получения оптимальных твердых дисперсий. Специалистам в данной области будет понятно, что маленький размер частиц будет приводить к более быстрому удалению растворителя. Заявители, однако, обнаружили, что меньший размер частиц может приводить к мелкокристаллическим частицам, которые не приводят к оптимальным твердым дисперсиям для последующей обработки, такой как таблетирование. При высоких температурах может происходить кристаллизация или химическое разложение VX-950. При более низких температурах может быть удалено недостаточное количество растворителя. Распределение частиц по размерам и плотности (например, объемная масса и/или плотность утряски) могут быть оптимизированы, например, за счет варьирования одного или нескольких из следующих параметров: температура на выходе и давление подачи. Пригодность варьируемого параметра может быть оценена. Например, для оценки пригодности температуры на входе температура может быть повышена (например, до 30 С) при этом оставляя другие параметры неизменными. Свойства (например,плотности) дисперсии, полученной распылительной сушкой при использовании такой повышенной температуры, сравнивают со свойствами дисперсии, полученной при использовании настоящего описания(например, температура на выходе 25 С) и может быть сделана оценка, благоприятно ли такое повышение температуры (например, если изменение приводит к усилению желаемого свойства (например, увеличению объемной массы), в таком случае изменение может рассматриваться как благоприятное). Другие параметры, которые могут быть оптимизированы (например, аналогичным образом) для способа распылительной сушки включают выбор нелетучего растворителя, используемое процентное содержание нелетучего растворителя, выбор летучего растворителя(ей), используемое процентное содержание летучего растворителя(ей) (например, общее процентное содержание и/или отношение каждого из летучих растворителей к другому, если использовано более одного летучего растворителя), выбор поверхностно-активного вещества, процентное содержание поверхностно-активного вещества, выбор полимера, процентное содержание используемого полимера, выбор распылителя, скорость подачи раствора, дифференциал давления циклона, другие твердые добавки, процентное содержание загрузки твердых веществ, и/или температуру на входе. Если породят сушку после распыления, то можно оптимизировать следующее: выбор способа сушки, продолжительность способа сушки, скорость вращения сушки,- 10018811 температуру сушки, давление сушки и/или время сушки. Можно модифицировать природу растворителя для оптимизации размера частиц и плотности. Например, увеличение количества высококипящего (или нелетучего) компонента в растворителе может увеличивать продолжительность времени, требуемого для отверждения и/или сушки частиц, полученных распылительной сушкой. Таким образом, в том случае, если необходимо иметь более крупные и/или более плотные частицы, желательно большее количество высококипящего (или нелетучего) растворителя. Природа высококипящего или нелетучего растворителя также может варьировать, в зависимости от желаемых свойств диспергированных частиц и/или свойств лекарственного средства. Например, желательные высококипящие или нелетучие растворители улучшают растворимость лекарственного средства или других компонентов (например, поверхностно-активного вещества, например SLS; или полимера) в растворе и не вступают в химическую реакцию или не оказывают вклад в химическое разрушение лекарственного средства (или поверхностно-активного вещества, или полимера, если присутствует). Например,растворитель органическая кислота не будет пригодным для лекарственного средства, которое является чувствительным к кислотам, или которое содержит функциональную группу, подверженную действию кислот. Способы, описанные здесь, обеспечивают оптимальный размер частиц и оптимальное время сушки. Примеры летучих растворителей включают кетоны, спирты, ацетонитрил, хлористый метилен, хлороформ и ТГФ. Как будет понятно специалисту в данной области, выбор растворителя зависит, по крайней мере частично, от растворимости композиции (например, лекарственного средства или другого терапевтического агента) в растворителе и/или от реакционной способности композиции (например, функциональной группы) и конкретного растворителя. Примеры нелетучих растворителей включают органические кислоты, такие как толуол, ледяная уксусная кислота, ДМСО, ДМФ и воду. Выбор растворителя может зависеть, по крайней мере частично, от растворимости композиции (например, лекарственного средства или другого терапевтического агента) в растворителе и/или от реакционной способности композиции (например, функциональных групп) с конкретным растворителем. Как используется здесь термин "нелетучий растворитель" относится к жидкости, которая имеет точку кипения выше 80 С при 1 атм. Для оценки пригодности растворителя можно менять растворитель при условии сохранения остальных параметров неизменными. Свойства (например, плотности) дисперсии, полученной распылительной сушкой при использовании такого замененного растворителя сравнивают со свойствами дисперсии, полученной согласно настоящему описанию при использовании описанного здесь растворителя (например,воды в качестве нелетучего растворителя), и может быть сделана оценка, является ли выгодной подобная замена растворителя (например, если изменение приводит к усилению желаемого свойства (например,повышению объемной плотности), тогда изменение может быть выгодным). Сходным образом, можно оценить используемое количество заданного растворителя (например, воды в качестве нелетучего растворителя), например, путем сравнения полученного продукта с продуктом, полученным при использовании растворителя, описанного здесь, в описанном здесь количестве, например 1% воды в качестве нелетучего растворителя. Полимеры Продукты (например, агломерированные продукты, такие как порошки или гранулы), подвергаемые распылительной сушке или подвергаемые распылительной сушке в псевдоожиженном слое, такие как твердые дисперсии (например, аморфные твердые дисперсии), включающие представляющее интерес соединение (например, лекарственное средство, например, плохо растворимое лекарственное средство,например, VX-950), могут включать полимер или несколько полимеров (или твердофазный носитель(и. Способы распылительной сушки и FSD, использующие описанный здесь нелетучий растворитель,можно использовать для получения твердой дисперсии (например, аморфной твердой дисперсии), включающей представляющее интерес соединение (например, лекарственное средство, например, плохо растворимое лекарственное средство, например, VX-950). Дополнительно, смесь, которая содержит растворители (например, летучие и нелетучие растворители) и представляющее интерес соединение (например, лекарственное средство), которая подлежит сушке, может включать полимер или несколько полимеров (или твердофазный носитель(и. Полимер или несколько полимеров можно использовать в качестве части системы аморфной твердой дисперсии вместе с представляющим интерес соединением. Например, полимер(ы) может присутствовать в загружаемом растворе (например, которые будут сушить при использовании FSD) вместе с представляющим интерес соединением (например, лекарственным средством). Без ограничения какойлибо теорией наличие полимера может помочь предотвратить, уменьшить или замедлить степень или скорость кристаллизации соединения, представляющего интерес (например, лекарственного средства),по сравнению со степенью или скоростью кристаллизации, которые происходят в отсутствие полимера. Например, при использовании полимер, степень кристаллизации может уменьшаться на по крайней мере примерно 10%, на по крайней мере примерно 20%, на по крайней мере примерно 30%, на по крайней мере примерно 40%, на по крайней мере примерно 50%, на по крайней мере примерно 60%, на по крайней мере примерно 70%, на по крайней мере примерно 80%, на по крайней мере примерно 90%, на по крайней мере примерно 95% или на по крайней мере примерно 99%, по сравнению со степенью кристаллизации в отсутствие полимера. Например, полимер или несколько полимеров могут защитить лекарственное средство от кристаллизации в водной среде, такой как желудочные соки и/или кишечные соки. Например, НРМС может помочь уменьшению степени кристаллизации (например, в представляющем интерес соединении, например, слабо растворимом лекарственном препарате, например, VX-950 при низком рН, таком как, например, в желудочных соках. НРМС может обеспечить защиту в желудочных соках (например, голодном или сытом желудочных соках), и искусственных желудочных соках ("SGF"). В качестве еще одного примера HPMCAS может обеспечивать улучшенную физическую стабильность и помочь уменьшению степени кристаллизации (например, представляющего интерес соединения, например, слабо растворимого лекарственного средства, например, VX-950 в кишечных соках (например,голодном или сытом кишечных соках) и искусственных кишечных соках ("SIF") (например, голодном или сытом SIF). Как результат, можно улучшить один или несколько параметров из биодоступности,растворимости и абсорбции представляющего интерес соединения (например, лекарственного средства,например, слаборастворимого лекарственного средства, например, VX-950). Дополнительно, за счет уменьшения степени кристаллизации, полимер может увеличивать стабильность при хранении композиции, например, дисперсии, полученной распылительной сушкой илиFSD, или твердой формы (например, непосредственно прессованной формы, например, таблетки), содержащей представляющее интерес соединение (например, лекарственное средство, например, слабо растворимое лекарственное средство, например, VX-950) по сравнению со стабильностью композиции, в которой не использовался полимер, на по крайней мере примерно 10% (например, на по крайней мере примерно 20%, на по крайней мере примерно 30%, на по крайней мере примерно 40%, на по крайней мере примерно 50%, на по крайней мере примерно 60%, на по крайней мере примерно 70%, на по крайней мере примерно 80% или на по крайней мере примерно 90%). Полимер может улучшать стабильность твердой дисперсии (например, при хранении при 4 С или при комнатной температуре) по крайней мере на по крайней мере примерно 10% (например, на по крайней мере примерно 20%, на по крайней мере примерно 30%, на по крайней мере примерно 40%, на по крайней мере примерно 50%, на по крайней мере примерно 60%, на по крайней мере примерно 70%, на по крайней мере примерно 80% или на по крайней мере примерно 90%) по сравнению с твердой дисперсией, хранимой при идентичных условиях и не содержащей полимера. Дополнительно, без ограничения какой-либо теорией, присутствие нескольких полимеров может помочь предотвратить, уменьшить или замедлить степень или скорость кристаллизации представляющего интерес соединения (например, лекарственного средства, например, слабо растворимого лекарственного средства, например, VX-950) по сравнению со степенью или скоростью кристаллизации, которая имеет место в присутствие одного полимера. Например, при использовании нескольких полимеров, степень кристаллизации может быть уменьшена на по крайней мере примерно 10%, а по крайней мере примерно 20%, на по крайней мере примерно 30%, на по крайней мере примерно 40%, на по крайней мере примерно 50%, на по крайней мере примерно 60%, на по крайней мере примерно 70%, на по крайней мере примерно 80%, на по крайней мере примерно 90%, на по крайней мере примерно 95 или на по крайней мере примерно 99%, по сравнению со степенью кристаллизации в присутствие одного полимера. Например, несколько полимеров могут защитить лекарственное средство от кристаллизации в водной среде, такой как желудочные соки или кишечные соки. Например, НРМС или HPMCAS, или несколько полимеров, например смесь, содержащая НРМС и HPMCAS, может обеспечить увеличение защиты заданной дисперсии VX-950: например, НРМС может защитить VX-950 от кристаллизации в желудочных соках или SGF, тогда как HPMCAS может защитить VX-950 от кристаллизации в кишечных соках илиSIF. В результате, использование смеси может обеспечить улучшенную биодоступность, растворимость и/или абсорбцию представляющего интерес соединения, (например, лекарственного средства, например,слабо растворимого лекарственного средства, например, VX-950). Дополнительно, несколько полимеров могут увеличивать стабильность при хранении композиции, например, твердой формы (например, дисперсии, полученной распылительной сушкой, непосредственно прессованной формы, например, таблетки), содержащей представляющее интерес соединение (например, лекарственное средство, например,слабо растворимое лекарственное средство, например, VX-950) по сравнению со стабильностью композиции, в которой не использовался полимер, на по крайней мере примерно 10% (например, на по крайней мере примерно 20%, на по крайней мере примерно 30%, на по крайней мере примерно 40%, на по крайней мере примерно 50%, на по крайней мере примерно 60%, на по крайней мере примерно 70%, на по крайней мере примерно 80% или на по крайней мере примерно 90%). Несколько полимеров могут увеличить стабильность твердой дисперсии (например, при хранении при 4 С или при комнатной температуре) по крайней мере на по крайней мере примерно 10% (например, на по крайней мере примерно 20%, на по крайней мере примерно 30%, на по крайней мере примерно 40%, на по крайней мере примерно 50%, на по крайней мере примерно 60%, на по крайней мере примерно 70%, на по крайней мере примерно 80% или на по крайней мере примерно 90%) по сравнению с твердой дисперсией, хранимой при идентичных условиях и не содержащей полимера. Полимер или несколько полимеров (например, включающих один или несколько целлюлозных по- 12018811 лимеров) можно также использовать для обеспечения формы представляющего интерес соединения (например, лекарственного средства, например, слабо растворимого лекарственного средства, например,VX-950), такой, что при ее введении площадь под кривой (AUC) представляющего интерес соединения(например, лекарственного средства, например, слабо растворимого лекарственного средства, например,VX-950) будет в значительной степени одинаковой у голодных и сытых субъектов, например, уменьшая или в значительной мере устраняя воздействие пищи на субъекта. В одном из вариантов осуществления полимер или несколько полимеров, или один или большее число полимеров из нескольких полимеров согласно настоящему описанию способны растворяться в водной среде. Растворимость полимера(ов) может быть рН-независимой или рН-зависимой. Последний случай включает один или несколько энтеросолюбильных полимеров. Термин "энтеросолюбильный полимер" относится к полимеру, который предпочтительно растворяется в менее кислой среде кишечника по сравнению с более кислой средой желудка, например, полимер, который нерастворим в кислой водной среде, но растворим, когда рН выше 5-6. Пригодный полимер должен быть химически и биологически инертным. Для того чтобы улучшить биологическую стабильность твердых дисперсий, температура стеклования (Tg)полимера или полимеров (например, нескольких полимеров или одного или большего числа полимеров из нескольких полимеров) должна быть насколько возможно высокой. Например, предпочтительные полимеры имеют температуру стеклования, по крайней мере равную или выше температуры стеклования представляющего интерес соединения (например, лекарственного препарата, например,плохо растворимого лекарственного препарата, например, VX-950). Другие предпочтительные полимеры имеют температуру стеклования, которая находится в интервале от примерно 10 до примерно 15C от температуры стеклования представляющего интерес соединения (например, лекарственного препарата,например, плохо растворимого лекарственного препарата, например, VX-950). Примеры пригодных температур стеклования полимеров включают по крайней мере 55 С, по крайней мере 60 С, по крайней мере 65 С, по крайней мере 70 С, по крайней мере 75 С, по крайней мере 80 С, по крайней мере 85 С, по крайней мере 90 С, по крайней мере 95 С, по крайней мере 100 С, по крайней мере 105 С, по крайней мере 110 С, по крайней мере 115 С, по крайней мере 120 С, по крайней мере 125 С, по крайней мере 130 С, по крайней мере 135 С, по крайней мере 140 С, по крайней мере 145 С, по крайней мере 150 С,по крайней мере 155 С, по крайней мере 160 С, по крайней мере 165 С, по крайней мере 170 С или по крайней мере 175 С (измеренную при сухих условиях). Без ограничения какой-либо теорией, полагают,что лежащий в основе этого механизм состоит в том, что полимер с более высокой Tg обычно имеет более низкую молекулярную подвижность при комнатной температуре, что может оказаться критическим фактором в стабилизации физической стабильности аморфной твердой дисперсии. Дополнительно, гигроскопичность полимера (или нескольких полимеров, или одного или большего числа из нескольких полимеров) должна быть максимально низкой. С точки зрения сравнения в данном применении, гигроскопичность полимера, комбинации полимеров или композиции характеризуют при относительной влажности 60%. В некоторых предпочтительных вариантах осуществления полимер(ы) адсорбируют менее чем 10% воды, например, менее чем примерно 9%, менее чем примерно 8%, менее чем примерно 7%, менее чем примерно 6%, менее чем примерно 5%, менее чем примерно 4%, менее чем примерно 3% или менее чем примерно 2% воды. Целлюлозные полимеры обычно абсорбируют примерно 3% воды, тогда как PVP обычно абсорбируют примерно 9% воды. Гигроскопичность может также влиять на физическую стабильность твердых дисперсий. Обычно влага, абсорбированная в полимере,может значительно понижать Tg полимеров, а также получаемых твердых дисперсий, что будет дополнительно понижать физическую стабильность твердых дисперсий, как описано выше. В одном из вариантов осуществления, полимер или несколько полимеров, или один или большее число полимеров из нескольких полимеров представляет собой один или большее число водорастворимый(ых) полимер(ов) или частично водорастворимый(ых) полимер(ов). Водорастворимые или частично водорастворимые полимеры включают, но не ограничиваются перечисленным) производные целлюлозы(например, гидроксипропилметилцеллюлозу (НРМС, также известную как гипромеллоза), гидроксипропилцеллюлозу (НРС или этилцеллюлозу; поливинилпирролидоны (PVP); полиэтиленгликоли (PEG),Поливиниловые спирты (PVA); акрилаты, такие как полиметакрилаты (например, EUDRAGIT Е); циклодекстрины (например, -циклодекстрин) и сополимеры и их производные, включая, например, PVPVA (поливинилпирролидон-винилацетат). В некоторых предпочтительных вариантах осуществления полимер или один из нескольких полимеров представляет собой гидроксипропилметилцеллюлозу(НРМС), такую как НРМС Е 50 (например, от Dow), HPMCE15, или НРМС 60SH 50 сР (например, ShinEtsu Metolose, HMPC60SH50). HMPC доступна в различных типах от Shin-Etsu, включая SM, 60SH,65SH, 90SH. Каждый из указанных типов отличается по коэффициенту вязкости и содержанию метоксила и гидроксипропоксила. Наиболее предпочтительный тип для использования в распыляемой дисперсии представляет собой HMPC60SH. В некоторых вариантах осуществления полимер или несколько полимеров, или один или большее число полимеров из нескольких полимеров представляют собой рН-зависимые энтеросолюбильные полимеры. Такие рН-зависимые энтеросолюбильные полимеры включают, но не ограничиваются перечис- 13018811 ленным, производные целлюлозы (например, фталат ацетата целлюлозы (САР, фталаты гидроксипропилметилцеллюлозы (НРМСР), сукцинаты ацетата гидроксипропилметилцеллюлозы (HPMCAS), ацетат гидроксипропилметилцеллюлозы (НРМСА), карбоксиметилцеллюлозу (CMC) или ее соль (например,натриевая соль, такая как (СМС-Na, тримеллитат ацетата целлюлозы (CAT), фталат ацетата гидроксипропилцеллюлозы (НРСАР), фталат ацетата гидроксипропилметилцеллюлозы (НРМСАР) и фталат ацетата метилцеллюлозы (МСАР) или полиметакрилаты (например, Eudragit S). В некоторых предпочтительных вариантах осуществления полимер или один из нескольких полимеров представляет собой сукцинат ацетата гидроксипропилметилцеллюлозы (HPMCAS). HPMCAS доступен в виде различных марок от Shin-Etsu, включая AS-LF, AS-MF, AS-HF, AS-LG, AS-MG, AS-HG. Каждая из указанных марок отличается по процентному содержанию замещенного ацетата и сукцината. Наиболее предпочтительная марка для использования в распыляемой дисперсии представляет собой AS-HG от Shin-Etsu. Другие полимеры HPMCAS и НРМСА с различной степенью и комбинациями замещенных гидроксипропокси, метокси, ацетильных и сукциноильных групп также известны в данной области техники(см., например, WO 2005/115330) и могут быть использованы в изобретениях, описанных здесь. Например, могут быть использованы HPMCAS полимеры, в которых степень замещения сукциноильных групп(DOSs) и степень замещения ацетильных групп (DOSAC) В HPMCAS составляет DOSsпримерно 0,02,DOSACпримерно 0,65 и DOSs + DOSACпримерно 0,85. В качестве другого примера могут быть использованы полимеры НРМСА, в которых степень замещения ацетильных групп (DOSAC) в полимере составляет примерно 0,6 или менее или степень замещения ацетильных групп (DOSAC) В полимере составляет примерно 0,15. В других вариантах осуществления могут быть использованы полимеры НРМСА, имеющие параметр растворимости примерно 24,0 (Дж/см) или менее. В еще одном варианте осуществления полимер или один или большее число полимеров из нескольких полимеров представляет собой нерастворимый сшитый полимер, например поливинилпирролидон(например, Crospovidon). В некоторых случаях полимер может вступать в реакцию с представляющим интерес соединением. Таким образом, в некоторых вариантах осуществления предпочтительным является полимер, который не вступает в реакцию с представляющим интерес соединением при приготовлении загружаемого раствора,содержащего такое соединение. Например, спирты могут вступать в реакцию с представляющим интерес соединением (например, лекарственным средством, например, плохо растворимым лекарственным средством, например, VX-950) с образованием кеталей. Таким образом, полимер, который не вступает в реакцию с представляющим интерес соединением (например, лекарственным средством, например, плохо растворимым лекарственным средством, например, VX-950) (в особенности с образованием кеталей) представляет собой предпочтительный при соединением при приготовлении загружаемого раствора, содержащего такое соединение. Такой полимер не должен содержать ОН группы или сходной реакционной функциональной группы. В связи с реакционной способностью определенных соединений (например,VX-950), предпочтительный полимер для использования в множестве полимеров или в качестве полимера в связи с данным описанием для приготовления загружаемого раствора, содержащего такое соединение, отличается от полиэтиленгликоля (например, PEG 8000) (т.е. отличается от полимера, имеющего свободные гидроксильные функциональные группы). В вариантах осуществления, в которых представляющее интерес соединение (например, лекарственное средство, например, плохо растворимое лекарственное средство, например, VX-950) образует твердую дисперсию (например, агломерированный продукт) с полимером или несколькими полимерами,например, VX-950 с НРМС и/или HPMCAS полимером, общее количество полимера(ов) по отношению к общей массе твердой дисперсии составляет обычно примерно 5% (например, примерно 4 или 6%), по крайней мере примерно 10% (например, 9 или 11%), по крайней мере примерно 15% (например, 14 или 16%), по крайней мере примерно 20% (например, 19 или 21%) и предпочтительно по крайней мере примерно 30% (например, 29 или 31%), например, по крайней мере примерно 35% (например, 34 или 36%),по крайней мере примерно 40% (например, 39 или 41%), по крайней мере примерно 45% (например, 44 или 46%) или по крайней мере примерно 50% (например, 49 или 51%). Количество обычно составляет примерно 99% или менее и предпочтительно примерно 80% или менее, например, примерно 75% или менее, примерно 70% или менее, примерно 65% или менее, примерно 60% или менее или примерно 55% или менее. В одном из вариантов осуществления полимер(ы) составляют количество до примерно 30% от общей массы дисперсии (и даже более определенно, в диапазоне от примерно 28 и 32%, как примерно 29%) . В одном из вариантов осуществления полимер(ы) составляет количество до примерно 35% от общей массы дисперсии (и даже более определенно, в диапазоне от примерно 33 и 37%, как примерно 34%). В одном из вариантов осуществления полимер(ы) составляют количество до примерно 40% от общей массы дисперсии (и даже более определенно, в диапазоне от примерно 38 и 42%, как примерно 39%). В одном из вариантов осуществления полимер(ы) составляют количество до примерно 45% от общей массы дисперсии (и даже более определенно, в диапазоне от примерно 43 и 47%, как примерно 44%). Твердые дисперсии (например, агломерированные продукты), содержащие представляющее инте- 14018811 рес соединение (например, лекарственное средство, например, плохо растворимое лекарственное средство, например, VX-950) могут включать несколько полимеров. Например, в дисперсии могут быть использованы два полимера. В некоторых вариантах осуществления несколько полимеров могут включать один или большее число целлюлозных полимеров. Например, дисперсия, подвергаемая распылительной сушке, может включать два целлюлозных полимера, например, НРМС и HPMCAS. В некоторых вариантах осуществления твердая дисперсия включает смесь НРМС и HPMCAS. Количество каждого полимера, используемого в дисперсии, может варьировать и соотношение полимеров одного к другому также может варьировать. Например, дисперсия может включать от примерно 0 до примерно 100 мас.% первого полимера (например, НРМС) и от примерно 0 до примерно 100 мас.% второго полимера (например,HPMCAS) (где проценты по массе двух полимеров составляют 100% всего полимера, присутствующего в дисперсии). Например, в твердой дисперсии VX-950, содержащей полимеры, первый полимер представлен в количестве примерно 33% и второй полимер представлен в количестве примерно 67% от общего количества добавляемого полимера. В другом примере, первый полимер представлен в количестве примерно 55,5% и второй полимер представлен в количестве примерно 44,5% от общего количества добавляемого полимера. В другом примере, первый полимер представлен в количестве примерно 63% и второй полимер представлен в количестве примерно 37% от общего количества добавляемого полимера. В другом примере, первый полимер представлен в количестве примерно 50% и второй полимер представлен в количестве примерно 50% от общего количества добавляемого полимера. В другом примере, первый полимер представлен в количестве примерно 100% и второй полимер представлен в количестве примерно 0% от общего количества добавляемого полимера. В одном из более специфических вариантов осуществления настоящего описания, один из полимеров представляет соой поливинилпирролидон (PVP) (например, PVP29/32). PVP может быть представлен в количестве до примерно 35%, до примерно 40%, до примерно 45% или до примерно 50%. Дисперсия,включающая примерно 50% (например, примерно 49,5%) PVP29/32 включена в настоящее описание. В другом варианте осуществления описание включает твердую дисперсию (например, агломерированный продукт) представляющего интерес соединения (например, лекарственного средства, например,плохо растворимого лекарственного средства, например, VX-950) и целлюлозного полимера, например,НРСМ или HPCMAS полимера. В некоторых предпочтительных вариантах осуществления соединение(например, VX-950) присутствует в количестве по крайней мере примерно 50% от дисперсии, например,по крайней мере 55%, по крайней мере 60%, по крайней мере 65%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90% или даже большем. В некоторых предпочтительных вариантах осуществления лекарственное средство присутствует в количестве в диапазоне от примерно 55% до примерно 90%, таком как примерно 55%, примерно 60%, примерно 65%,примерно 70%, примерно 75%, примерно 80% или примерно 85%. Количество полимера присутствует в количестве по крайней мере 5%, по крайней мере 10%, по крайней мере 15%, по крайней мере 20%, по крайней мере 25%, по крайней мере 30%, по крайней мере 35%, по крайней мере 40% или по крайней мере 45%. В некоторых вариантах осуществления количество обычно составляет примерно 55% или менее и предпочтительно 50% или менее, например, примерно 45% или менее, примерно 40% или менее,примерно 35% или менее, примерно 30% или менее, примерно 25% или менее, примерно 20% или менее,примерно 15% или менее или примерно 10% или менее. В другом варианте осуществления описание включает твердую дисперсию (например, агломерированный продукт) представляющего интерес соединения (например, лекарственного средства, например,плохо растворимого лекарственного средства, например, VX-950) и по крайней мере двух целлюлозных полимеров, например, НРСМ и/или HPCMAS полимера. В некоторых предпочтительных вариантах осуществления соединение (например, VX-950) присутствует в количестве по крайней мере примерно 50% от дисперсии, например, по крайней мере 55%, по крайней мере 60%, по крайней мере 65%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90% или даже большем. В некоторых предпочтительных вариантах осуществления лекарственное средство присутствует в количестве в диапазоне от примерно 55% до примерно 70%, таком как примерно 55%, примерно 60%, примерно 65% или примерно 70%. Как описано выше, общее количество полимеров присутствует в количестве по крайней мере 15% и предпочтительно по крайней мере 20%, например, по крайней мере 25%, по крайней мере 30%, по крайней мере 35%, по крайней мере 40% или по крайней мере 45%. В некоторых вариантах осуществления количество обычно составляет 55% или менее и предпочтительно 50% или менее, например, примерно 45% или менее, примерно 40% или менее, примерно 35% или менее, примерно 30% или менее, примерно 25% или менее, примерно 20% или менее, примерно 15% или менее или примерно 10% или менее. В некоторых предпочтительных вариантах осуществления дисперсия дополнительно включает другие вводимые в малых дозах ингредиенты, такие как сурфактант (например, SLS или Витамин Е TPGS). В некоторых предпочтительных вариантах осуществления поверхностно-активное вещество представлено в количестве менее чем примерно 10% от массы дисперсии, например, менее чем примерно 9 мас.%,менее чем примерно 8 мас.%, менее чем примерно 7 мас.%, менее чем примерно 6 мас.%, менее чем примерно 5 мас.%, менее чем примерно 4% мас, менее чем примерно 3 мас.%, менее чем примерно 2 мас.% или примерно 1 мас.%. В наиболее предпочтительном варианте осуществления дисперсия включает примерно 49,5% VX950, примерно 49,5% HPCMAS и примерно 1% SLS. Полимер или несколько полимеров должны присутствовать в количестве, эффективном для стабилизации твердой дисперсии. Стабилизация включает ингибирование или уменьшение кристаллизации представляющего интерес соединения (например, лекарственного средства, например, плохо растворимого лекарственного средства, например, VX-950). Такая стабилизация будет ингибировать превращение соединения из аморфной формы в кристаллическую. Например, полимер(ы) будет предотвращать по крайней мере часть (например, примерно 5%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 55% или более) соединения от перехода из аморфной в кристаллическую форму. Например, при низком рН (например, в желудочном соке (например, голодном желудочном соке) или SGF (например, голодном SGF), представляющее интерес соединение (например, лекарственное средство, например, плохо растворимое лекарственное средство, например, VX-950) может растворяться,становиться сверхнасыщенным и затем кристаллизоваться. Полимер или несколько полимеров могут предотвратить или уменьшить кристаллизацию соединения в таких или сходных условиях, или в ходе хранения композиции, содержащей соединение. Стабилизация может быть измерена, например, измерением температуры стеклования твердой дисперсии, измерением скорости релаксации аморфного материала или измерением растворимости или биодоступности соединения. Полимер или несколько полимеров можно использовать в составе с представляющим интерес соединением (например, лекарственным средством, например, плохо растворимым лекарственным средством, например, VX-950). Один, более чем один или все полимеры, пригодные для использования в комбинации с соединением, например с образованием твердой дисперсии (например, агломерированного продукта), такой как аморфная твердая дисперсия, должен обладать одним или несколькими из следующих свойств: 1. Температура стеклования полимера или полимеров в комбинации должна иметь температуру не менее чем примерно на 10-15 С ниже температуры стеклования соединения. Предпочтительно, температура стеклования полимера или полимеров в комбинации в общем выше температуры стеклования соединения и в общем по крайней мере на 50 С выше, чем желаемая температура хранения продукта лекарственного средства. Например, по крайней мере 100 С, по крайней мере 105 С, по крайней мере 105 С, по крайней мере 110 С, по крайней мере 120 С, по крайней мере 130 С,по крайней мере 140 С, по крайней мере 150 С, по крайней мере 160 С, по крайней мере 160 С или более. 2. Полимер или полимеры в комбинации должны быть относительно негигроскопичными. Например, полимеры должны при хранении при стандартных условиях абсорбировать менее чем примерно 10% воды, например, менее чем примерно 9% воды, менее чем примерно 8% воды, менее чем примерно 7% воды, менее чем примерно 6% воды, менее чем примерно 5% воды, менее чем примерно 4% воды или менее чем примерно 3% воды. Предпочтительно полимер или полимеры при хранении при стандартных условиях будут в значительной степени не содержать абсорбированной воды. 3. Полимер или полимеры в комбинации должны иметь сходную или лучшую растворимость в растворителях, пригодных для методов распылительной сушки, по сравнению с растворимостью соединения. В предпочтительных вариантах осуществления полимер или полимеры будут растворяться в одном или нескольких тех же самых растворителях или растворительных системах, что и соединение. Предпочтительно, если полимер или полимеры представляют собой растворимые по крайней мере в одном не содержащем гидроксигрупп растворителе, таком как хлористый метилен, ацетон или их комбинация. 4. Полимер или полимеры в комбинации, при комбинировании с соединением, например, в твердой дисперсии, должны увеличивать растворимость соединения в водной или физиологической среде или по сравнению с растворимостью соединения в отсутствие полимеров, или по сравнению с растворимостью соединения при комбинировании с полимером сравнения. Например, полимер или полимеры могут увеличивать растворимость аморфного соединения путем уменьшения количества аморфного соединения,которое переходит в кристаллическое соединение из твердой аморфной дисперсии. 5. Полимер или полимеры в комбинации должны уменьшать скорость релаксации аморфного вещества. 6. Полимер или полимеры в комбинации должны увеличивать физическую и/или химическую стабильность соединения. 7. Полимер или полимеры в комбинации должны улучшать технологичность соединения. 8. Полимер или полимеры в комбинации должны улучшать одно или несколько свойств соединения из манипулирования, введения или хранения. 9. Полимер или полимеры в комбинации не должны нежелательным образом взаимодействовать с другими фармацевтическими компонентами, например эксципиентами. Пригодность потенциального полимера(ов) (или другого компонента) можно оценивать при ис- 16018811 пользовании описанных здесь FSD способов для получения композиции, содержащей аморфное соединение. Потенциальную композицию можно сравнивать с точки зрения стабильности, устойчивости по отношению к образованию кристаллов или других свойств и можно сравнивать с составом сравнения,например, составом, описанным здесь, например, содержащим представляющее интерес соединение (например, лекарственное средство, например, плохо растворимое лекарственное средство, например, VX950). Например. состав, содержащий примерно 83% аморфного VX-950, примерно 17% HPMCAS или кристаллический VX-950. Например, потенциальная композиция может быть испытана для определения,ингибирует ли она по времени начало кристаллизации, вызванной растворителем, или процент конверсии при заданном времени при контролируемых условиях, на по крайней мере 50, 75, 100 или 110%, а также состав сравнения и потенциальную композицию можно испытывать для определения, обладает ли она улучшенной биодоступностью или растворимостью VX-950 по сравнению с кристаллическим VX950. Поверхностно-активные вещества Продукты (например, агломерированные продукты, такие как порошки или гранулы), подвергаемые распылительной сушке или распылительной сушке в псевдоожиженном слое, такие как твердые дисперсии (например, аморфные твердые дисперсии), включающие представляющее интерес соединение (например, лекарственное средство, например, плохо растворимое лекарственное средство, например, VX950) и необязательно полимер или несколько полимеров (или твердофазный носитель(и могут включать поверхностно-активное вещество. Поверхностно-активное вещество или смесь поверхностноактивных веществ будет в общем случае уменьшать поверхностное натяжение на границе раздела фаз между твердой дисперсией и водной средой. Подходящее поверхностно-активное вещество или смесь поверхностно-активных веществ может также улучшать водорастворимость и биодоступность представляющего интерес соединения (например, лекарственного средства, например, плохо растворимого лекарственного средства, например, VX-950) из твердой дисперсии. Поверхностно-активные вещества для использования в контексте настоящего описания включают, но не ограничиваются перечисленным, эфиры сорбита и жирной кислоты (например, SPANS), полиоксиэтиленовые эфиры сорбита и жирной кислоты (например, TWEENS), полисорбаты, лаурилсульфат натрия (SLS, известный также как SDS или додецилсульфат натрия), додецилбензол сульфонат натрия (SDBS), диоктилсульфосукцинат натрия (Docusate), натриевую соль диоксихолиевой кислоты (DOSS), моностеарат собита, тристеарат сорбита, гексадецил триметиламмоний бромид (НТАВ), N-лауроилсаркозин натрия, олеат натрия, миристат натрия,стеарат натрия, пальмитат натрия, Gelucire 44/14, этилендиамин тетрауксусную кислоту (ЭДТА), витамин Е или производные токола, такие как альфатокоферол (например, d-альфа токоферол, d1-альфа токоферол, сложные эфиры сукцината и токоферола) и токоферильные сложные эфиры, такие как сложные эфиры уксусной кислоты и токоферила, сложные эфиры токоферила и янтарной кислоты, например, Витамин Е d-альфа токоферил полиэтилен гликоль 1000 сукцинат (TPGS; например, витамин Е TPGS отEastman), лецитин, MW 677-692, моногидрат мононатриевой соли глутаминовой кислоты, Labrasol, PEG 8 каприловые/каприновые глицериды, Transcutol, моноэтиловый простой эфир диэтиленгликоля, SolutolHS-15, полиэтиленгликоль/гидроксистеарат, таурохолиевая кислота, Pluronic F68, Pluronic F108 и Pluronic F127 (и любые другие сополимеры поликсиэтилена и полиоксипропилена (PLURONIC) или насыщенные поликолизированные глицериды (GELUCIRS. Конкретные примеры таких поверхностно-активных веществ, которые могут быть использованы в контексте настоящего изобретения, включают, но не ограничиваются перечисленным, Span 65, Span 25,Tween 20, Capryol 90, Pluronic F108, лаурилсульфат натрия (SLS), витамин Е TPGS, блоксополимеры полиоксиэтилена и полиоксипропилена и сополимеры, фосфолипиды, такие как PC (фосфатидилхолин)(например, из яиц или сои), PI (фосфатидилглицерол), РА (фосфатидиловая кислота), РЕ (фосфатидилэтаноламин), PG (фосфатидилглицерин). Поверхностно-активное вещество может также представлять собой липид или жирную кислоту, такие как дипальмитоилфосфохолин (DPPC) или сходные липиды(DAPC, DSPC, DPPG и т.д.). Такие липиды могут быть получены синтетически, например от Genzyme или Avanti Polar Lipids. Предпочтительными являются SLS (например, от Sigma или Fischer) и витамин ЕTPGS. Количество поверхностно-активного вещества (например, SLS или витамина Е TPGS) по отношению к общей массе твердой дисперсии может быть примерно от 0,1 до 20%. Предпочтительно количество составляет от примерно 1 до примерно 20%, от примерно 1 до примерно 15%, от примерно 1 до примерно 10%, более предпочтительно от примерно 1 до примерно 5%, например, примерно 1%, примерно 2%, примерно 3%, примерно 4% или примерно 5% . В некоторых вариантах осуществления количество поверхностно-активного вещества по отношению к общей массе твердой дисперсии составляет по крайней мере примерно 0,1%, предпочтительно по крайней мере примерно 0,5% и более предпочтительно по крайней мере примерно 1% (например, примерно 1%). В указанных вариантах осуществления поверхностно-активное вещество будет присутствовать в количестве не превышающем примерно 20% и предпочтительно не превышающем примерно 15%,примерно 12%, примерно 11%, примерно 10%, примерно 9%, примерно 8%, примерно 7%, примерно 6%,- 17018811 примерно 5%, примерно 4%, примерно 3%, примерно 2% или примерно 1%. Потенциальные поверхностно-активные вещества (или другие компоненты) и возможные количества можно испытывать на пригодность для использования в описании сходным образом с тем, как было описано для оценки растворителей. Композиции/упаковка/использование В одном из вариантов осуществления, твердая дисперсия может быть составлена в виде фармацевтической композиции, например таблетки. Согласно предпочтительному варианту осуществления твердая дисперсия присутствует в количестве, эффективном, чтобы обладать терапевтическим эффектом у пациента. В качестве альтернативы, композиция по настоящему изобретению включает другой дополнительный агент, как описано здесь (например, для обеспечения комбинированной терапии). Каждый компонент может присутствовать в индивидуальных композициях, комбинациях композиций или в одной композиции. Фармацевтические композиции, например таблетки, включающие твердую дисперсию обычно содержат фармацевтически приемлемый носитель, связующее/разбавитель, поверхностно-активное вещество, разрыхлитель, добавку, повышающую текучесть, смазывающий агент или основу (или носитель). Например, твердая дисперсия, полученная как описано здесь, может быть непосредственно прессована в форму дозировки. В некоторых вариантах осуществления перед прессованием дисперсию смешивают с одним или несколькими эксципиентами. В качестве одного из примеров служит детальное описание прямого прессования VX-950, представленное в предварительной заявке, поданной 22 декабря 2006,озаглавленной Формы дозировки, полученные прямым прессованием, Attorney-Docket19079-017 Р 01. Композиции и способы настоящего изобретения могут необязательно включать один или несколько эксципиентов (см., патент США 6720003, Публикация заявки на патент США 2004/0030151 и/или Международная заявка WO 99/02542 . Эксципиент представляет собой вещество, используемое в качестве носителя или наполнителя в форме дозировки, или добавляемое в фармацевтическую композицию для улучшения манипулирования,хранения или получения формы дозировки. Эксципиенты включают, но не ограничиваются перечисленным, разбавители, разрыхлители, адгезивы, смачивающие агенты, смазывающие агенты, вещества, способствующие скольжению, ингибиторы кристаллизации, агенты, модифицирующие поверхность, агенты,для маскировки или устранения неприемлемого вкуса или запаха, отдушки, красители, ароматизаторы,наполнители, связующие, стабилизаторы и вещества для улучшения внешнего вида композиции. Используемый здесь термин "включение" подразумевается как допускающий дополнение, таким образом, обозначая потенциальное включение других агентов дополнительно к конкретным агентам. Фармацевтически приемлемые носители, которые могут быть использованы в указанных композициях, включают, но не ограничиваются перечисленным, ионообменные вещества, диоксид алюминия,стеарат алюминия, лецитин, сывороточные белки, такие как человеческие сывороточные белки, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, частично глицерированные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный кремнезем, трисиликат магния, поливинилпирролидон, соединения на основе целлюлозы, полиэтиленгликоль, натрий карбоксиметилцеллюлозу, полиакрилаты, воска, полиэтилен полиоксипропилен блоксополимеры, полиэтиленгликоль и ланолин. Фармацевтические композиции, например твердая дисперсия, например лекарственное средство,подвергнутое распылительной сушке, могут быть составлены в виде таблеток. Например, распыляемую дисперсию лекарственного средства можно комбинировать с расплавленным гранулятом, одним или несколькими разбавителями и/или несколькими разрыхлителями и одним или несколькими смазывающими агентами, одним или несколькими другими эксципиентами, основами, носителями и/или наполнителями и прессованы в таблетированную форму. Полученная таблетка затем может быть дополнительно обработана, например, таблетка может быть покрыта веществом, таким как пленка или шеллак, для облегчения поддержания стабильности или целостности таблетки, для облегчения перорального введения таблетки,для маскировки вкуса таблетки, для добавления отдушки, для окраски таблетки, для регуляции высвобождения лекарственного средства, содержащегося в таблетке, при проглачивании и/или для маскировки вкуса таблетированной композиции. Покрытия, пригодные в этих целях (например, шеллак, энтеросолюбильные покрытия для регуляции высвобождения), известны в данной области техники. При желании, к таблетке или покрытию могут быть добавлены определенные подсластители, отдушки или красящие агенты. Технологические способы и композиции для получения таблеток описаны, например, в Remington's Pharmaceutical Sciences, Artur Osol, editor, pp. 1553-1593 (1980). Согласно предпочтительному варианту осуществления композиции по настоящему изобретению составлены для фармацевтического введения млекопитающему, предпочтительно человеческому существу. Хотя форма таблеток, определенная здесь, представляет собой предпочтительно составленную для перорального введения, могут быть получены другие составы. Изобретение также обеспечивает фармацевтические упаковки и наборы, включающие таблетированные составы аморфного VX-950, или фармацевтическую композицию по любому из указанных здесь вариантов осуществления. Фармацевтические композиции, например, содержащие твердую (например, подвергаемую распылительной сушке) описанную здесь дисперсию, могут быть также прописаны пациенту в виде "упаковок для пациента", содержащих более чем одну дозу и предпочтительно полный курс лечения, в одной упаковке (например, блистерной упаковке). Упаковка для пациента по сравнению с традиционными назначениями, при которых фармацевт отделяет партию фармацевтического средства для пациента от партии без упаковки, в том, что пациент всегда имеет доступ к листовке, приложенной к упаковке для пациента,которая отсутствует при традиционных назначениях. Показано, что включение листовки улучшает соблюдение пациентом инструкций терапевта. Предпочтительно лекарственное средство представлено в пероральной дозировке, например, в форме таблетки. Будет понятно, что назначение комбинации по изобретению в виде одной упаковки для пациента или упаковок для пациента каждого состава, содержащих листовку, инструктирующую пациента о корректном использовании описания, представляет желательный дополнительный признак настоящего описания. В альтернативном варианте осуществления фармацевтическая упаковка дополнительно включает один или несколько дополнительных описанных здесь агентов. Дополнительный агент или агенты могут присутствовать в той де упаковки или в отдельных упаковках. Согласно дополнительному аспекту описания существует упаковка, включающая любую таблетированную форму твердой (например, подвергнутой распылительной сушке) дисперсии или любой композиции согласно настоящему описанию, и листовку, содержащую инструкции по использованию композиции по описанию (или использовании комбинации композиции по настоящему описания и дополнительного агента или агентов, описанных здесь. Таким образом, настоящее описание обеспечивает набор для одновременного или последовательного введения твердой (например, подвергнутой распылительной сушке) дисперсии или любой композиции согласно настоящему описанию (и необязательно дополнительно агента) или их производных, которые получены обычным способом. Обычно такой набор будет включать, например, композицию каждого ингибитора и необязательно дополнительного агента(ов) в фармацевтически приемлемой основе (и в одном или нескольких фармацевтических составах) и написанные инструкции для одновременного или последовательного введения. Предпочтительно лекарственное средство представляет собой пероральную форму дозировки, например форму таблетки. В другом варианте осуществления обеспечивают упакованный набор, который содержит одну или несколько форм дозировки (предпочтительно пероральную форму дозировки) для самостоятельного введения; контейнерное устройство, предпочтительно запаянное, для помещения форм дозировки в ходе хранения и перед использованием и инструкции для пациента для приема лекарственного средства. Инструкции будут обычно представлять собой инструкции, написанные на листовке, этикетке и/или на других компонентах набора и формы дозировки или формах как описано здесь. Каждая форма дозировки может быть индивидуально помещена как, например, в листе ламината металлической фольги-пластика,с каждой формой дозировки изолированной от другой в индивидуальной ячейке или пузырьке, или формы дозировки могут быть помещены в один контейнер, такой как пластиковый флакон или пузырек. Представленные наборы также будут обычно включать упаковку индивидуальных компонентов набора,т.е. форм дозировки, контейнеров и написанных инструкций для использования. Такая упаковка может иметь форму картонной коробки или бумажной коробки или пакета из пластика или фольги и т.д. Варианты осуществления настоящего описания могут также включать дополнительные агенты. Таким образом, способ настоящего описания может включать стадии, такие как введение таких дополнительных агентов. Форма дозировки Уровни дозировки от примерно 0,01 до примерно 100 мг/кг веса тела в день, предпочтительно от примерно 10 до примерно 100 мг/кг веса тела в день твердой (например, подвергаемой распылительной сушке) дисперсии пригодны для предотвращения и лечения заболевания, которое подвергают лечению у субъекта. В некоторых вариантах осуществления включены уровни дозировки, составляющие от примерно 0,4 до примерно 10 г/день, например, от примерно 1 до примерно 4 г/день, предпочтительно от примерно 2 до примерно 3,5 г/день на один индивид (базируясь на среднем размере индивидуума, рассчитанном как примерно 70 кг). Обычно, фармацевтические композиции по и согласно настоящему описанию вводят от примерно 1 до примерно 5 раз в день, предпочтительно от примерно 1 до примерно 3 раз в день или в качестве альтернативы, в виде непрерывной инфузии. В некоторых вариантах осуществления, твердую (например, подвергаемую распылительной сушке) дисперсию или включающую ее фармацевтическую композицию вводят при использовании состава с контролируемым высвобождением. В некоторых вариантах осуществления такое введение может помочь обеспечить относительно стабильное содержание в крови твердой (например, подвергаемой распылительной сушке) дисперсии. В некоторых вариантах осуществления дозировка твердой (например, подвергаемой распылительной сушке) дисперсии может быть стандартной дозой, например, от примерно 1 до примерно 5 г в день,более предпочтительно от примерно 2 до примерно 4 г в день, более предпочтительно от примерно 2 до примерно 3 г в день, например, примерно 2,25 или примерно 2,5 г в день. Дозу можно вводить, например,в виде подвергаемой распылительной сушке дисперсии или в виде таблетки. Такое введение может использоваться в качестве длительной или неотложной терапии. Количество активного ингредиента, которое можно комбинировать с материалами носителя для получения одной формы дозировки, будет изменяться в зависимости от подвергаемого лечению субъекта и конкретной формы введения. Обычный состав будет содержать от примерно 5 до примерно 95% активного соединения (мас./мас.). Предпочтительно такие составы содержат от примерно 20 до примерно 80%, от примерно 25 до примерно 70%, от примерно 30 до примерно 60% активного соединения. Если композиции или способы настоящего описания включают комбинацию твердой (например,подвергаемой распылительной сушке) дисперсии и одного или нескольких дополнительных терапевтических или профилактических агентов, оба компонента, твердая (например, подвергаемая распылительной сушке) дисперсия и дополнительный агент должны присутствовать в уровне дозировки в диапазоне от примерно 10 до примерно 100% и более предпочтительно от примерно 10 до 80% дозировки обычно вводимой в монотерапевтическом режиме. При улучшении состояния пациента, если необходимо, можно вводить поддерживающую дозу соединения, композиции или комбинации по настоящему описанию. Затем дозу или частоту введения или и то, и другое можно уменьшать, например до примерно 1/2 или 1/4, или менее дозировки или частоты введения, в зависимости от симптомов, до уровня, при котором улучшенное состояние сохраняется, в том случае если симптомы облегчаются до желаемого уровня лечение необходимо прекратить. Однако пациент может требовать периодического лечения на долговременной основе при любом рецидиве симптомов заболевания. Необходимо понимать, что конкретная доза и режим лечения для любого определенного пациента будут зависеть от множества факторов, включающих активность конкретного применяемого соединения,возраста, веса тела, общего состояния здоровья, пола, диеты, времени введения, скорости выведения,комбинации лекарственных средств, мнения лечащего врача и степени тяжести определенного подвергаемого лечению заболевания. Количество активного ингредиента также будет зависеть от определенного описанного соединения и присутствия или отсутствия, а также природы дополнительного противовирусного агента в композиции. Примеры Пример 1. Смесь следующих компонентов подвергали распылительной сушке для получения твердой дисперсии VX-950. VX-950/HPMCAS-HG/SLS комбинировали в соотношении 49,5/49,5/1 мас./мас. и комбинировали в системе растворителя при концентрации твердых веществ 10, где система растворителя включала хлористый метилен/ацетон/ледяную уксусную кислоты в соотношении 66,6/28,5/5 с получением продукта, имеющего d50 43,03 и объемную плотность 0,37. Пример 2. Смесь следующих компонентов подвергали распылительной сушке для получения твердой дисперсии VX-950. VX-950/HPMCAS-HG/SLS комбинировали в соотношении 49,5/49,5/1 мас./мас., и комбинировали в системе растворителя при концентрации твердых веществ 10, где система растворителя включала хлористый метилен/ацетон/ледяную уксусную кислоты в соотношении 63/27/10 с получением продукта, имеющего d50 47,02 и объемную плотность 0,41. Пример 3. Подвергнутые распылительной сушке дисперсии VX-950 получали при использовании партий VX950, HPMCAS-HG (сукцинат ацетата гидроксипропилметилцеллюлозы, степени HG, Shin-Etsu ChemicalCo) полимера и SLS (лаурилсульфат натрия, Fisher) поверхностно-активного вещества. Осуществляли распылительную сушку и последующую сушку в биконической сушке. Получали сухую дисперсию с низким содержанием остаточного растворителя и заданными свойствами порошка. Критерии успеха включали приемлемый выход способа (более 80%) и соответствие заданным спецификациям целевого лекарственного средства по чистоте и соответствие целевых характеристик диапазону, указанному для физических характеристик (размер частиц и объемная плотность). Композиция состава и описание процесса Состав композиции для каждой из двух полученных активных дисперсий описан в табл. 1. Таблица 1. Состав композиции для каждой из двух полученных активных дисперсий на основе 116,25 кг Схематическое графическое представление способа производства представлено на фиг. 1. Объяснение протекания способа представлено ниже: А) Получение раствора и распылительная сушка. 1) Хлористый метилен получали в равновесном баке растворителя. 2) 100 кг заданного количества ацетона добавляли в смесительный реактор (см. табл. 1). 3) Подходящее количество хлористого метилена (см. табл. 1) получали в основном растворном реакторе. Датчики перепада давления служили подтверждением правильных количеств загружаемых растворителей. 4) В растворный реактор загружали вещество лекарственного средства VX-950 (см. табл. 1). Общее количество загруженных твердых веществ составило 13 мас.%. Отбирали образец для визуального подтверждения того, что вещество лекарственного средства растворялось. 5) HPMCAS-HG загружали в основной растворный реактор (см. табл. 1). Общее количество загруженных твердых веществ составило 13 мас.%. 6) Оставшееся заданное количество ацетона добавляли в смесительный реактор (см. табл. 1). 7) Ацетон, SLS и деионизированную воду загружали в основной растворный реактор. 8) Полученную партию тестировали на внешний вид и вязкость после растворения. 9) Устанавливали сопло высокого давления Spraying Systems SK-MFP и тестировали на корректное распыление с равновесным растворителем (также могли быть использованы сопла 48/21, 50/21 или 52/21). В) Пуск распылительной сушки 1) Распылительную сушку нагревали до подходящей температуры на выходе. 2) Распыляли равновесные растворители до тех пор, пока все параметры не выравнивались и не становились постоянными. 3) Начинали распылительную сушку загрузочного раствора в тот момент, когда распылительная сушка находилась в равновесии. 4) Сухие частицы пассивно отделяли от технологического газа при использовании циклона и собирали в полиэтиленовые мешки. Затем технологический газ фильтровали от мелких частиц и конденсировали для удаления растворителей способа. 5) Отбирали начальный образец и тестировали его на распределение размера частиц и объемную плотность и плотность утряски. а) Если распределение размеров частиц и плотности находились в пределах приемлемых критериев и были близки к целевым (см. табл. 6), способ продолжали и образцы отбирали согласно плану отбора.b) Если распределение размеров частиц и плотности не находились в пределах приемлемых критериев и не были близки к целевым (см. табл. 6), если необходимо, способ оптимизировали (например, путем изменения одного или более из следующего: сопло, выходная температура, давление подачи). Мешки для сбора заменяли и порошок, не удовлетворяющий критериям приемлемости, подвергали карантину. Как только образец был в пределах спецификации, начинали способ с текущими параметрами.C) Продолжение распылительной сушки 1) Брали образцы согласно плану отбора. 2) Отмечали любые изменения параметров обработки. 3) Отмечали любые наблюдаемые неполадки или остановки непрерывной работы. 4) По завершению распылительной сушки подаваемого раствора, переключали на равновесный растворитель и следовали нормальной процедуре прекращения работы.D) Способ последующей сушки 1) Дисперсию, подвергнутую распылительной сушке, загружали во вторичную сушку и сушили,пока все остаточные растворители (хлористый метилен, ацетон, этилацетат и толуол) не были ниже уста- 21018811 новленных спецификаций. Оборудование Для смешивания начального раствора использовали 8000 л производственный реактор, оснащенный механической мешалкой и термическим контуром. Промышленную распылительную сушку (Niro Pharmaceutical Spray Dryer FSD 12.5CC) использовали в нормальном прямоточном режиме распылительной сушки. Использовали систему сопел высокого давления (модификация Spraying Systems Free passage SKMFP Series, отверстие 48-54, сердечник 21) . Высокоэффективным гидравлическим насосом с совместимыми с растворителем/устойчивыми прокладками закачивали загружаемый раствор через распылитель в сосуд распылительной сушки. Пассивным циклоном отделяли продукт от отработанного газа и паров растворителя. Затем собирали тонкие частицы, не отделенные циклоном в фильтровальный мешок. Полученный газ конденсировали для удаления растворителей способа и рециркулировали назад в нагреватель и распылительную сушку (замкнутый цикл). Фиг. 2 представляет собой схему способа распылительной сушки. Полученный продукт затем переносили в биконическую вакуумную сушку для высушивания остаточных растворителей. Ключевые параметры и контроль способа Ключевые параметры и контроль способа были необходимы как для распылительной сушки, так и для способа биконической сушки. Первоначальные контрольные параметры способа были определены посредством предварительных экспериментальных партий. Ключевые параметры и контроль для способа распылительной сушки, которые наблюдали и регистрировали в ходе всего времени обработки, были: Установка распылителя/сопла Давление подачи Температура на входе Заданное значение температуры конденсора (при примерно от -10 до -15 С) Ключевые измеряемые параметры для способа распылительной сушки, которые наблюдали и регистрировали в ходе всего времени обработки, были: Скорость подачи раствора Температура на выходе Градиент давления циклона и скорость потока сушильного газа В табл. 2 определены параметры способа распылительной сушки/измеряемые параметры, установки/диапазоны и целевые инструкции. Таблица 2. Переменные, установки и целевые значения распылительной сушки Материалы Как указано в табл. 1 и 3, все использованные эксципиенты и растворители способа соответствовали современным монографиям Европейской Фармакопеи, Японской Фармакопеи или USP/NF. Все эксципиенты и растворители способа приобретали от утвержденных поставщиков. Были приняты сертификаты анализа производителя и все полученные материалы будут подвергаться исследованию. Таблица 3. Материалы Вариации в производстве В производстве 2 использовали способ, оптимизированный для дисперсии. Отличительная особенность указанной дисперсии состояла в том, что она имела больший размер частиц и объемную плот- 22018811 ность, по сравнению с производством 1, что необходимо для текучести порошка и непосредственного прессования на высокоскоростном таблетирующем прессе. Для получения такого порошка изменяли параметры распылительной сушки. Также производили изменения для стабилизации способа и для того,чтобы избежать возможных отклонений. Пример 4. Подвергаемые распылительной сушке дисперсии VX-950 получали при использовании системы растворителей, которая содержала воду, как описано. Система растворителя, содержала 75% хлористого метилена; 24% ацетона; и 1% воды (масс./масс./масс.). Дисперсия 49,5% VX-950; 49,5 % HMPCAS-HG и 1% SLS (мас./мас./мас.). Как указано на фиг. 3, испытывали различные комбинации температуры на выходе, давления подачи, давления циклона, установленную температуру конденсатора, типа сопла, загрузки твердых веществ и скорости подачи раствора в способе распылительной сушки. Как указано на фиг. 4,изменение этих параметров изменяла свойства (диапазон размера частиц (PS), объемную плотность,плотность утряски и содержание остаточных растворителей) полученных дисперсий. Пример 5. Цели и критерии успеха Были получены сухие дисперсии с низкими содержаниями остаточных растворителей и целевыми характеристиками порошка. Критерии успех включали приемлемый выход способа ( 80%) и соответствие заданным спецификациям целевого продукта лекарственного средства по чистоте и соответствие целевых характеристик диапазону, указанному для физических характеристик (размер частиц и объемная плотность). Композиция состава и описание процесса Состав композиции для каждой из двух полученных активных дисперсий описан в табл. 4. Таблица 4. Состав композиции для каждой из двух полученных активных дисперсий на основе 116,25 кг Схематическое графическое представление способа производства представлено на фиг. 4. Объяснение протекания способа представлено ниже: А) Получение раствора и распылительная сушка 1) Хлористый метилен получали в равновесном баке растворителя. 2) Деионизованную воду загружали во второй смесительный сосуд (см. табл. 4). 3) Подходящее количество хлористого метилена (см. табл. 1) получали в основном растворном реакторе. Датчики перепада давления служили подтверждением правильных количеств загружаемых растворителей. 4) В основной растворный реактор загружали вещество лекарственного средства VX-950 (см. табл. 7). Общее количество загруженных твердых веществ составило 15 мас.%. Отбирали образец для визуального подтверждения того, что вещество лекарственного средства растворялось. 5) HPMCAS-HG загружали в основной растворный реактор (см. табл. 4). Общее количество загруженных твердых веществ составило 15 мас.%. 6) Добавляли количество ацетона (см. табл. 4). Отбирали образец для определения, растворились ли все твердые вещества. 7) SLS и воду загружали в основной смесительный реактор. 8) Устанавливали сопло высокого давления Spraying Systems SK-MFP и тестировали на корректное распыление с равновесным растворителем.B) Пуск распылительной сушки 1) Распылительную сушку нагревали до подходящей температуры на выходе. 2) Распыляли равновесные растворители до тех пор, пока все параметры не выравнивались и не становились постоянными. 3) Начинали распылительную сушку загрузочного раствора в тот момент, когда распылительная сушка находилась в равновесии. 4) Сухие частицы пассивно отделяли от технологического газа при использовании циклона и собирали в полиэтиленовые мешки. Затем технологический газ фильтровали от мелких частиц и конденсировали для удаления растворителей способа. 5) Отбирали начальный образец и тестировали его на распределение размера частиц и объемную плотность и плотность утряски.a) Если распределение размеров частиц и плотности находились в пределах приемлемых критериев и были близки к целевым (см. табл. 11), способ продолжали и образцы отбирали согласно плану отбора.b) Если распределение размеров частиц и плотности не находились в пределах приемлемых критериев и не были близки к целевым (см. табл. 11), если необходимо способ оптимизировали (например,путем изменения одного или более из следующего: выходная температура, давление подачи или температура конденсора). Мешки для сбора заменяли и порошок неудовлетворяющий критериям приемлемости подвергали карантину. Как только образец был в пределах спецификации, начинали способ с текущими параметрами.C) Способ последующей сушки 1) Подвергнутую распылительной сушке загружали во второй сушитель. 2) Продолжали сушку пока все остаточные растворители (хлористый метилен, ацетон, этилацетат и толуол) не были ниже установленных спецификаций.D) Тестирование, перевозка 1) Для образцов указанной дисперсии проводили промышленные испытания. Оборудование Для смешивания начального раствора использовали 8000 л производственный реактор (R240) , оснащенный механической мешалкой и термическим контуром. Для смеси SLS и воды использовали реактор (R32). Промышленную распылительную сушку (Niro Pharmaceutical Spray Dryer FSD 12.5CC) использовали в нормальном прямоточном режиме распылительной сушки. Использовали систему сопел высокого давления (модификация Spraying Systems Free passage SKMFP Series, отверстие 48-54, сердечник 21). Высокоэффективным гидравлическим насосом с совместимыми с растворителем/устойчивыми прокладками закачивали загружаемый раствор через распылитель в сосуд распылительной сушки. Пассивным циклоном отделяли продукт от отработанного газа и паров растворителя. Затем собирали тонкий частицы не отделенные циклоном в фильтровальный мешок. Полученный газ конденсировали для удаления растворителей способа и рециркулировали назад в нагреватель и распылительную сушку (замкнутый цикл). Фиг. 2 представляет собой схему способа распылительной сушки. Полученный продукт затем переносили в биконическую вакуумную сушку (S901) для высушивания остаточных растворителей. Высушенный продукт просеивали в перчаточном боксе с азотной атмосферой и упаковывали. Ключевые параметры и контроль способа Ключевые параметры и контроль способа были необходимы как для распылительной сушки, так и для способа биконической сушки. Первоначальные контрольные параметры способа были определены посредством предварительных экспериментальных партий. Ключевые параметры и контроль для способа распылительной сушки, которые наблюдали и регистрировали в ходе всего времени обработки, были: Установка распылителя/сопла Давление подачи Температура на входе Заданное значение температуры конденсора (при примерно от -10 до -15 С) Ключевые измеряемые параметры для способа распылительной сушки, которые наблюдали и регистрировали в ходе всего времени обработки, были: Скорость подачи раствора Температура на выходе Градиент давления циклона и скорость потока сушильного газа В табл. 5 определены параметры способа распылительной сушки/измеряемые параметры, установки/диапазоны и целевые инструкции Таблица 5. Переменные, установки и целевые значения распылительной сушки Материалы Как указано в табл. 4 и 6, все использованные эксципиенты и растворители способа соответствовали современным монографиям Европейской Фармакопеи, Японской Фармакопеи или USP/NF. Все эксципиенты и растворители способа приобретали от утвержденных поставщиков. Были приняты сертификаты анализа производителя и все полученные материалы будут подвергаться исследованию. Таблица 6. Вариации в производстве В производстве использовали 10 или 30 мас.% раствора. Также может изменяться производство раствора. В некоторых партиях в конце добавляют смесь SLS/деионизованной воды в основной смесительный реактор. Отслеживали выходную температуру распылительной сушки, но в некоторых производствах диапазон или целевое значение не было определено. Рекомендован уменьшенный отбор проб в ходе процесса. Можно проводить KF тестирование полимера перед загрузкой. Описан ряд вариантов осуществления изобретения. Несмотря на это будет понятно, что можно проводить ряд изменений без отклонений от объема и сущности изобретения. Таким образом, другие варианты осуществления входят в объем следующей формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения твердой дисперсии лекарственного средства, включающий:a) получение раствора или суспензии лекарственного средства в системе растворителей, где система растворителей включает один или более нелетучих растворителей, выбранных из группы, состоящей из ледяной уксусной кислоты и воды; иb) распылительную сушку раствора или суспензии лекарственного средства с образованием твердой дисперсии, где лекарственное средство представляет собой соединение формулы 2. Способ по п.1, в котором нелетучий растворитель присутствует в количестве от примерно 0,1 до примерно 20 мас.%. 3. Способ по п.1, в котором система растворителей дополнительно включает один или более летучих растворителей, выбранных из хлористого метилена и ацетона. 4. Способ по п.1, в котором нелетучий растворитель включает ледяную уксусную кислоту. 5. Способ по п.3, в котором система растворителей включает хлористый метилен, ацетон и ледяную уксусную кислоту. 6. Способ по п.5, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты. 7. Способ по п.1, в котором нелетучий растворитель включает воду. 8. Способ по п.1, в котором система растворителей включает хлористый метилен, ацетон и воду. 9. Способ по п.8, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды. 10. Способ по п.1, в котором раствор или суспензия лекарственного средства дополнительно включает поверхностно-активное вещество, где поверхностно-активное вещество представляет собой лаурилсульфат натрия. 11. Способ по п.1, в котором раствор или суспензия лекарственного средства дополнительно включает сукцинат ацетата гидроксипропилметилцеллюлозы. 12. Способ по п.11, в котором твердая дисперсия представляет собой аморфную твердую дисперсию. 13. Способ по п.1, в котором раствор или суспензия лекарственного средства дополнительно включает смесь из двух полимеров: гидроксипропилметилцеллюлозы и сукцинат ацетата гидроксипропилметилцеллюлозы. 14. Способ по п.1, дополнительно включающий один или несколько полимеров, присутствующих в количестве от примерно 30 до примерно 70 мас.% твердой дисперсии. 15. Способ по п.1, в котором нелетучий растворитель присутствует в количестве от примерно 0,1 до примерно 20 мас.%. 16. Способ по п.3, в котором система растворителей включает комбинацию одного или более из летучих растворителей с одним или более из нелетучих растворителей. 17. Способ по п.16, в котором один или более из летучих растворителей включает хлористый метилен и ацетон. 18. Способ по п.16, в котором один или более из нелетучих растворителей включает ледяную уксусную кислоту. 19. Способ по п.16, в котором система растворителей включает хлористый метилен, ацетон и ледяную уксусную кислоту. 20. Способ по п.19, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты. 21. Способ по п.16, в котором нелетучий растворитель включает воду. 22. Способ по п.16, в котором система растворителей включает хлористый метилен, ацетон и воду. 23. Способ по п.22, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды. 24. Способ по п.11, в котором система растворителей включает ледяную уксусную кислоту. 25. Способ по п.11, в котором система растворителей включает воду. 26. Способ по п.11, в котором раствор или суспензия лекарственного средства дополнительно включает поверхностно-активное вещество, где поверхностно-активное вещество представляет собой лаурилсульфат натрия. 27. Способ получения твердой дисперсии лекарственного средства, включающий:a) получение раствора или суспензии лекарственного средства, сукцинат ацетата гидроксипропилметилцеллюлозы и систему растворителей, включающую по меньшей мере один нелетучий растворитель, выбранный из группы, состоящей из ледяной уксусной кислоты и воды; иb) распылительную сушку раствора или суспензии лекарственного средства с образованием твердой дисперсии, где лекарственное средство представляет собой соединение формулы 28. Способ по п.27, дополнительно включающий гидроксипропилметилцеллюлозу. 29. Способ по п.27, в котором сукцинат ацетата гидроксипропилметилцеллюлозы присутствует в количестве от примерно 30 до примерно 90 мас.% твердой дисперсии. 30. Способ по п.27, в котором система растворителей дополнительно включает один или более летучих растворителей, выбранных из хлористого метилена и ацетона. 31. Способ по п.30, в котором один или более из нелетучих растворителей присутствует в количестве от примерно 0,1 до примерно 20 мас.%. 32. Способ по п.30, в котором система растворителей включает комбинацию одного или более из летучих растворителей с одним или более нелетучим растворителем. 33. Способ по п.32, в котором один или более из летучих растворителей включает хлористый мети- 26018811 лен и ацетон. 34. Способ по п.33, в котором система растворителей включает хлористый метилен, ацетон и нелетучий растворитель в процентном весовом соотношении примерно 75:24:1. 35. Способ по п.32, в котором нелетучий растворитель включает ледяную уксусную кислоту. 36. Способ по п.32, в котором система растворителей включает хлористый метилен, ацетон и ледяную уксусную кислоту. 37. Способ по п.36, в котором система растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% ледяной уксусной кислоты. 38. Способ по п.32, в котором нелетучий растворитель включает воду. 39. Способ по п.32, в котором комбинация растворителей включает хлористый метилен, ацетон и воду. 40. Способ по п.39, в котором комбинация растворителей включает от примерно 40 до примерно 80% хлористого метилена, от примерно 20 до примерно 35% ацетона и от примерно 0,1 до примерно 15% воды. 41. Способ по п.27, в котором система растворителей включает ледяную уксусную кислоту. 42. Способ по п.27, в котором система растворителей включает воду. 43. Способ по п.27, в котором смесь дополнительно включает лаурилсульфат натрия. 44. Способ по п.1, включающий:a) получение раствора содержащего VX-950 и растворитель, в котором растворитель включает по меньшей мере один нелетучий растворитель, выбранный из ледяной уксусной кислоты и воды, и раствор дополнительно включает целлюлозный полимер, выбранный из гидроксипропилметилцеллюлозы, и сукцинат ацетата гидроксипропилметилцеллюлозы;b) распылительную сушку смеси с образованием твердой аморфной дисперсии, включающей VX950 и целлюлозный полимер. 45. Способ по п.1, включающий:a) получение смеси, содержащей VX-950 и растворитель, в котором растворитель включает ледяную уксусную кислоту, и смесь дополнительно включает по меньшей мере один целлюлозный полимер,выбранный из гидроксипропилметилцеллюлозы и сукцинат ацетата гидроксипропилметилцеллюлозы; иb) распылительную сушку смеси с образованием твердой дисперсии, включающей VX-950. 46. Способ по п.1, включающий:a) получение смеси, содержащей VX-950 и растворитель, в котором растворитель включает воду, и смесь дополнительно включает по меньшей мере один целлюлозный полимер, выбранный из гидроксипропилметилцеллюлозы и сукцинат ацетата гидроксипропилметилцеллюлозы, иb) распылительную сушку смеси с образованием твердой дисперсии, включающей VX-950. 47. Способ по п.1, в котором VX-950 высушен распылением. 48. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.1. 49. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.27. 50. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.44. 51. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.45. 52. Твердая дисперсия лекарственного средства, обладающая противовирусной активностью, полученная способом по п.46.
МПК / Метки
МПК: A61K 38/05
Метки: способы, полученные, получения, этим, твердой, твердые, средства, дисперсии, способом, лекарственного
Код ссылки
<a href="https://eas.patents.su/30-18811-sposoby-polucheniya-tverdojj-dispersii-lekarstvennogo-sredstva-i-tverdye-dispersii-lekarstvennogo-sredstva-poluchennye-etim-sposobom.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения твердой дисперсии лекарственного средства и твердые дисперсии лекарственного средства, полученные этим способом</a>
Предыдущий патент: Защищенный от приведения в действие детьми выдачной механизм (варианты)
Следующий патент: Система для выработки электроэнергии из плазмы
Случайный патент: Новый способ предупреждения или лечения инфекции, вызываемой m.tuberculosis












