Хинолинил и бензотиазолил ppar-гамма модуляторы
Номер патента: 5976
Опубликовано: 25.08.2005
Авторы: Хагивара Атсуси, Рабенстейн Стивен М., Синкаи Хисаси, Хаузе Джонатан Б., Макджи Лоуренс Р., Фурукава Нобору
Формула / Реферат
1. Соединение формулы (I)
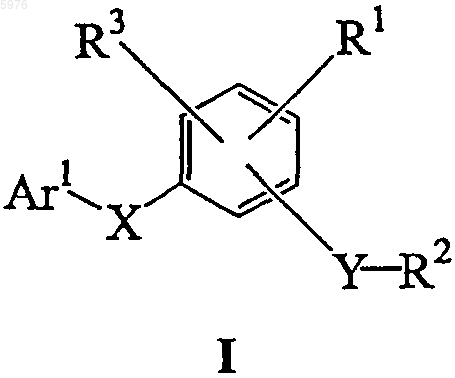
где Ar1 представляет собой 2-бензотиазолил, замещенный 0, 1 или 2 заместителями, выбранными из галогена, -CN, -NO2, (C1-3)алкила, -O(C1-3)алкила, -COOH, COO(C1-3)алкила, S(O)2Me; -NH2-, MeSO2NH-, теразолила и перфтор(C1-4)алкила;
X выбран из группы, состоящей из -O-, -C(O)- и -N(R11)-, где
R11 представляет собой член, выбранный из группы, состоящей из водорода и (C1-C8)алкила;
Y является -N(R12)-S(O)2-, где R12 представляет собой член, выбранный из группы, состоящей из водорода и (C1-C8)алкила;
R1 представляет собой член, выбранный из группы, состоящей из водорода и галогена;
R2 представляет собой незамещенный фенил или замещенный фенил, имеющий от 1 до 3 заместителей, независимо выбираемых из -OCF3, -O(C1-4)алкила, -CF3, -C(O)CH3, -NHCH2CH3 и (C1-4)алкила;
R3 представляет собой член, выбранный из группы, состоящей из галогена и (C1-C4)алкокси.
2. Соединение по п.1, в котором X представляет двухвалентную связку, выбранную из группы, состоящей из -O- и -NH-.
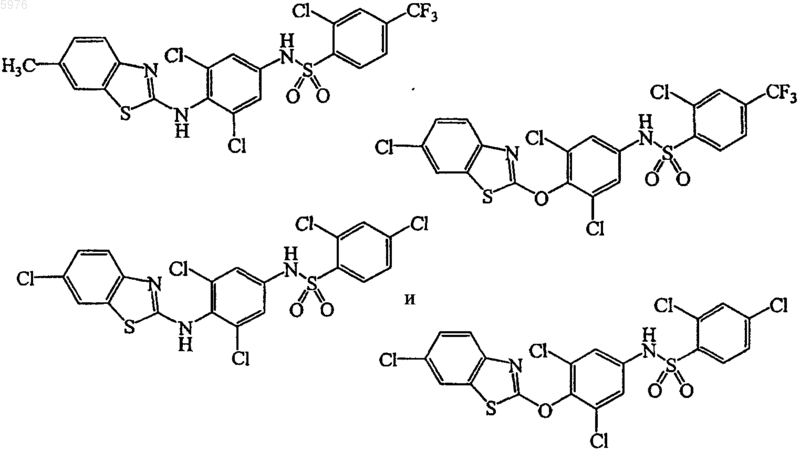
3. Соединение по п.1, выбранное из группы, состоящей из
4. Соединение по п.1, представленное формулой
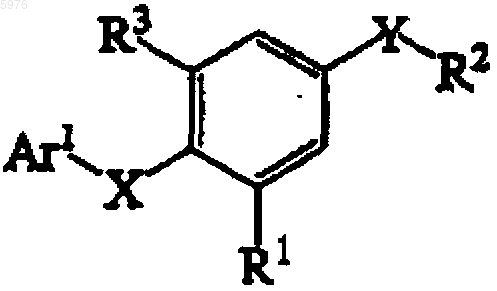
или его фармацевтически приемлемая соль или сольват.
5. Соединение по любому из пп.1-4, в котором Ar1 представляет собой незамещенный 2-бензотиазолил или 2-бензотиазолил, замещенный галогеном, (C1-C8)алкилом.
6. Соединение по любому из пп.1-4, в котором Ar1 представляет собой незамещенный 2-бензотиазолил или 2-бензотиазолил, замещенный галогеном, трифторметилом или низшим алкилом; Y представляет собой -NH-SO2; и R2 представляет собой фенил, замещенный галогеном, трифторметилом, низшим алкилом или низшим алкокси.
7. Соединение формулы

или его фармацевтически приемлемая соль или сольват, где
Ar1 представляет собой незамещенный 2-бензотиазолил или 2-бензотиазолил, замещенный хлором, трифторметилом или низшим алкилом;
X представляет собой (C1-C8)алкилен;
Y представляет собой -NH-SO2-;
R1 представляет собой галоген или водород;
R3 представляет собой галоген;
R2 представляет собой замещенный фенил, который имеет от 1 до 3 заместителей, выбранных из группы, состоящей из галогена, трифторметила и (C1-C8)алкила.
8. Соединение по п.7, в котором Ar1 представляет собой незамещенный 2-бензотиазолил или 2-бензотиазолил, замещенный в положении 5 хлором или метилом; X представляет собой метилен; R1 представляет собой хлор; и R2 представляет собой замещенный фенил, который имеет от 1 до 3 заместителей, выбранных из группы, состоящей из хлора, трифторметила и метила.
9. Соединение по п.7, представленное формулой
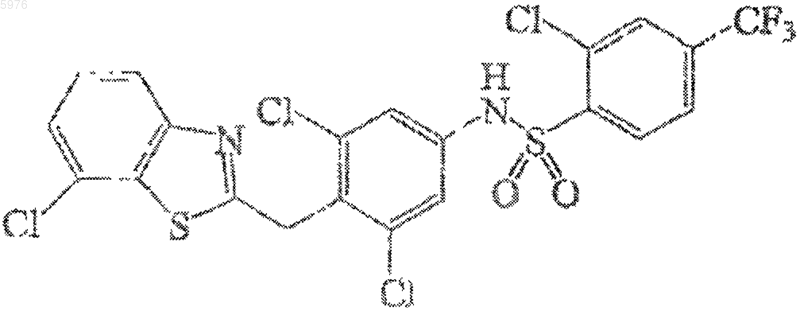
10. Композиция, содержащая фармацевтически приемлемый носитель или наполнитель и соединение по любому из пп.1-9.
11. Применение соединения по любому из пп.1-9 для лечения или модулирования нарушения метаболизма или воспалительного заболевания у хозяина, включающее введение указанному хозяину терапевтически эффективного количества этого соединения.
12. Применение по п.11, при котором указанным хозяином является млекопитающее, выбранное из группы, состоящей из человека, собаки, обезьяны, мыши, крысы, лошади, кошки.
13. Применение по п.11, при котором введение является оральным.
14. Применение по п.11, при котором введение является местным.
15. Применение по п.11, при котором указанное введение является профилактическим, чтобы предотвратить начало PPARg-опосредованных состояний.
16. Применение по п.11, при котором указанное нарушение метаболизма или воспалительное состояние выбрано из группы, включающей ожирение, гиперхолестеринемию или иное липидопосредованное заболевание и воспалительное состояние.
17. Применение по п.11, при котором указанно воспалительное состояние является инсулиннезависимым сахарным диабетом (NIDDM).
18. Применение по п.11, при котором введение является парентеральным.
19. Применение по п.11, при котором указанное метаболическое нарушение или воспалительное состояние опосредуется PPARg.
20. Применение по п.11, при котором указанное метаболическое нарушение или воспалительное состояние является атеросклерозом или ревматоидным артритом.
21. Применение по любому из пп.11-20, при котором указанным хозяином является человек.
22. Применение по п.21 с целью лечения метаболических нарушений или воспалительных состояний.
Текст
005976 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, которые модулируют PPAR рецептор и которые полезны для диагностики и лечения диабетов типа II (и их осложнений), гиперхолестеринемии (и родственных заболеваний, связанных с патологически высокими или низкими уровнями липопротеина или триглицирида в плазме крови), а также воспалительных заболеваний. Предшествующий уровень техники Рецепторы, активируемые пролифераторами пероксисом (PPARs), представляют собой участвующие в передаче сигнала белки, принадлежащие к надсемейству стеорид/тироид/ретиноидных рецепторов. Первоначально PPARs были идентифицированы как рецепторы-"сироты", не имеющие известных лигандов, но они были названы так благодаря их способности опосредовать плейотропные воздействия жирнокислотных пролифераторов пероксисом. Указанные рецепторы функционируют как лигандрегулируемые транскрипционные факторы, которые контролируют экспрессию генов-мишеней путем связывания с чувствительной ДНК последовательностью в форме гетеродимеров с RXR. Гены-мишени кодируют ферменты, участвующие в липидном метаболизме и дифференциации адипоцитов. Таким образом, обнаружение транскрипционных факторов, вовлеченных в регуляцию липидного метаболизма, обеспечивает проникновение в механизмы регулирования энергетического гомеостаза у позвоночных животных и в дальнейшем определяет мишени для разработки терапевтических агентов для лечения нарушений, таких как ожирение, диабеты и дислипидемия.PPAR является одним из представителей ядерных рецепторов - надсемейства лигандактивируемых транскрипционных факторов, - и, как было показано, его экспрессия является специфичной для жировой ткани. Его экспрессия индуцируется на ранних стадиях дифференциации нескольких линий клеток преадипоцитов. Дополнительное исследование продемонстрировало, что PPAR играет центральную роль в адипогенном сигнальном каскаде. PPAR также регулирует ген ob/leptin, который вовлечен в регулирование энергетического гомеостаза и дифференциацию адипоцитов, которая, как было показано, является той критической ступенью, на которую должны быть нацелены воздействия при лечении заболеваний,связанных с ожирением и диабетом. Чтобы понять роль PPAR в дифференциации адипоцитов, ряд исследователей сосредоточился на идентификации активаторов PPAR. Один класс соединений, таких как тиазолидиндионы, которые, как было известно, обладают адипогенным действием на преадипоциты, а также мезенихимальные стволовые клетки in vitro и антидиабетическим действием на моделях животных на инсулиннезависимыми сахарными диабетами (NIDDM), также демонстрирует способность быть РРАR-селективными лигандами. Как было показано в последнее время, соединения, которые селективно активируют мышиный PPAR,обладают антидиабетической активностью у мышей in vivo. Несмотря на достижения, сделанные в области исследования противодиабетических агентов класса тиазолидиндиона, недопустимые побочные эффекты ограничили их клиническое использование. Соответственно, имеется потребность в мощных селективных активаторах PPAR, которые будут полезны для лечения NIDDM и других заболеваний, связанных с липидным метаболизмом и энергетическим гомеостазом. Кроме того, соединения, которые блокируют действие PPAR, будут полезными для предотвращения созревания преадипоцитов в адипоциты, и, таким образом, они могут быть полезными при лечении ожирения и близких заболеваний, связанных с нежелательным созреванием адипоцитов. Настоящее изобретение обеспечивает соединения, которые являются полезными как в качестве активаторов, так и антагонистов PPAR активности, а также содержащие их композиции и способы их применения. Сущность изобретения В одном из аспектов настоящее изобретение обеспечивает способы лечения или профилактики заболеваний, связанных с нарушением обмена веществ или воспалений. Обычно способы включают введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения, имеющего формулу (I): где символ Аr1 означает замещенный или незамещенный 2-бензотиазолил или замещенный или незамещенный хинолинил; Х представляет собой двухвалентный мостик, выбранный из -О-, -С(О)-, -СН(R10)-,-N(R11)- и -S(O)k-, где R10 выбирают из водорода, циано и (С 1-С 4)алкила, R11 выбирают из водорода и (С 1 С 8)алкила и нижний индекс k является целым числом от 0 до 2; при условии, что когда Аr1 представляет собой замещенный или незамещенный 2-бензотиазолил, тогда Х отличен от значения -S(O)k-.Y означает двухвалентный мостик, имеющий формулу -N(R12)-S(O)2-, где R12 представляет собой водород или (С 1-С 8)алкил.-1 005976 Символ R1 означает водород, (С 2-С 8)гетероалкил, галоген, (С 1-С 8)алкил, (C1-С 8)алкокси, -С(O)R14,-CO2R14, -С(O)NR15R16, -S(O)p-R14, -S(O)q-NR15R16, -O-C(O)-R17 или -N(R14)-C(O)-R17; где R14 выбран из водорода, (С 1-С 8)алкила, (С 2-С 8)гетероалкила, арила и арил (С 1-С 4)алкила; R15 и R16 независимо выбраны из водорода, (С 1-С 8)алкила, (С 2-С 8)гетероалкила, арила и арил (С 1-С 4)алкила или, взятые вместе с атомом азота, к которому они присоединены, образуют 5-, 6- или 7-членное кольцо; R17 выбирают из (C1 С 8)алкила, (С 2-С 8)гетероалкила, арила и арил (С 1-С 4)алкила; нижний индекс р является целым числом от 0 до 3; и нижний индекс q является целым числом от 1 до 2.R2 представляет собой замещенный или незамещенный арил; иR3 выбирают из галогена и (С 1-С 8)алкокси. В другом аспекте настоящее изобретение обеспечивает способы лечения или профилактики заболеваний и состояний, опосредованных PPAR, а также способы модулирования PPAR. Еще в одном аспекте настоящее изобретение обеспечивает соединения формулы I и фармацевтические композиции, содержащие соединения формулы I. Подробное описание изобретения Сокращения и определения Сокращения, применяемые в настоящем изобретении, являются обычными, если другое не отмечено. Применяемый в описании термин "диабеты" относится к сахарным диабетам типа I (детские диабеты) или к сахарным диабетам типа II (инсулиннезависимые сахарные диабеты или NIDDM), предпочтительно сахарным диабетам типа II. Термины "лечить", "лечение" и "обработка" относятся к методу облегчения или подавления болезни и/или сопутствующих ей симптомов. Термины "предотвращать", "профилактика" и "предупреждение" относятся к способу уменьшения вероятности или устранения возможности того, что болезнь будет развиваться. Применяемый в настоящем описании термин "связанное с PPAR состояние или заболевание" и т.п. относится к состоянию или заболеванию, характеризующемуся несоответствующей, например меньшей чем или большей чем нормальная, PPAR активностью. Опосредованное PPAR состояние или заболевание может быть полностью или частично связанным с необычной PPAR активностью. Однако опосредованное PPAR состояние или заболевание является одним из тех, в котором модулирование PPAR заканчивается некоторым воздействием на текущее состояние или заболевание (например, PPAR антагонист приводит к некоторому улучшению состояния у, по крайней мере, некоторых больных). Примеры опосредованных PPAR состояний и заболеваний включают метаболические нарушения, например диабеты, ожирение, гипергликемию, устойчивость к инсулину, гиперинсулинемию, гиперхолестеринемию,гипертонию, гиперлипопротеинемию, гиперлипидемию, гипертриглицеридемию и дислипидемию, а также воспалительные состояния, например ревматоидный артрит и атеросклероз. Термин "модулировать" относится к способности соединения увеличивать или уменьшать функцию или активность PPAR. Модуляция, как описано в настоящем изобретении, включает ингибирование или активацию PPAR, как непосредственную, так и косвенную. Ингибиторы представляют собой соединения, которые, например, частично связываются или полностью блокируют возбуждение, уменьшают,предотвращают, задерживают активацию, инактивируют, уменьшают чувствительность или снижают сигнальную трансдукцию, например антагонисты. Активаторы представляют собой соединения, которые, например, связывают, стимулируют, увеличивают, открывают, активируют, облегчают, увеличивают активацию, повышают чувствительность или увеличивают сигнальную трансдукцию, например агонисты. Термин "терапевтически эффективное количество" относится к такому количеству вводимого соединения, которое достаточно, чтобы предотвратить развитие или облегчить до некоторой степени один или больше симптомов состояния или заболевания, которые лечат. Термин "субъект" определен в настоящем изобретении как относящийся к животным, таким как млекопитающие, включая, но не ограничиваясь, приматами (например, человеком), коровами, овцами,козами, лошадьми, собаками, кошками, кроликами, крысами, мышами и т.п. В предпочтительных воплощениях субъект представляет собой человека. Термин "алкил", как сам по себе или как часть другого заместителя, обозначает, если другое не указано, прямую или разветвленную цепь, или циклический углеводородный радикал, или их комбинацию,которая может быть полностью насыщенной, моно- или полиненасыщенной и может включать ди- и поливалентные радикалы, имеющие обозначенное число атомов углерода (т.е. C1-С 10 подразумевает от 1 до 10 атомов углерода). Примеры насыщенных углеводородных радикалов включают группы, такие как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, (циклогексил)этил, циклопропилметил, гомологи и изомеры, например н-пентил, н-гексил, н-гептил, н-октил и т.п. Ненасыщенная алкильная группа представляет собой группу, имеющую одну или больше двойных или тройных связей. Примеры ненасыщенных алкильных групп включают винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил,высшие гомологи и изомеры. Термин "алкил," если другое не указано, также означает, что он включает-2 005976 производные алкила, которые определены более детально ниже как "гетероалкил, " "циклоалкил" и "алкилен". Термин "алкилен", отдельно или как часть другого заместителя, подразумевает двухвалентный радикал, полученный из алкана, например -CH2 СН 2 СН 2 СН 2-. Обычно алкильная группа будет иметь от 1 до 24 атомов углерода с предпочтительными группами, которые имеют 10 или меньшее количество атомов углерода. "Низший алкил" или "низший алкилен" представляет собой более короткую цепь алкила или алкиленовой группы, как правило, имеющую 8 или меньшее число атомов углерода. Термин "гетероалкил", сам по себе или в комбинации с другим термином, означает, если другое не указано, устойчивую прямую или разветвленную цепь, или циклический углеводородный радикал, или их комбинацию, состоящую из установленного числа атомов углерода и от 1 до 3 гетероатомов, выбранных из группы, состоящей из О, N, Si и S, и где атомы азота и серы могут быть необязательно окислены,и гетероатом азота может быть необязательно кватернизован. Гетероатом(ы) О, N и S может быть размещен в любом внутреннем положении гетероалкильной группы. Гетероатом Si может быть размещен в любом положении гетероалкильной группы, включая положения, которыми алкильная группа присоединена к остатку молекулы. Примеры включают -СН 2-СН 2-O-СН 3, -СН 2-СН 2-NН-СН 3, -CH2-CH2-N(СН 3)-СН 3,-CH2-S-СН 2-СН 3, -CH2-CH2-S(О)-СН 3, -CH2-CH2-S(O)2-СН 3, -СН=СН-O-СН 3, -Si(СН 3)3, -СН 2-СН=N-ОСН 3 и -CH=CH-N(СН 3)-СН 3. Вплоть до 2 гетероатомов могут быть последовательны в таких группах, как,например, -СН 2-NН-ОСН 3 и -CH2-O-Si(СН 3)3. Также термин "гетероалкил" охватывает те радикалы, которые описаны более подробно ниже как "гетероалкилен" и "гетероциклоалкил". Термин "гетероалкилен", сам по себе или как часть другого заместителя, означает двухвалентный радикал, полученный из гетероалкила, как иллюстрируется группами -CH2-CH2-S-СН 2 СН 2- и -CH2-S-CH2-CH2-NH-СН 2-. В гетероалкиленовых группах гетероатомы могут также занимать любой или оба конца цепи. Однако в дальнейшем для алкиленовых и гетероалкиленовых связывающих групп так же, как для всех других связывающих групп, описанных в настоящем изобретении, не подразумевается никакая ориентация связывающей группы. Термины "циклоалкил" и "гетероциклоалкил", сами по себе или в комбинации с другими терминами, представляют, если не указано другое, циклические версии "алкила" и "гетероалкила", соответственно. Кроме того, в гетероциклоалкиле гетероатом может занимать положение, которым гетероцикл прикрепляется к остатку молекулы. Примеры циклоалкила включают циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.п. Примеры гетероциклоалкила включают 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2 пиперазинил и т.п. Термины "гало" или "галоген", сами по себе или как часть другого заместителя, означают, если другое не указано, атом фтора, хлора, брома или иода. Кроме того, термины, такие как "фторалкил", включают монофторалкил и полифторалкил. Термин "арил", сам по себе или в комбинации с другими терминами (например, арилокси, арилтиокси, арилалкил), означает, если другое не указано, ароматический заместитель, который может иметь одно или несколько колец (до трех колец), которые сконденсированы или связаны ковалентно. Кольца могут каждый раз содержать от 0 до 4 гетероатомов, выбранных из N, О, и S, где атомы азота и серы необязательно окислены и атом(ы) азота необязательно кватернизован(ы). Арильные группы, которые содержат гетероатомы, могут относиться к такому термину, как "гетероарил", и могут быть присоединены к остатку молекулы через гетероатом. Примеры, которыми не ограничивается выбор арильных групп,включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2 имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3 изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 2-бензотиазолил, 5-бензотиазолил, 2-бензоксазолил, 5-бензоксазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолинил, 5 изохинолинил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолинил и 6-хинолинил. Заместители для каждого из вышеупомянутых указанных арильных колец выбраны из группы приемлемых заместителей, описанных ниже. Термин "арилалкил" предполагает включение тех радикалов, в которых арильная группа присоединена к алкильной группе (например, бензил, фенэтил, пиридилметил и т.п.) или гетероалкильной группе (например, феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и т.п.). Каждый из вышеупомянутых терминов (например, "алкил", "гетероалкил" и "арил") включает как замещенную, так и незамещенную формы обозначенного радикала. Предпочтительные заместители для каждого типа радикала приведены ниже. Заместители для алкильных и гетероалкильных радикалов (включая те группы, которые часто определяют как алкилен, алкенил, гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил,циклоалкенил и гетероциклоалкенил) могут быть вариантами групп, выбранных из -OR', =O, =NR', =N-OR',-NR'R", -SR', -галоген, -SiR'R"R"', -ОС(O)R', -C(O)R', -CO2R', CONR'R", -ОС(O)NR'R", -NR"C(O)R', -NR'C(O)NR"R'", -NR"C(O)2R', -NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R",-CN и -NO2 с числом, находящимся в интервале от 0 до (2N+1), где N является общим числом атомов углерода в таком радикале. R', R" и R'", каждый независимо относится к водороду, незамещенному (C1-3 005976C8)aлкилy и гетероалкилу, незамещенному арилу, арилу, замещенному 1-3 галогенами, незамещенным алкилом, алкокси или тиоалкоксигруппами, или к арил(С 1-С 4)алкильным группам. Когда R' и R" присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием 5-,6-, или 7-членного кольца. Например, -NR'R" предполагает включение 1-пирролидинила и 4-морфолинила. Из вышеупомянутого определения заместителей средний специалист в данной области понимает,что термин "алкил" предполагает включение групп, таких как галогеналкил (например, -СF3 и -СН 2 СF3) и ацил (например, -С(О)СН 3, -С(О)СF3, -С(O)СН 2OСН 3 и т.п.). Предпочтительно, алкильные группы (и имеющие в своем составе алкил, такие группы, как алкокси, гетероалкил и т.д.) являются незамещенными или имеют от 1 до 3 заместителей, выбранных из галогена, -OR', =O, -NR'R", -SR', -ОС(O)R', -С(O)R',-CO2R', -CONR'R", -NR"C(O)R', -S(O)2R', -S(O)2NR'R", -CN и -NO2. Более предпочтительно, алкил и группы, имеющие в своем составе алкил, имеют 0, 1 или 2 заместителя, выбранных из галогена, -OR', =O,-NR'R", -SR', -CO2R', -CONR'R", -NR"C(O)R', -CN и -NO2. Аналогично, заместители арильных групп могут различаться, и их выбирают из галогена, -OR',-ОС(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -С(O)R', -ОС(O)NR'R", -NR"C(O)R', -NR"C(O)2R',-NR'-C(O)NR"R'", -NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R", -N3,-CH(Ph)2, перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкил в количестве, находящемся в интервале от 0 до общего числа свободных валентностей в системе ароматического кольца; и где R', R" и R'" независимо выбраны из водорода, (С 1-С 8)алкила и гетероалкила, незамещенного арила, (незамещенный арил)-(С 1 С 4)алкила и (незамещенный арил)окси-(С 1-С 4)алкила. Предпочтительно, арильные группы являются незамещенными или имеют от 1 до 3 заместителей, выбранных из галогена, -OR', -ОС(O)R', -NR'R", -SR',-R', -CN, -NO2, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O)2R', -S(O)2NR'R", перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила. Еще более предпочтительно, если арильные группы имеют 0, 1 или 2 заместителя,выбранных из галогена, -OR', -NR'R", -SR', -R', -CN, -NO2, -CO2R', -CONR'R", -NR"C(O)R', -S(O)2R',-S(O)2NR'R", перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила. Два заместителя на расположенных рядом атомах арильного кольца могут быть необязательно замещены заместителем формулы -А-(СН 2)r-В-, где А и В независимо являются -СН 2-, -О-, -NH-, -S-, -S(О)-,-S(O)2-, -S(O)2NR'- или простой связью и r является целым числом от 1 до 3. Одна из простых связей таким образом образованного нового кольца может быть необязательно заменена двойной связью. Альтернативно, два заместителя на расположенных рядом атомах арильного кольца могут быть необязательно замещены заместителем формулы -(CH2)s-X-(CH2)t, где s и t являются независимо целыми числами от 0 до 3 и Х представляет собой -О-, -NR'-, -S-, -S(О)-, -S(O)2- или -S(O)2NR'-. Заместитель R' в -NR'- и-S(O)2NR'- выбирают из водорода или незамещенного (С 1-С 6)алкила. Применяемый в настоящем описании термин "гетероатом" означает включение кислорода (О), азота (N), серы (S) и кремния (Si). Термин "фармацевтически приемлемые соли" предполагает включение солей активных соединений,которые получают с нетоксичными кислотами или основаниями, в зависимости от конкретного заместителя, находящегося на соединениях, описанных в настоящем изобретении. Когда соединения настоящего изобретения содержат кислотные группы, аддитивно-основные соли могут быть получены при контактировании нейтральных форм таких соединений с достаточным количеством основания, при необходимости в подходящем инертном растворителе. Примеры фармацевтически приемлемых основно-аддитивных солей включают натриевую, кальциевую, аммониевую, органическую амино или магниевую соль или подобную соль. Когда соединения настоящего изобретения содержат основные группы, кислотно-аддитивные соли могут быть получены при контактировании нейтральных форм таких соединений с достаточным количеством кислоты, при необходимости в подходящем инертном растворителе. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают те, которые получены из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, иодисто-водородная или фосфористая кислоты и т.п., а также соли, полученные из относительно нетоксичных органических кислот, аналогичных уксусной, пропионовой, изомасляной, щавелевой, малеиновой, малоновой,бензойной, янтарной, пробковой, фумаровой, миндальной, фталевой, бензолсульфоновой, п-толилсульфоновой, лимонной, винной, метансульфоновой и т.п. Также сюда включены соли аминокислот, такие как аргинат и т.п., и соли органических кислот, аналогичных глюкуроновой или галактуроновой кислотам и т.п. (см., например, Berge, S.M., et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 1977,66, 1-19). Ряд конкретных соединений по настоящему изобретению содержит обе функциональные группы,кислотную и основную, что позволяет перевести соединения как в основно-, так и в кислотно-аддитивные соли. Нейтральные формы соединений могут быть получены при взаимодействии соли с основанием или кислотой и выделены в виде исходных соединений обычным способом. Исходные соединения отличаются от различных форм солей рядом физических свойств, таких как растворимость в полярных растворителях, но, тем не менее, соли являются эквивалентными исходным формам соединений с точки зрения выполнения целей настоящего изобретения.-4 005976 В дополнение к солевым формам настоящее изобретение обеспечивает соединения, которые являются пролекарственной формой. Пролекарства соединений, описанные в настоящем изобретении, являются теми соединениями, которые подвергаются химическим реакциям при физиологических состояниях,чтобы обеспечить соединения настоящего изобретения. Кроме того, пролекарства могут быть преобразованы в соединения настоящего изобретения химическим или биохимическим методом, в ex vivo окружающей среды. Например, пролекарства могут быть медленно преобразованы в соединения настоящего изобретения, когда их помещают в трансдермальный резервуар пластыря (повязки) с пригодным ферментом или химическим реагентом. Пролекарства являются часто полезными, потому что в некоторых ситуациях они могут быть более легко введены, чем исходный препарат. Они могут, например, быть биодоступными для орального введения, когда не может быть введено исходное лекарственное средство. Пролекарство может также иметь улучшенную растворимость в фармакологических композициях по сравнению с исходным лекарственным средством. Широкое разнообразие производных пролекарственных средств, известных в данной области, найдено среди тех, которые подвергаются гидролизному расщеплению или окислительной активации пролекарств. Неограничивающий пример пролекарства, в виде которого возможно ввести соединение по настоящему изобретению, представляет собой сложный эфир("пролекарство"), который затем метаболически гидролизуется до карбоновой кислоты, активного вещества. Дополнительные примеры включают пептидильные производные соединений по настоящему изобретению. Некоторые соединения настоящего изобретения могут существовать в несольватированных формах,так же как в сольватированных формах, включая гидратные формы. Сольватированные формы являются эквивалентными несольватированным формам и охватываются рамками настоящего изобретения. Некоторые соединения настоящего изобретения могут существовать в многочисленных кристаллических или аморфных формах. Все физические формы являются эквивалентными для использования в настоящем изобретении и, как подразумевается, находятся в рамках настоящего изобретения. Ряд соединений настоящего изобретения имеет асимметричные атомы углерода (оптические центры) или двойные связи; рацематы, диастереомеры, геометрические изомеры и индивидуальные изомеры, все они, как подразумевается, охватываются рамками настоящего изобретения. Соединения по настоящему изобретению могут также содержать неприродные соотношения атомных изотопов у одного или более атомов, которые входят в состав таких соединений. Например, соединения могут быть мечены радиоактивными изотопами, такими как, например, тритий (3H), иод-125 (125I) или углерод-14 (14 С). Все изотопные варианты соединений настоящего изобретения, как радиоактивные,так и нерадиоактивные, как подразумевается, охватываются рамками настоящего изобретения. Воплощения изобретения Открыт новый класс соединений, которые модулируют PPAR. В зависимости от биологической среды (например, тип клетки, патологическое состояние объекта и т.д.), соединения настоящего изобретения могут усиливать или подавлять активность PPAR. Таким образом, соединения в соответствии с настоящим изобретением являются полезными при лечении или профилактике состояний и заболеваний,связанных с энергетическим гомеостазом, липидным метаболизмом, адипоцитной дифференциацией и воспалением (см. Ricote et al. (1998) Nature 391:79-82 и Jiang et al. (1998) Nature 391:82-86). Например,соединения, которые активируют PPAR, являются полезными при лечении метаболических заболеваний, таких как диабеты. Кроме того, соединения по изобретению являются полезными для профилактики и лечения осложнений при метаболических заболеваниях, таких как диабеты, например невропатии, ретинопатии, гломерулосклероза и сердечно-сосудистых заболеваний. В дополнение к их антидиабетической активности многие синтетические PPAR лиганды также способствуют увеличению веса тела, т.е. созданию ситуации, которая может ухудшать диабетическое и тучное состояние. Лиганды, иллюстрируемые в настоящем изобретении, улучшают этот параметр, обеспечивая эффективное снижение уровней глюкозы в сыворотке крови, при отсутствии сильных увеличений веса тела. Родственные соединения более общего класса в некоторых случаях были модифицированы, чтобы получить фармакологически активные метаболиты, обладающие экспозицией и in vivo продолжительностью жизни, которые превышают исходные соединения. При лечении некоторых хронических заболеваний такие метаболиты были связаны из-за неблагоприятных условий. Некоторые соединения, рассмотренные в настоящем изобретении, не образуют таких долгоживущих метаболитов, в то же время обеспечивают поддержание желательных фармакалогических свойств общего класса.PPAR модуляторы Настоящее изобретение обеспечивает соединения, которые представлены формулой (I):-5 005976 В формуле I Аr1 означает замещенный или незамещенный 2-бензотиазолил или замещенную или незамещенную хинолинильную группу; Х означает двухвалентный мостик, выбранный из -О-, -С(О)-,-СН(R10)-, -N(Rn)-, и -S(O)k-, где R10 представляет собой водород, циано или (С 1-С 4)алкил; и R11 представляет собой водород или (С 1-С 8)алкил, при этом нижний индекс k является целым числом от 0 до 2; при условии, что когда Аr1 представляет собой замещенный или незамещенный 2-бензотиазолил, тогда Х отличен от значения -S(O)k-.Y представляет собой двухвалентный мостик формулы -N(R12)-S(O)2-, где R12 представляет собой водород или (С 1-С 8)алкил.R17 выбирают из (C1-С 8)алкила, (С 2-С 8)гетероалкила, арила и арил(С 1-С 4)алкила; нижний индекс р является целым числом от 0 до 3; нижний индекс q является целым числом от 1 до 2.R2 представляет собой замещенный или незамещенный арил; и R3 представляет собой галоген или(С 1-С 8)алкокси. Средний специалист понимает, что формулой I представлен и ряд структурных изомеров. В первой группе воплощений изобретения изомерами являются те соединения, у которых группы на фенильном кольце занимают положения, не являющиеся смежными. В других воплощениях это те соединения, которые имеют структурные ориентации, представленные формулами (Ia-Ij):Ar1 представляет собой замещенный или незамещенный 2-бензотиазолил. Далее представлен ряд предпочтительных воплощений настоящего изобретения. Например, в первом предпочтительном воплощении Ar1 представляет собой замещенный или незамещенный 2-бензотиазолил; Х представляет собой -О- или -N(R11)-; Y представляет собой -NH-S(O)2-; R1 представляет собой водород, галоген, (С 1-С 8)алкокси, (С 1-С 8)алкил, -CO2R14 или -С(O)NR15R16, где R14 представляет собой водород, (C1-С 8)алкил, (С 2-С 8)гетероалкил, арил и арил (С 1-С 4)алкил, R15 и R16 независимо выбраны из водорода, (С 1-С 8)алкила, (С 2-С 8)гетероалкила, арила и арил(С 1-С 4)алкила или, взятые вместе с атомом азота, к которому они присоединены, образуют 5-, 6- или 7-членное кольцо; R2 представляет собой замещенный или незамещенный фенил; и R3 представляет собой галоген или (С 1-С 4)алкокси. В другом предпочтительном воплощении R1 выбирают из галогена, циано, (C1-С 8)алкокси, (С 1 С 8)алкила, -CO2R14 и -С(O)NR15R16, где R14 представляет собой (C1-С 8)алкил; R15 и R16 независимо выбраны из водорода и (С 1-С 8)алкила или, взятые вместе с атомом азота, к которому они присоединены,образуют 5- или 6-членное кольцо. В других предпочтительных воплощениях R1 выбирают из галогена, циано, (C1-С 8)алкокси и (С 1 С 8)алкила. В других предпочтительных воплощениях Х выбирают из -О- и -NH-. В некоторых предпоч-6 005976 тительных воплощениях R2 представляет собой замещенный фенил, имеющий от 1 до 3 заместителей,независимо выбранных из галогена, циано, нитро, -ОСF3, -ОН, -О(С 1-С 6)алкила, -СF3, (С 1-С 8)алкила. В особенно предпочтительных воплощениях настоящего изобретения Аr1 представляет собой замещенную или незамещенную 2-бензотиазолильную группу; Х представляет собой -О- или -NH-; Y представляет собой -NH-S(O)2-; R1 представляет собой водород, галоген, циано, (С 1-С 8)алкокси, (С 1 С 8)алкил, -CO2R14 или -С(O)NR15R16, где R14 представляет собой водород или (С 1-С 8)aлкил; R15 и R16 независимо выбраны из водорода и (С 1-С 8)aлкилa или, взятые вместе с атомом азота, к которому они присоединены, образуют 5-, 6- или 7-членное кольцо; R2 представляет собой замещенный фенил, имеющий от 1 до 3 заместителей, независимо выбранных из галогена, циано, нитро, -ОСF3, -ОН, -О(С 1-С 6)алкила,-СF3, (С 1-С 8)алкила; и R3 представляет собой галоген или (С 1-С 4)алкокси. Более предпочтительными являются те воплощения, в которых соединение представлено формулой, выбранной из В более предпочтительных воплощениях соединение выбирают из Аr1 представляет собой замещенный или незамещенный хинолинил. В другой группе предпочтительных воплощений Аr1 представляет собой замещенную или незамещенную хинолинильную группу; Х выбирают из -О-, -S- и -N(R11)-; Y представляет собой -N(R12)-S(O)2-,где R12 выбирают из водорода и (C1-С 8)алкила; R1 выбирают из водорода, галогена, циано, (С 1-С 8)aлкокси, (С 1-С 8)алкила, -CO2R14 и -С(O)NR15R16, где R14 выбирают из водорода, (С 1-С 8)алкила, (C1-С 8)гетероалкила, арила и арил(С 1-С 8)алкила, и R15 и R16 независимо выбраны из водорода, (С 1-С 8)алкила, (С 2-С 8)гетероалкила, арила, и арил(С 1-С 4)алкила или, взятые вместе с атомом азота, к которому они присоединены,образуют 5-, 6- или 7-членное кольцо; R2 представляет собой замещенный или незамещенный фенил; иR3 выбирают из галогена и (С 1-С 8)алкокси. Кроме того, предпочтительными являются те соединения, в которых R1 выбирают из галогена, циано, (С 1-С 8)алкокси, (С 1-С 8)алкила, -CO2R14 и -С(O)NR15R16, где R14 представляет собой (С 1-С 8)алкил; R15 иR16 независимо выбраны из водорода и (C1-С 8)алкила или, взятые вместе с атомом азота, к которому они присоединены, образуют 5-или 6-членное кольцо. В других предпочтительных воплощениях R1 выбирают из галогена, циано, (C1-С 8)алкокси и (С 1 С 8)алкила. В других предпочтительных воплощениях Х выбирают из -O-, -S- и -NH-. В других предпочтительных воплощениях Y представляет собой -NH-S(O)2-. В других предпочтительных воплощениях R2 представляет собой замещенный фенил, имеющий от 1 до 3 заместителей, независимо выбранных из галогена, циано, нитро, -ОСF3, -ОН, -О(С 1-С 6)алкила, -СF3, -(С 1-С 8)алкила. В наиболее предпочтительном воплощении настоящего изобретения Аr1 представляет собой замещенную или незамещенную хинолинильную группу; Х представляет собой -О-, -S- или -NH-; Y представляет собой -NH-S(O)2-; R1 представляет собой водород, галоген, циано, (С 1-С 8)aлкокси, (С 1-С 8)алкил,-CO2R14 или -С(O)NR15R16, где R14 представляет собой водород или (С 1-С 8)алкил; R15 и R16 независимо выбраны из водорода и (С 1-С 8)алкила или, взятые вместе с атомом азота, к которому они присоединены,образуют 5-, 6- или 7-членное кольцо; R2 представляет собой замещенный фенил, имеющий от 1 до 3 заместителей, независимо выбранных из галогена, циано, нитро, -ОСF3, -ОН, -О(С 1-С 6)алкила, -СF3-(С 1 С 8)алкила; и R3 представляет собой галоген или (С 1-С 4)алкокси. Кроме того, предпочтительными являются те воплощения, в которых соединение представлено формулой, выбранной из В наиболее предпочтительных воплощениях изобретения соединение выбрано из В другом аспекте настоящее изобретение обеспечивает фармацевтические композиции, содержащие по крайней мере одно из вышеупомянутых соединений в смеси с фармацевтически приемлемым носителем. В следующем аспекте настоящее изобретение обеспечивает способы модулирования заболеваний,опосредованных PPAR. В особенности эти заболевания выбирают из неинсулинзависимых сахарных диабетов, ожирения, состояний, связанных с патологическими уровнями липопротеинов или триглицеридов в плазме крови, и воспалительных процессов, таких как, например, ревматоидные артриты и атеросклерозы. Получение соединений Соединения настоящего изобретения могут быть получены при использовании стандартных способов синтеза. Схемы 1-3 иллюстрируют типичные способы получения соединений структурной формулы Iа. Средние специалисты понимают, что аналогичные способы могут быть применены для синтеза соединений других структур. Как видно из схемы 1, соединения настоящего изобретения могут быть получены из коммерчески доступного 2-хлор-5-нитробензонитрила (i). Обработка i фенолом, тиофенолом или необязательно защищенным анилином в присутствии основания и при нагревании обеспечивает аддукт (ii). Восстановление нитрогруппы в ii с помощью, например, H2 в присутствии катализатора никеля Ренея приводит к производному анилина (iii). Сульфонирование iii соответствующим арилсульфонилгалоидом (Ar1SO2Cl) в присутствии основания (обычно третичным амином) обеспечивает целевое соединение (iv). Соединение iii может быть также преобразовано в родственное соединение формулы (vi), в котором ориентация сульфонамидной связи является противоположной. Таким образом, преобразование анилина iii в бензолсульфонилхлорид v может быть совершено с использованием способа, описанного в Hoffman, Organic Syntheses Collective Volume VII,pp. 508-511. Последующая обработка v соответствующим анилином приводит к целевому соединению vi. Схема 1-8 005976 Схема 2 отражает альтернативное получение соединений формулы I (где N представляет собой замещенный или незамещенный 2-бензотиазолил и Х представляет собой -О-). Схема 2 Схема 3 отражает альтернативное получение соединений формулы I, где Аr1 представляет собой замещенный или незамещенный 2-бензотиазолил и Х представляет собой -N(R11)-. Схема 3 Другие соединения настоящего изобретения могут быть получены исходя из, например, 3,4-дифторнитробензола, 3-хлор-4-фторнитробензола, 2-хлор-5-нитроанизола, 3-бром-4-фторнитробензола и т.п. Анализ соединений Соединения настоящего изобретения могут быть оценены с точки зрения их способности модулировать PPAR рецептор, используя тесты, описанные у Jiang, et al., Nature 391:82-86 (1998), Ricote, et al.,Nature 391:79-82 (1998) и Lehmann, et al., J. Biol. Chem. 270 (12): 12953-12956 (1995). Альтернативно, соединения могут быть оценены с точки зрения их способности замещать меченный радиоактивным изотопом BRL 49653 из PPAR-GST слитого белка следующим образом. Материалы.PPAR-GST слитый белок (приготовлен в соответствии со стандартными методиками), [3H]-BRL 49653, имеющий 50 Ci/ммоль специфическую активность, Polifiltronics Unifilter 350 фильтровальный планшет и глутатион-сефарозные гранулы (Pharmacia: промытые дважды с 10 х связывающим буфером,в котором BSA и DTI могут быть выведены). Способ. Связывающий буфер в количестве 80 мкл (10 мМ Tris-HCl, pH 8,0, 50 мМ KCl, 10 мМ DTT, 0,02%BSA и 0,01% NP-40) добавляют в лунки фильтровального планшета. Затем добавляют испытываемое соединение в 10 мкл ДМСО. PPAR-GST слитый белок и радиомеченное BRL соединение предварительно смешивают в связывающем буфере, содержащем 10 мМ DTT, и добавляют в количестве 10 мкг в лунки планшета, чтобы обеспечить конечные концентрации 1 мкг/лунка PPAR-GST слитого белка и 10 нМ [3 Н]BRL 49653 соединения. Планшет инкубируют 15 мин. Добавляют глутатион-агарозные гранулы в 50 мкл связывающего буфера, после чего планшет энергично встряхивают в течение 1 ч. Планшет промывают 4 раза с помощью 200 мкл/лунка связывающим буфером (без BSA и DTT). Основание планшета герметично закрывают и добавляют 200 мкл/лунка коктейля для сцинтилляционного счета. Затем герметизируют планшет сверху и определяют радиоактивность. Составы. Соединения в соответствии с настоящим изобретением могут быть введены любым пригодным путем, наиболее предпочтительно оральным или парантеральным, в соответствии с формой, приспособлен-9 005976 ной для такого введения. Таким образом, соединения настоящего изобретения могут быть введены с помощью инъекций, например внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально или внутрибрюшинным путем. Настоящее изобретение также предполагает применение хранящихся составов, в которых активный(е) ингредиент(ы) высвобождаются в определенный период времени. Также соединения, описанные в настоящем изобретении, могут быть введены с помощью ингаляции, например интраназально. Кроме того, соединения настоящего изобретения могут быть введены трансдермально. Соответственно, настоящее изобретение также обеспечивает фармацевтические композиции, содержащие фармацевтически приемлемый носитель или накопитель и либо соединение формулы I, либо фармацевтически приемлемую соль соединения формулы I. Для приготовления фармацевтических композиций из соединений настоящего изобретения фармацевтически приемлемые носители могут быть твердыми или жидкими. Твердые формы препаратов включают порошки, таблетки, пилюли, капсулы, облатки, свечи и диспергированные гранулы. Твердый носитель может представлять собой одно или более соединений, которые могут также действовать как разжижители, отдушки, связующие вещества, консерванты, агенты дезинтеграторы таблеток или инкапсулирующий материал. В порошках носитель представляет собой хорошо раздробленное твердое вещество, которое находится в смеси с хорошо раздробленным активным компонентом. В таблетках активный компонент смешивают с носителем, имеющим необходимые связующие свойства в пригодных пропорциях, и компануют в желательную форму и размер. Порошки и таблетки предпочтительно содержат от 5 или 10 до 70% активного соединения. Пригодными носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин,крахмал, желатин, трагакат, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, легкорасплавляющийся воск, масло какао и т.п. Термин "получение", как предполагается, обозначает образование состава из активного соединения с инкапсулирующим материалом как носителем, образующим капсулу, в которой активный компонент находится с или без других носителей, окружен носителем, который находится,таким образом, в ассоциации с ним. Аналогично сюда включены облатки и лепешки. Таблетки, порошки,капсулы, пилюли, облатки и лепешки могут быть применены как твердые дозированные формы, пригодные для орального введения. Для приготовления свечей из легкорасплавляющегося воска, такого как смесь глицеридов жирных кислот или масла какао, его сначала расплавляют, после чего активные компоненты в нем однородно распределяют при перемешивании. Расплавленную гомогенную смесь затем выливают в подходящие по размеру формы, дают возможность остыть, и таким образом она затвердевает. Жидкая форма препаратов включает растворы, суспензии и эмульсии, например водные или водно/пропиленгликолевые растворы. Для парентеральной инъекции жидкие препараты могут быть сформированы в виде раствора в водном пропиленгликоле. Водные растворы, пригодные для орального применения, могут быть получены путем растворения активного компонента в воде и добавления пригодных красителей, ароматизирующих веществ, стабилизаторов и загустителей. Водные суспензии, пригодные для орального применения, могут быть изготовлены путем диспергирования хорошо разделенного активного компонента в воде с вязким материалом,таким как натуральная или синтетическая камедь, смола, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другие хорошо известные суспендирующие агенты. Также являются включенными твердые формы препаратов, которые предназначены для того, чтобы быть преобразованными перед применением путем орального введения в жидкие формы препаратов. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать, дополнительно к активному компоненту, красители, ароматизаторы, стабилизаторы, буферы, искусственный и натуральный заменители сахара, диспергаторы, загущающие агенты, растворители и т.п. Фармацевтические препараты предпочтительно находятся в виде стандартной или унифицированной лекарственной формы. В такой форме препарат разделяют на одноразовые дозы, содержащие соответствующее количество активного компонента. Стандартная лекарственная форма может быть расфасована. Расфасовка, содержащая дискретные количества препарата, может быть в виде упакованных таблеток, капсул и порошков в пузырьках или ампулах. Также унифицированная лекарственная форма может быть в виде капсулы, таблетки, облатки или лепешки, или это может быть соответствующее количество любой из указанных расфасованных форм. Количество активного компонента в единичной дозе препарата может быть различным или установленным от 0,1 до 1000 мг, предпочтительно от 1,0 до 100 мг, в соответствии с конкретным применением настоящего изобретения и потенцией активного компонента. Композиция может, если желательно,также содержать другие сочетаемые терапевтические агенты. В терапевтическом применении для лечения ожирения, диабетов, воспалительных процессов или других процессов или заболеваний, опосредованных PPAR, соединения, используемые в способе лечения по настоящему изобретению, вводят в начальной дозе от около 0,001 до около 100 мг/кг ежедневно. Ежедневная доза, находящаяся в интервале от около 0,1 до около 10 мг/кг, является предпочтительной. В то же время дозировки могут меняться в зависимости от потребностей пациента, серьезности заболева- 10005976 ния, которое лечат, и применяемого соединения. Определение правильных доз для конкретной ситуации находится в пределах навыков практикующего врача. Как правило, лечение начинают с меньших дозировок, которые являются меньшими, чем оптимальная доза соединения. После этого дозировки увеличивают маленькими приращениями до достижения оптимального результата в указанных условиях. Для удобства общая дневная доза может быть разделена и введена при желании порциями в течение дня. Композиции могут быть преимущественно объединены и/или применены в комбинации с агентами,полезными для лечения и/или профилактики нарушений метаболизма и воспалительных процессов, их осложнений и патологии, связанной с этим (например, сердечно-сосудистые заболевания и гипертония). В многочисленных примерах введение заявленных соединений или композиций вместе с этими альтернативными агентами увеличивает эффективность таких агентов. Соответственно, в некоторых случаях,когда соединения по изобретению объединяют или их вводят в комбинации, например, с антидиабетическими агентами, они могут быть применены в дозах, которые являются меньшими, чем ожидаемое количество, когда их применяют индивидуально, или в меньших, чем расчетное количество, для комбинационной терапии. Пригодные агенты для комбинационной терапии включают те, которые являются в настоящее время, коммерчески доступными, а не те, которые находятся в стадии развития или изучения. Типичные агенты, полезные при лечении нарушений метаболизма включают, но не ограничиваются следующими:(а) антидиабетические агенты, такие как инсулин, сульфонилмочевины (например, меглинатид, толбутамид,хлорпропамид, ацетогексамид, толазамид, глибурид, глипизид и глимепирид), бигуаниды, например метформин (Glucophage), ингибиторы -глюкозидазы (акарбоза), соединения тиазолидинона, например розилитазон (Avandia), троглитазон (Rezulin) и пиоглитазон (Actos); (b) агонисты 3 адренергического рецептора, лептин или их производные и антагонисты нейропептидов Y; (с) желочно-кислотные последовательности (например, холестирамин и колестипол), ингибиторы HMG-CoA редуктазы, например статины (например, ловастатин, аторвастатин, флувастатин, правастатин и симвастатин), никотиновая кислота (ниацин), производные фибриновой кислоты (например, гемфиброзил и клофибрат) и нитроглицерин. Типичные агенты, полезные при лечении воспалительных процессов, включают, но не ограничиваются следующими: (а) нестероидные противовоспалительные агенты (NS СПИД), такие как производные пропионовой кислоты (например, альминопрофен, беноксапрофен, буклоновая кислота, карпрофен,фенбуфен, фенопрофен, флупрофен, флубипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен,напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен),производные уксусной кислоты (например, индометацин, ацеметацин, алклофенак, клиданак, дихлофенак, фенклофенак, фенклозиновая кислота, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин, зидометацин и зомепирак), производные фенаминовой кислоты (например,флуфенаминовая кислота, меклофенаминовая кислота, мефенаминовая кислота, нифлуминовая кислота и толфенаминовая кислота), производные бифенилкарбоновой кислоты (например, дифлунизал и флуфенизал), оксикамы (например, изоксикам, пироксикам, судоксикам и теноксикан), салицилаты (например,ацетилсульфоновая кислота и сульфазалазин) и пиразолоны (например, апазон, безпиперилон, фепразон,мофебутазон, оксифенбутазон и фенилбутазон); (b) ингибиторы циклооксигеназы-2 (СОХ-2), такие как селекоксиб (Celebrex) и рофекоксиб (Vioxx), и (с) ингибиторы фосфодиэстеразы типа IV (PDE-IV). Способы применения. Настоящее изобретение раскрывает способы применения вышеупомянутых соединений и композиций для лечения или профилактики нарушений метаболизма или воспалительных заболеваний. Настоящее изобретение также раскрывает способ применения вышеупомянутых соединений и композиций для лечения или профилактики заболеваний или нарушений, установленных с помощью PPAR. Способы включают введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I. В другом аспекте настоящее изобретение обеспечивает способы применения вышеупомянутых соединений и композиций для модулирования PPAR. Способы включают взаимодействие клетки с соединением формулы I. Следующие примеры являются иллюстрирующими и не предназначены, чтобы ограничить область настоящего изобретения. Примеры Реагенты и растворители, примененные ниже, могут быть получены из коммерческих источников,таких как Aldrich Chemical Co. (Milwaukee, Wisconsin, USA). 1H-ЯМР спектры зарегистрированы на VarianGemini 400 МГц ЯМР спектрометре. Заметные пики сведены в таблицу в следующем порядке: число протонов, множество (с, синглет; д, дублет; т, триплет; кв, квартет; м, мультиплет; уширенный с, уширенный синглет) и константа взаимодействия (с) в герцах (Гц); электронная ионизация (EI) масс-спектры были зарегистрированы на Hewlett Packard 5989A масс-спектрометре. Масс-спектрометрические данные определены как отношение массы к заряду, а затем относительного процента соотношения каждого иона(в круглых скобках). В таблицах отдельная графа м/е значения составлена для М+Н (или как отмечено для М-Н) иона, содержащего наиболее общие атомные изотопы. Образцы изотопов соответствуют пред- 11005976 полагаемой формуле во всех случаях. Электроспрейный ионизационный (ESI) масс-спектральный анализ проводят на Hewlett-Packard 1100 MSD электроспрейном масс-спектрометре с использованием НР 1 100 HPLC для каждого образца. Обычно образец растворяют в метаноле при 0,1 мг/мл и 1 мкл вспрыскивают со свободными растворителями в масс-спектрометр, который сканируют при от 100 до 1500 дальтонов (D). Все соединения могут быть проанализированы в положительном ESI стандарте, с использованием 1:1 смеси ацетонитрил/вода с 1% уксусной кислоты как свободного растворителя. Соединения, представленные ниже, могут также быть проанализированы в отрицательном ESI стандарте с использованием 2 мМ(НОАТ), О-(7-азабензотриазол-1-ил)-N,N, N',N'-тетраметилмочевина)гексафторфосфат (HATU), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDCI). Ряд промежуточных продуктов, использованных при получении соединений, описанных ниже, описаны в совместной заявке U.S. 09/606, 433, зарегистрированной 28 июня, 2000. Пример 1. Следующие бензолсульфонилхлориды получают по методике, описанной у R.V. Hoffman (Org. Syn.Coll. Vol. VII, 508-511), из соответствующих коммерчески доступных анилинов и используют, чтобы провести приведенные ниже примеры. 2-Хлор-4-трет-бутилбензолсульфонилхлорид (Iа). Выход 34%. 1 Н ЯМР (CDCl3):8,06 (1H, д, J=8,4 Гц), 7,62 (1H, с), 7,48 (1 Н, д, J=8,4 Гц), 1,37 (9 Н, с). Т.пл. 68,8 С. 2-Трифторметил-4-хлорбензолсульфонилхлорид (Ib). Выход 76%, в виде твердого вещества. 1 Н ЯМР (СDСl3):8,325 (д, J=8,4 Гц, 1H), 7,966 (уширенный с, 1H), 7,829 (уширенный д, J=8,4 Гц, 1 Н). Т.пл. 37,0 С. 2-Хлор-4-метилбензолсульфонилхлорид (Iс). Выход 47% в виде масла. 1 Н ЯМР (СDСl3):8,02 (1 Н, д, J=8,8 Гц), 7,46 (1 Н, с), 7,28 (1H, д, J=8,8 Гц),2,47 (3 Н, с). Пример 2. Соединение 2.3. Соединение 2.1 приготовлено путем модификации опубликованной методики Albert и Barlin (J. Chem.(21 г) и воды (100 мл) при 0-5 С перед медленным введением нитрита натрия (7,6 г, 110 ммоль). Затем смесь порциями добавляют к другому раствору этилксантата калия (20,8 г, 125 ммоль) в воде (60 мл) при 45 С. Смесь нагревают в течение 1 ч перед охлаждением. Затем смесь экстрагируют эфиром. Эфирный раствор перед высушиванием над сульфатом магния промывают 2N раствором NaOH, водой и рассолом. После фильтрования растворитель удаляют и получают масло коричневого цвета (15 г), которое затем растворяют в этаноле (150 мл) и нагревают при кипении с обратным холодильником с KОН (25 г) в атмосфере азота в течение ночи. Этанол затем удаляют в вакууме и осадок разделяют между водой и эфиром. Эфирный раствор отбрасывают. Водный раствор подкисляют до значения рН, равного 4, а затем экстрагируют эфиром. Затем эфирный раствор промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, что дает сырой продукт (7,5 г) в виде масла коричневого цвета. Последующая флеш-хроматография (0-5-10% этилацетат/дихлорметан) приводит к 3-меркаптохинолину (2.1)(5,35 г, 32% выход) в виде твердого вещества. 1H ЯМР (ДМСО):9,02 (1H, д, J=2,3 Гц), 8,63 (1H, д, J=2,2 Гц), 7,95-8,05 (2 Н, м), 7,75-8,02 (1H, м), 7,60-7,67 (1H, м). К смеси 3-меркаптохинолина (2.1) (1,18 г, 7,33 ммоль) и 1,2,3-трихлор-5-нитробензола (1,66 г, 7,33 ммоль),растворенных в этаноле (100 мл), добавляют раствор трет-ВuОK (7,5 мл, 1 М) в ТГФ (тетрагидрофуране). Затем смесь нагревают до 80 С в течение ночи, а затем охлаждают. После удаления этанола смесь разделяют между этилацетатом и водой. Органический раствор промывают рассолом, сушат над сульфатом магния и фильтруют. Фильтрат затем концентрируют, получают сырой продукт, который затем флеш- 12005976 хроматографируют с элюентом (10% гексаны/дихлорметан), что позволяет получить 2.2 (1,80 г, 70% выход) в виде масла желтого цвета. 1H ЯМР (ДМСО):8,75 (1 Н, д, J=2,3), 8,51 (1H, с), 8,22 (1 Н, с), 8,01(1H, д, J=8,4 Гц), 7,92 (1H, д, J=7,6 Гц), 7,74-7,80 (1H, м), 7,60-7,66 (1H, м). Раствор 2.2 (1,80 г, 5,1 ммоль) в этилацетате (100 мл) и дигидрат хлорида олова (II) (6,88 г, 30 ммоль) нагревают при кипении с обратным холодильником в течение ночи, а затем охлаждают. Полученный раствор выливают в раствор 1N NaOH (400 мл). После перемешивания в течение 30 мин смесь разделяют и органический раствор промывают водой, насыщенным раствором бикарбоната натрия и рассолом. После высушивания над сульфатом магния раствор фильтруют и концентрируют в вакууме. Осадок смешивают с дихлорметаном (10 мл) и обрабатывают ультразвуком. Последующее вакуумное фильтрование дает анилин 2.3 (1,35 г, 82% выход) в виде грязно-белого твердого вещества. 1H ЯМР (ДМСО):8,61(1H, д, J=2,4), 7,96 (1H, д, J=8,4 Гц), 7,88 (1H, д, J=8,2 Гц), 7,83 (1H, д, J=2,2 Гц), 7,67-7,72 (1H, м), 7,547,60 (1H, м). Т.пл. 213,2 С. Пример 3. Соединение 3. Анилин 2.3 (250 мг, 0,78 ммоль) и 2-хлорбензолсуфонилхлорид (339 мг, 1,60 ммоль) растворяют в смеси растворителей ТГФ (5 мл) и дихлорметана (5 мл). К раствору добавляют пиридин (0,185 мл, 2,34 ммоль) и каталитическое количество ДМАП. Раствор нагревают при 50 С, чтобы отогнать дихлорметан и затем ТГФ с помощью вакуума. Осадок подвергают флеш-хроматографии с элюентом (2,5% этилацетат/дихлорметан), что дает сульфонамид 3 (см. табл. 1) (302 мг, 78%) в виде грязно-белого твердого вещества. 1 Н ЯМР (ДМСО):11,58 (1H, с), 8,61 (1H, д, J=2,4 Гц), 8,19 (1H, д, J=7,6 Гц), 7,83-8,00 (3 Н, м),7,67-7,75 (3 Н, м), 7,56-7,65 (2 Н, м), 7,31 (2 Н, с). MS (М+Н) 494,9. Т.пл.: 219,6 С. Анализ, вычислено: С 50,87, Н 2,64, N 5,65; найдено: С 50,86, Н 2,62, N 5,52. Таблица 1- 13005976 Пример 5. Общая методика окисления серы до сульфоксида. Нафтилтиоэфир из примеров 3 или 4 (0,2 ммоль) растворяют в смеси растворителей дихлорметана(10 мл) и метанола (5 мл). К раствору добавляют mСРВА (120 мг, 0,7 ммоль, 77% чистота) шестью порциями с интервалом более 20 мин. Затем раствор промывают 5% раствором тиосульфата натрия, 1% раствором бикарбоната натрия и рассолом и затем сушат над сульфатом магния. После фильтрования фильтрат концентрируют, что дает сырой продукт, который затем подвергают флеш-хроматографии с элюентом (5-30% этилацетат/дихлорметан), что позволяет получить соответствующий сульфоксид. Пример 5.1. 1 Н ЯМР (ДМСО):11,75 (1 Н, с), 8,82 (1H, с), 8,68 (1 Н, с), 8,15-8,20 (2 Н, м), 8,09 (1 Н, д, J=8,5 Гц),7,85-7,91 (1H, м), 7,67-7,75 (3 Н, м), 7,57-7,64 (1H, м), 7,17 (2 Н, с). MS (М+Н) 511. Т.пл. 239,5 С с разложением. Анализ, вычислено: С 49,28. Н 2,56, N 5,47; найдено: С 49,30, Н 2,63, N 5,37. Пример 5.2. 1H ЯМР (ДМСО):11,43 (1H, с), 8,81 (1H, с), 8,68 (1H, с), 8,18 (1H, д, J=8,2 Гц), 8,09 (1H, д, J=8,5 Гц),7,82-7,90 (3 Н, м), 7,58-7,74 (4 Н, м), 7,21 (2 Н, с). MS (М+Н) 476,9. Т.пл. 261,8 С с разложением. Анализ,вычислено: С 52,83, Н 2,96, N 5,87; найдено: С 52,71, H 3,05, N 5,71. Пример 6. Гидрохлорид 2-амино-4-хлорбензолтиол (6). С помощью методики, описанной Danley et al. (1965) Can. J. Chem. 43:2610-2612, получают тетрасульфид натрия при растворении серы (Aldrich, 9,6 г, 300 ммоль) в расплавленном нонангидрате сульфида натрия (Aldrich, 24,0 г, 100 ммоль). Полученную горячую жидкость добавляют к раствору 2,5-дихлорнитробензола (Aldrich, 38,4 г, 200 ммоль) в 95% этаноле (140 мл). После того как экзотермическая реакция прекращается, смесь нагревают при кипении с обратным холодильником в течение 2 ч и фильтруют горячей. Осадок промывают водой (50 мл) и этанолом (50 мл), что дает 37,7 г промежуточного трисульфида, в виде желтого твердого вещества. 1 Н ЯМР (CDCl3):8,83 (д, J=2,3 Гц, 1 Н), 7,76 (д, J=8,6 Гц, 1 Н),7,55 (дд, J=8,6, 2,3 Гц, 1 Н). Концентрированную соляную кислоту (125 мл) медленно (в течение ночи, 15 ч) добавляют к хорошо перемешиваемой суспензии трисульфида (37,7 г), описанной выше, и олова (Aldrich, 88 г, 737 ммоль) в 95% этаноле (200 мл). После фильтрования горячего раствора фильтрату дают возможность отстояться при комнатной температуре в течение ночи, что дает осадок сырого продукта. Осадок отфильтровывают,промывают смесью 1:1 этанол/концентрированная НСl. Перекристаллизация из смеси 1:1 МеОН/концентрированная НСl дает соединение 6 (13,8 г) в виде белых игл. 1H ЯМР (ДМСО-d6):6,96 (д, J=8,3 Гц,1 Н), 6,86 (д, J=2,3 Гц, 1 Н), 6,50 (дд, J=8,3, 2,3 Гц, 1 Н). Пример 7. Гидрохлорид 2-амино-4-метилбензолтиол (7). Бис-(4-метил-2-нитрофенил)трисульфид готовят с использованием методики, изложенной в примере 6, исходя из 4-хлор-3-нитротолуола (Aldrich, 34,3 г, 200 ммоль), серы (Aldrich, 9,6 г, 300 ммоль) и нонангидрата сульфида натрия (Aldrich, 24,0 г, 100 ммоль) в 95% ЕtOН (150 мл). 27,7 г трисульфида получают в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):8,21 (д, J=8,3 Гц, 1H), 8,07 (уширенный с, 1 Н), 7,58 (дд, J=8,3, 1,3 Гц, 1 Н), 2,48 (с, 3 Н). Восстановление бис-(4-метил-2-нитрофенил)трисульфида, как изложено в примере 6, дает после перекристаллизации соединение 7 (11,3 г) в виде смеси, но которое используют непосредственно в последующих реакциях. Пример 8. 5-Хлор-2-(2,6-дихлор-4-нитробензил)бензотиазол (8). Модификацией методики, описанной у D.L. Boger (J. Org. Chem. 43:2296-2297 (1978 раствор(пример 6, 1,96 г, 10,0 ммоль) и (2,6-дихлор-4-нитрофенил)уксусной кислотой (2,50 г, 10,0 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 1 ч, затем нагревают до 90 С в течение ночи (15 ч). После охлаждения до комнатной температуры реакционную смесь выливают на лед и полученную смесь трижды экстрагируют ЕtOАс (50 мл). Органические слои объединяют и дважды промывают рассолом раствора (100 мл), сушат над Na2SO4 и концентрируют в вакууме. Сырое твердое вещество хроматографируют (СН 2 Сl2), что дает выход 3,7 г (99%) соединения 8 в виде бледно-желтого твердого вещества. 1 Н ЯМР (CDCl3):8,28 (с, 2 Н), 7,98 (д, J=1,9 Гц, 1H), 7,76 (д, J=8,5 Гц, 1H), 7,38 (дд,J=8,5, 1,9 Гц, 1H), 4,87 (с, 2 Н). MS (M+H) 373. Соединения, включенные в табл. 2, получают с использованием методики примера 8.(д, J=8,5 Гц, 1H), 7,74 ( уширенный с, 1H), 7,25 (дд, J=8,2, 1,0 Гц, 1H), 4,73 (с, 2 Н), 2,42 (с, 3 Н). MS (М-Н) 317. Примеры 16-23. Соединения, включенные в табл. 2, восстанавливают до анилинов, сведенных в табл. 3, используя методики, описанные ниже, как обозначено в табл. 3. Метод А. К раствору нитросоединения в этилацетате (0,1 М) при кипении с обратным холодильником добавляют дихлорид дигидрат (5 экв.) олова (II). После кипения с обратным холодильником в течение от 0,5 до 2 ч горячую смесь выливают в делительную воронку, содержащую 2 Х объема этилацетата и 50 экв. 1N KОН, только что приготовленного и еще теплого. Смесь быстро экстрагируют и разделяют. Органический слой промывают рассолом, сушат над MgSO4 и концентрируют, что дает анилин, который может быть обычно применен непосредственно на следующем этапе. Метод В. Смотри пример 39. Метод С. К раствору нитросоединения (7 ммоль) в изопропаноле (50 мл)/ТГФ (20 мл) добавляют жидкую суспензию (0,5 мл) никеля Ренея в воде. Реакционную массу перемешивают в атмосфере водорода при- 15005976 нормальных давлении и температуре в течение 24 ч. После фильтрования через подушку из целита раствор концентрируют в вакууме, что позволяет получить желаемый анилин. Остаток никеля Ренея на подушке из целита суспендируют в галогенированном растворителе для дезактивации. Таблица 3H ЯМР (ДМСО-d6):7,99 (дд, J=8,0, 0,6 Гц, 1 Н), 7,92 (д, J=8,1 Гц, 1 Н), 7,45 (триплет+дублет, J=8,2,1,2 Гц, 1 Н), 7,38 (триплет+дублет, J=8,0, 1,0 Гц, 1 Н), 6,70 (с, 2 Н), 5,78 (с, 2 Н), 4,51 (с, 2 Н). MS (M+H) 309. Пример 21. 4-Бензотиазол-2-илметил-3-хлорфениламин (21). 1 Н ЯМР (ДМСО-d6):7,98 (д, J=8,0 Гц, 1 Н), 7,92 (д, J=8,0 Гц, 1 Н), 7,47 (триплет+дублет, J=7,9, 1,2 Гц,1 Н), 7,38 (триплет+дублет, J=7,9, 1,0 Гц, 1 Н), 7,17 (д, J=8,3 Гц, 1 Н), 6,66 (д, J=2,2 Гц, 1 Н), 6,54 (дд, J=8,2,2,2 Гц, 1 Н), 5,44 (с, 2 Н), 4,35 (с, 2 Н). MS (M+H) 275. Пример 22. 3,5-Дихлор-4-(5-метилбензотиазол-2-илметил)фениламин (22). 1 Н ЯМР (ДМСО-d6):7,84 (д, J=8,2 Гц, 1 Н), 7,73 (уширенный с, 1 Н), 7,21 (дд, J=8,2, 1,0 Гц, 1 Н),6,69 (с, 2 Н), 5,77 (с, 2 Н), 4,48 (с, 2 Н), 2,43 (с, 3 Н). MS (M+H) 323. Пример 23. 3-Хлор-4-(5-метилбензотиазол-2-илметил)фениламин (23). 1 Н ЯМР (ДМСО-d6):7,84 (д, J=8,2 Гц, 1 Н), 7,73 (с, 1 Н), 7,21 (д, J=8,2 Гц, 1 Н), 7,15 (д, J=8,2 Гц,1 Н), 6,65 (д, J=2,1 Гц, 1 Н), 6,52 ( дд, J=8,2, 2,1 Гц, 1 Н), 5,41 (с, 2 Н), 4,32 (с, 2 Н), 2,43 (с, 3 Н). MS (M+H) 289. Соединения, включенные в табл. 4, получают с использованием обычных способов из соединений,сведенных в табл. 3, и соответствующего арилсульфонилхлорида. 3-Гидроксихинолин (приготовленный в соответствии с методикой Naumann, et al. Synthesis, 1990, 4,279-281 (3 г) и 1,2,3-трихлор-5-нитробензол (4,7 г) растворяют в ДМФА (80 мл) и нагревают с карбонатом цезия (7,4 г) в течение 2 ч при 60 С. Реакционную массу выливают в ванну со льдом/водой (500 мл). Полученный грязно-белый осадок собирают с помощью фильтрования и промывают гексаном, что дает соединение 38 в виде твердого вещества (6,9 г), пригодного для применения в следующей реакции. 1H ЯМР (CDCl3):8,863 (д, J=2,2 Гц, 1 Н), 8,360 (с, 2 Н), 8,106 (д, J=8,6 Гц, 1 Н), 7,646 (м, 2 Н), 7,529 (д, J=8,6 Гц,1 Н), 7,160 (д, J=2,2 Гц, 1 Н). Пример 39. К раствору соединения 38 (6,9 г) в этаноле/ТГФ/воде (соотношение 40:20:10) добавляют хлорид аммония (3,3 г) и порошкообразное железо (3,4 г). Полученную смесь нагревают при кипении с обратным холодильником в течение 5 ч. Затем горячую смесь фильтруют через целит и концентрируют. Осадок растворяют в этилацетате и промывают насыщенным раствором NaHCO3, затем водой и затем рассолом. Раствор сушат над сульфатом магния и концентрируют, что дает соединение 39 в виде грязно- 18005976 белого твердого вещества (5,6 г). 1 Н ЯМР (ДМСО):8,846 (д, J=2,9 Гц, 1 Н), 8,010 (м, 1 Н), 7,915 (м, 1 Н),7,645 (м, 1 Н), 7,560 (м, 1 Н), 7,401 (д, J=2,9 Гц, 1 Н), 6,778 (с, 2 Н), 5,762 (с, 2 Н). Обработка анилина 39 различными сульфонилхлоридами в соответствии с обычной методикой дает сульфонамиды 40-44, представленные в табл. 5. Таблица 5H ЯМР (300 МГц/СDСl3):7,14 (1H, дд, J=2,6 Гц, J=8,9 Гц), 7,26 (1H, д, J=8,9 Гц) 7,33 (1H, д, J=2,6 Гц),7,56-7,58 (2 Н, м), 7,66-7,69 (2 Н, м), 7,87 (1H, м), 7,93 (1H, д, J=2,0 Гц), 8,00 (1H, м), 8,09 (1H, д, J=8,5 Гц),8,80 (1H, д, J=2,9 Гц), 11,06 (1H, уширенный синглет). MS (M+H) 479. Т.пл. 122 С. Пример 45. Метиловый эфир 3-[2,6-дихлор-4-(2,4-дихлорбензолсульфониламино)фенокси]хинолин 6-карбоновой кислоты (45). Раствор метилового эфира 3-(4-амино-2,6-дихлорфенокси)хинолин-6-карбоновой кислоты (96) (0,93 ммоль) и 2,4-дихлорбензолсульфонилхлорида (250 мг, 1,02 ммоль) в пиридине (0,13 мл, 1,53 ммоль) и СН 2 Сl2 (3,7 мл) перемешивают при комнатной температуре в течение 12 ч. К реакционной смеси добавляют насыщенный раствор NаНСО 3, затем экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над безводным MgSO4 и концентрируют. Сырой осадок очищают с помощью хроматографической колонки (гексан/AcOEt=2/1, 80 г силикагеля), что дает соединение 45 (237 мг, 41%, в 3 этапа). 1H ЯМР (300 МГц, ДМСО-d6):3,90 (3 Н, с), 7,31 (2 Н, с), 7,72 (1H, дд, J=1,8, 7,8 Гц), 7,79 (1H, д, J=3,0 Гц),- 19005976 7,96 (1H, д, J=1,8 Гц), 8,11 (2 Н, с), 8,18 (1H, д, J=7,8 Гц), 8,64 (1H, с), 8,99 (1H, д, J=3,0 Гц), 11,42 (1H,уширенный с). MS (M+H) 571. Пример 46. 3-[2,6-Дихлор-4-(2,4-дихлорбензолсульфониламино)фенокси]хинолин-8-карбоновой кислоты метиловый эфир (46). К раствору метилового эфира 3-(4-aмино-2,6-дихлорфенокси)хинолин-8-карбоновой кислоты (99)(1,26 ммоль) в пиридине (0,15 мл, 1,80 ммоль) и CH2Cl2 (5 мл) добавляют 2,4-дихлорбензолсульфонилхлорид (381 мг, 1,55 ммоль). Смесь перемешивают при комнатной температуре в течение 12 ч. Насыщенный раствор NaHCO3 добавляют к реакционной смеси, затем экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над MgSO4 и концентрируют. Сырой осадок очищают с помощью хроматографической колонки (гексан/АсОЕt=2/1, 80 г силикагеля), что дает соединение 46 (506 мг, 70%) в виде белого твердого вещества. 1 Н ЯМР (300 МГц, ДМСО-d6):3,91 (3 Н, с), 7,31 (2 Н, с), 7,577,65 (2 Н, м), 7,72 (1 Н, дд, J=2,1, 8,6 Гц), 7,83 (1 Н, д, J=8,6 Гц), 7,96 (2 Н, д, J=2,1 Гц), 8,03 (1 Н, д, J=8,6 Гц), 8,18 (1H, д, J=8,6 Гц), 8,94 (1 Н, д, J=2,1 Гц), 11,4 (1H, уширенный с), MS (M+H) 571. Пример 47. 3-[2,6-Дихлор-4-(2,4-дихлорбензолсульфониламино)фенокси]хинолин-6-карбоновая кислота (47). К раствору метилового эфира 3-[2,6-дихлор-4-(2,4-дихлорбензолсульфониламино)фенокси]хинолин-6-карбоновой кислоты (45) (200 мг, 0,35 ммоль) в ТГФ/МеОН (2 мл/2 мл) добавляют 4N NaOH (0,1 мл,0,4 ммоль). Полученную смесь нагревают при кипении с обратным холодильником в течение 2,5 ч. Реакционную смесь охлаждают до комнатной температуры и нейтрализуют 2N НСl, затем концентрируют. Осадок экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над безводнымMgSO4 и концентрируют, что дает твердое вещество. Сырой продукт перекристаллизовывают с помощью гексана/AcOEt, что дает соединение 47 (153 мг, 78%). 1 Н ЯМР (300 МГц, DMSO-d6):7,16 (2 Н, с),7,62 (1H, дд, J=2,0, 8,5 Гц), 7,73 (1H, д, J=2,9 Гц), 7,82 (1H, с), 8,08-8,11 (3 Н, м), 8,60 (1H, с), 8,95 (1H, д,J=2,9 Гц), 13,2 (1H, уширенный с), MS (M+H) 557. Т.пл. 228-2C. Пример 48. 3-[2,6-Дихлор-4-(2,4-дихлорбензолсульфониламино)фенокси]хинолин-8-карбоновая кислота (48). К раствору метилового эфира 3-[2,6-дихлор-4-(2-дихлор-4-трифторметилбензолсульфониламино) фенокси]хинолин-8-карбоновой кислоты (47) (402 мг, 0,7 ммоль) в ТГФ/МеОН=0,1 мл/0,3 мл добавляют 4N NaOH (0,2 мл, 0,77 ммоль). Смесь нагревают при кипении с обратным холодильником в течение 12 ч. После охлаждения до комнатной температуры реакционную смесь фильтруют, чтобы удалить нерастворимые вещества. Фильтрат концентрируют и осадок растворяют в водном растворе NH4Cl и экстрагируют дважды AcOEt. Органический слой промывают рассолом и сушат над безводным MgSO4, концентрируют, что дает соединение 48 (197 мг, 50%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСОd6):7,32 (2 Н, с), 7,70-7,81 (2 Н, м), 7,90 (1 Н, д, J=2,2 Гц), 7,96 (1 Н, д, J=2,2 Гц), 8,17-8,19 (1 Н, м), 8,228,24 (1 Н, м), 8,38-8,39 (1 Н, м), 9,11 (1H, д, J=2,2 Гц), 11,4 (1 Н, уширенный с), 15,4 (1 Н, уширенный с). MS(М+Н) 557. Т.пл. 263-266 С. Пример 49. 2,4-Дихлор-N-[3,5-дихлор-4-(6-метилхинолин-3-илокси)фенил]-5-метилбензолсульфонамид (49). К раствору 3,5-дихлор-4-(6-метилхинолин-3-илокси)фениламина (100) (400 мг, 1,25 ммоль) в пиридине (0,12 мл, 1,48 ммоль) и СH2 Сl2 (4 мл) добавляют 2,4-дихлор-5-метилбензолсульфонилхлорид (325 мг,1,25 ммоль). Смесь перемешивают при комнатной температуре в течение 12 ч. Реакционную смесь концентрируют и осадок очищают с помощью хроматографической колонки (гексан/АсОЕt=2/1, 80 г силикагеля), что дает соединение (49) (453 мг, 66%) в виде белого твердого вещества. 1 Н ЯМР (300 МГц,ДМСО-d6):2,41 (3 Н, с), 2,44 (3 Н, с), 7,31 (3 Н, с), 7,49 (1H, д, J=8,7 Гц), 7,61 (1H, с), 7,88-7,91 (2 Н, м),8,19 (1H, с), 8,74 (1H, д, J=3,0 Гц), 11,3 (1H, уширенный с), MS (М+Н) 541. Т.пл. 228-230 С. Пример 50. Часть 1. 3-Хлор-5-фтор-4-(хинолин-3-илокси)нитробензол (50.1). К раствору 3,4-дифторнитробензола (1,00 г) в концентрированной H2SO4 (20 мл) порциями добавляют Cl2 О в ССl4 (25 мл, приготовлен, как описано Cady G.H. et al. в Inorg. Synth. Vol 5, р. 156 (1957. Смесь перемешивают при комнатной температуре в течение ночи. Затем ее выливают на дробленый лед и экстрагируют Et2O (30 мл х 3). Объединенные слои эфира промывают 10% Na2SO3 и рассолом, сушат над Na2SO4. Растворитель концентрируют до около 10 мл (этот раствор содержит 3-хлор-4,5-дифторнитробензол). Полученный раствор разбавляют ацетоном (60 мл), затем к указанному раствору добавляют 3-гидроксихинолин (0,75 г) и K2 СО 3 (2,2 г). Смесь нагревают при кипении с обратным холодильником в течение 1,5 ч. После охлаждения реакционную смесь фильтруют через небольшую подушку из целита. Фильтрат концентрируют, что дает масло, которoе затем очищают с помощью хроматографической колонки (силикагель, АсОЕt:гексан=1,5), что дает примежуточное соединение 50.1 (0,980 г) в виде масла желтого цвета. Часть 2. 3-Хлор-5-фтор-4-(хинолин-3-илокси)фениламин (50.2). К раствору 3-хлор-5-фтор-4-(хинолин-3-илокси)нитробензола (50.1) (0,980 г) и NH4Cl (1,64 г) в ЕtOН(50 мл) - H2O (5 мл) добавляют порошок железа (1,92 г). Смесь нагревают при кипении с обратным холо- 20005976 дильником в течение 1 ч. После охлаждения реакционную смесь фильтруют через небольшую подушку из целита. Фильтрат концентрируют, разбавляют насыщенным NаНСО 3 и экстрагируют AcOEt (30 мл х 3). Объединенные органические слои промывают рассолом и сушат над Na2SO4. Концентрирование растворителя дает сырой продукт, который очищают с помощью хроматографической колонки (силикагель,АсОЕt:гексан=1:3), что дает анилин 50.2 (0,420 г) в виде бесцветного твердого вещества. Часть 3. N-[3-Хлор-5-фтор-4-(хинолин-3-илокси)фенил]-2,4-дихлор-5-метилбензолсульфонамид (50). К раствору 3-хлор-5-фтор-4-(хинолин-3-илокси)фениламина (50.2) (0,420 г) в пиридине (2,2 мл) добавляют 2,4-дихлор-5-метилбензолсульфонилхлорид (0,360 г). Смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь очищают непосредственно с помощью хроматографической колонки (силикагель, АсОЕt:гексан=1:3). Продукт растирают в порошок с помощью гексана, что дает названное соединение (0,522 г). Выход 73%, в виде твердого вещества. 1 Н ЯМР (300 МГц/СDСl3):2,43(3 Н, с), 7,05 (1 Н, д, J=2,6 Гц), 7,09-7,11 (1 Н, м), 7,21 (1H, д, J=2,6 Гц), 7,36 (1 Н, уширенный синглет),7,49-7,66 (4 Н, м), 7,96 (1 Н, с), 8,10 (1H, д, J=8,2 Гц), 8,80 (1H, уширенный синглет). MS (M+H) 511. Т.пл. 187 С. Пример 51. 3-Хлор-4-(хинолин-3-илокси)нитробензол (51). К раствору 3-гидроксихинолина (1,00 г) и 3-хлор-4-фторнитробензола (1,21 г) в ацетоне (20 мл) добавляют K2 СО 3 (2,86 г). Смесь нагревают при кипении с обратным холодильником в течение 1 ч. После охлаждения реакционную смесь фильтруют через небольшую подушку из целита. Фильтрат концентрируют, что дает соединение 51 (2,07 г, количественный) в виде масла коричневого цвета. 1 Н ЯМР (300 МГц/ СDСl3):7,02 (1H, д, J=9,1 Гц), 7,61 (1H, м), 7,72-7,80 (3 Н, м), 8,10-8,18 (2 Н, м), 8,45 (1H, д, J=2,7 Гц),8,82 (1H, д, J=2,8 Гц). Пример 52. 3-Хлор-4-(хинолин-3-илокси)фениламин (52). К раствору нитробензола 51 (2,07 г) и NH4Cl (1,84 г) в ЕtOН (40 мл) - Н 2 О (10 мл) добавляют порошок железа (1,92 г). Смесь нагревают при кипении с обратным холодильником в течение 1 ч. После охлаждения реакционную смесь фильтруют через небольшую подушку из целита. Фильтрат концентрируют, разбавляют насыщенным раствором NaHCO3 (30 мл) и экстрагируют AcOEt (30 мл). Объединенные органические слои промывают рассолом (30 мл) и сушат над Na2SO4. Концентрирование растворителя дает анилин 52 (1,77 г, 95%) в виде желтого твердого вещества. 1 Н ЯМР (300 МГц/СDСl3):3,77 (2 Н, уширенный синглет), 6,63 (1H, дд, J=2,7 Гц, J=8,6 Гц), 6,83 (1H, д, J=2,7 Гц), 6,99 (1 Н, д, J=8,6 Гц), 7,24 (1H,д, J=2,8 Гц), 7,49 (1H, м), 7,56-7,64 (2 Н, м), 8,08 (1H, м), 8,86 (1H, J=2,8 Гц). Структуры соединений для примеров 53-54 и 56-61 проиллюстрированы в табл. 6. Таблица 6 Пример 53. Соединение 53. 2-Амино-6-хлорбензотиазол (3,68 г, 20 ммоль) и 1,2,3-трихлор-5-нитробензол (4,53 г, 20 ммоль) растворяют в безводном ДМСО (10 мл). Добавляют твердый K2 СО 3 (3,04 г, 22 ммоль) и реакционную смесь нагревают до 150 С в течение 4 ч. Ей позволяют охладиться, затем выливают в 53 мл деионизиро- 21005976 ванной воды. Выпадает ярко-желтое твердое вещество, осадок которого собирают с помощью фильтрования после попыток растворить продукт в этилацетате. Желтое твердое вещество суспендируют в 100 мл этилацетата и нагревают до кипении с обратным холодильником. После охлаждения до комнатной температуры, фильтрования, промывания этилацетатом, затем гексаном и высушивания в вакууме получают нитросоединение 53 в виде желтого вещества в порошке (1,06 г). 1 Н ЯМР (d6-ДМСО):8,37 (с, 2 Н); 7,76(уширенный, 1 Н); 7,30 (дд, 1 Н); 7,23 (уширенный, 1 Н). MS (M-H) 372. Пример 54. Соединение 54. К раствору 2-хлор-4-нитроанилина (2 г) и трет-бутоксида калия (12 ммоль) в ТГФ (18 мл) добавляют раствор 2-хлорбензотиазола (2,75 г) в ТГФ (6 мл). Смесь нагревают при кипении с обратным холодильником в течение ночи, затем захолаживают (100 мл). Продукт экстрагируют хлористым метиленом и очищают с помощью флеш-хроматографии, что дает соединение 54 (300 мг) в виде желтого твердого вещества. 1 Н ЯМР (d6-ацетон):9,74 (уширенный с, 1 Н), 9,214 (уширенный д, 1 Н), 8,346 (м, 2 Н), 7,891(Lancaster) (0,95 г) конденсируют с 2-амино-4-хлортолуолом (0,69 г) в кипящем ацетоне с образованием смешенной тиомочевины 55 (1,5 г). 1H ЯМР (ДМСО):10,021 (с, 1 Н), 9,789 (с, 1 Н), 8,373 (м, 1 Н), 8,197(м, 2 Н), 7,441 (д, J=1,6 Гц, 1 Н), 7,315 (д, J=8,4 Гц, 1 Н), 7,268 (дд, J=8,4, 2 Гц, 1 Н), 2,237 (с, 3 Н). MS (M+H) 356. CHN, вычислено: 47,20% С, 3,11% Н, 11,80% N; найдено: 47,24% С, 3,15% N, 11,69% N. Пример 56. Соединение 56. К охлажденному раствору тиомочевины 55 (0,63 г) в хлороформе (6 мл) медленно добавляют бром(0,6 г). Затем смесь нагревают до кипения с обратным холодильником в течение 2 ч. После охлаждения твердое вещество собирают с помощью фильтрования и затем растирают в порошок с ацетоном, что дает бензотиазол 56 в виде его соли с НВr (0,5 г). 1 Н ЯМР (ДМСО):8,989 (уширенный д, J=8,4 Гц, 1 Н), 8,365(д, J=2,4 Гц, 1 Н), 8,291 (дд, J=9,2, 2,8 Гц, 1 Н), 7,259 (м, 2 Н), 5,4 (уширенный с), 2,557 (с, 3 Н). MS (М-Н) 352. CHN, вычислено: М+0,9 НВr: 39,38% С, 2,34% Н, 9,84% N; найдено: 39,44% С, 2,35% Н, 9,66% N. Пример 57. Соединение 57. С помощью методики, приведенной в примерах 55 и 56, 2,6-дихлор-4-нитрофенилизотиоцианат конденсируют с 3,5-дихлоранилином с образованием соответствующей смешанной тиомочевины, которую циклизуют с бромом, что дает бензотиазол 57, пригодный для применения в следующей реакции.MS (М-Н) 406. Пример 58. По методике, изложенной в примере 53, бензотиазол 58 получают с 78% выходом, в виде желтого твердого вещества. MS (M+H) 354. Пример 59. По методике, изложенной в примере 53, бензотиазол 59 получают с 30% выходом, в виде желтого твердого вещества. MS (M+H) 354. Пример 60. Соединение 60. 2,7-Дихлорбензотиазол (0,85 г, 4,2 ммоль) и 2,6-дихлор-4-нитроанилин (2,1 г, 10,4 ммоль) растворяют в безводном ДМСО (10 мл). Добавляют твердый CS2CO3 (4,1 г, 12,5 ммоль) и реакционную смесь нагревают до 80 С в течение 16 ч. Ей позволяют охладиться, затем выливают в 200 мл дистиллированной воды. Избыток карбоната цезия нейтрализуют уксусной кислотой. Водный слой экстрагируют 2 х 100 мл этилацетата. Объединенные органические слои промывают насыщенным рассолом, сушат над MgSO4,фильтруют, после чего концентрируют до образования желто-коричневого твердого вещества. Нерастворимость этого соединения мешает очистке, поэтому сырой продукт применяют непосредственно на сле- 22005976 дующей стадии. 1H ЯМР (400 МГц) (d6-ацетон):10,35 (уширенный, 1 Н); 8,36 (с, 2 Н); 7,37 (т, 1 Н); 7,30(GB1131780 (1966 конденсируют с метил-(4-аминофенил)сульфоном с образованием соответствующей смеси тиомочевины, которую подвергают циклизации с бромом, что дает бензотиазол 61, пригодный для применения на следующей стадии. 1 Н ЯМР (ДМСО):8,44 (с, 2 Н), 8,28 (уширенный с, 2 Н), 7,82 (уширенный д, 1 Н), 7,41 (уширенный д, 1 Н), 3,19 (с, 3 Н). MS (M-H) 416. Примеры 62-69. Восстановление нитропроизводных, включенных в табл. 6, по способу А, описанному в примерах 16-23, дает соответствующие анилины, проиллюстрированные в табл. 7. Таблица 7(уширенный с, 2 Н). MS (M+H) 378. Пример 68. Сырой 58 восстанавливают с помощью SnCl22H2O в соответствии с методикой, описанной в настоящем описании, что дает соединение 68 в виде зеленоватого/серого твердого вещества после перекристаллизации из горячего этилацетата/гексана (1,14 г). 1H ЯМР (d6-ацетон):8,87 (уширенный, 1 Н); 7,40(дд, 1 Н); 7,30 (т, 1 Н); 7,11 (д, 1 Н); 6,87 (с, 2 Н); 5,44 (уширенный, 2 Н). MS (M+H) 344,0. Пример 69. 1 Н ЯМР (ДМСО):10,08 (с, 1 Н), 8,31 (с, 1 Н), 7,76 (д, J=8,4 Гц, 1 Н), 7,57 (д, J=8,4 Гц, 1 Н), 6,73 (с,2 Н), 5,90 (с, 2 Н), 3,17 (с, 3 Н). MS (M-H) 388. Примеры 70-91. Сульфонирование анилинов из табл. 7 по методике, изложенной в примере 3, или одной из методик,указанных ниже, обеспечивает соединения, проиллюстрированные в табл. 8. Способ D. К раствору анилина в хлористом метилене (10 мл/г) добавляют сульфонилхлорид (от 1,1 до 1,5 экв.) в хлористом метилене. Затем добавляют пиридин (2 экв.). Смесь медленно концентрируют на роторном испарителе при нормальном давлении при температуре ванны от 40 до 60 С. После 2-18 ч смесь концентрируют в вакууме и вновь растворяют в хлористом метилене. Флеш-хроматография с 0-20% этилацетатом в хлористом метилене представляет желаемый продукт, который может быть быстро растерт в порошок с эфиром или гексаном, что дает продукт в виде твердого вещества.- 23005976 Способ Е. Раствор анилина (0,5 ммоль) в ацетоне (3 мл) обрабатывают арилсульфонилхлоридом (1 экв.), 2,6 лутидином (1 экв.) и каталитическим ДМАП в течение ночи при комнатной температуре. Реакционную массу разбавляют хлористым метиленом, промывают 1N HCl и затем рассолом. Органический слой концентрируют, затем очищают с помощью флеш-хроматографии с получением вещества в виде пены, которая может быть закристаллизована при растирании в порошок со смесью эфир/гексан. Таблица 8(с, 3 Н). MS (M-H) 628. Пример 92. 3-Гидрокси-6-метилхинолин (92). Раствор 3-амино-6-метилхинолина (1,21 г, 7,65 ммоль, полученный в соответствии с J. Chem. Soc. 2024-2027 (1948) Morley et al.) в 6N H2SO4 (25 мл) охлаждают на бане со льдом. К раствору добавляютNaNO2 (560 мг, 8,10 ммоль) в воде (2 мл) и перемешивают в течение 30 мин при 0 С. Отдельно нагревают 5% H2SO4 при кипении с обратным холодильником и добавляют вышеуказанную диазореакционную смесь к этому нагретому при кипении с обратным холодильником раствору. Через 30 мин реакционную смесь охлаждают до комнатной температуры и нейтрализуют 6N NaOH. Полученный нерастворимый продукт собирают с помощью фильтрования. Твердое вещество перекристаллизовывают изCHCl3/AcOEt, что дает соединение (92) (348 мг, 29%). 1 Н ЯМР (300 МГц, ДМСО-d6):7,34 (1H, дд,J=1,9, 8,6 Гц), 7,42 (1H, д, J=2,8 Гц), 7,55 (1H, с), 7,79 (1H, д, J=8,6 Гц), 8,50 (1H, д, J=2,8 Гц). Пример 93. 3-(2,6-Дихлор-4-нитрофенокси)-6-метилхинолин (93). К раствору 3-гидрокси-6-метилхинолина (92) (348 мг, 2,19 ммоль) в ДМФА (3,5 мл) добавляют NaH(60% суспензия в масле, 90 мг, 2,25 ммоль) одной порцией при комнатной температуре. Через 5 мин добавляют 3,4,5-трихлорнитробензол (509 мг, 2,25 ммоль) в ДМФА (2 мл) и реакционную смесь нагревают при 50 С при перемешивании в течение 2 ч. После чего реакционную смесь охлаждают до комнатной температуры, добавляют ледяную воду, которую затем подкисляют 2N НСl и экстрагируют дваждыAcOEt. Органический слой промывают рассолом, сушат над безводным MgSO4 и концентрируют. Сырой осадок очищают с помощью хроматографической колонки (гексан/АсОЕt=4/1, 80 г силикагеля), что дает соединение 93 (510 мг, 67%). 1H ЯМР (300 МГц, ДМСО-d6):7,52-7,57 (2 Н, м), 7,61 (1 Н, с), 7,94 (1 Н, д,J=8,6 Гц), 8,63 (2 Н, с), 8,86 (1 Н, д, J=2,9 Гц). Пример 94. 3-(2,6-Дихлор-4-нитрофенокси)хинолин-6-карбоновая кислота (94). Раствор 3-(2,6-дихлор-4-нитрофенокси)-6-метилхинолина (93) (510 мг, 1,46 ммоль) и оксида хрома(VI) (292 мг, 2,92 ммоль) в H2SO4/H2O=2,4 мл/4,7 мл нагревают при 100 С, пока три порции по 292 мг хромового ангидрида добавляют с интервалом каждые 8 ч. Через 32 ч нагревание останавливают и дают возможность смеси отстояться в течение ночи. Нерастворимый продукт собирают с помощью фильтрования и данное твердое вещество промывают водой дважды, что дает соединение (94) (443 мг, 80%). 1 Н ЯМР (300 МГц, ДМСО-d6):7,94 (1 Н, д, J=3,0 Гц), 8,14 (2 Н, с), 8,56 (1 Н, с), 8,65 (2 Н, с), 9,09 (1 Н, д,J=3,0 Гц). Пример 95. Метиловый эфир 3-(2,6-дихлор-4-нитрофенокси)хинолин-6-карбоновой кислоты (95). К раствору 3-(2,6-дихлор-4-нитрофенокси)хинолин-6-карбоновой кислоты (94) (443 мг, 0,93 ммоль) в сухом ТГФ (20 мл) добавляют CH2N2 в растворе Et2O (получен из нитрозометилмочевины (1,65 г) и 50% КОН (5 мл. Полученную смесь перемешивают при комнатной температуре в течение 1 ч. К реакционной смеси добавляют АсОН (1 мл), затем концентрируют. К осадку добавляют насыщенную NaHCO3,экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над безводным MgSO4 и концентрируют, что дает соединение 95 (415 мг). 1H ЯМР (300 МГц, ДМСО-d6):3,89 (3 Н, с), 5,75 (2 Н,уширенный с), 6,76 (2 Н, с), 7,73 (1 Н, д, J=2,9 Гц), 8,09 (2 Н, с), 8,67 (1 Н, с), 8,94 (1 Н, д, J=2,9 Гц). Пример 96. Метиловый эфир 3-(4-амино-2,6-дихлорфенокси)хинолин-6-карбоновой кислоты (96). К раствору метилового эфира 3-(2,6-дихлор-4-нитрофенокси)хинолин-6-карбоновой кислоты (95)(0,93 ммоль) и NH4Cl (283 мг, 5,3 ммоль) в смеси ЕtOН/ТГФ/вода (8 мл/16 мл/1 мл) добавляют порошок железа (296 мг, 5,3 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 4 ч. Нерастворимые вещества удаляют с помощью целитовой подушки, которую промывают ТГФ, ацетоном и затем EtOH. Фильтрат концентрируют, и добавляют насыщенный NаНСО 3, и экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над безводным MgSO4 и концентрируют, что дает соединение 96 (372 мг, более светлое). 1 Н ЯМР (300 МГц, ДМСО-d6):3,89 (3 Н, с),5,75 (2 Н, с), 6,76 (2 Н, с), 7,73 (1 Н, д, J=2,9 Гц), 8,09 (2 Н, с), 8,67 (1 Н, с), 8,94 (1 Н, д, J=2,9 Гц). Пример 97. Метиловый эфир 3-гидрокси-8-хинолинкарбоновой кислоты (97). К смеси 8-хинолинкарбоновой кислоты (500 мг, 2,89 ммоль) в ТГФ (80 мл) добавляют CH2N2 в Еt2O растворе (получен из нитрозометилмочевины (1,65 г) и 50% KОН (5 мл при комнатной температуре. Реакционную смесь перемешивают в течение 12 ч и затем концентрируют, что дает примежуточное соединение - сложный эфир. 1H ЯМР (300 МГц, ДМСО-d6):3,92 (3 Н, с), 7,60-7,70 (2 Н, м), 7,93-7,96 (1 Н,м), 8,14-8,17 (1 Н, м), 8,44-8,48 (1 Н, м), 8,97-8,99 (1 Н, м). К раствору промежуточного метилового эфира 8-хинолинкарбоновой кислоты (2,89 ммоль) в АсОН (4 мл) добавляют 30% Н 2 О 2 (0,6 мл). Реакционную смесь нагревают при 85 С в течение 7,5 ч. Реакционную смесь обрабатывают насыщенным NаНСО 3 и 1- 26005976 экстрагируют 6 раз с помощью СНСl3. Органический слой сушат над безводным MgSO4 и концентрируют. Сырой осадок растирают в порошок со смесью СНСl3/толуол, что дает соединение 97 (256 мг, 44%, в 2 стадии). 1 Н ЯМР (300 МГц, ДМСО-d6):3,89 (3 Н, с), 7,52 (1 Н, д, J=6,9 Гц), 7,57 (1 Н, д, J=1,5 Гц), 7,66(1 Н, дд, J=1,5, 6,9 Гц), 7,95 (1 Н, дд, J=1,5, 8,1 Гц), 8,63 (1 Н, д, J=2,7 Гц), 10,5 (1H, уширенный с). Пример 98. Метиловый эфир 3-(2,6-дихлор-4-нитрофенокси)хинолин-8-карбоновой кислоты (98). К раствору метилового эфира 3-гидрокси-8-хинолинкарбоновой кислоты (97) (256 мг, 1,26 ммоль) и 3,4,5-трихлорнитробензола (294 мг, 1,30 ммоль) в ацетоне (40 мл) добавляют K2 СО 3 (870 мг, 6,30 ммоль). Полученную смесь нагревают при кипении с обратным холодильником в течение 3,5 ч. Реакционную смесь охлаждают до комнатной температуры и нерастворимые вещества удаляют с помощью фильтрования через целит. Фильтрат концентрируют и осадок очищают с помощью хроматографической колонки(гексан/АсОЕt=4/1, 80 г силикагеля), что дает соединение 98. 1 Н ЯМР (300 МГц, ДМСО-d6):3,92 (3 Н,с), 7,67 (1H, дд, J=7,3 Гц), 7,79 (1H, д, J=2,9 Гц), 7,88 (1H, дд, J=1,5, 7,3 Гц), 9,05 (1H, д, J=2,9 Гц). Пример 99. Метиловый эфир 3-(4-амино-2,6-дихлорфенокси)хинолин-8-карбоновой кислоты (99). К раствору метилового эфира 3-(2,6-дихлор-4-нитрофенокси)хинолин-8-карбоновой кислоты (98)(1,26 ммоль) и NH4Cl (370 мг, 6,91 ммоль) в ЕtOН/ТГФ/Н 2O=8 мл/4 мл/2 мл добавляют порошок железа(386 мг, 6,91 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 3,5 ч. После охлаждения до комнатной температуры нерастворимые вещества фильтруют с помощью целитовой фильтрования. Фильтрат концентрируют и добавляют к осадку насыщенный раствор NаНСО 3,экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над MgSO4 и концентрируют. Сырой осадок очищают с помощью хроматографической колонки (гексан/АсОЕt=2/1, 80 г силикагеля), что дает соединение 99 (543 мг). 1 Н ЯМР (300 МГц, ДМСО-d6):3,91 (3 Н, с), 5,77 (2 Н, уширенный с), 6,78 (2 Н, с), 7,50 (1 Н, д, J=3,0 Гц), 7,61 (1 Н, дд, J=8,1 Гц), 7,81 (1 Н, дд, J=1,4, 6,4 Гц), 8,08 (1 Н, дд,J=1,4 Гц, 6,4 Гц), 8,93 (1H, д, J=3,0 Гц). Пример 100. 3,5-Дихлор-4-(6-метилхинолин-3-илокси)фениламин (100). К раствору 3-(2,6-дихлор-4-нитрофенокси)-6-метилхинолина (93) (1,30 г, 3,71 ммоль) и NH4Cl (992 мг,18,55 ммоль) в ЕtOН/ТГФ/Н 2O=12 мл/12 мл/3 мл добавляют порошок железа (1,04 г, 18,55 ммоль). Смесь нагревают при кипении с обратным холодильником в течение 4 ч. Нерастворимые вещества удаляют с помощью целитовой подушки. Фильтрат концентрируют и насыщенный раствор NaHCO3 добавляют к осадку, затем экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над безводным MgSO4 и концентрируют, что дает соединение 100 (1,18 г, 98%). 1 Н ЯМР (300 МГц, ДМСО-d6):2,44 (3 Н, с), 5,75 (2 Н, уширенный с), 6,77 (2 Н, с), 7,27 (1H, д, J=2,8 Гц), 7,48 (1H, д, J=8,6 Гц), 7,67 (1H,с), 7,89 (1H, д, J=8,6 Гц), 8,74 (1H, д, J=2,8 Гц). Пример 101. 2,6-Дихлорбензотиазол (101). 2-Амино-6-хлорбензотиазол (15,7 г, 85 ммоль) в Н 3 РO4 (85%) (470 мл) нагревают до 100 С, растворяют. Затем полученный прозрачный раствор охлаждают и энергично перемешивают с помощью механической мешалки. Добавляют медленно NaNO2 (17,6 г, 255 ммоль) в воде (30 мл), поддерживая температуру ниже 0 С. Отдельно охлаждают раствор CuSO4/5H2O (85 г), NaCl (107 г) в воде (350 мл) до -5 С и перемешивают с помощью механической мешалки. После того как окрашивание крахмальной бумаги иодидом калия исчезает, раствор диазония, поддерживая его холодным, медленно добавляют к раствору хлорида меди при энергичном перемешивании. Реакционной смеси дают возможность нагреться до комнатной температуры. Через 1 ч к реакционной смеси добавляют воду (1 л) и эфир (1 л) и дважды экстрагируют. Органический слой промывают водой, сушат над безводным MgSO4 и концентрируют. Сырой осадок очищают с помощью хроматографии на силикагеле (Н/А=4/1, 180 г силикагеля), что дает названное соединение 101 (7,46 г, 48%). Пример 102. 3,5-Дихлор-4-(6-хлорбензотиазол-2-илокси)фениламин (102). К раствору 4-амино-2,6-дихлорфенола (6 г, 26,5 ммоль) и 2,6-дихлорбензотиазола (101) (6 г, 29,4 ммоль,1,1 экв.) в ДМСО (25 мл) добавляют K2 СО 3 (11 г, 80 ммоль, 3,0 экв.). Смесь перемешивают и нагревают до 160 С. Через 5,5 ч к реакционной смеси добавляют воду (20 мл), нейтрализуют 2N НСl и трижды экстрагируют AcOEt. Затем органический слой промывают рассолом, сушат над безводным MgSO4 и концентрируют. Сырой осадок очищают с помощью хроматографической колонки (СНСl3/ацетон=9/1, 180 г силикагеля), что дает 3,5-дихлор-4-(6-хлорбензотиазол-2-илокси)фениламин (102) в виде твердого вещества черного цвета (4,52 г, 49%). 1H ЯМР (300 МГц, ДМСО-d6):5,86 (2 Н, уширенный с), 6,74 (2 Н, с),7,48 (1 Н, дд, J=2,1, 5,7 Гц), 7,70 (1 Н, д, 8,7 Гц), 8,10 (1H, д, 2,1 Гц). Пример 103. 2-Хлор-N-[3,5-дихлор-4-(6-хлорбензотиазол-2-илокси)фенил]-4-трифторметилбензолсульфонамид (103). Раствор 3,5-дихлор-4-(6-хлорбензотиазол-2-илокси)фениламина (102) (2,0 г, 5,79 ммоль) и 3-хлор-4 трифторметилбензолсульфонилхлорида (1,7 г, 6,08 ммоль) в пиридине (10 мл) перемешивают при комнатной температуре. Через 3 ч к реакционной смеси добавляют воду, а затем подкисляют с помощью 2N НСl. Реакционную смесь экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над MgSO4 и концентрируют. Сырой осадок очищают с помощью хроматографической колонки(Н/А=4/1, 80 г силикагеля), что дает названное соединение 103 (2,11 г, 65%) в виде белого твердого ве- 27005976 щества. Т.пл. 82-84 С. 1H ЯМР (400 МГц, ДМСО-d6):7,32 (2 Н, с), 7,46 (1H, дд, J=2,2, 8,7 Гц), 7,67 (1H,д, J=8,7 Гц), 8,00 (1H, д, 8,0 Гц), 8,14 (1H, д, J=2,2 Гц), 8,20 (1H, с), 8,38 (1H, д, J=8,3 Гц), 11,6 (1H, уширенный с). MS (M+H) 586. Пример 104. 2,4-Дихлор-N-[3,5-дихлор-4-(6-хлорбензотиазол-2-илокси)фенил]бензолсульфонамид (104). Раствор 3,5-дихлор-4-(6-хлорбензотиазол-2-илокси)фениламина (102) (2,0 г, 5,79 ммоль) и 2,4 дихлорбензолсульфонилхлорида (1,5 г, 6,08 ммоль) в пиридине (10 мл) перемешивают при комнатной температуре в течение 12 ч. К реакционной смеси добавляют воду, подкисляют с помощью 2N НСl и экстрагируют дважды AcOEt. Органический слой промывают рассолом, сушат над MgSO4 и концентрируют. Сырой осадок очищают с помощью хроматографической колонки (Н/А=4/1, 80 г силикагеля), что дает названное соединение (104) (1,49 г, 46%) в виде белого твердого вещества. Т.пл. 73-75 С. 1 Н ЯМРChem. 30: p. 1166 (1987 и 4-амино-2,6-дихлорфенола (1,3 г, от Tokyo Chemical Industry Co., Ltd.) в ДМСО (9 мл) добавляют K2 СО 3 (3,12 г). Смесь нагревают при 150 С в течение 3 ч. Реакционную смесь очищают с помощью хроматографической колонки (силикагель, АсОЕt:гексан=1:2), что дает анилин 105 К раствору 3,5-дихлор-4-(6-метоксибензотиазол-2-илокси)фениламина (105) (1,40 г) в пиридине (5 мл) добавляют 2-хлор-4-трифторбензолсульфонамид (1,15 г). Смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь очищают непосредственно с помощью хроматографической колонки (силикагель, АсОЕt:гексан=1:3). Продукт растирают в порошок с помощью гексана, что дает названное соединение 106 (1,97 г, 82%) в виде бесцветного порошка. Т.пл. 164-165 С. 1H ЯМР (300 МГц/ДМСО-d6):3,79 (3 Н, с), 7,00 (1H, дд, J=2,9 Гц, J=8,8 Гц), 7,31 (2 Н, с), 7,55 (1H, д, J=8,8 Гц), 7,58 6-Хлорбензотиазол-2-иламин (200). Концентрированную серную кислоту (VWR, 5,4 мл, 100 ммоль) добавляют в течение более 10 мин к перемешиваемому раствору 4-хлоранилина (Aldrich, 25,52 г, 200 ммоль) в 130 мл хлорбензола. Образуется густая суспензия. К полученной выше суспензии добавляют KSCN (Aldrich, 25,3 г, 260 ммоль), а затем смесь нагревают до 110 С в течение 6 ч. Смесь охлаждают до комнатной температуры, разбавляют 300 мл гексана и фильтруют. Осадок помещают в 500 мл воды, нагревают до 80 С в течение 30 мин. Фильтрование дает 32,0 г продукта. К перемешиваемому раствору вышеупомянутого продукта в 120 мл СНСl3 при 10 С добавляют бром (Aldrich, 68,8 г, 430 ммоль) в течение более 20 мин. Смесь перемешивают при комнатной температуре в течение 30 мин и затем нагревают при кипении с обратным холодильником в течение 30 мин. Фильтрование после промывания твердого вещества с помощью СНСl3 и эфира дает желтое твердое вещество, которое суспендируют в ацетоне. Это приводит к исчезновению желтого цвета у вещества, после чего фильтрование после промывания ацетоном и эфиром дает белое твердое вещество. Твердое вещество растворяют в 800 мл горячей воды и рН охлажденного раствора доводят до значения 9 с помощью концентрированного NH4OH. Фильтрование с последующим промыванием водой дает 17,8 г продукта. 1 2-Амино-5-хлорбензолтиол (201). Раствор 6-хлорбензотиазол-2-иламина (пример 200, 17,8 г, 96,7 ммоль) и KОН (ЕМ, 87 г, 1,55 моль) в 150 мл воды нагревают при кипении с обратным холодильником в течение 2 дней. Смесь охлаждают до комнатной температуры и разбавляют льдом. Раствор доводят до значения рН, равного 5, с помощью концентрированной НСl. Смесь экстрагируют 3 х ЕtOАс (300 мл). Органические слои объединеняют и дважды промывают рассолом (300 мл), сушат над Na2SO4. Удаление растворителя при пониженном давлении дает 10,5 г продукта. 1 Н ЯМР (400 МГц, ДМСО):7,20 (д, J=2,5 Гц, 1H), 6,93 (дд, J=8,6, 2,5 Гц,1 Н), 6,69 (д, J=8,6 Гц, 1 Н) 5,30 (с, 3 Н). MS (EI): м/е 160 (М+Н). Пример 202. 2-Хлор-6-нитробензолтиол (202). К раствору 2,3-дихлорнитробензола (Aldrich, 19,2 г, 100 ммоль) в 300 мл ДМСО добавляют порошкообразный Na2S9H2O (Aldrich, 24,0 г, 100 ммоль). Смесь перемешивают при комнатной температуре в течение 24 ч, затем разбавляют 2 л воды. Смесь фильтруют и фильтрат подкисляют до значения рН, равного 4, с помощью концентрированной НСl. Смесь экстрагируют 3 х Et2O (400 мл). Органические слои объединяют, дважды промывают рассолом (400 мл) и сушат над Na2SO4. Удаление растворителя при пониженном давлении дает 18,4 г продукта. 1H ЯМР (400 МГц, ДМСО):8,11 (дд, J=8,3, 1,3 Гц, 1H), 7,93NaH (Aldrich, 2,60 г, 60%, 65 ммоль). Смесь перемешивают в течение 20 мин, затем добавляют бензилбромид (Aldrich, 6,2 мл, 52 ммоль). После перемешивания в течение 3 ч смесь разбавляют 2N НСl, экстрагируют 3 х ЕtOАс (200 мл). Органические слои объединяют, дважды промывают рассолом (200 мл),сушат над Na2SO4 и концентрируют в вакууме. Осадок хроматографируют (40-60% СН 2 Сl2/гексан) с получением 12,82 г (92%) продукта. 1 Н ЯМР (400 МГц, ДМСО):7,87 (дд, J=8,1, 1,3 Гц, 1H), 7,76 (дд,J=8,0, 1,3 Гц, 1H), 7,59 (т, J=8,1 Гц, 1H) 7,24-7,18 (м, 3 Н), 7,10-7,06 (м, 2 Н), 4,15 (с, 2 Н). Пример 204. 2-Бензилсульфанил-3-хлорфениламин (204). 2-Бензилсульфанил-3-хлорфениламин (204) синтезируют из бензилового эфира 2-хлор-6-нитробензолтиола (203, 20,0 г, 71,6 ммоль) способом, аналогичным описанному в примерах 16-23 (способ А). 1 Н ЯМР(400 МГц, ДМСО):7,27-7,18 (м, 5 Н), 7,00 (т, J=8,0 Гц, 1 Н), 6,65 ( дд, J=8,0, 1,1 Гц, 1 Н), 6,63 (дд, J=8,0,1,1 Гц, 1 Н), 3,91 (с, 2 Н). Продукт используют непосредственно на следующей стадии, как в примере 205. Пример 205.- 29005976 К раствору 2-бензилсульфанил-3-хлорфениламина (204) в 140 мл бензола при 0 С добавляют порциями АlСl3 (Aldrich, 23,8 г, 179 ммоль). Смесь становится пурпурного цвета. После перемешивания при комнатной температуре в течение ночи смесь выливают в смесь льда и ЕtOАс и перемешивают еще в течение 20 мин, затем экстрагируют 3 х ЕtOАс (500 мл). Органические слои дважды промывают рассолом(400 мл), сушат над Na2SO4 и концентрируют в вакууме. Сырой продукт обрабатывают 145 мл 1N HCl в эфире. Продукт (13,6 г) собирают с помощью фильтрования и промывают гексаном. 1 Н ЯМР (400 МГц,ДМСО):7,05 (т, J=8,2 Гц, 1 Н), 6,70 (д, J=8,2 Гц, 1 Н), 6,61 (д, J=7,8 Гц, 1 Н). Пример 206. 2-Амино-5-метилбензолтиол (206). 6-Метил-2-аминобензотиазол (5 г) суспендируют в растворе KОН (25 г), в воде (50 мл) и нагревают до кипения с обратным холодильником в течение ночи. После охлаждения до температуры окружающей среды рН раствора с помощью уксусной кислоты устанавливают до значения равного 6. Плотный осадок собирают фильтрованием и промывают водой. Осадок растворяют в хлористом метилене, сушат над сульфатом магния и концентрируют, что дает желтое твердое вещество (4,08 г), содержащее желаемый 2 амино-5-метилбензолтиол. (88% чистота). 1 Н ЯМР (d6-ДМСО) 6,982 (д, J=2 Гц, 1 Н); 6,744 (дд, J=8,2 Гц,1H); 6,605 (д, J=8,4 Гц, 1 Н); 4,885 (уширенный с, 2 Н); 3,32 (с, 1H); 2,103 (с, 3 Н). MS (ЕI): м/е 138 (М-Н). Соединения, включенные в табл. 9, получают по методике примера 8. Пример 207. 6-Хлор-2-(2,6-дихлор-4-нитробензил)бензотиазол (207). 1
МПК / Метки
МПК: C07D 277/82, A61P 29/00, A61K 31/428
Метки: модуляторы, ppar-гамма, хинолинил, бензотиазолил
Код ссылки
<a href="https://eas.patents.su/30-5976-hinolinil-i-benzotiazolil-ppar-gamma-modulyatory.html" rel="bookmark" title="База патентов Евразийского Союза">Хинолинил и бензотиазолил ppar-гамма модуляторы</a>
Предыдущий патент: Соединения пиперазинилпиразинов в качестве антагонистов серотонин 5-ht2 рецептора
Следующий патент: Способы стерилизации биологических материалов
Случайный патент: Способ получения метилового сложного эфира жирной кислоты и установка для осуществления способа












