Одно- и двузамещенные 3-пропил-гамма-аминомасляные кислоты
Номер патента: 4398
Опубликовано: 29.04.2004
Авторы: Беллиотти Томас Ричард, Торп Эндрю Джон, Брайанз Джастин Стивен, Уайз Лоренс Дейвид, Скелкан Роберт Майкл, Осума Огастин Тоби, Вустроу Дейвид Джурджен, Юэн По-Уэй, Экхэйто Айхизо Виктор, Шварц Джейкоб Брэдли
Формула / Реферат
1. Соединение формулы I
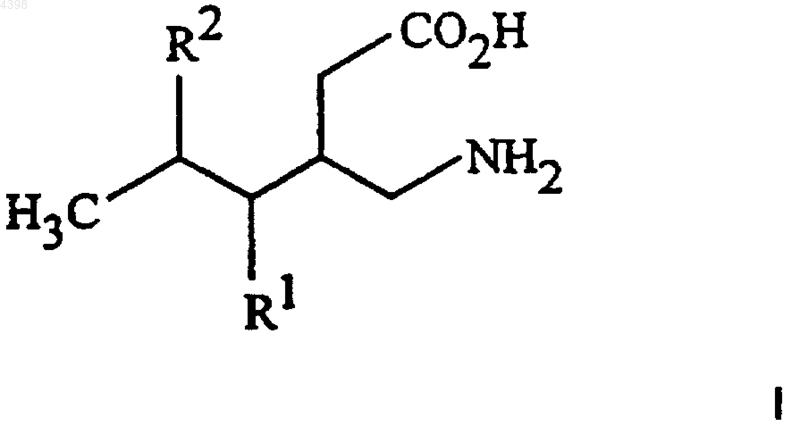
или его фармацевтически приемлемая соль, где
R1 представляет собой водород, нормальный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, или фенил;
R2 представляет собой нормальный или разветвленный алкил, содержащий от 4 до 8 атомов углерода; нормальный или разветвленный алкил, содержащий от 1 до 8 атомов углерода, в котором от 1 до 3 атомов водорода на алкиле могут быть заменены 1-3 атомами фтора, нормальный или разветвленный алкенил, содержащий от 2 до 8 атомов углерода, циклоалкил, содержащий от 3 до 7 атомов углерода, алкокси, содержащий от 1 до 6 атомов углерода, циклоалкилалкил, алкоксиалкил, OH-алкил, фенилалкил, феноксиалкил или фенил, замещенный 1-3 группами, каждая из которых независимо выбрана из галогена, алкокси, алкила и амино.
2. Соединение по п.1, где R1 представляет собой водород и R2 представляет собой нормальный или разветвленный алкил, содержащий от 4 до 8 атомов углерода.
3. Соединение или его фармацевтически приемлемая соль по п.1, выбранное из
3-аминометил-5-метилнонановой кислоты;
3-аминометил-5-метилдекановой кислоты;
3-аминометил-5-метилундекановой кислоты;
3-аминометил-5-метилдодекановой кислоты;
3-аминометил-5-метилтридекановой кислоты;
3-аминометил-5-циклопропилгексановой кислоты;
3-аминометил-5-циклобутилгексановой кислоты;
3-аминометил-5-трифторметилгексановой кислоты;
3-аминометил-5-(2-хлорфенил)гексановой кислоты;
3-аминометил-5-(3-хлорфенил)гексановой кислоты;
3-аминометил-5-(4-хлорфенил)гексановой кислоты;
3-аминометил-5-(2-метоксифенил)гексановой кислоты;
3-аминометил-5-(3-метоксифенил)гексановой кислоты;
3-аминометил-5-(4-метоксифенил)гексановой кислоты и
3-аминометил-5-(фенилметил)гексановой кислоты.
4. Соединение или его фармацевтически приемлемая соль, где указанное соединение представляет собой
(3S,5R)-3-аминометил-5-метилоктановую кислоту;
3-аминометил-5-метилоктановую кислоту;
3-аминометил-4-изопропилгептановую кислоту или
(3R,4R,5R)-3-аминометил-4,5-диметилоктановую кислоту.
5. Соединение или его фармацевтически приемлемая соль по п.1, где указанное соединение представляет собой
(3S,5R)-3-аминометил-5-метилнонановую кислоту;
(3S,5R)-3-аминометил-5-метилдекановую кислоту;
(3S,5R)-3-аминометил-5-метилундекановую кислоту или
(3S,5R)-3-аминометил-5-метилдодекановую кислоту.
6. Соединение по п.1, выбранное из
(3S,5R)-3-аминометил-5,9-диметилдекановой кислоты;
(3S,5R)-3-аминометил-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-5,7-диметилоктановой кислоты;
(3S,5R)-3-аминометил-5,10-диметилундекановой кислоты;
(3S,5R)-3-аминометил-6-циклопропил-5-метилгексановой кислоты;
(3S,5R)-3-аминометил-6-циклобутил-5-метилгексановой кислоты;
(3S,5R)-3-аминометил-6-циклопентил-5-метилгексановой кислоты;
(3S,5R)-3-аминометил-6-циклогексил-5-метилгексановой кислоты;
(3S,5R)-3-аминометил-7-циклопропил-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-циклобутил-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-циклопентил-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-циклогексил-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-8-циклопропил-5-метилоктановой кислоты;
(3S,5R)-3-аминометил-8-циклобутил-5-метилоктановой кислоты;
(3S,5R)-3-аминометил-8-циклопентил-5-метилоктановой кислоты;
(3S,5R)-3-аминометил-8-циклогексил-5-метилоктановой кислоты;
(3S,5R)-3-аминометил-8-фтор-5-метилоктановой кислоты и
(3S,5R)-3-аминометил-9-фтор-5-метилнонановой кислоты.
7. Соединение по п.1, выбранное из
(3S,5S)-3-аминометил-5-метоксигексановой кислоты;
(3S,5S)-3-аминометил-5-этоксигексановой кислоты;
(3S,5S)-3-аминометил-5-пропоксигексановой кислоты;
(3S,5S)-3-аминометил-5-изопропоксигексановой кислоты;
(3S,5S)-3-аминометил-5-трет-бутоксигексановой кислоты;
(3S,5S)-3-аминометил-5-фторметоксигексановой кислоты;
(3S,5S)-3-аминометил-5-(2-фторэтокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(3,3,3-трифторпропокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-феноксигексановой кислоты;
(3S,5S)-3-аминометил-5-(4-хлорфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(3-хлорфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(2-хлорфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(4-фторфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(3-фторфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(2-фторфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(4-метоксифенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(3-метоксифенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(2-метоксифенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(4-нитрофенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(3-нитрофенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-(2-нитрофенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-пропоксигексановой кислоты;
(3S,5S)-3-аминометил-6-изопропокси-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-трет-бутокси-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-фторметокси-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(2-фторэтокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-(3,3,3-трифторпропокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-феноксигексановой кислоты;
(3S,5S)-3-аминометил-6-(4-хлорфенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(3-хлорфенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(2-хлорфенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(4-фторфенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(3-фторфенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(2-фторфенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(4-метоксифенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(3-метоксифенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(2-метоксифенокси)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-(4-трифторметилфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-(3-трифторметилфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-(2-трифторметилфенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-(4-нитрофенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-(3-нитрофенокси)гексановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-(2-нитрофенокси)гексановой кислоты;
(3S,5S)-3-аминометил-6-бензилокси-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-7-гидрокси-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-метокси-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-пропоксигептановой кислоты;
(3S,5S)-3-аминометил-7-изопропокси-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-трет-бутокси-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-фторметокси-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(2-фторэтокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-(3,3,3-трифторпропокси)гептановой кислоты;
(3S,5S)-3-аминометил-7-бензилокси-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-феноксигептановой кислоты;
(3S,5S)-3-аминометил-7-(4-хлорфенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(3-хлорфенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(2-хлорфенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(4-фторфенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(3-фторфенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(2-фторфенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(4-метоксифенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(3-метоксифенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-7-(2-метоксифенокси)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-(4-трифторметилфенокси)гептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-(3-трифторметилфенокси)гептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-(2-трифторметилфенокси)гептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-(4-нитрофенокси)гептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-(3-нитрофенокси)гептановой кислоты;
(3S,5S)-3-аминометил-5-метил-7-(2-нитрофенокси)гептановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-фенилгексановой кислоты;
(3S,5S)-3-аминометил-6-(4-хлорфенил)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(3-хлорфенил)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(2-хлорфенил)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(4-метоксифенил)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(3-метоксифенил)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(2-метоксифенил)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(3-фторфенил)-5-метилгексановой кислоты;
(3S,5S)-3-аминометил-6-(2-фторфенил)-5-метилгексановой кислоты;
(3S,5R)-3-аминометил-5-метил-7-фенилгептановой кислоты;
(3S,5R)-3-аминометил-7-(4-хлорфенил)-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-(3-хлорфенил)-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-(2-хлорфенил)-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-(4-метоксифенил)-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-(3-метоксифенил)-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-(2-метоксифенил)-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-(4-фторфенил)-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-(3-фторфенил)-5-метилгептановой кислоты;
(3S,5R)-3-аминометил-7-(2-фторфенил)-5-метилгептановой кислоты;
(3S,5S)-3-аминометил-5-метил-гепт-6-еновой кислоты;
(3S,5R)-3-аминометил-5-метил-окт-7-еновой кислоты;
(3S,5R)-3-аминометил-5-метил-нон-8-еновой кислоты;
(E)-(3S,5S)-3-аминометил-5-метил-окт-6-еновой кислоты;
(Z)-(3S,5S)-3-аминометил-5-метил-окт-6-еновой кислоты;
(Z)-(3S,5S)-3-аминометил-5-метил-нон-6-еновой кислоты;
(E)-(3S,5S)-3-аминометил-5-метил-нон-6-еновой кислоты;
(E)-(3S,5R)-3-аминометил-5-метил-нон-7-еновой кислоты;
(Z)-(3S,5R)-3-аминометил-5-метил-нон-7-еновой кислоты;
(Z)-(3S,5R)-3-аминометил-5-метил-дек-7-еновой кислоты;
(E)-(3S,5R)-3-аминометил-5-метил-ундек-7-еновой кислоты;
(3S,5S)-3-аминометил-5,6,6-триметилгептановой кислоты;
(3S,5S)-3-аминометил-5-циклопропилгексановой кислоты;
(3S,5S)-3-аминометил-5-циклобутилгексановой кислоты;
(3S,5R)-3-аминометил-5-метил-8-фенилоктановой кислоты;
(3S,5S)-3-аминометил-5-метил-6-фенилгексановой кислоты и
(3S,5R)-3-аминометил-5-метил-7-фенилгептановой кислоты.
8. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 или 4 и фармацевтически приемлемый носитель.
9. Способ лечения эпилепсии, приступов головокружения, гипокинезии, краниальных расстройств, нейродегенеративных расстройств, депрессии, тревоги, паники, боли, невропатологических расстройств, нарушений сна, синдрома раздраженного кишечника (СРК) или желудочного нарушения, при котором млекопитающему, нуждающемуся в указанном лечении, вводят терапевтически эффективное количество соединения по п.1 или 4.
10. Способ лечения эпилепсии, тревоги, паники, боли, нарушений сна, синдрома раздраженного кишечника (СРК) или желудочного нарушения, при котором млекопитающему, нуждающемуся в указанном лечении, вводят терапевтически эффективное количество соединения по п.1 или 4.
Текст
1 Предпосылки изобретения Соединения формулы где R1 представляет собой водород или низший алкильный радикал и n равно 4, 5 или 6, известны из патента США 4024175 и его выделенного из нее патента США 4087544. Раскрыты применения: защитный эффект против спазма,индуцированного тиосемикарбазидом; защитное действие против спазма, индуцированного кардиазолом; заболевания головного мозга, эпилепсия, приступы головокружения, гипокинезия и черепные травмы; а также улучшение функций головного мозга. Эти соединения являются полезными у гериатрических пациентов. Эти патенты включены в данное описание изобретения путем ссылки. Соединения формулы или их фармацевтически приемлемые соли,где R1 представляет собой нормальную или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, фенил или циклоалкил,имеющий от 3 до 6 атомов углерода; R2 представляет собой водород или метил; и R3 представляет собой водород или карбоксил, известны из патента США 5563175 и различных выделенных из него патентов. Эти патенты включены сюда путем ссылки. Краткое изложение сущности изобретения Соединения по настоящему изобретению представляют собой соединения формулы I или их фармацевтически приемлемую соль,где R1 представляет собой водород, нормальный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, или фенил;R2 представляет собой нормальный или разветвленный алкил, содержащий от 4 до 8 атомов углерода, нормальный или разветвленный алкил, содержащий от 1 до 8 атомов углерода, в котором от 1 до 3 атомов водорода на алкиле могут быть заменены 1-3 атомами фтора,нормальный или разветвленный алкенил,содержащий от 2 до 8 атомов углерода,циклоалкил, содержащий от 3 до 7 атомов углерода,алкокси, содержащий от 1 до 6 атомов углерода,циклоалкилалкил,алкоксиалкил,ОН-алкил,фенилалкил,феноксиалкил или 2 фенил, замещенный 1-3 группами, каждая из которых независимо выбрана из галогена,алкокси, алкила и амино. Предпочтительными соединениями являются соединения формулы I, где R1 представляет собой водород, и R2 представляет собой нормальный или разветвленный алкил, содержащий от 4 до 8 атомов углерода. Изобретение также охватывает следующие соединения:(3R,4R,5R)-3-аминометил-4,5-диметилоктановую кислоту,и их фармацевтически приемлемые соли. Особенно предпочтительные соединения выбраны из 3-аминометил-5-метилнонановой кислоты; 3-аминометил-5-метилдекановой кислоты; 3-аминометил-5-метилундекановой кислоты; 3-аминометил-5-метилдодекановой кислоты; 3-аминометил-5-метилтридекановой кислоты; 3-аминометил-5-циклопропилгексановой кислоты; 3-аминометил-5-циклобутилгексановой кислоты; 3-аминометил-5-трифторметилгексановой кислоты; 3-аминометил-5-(2-хлорфенил)гeксановой кислоты; 3-аминометил-5-(3-хлорфенил)гексановой кислоты; 3-аминометил-5-(4-хлорфенил)гексановой кислоты; 3-аминометил-5-(2-метоксифенил)гексановой кислоты; 3-аминометил-5-(3-метоксифенил)гексановой кислоты; 3-аминометил-5-(4-метоксифенил)гексановой кислоты; и 3-аминометил-5-(фенилметил)гексановой кислоты и их фармацевтически приемлемых солей. Другие предпочтительные соединения выбраны из(3S,5R)-3-аминометил-5-метил-7-фенилгептановой кислоты и их фармацевтически приемлемых солей. Еще одними более предпочтительными соединениями являются(3S,5S)-3-аминометил-9-фтор-5-метилнонановая кислота и их фармацевтически приемлемые соли. Изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество одного или более чем 7 одного соединения по изобретению и фармацевтически приемлемый носитель. Изобретение также относится к способу лечения эпилепсии, приступов головокружения,гипокинезии, краниальных расстройств, нейродегенеративных расстройств, депрессии, тревоги, паники, боли, невропатологических расстройств, нарушений сна, синдрома раздраженного кишечника (СРК) или желудочного нарушения, при котором млекопитающему, нуждающемуся в указанном лечении, вводят терапевтически эффективное количество соединения по изобретению. Изобретение также относится к способу лечения эпилепсии, тревоги, паники, боли, нарушений сна, синдрома раздраженного кишечника (СРК) или желудочного нарушения, при котором млекопитающему, нуждающемуся в указанном лечении, вводят терапевтически эффективное количество соединения по изобретению. Подробное описание изобретения Соединения по настоящему изобретению представляют собой одно- и двузамещенные 3 пропил-гамма-аминомасляные кислоты, как показано приведенной выше формулой I. Термины являются такими, как описано ниже, или как они встречаются в описании изобретения. Термин алкил или алкенил представляет нормальную или разветвленную группу, содержащую от 1 до 8 атомов углерода или от 2 до 8 атомов углерода, включая, но не ограничиваясь этим, метил, этил, пропил, н-пропил, изопропил,бутил, 2-бутил, тpeт-бутил и октил. Алкил может быть незамещенным или замещенным 1-3 атомами фтора. Предпочтительными группами являются метил и этил. Циклоалкил представляет собой циклическую группу, содержащую от 3 до 7 атомов углерода. Бензильные и фенильные группы могут быть незамещенными или замещенными 1-3 группами, каждая из которых независимо выбрана из галогена, особенно фтора, алкокси,алкила и амино. Галоген включает в себя фтор, хлор, бром и йод. Алкокси является таким, как описано выше для алкила. Поскольку аминокислоты являются амфотерными, фармакологически совместимые соли,когда R представляет собой водород, могут представлять собой соли подходящих неорганических или органических кислот, например,соляной, серной, фосфорной, уксусной, щавелевой, молочной, лимонной, яблочной, салициловой, малоновой, малеиновой, янтарной и аскорбиновой. Используя соответствующие исходные гидроксиды или карбонаты, образуют соли с щелочными металлами или щелочноземельными металлами, например, с натрием, 004398 8 калием, магнием или кальцием. Можно также получить соли с четвертичными аммониевыми ионами, например, с ионом тетраметиламмония. Пролекарства соединений I-VIII включены в объем настоящего изобретения. Эфиры аминоацилгликолевой и -молочной кислоты известны в качестве пролекарств аминокислот (Wermuth С.G., Chemistry and Industry, 1980: 433435). Карбонильную группу аминокислот можно этерифицировать известными способами. Пролекарства и слабые лекарства известны в данной области (Palomino E., Drugs of the Future,1990: 15 (4): 361-368). Две последние ссылки включены сюда путем ссылки. Эффективность лекарства, вводимого перорально, зависит от эффективного транспорта этого лекарства через эпителий слизистой оболочки и от его стабильности в кишечнопеченочном кровообращении. Лекарства, которые являются эффективными после парентерального введения, но менее эффективны перорально, либо лекарства, период полувыведения которых в плазме считается слишком коротким,можно модифицировать химическим путем в форму пролекарства. Пролекарство представляет собой лекарство, которое химически модифицировано и может быть биологически неактивным в месте его действия, но которое может разлагаться или модифицироваться до родоначальной биологически активной формы посредством одного или более чем одного из ферментативных или других in vivo процессов. Это химически модифицированное лекарство, или пролекарство, должно иметь фармакокинетический профиль, отличающийся от родоначального лекарства, обеспечивающий более легкое всасывание через эпителий слизистой оболочки, лучшее приготовление в виде соли и/или лучшую растворимость, улучшенную системную стабильность (например, в отношении периода полувыведения в плазме). Эти химические модификации могут представлять собой 1) производные сложные эфиры или амиды, которые могут расщепляться, например,эстеразами или липазами. В отношении производных эфиров, эфир получают путем замещения по группировке карбоновой кислоты молекулы лекарства известными способами. Что касается производных амидов, амид можно получить путем замещения по группировке карбоновой кислоты или аминной группировке молекулы лекарства с помощью известных способов; 2) пептиды, которые могут распознаваться специфичными или неспецифичными протеиназами. Пептид можно связать с молекулой лекарства посредством образования амидной связи с аминной группировкой или с группировкой карбоновой кислоты молекулы лекарства с помощью известных способов; 3) производные, которые накапливаются в месте действия благодаря мембранному отбору 9 пролекарственной формы или модифицированной пролекарственной формы; 4) любую комбинацию модификаций с 1 по 3. Текущие исследования с экспериментами на животных показали, что пероральное всасывание некоторых лекарств можно повысить путем получения слабых четвертичных солей. Такую четвертичную соль обозначают термином слабая четвертичная соль, поскольку в отличие от обычных четвертичных солей, например R-N+(СН 3)3, она может высвобождать активное лекарство при гидролизе. Слабые четвертичные соли обладают полезными физическими свойствами по сравнению с основным лекарством или его солями. Растворимость в воде может быть повышена по сравнению с другими солями, такими как гидрохлорид, однако более важным может быть повышенное всасывание этого лекарства из кишечника. Повышенное всасывание является,вероятно, следствием того факта, что слабая четвертичная соль обладает поверхностноактивными свойствами и способна к образованию мицелл и неионизированных ионных пар с желчными кислотами и т.д., которые обладают способностью более эффективно проникать через кишечный эпителий. Это пролекарство после всасывания быстро подвергается гидролизу с высвобождением активного родоначального лекарства. Некоторые из соединений по настоящему изобретению могут существовать как в несольватированных, так и в сольватированных формах, включая гидратированные формы. Как правило, сольватированные формы, включая гидратированные формы, являются эквивалентными несольватированным формам и подразумевается, что они входят в объем настоящего изобретения. Соединения по настоящему изобретению включают в себя все энантиомерные и эпимерные формы, а также соответствующие их смеси. Например, соединение примера 1 представляет собой смесь всех четырех возможных стереоизомеров. Соединение примера 6 представляет собой один из изомеров. Конфигурация углеродных центров циклогексанового кольца может быть R или S в этих соединениях, где конфигурацию можно определить. Применили анализ связывания радиоактивного лиганда, используя [3H]габапентин([3H]ГБП) и 2 субъединицу, полученную из ткани головного мозга свиньи (Gee N.S., Brown В приведенной выше табл. 1 показано сродство связывания соединений по изобретению с 2 субъединицей. Соединения по изобретению сравнивают сNeurontin, имеющимся в продаже лекарством,эффективным при лечении таких расстройств,как эпилепсия. Neurontin представляет собой 1(аминометил)-циклогексануксусную кислоту,имеющую структурную формулу В данном анализе габапентин (Neurontin) находится в количестве примерно от 0,10 до 0,12 мкМ. Следовательно, ожидается, что соединения по настоящему изобретению проявляют фармакологические свойства, сравнимые с габапентином, или лучшие, чем у габапентина,например, в качестве агентов против судорог,тревоги и боли. Настоящее изобретение также относится к терапевтическому применению соединений миметиков в качестве агентов против нейродегенеративных расстройств. Такими нейродегенеративными расстройствами являются, например, болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона и боковой амиотрофический склероз. Настоящее изобретение также охватывает лечение нейродегенеративных расстройств, обозначенных термином острая черепно-мозговая травма. Эти расстройства включают в себя, но не ограничиваются ими, удар, травму головы и асфиксию. Инсульт относится к сосудистому заболеванию головного мозга, к нему также может 11 относиться приступ ишемической болезни сердца (CVA), и он включает в себя острый тромбоэмболический инсульт. Инсульт включает в себя как фокальную, так и глобальную ишемию. Включены также преходящие нарушения мозгового кровообращения и другие сосудистые проблемы головного мозга, сопровождающиеся ишемией головного мозга; пациент,перенесший конкретно эндартерэктомию сонной артерии или другие хирургические манипуляции на сосудах головного мозга или на сосудах в целом, либо диагностические манипуляции на сосудах, включая ангиографию головного мозга и тому подобное. Другими случаями являются травма головы, травма позвоночника или повреждение вследствие общей аноксии, гипоксии, гипогликемии, гипотензии, а также подобные повреждения, наблюдаемые во время манипуляций в результате эмболии, гиперфузии и гипоксии. Настоящее изобретение полезно в ряде случаев, например, во время операции шунтирования сердца, в случаях внутричерепного кровоизлияния, при перинатальной асфиксии,при остановке сердца и при эпилептическом статусе. К боли относится как острая, так и хроническая боль. Острая боль обычно является непродолжительной и связана с гиперактивностью симпатической нервной системы. Примерами являются послеоперационная боль и аллодиния. Хроническую боль обычно определяют как боль, продолжающуюся от 3 до 6 месяцев, и включающую соматогенные боли и психогенные боли. Другая боль является ноцицептивной. Кроме того, другая боль вызвана повреждением или инфекцией периферических чувствительных нервов. Она включает в себя, но не ограничена ими, боль в результате травмы периферических нервов, инфекции вируса герпеса,сахарного диабета, каузалгии, авульсии сплетения, невромы, ампутации конечности и васкулита. Невропатическая боль также вызвана повреждением нервов вследствие хронического алкоголизма, инфекции вируса иммунодефицита человека, гипотиреоза, уремии или витаминной недостаточности. Невропатическая боль включает в себя, но не ограничена этим, боль,вызванную повреждением нервов, такую как,например, боль, которой страдают диабетики. Психогенной болью является та, которая возникает, не имея органического источника,как например боль в нижней части спины, атипическая лицевая боль и хроническая головная боль. Другими типами боли являются боль при воспалении, боль при остеоартрите, невралгия тройничного нерва, боль при раке, диабетическая невропатия, синдром усталых ног, острая герпетическая и постгерпетическая невралгия,каузалгия, авульсия плечевого сплетения, заты 004398 12 лочная невралгия, подагрическая, фантомная,ожоговая и другие формы невралгии, невропатический и идиопатический болевой синдром. Квалифицированный врач способен определить соответствующую ситуацию, когда субъекты являются склонными или имеют риск,например, удара, а также переносят удар, для введения с использованием способов по настоящему изобретению. Ожидается также, что соединения по изобретению являются полезными при лечении депрессии. Депрессия может быть результатом органического заболевания, вторичной по отношению к стрессу, связанному с утратой человека, или идиопатической по происхождению. Существует сильная тенденция семейной распространенности некоторых форм депрессии,что позволяет предположить механическую причину по меньшей мере для некоторых форм депрессии. Диагностику депрессии сначала осуществляют путем количественного определения изменений в настроении пациентов. Эти оценки настроения, как правило, проводятся врачом или количественно определяются психоневрологом с использованием признанных шкал оценок, таких как шкала Гамильтона для оценки депрессии (Hamilton Depression RatingScale) или краткой психиатрической шкалы оценок (Brief Psychiatric Rating Scale). Разработан ряд других шкал для количественного определения и измерения степени изменений настроения у пациентов с депрессией, таких как бессонница, затруднение концентрации, недостаток энергии, чувства ненужности и вины. Стандарты для диагностики депрессии, а также всех психиатрических диагнозов собраны в Diagnostic and Statistical Manual of Mental Disorders(Fourth Edition), на которое ссылаются как на руководство DSM-IV-R, опубликованное Американской Психиатрической Ассоциацией(American Psychiatric Association), 1994. ГАМК (гамма-аминомасляная кислота,GABA) представляет собой ингибиторный нейротрансмиттер центральной нервной системы. В общепринятом смысле ингибирования кажется вероятным, что ГАМК-миметики могут снижать или ингибировать функцию головного мозга и,следовательно, могут замедлять функцию и снижать настроение, приводящее к депрессии. Соединения по настоящему изобретению могут давать противосудорожный эффект посредством увеличения новой образованной ГАМК в синапсе. Если габапентин действительно повышает уровни ГАМК или эффективность ГАМК в синапсе, его можно отнести к ГАМКмиметикам, и он может снижать или ингибировать функцию головного мозга и может, следовательно, замедлять функцию и снижать настроение, приводящее к депрессии. Тот факт, что агонист ГАМК, или ГАМКмиметик, может действовать прямо противоположным образом путем повышения настроения и, таким образом, являться антидепрессантом,представляет собой новую концепцию, отличную от преобладающего прежде мнения об активности ГАМК. Ожидается, что соединения по настоящему изобретению также являются полезными при лечении тревоги и паники, как продемонстрировано с помощью стандартных фармакологических процедур. Также ожидается, что соединения по изобретению являются полезными при лечении нарушений сна. Нарушения сна представляют собой расстройства, которые влияют на способность впадать в состояние сна и/или оставаться в нем, которые сильно влияют на сон, или которые приводят в результате к аномальному поведению, связанному со сном. Эти расстройства включают в себя,например, бессонницу, связанную с лекарствами бессонницу, гиперсомнию, нарколепсию, синдромы апноэ во сне и парасомнии. Соединения по изобретению также являются полезными при лечении артрита. Биологическая активность Таблица 2 Пример(3R,4R)-3-aминометил-4,5-диметил 0,022 204 гексановая кислота 3-Аминометил-5 метилгептановая 0,092 79 кислота 3-Аминометил-50,019 НТ метилоктановая кислота 3-Аминометил-5 метилдекановая 0,150 НТ кислота 3-Аминометил-5 метилнонановая 0,178 НТ кислота 3-Аминометил-50,163 НТ метилундекановая кислота(3S,5R)-3-aминометил-5-метилгепта- Тестируется Тестируется новая кислота(3S,5S)-3-aминоТестируется Тестируется метил-5-метилнонановая кислота 3-Аминометил-5 метил-6-фенил 9,08 НТ гексановая кислота 3-Аминометил-5,7,7 триметилоктановая 10 НТ кислота(S)-3-Аминометил 5-метилоктановая 0,0126 135,38 кислота 3-Аминометил-5,70,359 НТ диметилоктановая кислота 3-Аминометил-6,6,6 трифтор-5-метил 4,69 НТ гексановая кислота 3-Аминометил-5 метил-окт-7-еновая 10 НТ кислота(S)-3-aминометил 6-метокси-5-метил- Тестируется Тестируется гексановая кислота 3-Аминометил-4 изопропилгепта 0,671 НТ новая кислота 3-Аминометил-4 изопропилокта 5,4 НТ новая кислота 3-Аминометил-40,49 НТ изопропилгексановая кислота 3-Аминометил-5 метил-4-фенилНТ гексановая кислота(S)-3-аминометил 6-фтор-5-метил 0,605 НТ гексановая кислота 3-Аминометил-5 циклогексилгекса 7,3 НТ новая кислота 3-Аминометил-510 циклопентилгексановая кислота 3-Аминометил-5 фенилгексановая 10,1 НТ кислота Соединения дозировали по 30 мг/кг перорально НТ=не тестировали Соединения по настоящему изобретению являются полезными в качестве анксиолитиков и противосудорожных средств, как показано в приведенной выше табл. 2. Их сравнивали с прегабалином, который представляет собой изобутилгамк (isobutylgaba), или (S)-3-(аминометил)-5-метилгексановую кислоту, формулы Материалы и методы Гипералгезия, индуцированная каррагенином Пороговые величины ноцицептивного давления измеряли в тесте на давление в лапах(70-90 г) тренировали на этом аппарате перед днем тестирования. Давление постепенно прилагали к задней лапе каждой крысы, и ноцицептивные пороговые величины определяли как давление (g), требующееся, чтобы вызвать отдергивание лапы. Для предупреждения какоголибо повреждения тканей лапы использовали ограничивающий предел 250 г. В день тестирования проводили от двух до трех исходных измерений до того, как животным вводили 100 мкл 2% каррагенина посредством внутриподошвенной инъекции в правую заднюю лапу. Ноцицептивные пороговые величины снова снимали через 3 ч после каррагенина, чтобы установить, что животные проявляют гипералгезию. Животным давали дозы либо габапентина (3-300 мг, подкожно), морфина (3 мг/кг, подкожно), либо физиологического раствора через 3,5 ч после каррагенина, и проверяли ноцицептивные пороговые величины через 4, 4,5 и 5 ч после каррагенина. На описанной выше модели индуцированной каррагенином гипералгезии тестировали(R)-2-азаспиро[4,5]декан-4-карбоновой кислоты гидрохлорид. Это соединение перорально давали дозами в количестве 30 мг/кг, и через 1 ч после введения доз получали процент от максимально возможного эффекта (МВЭ), составляющий 53%. Через 2 ч после введения доз он составлял только 4,6% МВЭ. Тонические припадки, индуцированные семикарбазидом Тонические припадки у мышей индуцируют подкожным введением семикарбазида (750 мг/кг). Отмечают латентность тонического распрямления передних лап. Любых мышей, у которых нет судорог в течение 2 ч после семикарбазида, считают предохраненными и дают им максимальную оценку латентности 120 мин. Животные Самцов крыс Hooded Lister (200-250 г) получают от Interfauna (Huntington, UK), а самцов мышей ТО (20-25 г) получают от Bantjn andKingman (Hull, UK). Оба вида грызунов содержат группами по 6 штук. 10 обыкновенных игрунок (Callithrix Jacchus) массой от 280 до 360 г,выращенных на медицинском факультете Манчестерского университета (Manchester UniversityMedical School, Manchester, UK), содержат парами. Всех животных содержат при 12-часовом цикле чередования света и темноты (свет включают в 07.00 часов) и свободном доступе к пище и воде. 16 Введение лекарств Лекарства вводят либо внутрибрюшинно(IP), либо подкожно (SC) за 40 мин до тестирования в объеме 1 мл/кг для крыс и игрунок и 10 мл/кг для мышей. Свето-теневая камера для мышей Аппарат представляет собой камеру с открытым верхом, длиной 45 см, шириной 27 см и высотой 27 см, разделенную на малую (2/5) и большую (3/5) области перегородкой, которая продолжается на 20 см выше стенок (Costall В.Biochem. Behav., 1989; 32: 777-785). В центре перегородки на уровне пола находится отверстие 7,5 х 7,5 см. Малое отделение окрашено в черный цвет, а большое отделение окрашено в белый цвет. Белое отделение освещают 60 Вт вольфрамовой лампой. Каждую мышь тестируют, помещая ее в центр белой области и давая ей возможность освоить новую окружающую среду в течение 5 мин. Измеряют время, проведенное на освещенной сторонеmodel of anxiety in mice, Neuropharmacol., 1989; 28: 901-905). Каскадный Х-образный лабиринт для крыс Стандартный каскадный Х-образный лабиринт (Handley S. L. Et al., Effects of alphaadrenoceptor agonists and antagonists in a mazeexploration model of 'fear'-motivated behavior,Naunyn-Schiedeberg's Arch. Pharmacol., 1984; 327: 1-5) автоматизировали, как описано ранее(Suppl.): 304P). Животных помещают в центр Хобразного лабиринта лицом к одному из открытых рукавов. Для определения анксиолитических эффектов заходы и время, проведенное в концевых половинных секциях открытых рукавов, измеряют в течение 5-минутного периода тестирования (Costall et al., Use of the elevatedplus maze to assess anxiolytic potential in the rat,Br. J. Pharmacol., 1989; 96 (Suppl.): 312P). Тест на угрозу от человека у игрунок Общее число положений тела, демонстрируемых животным по отношению к угрожающему стимулу (человек, стоящий на расстоянии примерно 0,5 м от клетки с игрунками и пристально смотрящий в глаза игрунке), регистрируют в течение 2-минутного периода тестирования. Оцениваемыми положениями тела являются прищуренные пристальные взгляды, положения хвоста, запаховое мечение клетки/жердочек, пилоэрекция, отступления и выгибание спины. Каждое животное подвергают угрожающему стимулу дважды в день тестирования, до и после лечения лекарством. Разницу между этими двумя оценками анализируют,используя односторонний дисперсионный анализ с последующим t-тестом Даннета. Все лече 17 ния лекарством проводят подкожно (SC) по меньшей мере через 2 ч после первой (контрольной) угрозы. Время предварительного лечения для каждого соединения составляет 40 мин. Конфликтный тест для крыс Крыс в рабочих камерах тренируют нажимать на рычаг с получением пищевого подкрепления. Режим состоит из чередований четырех 4-минутных безнаказанных периодов в переменном интервале в 30 с, сигнализируемых включением света в камерах, и трех 3-минутных периодов с наказанием с фиксированным соотношением 5 (электрическим ударом стопы, сопутствующим подаче пищи), сигнализируемых выключением света в камере. Степень электрического удара стопы регулируют для каждой крысы, чтобы получить подавление ответа примерно от 80 до 90% по сравнению с безнаказанным ответом. В дни тренировки крысы получают носитель - физиологический раствор. Модель противосудорожной эффективности на мышах DBA2 Все процедуры осуществляли с соответствии с Руководством по содержанию и использованию лабораторных животных NIH (NIH Guidefor the Care and Use of Laboratory Animals) по протоколу, одобренному Комитетом ПаркДэвиса по использованию животных (ParkeDavis Animal Use Committee). Самцов мышейJackson Laboratories, Bar Harbour, Maine. Непосредственно перед противосудорожным тестированием мышей помещали на проволочную сетку площадью 25 см 2 (4 кв.дюйма), подвешенную на стальном стержне. Эту площадку медленно переворачивали на 180 С и наблюдали мышей в течение 30 с. Любую мышь, проваливающуюся сквозь проволочную сетку, оценивали как атаксическую (Coughenour L.L.,McLean J.R., Parker R.B. A new device for themice, Pharm. Biochem. Behav., 1977; 6(3): 3513). Мышей помещали в закрытую акриловую пластмассовую камеру (21 см высотой, примерно 30 см в диаметре) с высокочастотным динамиком (4 см в диаметре) в центре верхней крышки. Генератор звукового сигнала (модельProtek B-810) использовали, чтобы производить непрерывный синусоидальный тон, частота которого нарастала линейно от 8 до 16 кГц один раз каждые 10 мс. Средний уровень звукового давления (УЗД) во время стимуляции составлял примерно 100 дБ на полу камеры. Мышей помещали внутрь этой камеры и давали им возможность привыкнуть к обстановке в течение 1 мин. Мыши DBA/2 в группе, которую лечили носителем, отвечали на звуковые стимулы (прилагаемые до тех пор, пока не происходило тоническое выпрямление, либо в течение максимум 60 с) характерной последовательностью припадков, состоящей из пугливого бега с по 004398 18 следующими клоническими припадками, а затем с тоническим выпрямлением, и, наконец, с последующей остановкой дыхания и гибелью 80% или более мышей. У мышей, которых лечили носителем, полная последовательность припадков вплоть до остановки дыхания длится примерно от 15 до 20 с. Регистрировали встречаемость для всех фаз припадка у мышей, которых лечили лекарством и которых лечили носителем, и использовали появление тонических припадков для вычисления значений противосудорожных ED50 с помощью пробит-анализаfor evaluating dose-effect experiments, J. Pharmacol., 1949; 96: 99-113). Для тестирования каждого значения дозы мышей использовали только 1 раз. Группы мышей DBA/2 (n=5-10 на дозу) тестировали на индуцированные звуком припадочные ответы через 2 ч (предварительно определенное время пика эффекта) после того, как лекарства дали перорально. Все лекарства в настоящем исследовании растворяли в дистиллированной воде и давали перорально принудительным образом через зонд в объеме 10 мл/кг массы тела. Соединения, которые являются нерастворимыми, следует суспендировать в 1% карбоксиметилцеллюлозе. Дозы выражают как массу группировки активного лекарства. Ожидается также, что соединения по настоящему изобретению являются полезными при лечении боли и фобических расстройств(Am. J. Pain Manag., 1995; 5: 7-9). Также ожидается, что соединения по настоящему изобретению будут полезны при лечении симптомов маниакальной, острой или хронической, единичной верхней или рекуррентной депрессии. Ожидается также, что они полезны при лечении и/или предупреждении биполярного расстройства (патент США 5510381). Также ожидается, что соединения по изобретению являются полезными при нарушениях сна. Оценка описана в Drug Dev. Res. 1988; 14: 151-159. Соединения по настоящему изобретению можно приготавливать и вводить в широком ряде пероральных и парентеральных лекарственных форм. Так, соединения по настоящему изобретению можно вводить путем инъекции,то есть внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально или внутрибрюшинно. Также соединения по настоящему изобретению можно вводить путем ингаляции,например интраназально. Кроме того, соединения по настоящему изобретению можно вводить чрескожно. Специалистам в данной области техники будет очевидно, что следующие лекарственные формы могут содержать в качестве активного компонента либо соединение формулы I, либо соответствующую фармацевтически приемлемую соль соединения формулы I. 19 Для приготовления фармацевтических композиций из соединений по настоящему изобретению фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты в виде твердых форм включают в себя порошки, таблетки, пилюли, капсулы,крахмальные облатки, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или более чем одно из веществ, которые могут действовать в качестве разбавителей, корригентов, связывающих агентов, консервантов, агентов, разрыхляющих таблетки, либо инкапсулирующего материала. В порошках носитель представляет собой тонко измельченное твердое вещество, которое находится в смеси с тонко измельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связывающими свойствами, в подходящих соотношениях, и спрессован в желаемой форме с желаемым размером. Порошки и таблетки предпочтительно содержат от 5-10 до примерно 70% активного соединения. Подходящими носителями являются карбонат магния, стеарат магния, тальк, сахар,лактоза, пектин, декстрин, крахмал, желатин,трагакант, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, легкоплавкий воск, масло какао и тому подобное. Имеется в виду, что термин препарат включает в себя препарат активного соединения с инкапсулирующим материалом в качестве носителя, обеспечивающего капсулу, в которой активный компонент, с другими носителями или без них, окружен носителем, который, таким образом, находится в ассоциации с ним. Подобным образом включены крахмальные облатки и лепешки. Таблетки, порошки,капсулы, пилюли, крахмальные облатки и лепешки можно применять как твердые лекарственные формы, подходящие для перорального введения. Для приготовления суппозиториев легкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, сначала плавят, и активное соединение диспергируют в нем до гомогенности, например, путем перемешивания. Затем расплавленную гомогенную смесь выливают в формы подходящего размера, дают охладиться и, таким образом, затвердеть. Препараты в виде жидких форм включают в себя растворы, суспензии и эмульсии, например водные или водно-пропиленгликолевые растворы. Для парентеральных инъекций жидкие препараты можно приготовить в растворе в водном полиэтиленгликолевом растворе. Водные растворы, подходящие для перорального применения, можно приготовить путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загустителей, сколько требуется. 20 Водные суспензии, подходящие для перорального применения, можно производить путем диспергирования тонко измельченного активного компонента в воде с вязким материалом, таким как натуральные или синтетические камеди, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другие известные суспендирующие агенты. Включены также препараты в виде твердых форм, которые предназначены для превращения непосредственно перед применением в препараты в виде жидких форм для перорального введения. Такие жидкие формы включают в себя растворы, суспензии и эмульсии. Эти препараты могут содержать, в дополнение к активному компоненту, красители, корригенты, стабилизаторы, буферы, синтетические и натуральные подсластители, диспергирующие агенты, загустители, солюбилизирующие агенты и тому подобное. Фармацевтический препарат предпочтительно находится в стандартной лекарственной форме. В такой форме этот препарат подразделен на стандартные дозы, содержащие подходящие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, причем упаковка содержит дискретные количества препарата, как, например, упакованные таблетки,капсулы и порошки во флаконах или ампулах. Также стандартная лекарственная форма может представлять собой капсулу, таблетку, крахмальную облатку или лепешку саму по себе,либо она может представлять собой соответствующее число любой из них в упакованной форме. Количество активного компонента в препарате стандартной дозы можно варьировать или регулировать в пределах от 0,1 мг до 1 г в соответствии с конкретным применением и эффективностью активного компонента. При применении в консервативном лечении лекарство можно вводить 3 раза в сутки, как, например, в капсулах по 100 или 300 мг. Композиция также может содержать, если требуется, другие совместимые терапевтические агенты. При терапевтическом применении соединения, используемые в фармацевтическом способе по данному изобретению, вводят в начальной дозировке от примерно 0,01 мг до примерно 100 мг/кг в сутки. Диапазон суточной дозы, составляющий от примерно 0,01 мг до примерно 100 мг/кг, является предпочтительным. Дозировки, однако, можно варьировать в зависимости от потребностей пациента, тяжести состояния, которое лечат, и от применяемого соединения. Определение правильной дозировки для конкретной ситуации находится в компетенции специалиста в данной области. Как правило,лечение начинают меньшими дозировками, которые меньше, чем оптимальная доза соединения. После этого дозировку увеличивают не 21 большими приращениями, пока не будет достигнут оптимальный эффект при данных обстоятельствах. Для удобства, если желательно,суммарную суточную дозировку можно разделить и вводить порциями в течение суток. Следующие примеры являются иллюстративными для настоящего изобретения; подразумевается, что они не ограничивают его объем. Общие схемы синтеза Общее описание Способ 1.X=OEt или хиральная оксазолидиновая вспомогательная группа.g) I. H2 Pd/C; II. HCl; III. ионообменная хроматография. Конкретные примеры Синтез примера 1. 3-Аминометил-5-метилгептановая кислота.e) 6 н. HCl, кипячение с обратным холодильником, ионообменная смола (Dowex 50WX8, сильнокислотная). 3-Метил-1-пентаналь 11. К перемешанной суспензии пиридиния дихромата (112,17 г, 298,1 ммоль) в дихлорметане 500 мл добавляли 3-метил-1-пентанол 10 (15 г,146,79 ммоль). После перемешивания в течение 2,5 ч добавляли 400 мл диэтилового эфира, и перемешивание продолжали еще в течение 5 мин. Фильтрат этой смеси концентрировали до небольшого объема и наносили на колонку Florisil. Соединение элюировали петролейным эфиром и затем подвергали хроматографии на колонке с силикагелем, используя 10% диэтиловый эфир в петролейном эфире в качестве элюента, с получением 11 (6,5 г, 44%). 1 Н-ЯМР (CDCl3)9,72 (d, -СНО), 2,38 (dd,1H, -CH2CHO), 2,19 (dd, 1H, -СН 2 СНО), 1,95 (m,1H, С 2 Н 5(СН 3)СНСН 2-), 1,4-1,0 (m), 0,9-0,8 (m). Этил-5-метил-2-гептеноат 12. Гидрид натрия (60% дисперсия, 2,4 г, 65 ммоль) промывали гексаном и суспендировали в 60 мл диметоксиэтане. Во время охлаждения в ледяной водяной бане медленно добавляли триэтилфосфоноацетат, примерно 5 мин. Эту реакционную смесь перемешивали в течение 15 мин при 0 С и добавляли раствор 3-метил-1 пентаналя 11 (6,5 г, 65 ммоль) в диметоксиэтане 20 мл. После кипячения с обратным холодильником в течение ночи смесь концентрировали,добавляли воду и гексан, органическую фазу отделяли, а водную часть отбрасывали. Этот раствор дважды промывали рассолом и высушивали над сульфатом магния. Растворитель выпаривали с получением 12 (6,75 г, 61%).(21,97 г, 359,9 ммоль) в ацетонитриле 80 мл перемешивали при комнатной температуре в атмосфере азота в течение ночи. Эту смесь концентрировали до масла. Раствор этого масла в диэтиловом эфире промывали 1 н. HCl, рассолом и высушивали. Полученное выпаривали с получением светлого масла, которое подвергали хроматографии на силикагеле, элюируя 5-10% диэтиловым эфиром в петролейном (Pet.) эфире с получением 13 (3,6 г, 42%). 1 Н-ЯМР (CDCl3)4,49-4,39 (m), 4,12-4,07(3,6 г) гидрировали в этаноле в присутствии 20% Pd/C и выпаривали с получением 14. Добавляли шестинормальную соляную кислоту 30 мл и кипятили с обратным холодильником в течение ночи. Растворитель выпаривали при пониженном давлении и получали азеотропную смесь остатка с толуолом. Водный раствор остатка наносили на ионообменную смолу Dowex 50WX 8-100, которая была промыта до нейтрального рН водой со степенью очистки, подходящей для ВЭЖХ. Колонку элюировали водой до тех пор, пока рН элюента не становился нейтральным, а затем 0,5 н. раствором NH4OH с получением фракций,содержащих 3 аминометил-5-метилгептановую кислоту. Фракции объединяли и затем подвергали хроматографии на колонке С 18. Соединение элюировали 40% водой в метаноле и кристаллизовали из смеси метанолдиэтиловый эфир с получением 630 мг примера 1. 1H-ЯМР (CD3OD)2,83 (m, 1 Н), 2,75 (m,1H), 2,35 (m, 1 Н), 2,15 (m, 1H), 1,95 (1H, bs),1,38 (1H, m), 1,3-1,15 (m, 2H), 1,14-0,95 (m, 2H),0,80 (m, 2 СН 3). МС (массспектрометрия) обнаружен молекулярный ион при (М+1) 174 и другие ионы при 156, 139 и 102. Аналитически вычислено для С 9 Н 19NО 2: С, 62,39; Н, 11,05; N,8,08. Обнаружено: С, 62,00; Н, 10,83; N, 7,98. Подобным способом можно получить следующие примеры: 3-аминометил-5-метилгептановая кислота; 3-аминометил-5-метилоктановая кислота; 3-аминометил-5-метилнонановая кислота; 3-аминометил-5-метилдекановая кислота; 3-аминометил-5-метилундекановая кислота; 3-аминометил-5-метилдодекановая кислота; 3-аминометил-5-метилтридекановая кислота;(200 мл) при -20 С. Через 1 ч добавляли хлорид лития (2,35 г, 0,55 моль) и (R)-(-)-4-фенил-2 оксазолидинон (8,15 г, 0,05 моль), и эту густую суспензию нагревали до комнатной температуры. Через 20 ч эту суспензию фильтровали и фильтрат концентрировали. Полученное в результате твердое вещество перекристаллизовывали из смеси гексан/этилацетат (5:1) с получением оксазолидинона 16 в виде белого твердого вещества (8,83 г, 68%). 1H-ЯМР (СDСl3)7,35(3R,3R)-3-(3,4-Диметилпентаноил)-4-фенилоксазолидин-2-он 17. К комплексу бромид меди (I) - диметилсульфид в THF (45 мл) при -20 С добавляли метилмагнийхлорид (в виде 3 М раствора вTHF). Через 20 мин добавляли оксазолидинон 16 (3,69 г, 0,014 моль) в THF (20 мл) по каплям в течение 10 мин. Через 2,5 ч эту реакционную смесь гасили путем добавления насыщенного водного раствора хлорида аммония. Полученные в результате два слоя разделяли, и водный слой экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали 1 М соляной кислотой, затем 5% водным гидроксидом аммония. Органические фазы высушивали(MgSO4) и концентрировали с получением оксазолидинона 17 в виде белого твердого вещества(относительная интенсивность): 276 [М+Н,100%]. тpeт-Бутиловый эфир [3R-(3R(R),4S)]4,5-диметил-3-(2-оксо-4-фенилоксазолидин-3 карбонил)гексановой кислоты 18. Бис(триметилсилил)амид натрия (14,4 мл,0,014 моль 1 М раствора в THF) добавляли к раствору оксазолидинона 17 (3,37 г, 0,012 моль) в THF (35 мл) при -78 С. Через 35 мин добавляли тpeт-бутилбромацетат (3,5 г, 0,018 моль), и раствор немедленно нагревали до -40 С. Через 3 26 ч эту реакцию останавливали путем добавления насыщенного водного раствора хлорида аммония. Полученные в результате два слоя разделяли и водный слой экстрагировали диэтиловым эфиром. Объединенные органические фазы высушивали (MgSO4) и концентрировали. Флэшхроматографией(3,81 г, 82%) в виде белого твердого вещества. 1(s, 9H), 1,02 (d, 1H, J=6,5 Гц), 0,93 (d, 1H, J=6,7 Гц), 0,80 (d, 1H, J=7,0 Гц). МС, m/z (относительная интенсивность): 429 [М-Н+СН 3 СN, 100%],388 [М-Н, 20%]. 4-трет-Бутиловый эфир (3R,4S)-2-(1,2 диметилпропил)янтарной кислоты 19. К оксазолидинону 18 (3,62 г, 9,3 ммоль) в смеси THF (54 мл)/вода (15 мл) добавляли предварительно смешанные раствор гидроксида лития (20 мл в 0,8 М водном растворе, 0,016 моль)/Н 2O2 (5,76 мл 30% водного раствора). Через 7 ч раствор разбавили водой и добавили бисульфит натрия (10 г). После перемешивания в течение дополнительных 0,5 ч два слоя разделяли и водную фазу экстрагировали диэтиловым эфиром. Затем водную фазу делали кислой(рН 2) с помощью 1 М соляной кислоты и экстрагировали диэтиловым эфиром. Объединенные органические фазы высушивали (MgSO4) и концентрировали. Флэш-хроматографией (гексан/этилацетат 5:1) получили кислоту 19 (2,1 г,95%) в виде бесцветного масла. 1 Н-ЯМР (CDCl3)3,0 (m, 1H), 2,55 (dd, 1H, J=16,6 и 11,2 Гц),2,27 (dd, 1H, J=16,6 и 3,4 Гц), 1,70 (m, 1H), 1,53(m, 1H), 1,45 (m, 1H), 1,43 (s, 9H), 0,95 (d, 1H,J=6,8 Гц), 0,90 (d, 1H, J=6,6 Гц), 0,83 (d, 1H,J=6,8 Гц). МС, m/z (относительная интенсивность): 243 [М-Н, 100%]. тpeт-Бутиловый эфир (3R,4S)-3-гидроксиметил-4,5-диметилгексановой кислоты 20. Комплекс боранметилсульфид (16 мл,0,032 моль 2 М раствора в THF) добавляли к перемешиваемому раствору кислоты 19 (1,96 г, 8 ммоль) в THF (20 мл) при 0 С. Через 20 ч добавляли метанол до тех пор, пока не прекращалось выделение пузырьков газа, и раствор концентрировали. Флэш-хроматографией (градиент смеси гексан/этилацетат 5:1) получили спирт 20 27 Хлорангидрид пара-толуолсульфоновой кислоты (847 мг, 4,4 ммоль) добавляли к перемешиваемому раствору спирта 6 (850 мг, 3,7 ммоль), 4-диметиламинопиридина (DMAP) (10 мг, 0,08 ммоль) и триэтиламина (1,23 мл, 8,88 ммоль) в CH2Cl2 (20 мл) при 0 С, и раствор нагревали до комнатной температуры. Через 15 ч этот раствор промывали 1 н. соляной кислотой,затем рассолом. Объединенные органические фазы высушивали (MgSO4) и концентрировали. Флэш-хроматографией (градиент смеси гексан/этилацетат от 100 до 92%) получили тозилат 21 (1,22 г, 86%) в виде густой смолы. 1 Н-ЯМР(3R,4S)-3 азидометил-4,5-диметилгексановой кислоты 22. Раствор тозилата 21 (1,19 г, 3,1 ммоль) и азида натрия (402 мг, 6,2 ммоль) в ДМСО (15 мл) нагревали до 60 С в течение 2,5 ч. Добавляли воду (100 мл), и этот раствор экстрагировали эфиром. Объединенные органические фазы высушивали (MgSO4) и концентрировали. Флэшхроматографией (гексан/этилацетат 9:1) получили азид 22 (628 мг, 80%) в виде бесцветного масла. 1 Н-ЯМР (CDCl3)3,4 (dd, 1H, J=12,21 и 6,11 Гц), 3,3 (dd, 1H, J=21,11 и 6,59 Гц), 2,30 (dd,1H, J=15,14 и 3,66 Гц), 2,25 (m, 1H), 2,05 (dd,1H, J=15,14 и 9,04 Гц), 1,55 (m, 1H), 1,45 (s, 9 Н),1,35 (m, 1H), 0,95 (d, 1H, J=6,59 Гц), 0,90 (d, 1H,J=6,83 Гц), 0,80 (d, 1H, J=7,08 Гц). МС, m/z (относительная интенсивность); 228 [M-N2, 35%],172 [M-N2-тpeт-Bu, 100%]. тpeт-Бутиловый эфир (3R,4S)-3-аминометил-4,5-диметилгексановой кислоты 23 и [4R[4R(S)-4-(1,2-диметилпропил)пирролидин-2 он 24. Азид 22 (640 мг, 2,5 ммоль) и никель Ренея(1 г) в метаноле (50 мл) встряхивали в атмосфере водорода в течение 4 ч. Этот раствор фильтровали, и фильтрат концентрировали с получением смеси амина 23 и лактама 24, которую использовали без дальнейшей очистки на следующей стадии.(3R,4S-3-aминометил-4,5-диметилгексановая кислота (пример 2). Раствор амина 23 и лактама 24 (500 мг) в 3 М соляной кислоте нагревали до температуры дефлегмации в течение 9 ч, затем перемешивали при комнатной температуре в течение 15 ч. Этот раствор концентрировали, и полученное в результате твердое вещество подвергали последовательной очистке, включающей в себя ионообменную хроматографию (Dowex 50WX8, сильнокислотная), образование соли оксалата, затем 28 дальнейшую очистку ионообменной хроматографией (Dowex 50WX8, сильнокислотная) с получением примера 2 (343 мг) в виде белого твердого вещества. 1H-ЯМР (D2O)2,87 (m,2 Н), 2,22 (dd, 1H, J=15,4 и 3,4 Гц), 2,12 (m, 1H),1,93 (dd, 1H, J=15,4 и 9,5 Гц), 1,38 (m, 1H), 1,12(m, 1H), 0,77 (d, 1H, J=6,6 Гц), 0,74 (d, 1H,J=6,6 Гц), 0,70 (d, 1H, J=6,8 Гц). МС, m/z (относительная интенсивность): 174 [М+Н, 100%]. Подобным способом можно получить следующие примеры: 3-аминометил-4,5-диметилгексановая кислота;n=0-2 Соединение, имеющее структуру 30, можно получить из соединения, имеющего структуру 29, обработкой водной кислотой, такой как соляная кислота и подобные, при температуре между комнатной температурой и температурой дефлегмации. В качестве альтернативы соединение, имеющее структуру 30, можно получить 29 из соединения, имеющего структуру 32, обработкой трифторуксусной кислотой в растворителе, таком как СН 2 Сl2 или ЕtOАс и подобные. Соединение 32 можно получить опосредованным основанием гидролизом Вос-защищенного лактама, такого как соединение 31, которое само можно получить из соединения, имеющего структуру 29, обработкой ди-трет-бутилбикарбонатом в растворителе, таком как THF и подобные. Обработка Вос-лактама 31 водным гидроксидом натрия, например, будет давать кислоту 32. Соединение, имеющее структуру 29, можно получить из соединения, имеющего структуру 28 (n=0), обработкой металлическим натрием или литием в аммиаке. Предпочтительно эту реакцию проводят с металлическим натрием в аммиаке. Альтернативно, соединение, имеющее структуру 29, можно получить из соединения,имеющего структуру 28 (n=1 или 2), обработкой церийаммонийнитратом в смеси ацетонитрила и воды. Другие известные из литературы способы удаления замещенных алкоксибензильных групп с атома азота описаны в Green, ProtectiveGroups in Organic Synthesis, Wiley, 2nd ed., 1991,и могут быть использованы. Соединение, имеющее структуру 28, можно получить из соединения, имеющего структуру 27 (где LG представляет собой подходящую уходящую группу, такую как галогенид или алкилсульфонат, предпочтительно следует использовать йодид) с помощью реакций образования связи углерод-углерод, известных в данной области техники. В литературе встречается несколько способов связывания органогалогенидов или органоалкилсульфонатов с металлорганическими реагентами в присутствии различных солей металлов, как суммировано вComprehensive Organic Synthesis, volume 3: 413,которые могут быть использованы. Например,соединение, имеющее структуру 28, можно получить из соединения, имеющего структуру 27(где LG представляет собой йодид), обработкой подходящим вторичным галогенидом (хлоридом или йодидом) в присутствии металлического магния, йода и медь бромид дисульфида в растворителе, таком как тетрагидрофуран и подобные. Альтернативно можно использовать способ согласно Е.I. Marini, Synthesis, 1992: 1104. Следовательно, соединение, имеющее структуру 28, можно получить из соединения,имеющего структуру 27 (где LG представляет собой йодид), обработкой подходящим метилзамещенным вторичным галогенидом, таким как йодид, в присутствии магния, йода и тетрахлорокупрата лития в растворителе, таком как тетрагидрофуран и подобные. Соединение, имеющее структуру 27,включает подходящую уходящую группу, которая могла бы подвергнуться нуклеофильному замещению подходящим нуклеофилом. Примеры таких уходящих групп включают в себя га 004398LG=йодид), можно получить из соединения,имеющего структуру 26, посредством обработки йодом, трифенилфосфином и имидазолом в растворителе, таком как толуол и подобные. Соединение, имеющее структуру 26, можно получить из соединения, имеющего структуру 25, обработкой борогидридом металла, таким как борогидрид натрия, в растворителе, таком как тетрагидрофуран или диметиловый эфирMed. Chem., 1990; 33: 71-77, используя подходящий бензиламин, такой как, но не ограниваясь ими, бензиламин, 4-метоксибензиламин или 2,4-диметоксибензиламин. В качестве альтернативного подхода соединение, имеющее структуру 26, можно обработать металлическим натрием и аммиаком с получением 4-гидроксиметилпирролидинона,который можно йодировать с получением 4 йодметилпирролидинона. Затем 4-йодметилпирролидинон можно связать с металлорганическими реагентами согласно вышеописанным методикам, избегая защиты атома азота лактама, как показано ниже. Аналогично вышеописанным способам можно использовать лактам, имеющий структуру 33, (см. Nielsen et al., J. Med. Chem., 1990; 33: 71-77 для общего способа получения), устанавливая таким образом фиксированную стереохимию у С 3 конечных аминокислот. Соединения, которые можно получить данным способом, включают в себя 3-аминометил-5-метил-6-фенилгексановую кислоту; 3-аминометил-6-(4-хлорфенил)-5-метилгексановую кислоту; 3-аминометил-6-(3-хлорфенил)-5-метилгексановую кислоту; 3-аминометил-6-(2-хлорфенил)-5-метилгексановую кислоту; 3-аминометил-6-(4-фторфенил)-5-метилгексановую кислоту; 3-аминометил-6-(3-фторфенил)-5-метилгексановую кислоту; 34 Соединение структуры 40 можно получить из соединения структуры 39 посредством обработки диэтиламиносеры трифторидом в растворителе, таком как метиленхлорид, при температуре между -78 С и комнатной температурой. Известны другие способы фторирования спиртов, и их можно использовать, как проиллюстрировано в Wilkinson, Chem. Rev. 1992; 92: 505519. Соединения структуры 40 можно превратить в необходимую -аминокислоту, как описано в приведенном выше способе 3. Соединение структуры 39 можно получить из соединения структуры 38 посредством обработки тетроксидом осмия и периодатом натрия в растворителе, таком как THF и вода, и восстановлением полученного в результате промежуточного соединения борогидридом натрия в растворителе, таком как этанол. Соединения, имеющие структуры 38 и 34,можно получить из соединения структуры 33 в соответствии с принципами, описанными в способе 3. Альтернативная методика синтеза спирта 39 (n=0) включает в себя обработку соединения структуры 36 борогидридом металла, таким как борогидрид натрия, в растворителе, таком как тетрагидрофуран или DME и подобные, с получением соединения структуры 37, фторирование которого можно осуществить способом, подобным получению соединения структуры 40. Соединение структуры 36 можно получить из соединения структуры 35 посредством обработки хлоридом натрия или лития в водном ДМСО при температуре между комнатной температурой и температурой дефлегмации. Предпочтительно эту реакцию проводят, используя хлорид натрия в водном ДМСО при кипячении с обратным холодильником. Соединение структуры 35 можно получить из соединения структуры 34 посредством обработки подходящим диэфиром метилмалоновой кислоты, таким как диметилметилмалонат и подобные, с гидридом натрия в растворителе, таком как ДМСО или THF и подобные. Предпочтительно эту реакцию проводят путем добавления NaH к раствору диметилметилмалоната в ДМСО с последующим добавлением лактама 34 (где LG предпочтительно представляет собой йодид или является такой,как определено в способе 3), предварительно растворенного в ДМСО. Соединения 39 и 37 можно превратить в свободные аминокислоты, несущие гидроксильную группу, с помощью способов, описанных выше. Данным способом можно получить следующие соединения: Соединение структуры 41 можно получить из соединения структуры 39 посредством обработки подходящим алкилйодидом (или алкилсульфонатом), таким как метилйодид и подобные, и основанием, таким как н-бутиллитий или гидрид натрия и подобные, в растворителе, таком как ДМСО или THF и подобные. Предпочтительно эту реакцию проводят путем добавления NaH к раствору спирта в ДМСО с последующим добавлением алкилйодида и нагреванием этой реакционной смеси при температуре между комнатной температурой и температурой дефлегмации. Превращение соединений структуры 41 в -аминокислоты было описано выше. Альтернативно соединения структуры 41 можно получить из соединений структуры 42(где LG=йодид, бромид или эфир сульфоновой кислоты, как проиллюстрировано в способе 3) обработкой подходящего алкоксианиона в растворителе, таком как ДМСО или THF и подобные. Соединение структуры 42 будет также служить в качестве субстрата в процедурах образования связи углерод-углерод, как вкратце описано в способе 3. Соединения, которые можно получить данным способом, включают в себя Соединения структуры 53 можно получить из соединения структуры 45, как показано выше, а также с помощью общих методик, описанных в Hoekstra et al., Organic Process Researchand Development, 1997; 1: 26-38. Соединения структуры 45 можно получить из соединений структуры 44 обработкой раствором триоксида хрома в смеси вода/серная кислота. Можно применять альтернативные способы расщепления олефина в 44, как подробно описано в Hudlicky, Oxidations in Organic(S)цитронеллилбромида с помощью реакций образования связи углерод-углерод, известных в данной области техники, а также, как описано в способе 3. Замещение галогенида в (S)цитронеллилбромиде алкоксианионами также можно использовать для получения соединений структуры 44, где R=алкокси- или феноксиэфиры (и их подходящие замещения в соответствии с формулой I). Альтернативно (S) 37 цитронеллол можно использовать для получения соединений структуры 44 обработкой (S)цитронеллола основанием, таким как гидрид натрия, и обработкой полученного в результате алкоголята подходящим алкилгалогенидом с получением простых эфиров. В другом способе(S)-цитронеллилбромид (или подходящий эфир сульфоновой кислоты, такой как, но не ограничиваясь этим, (S)-3,7-диметил-окт-6-ениловый эфир метансульфоновой кислоты) можно восстановить подходящим борогидридом металла или разновидностями гидрида алюминия, такими как LAH (алюмогидрид лития), с получением (R)-2,6-диметил-окт-2-ена. Специалисту в данной области будет понятно, что рациональный выбор либо R- или Sцитронеллола,либоSцитронеллилбромида будет давать требуемый изомер по С 5 конечной аминокислоты. Соединения, которые можно получить данным способом, включают в себя Соединение структуры 58 можно получить из соединения структуры 57 обработкой эфиратом трифторида бора и триэтилсиланом в растворителе, таком как СН 2 Сl2. Альтернативно способ, описанный в Meyers, J. Org. Chem.,1993; 58: 36-42, можно использовать, обрабатывая, таким образом, соединение структуры 57 цианоборогидридом натрия в растворителе, таком как смесь THF/метанол, с 3% HCl в метаноле. Соединение структуры 57 можно получить из соединения структуры 56 обработкой диметиламином в растворителе, таком как ДМФ и подобные, согласно методике Koot, TetrahedronLett., 1992; 33: 7969-7972. Соединение структуры 56 можно получить из соединения структуры 54 обработкой подходящего первичного галогенида 55 (йодида, бромида или хлорида) в стандартных условиях переметалирования тpeт-BuLi и обработкой полученного в результате металлорганического реагента подходящей солью меди, такой как, но не ограниваясь ими, бромид меди или йодид меди. Полученный в результате органокупрат добавляют к лактаму (см. Koot et al., J. Org. Chem.,1992; 57: 1059-1061 для получения хирального лактама 54) в растворителе, таком как THF и подобные. Пример данного способа представляет собой методика Koot, Tetrahedron Lett., 1992; 33: 7969-7972. Специалисту в данной области техники будет понятно, что рациональный выбор либоR-, либо S-первичных галогенидов будет давать требуемый изомер по атому С 5 конечной аминокислоты. Соединения, которые можно получить данным способом, включают в себя Соединение структуры 60 можно получить из соединения структуры 59 посредством обработки подходящим образом замещенного фенола (включая сам фенол) в условиях, описанных в Mitsunobu, Synthesis, 1981: 1. Соединение структуры 59 можно получить из соединения структуры 39 посредством обработки металлическим натрием или литием и подобным в аммиаке. Предпочтительно, реакцию осуществляют с помощью металлического натрия в аммиаке. Прямой гидролиз соединения 60 будет давать желаемую аминокислоту, либо можно использовать подход, применяющий гидролиз Вос-защищенного лактама. Соединения, которые можно получить данным способом, включают в себя Соединение структуры 64 можно получить из соединения структуры 63 путем обработки 63 водородом при давлении 344,4 кПа (50 фунтов на кв.дюйм) в присутствии катализатора, такого как никель Ренея, в присутствии основания, такого как триэтиламин, в органическом растворителе, например метаноле. Затем полученный в результате продукт обрабатывают водной кислотой, такой как 6 н. НСl, при температуре между комнатной температурой и температурой дефлегмации. Полученную в результате смесь можно подвергнуть ионообменной хроматографии, чтобы выделить продукт 64. Соединение структуры 63 можно получить из соединения структуры 62 В обработкой подходящим основанием, таким как, но не ограничиваясь ими, гидрид натрия, н-бутиллитий и подобные, и алкилирующим реагентом, таким 45 как тpeт-бутилбромацетат или бензилбромацетат, в растворителе, таком как ДМСО или THF и подобные. Предпочтительно эту реакцию проводят путем обработки раствора соединения структуры 62 В в THF гидридом натрия и алкилированием полученного в результате аниона тpeт-бутилбромацетатом. Соединение структуры 62 В можно получить из соединения структуры 62 А обработкой хлоридом натрия в растворителе, таком как водный ДМСО, при температуре между 50 С и температурой дефлегмации. Соединение структуры 62 А можно получить из соединения структуры 61 обработкой подходящим алкилметаллгалогенидом, таким как алкиллитиевый реагент или органомагнийгалогенид, в растворителе, таком как THF или диэтиловый эфир, в присутствии соли меди,такой как, но не ограничиваясь этим, йодид меди, меди бромид диметилсульфид. Альтернативно эту реакцию можно проводить путем обработки нитрила в растворителе, таком как эфир, алкилмагнийхлоридом при комнатной температуре или ниже. Соединение, такое как 61, можно получить согласно известным из литературы методикам конденсации изобутилового альдегида и метилцианоацетата. Способ 10. С 4-замещение. Дважды разветвленные 3-замещенные аналоги ГАМК 72 можно получить в две стадии из азида 71 путем гидрирования азида 71 в присутствии катализатора на основе благородного металла, такого как 5% палладий на углероде, и гидролиза полученного в результате лактама сильной кислотой, такой как 6 н. HCl, при температуре дефлегмации. Затем конечный продукт 72 можно выделить, используя ионообменную хроматографию. Соединение 71 можно получить в две стадии обработкой лактона, такого как 70, с помощью НВr в растворителе, таком как этанол, при температуре, например, 0 С, и взаимодействием полученного в результате бромида с азидом натрия в растворителе, таком как диметилсульфоксид, при температуре между 10 и 80C. Лактон 70 можно получить в две стадии окислением соединения, такого как 69, окислителем, таким как периодат натрия, в присутст 004398 46 вии каталитического количества трихлорида рутения в растворителе, таком как ацетонитрил,при температуре между 0 и 100 С, и обработкой полученного в результате соединения карбонатом калия в метаноле, выполняемой при температуре между 25 и 70 С, а затем обработкой кислотой, такой как пара-толуолсульфоновая кислота, в растворителе, таком как THF, при температуре дефлегмации, либо водной кислотой, такой как HCl в воде, при температуре окружающей среды. Такое соединение, как 69, можно получить восстановлением такого соединения, как 68,гидридным восстанавливающим агентом, таким как алюмогидрид лития, в растворителе, таком как диэтиловый эфир или THF, и взаимодействием полученного в результате спирта с ацилирующим агентом, таким как уксусный ангидрид, в присутствии основания, такого как триэтиламин или пиридин или подобные. Соединения структуры 68 можно получить взаимодействием соединений, таких как 67, с водородом примерно при 344,4 кПа (50 фунтов на кв.дюйм) в присутствии катализатора на основе благородного металла, такого как 5% палладий на углероде, в растворителе, таком как этанол. Соединение формулы 67 можно получить взаимодействием соединения структуры 66 с раствором этанола, насыщенного газообразным бромидом водорода. Соединение, такое как 66, можно получить из такого соединения, как 65, обработкой соединения, такого как указанное, сильным основанием, таким как диизопропиламин лития, в растворителе, таком как THF,при температуре, такой как -78 С, и взаимодействием полученного в результате аниона с соединением, таким как бензилбромид или бензилиодид. Соединения структуры 66 (R=Н или низший алкил) можно получить в оптической форме способами, известными из литературыBertus, Tetrahedron, Asymmetry 1999; 10 (7): 1369-1380; Yamamoto, J. Am. Chem. Soc., 1992; 114 (20): 7652-60). Конкретные примеры Пример 3. Синтез 3-аминометил-5-метилоктановой кислоты. 47 810-814) (32,0 г, 0,137 моль) в 1,2-диметоксиэтане (600 мл) и кипятили с обратным холодильником в течение 19 ч. Эту реакционную смесь охлаждали до комнатной температуры и добавляли 200 мл воды. Реакционную смесь гасили 1 М лимонной кислотой и концентрировали при пониженном давлении. Остаток экстрагировали дихлорметаном, высушивали над сульфатом магния и выпаривали досуха с получением 17,47 г, 62% спирта 74 в виде прозрачного масла. 1H-ЯМР (CDCl3)7,30 (m, 5H), 4,38(d, 1H, J=14,7), 4,46 (d, 1H, J=14,7), 3,56 (m, 2H),3,36 (m, 1H), 3,10 (m, 1H), 2,52 (m, 2H), 2,26 (m,1H). MC, m/z (относительная интенсивность): 207 [М+2 Н, 66%]. ИК (КВr) 3345, 2946, 2866,1651, 1445, 1025, 737 и 698 см-1. 1-Бензил-4-йодметилпирролидин-2-он 75. К спирту лактаму 74 (11,18 г, 0,056 моль) в 210 мл толуола добавляли по очереди трифенилфосфин (20,0 г, 0,076 моль), имидазол (10,8 г, 0,159 моль) и йод (19,0 г, 0,075 моль). После перемешивания этой суспензии в течение 1,5 ч супернатант выливали в другую колбу. Липкий желтый остаток дважды промывали диэтиловым эфиром, и растворы объединяли. Растворитель выпаривали и остаток подвергали хроматографии на силикагеле, элюируя смесью ацетон/гексан 1:1 с получением 7,92 г, 46% йодолактама 75 в виде желтого масла. 1H-ЯМР(dd, 1H, J=5,6 и 4,4), 3,12 (dd, 1H, J=7,3 и 2,4),2,96 (dd, 1H, J=5,8 и 4,4), 2,60 (m, 2H), 2,22 (dd,1H, J=10,5 и 9,7). MC, m/z (относительная интенсивность): 224 [M-H-Bn, 94%], 317 [М+2 Н,64%]. ИК 3027, 2917, 1688, 1438, 1267 и 701 см-1. 1-Бензил-4-(2-метилпентил)пирролидин-2 он 76. К суспензии магниевой стружки (0,50 г,0,021 моль) в 15 мл безводного THF в атмосфере азота добавляли кристалл йода и 2 бромпентан (2,88 г, 0,019 моль). После экзотермической реакции, которую периодически охлаждали в ледяной бане, эту реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавили 8 мл Li2CuCl4 (полученного из 84 мг LiCl и 134 мг CuCl2 в 10 мл безводного THF) при 0 С с последующим добавлением по каплям 1-бензил-4-йодметилпирролидин-2-она 75 в 15 мл безводного THF и полученную в результате суспензию оставляли перемешиваться при 0 С в течение 3 ч. Перемешивание продолжали при комнатной температуре в течение 1 ч до того, как гасили насыщенным раствором хлорида аммония. Добавляли воду для растворения образовавшегося осадка, и затем раствор экстрагировали диэтиловым эфиром и высушивали над сульфатом магния. Растворитель выпаривали в вакууме и остаток под 004398 48 вергали хроматографии на силикагеле, элюируя смесью ацетон/гексан 1:1, с получением 1,13 г,69% 1-бензил-4-(2-метилпентил)пир-ролидин-2 она 76. 1H-ЯМР (CDCl3)7,30 (m, 5 Н), 4,44 (m,2H), 3,32 (m, 1H), 2,86 (m, 1H), 2,56 (m, 1H), 2,40THF. Свеженарезанные гранулы натрия добавляли до получения устойчивого темно-синего цвета. Охлаждающую баню убирали, и реакционную смесь перемешивали при температуре дефлегмации (-33 С) в течение 1 ч. Эту реакционную смесь гасили хлоридом аммония, и избытку аммиака давали возможность испариться. Полученный в результате остаток разбавляли водой, экстрагировали дихлорметаном и высушивали над сульфатом магния. Выпариванием растворителя с последующей хроматографией на силикагеле с элюированием смесью ацетон/гексан 1:1 получили 0,94 г, 86% 4-(2-метилпентил)пирролидин-2-она 77. 1 Н-ЯМР (CDCl3)6,25 (br, 1H), 3,44 (m, 1H), 2,95 (m, 1H), 2,54 (m,1H), 2,40 (m, 1H), 1,98 (m, 1H), 1,30 (m, 6H), 0,80(0,94 г, 0,007 моль) растворяли в 70 мл 6 н. HCl и кипятили с обратным холодильником в течение 20 ч. Этот раствор выпаривали в вакууме и водный раствор остатка наносили на ионообменную смолу Dowex 50WX 8-100 (сильнокислотная), которая была промыта водой со степенью очистки, пригодной для ВЭЖХ. С колонки элюировали сначала водой, пока рН элюента не стал постоянным, а затем 5% раствором гидроксида аммония. Фракции гидроксида аммония выпаривали и образовывали азеотропную смесь с толуолом. Белое твердое вещество промывали ацетоном, фильтровали и высушивали в вакуумном сушильном шкафу в течение 24 ч с получением аминокислоты 0,61 г, 59%. 1 Н-ЯМР Метиловый эфир 1-(4-метоксибензил)-5 оксопирролидин-3-карбоновой кислоты 79. К 4-метоксибензиламину (42 г, 0,306 моль) в метаноле (40 мл) при 0 С добавляли диметилитаконат (48 г, 0,306 моль) в метаноле (13 мл). Этот раствор перемешивали при комнатной температуре в течение 4 суток. К этому раствору добавляли 1 М HCl, а затем диэтиловый эфир. Два слоя разделяли, и водную фазу экстрагировали диэтиловым эфиром. Объединенные органические фазы высушивали (MgSO4). После фильтрования осушителя желаемый материал 79 осаждали из раствора, который собирали и высушивали в вакууме. 23,26 г, 29%. МС, m/z(относительная интенсивность): 264 [М+Н,100%]. Аналитически вычислено для С 14 Н 17N1O4: С, 63,87; Н, 6,51; N, 5,32. Обнаружено: С, 63,96; Н, 6,55; N, 5,29. 4-Гидроксиметил-1-(4-метоксибензил)пирролидин-2-он 80.NaBH4 (15 г, 0,081 моль) добавляли порциями к эфиру 79 в этаноле (600 мл) при комнатной температуре. Через 4,5 ч к этой реакционной смеси осторожно добавляли воду (200 мл), и раствор перемешивали при комнатной температуре в течение ночи. Полученное в результате твердое вещество удаляли фильтрованием, и фильтрат концентрировали с получением спирта 80 в виде масла. 15,33 г, 81%. МС,m/z (относительная интенсивность): 235 [М+Н,100%]. 4-Иодметил-1-(4-метоксибензил)пирролидин-2-он 81. К спирту 80 (12,9 г, 0,055 моль) в PhMe добавляли трифенилфосфин (20 г, 0,077 моль),имидазол (10,8 г, 0,16 моль) и иод (19 г, 0,075 моль). Эту суспензию перемешивали при комнатной температуре в течение 5 ч. Добавляли 50 насыщенный водный раствор тиосульфата натрия и два слоя разделяли. Водную фазу экстрагировали диэтиловым эфиром и объединенные органические фазы промывали рассолом, высушивали (MgSO4) и концентрировали. Флэшхроматографией остатка (толуол/ацетон от 6:1 до 4:1) получили иодид 81 в виде масла. 11,9 г,63%. МС, m/z (относительная интенсивность): 346 [М+Н, 100%]. 4-(2,4-Диметилпентил)-1-(4-метоксибензил)пирролидин-2-он 82. Использовали методику, аналогичную получению 1-бензил-4-(2-метилпентил)пирролидин-2-она 76, с получением 4-(2,4-диметилпентил)-1-(4-метоксибензил)пирролидин-2-она в виде масла. 1,22 г, 29%. МС, m/z (относительная интенсивность): 304 [М+Н, 100%]. 4-(2,4-Диметилпентил)пирролидин-2-он 83. К лактаму (1,17 г, 3,86 ммоль) в MeCN (20 мл) при 0 С добавляли церийаммонийнитрат(4,2 г, 7,7 ммоль) в Н 2O (10 мл). Через 50 мин добавляли дополнительную порцию церийаммонийнитрата (2,1 г, 3,86 ммоль), и через 1 ч эту смесь абсорбировали на силикагеле и подвергали флэш-хроматографии с получением масла. МС, m/z (относительная интенсивность): 183(S)-4-гидроксиметил-1-S)-1-фенилэтил) пирролидин-2-он 84. К эфиру 33 (49 г, 0,198 моль) в ЕtOН (600 мл) добавляли борогидрид натрия (22 г, 0,595 моль). Через 7 ч осторожно добавляли 1 М лимонную кислоту, и когда прекращалось выделение пузырьков газа, добавляли воду, чтобы полностью погасить реакционную смесь. При пониженном давлении удаляли этанол и добавляли этилацетат. Полученные в результате два слоя разделяли, водную фазу экстрагировали ЕtOАс, и объединенные органические фазы высушивали (MgSO4) и концентрировали с полу 51 чением тяжелого масла. МС, m/z (относительная интенсивность): [М+Н, 100%].(S)-4-иодметил-1-S)-1-фенилэтил)пирролидин-2-он 85. Использовали методику, аналогичную иодированию соединения 80, с получением иодида 85 в виде масла. 35,2 г, 56%. Аналитически вычислено для C13H16I1N1O1: С, 47,43; Н, 4,90; N,4,25. Обнаружено: С, 47,41; Н, 4,83; N, 4,17. 4-(2-Метилпентил)-1-S)-1-фенилэтил) пирролидин-2-он 86. Использовали методику, аналогичную получению 1-бензил-4-(2-метилпентил)пирролидин-2-она 76, с получением 2,71 г, 81,0% соединения 86 в виде масла. МС, m/z (относительная интенсивность): 274 [М+1 Н, 100%], 315THF/H2O (3:1, 100 мл). Через 1 ч добавляли периодат натрия (11,4 г, 0,053 моль). Через 2 ч суспензию 52 фильтровали и твердые вещества промывали дихлорметаном. Фильтрат концентрировали и образовывали азеотропную смесь остатка с толуолом. Остаток растворяли в этаноле и добавляли борогидрид натрия (2,5 г). Эту суспензию перемешивали при комнатной температуре в течение ночи. Добавляли 1 н. лимонную кислоту, и эту смесь разбавляли диэтиловым эфиром. Полученные в результате два слоя разделяли, и водную фазу экстрагировали диэтиловым эфиром, и объединенные органические фазы высушивали (МgSO4) и концентрировали. Флэш-хроматографией (1:1 гексан/ЕtOАс) остатка получили масло, 4,2 г, 73%. МС, m/z (относительная интенсивность): 276 [М+Н,100%].(S)-4-(4-метокси-2-метилбутил)-1-S)-1 фенилэтил)пирролидин-2-он 90. К спирту 89 (2 г, 7,66 ммоль) в ДМСО (60 мл) при комнатной температуре добавляли NaH(368 мг, 60% в масле). Через 30 мин добавляли метилиодид (1,08 г, 7,66 ммоль), и этот раствор перемешивали при комнатной температуре в течение ночи, после чего эту реакционную смесь разбавляли водой (500 мл). Этот раствор экстрагировали диэтиловым эфиром, и объединенные органические экстракты высушивали(MgSO4) и концентрировали. Флэш-хроматографией (гексан/ацетон от 90 до 50%) остатка получили продукт 90 в виде масла (1,1 г, 52%). МС m/z 290 [М+Н, 100%].(S)-4-(4-метокси-2-метилбутил)пирролидин-2-он 91. Использовали методику, аналогичную синтезу 4-(2-метилпентил)пирролидин-2-она 77,с получением лактама 91 в виде масла. МС, m/z 186 (М+Н, 100%). Пример 6. (S)-3-аминометил-7-метокси-5 метилгептановая кислота. Следовали методике, аналогичной синтезу примера 3. Полученную в результате аминокислоту, выделенную при ионообменной хроматографии, перекристаллизовывали из смеси метанол/этилацетат с получением примера 6 в виде белого твердого вещества. МС, m/z 204 (М+Н,100%). Аналитически вычислено для 53 Диметиловый эфир 2-метил-2-[(S)-5-оксо 1-S)-1-фенилэтил)пирролидин-3-илметил]малоновой кислоты 92. К диметилметилмалонату (1,06 г, 7,29 ммоль) в ДМСО (7 мл) при комнатной температуре добавляли NaH (291 мг 60% дисперсии в масле). После того как прекращалось выделение пузырьков газа, добавляли лактам 85 (2 г, 7,29 ммоль) в ДМСО (5 мл). Через 1 ч добавляли воду, и этот водный раствор экстрагировали диэтиловым эфиром. Объединенные органические экстракты высушивали (MgSО 4) и концентрировали. Флэш-хроматографией (1:1 гексан/ацетон) остатка получили продукт в виде масла (1,7 г, 81%). МС m/z 348 (М+Н, 100%). Метиловый эфир 2-метил-3-[(S)-5-оксо-1S)-1-фенилэтил)пирролидин-3-ил]пропионовой кислоты 93. Эфир 92 (483 мг, 1,4 ммоль), NaCI (104 мг,1,8 ммоль), воду (105 мкл) и ДМСО (5 мл) нагревали до температуры дефлегмации в течение 2 ч. Этот раствор охлаждали до комнатной температуры, добавляли воду, и водный раствор экстрагировали диэтиловым эфиром. Объединенные органические экстракты высушивали(MgSO4) и концентрировали. Флэш-хроматографией (гексан/ацетон от 80 до 66%) остатка получили продукт в виде масла (160 мг, 40%). МС m/z 290 (M+H, 100%).(100 мл) добавляли NaBH4 (3,7 г, 0,10 моль) и эту смесь нагревали до температуры дефлегмации в течение 2,5 ч. Этот раствор охлаждали до 0 С и осторожно добавляли 1 М лимонную кислоту, а затем воду. Этот раствор концентрировали до получения половины добавленного объема и экстрагировали диэтиловым эфиром. Объединенные органические экстракты высушивали(МgSO4) и концентрировали. Флэш-хроматографией (1:1 гексан/ацетон) остатка получили продукт в виде масла (2,6 г, 59%). МС m/z 262(1 г, 6,2 ммоль) в CH2Cl2 (20 мл) при -78 С добавляли спирт 37 в CH2Cl2 (10 мл). Через 1 ч при -78 С этот раствор нагревали до комнатной температуры. Через 7 ч этот раствор осторожно гасили насыщенным водным раствором бикарбоната натрия и два слоя разделяли. Органическую фазу высушивали (MgSO4) и концентрировали. Флэш-хроматографией (гексан/ацетон от 90 до 66%) остатка получили продукт в виде масла (600 мг, 37%). МС m/z 264 (M+H, 100%).(S)-4-(3-фтор-2-метилпропил)пирролидин 2-он 95. Использовали методику, аналогичную получению 4-(2-метилпентил)пирролидин-2-она 77, с получением лактама в виде масла (242 мг,68%). МС, m/z 159 (М, 100%). Пример 7. (S)-3-аминометил-6-фтор-5 метилгексановая кислота. Следовали методике, аналогичной синтезу примера 3. Полученную в результате аминокислоту, выделенную в результате ионообменной хроматографии, перекристаллизовывали из смеси метанол/этилацетат с получением примера 7 в виде белого твердого вещества. МС, m/z 177(S)-4-(3-метокси-2-метилпропил)пирролидин-2-он 97. Использовали методику, аналогичную синтезу 4-(2-метилпентил)пирролидин-2-она 77,с получением 97 в виде масла (760 мг, 93%). МС, m/z 171 (M+H, 100%). Пример 8. (S)-3-аминометил-6-метокси-5 метилгексановая кислота. Следовали методике, аналогичной синтезу примера 3. Полученную в результате аминокислоту, выделенную с помощью ионообменной хроматографии, перекристаллизовывали из смеси метанол/этилацетат с получением примера 8 в виде белого твердого вещества. МС, m/z 190C9H19N1O3: С, 57,12; Н, 10,12; N, 7,40. Обнаружено: С, 57,04; Н, 10,37; N, 7,30. Вторую партию осаждали из маточных растворов (соотношение С 5-изомеров 1:5 по 1H-ЯМР). МС, m/z 190 (M+H, 100%).(4,3 г), а затем CuCl2 (6,8 г). Через 30 мин добавляли метилмагнийхлорид (152 мл 3 М раствора в THF, Aldrich), и этот раствор нагревали до комнатной температуры. Через 10 ч этот раствор охлаждали до 0 С и осторожно добавляли насыщенный водный раствор хлорида аммония. Полученные в результате два слоя разделяли, и водную фазу экстрагировали диэтиловым эфиром. Объединенные органические фазы высушивали (МgSO4) и концентрировали с получением масла. 32,6 г; 93%. Использовали без дальнейшей очистки. 13 С-ЯМР (100 МГц;(433 мл) добавляли раствор СrО 3 (39 г, 0,39 моль) в H2SO4 (33 мл)/Н 2O (146 мл) в течение 50 мин. Через 6 ч добавляли дополнительное количество СrО 3 (26 г, 0,26 моль) в H2SO4 (22 мл)/Н 2O (100 мл). Через 12 ч раствор разбавляли рассолом и этот раствор экстрагировали диэтиловым эфиром. Объединенные органические фазы высушивали (MgSO4) и концентрировали. Флэш-хроматографией (градиент смеси гексан/ЕtOАс от 6:1 до 2:1) получили продукт 99 в виде масла. 12,1 г; 65%. МС, m/z (относительная интенсивность): 143 [М-Н, 100%].(4S,5R)-4-метил-3-R)-4-метилгептаноил)5-фенилоксазолидин-2-он 100. К кислоте 99 (19 г, 0,132 моль) и триэтиламину (49,9 г, 0,494 моль) в THF (500 мл) при 0 С добавляли хлорангидрид триметилуксусной кислоты (20 г, 0,17 моль). Через 1 ч добавлялиLiCI (7,1 г, 0,17 моль) с последующим добавлением оксазолидинона (30 г, 0,17 моль). Эту смесь нагревали до комнатной температуры и через 16 ч фильтрат удаляли фильтрованием и раствор концентрировали при пониженном давлении. Флэш-хроматографией (гексан/ЕtOАсTHF (200 мл) при -50 С добавляли NaHMDS (48 мл 1 М раствора в THF). Через 30 мин добавляли тpeт-бутилбромацетат (15,6 г, 0,08 моль). Этот раствор перемешивали в течение 4 ч при 50 С, а затем нагревали до комнатной температуры. Через 16 ч добавляли насыщенный водный раствор хлорида аммония и два слоя разделяли. Водную фазу экстрагировали диэтиловым эфиром и объединенные органические фазы высушивали (MgSO4) и концентрировали. Флэш-хроматографией (гексан/ЕtOАс 9:1) получили продукт 101 в виде белого твердого вещества, 12 г; 72%. []D=30,2 (с 1 в СНСl3). 13 СЯМР (100 МГц; CDCl3) 176,47, 171,24, 152,72,133,63, 128,87, 125,86, 80,85, 78,88, 55,34, 39,98,38,77, 38,15, 37,58, 30,60, 28,23, 20,38, 20,13,14,50, 14,28. 4-трет-Бутиловый эфир (S)-2-R)-2-Метилпентил)янтарной кислоты 102. К эфиру 101 (10,8 г, 0,025 моль) в Н 2O (73 мл) и THF (244 мл) при 0 С добавляли предварительно смешанные раствор LiOH (51,2 мл 0,8 М раствора) и Н 2O2 (14,6 мл 30% раствора). Через 4 ч добавляли еще 12,8 мл LiOH (0,8 М раствор) и 3,65 мл Н 2O2 (30% раствор). Через 30 мин добавляли бисульфит натрия (7 г), сульфит натрия (13 г) и воду (60 мл) с последующим добавлением гексана (100 мл) и диэтилового эфира (100 мл). Два слоя разделяли и водный слой экстрагировали диэтиловым эфиром. Объединенные органические фазы концентрировали до масла, которое растворяли в гептане (300 мл). Полученное в результате твердое вещество отфильтровывали и фильтрат высушивали(МgSO4) и концентрировали с получением масла (6 г, 93%), которое использовали без дальнейшей очистки. МС, m/z (относительная интенсивность): 257 [М+Н, 100%]. тpeт-Бутиловый эфир (3S,5R)-3-гидроксиметил-5-метилоктановой кислоты 103. К кислоте 102 (3,68 г, 0,014 моль) в THF(100 мл) при 0 С добавляли ВН 3 Ме 2 (36 мл 2 М раствора в THF, Aldrich), после чего этот раствор нагревали до комнатной температуры. Через 15 ч к этому раствору осторожно добавляли лед (чтобы контролировать выделение пузырьков газа) с последующим добавлением рассола. Этот раствор экстрагировали диэтиловым эфиром и объединенные органические фазы высушивали (MgSO4) и концентрировали при пониженном давлении. Флэш-хроматографией (гексан/ЕtOАс 4:1) получили спирт 103 в виде масла(40 мл) при комнатной температуре добавляли триэтиламин (2,4 г, 0,024 моль), DMAP (20 мг) и хлорангидрид толуолсульфоновой кислоты (2,3 г, 0,012 моль). Через 14 ч добавляли 1 н. HCl и два слоя разделяли. Водную фазу экстрагировали диэтиловым эфиром и объединенные органические фазы высушивали (МgSO4) и концентрировали. Флэш-хроматографией (гексан/ ЕtOАс 95%) получили тозилат 104 в виде масла(2,94 г, 91%). 13 С-ЯМР (100 МГц; CDCl3) 171,60,144,92, 133,07, 130,02, 128,12, 80,80, 72,15,39,73, 38,09, 37,89, 32,67, 29,71, 28,22, 21,83,20,10, 19,54, 14,49. тpeт-Бутиловый эфир (3S,5R)-3-азидометил-5-метилоктановой кислоты 105. Тозилат 104 (2,92 г, 7,3 ммоль) и азид натрия (1,43 г, 0,02 моль) нагревали до 50 С в ДМСО (30 мл). Через 2 ч этот раствор охлаждали до комнатной температуры и разбавляли водой. Этот раствор экстрагировали диэтиловым эфиром и объединенные органические фазы высушивали (МgSО 4) и концентрировали с получением масла, 1,54 г, 79%. Дальнейшей очисткой флэш-хроматографией(S)-4-R)-2-метилпентил)пирролидин-2-он 107 и тpeт-бутиловый эфир (3S,5R)-3-аминометил-5-метилоктановой кислоты 106. Азид 105 обрабатывали 5% Pd/C и встряхивали в атмосфере водорода в течение 20 ч,после чего добавляли дополнительно 200 г 5%Pd/C. Через 6 ч фильтрат концентрировали с получением масла, которое, как обнаружено с помощью 1H-ЯМР, представляло собой смесь первичного амина 106 и лактама 107 (1,75 г),которую использовали без дальнейшей очистки. Пример 9. (3S,5R)-3-Аминометил-5-метилоктановой кислоты гидрохлорид. Смесь амина 106 и лактама 107 (1,74 г) обрабатывали 3 н. HCl (40 мл), и этот раствор нагревали до 50 С в течение 4 ч, затем охлаждали до комнатной температуры. Через 12 ч этот раствор концентрировали и остаток перекристаллизовывали из этилацетата с получением аминокислоты в виде белого твердого вещества, 605 мг. МС, m/z (относительная интенсивность): 188(800 мл) при 0 С добавляли хлорангидрид метансульфоновой кислоты (26 мл, 0,329 моль) вCH2Cl2 (200 мл). Через 2 ч при 0 С этот раствор промывали 1 н. HCl, затем рассолом. Органическую фазу высушивали (MgSO4) и концентрировали с получением масла (60,5 г, 94%), которое использовали без дальнейшей очистки. 1HЯМР (400 МГц; CDCl3) 5,05 (1 Н, m), 4,2 (2 Н, m),2,95 (3 Н, s), 1,98 (2 Н, m), 1,75 (1 Н, m), 1,6 (3 Н,s), 1,5 (4 Н, m), 1,35 (2 Н, m), 1,2 (1 Н, m), 0,91(R)-2,6-Диметил-окт-2-ен 109. К алкену 108 (60 г, 0,256 моль) в THF (1 л) при 0 С добавляли алюмогидрид лития (3,8 г,0,128 моль). Через 7 ч добавляли дополнительно 3,8 г алюмогидрида лития и этот раствор нагревали до комнатной температуры. Через 18 ч добавляли дополнительно 3,8 г алюмогидрида лития. По прошествии следующих 21 ч эту реакционную смесь осторожно гасили 1 н. лимонной кислотой и этот раствор далее разбавляли рассолом. Полученные в результате две фазы разделяли и органическую фазу высушивали(MgSO4) и концентрировали с получением масла, которое использовали без дальнейшей очистки. МС, m/z (относительная интенсивность): 139 [М-Н, 100%].(4R,5S)-4-Метил-3-R)-4-метилгексаноил)-5-фенилоксазолидин-2-он 111. Использовали методику, аналогичную синтезу (4R,5S)-4-метил-3-R)-4-метилгептаноил)-5-фенилоксазолидин-2-она 100, с получением оксазолидинона 111 в виде масла (35,7 г,95%). МС, m/z (относительная интенсивность): 290 [М+Н, 100%]. трет-Бутиловый эфир (3S,5R)-5-метил-3[1-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-ил)метаноил]гептановой кислоты 112. Следовали методике, аналогичной получению тpeт-бутилового эфира (3S,5R)-5-метил-34R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3 карбонил)октановой кислоты 101, с получением 112 в виде масла (7,48 г, 31%). 4-трет-Бутиловый эфир (S)-2-R)-2-метилбутил)янтарной кислоты 113. К эфиру 112 (7,26 г, 0,018 моль) в Н 2O (53 мл) и THF (176 мл) при 0 С добавляли предварительно смешанные раствор LiOH (37 мл 0,8 М раствора) и Н 2O2 (10,57 мл 30% раствора) и этот раствор нагревали до комнатной температуры. Через 2 ч добавляли бисульфит натрия (7 г),сульфит натрия (13 г) и воду (60 мл) два слоя разделяли и водный слой экстрагировали диэтиловым эфиром. Объединенные органические фазы концентрировали до масла, которое растворяли в гептане (200 мл). Полученное в результате твердое вещество отфильтровывали и фильтрат высушивали (МgSO4) и концентрировали с получением масла (4,4 г), которое использовали без дальнейшей очистки. трет-Бутиловый эфир (3S,5R)-3-гидроксиметил-5-метилгептановой кислоты 114. Использовали методику, аналогичную получению тpeт-бутилового эфира (3S,5R)-3 гидроксиметил-5-метилоктановой кислоты 103,с получением спирта 114 в виде масла (2,68 г,69%). МС, m/z (относительная интенсивность): 216 [89%], 174 [М-(СН 3)3 С, 100%]. тpeт-Бутиловый эфир (3S,5R)-5-метил-3(толуол-4-сульфонилоксиметил)гептановой кислоты 115. К спирту 114 (2,53 г, 0,011 ммоль) в СН 2 Сl2 (140 мл) при 0 С добавляли пиридин (2,6 г, 0,033 моль), DMAP (100 мг) и хлорангидрид толуолсульфоновой кислоты (3,15 г, 0,016 моль) и этот раствор нагревали до комнатной температуры в течение 3,5 ч, после чего добавляли еще DMAP и TsCl (3,15 г). Через 14 ч добавляли 1 н. HCl и два слоя разделяли. Органическую фазу промывали рассолом, затем высушивали(90 мг) в THF (20 мл) и встряхивали в атмосфере водорода в течение 36 ч. Катализатор удаляли фильтрованием и полученное в результате масло использовали без дальнейшей очистки. Пример 10. (3S,5R)-3-aминометил-5-метилгептановая кислота. Смесь амина 117 и лактама 118 обрабатывали 6 н. HCl и этот раствор нагревали до 50 С в течение 17 ч, затем охлаждали до комнатной температуры и концентрировали. Полученное в результате масло подвергали ионообменной хроматографии (Dowex, сильнокислотная смола), с использованием 5% гидроксида аммония,с получением твердого вещества кремового цвета, которое перекристаллизовывали из смеси метанол/этилацетат с получением (3S,5R)-3 аминометил-5-метилгептановой кислоты, пример 10. МС, m/z (относительная интенсивность): 174 [М+Н, 100%]. Аналитически вычислено дляTHF (40 мл) в течение 15 мин. Полученный в результате раствор добавляли к метилмагнийхлориду, 3,0 М в THF (168 мл), при 0 С в атмосфере азота и перемешивали при этой температуре в течение 15 мин. К этой реакционной суспензии медленно добавляли (R)-(-)-цитронеллилбромид (55,16 г, 251,8 ммоль) в THF (100 мл) и перемешивали при 0 С в течение 2,5 ч. Ее нагревали до комнатной температуры и перемешивание продолжали в течение еще 1 ч. Смесь охлаждали до 0 С и гасили насыщенным раствором хлорида аммония. Затем эту суспен
МПК / Метки
МПК: C07C 229/08, A61P 25/00, A61K 31/197
Метки: одно, двузамещенные, кислоты, 3-пропил-гамма-аминомасляные
Код ссылки
<a href="https://eas.patents.su/30-4398-odno-i-dvuzameshhennye-3-propil-gamma-aminomaslyanye-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Одно- и двузамещенные 3-пропил-гамма-аминомасляные кислоты</a>
Предыдущий патент: Пол, комплект элементов для выравнивания и/или установки на заданном уровне настила пола относительно его основания и крепежно-опорный элемент
Следующий патент: Способ получения (+/-) 3 – (3,4 – дихлорфенил) – 2 – диметиламино-2 – метилпропан-1-ола или церикламина (inn)
Случайный патент: Резервуар для хранения формовочной смеси в формовочной машине с устройством для всасывания и выпуска воздуха












