Новые фармацевтические композиции, содержащие флибансерин в полиморфной модификации а
Формула / Реферат
1. Фармацевтическая композиция для перорального применения в виде таблетки, состоящей из сердцевины, содержащей флибансерин в полиморфной модификации А, эндотермический максимум которой по данным анализа дифференциальной сканирующей калориметрией приходится на температуру 161шС, в смеси по меньшей мере с одним фармацевтически приемлемым вспомогательным веществом, и пленочного покрытия, в которое заключена эта сердцевина.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что фармацевтически приемлемое вспомогательное вещество представляет собой наполнитель, выбранный из группы, включающей моногидрат лактозы как в виде тонкоизмельченного материала или модифицированной лактозы, такой как лактоза распылительной сушки, так и в виде агломерированной лактозы (таблеттозы), безводную лактозу, микрокристаллическую целлюлозу, двухосновный фосфат кальция, кукурузный крахмал, сахароспирты и их смеси.
3. Фармацевтическая композиция по п.1 или 2, отличающаяся тем, что содержание полиморфной модификации А флибансерина составляет от 1 до 50 мас.% в пересчете на общую массу сердцевины.
4. Фармацевтическая композиция по пп.1, 2 или 3, отличающаяся тем, что содержание наполнителя в сердцевине составляет от 50 до 99 мас.% в пересчете на общую ее массу.
5. Фармацевтическая композиция по пп.1, 2, 3 или 4, отличающаяся тем, что сердцевина дополнительно содержит связующее, выбранное из группы, включающей повидон, коповидон, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, кукурузный крахмал и их смеси.
6. Фармацевтическая композиция по любому из пп.1-5, отличающаяся тем, что сердцевина дополнительно содержит разрыхлитель, выбранный из группы, включающей натрийкрахмалгликолят, кросповидон, натриевую соль кроскармеллозы, натрийкарбоксиметилцеллюлозу, высушенный кукурузный крахмал и их смеси.
7. Фармацевтическая композиция по любому из пп.1-6, отличающаяся тем, что сердцевина дополнительно содержит регуляторы текучести, смазывающие вещества и смазку для отделения от формы или антиадгезивы из группы веществ, включающей диоксид кремния, тальк, стеарат магния и их смеси.
8. Фармацевтическая композиция по любому из пп.1-7, отличающаяся тем, что пленочное покрытие, в которое заключена сердцевина, содержит по меньшей мере один пленкообразователь из группы веществ, включающей гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу и сополимер этилакрилата и метилметакрилата.
9. Применение содержащей флибансерин в полиморфной модификации А композиции по любому из пп.1-8 для лечения заболеваний, при которых применение соединений, проявляющих сродство к 5-HT1A- и 5-НТ2-рецептору, может оказывать положительное терапевтическое действие.
10. Применение по п.9, отличающееся тем, что заболевание выбрано из группы, включающей депрессию, шизофрению, болезнь Паркинсона, состояние тревоги или страха, нарушения сна, половые и психические расстройства и возрастные нарушения памяти.
Текст
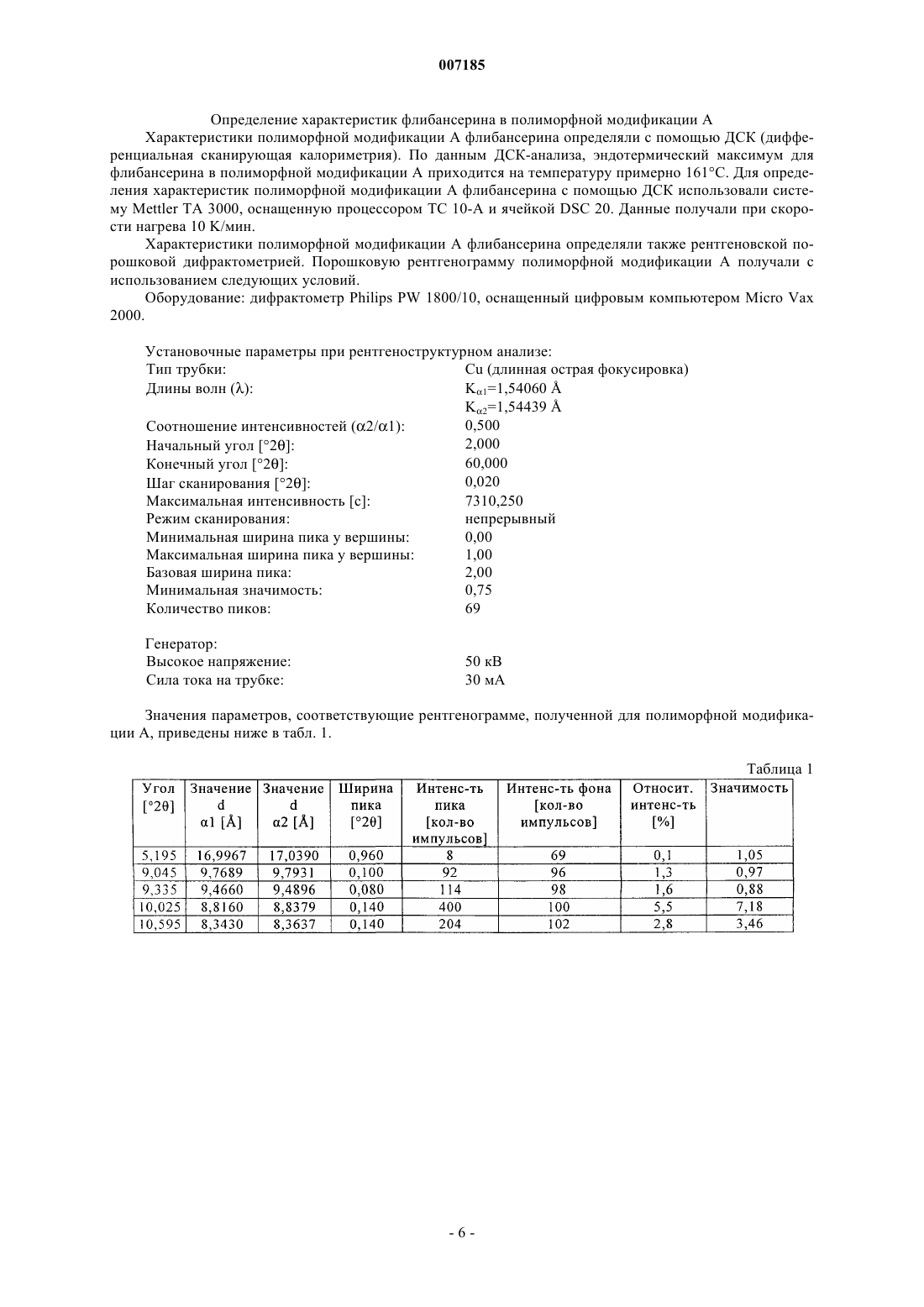
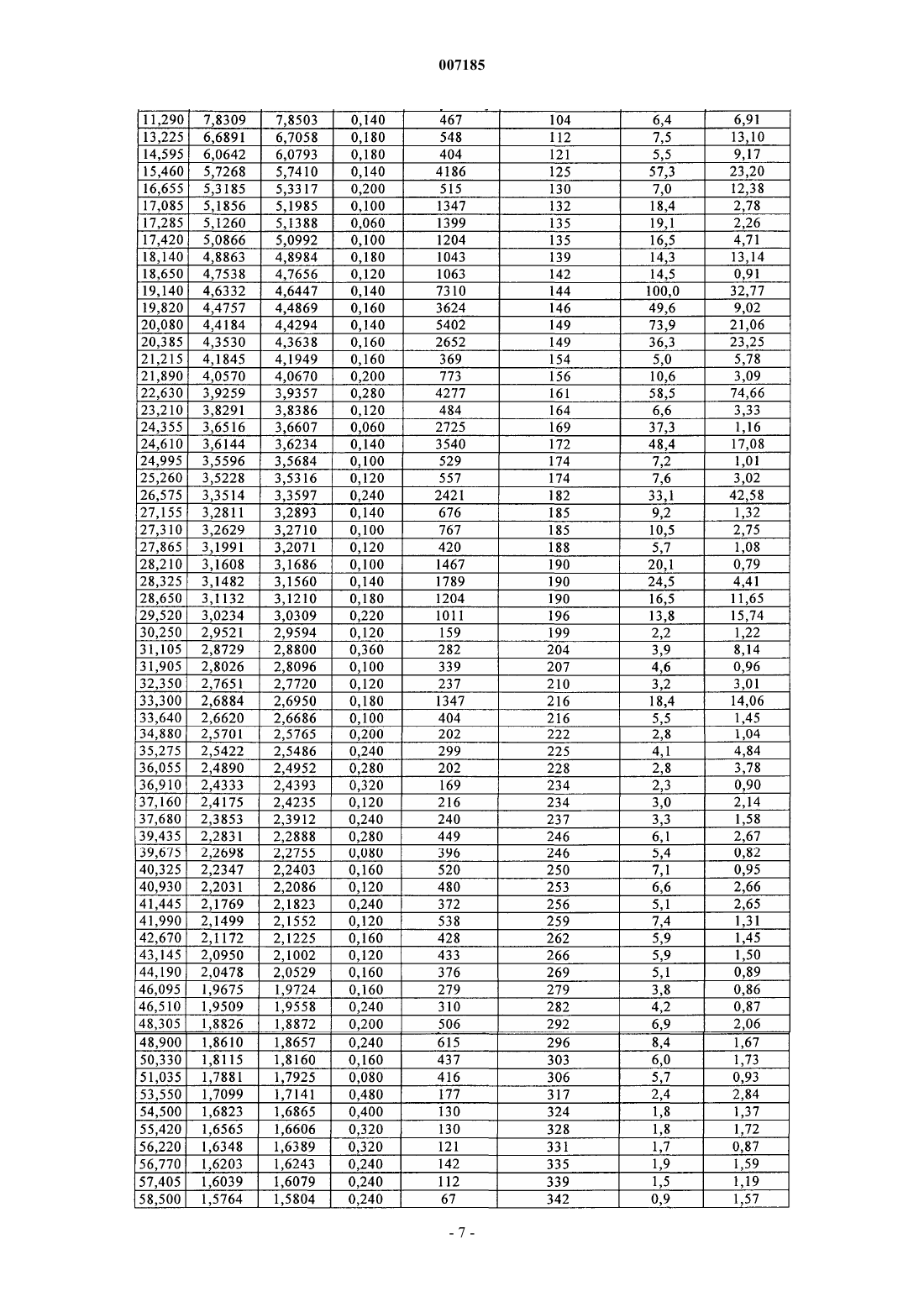
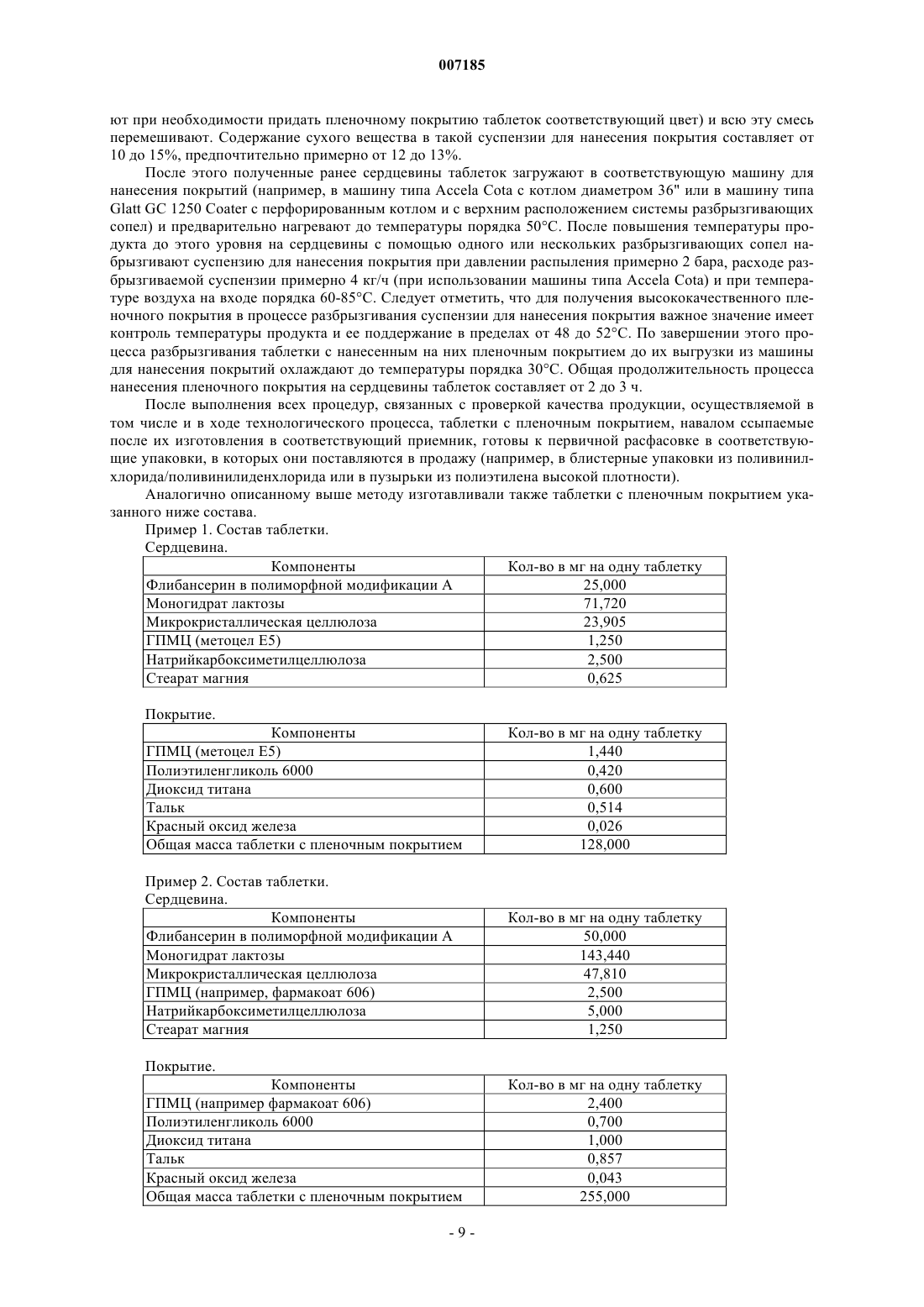
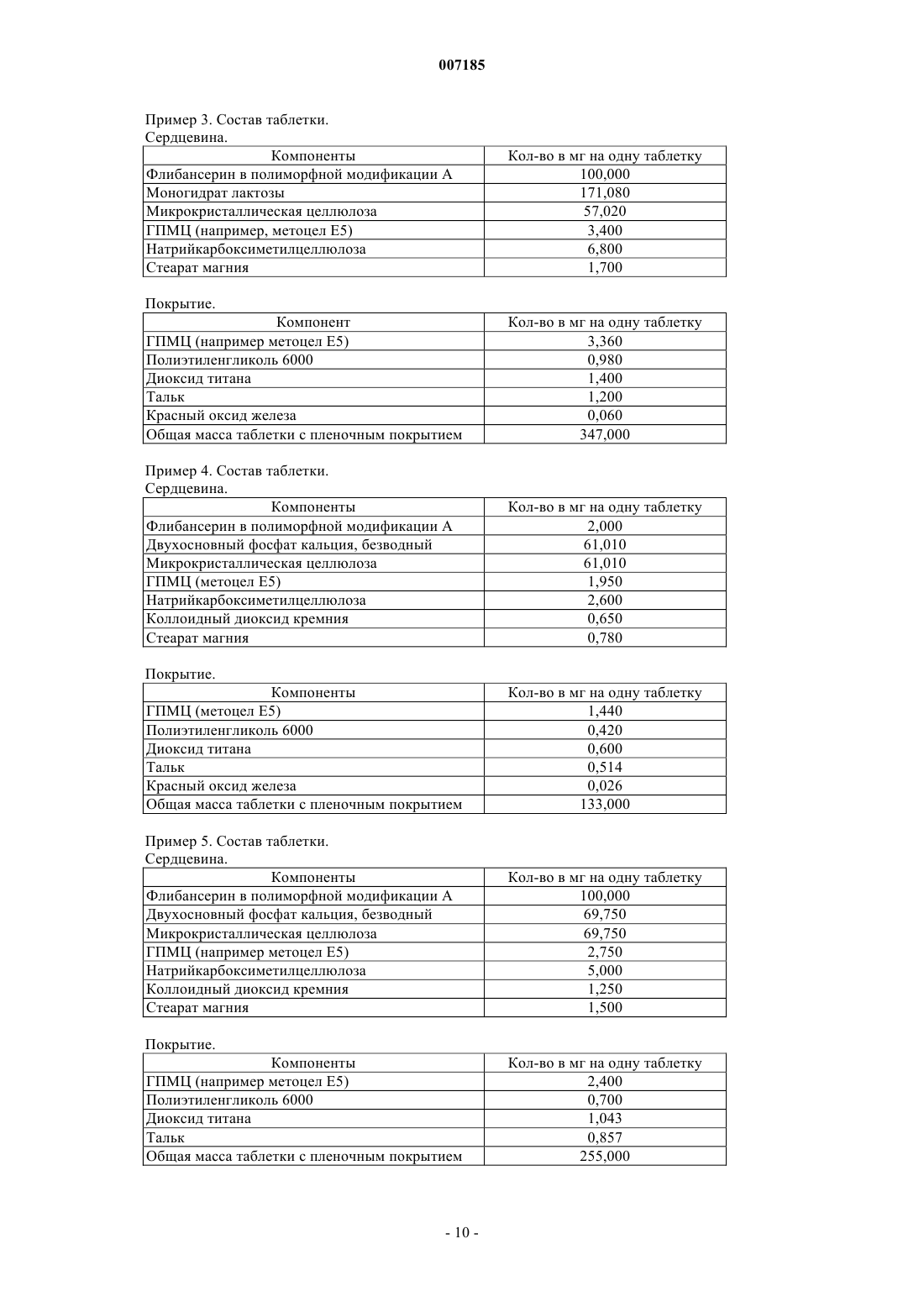
007185 Настоящее изобретение относится к фармацевтическим композициям для перорального применения, содержащим флибансерин, способам их получения и их применению в качестве лекарственного средства. Предпосылки создания изобретения Соединение 1-[2-(4-(3-трифторметилфенил)пиперазин-1-ил)этил]-2,3-дигидро-1H-бензимидазол-2-он(флибансерин) описано в форме его гидрохлорида в заявке ЕР-А 526434 и имеет следующую химическую структуру: Флибансерин проявляет сродство (аффинность) к 5-HT1A- и 5-НТ 2-рецепторам. С учетом этого такое соединение является перспективным терапевтическим агентом, который может использоваться для лечения различных заболеваний, например депрессии, шизофрении, болезни Паркинсона, состояний тревоги, нарушений сна, сексуальных и психических расстройств, а также возрастных нарушений памяти. Очевидно, что основным предварительным условием, соблюдение которого служит необходимой предпосылкой для начала коммерческого производства фармацевтического действующего вещества и его поступления в продажу в качестве апробированного лекарственного средства, является точное определение его фармацевтической активности. Однако к фармацевтическому действующему веществу предъявляется и целый ряд различных иных требований. Подобные требования, которым должно удовлетворять фармацевтическое действующее вещество, основаны на различных параметрах, связанных с природой самого действующего вещества. В качестве примера таких параметров можно назвать, но не ограничиваясь только ими, стабильность действующего вещества в различных окружающих условиях,его стабильность в процессе приготовления лекарственного средства, а также его стабильность в составе конечных лекарственных препаратов. Фармацевтическое действующее вещество, используемое для получения фармацевтических препаратов или композиций, должно обладать максимально возможной степенью чистоты, а также должно оставаться стабильным при его длительном хранении в различных окружающих условиях. Обязательное соблюдение этого требования обусловлено необходимостью исключить применение лекарственных препаратов, в которых наряду с собственно действующим веществом присутствуют, например, продукты его разложения. В этих случаях лекарственный препарат может содержать действующее вещество в количестве, которое меньше указанного производителем. Важное значение имеет далее равномерное распределение действующего вещества в лекарственной композиции, и в частности при необходимости введения лекарственного средства в низкой дозировке. Обеспечить равномерное распределение действующего вещества в лекарственной композиции можно за счет уменьшения размера его частиц до приемлемого уровня, например, измельчением. Поскольку при приготовлении лекарственного средства следует по возможности практически полностью исключить проявление таких сопутствующих измельчению (или микронизации) фармацевтического действующего вещества эффектов, как его разложение и/или переход в аморфное состояние, обязательным требованием, которому должно удовлетворять действующее вещество, является его высокая стабильность в процессе измельчения, несмотря на наличие жестких условий, необходимых для проведения этого процесса. Получение гомогенной фармацевтической композиции с постоянно воспроизводимым заданным содержанием в ней действующего вещества возможно только при достаточно высокой его стабильности в процессе его измельчения. Помимо этого от свойств фармацевтической композиции как таковой напрямую зависит биодоступность входящего в ее состав действующего вещества и тем самым эффективность лекарственного средства при его предусмотренном медицинском применении. Исходя из вышеизложенного, в основу настоящего изобретения была положена задача предложить новую, содержащую флибансерин композицию для перорального применения, которая удовлетворяла бы указанным выше строгим требованиям, предъявляемым к фармацевтическим композициям. Подробное описание изобретения Согласно изобретению неожиданно было установлено, что флибансерин в виде свободного основания в определенной полиморфной модификации в полной мере отвечает тем требованиям, которым он должен удовлетворять в составе предлагаемой в изобретении фармацевтической композиции. Флибансерин в подобной определенной полиморфной модификации (полиморфной модификации А) можно получать за счет выбора особых условий проведения реакции, которые более подробно описаны ниже. Наряду с другими особенностями для флибансерина в такой его полиморфной модификации характерно наличие эндотермического максимума, который по данным термического анализа дифференциальной сканирующей калориметрией (ДСК) приходится на температуру 161 С. Предлагаемая в изобретении фармацевтическая композиция представляет собой таблетку для перорального применения, состоящую из сердцевины, содержащей флибансерин в полиморфной модифика-1 007185 ции А, эндотермический максимум которой по данным ДСК-анализа приходится на температуру 161 С,в смеси по меньшей мере с одним фармацевтически приемлемым вспомогательным веществом, и пленочного покрытия, в которое заключена эта сердцевина. Содержание полиморфной модификации А флибансерина в сердцевине предлагаемых в изобретении таблеток с пленочным покрытием (филмтаблеток) составляет от 1 до 50 мас.%, предпочтительно от 5 до 45 мас.%, наиболее предпочтительно примерно от 10 до 40 мас.%, в пересчете на общую массу сердцевины. В особенно предпочтительном варианте содержание полиморфной модификации А флибансерина составляет от 15 до 35 мас.%, более предпочтительно от 17 до 32 мас.%, в пересчете на общую массу сердцевины. Сердцевина таблетки, в виде которой представлена предлагаемая в изобретении фармацевтическая композиция, помимо флибансерина в полиморфной модификации А содержит по меньшей мере одно вспомогательное вещество в качестве наполнителя/сухого связующего. В качестве примера типичных наполнителей, которые могут использоваться в предлагаемой в изобретении фармацевтической композиции, можно назвать моногидрат лактозы как в виде тонкоизмельченного материала или модифицированной лактозы, такой как лактоза распылительной сушки, так и в виде агломерированной лактозы (таблеттозы), безводную лактозу, микрокристаллическую целлюлозу,двухосновный фосфат кальция, кукурузный крахмал, сахароспирты, такие как маннит и сорбит, и их смеси. Наполнитель, включаемый в состав предлагаемой в изобретении фармацевтической композиции,предпочтительно выбирать из группы, включающей лактозу различных типов, микрокристаллическую целлюлозу, кукурузный крахмал, сахароспирты и их смеси. Более предпочтительно выбирать используемый в предлагаемой в изобретении фармацевтической композиции наполнитель из группы, включающей лактозу различных типов, микрокристаллическую целлюлозу и их смеси. При использовании лактозы в качестве наполнителя ее предпочтительно применять в форме ее моногидрата в виде тонкоизмельченного материала (проходящего, например, через сито 200 меш). Сердцевина предлагаемой в изобретении таблетки с пленочным покрытием может также содержать обеспечивающие связывание ингредиентов в сухом состоянии связующие и/или обеспечивающие связывание ингредиентов во влажном состоянии связующие, такие как повидон (например, коллидон K 25),коповидон (например, коллидон VA 64), гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза,кукурузный крахмал и их смеси. В предпочтительном варианте связующее выбирают из группы, включающей повидон, гидроксипропилметилцеллюлозу, гидроксипропилэтилцеллюлозу, гидроксипропилцеллюлозу и их смеси. Более предпочтительно использовать в качестве связующего гидроксипропилметилцеллюлозу. При использовании гидроксипропилметилцеллюлозы (ГПМЦ) особый интерес представляет применение ГПМЦ-полимеров USP2910 и USP2208, таких, например, как метоцел Е 5, Е 4 М, Е 15 М(К 15 М и К 100 М), выпускаемых, в частности, компанией Dow Chemical Company. В приведенных выше аббревиатурах обозначение "Е" соответствует USP2910, а обозначение "K" соответствует USP2208. Числа в обозначении соответствующего материала указывают на его вязкость в 2%-ном водном растворе(например, "5" соответствует вязкости, равной 5 сП, а "15 М" соответствует вязкости, равной 15000 сП). Содержание наполнителя в сердцевине предлагаемых в изобретении таблеток с пленочным покрытием предпочтительно составляет от 50 до 99 мас.%, более предпочтительно от 55 до 95 мас.%, наиболее предпочтительно от 60 до 90 мас.%, в пересчете на общую массу сердцевины. В особенно предпочтительном варианте суммарное содержание наполнителя составляет от 65 до 85 мас.%, более предпочтительно от 68 до 80 мас.%, в пересчете на общую массу сердцевины. В предпочтительном варианте сердцевина таблетки предлагаемого в изобретении состава содержит флибансерин в полиморфной модификации А в смеси с моногидратом лактозы в качестве фармацевтически приемлемого вспомогательного вещества. В более предпочтительном варианте сердцевина таблетки предлагаемого в изобретении состава содержит флибансерин в полиморфной модификации А в смеси с моногидратом лактозы и микрокристаллической целлюлозой в качестве фармацевтически приемлемых вспомогательных веществ. В таблетках предлагаемого в изобретении состава, содержащих смесь моногидрата лактозы и микрокристаллической целлюлозы в качестве наполнителей (или фармацевтически приемлемых вспомогательных веществ), соотношение между моногидратом лактозы и микрокристаллической целлюлозой составляет, например, от примерно 15:1 до примерно 1:5, предпочтительно от примерно 10:1 до примерно 1:3, более предпочтительно от примерно 6:1 до примерно 1:1. В другом предпочтительном варианте осуществления изобретения таблетка предлагаемого в нем состава содержит флибансерин в полиморфной модификации А в смеси с моногидратом лактозы, микрокристаллической целлюлозой и ГПМЦ в качестве фармацевтически приемлемых вспомогательных веществ. В наиболее предпочтительных предлагаемых в изобретении композициях, содержащих смесь моногидрата лактозы, микрокристаллической целлюлозы и ГПМЦ в качестве наполнителей/связующих(или фармацевтически приемлемых вспомогательных веществ), количество моногидрата лактозы составляет, например, от 50 до 95 мас.%, предпочтительно от 60 до 90 мас.%, более предпочтительно примерно от 65 до 85 мас.%, в пересчете на общую массу наполнителя/связующего, используемых для получения сердцевины. В особенно предпочтительном варианте таблетки подобного состава содержат моногидрат-2 007185 лактозы в количестве примерно от 70 до 80 мас.% в пересчете на общую массу наполнителя/связующего,используемых для получения сердцевины. В наиболее предпочтительных предлагаемых в изобретении композициях, содержащих смесь моногидрата лактозы, микрокристаллической целлюлозы и ГПМЦ в качестве наполнителей/связующих (или фармацевтически приемлемых вспомогательных веществ), количество микрокристаллической целлюлозы составляет, например, от 5 до 45 мас.%, предпочтительно от 15 до 35 мас.%, более предпочтительно примерно от 20 до 30 мас.%, в пересчете на общую массу наполнителя/связующего, используемых для получения сердцевины. В особенно предпочтительном варианте таблетки подобного состава содержат микрокристаллическую целлюлозу в количестве примерно от 22 до 28 мас.% в пересчете на общую массу наполнителя/связующего, используемых для получения сердцевины. В наиболее предпочтительных предлагаемых в изобретении композициях, содержащих смесь моногидрата лактозы, микрокристаллической целлюлозы и ГПМЦ в качестве наполнителей/связующих (или фармацевтически приемлемых вспомогательных веществ), количество ГПМЦ составляет, например, от 0,5 до 5 мас.%, предпочтительно от 1,0 до 4,5 мас.%, в пересчете на общую массу наполнителя/связующего, используемых для получения сердцевины. В особенно предпочтительном варианте таблетки подобного состава содержат ГПМЦ в количестве примерно от 1 до 3 мас.% в пересчете на общую массу наполнителя/связующего, используемых для получения сердцевины. Сердцевина предлагаемой в изобретении таблетки с пленочным покрытием в дополнение к упомянутым выше ингредиентам может содержать также разрыхлители. В контексте настоящего изобретения подобные разрыхлители при определенных условиях могут быть также известны как способствующие распаду таблеток агенты. Такие вещества согласно изобретению предпочтительно выбирают из группы,включающей натрийкрахмалгликолят, кросповидон, натриевую соль кроскармеллозы, натрийкарбоксиметилцеллюлозу, высушенный кукурузный крахмал и их смеси. Наиболее предпочтительно согласно изобретению использовать натрийкрахмалгликолят, кросповидон, натрийкарбоксиметилцеллюлозу и натриевую соль кроскармеллозы, предпочтительно натриевую соль кроскармеллозы. При использовании вышеуказанных разрыхлителей их массовое количество в пересчете на общую массу сердцевины предлагаемой в изобретении таблетки с пленочным покрытием составляет, например, примерно от 0,1 до 10 мас.%, предпочтительно примерно от 0,5 до 5 мас.%, более предпочтительно примерно от 1 до 3 мас.%. Сердцевина предлагаемой в изобретении таблетки с пленочным покрытием может также содержать в качестве дополнительных ингредиентов регуляторы текучести. В качестве примера таких регуляторов текучести, которые могут использоваться в соответствии с изобретением, можно назвать диоксид кремния, тальк, стеарат магния и их смеси. Согласно изобретению предпочтительно использовать диоксид кремния, наиболее предпочтительно в коллоидной, высокодисперсной форме. При использовании вышеуказанных регуляторов текучести их массовое количество в пересчете на общую массу сердцевины предлагаемой в изобретении таблетки с пленочным покрытием предпочтительно составляет примерно от 0,1 до 5 мас.%, более предпочтительно примерно от 0,3 до 2 мас.%, наиболее предпочтительно от 0,4 до 1,5 мас.%. Сердцевина предлагаемой в изобретении таблетки с пленочным покрытием может также содержать в качестве дополнительных ингредиентов повышающие текучесть добавки, смазывающие вещества и смазку для отделения от формы или антиадгезивы. В качестве примера таких материалов, которые могут использоваться в соответствии с изобретением, можно назвать стеариновую кислоту, стеарат магния,стеарат кальция, стеарилфумарат натрия, трибегенат глицерина, тальк и их смеси. Согласно изобретению предпочтительно использовать стеариновую кислоту и стеарат магния. При использовании одного или нескольких вышеуказанных ингредиентов его(их) массовое количество предпочтительно составляет примерно от 0,01 до 5 мас.%, более предпочтительно примерно от 0,05 до 3 мас.%, наиболее предпочтительно примерно от 0,1 до 2 мас.%, в пересчете на общую массу сердцевины предлагаемой в изобретении таблетки с пленочным покрытием. При использовании, прежде всего, стеарата магния его количество предпочтительно составляет примерно от 0,2 до 1,5 мас.% в пересчете на общую массу сердцевины таблетки с пленочным покрытием. Пленочное покрытие, в которое заключена сердцевина предлагаемыхв изобретении таблеток, содержит по меньшей мере один пленкообразователь, выбранный из группы веществ, включающей гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксиметилцеллюлозу,гидроксиэтилцеллюлозу и сополимер этилакрилата и метилметакрилата, в качестве которого может использоваться, например, эудрагит NE 30 D. В другом варианте можно использовать, например, эудрагитRL 30 D или эудрагит Е 12.5. Указанные выше ингредиенты в некоторых случаях можно также использовать в виде их смесей. К предпочтительным пленкообразователям относятся гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, гидроксиметилцеллюлоза и гидроксиэтилцеллюлоза, среди которых в предлагаемых в изобретении таблетках наиболее предпочтительно использовать в качестве пленкообразователей гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу. Вышеуказанные пленкообразователи можно использовать по отдельности либо в виде их смесей. При использовании только одного из перечисленных выше пленкообразователей в качестве такового особенно предпочтительно согласно изобретению применять гидроксипропилметилцеллюлозу. Массовое количество пленкообразо-3 007185 вателей в пересчете на общую массу пленочного покрытия предлагаемой в изобретении таблетки предпочтительно составляет примерно от 20 до 95 мас.%, более предпочтительно от 30 до 90 мас.%. Пленочное покрытие, в которое заключена сердцевина таблетки, может также содержать эмульгаторы и/или пластификаторы, такие, например, как полиэтиленгликоль, глицерин и пропиленгликоль,необязательно в виде их смесей. В качестве пластификаторов предпочтительно использовать полиэтиленгликоли. Не ограничивающими объем изобретения примерами наиболее предпочтительных полиэтиленгликолей служат полиэтиленгликоль 400 и полиэтиленгликоль 6000. В контексте настоящего изобретения термин "макрогол" должен рассматриваться как эквивалентный термину "полиэтиленгликоль". Указанные выше числа 400 и 6000 соответствуют средней молекулярной массе используемого полиэтиленгликоля. Массовое количество пластификатора в пересчете на общую массу пленочного покрытия предлагаемой в изобретении таблетки предпочтительно составляет примерно от 1 до 50 мас.%, более предпочтительно от 5 до 40 мас.%, наиболее предпочтительно от 10 до 30 мас.%. В предпочтительном варианте количество пластификатора составляет примерно от 10 до 25 мас.%, более предпочтительно примерно от 12 до 18 мас.%, в пересчете на общую массу пленочного покрытия таблетки. Пленочное покрытие предлагаемой в изобретении таблетки может также содержать красители и окрашивающие вспомогательные вещества. В качестве примера при этом можно назвать оксид железа, диоксид титана, тальк и их смеси. При использовании талька его количество составляет, в частности, примерно от 5 до 50 мас.%, предпочтительно от 10 до 40 мас.%, наиболее предпочтительно от 15 до 30 мас.%, в пересчете на общую массу пленочного покрытия таблетки. В предпочтительном варианте количество талька составляет примерно от 15 до 20 мас.% в пересчете на общую массу пленочного покрытия таблетки. При использовании диоксида титана его количество составляет, в частности, примерно от 5 до 55 мас.%,предпочтительно от 10 до 40 мас.%, наиболее предпочтительно от 15 до 35 мас.%, в пересчете на общую массу пленочного покрытия таблетки. В предпочтительном варианте количество диоксида титана составляет примерно от 20 до 30 мас.% в пересчете на общую массу пленочного покрытия таблетки. При использовании оксида железа его количество составляет, в частности, примерно от 0,1 до 5 мас.%, предпочтительно примерно от 0,25 до 3 мас.%, более предпочтительно примерно от 0,5 до 1,5 мас.%, в пересчете на общую массу пленочного покрытия таблетки. В особенно предпочтительном варианте пленочное покрытие, в которое заключена сердцевина предлагаемой в изобретении таблетки, содержит гидроксипропилметилцеллюлозу, полиэтиленгликоль и диоксид титана. В другом варианте осуществления изобретения пленочное покрытие, в которое заключена сердцевина предлагаемой в изобретении таблетки, содержит гидроксипропилметилцеллюлозу, полиэтиленгликоль, диоксид титана и тальк. В следующем варианте осуществления изобретения пленочное покрытие, в которое заключена сердцевина предлагаемой в изобретении таблетки, содержит гидроксипропилметилцеллюлозу, полиэтиленгликоль, диоксид титана, тальк и оксиды железа, предпочтительно красный оксид железа. Предлагаемую в изобретении фармацевтическую композицию можно получать способом, который подробно рассмотрен в последующем описании в разделе, посвященном экспериментальной части. С учетом фармацевтической эффективности флибансерина еще одним объектом настоящего изобретения является применение предлагаемых в нем композиций, содержащих флибансерин в полиморфной модификации А, в качестве лекарственного средства. Следующим объектом настоящего изобретения является применение предлагаемых в нем композиций, содержащих флибансерин в полиморфной модификации А, для лечения заболеваний, при которых применение соединений, обладающих сродством к 5-HT1A- и 5-НТ 2-рецепторам, может оказывать эффективное терапевтическое действие. Еще одним объектом настоящего изобретения является применение предлагаемых в нем композиций, содержащих флибансерин в полиморфной модификации А, для лечения заболевания, выбранного из группы, включающей депрессию, шизофрению, болезнь Паркинсона, состояния тревоги, нарушения сна,сексуальные и психические расстройства и возрастные нарушения памяти. Настоящее изобретение относится, в частности, к применению предлагаемых в нем композиций,содержащих флибансерин в полиморфной модификации А, для лечения расстройств полового влечения. В предпочтительном варианте настоящее изобретение относится к применению предлагаемых в нем композиций, содержащих флибансерин в полиморфной модификации А, для лечения нарушений и расстройств, выбранных из группы, включающей гипоактивное половое влечение, потерю полового влечения, отсутствие полового влечения, снижение полового влечения, подавление полового влечения, потерю либидо, нарушение либидо и фригидность. Наиболее предпочтительным является согласно изобретению применение предлагаемых в нем композиций, содержащих флибансерин в полиморфной модификации А, для лечения нарушений и расстройств, выбранных из группы, включающей гипоактивное половое влечение, потерю полового влечения, отсутствие полового влечения, снижение полового влечения и подавление полового влечения. В особо предпочтительном варианте изобретение относится к применению предлагаемых в нем композиций, содержащих флибансерин в полиморфной модификации А, для лечения нарушений и расстройств,выбранных из группы, включающей гипоактивное половое влечение и потерю полового влечения.-4 007185 Еще одним объектом настоящего изобретения является способ лечения заболеваний, при которых применение соединений, обладающих сродством к 5-HT1A- и 5-НТ 2-рецепторам, может оказывать эффективное терапевтическое действие, заключающийся во введении в организм предлагаемых в изобретении композиций, содержащих флибансерин в полиморфной модификации А. Следующим объектом настоящего изобретения является способ лечения заболевания, выбранного из группы, включающей депрессию, шизофрению, болезнь Паркинсона, состояния тревоги, нарушения сна, сексуальные и психические расстройства и возрастные нарушения памяти, заключающийся во введении в организм предлагаемых в изобретении композиций, содержащих флибансерин в полиморфной модификации А. В настоящем изобретении предлагается, в частности, способ лечения расстройств полового влечения, заключающийся во введении в организм предлагаемых в изобретении композиций, содержащих флибансерин в полиморфной модификации А. В предпочтительном варианте в изобретении предлагается способ лечения нарушений и расстройств, выбранных из группы, включающей гипоактивное половое влечение, потерю полового влечения, отсутствие полового влечения, снижение полового влечения, подавление полового влечения, потерю либидо, нарушение либидо и фригидность, заключающийся во введении в организм предлагаемых в изобретении композиций, содержащих флибансерин в полиморфной модификации А. В наиболее предпочтительном варианте осуществления изобретения в нем предлагается способ лечения нарушений и расстройств, выбранных из группы, включающей гипоактивное половое влечение,потерю полового влечения, отсутствие полового влечения, снижение полового влечения и подавление полового влечения, заключающийся во введении в организм предлагаемых в изобретении композиций,содержащих флибансерин в полиморфной модификации А. В особенно предпочтительном варианте осуществления изобретения в нем предлагается способ лечения нарушений и расстройств, выбранных из группы, включающей гипоактивное половое влечение и потерю полового влечения, заключающийся во введении в организм предлагаемых в изобретении композиций, содержащих флибансерин в полиморфной модификации А. Упомянутый выше терапевтический эффект от применения предлагаемых в изобретении композиций, содержащих флибансерин в полиморфной модификации А, может в одинаковой степени проявляться и при лечении мужчин, и при лечении женщин. Однако в соответствии еще с одним объектом настоящего изобретения предпочтительным является применение предлагаемых в нем композиций, содержащих флибансерин в полиморфной модификации А, для лечения сексуальной дисфункции у женщин. Положительный эффект от применения предлагаемых в изобретении композиций, содержащих флибансерин в полиморфной модификации А, можно наблюдать вне зависимости от того, является ли то или иное расстройство или нарушение врожденным или же приобретенным, а также вне зависимости от его этиологии (обусловлено ли оно органическими факторами, к которым относятся и физические, и индуцированные лекарствами факторы, психогенными факторами, сочетанием органических факторов, к которым относятся и физические, и индуцированные лекарствами факторы, и психогенных факторов или же неустановленными факторами). Ниже изобретение проиллюстрировано на примерах. В этих примерах рассмотрены некоторые предпочтительные варианты осуществления изобретения. Очевидно, однако, что объем настоящего изобретения не ограничен рассмотренными в приведенных ниже примерах конкретными вариантами его осуществления. Синтез флибансерина в полиморфной модификации А В реактор, содержащий 2500 кг воды и 200 кг 45%-ного водного гидроксида натрия, загружают 375 кг 1-[(3-трифторметил)фенил]-4-(2-хлорэтил)пиперазина. Затем при перемешивании добавляют 169,2 кг 1(2-пропенил)-1,3-дигидробензимидазол-2 Н-она, 780 кг изопропанола, 2000 кг воды и 220 кг 45%-ного водного гидроксида натрия. Реакционную смесь нагревают до 75-85 С и добавляют 160 кг концентрированной соляной кислоты и 200 кг воды. Реакционную смесь перемешивают при постоянной температуре в течение примерно 45 мин. Осадок, полученный после отгонки смеси воды и изопропанола (около 3000 кг),охлаждают до температуры приблизительно 65-75 С и его значение рН устанавливают на 6,5-7,5 добавлением 125 кг 45%-ного водного гидроксида натрия. После охлаждения остатка до температуры примерно 45-50 С его значение рН устанавливают на 8-9 добавлением примерно 4 кг 45%-ного водного гидроксида натрия. Затем реакционную смесь охлаждают до 30-35 С и центрифугируют. Полученный в результате остаток промывают 340 л воды и 126 л изопропанола, а затем водой до полного удаления хлоридов. Влажный продукт сушат в вакууме при температуре порядка 45-55 С, получая 358 кг сырого флибансерина в виде его полиморфной модификации А. Полученный таким путем сырой продукт загружают в реактор, содержащий 1750 кг ацетона, и полученную смесь при перемешивании нагревают с обратным холодильником. Затем полученный раствор фильтруют и фильтрат концентрируют перегонкой. Далее в течение примерно 1 ч температуру поддерживают на уровне 0-5 С, после чего выпавшее в осадок твердое вещество отделяют фильтрацией и сушат при 55 С в течение по меньшей мере 12 ч. Окончательный выход чистого флибансерина в полиморфной модификации А составляет 280 кг.-5 007185 Определение характеристик флибансерина в полиморфной модификации А Характеристики полиморфной модификации А флибансерина определяли с помощью ДСК (дифференциальная сканирующая калориметрия). По данным ДСК-анализа, эндотермический максимум для флибансерина в полиморфной модификации А приходится на температуру примерно 161 С. Для определения характеристик полиморфной модификации А флибансерина с помощью ДСК использовали систему Mettler ТА 3000, оснащенную процессором ТС 10-А и ячейкой DSC 20. Данные получали при скорости нагрева 10 K/мин. Характеристики полиморфной модификации А флибансерина определяли также рентгеновской порошковой дифрактометрией. Порошковую рентгенограмму полиморфной модификации А получали с использованием следующих условий. Оборудование: дифрактометр Philips PW 1800/10, оснащенный цифровым компьютером Micro Vax 2000. Установочные параметры при рентгеноструктурном анализе: Тип трубки: Сu (длинная острая фокусировка) Длины волн :K2=1,544390,500 Соотношение интенсивностей (2/1): 2,000 Начальный угол [2]: 60,000 Конечный угол [2]: 0,020 Шаг сканирования [2]: Максимальная интенсивность [с]: 7310,250 Режим сканирования: непрерывный Минимальная ширина пика у вершины: 0,00 Максимальная ширина пика у вершины: 1,00 Базовая ширина пика: 2,00 Минимальная значимость: 0,75 Количество пиков: 69 Генератор: Высокое напряжение: Сила тока на трубке: Значения параметров, соответствующие рентгенограмме, полученной для полиморфной модификации А, приведены ниже в табл. 1. Таблица 1-7 007185 Изготовление содержащих флибансерин таблеток с пленочным покрытием А) Используемое оборудование. Для получения предлагаемой в изобретении фармацевтической композиции использовали следующее оборудование: смесительный резервуар с мешалкой Ekato и гомогенизатор типа Ultra Тurrах для получения жидкости для гранулирования и суспензии для нанесения пленочного покрытия соответственно,смеситель с высоким сдвиговым усилием/гранулятор (например, Diosna P 400),просеивающая машина для мокрого просеивания (например, Alexanderwerk),сушилка с псевдоожиженным слоем (например, Glatt WSG 15),просеивающая машина для сухого просеивания (например, Quadro Comil AS 197),смеситель со свободным падением перемешиваемого материала (например, Servolift 120 1 или контейнерный смеситель),ротационная таблетировочная машина (например, Fette P 1200),машина для нанесения покрытий (например, Glatt GC 1250). Б) Описание процесса изготовления таблеток. На первой стадии приготавливают жидкость для влажного гранулирования. С этой целью в соответствующий смесительный резервуар заливают очищенную воду и нагревают ее примерно до 80 С. После этого примешивают гипромеллозу (метоцел Е 5 Prem) и/или дополнительные связующие компоненты,обеспечивающие связывание ингредиентов во влажном состоянии, и полученную дисперсию охлаждают до комнатной температуры. При необходимости жидкость оставляют стоять на ночь (для завершения растворения/уменьшения пенообразования) и перемешивают перед дальнейшим использованием. Любое уменьшение массы (или объема) жидкости компенсируют добавлением очищенной воды. Содержание сухого вещества (доля твердого вещества) в такой жидкости для гранулирования предпочтительно составляет от 4 до 6%. Для процесса гранулирования в смеситель последовательно загружают тонкоизмельченный и просеянный моногидрат лактозы, необходимое количество флибансерина в полиморфной модификации А(зависящее от предусмотренной дозировки) в микронизированном виде и микрокристаллическую целлюлозу (авицел РН 101) и перемешивают до гомогенности в течение примерно 4 мин с помощью лопастной мешалки и измельчающих лопастей. После этого либо вручную, либо через разбрызгивающие сопла добавляют жидкость для гранулирования и полученную влажную массу гранулируют в течение примерно 2-3 мин, вновь используя лопастную мешалку и измельчающие лопасти. После выгрузки из смесителя с высоким сдвиговым усилием/гранулятора влажные гранулы для дробления крупных агломератов просеивают во влажном состоянии через сито с размером отверстий 3,0 мм. Просеянный во влажном состоянии материал переносят в обычную сушилку с псевдоожиженным слоем (или в другом варианте в тарельчатую сушилку) и сушат в потоке воздуха с температурой на входе, равной примерно 100 С, до снижения температуры отходящего воздуха (или в другом варианте до повышения температуры продукта) примерно до 50 С (45-55 С). Остаточная влажность гранулята после сушки должна лежать в интервале от 0,5 до 1,5%. Высушенные гранулы затем просеивают в сухом состоянии с помощью просеивающей машины Comil, используя сито терочного типа с размером отверстий 2 мм. В завершение просеянный гранулят загружают в соответствующий смеситель со свободным падением перемешиваемых компонентов,например в контейнерный смеситель, добавляют поперечно-сшитую натрийкарбоксиметилцеллюлозу(натриевую соль кроскармеллозы, торговое наименование Ac-Di-Sol) и стеарат магния и все эти компоненты перемешивают при скорости 10 об/мин в течение 10-20 мин, предпочтительно в течение 15 мин,до образования гомогенной смеси. Из полученной смеси в соответствующей таблетировочной машине (например, в ротационной таблетировочной машине) прессуют таблетки заданной массы, зависящей от требуемой дозировки флибансерина, используя соответствующие пуансон и матрицу (например, при изготовлении таблеток с содержанием действующего вещества 50 мг используют круглые пуансон и матрицу диаметром 9 мм с вогнутыми рабочими поверхностями с выступающими скошенными краями для образования фасеток у прессуемых таблеток или же при изготовлении таблеток с содержанием действующего вещества 100 мг используют пуансон и матрицу продолговатой формы размером 14 х 6,8 мм). Для обеспечения необходимого профиля растворения лекарственного средства и получения продукта с требуемыми свойствами твердость материала, из которого изготовлены пуансон и матрица, должна отвечать установленным для их различных типоразмеров техническим условиям. Поскольку лекарственное вещество флибансерин имеет горький вкус и в некоторой степени чувствительно к воздействию света, на сердцевины таблеток для получения стабильного и не вызывающего неприятных ощущений у конечного потребителя продукта целесообразно наносить защитное пленочное покрытие. С этой целью сначала приготавливают суспензию для нанесения покрытия, для чего в соответствующий смесительный резервуар заливают очищенную воду, в которой путем интенсивного перемешивания с помощью высокоскоростной мешалки растворяют полиэтиленгликоль 6000, а затем гидроксипропилметилцеллюлозу. На следующей стадии к полученному раствору пленкообразующего полимера добавляют водную суспензию диоксида титана, талька и красного оксида железа (который использу-8 007185 ют при необходимости придать пленочному покрытию таблеток соответствующий цвет) и всю эту смесь перемешивают. Содержание сухого вещества в такой суспензии для нанесения покрытия составляет от 10 до 15%, предпочтительно примерно от 12 до 13%. После этого полученные ранее сердцевины таблеток загружают в соответствующую машину для нанесения покрытий (например, в машину типа Accela Cota с котлом диаметром 36" или в машину типаGlatt GC 1250 Coater с перфорированным котлом и с верхним расположением системы разбрызгивающих сопел) и предварительно нагревают до температуры порядка 50 С. После повышения температуры продукта до этого уровня на сердцевины с помощью одного или нескольких разбрызгивающих сопел набрызгивают суспензию для нанесения покрытия при давлении распыления примерно 2 бара, расходе разбрызгиваемой суспензии примерно 4 кг/ч (при использовании машины типа Accela Cota) и при температуре воздуха на входе порядка 60-85 С. Следует отметить, что для получения высококачественного пленочного покрытия в процессе разбрызгивания суспензии для нанесения покрытия важное значение имеет контроль температуры продукта и ее поддержание в пределах от 48 до 52 С. По завершении этого процесса разбрызгивания таблетки с нанесенным на них пленочным покрытием до их выгрузки из машины для нанесения покрытий охлаждают до температуры порядка 30 С. Общая продолжительность процесса нанесения пленочного покрытия на сердцевины таблеток составляет от 2 до 3 ч. После выполнения всех процедур, связанных с проверкой качества продукции, осуществляемой в том числе и в ходе технологического процесса, таблетки с пленочным покрытием, навалом ссыпаемые после их изготовления в соответствующий приемник, готовы к первичной расфасовке в соответствующие упаковки, в которых они поставляются в продажу (например, в блистерные упаковки из поливинилхлорида/поливинилиденхлорида или в пузырьки из полиэтилена высокой плотности). Аналогично описанному выше методу изготавливали также таблетки с пленочным покрытием указанного ниже состава. Пример 1. Состав таблетки. Сердцевина. Компоненты Кол-во в мг на одну таблетку Флибансерин в полиморфной модификации А 25,000 Моногидрат лактозы 71,720 Микрокристаллическая целлюлоза 23,905 ГПМЦ (метоцел Е 5) 1,250 Натрийкарбоксиметилцеллюлоза 2,500 Стеарат магния 0,625 Покрытие. Компоненты ГПМЦ (метоцел Е 5) Полиэтиленгликоль 6000 Диоксид титана Тальк Красный оксид железа Общая масса таблетки с пленочным покрытием Кол-во в мг на одну таблетку 1,440 0,420 0,600 0,514 0,026 128,000 Пример 2. Состав таблетки. Сердцевина. Компоненты Флибансерин в полиморфной модификации А Моногидрат лактозы Микрокристаллическая целлюлоза ГПМЦ (например, фармакоат 606) Натрийкарбоксиметилцеллюлоза Стеарат магния Кол-во в мг на одну таблетку 50,000 143,440 47,810 2,500 5,000 1,250 Покрытие. Компоненты ГПМЦ (например фармакоат 606) Полиэтиленгликоль 6000 Диоксид титана Тальк Красный оксид железа Общая масса таблетки с пленочным покрытием-9 Кол-во в мг на одну таблетку 2,400 0,700 1,000 0,857 0,043 255,000 007185 Пример 3. Состав таблетки. Сердцевина. Компоненты Флибансерин в полиморфной модификации А Моногидрат лактозы Микрокристаллическая целлюлоза ГПМЦ (например, метоцел Е 5) Натрийкарбоксиметилцеллюлоза Стеарат магния Кол-во в мг на одну таблетку 100,000 171,080 57,020 3,400 6,800 1,700 Покрытие. Компонент ГПМЦ (например метоцел Е 5) Полиэтиленгликоль 6000 Диоксид титана Тальк Красный оксид железа Общая масса таблетки с пленочным покрытием Кол-во в мг на одну таблетку 3,360 0,980 1,400 1,200 0,060 347,000 Пример 4. Состав таблетки. Сердцевина. Компоненты Флибансерин в полиморфной модификации А Двухосновный фосфат кальция, безводный Микрокристаллическая целлюлоза ГПМЦ (метоцел Е 5) Натрийкарбоксиметилцеллюлоза Коллоидный диоксид кремния Стеарат магния Кол-во в мг на одну таблетку 2,000 61,010 61,010 1,950 2,600 0,650 0,780 Покрытие. Компоненты ГПМЦ (метоцел Е 5) Полиэтиленгликоль 6000 Диоксид титана Тальк Красный оксид железа Общая масса таблетки с пленочным покрытием Кол-во в мг на одну таблетку 1,440 0,420 0,600 0,514 0,026 133,000 Пример 5. Состав таблетки. Сердцевина. Компоненты Флибансерин в полиморфной модификации А Двухосновный фосфат кальция, безводный Микрокристаллическая целлюлоза ГПМЦ (например метоцел Е 5) Натрийкарбоксиметилцеллюлоза Коллоидный диоксид кремния Стеарат магния Кол-во в мг на одну таблетку 100,000 69,750 69,750 2,750 5,000 1,250 1,500 Покрытие. Компоненты ГПМЦ (например метоцел Е 5) Полиэтиленгликоль 6000 Диоксид титана Тальк Общая масса таблетки с пленочным покрытием- 10 Кол-во в мг на одну таблетку 2,400 0,700 1,043 0,857 255,000 007185 Пример 6. Состав таблетки. Сердцевина. Компоненты Флибансерин в полиморфной модификации А Моногидрат лактозы Микрокристаллическая целлюлоза Гидроксипропилцеллюлоза (например клуцел LF) Натрийкрахмалгликолят Стеарат магния Кол-во в мг на одну таблетку 20,000 130,000 43,100 1,900 4,000 1,000 Покрытие. Компоненты ГПМЦ (например метоцел Е 5) Полиэтиленгликоль 6000 Диоксид титана Тальк Общая масса таблетки с пленочным покрытием Кол-во в мг на одну таблетку 2,400 0,700 1,043 0,857 205,000 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для перорального применения в виде таблетки, состоящей из сердцевины, содержащей флибансерин в полиморфной модификации А, эндотермический максимум которой по данным анализа дифференциальной сканирующей калориметрией приходится на температуру 161 С, в смеси по меньшей мере с одним фармацевтически приемлемым вспомогательным веществом, и пленочного покрытия, в которое заключена эта сердцевина. 2. Фармацевтическая композиция по п.1, отличающаяся тем, что фармацевтически приемлемое вспомогательное вещество представляет собой наполнитель, выбранный из группы, включающей моногидрат лактозы как в виде тонкоизмельченного материала или модифицированной лактозы, такой как лактоза распылительной сушки, так и в виде агломерированной лактозы (таблеттозы), безводную лактозу, микрокристаллическую целлюлозу, двухосновный фосфат кальция, кукурузный крахмал, сахароспирты и их смеси. 3. Фармацевтическая композиция по п.1 или 2, отличающаяся тем, что содержание полиморфной модификации А флибансерина составляет от 1 до 50 мас.% в пересчете на общую массу сердцевины. 4. Фармацевтическая композиция по пп.1, 2 или 3, отличающаяся тем, что содержание наполнителя в сердцевине составляет от 50 до 99 мас.% в пересчете на общую ее массу. 5. Фармацевтическая композиция по пп.1, 2, 3 или 4, отличающаяся тем, что сердцевина дополнительно содержит связующее, выбранное из группы, включающей повидон, коповидон, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, кукурузный крахмал и их смеси. 6. Фармацевтическая композиция по любому из пп.1-5, отличающаяся тем, что сердцевина дополнительно содержит разрыхлитель, выбранный из группы, включающей натрийкрахмалгликолят, кросповидон, натриевую соль кроскармеллозы, натрийкарбоксиметилцеллюлозу, высушенный кукурузный крахмал и их смеси. 7. Фармацевтическая композиция по любому из пп.1-6, отличающаяся тем, что сердцевина дополнительно содержит регуляторы текучести, смазывающие вещества и смазку для отделения от формы или антиадгезивы из группы веществ, включающей диоксид кремния, тальк, стеарат магния и их смеси. 8. Фармацевтическая композиция по любому из пп.1-7, отличающаяся тем, что пленочное покрытие, в которое заключена сердцевина, содержит по меньшей мере один пленкообразователь из группы веществ, включающей гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу,гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу и сополимер этилакрилата и метилметакрилата. 9. Применение содержащей флибансерин в полиморфной модификации А композиции по любому из пп.1-8 для лечения заболеваний, при которых применение соединений, проявляющих сродство к 5HT1A- и 5-НТ 2-рецептору, может оказывать положительное терапевтическое действие. 10. Применение по п.9, отличающееся тем, что заболевание выбрано из группы, включающей депрессию, шизофрению, болезнь Паркинсона, состояние тревоги или страха, нарушения сна, половые и психические расстройства и возрастные нарушения памяти.
МПК / Метки
МПК: A61K 9/20, A61P 25/28, A61P 15/00, A61K 31/496, A61P 25/16
Метки: модификации, новые, композиции, флибансерин, фармацевтические, полиморфной, содержащие
Код ссылки
<a href="https://eas.patents.su/12-7185-novye-farmacevticheskie-kompozicii-soderzhashhie-flibanserin-v-polimorfnojj-modifikacii-a.html" rel="bookmark" title="База патентов Евразийского Союза">Новые фармацевтические композиции, содержащие флибансерин в полиморфной модификации а</a>
Предыдущий патент: Производные пиразола для лечения инфекции вируса иммунодефицита человека (вич)
Следующий патент: Производные 3-(4-амидопиррол-2-илметилиден)-2-индолинона в качестве ингибиторов протеинкиназ
Случайный патент: Верхняя крышка банок для напитков с открывателем, объединенным с гигиенической накладкой