Замещенные производные алкиламинопиридазинона, способ их получения и содержащие их фармацевтические композиции
Номер патента: 6942
Опубликовано: 30.06.2006
Авторы: Леваи Дьёрди, Гачальи Иштван, Вельман Янош, Шмидт Эва, Сенаши Габор, Харшинг Ласло Габор, Котаи Надь Петер, Миклошне Ковач Анико, Эдьед Андраш, Компагне Хайналка, Баркоци Йожеф, Мартонне Марко Бернадетт, Шимиг Дьюла, Левелеки Чилла
Формула / Реферат
Соединения общей формулы I

где R1 представляет собой водород или алкил, содержащий 1-4 атома углерода;
X представляет собой водород или галоген,
R2 представляет собой водород или алкил, содержащий 1-4 атомов углерода;
n - 1, 2 или 3;
Q и W независимо друг от друга представляют собой -N= или -CH=; и
R4 и R5 независимо друг от друга представляют собой водород, галоген, трифторметил или алкокси, содержащий 1-4 атома углерода,
и их фармацевтически приемлемые кислотные аддитивные соли.
2. Соединения общей формулы I по п.1, где
R1 представляет собой водород;
X представляет собой водород;
n равно 1;
Q и W независимо друг от друга представляют собой -N= или -CH=; и
R4 и R5 независимо друг от друга представляют собой водород, хлор, фтор, трифторметил или метокси,
и их фармацевтически приемлемые кислотные аддитивные соли.
3. 5-{2-[4-(метокситрифторметилфенил)пиперазин-1-ил]этиламино}-2Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли.
4. 5-{2-[4-(2-фторфенил)пиперазин-1-ил]этиламино}-2Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли.
5. 5-{2-[4-фенилпиперазин-1-ил]этиламино}-2Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли.
6. 5-[2-(4-пиридин-2-илпиперазин-1-ил)этиламино]-2Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли.
7. 5-[2-(4-пиримидин-2-илпиперазин-1-ил)этиламино]-2Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли.
8. 5-{2-[4-(3-хлорфенил)пиперазин-1-ил]этиламино}-2Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли.
9. 5-{2-[4-(4-фторфенил)пиперазин-1-ил]этиламино}-2Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли.
10. Способ получения соединений общей формулы I,
где R1 представляет собой водород или алкил, содержащий 1-4 атома углерода;
X представляет собой водород или галоген,
R2 представляет собой водород или алкил, содержащий 1-4 атома углерода;
n - 1, 2 или 3;
Q и W независимо друг от друга представляют собой -N= или -CH=; и
R4 и R5 независимо друг от друга представляют собой водород, галоген, трифторметил или алкокси, содержащий 1-4 атома углерода,
и их фармацевтически приемлемых кислотных аддитивных солей, включающий взаимодействие соединения общей формулы II
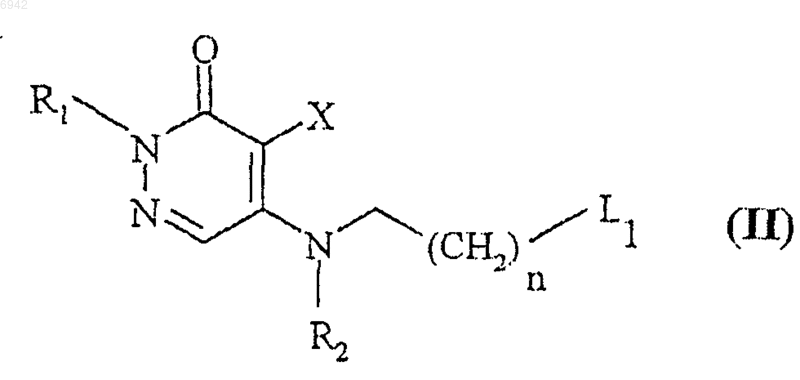
где L1 - отщепляемая группа, R1, R2, X и n такие, как определено выше, с амином общей формулы III
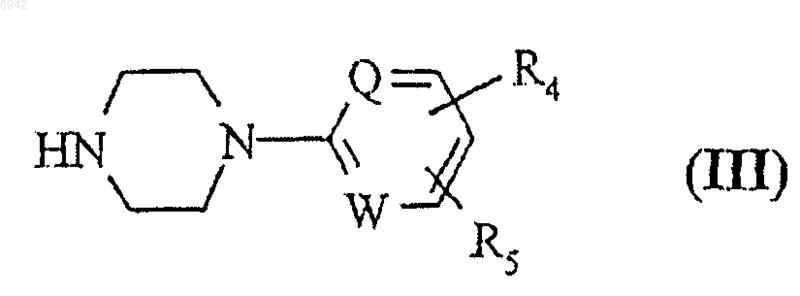
где Q, W, R4 и R5 такие, как определено выше,
и/или превращение соединения общей формулы I в его фармацевтически приемлемую кислотную аддитивную соль или высвобождение соединения общей формулы I из его кислотной аддитивной соли.
11. Способ получения соединений общей формулы I
где R1 представляет собой водород или алкил, содержащий 1-4 атома углерода;
X представляет собой водород или галоген;
R2 представляет собой водород или алкил, содержащий 1-4 атомов углерода;
n - 1, 2 или 3;
Q и W независимо друг от друга представляют собой -N= или -CH=; и
R4 и R5 независимо друг от друга представляют собой водород, галоген,
трифторметил или алкокси, содержащий 1-4 атома углерода,
и их фармацевтически приемлемых кислотных аддитивных солей, включающий
взаимодействие соединения общей формулы IV
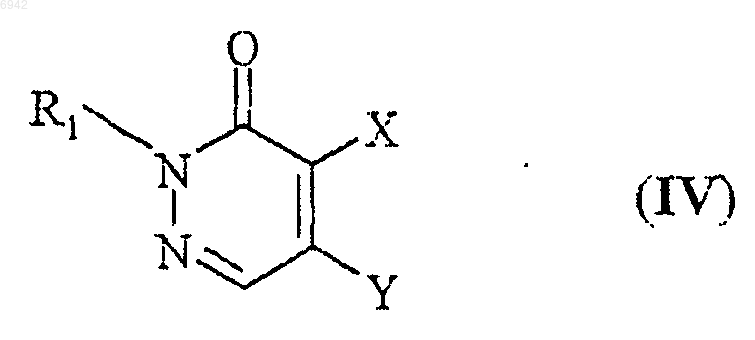
где Y - галоген и R1 и X такие, как определено выше, с соединением общей формулы V
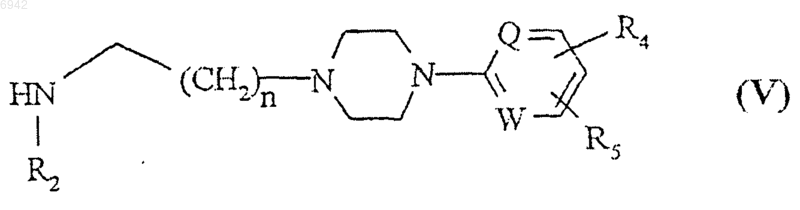
где R2, n, Q, W, R4 и R5 такие, как определено выше; и, если необходимо, осуществление каталитического дегалогенирования соединения общей формулы I, где X представляет собой галоген, с получением соединения общей формулы I или его гидрохлоридной соли, где X представляет собой водород; и/или превращение соединения общей формулы I в его фармацевтически приемлемую кислотную аддитивную соль или высвобождение соединения общей формулы I из его кислотной аддитивной соли.
12. Фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно соединение общей формулы I или его фармацевтически приемлемую кислотную аддитивную соль в смеси с подходящими инертными фармацевтическими носителями и/или вспомогательными агентами.
13. Способ получения фармацевтических композиций, включающий смешение соединения общей формулы I по п.1 или его фармацевтически приемлемой кислотной аддитивной соли с подходящими инертными фармацевтическими носителями и/или вспомогательными агентами.
14. Применение соединений общей формулы I по п.1 или его фармацевтически приемлемых кислотных аддитивных солей в качестве фармацевтически активных ингредиентов.
15. Применение соединений общей формулы I по п.1 или его фармацевтически приемлемых кислотных аддитивных солей в качестве анксиолитических и улучшающих познавательную способность фармацевтически активных ингредиентов.
16. Способ анксиолитического и улучшающего познавательную способность лечения анксиолитических состояний, включающий введение лицу, нуждающемуся в таком лечении, фармацевтически эффективного количества соединения формулы I по п.1 или его фармацевтически приемлемой кислотной аддитивной соли.
Текст
006942 Область техники Изобретение относится к замещенным производным алкиламинопиридазинона, способу их получения и фармацевтическим композициям, содержащим эти производные. Предпосылки изобретения Патологическое состояние тревоги - один из основных симптомов центральной нервной системы(ЦНС), сопровождаемый многими психиатрическими нарушениями, терапевтическими и хирургическими состояниями и стрессовыми ситуациями. Бензодиазепины, такие как диазепам, хлордиазепоксид, и альпразолам и т.п., являются наиболее часто используемыми агентами при различных анксиолитических расстройствах. Однако седативные и амнестические побочные эффекты представляют собой главный недостаток этих лекарств, особенно при расстройствах, поражающих активное работающее население. Более того, возможно появление симптома отмены после длительного периода терапии суспензией бензодиазепина. Следовательно, в настоящее время в фармакологии ЦНС существует необходимость создания эффективных анксиолитических/антистрессовых препаратов, не обладающих такими нежелательными побочными эффектами, имеющих низкий потенциал привыкания и хорошие свойства безопасности. Производные пиперазинилалкиламино-3(2 Н)-пиридазинона, обладающие эффектом снижения кровяного давления и пригодные для лечения сердечной недостаточности и нарушений периферийного кровообращения, известны из EP-A372305. Сущность изобретения Целью изобретения является создание новых замещенных производных алкиламинопиридазинона,имеющих полезные фармацевтические свойства и не обладающих нежелательными побочными эффектами. Указанная цель была достигнута благодаря изобретению. Настоящее изобретение относится к новым производным алкиламинопиридазинона общей формулы I где R1 представляет собой водород или алкил, содержащий 1-4 атомов углерода;X представляет собой водород или галоген,R2 представляет собой водород или алкил, содержащий 1-4 атомов углерода;Q И W независимо друг от друга представляют собой -N= или -CH=; иR4 и R5 независимо друг от друга представляют собой водород, галоген, трифторметил или алкокси,содержащий 1-4 атома углерода,и их фармацевтически приемлемым кислотным аддитивным солям. Описание предпочтительных вариантов изобретения Предпочтительная подгруппа соединений по настоящему изобретению состоит из соединений общей формулы I, гдеQ И W независимо друг от друга представляют собой -N= или -CH=; иR4 и R5 независимо друг от друга представляют собой водород, хлор, фтор, трифторметил или метокси, и их фармацевтически приемлемых кислотных аддитивных солей. Следующие соединения общей формулы I имеют наиболее полезные фармацевтические свойства: 5-2-[4-(метокситрифторметилфенил)-пиперазин-1-ил]-этиламино-2 Н-пиридазин-3-он; 5-2-[4-(2-фторфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-он; 5-2-[4-фенилпиперазин-1-ил]этиламино-2 Н-пиридазин-3-он; 5-[2-(4-пиридин-2-илпиперазин-1-ил)этиламино]-2 Н- пиридазин-3-он; 5-[2-(4-пиримидин-2-илпиперазин-1-ил)этиламино]-2 Н-пиридазин-3-он; 5-2-[4-(3-хлорфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-он; 5-2-[4-(4-фторфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-он и их фармацевтически приемлемые кислотные аддитивные соли. В описании и формуле изобретения используются следующие термины: Термин "галоген" означает фтор, хлор, бром и иод, предпочтительно хлор. Термин "алкил, содержащий 1-4 атома углерода" означает прямые или разветвленные алкильные группы, предпочтительно метильную группу, этильную группу, н-пропильную группу, изопропильную-1 006942 группу, н-бутильную группу, втор-бутильную группу, изобутильную группу или трет-бутильную группу,и т.п. Термин "алкокси" означает прямые или разветвленные алкоксигруппы, предпочтительно метокси-,этокси-, изопропилокси- или н-бутоксигруппу, предпочтительно метоксигруппу. Термин "отщепляемая группа" означает галоген (например, хлор, бром) или алкилсульфонилокси группы (например, метилсульфонилокси группы) или арилсульфонилокси группы (например, бензилсульфонилокси-, п-толуолсульфонилокси группы). Под фармацевтически приемлемыми кислотными аддитивными солями замещенных производных алкиламинопиридазинона формулы I подразумевают нетоксические кислотные аддитивные соли этих соединений, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и т.д. или с органическими кислотами, такими как муравьиная кислота, уксусная кислота, малеиновая кислота, фумаровая кислота, молочная кислота,винная кислота, янтарная кислота, лимонная кислота, бензолсульфокислота, n-тоулуолсульфокислота,метансульфокислота и т.д. Согласно другому аспекту изобретения, предложен способ получения соединений общей формулы I,где R1 представляет собой водород или алкил, содержащий 1-4 атомов углерода;X представляет собой водород или галоген,R2 представляет собой водород или алкил, содержащий 1-4 атомов углерода;Q И W независимо друг от друга представляют собой -N= или -CH=; иR4 и R5 независимо друг от друга представляют собой водород, галоген, трифторметил или алкокси,содержащий 1-4 атома углерода,и их фармацевтически приемлемых кислотных аддитивных солей,включающий а) взаимодействие соединения общей формулы II где L1 - отщепляемая группа, R1, R2, X и n такие, как определено выше, с амином общей формулы III где Q, W, R4 и R5 такие, как определено выше; или b) взаимодействие соединения общей формулы IV где Y - галоген и R1 и X такие, как определено выше, с соединением общей формулы V где R2, n, Q, W, R4 и R5 такие, как определено выше; и, если необходимо, осуществление каталитического дегалогенирования соединения общей формулы I, где X представляет собой галоген, с получением соединения общей формулы I или его гидрохлоридной соли, где X представляет собой водород; и/или превращение соединения общей формулы I в его фармацевтически приемлемую кислотную аддитивную соль или высвобождение соединения общей формулы I из его кислотной аддитивной соли. Реакции способов (а) и (b) проводят по методикам, известным для аналогичных способов, см., например, March, J.: Advanced Organic Chemistry, Reactions, Mechanism и Structure, 4th Edition, John Wiley иSons, New York, 1992. Когда замещенное производное алкиламинопиридазинона формулы I, где X является галогеном,предпочтительно хлором, подвергают каталитическому гидрированию, происходит дегалогенирование и получают соответствующее замещенное производное алкиламинопиридазинона формулы I, где X является водородом, или его гидрохлоридную соль.-2 006942 Каталитическое гидрирование проводят по методикам, известным для аналогичных способов, см.,например, March, J.: Advanced Organic Chemistry, Reactions, Mechanism и Structure 4th Edition, John Wiley и Sons, New York, 1992. В качестве источников водорода используют, например, газообразный водород, гидразин, гидразин гидрат, муравьиную кислоту, формиат триалкиламмония или формиат щелочного металла. В качестве катализатора используют, например, палладий, оксид платины, никель Ренея и т.п. Реакцию можно проводить в присутствии или отсутствии кислотосвязывающего агента. В качестве кислотосвязывающего агента можно использовать неорганическое основание, такое как гидроксид натрия, или органическое основание, такое как гидразин, триэтиламин, диизопропиламин, и т.п. Реакцию можно проводить в инертном протонном или апротонном растворителе или их смеси. В качестве протонного растворителя можно использовать, например алканол, воду или их смеси, в качестве апротонного растворителя можно использовать, например диоксан, тетрагидрофуран или дихлорметан. Как правило, температура реакции 0-150C, предпочтительно 20-100C. Получение кислотной аддитивной соли из свободного основания общей формулы I и высвобождение основания из соли проводят известными способами. Производные алкиламинопиридазинона формулы II, используемые в качестве исходных соединений можно получить способами, описанными в заявке PCT/HU98/00054 (WO 99/64402). Часть аминов формулы III известна. Новые могут быть получены аналогичными способами, см. Pollard et al., J. Am. Chem. Soc, 56,2199 (1934). Часть производных дигалопиридазинона формулы IV также известна из литературы. Новые могут быть получены аналогичными способами, известными из литературы, см. Homer et al., J. Chem. Soc.,1948, 2194. Соединения общей формулы V можно получить из соответствующих аминов формулы III известными способами, см. Shigenaga, S. et al., Arch. Pharm., 329(1) 3-10 (1996); Janssens, F. et al., J. Med. Chem.,28 (12), 1934-1943 (1985); Не Xiao Shu et al., Bioorg. Med. Chem. Lett., 7(18), 2399-2402 (1997). Фармакологический эффект замещенных производных алкиламинопиридазинона формулы I был изучен в следующих тестах. Методы и результаты Эффект на кровяное давление Эксперименты проводили на свободно перемещающихся самцах крыс линии Вистар в сознательном состоянии с использованием радиотелеметрической системы (Data Sciences International, St. Paul,Minnesota, USA). Перед испытаниями крысам имплантировали трансмиттеры типа TLl 1 М 2-С 50-РХТ,которые позволяли осуществлять непрерывный контроль кровяного давления. Для измерения артериального давления катетер трансмиттера вводили в брюшную аорту в стерильных условиях и пришивали в брюшной стенке под анестезией пентобарбиталом натрия (60 мг/кг интраперитонеально, Nembutal inj.Phилaxia-Sanofi, Budapest). После операции животные принимали антибиотик (1 мл/кг в.м. Tardomyocel соmр. inj. ad us. vet., Bayer AG, Leverkusen, Germany). Далее следовал 7-ми дневный период послеоперационного восстановления. Радиосигналы, излучаемые трансмиттерами детектировались приемниками типа RLA1000, помещенными под каждой клеткой с животными. Данные регистрировали, сохраняли и оценивали с использованием программного обеспечения Dataquest IV от Data Sciences. Компьютер был настроен на регистрацию параметров в течение 10 с каждые 2 мин. Тестируемые вещества или плацебо (метилцеллюлозу 0,4% вес/об.) вводили перорально в объеме 1 мл/кг примерно в 10 ч утра. Действие препаратов измеряли в течение 6 ч. Эффект каждого вещества сравнивали с эффектом плацебо с использованием двухстадийного анализа отклонений для повторных измерений по Шиффу (Scheff's post hoc test). Полученные данные приведены в табл. 1. Ни одно из исследуемых соединений не вызвало снижение кровяного давления. Таблица 1. Эффект различных исследуемых соединений или плацебо на среднее артериальное давление в течение 6 ч после их введения крысам в сознательном состоянииS.E. - стандартное отклонение от среднего;N.S. - статистически не значительно по сравнению с плацебо-3 006942 Согласно представленным данным соединения настоящего изобретения не влияют на кровяное давление, что указывает на отсутствие антигипертензивной активности. Анксиолитический эффект Конфликтный тест Вогеля Эксперименты проводили в системе, управляемой ПК (LIIKOSYS, Experimetria, Hungary), состоящей из 8 тестовых камер из плексиглаза (20 см х 20 см х 20 см), каждая из которых была оборудована системой водяных фонтанчиков, установленных на подходящей высоте на стенке камеры, и сетчатым полом для осуществления электрошока. Крысам линии Вистар весом 160-180 г (N=8) не давали пить воду в течение 48 ч и не давали пищи в течение 24 ч. Тестируемые и контрольные соединения или плацебо вводили интраперитонеально за 30 мин до теста. Все процедуры проводили в тихом проветриваемом помещении между 07: 30 и 13: 00 ч при температуре 232 С. Сначала тестируемые животные помещались в тестовую камеру, где они имели свободный доступ к воде в течение 30 с. После этого на них воздействовали электрошоком (600 мкА, 0,6 с) через носик фонтанчика для питья после каждых 20 лизаний в течение 5 мин (Vogel et al., 1974). Количество "наказанных" лизаний регистрировали сохраняли в памятиIBM совместимого компьютера. Среднюю величинустандартное отклонение (SEM) количества шоков рассчитывали для каждой группы, статистический анализ данных проводили методом ANOVA, и затем тестом Дункана (STATISTICA). Результаты представлены в табл. 2. Диазепам [7-хлор-1,3-дигидро-1 метил-5-фенил-2 Н-1.4-бензодиазепин-2-он] использовали в качестве вещества сравнения. Таблица 2. Конфликтный тест Вогеля Данные, представленные в табл. 2, указывают на то, что замещенные производные алкиламинопиридазинона формулы I имеют значительный анксиолитический эффект, эквивалентный эффекту диазепама. Тесты на крысах в приподнятом плюс-лабиринте Тесты проводили, как описано Pellow с соавторами [J. Neurosci. Methods, 14, 149, (1985)]. Для экспериментов использовали деревянный крест с каналами длиной 100 см и шириной 15 см. Стороны и два противоположных конца креста имели стенки высотой 40 см, однако эти каналы были открыты в центральную область креста площадью 15x15 см (закрытые каналы). Два других противоположных канала не были перекрыты стенками (открытые каналы). Для испытаний использовали самцов крыс линии Sprague-Dawley весом 200-220 г. Животным вводили тестируемые и контрольные вещества. Затем крыс помещали в центральную область лабиринта и проводили испытание в течение 5 мин. Определяли следующие параметры:- количество входов в закрытые каналы. Эффект выражался в процентном увеличении либо времени (измеренном в секундах), проведенного в открытых каналах, либо количества входов в открытые каналы. Минимальные эффективные дозы(МЭД) определяли для каждого соединения на основании времени, проведенного в открытых каналах. Полученные результаты приведены в табл. 3. Буспирон [8-4-[4-(2-пиримидинил)-1-пиперазинил]бутил 8-азаспиро-[4,5]декан-7,9-дион] использовали в качестве контрольного вещества.-4 006942 Таблица 3. Тесты на крысах в приподнятом плюс-лабиринте Из табл. 3 видно, что замещенные производные алкиламинопиридазинона формулы I имеют исключительно высокую анксиолитическую активность в указанном тесте, значительно превышающую активность контрольного вещества. Седативный эффект Ингибирование самопроизвольной двигательной активности Действие на самопроизвольную двигательную активность исследовали по методу Borsy с соавторами [Borsy, J. et al., Arch. Int. Pharmacodyn., 124, 180-190 (1960)], в аппарате Dews с 10 каналами по 1-1 животному в каждом канале. Животных помещали в аппарат через 60 мин после введения в рот (per os) либо тестируемого вещества, либо плацебо, подсчитывали количество пересечений инфракрасных лучей в течение 30 мин. Значения 50%-ной ингибирующей дозы (ID50) рассчитывали с помощью анализа линейной регрессии. Результаты представлены в табл. 4. Диазепам использовали в качестве вещества сравнения. Таблица 4. Ингибирование самопроизвольной двигательной активности в тестах на мышах В отличие от диазепама, используемого в качестве вещества сравнения, протестированные замещенные производные алкиламинопиридазинона формулы I оказывают седативный эффект только при относительно больших дозах. Представленные данные свидетельствуют о том, что замещенные производные алкиламинопиридазинона общей формулы I являются эффективными при лечении различных клинических состояний, связанных с патологическим состоянием тревоги. Для ряда веществ анксиолитический эффект на несколько порядков превосходит эффект веществ сравнения (диазепама, буспирона). Седативные побочные эффекты проявляются только в дозах в несколько раз больших, чем необходимые для получения терапевтического эффекта. Это означает, что замещенные производные алкиламинопиридазинона общей формулы I не имеют седативных снижающих качество жизни побочных эффектов, которые наблюдаются для бензодиазепинов. Эффект на познавательную способность и память Использовали самцов крыс Wistar весом 200-220 г. Животных получали из Charles River Co. Их содержали в комнате с нормальным чередованием света и темноты 12 ч -12 ч (свет включали в 06:00) при относительной влажности 6010%. Эксперимент проводили в пятиканальном аппарате для приобретения животными навыка пассивного избегания по типу "перехода через проход". Аппарат состоял из двух смежных камер из плексигласа размером 20x20x16 см. Одна из них была сделана из нормального прозрачного плексигласа, а другая - из черного непрозрачного плексигласа. Камеры были соединены проходом размером 7,5x8 см, снабженным контролируемой компьютером гильотинной дверью. Переход крыс через дверь определяли с помощью инфракрасных фотокамер, установленных в двух параллельных направлениях в отверстии прохода. Дверь автоматически закрывалась, когда животные преодолевали проход. Темное помещение было оборудовано полом, который представлял собой сетку из нержавеющей стали, через которую можно было воздействовать ударом тока на лапы животных. Над проходом в светлое помещение устанавливали лампу накаливания мощностью 10 Вт. Эксперимент проводили в течение двух дней в два этапа, которые отделялись друг от друга периодом в 24 ч. В 1-й день (Обучение) животные получали информацию о ситуации (электрошок через сетку в полу в темном помещении), во 2-й день (Ретенция) они воспроизводили приобретенную информацию для то-5 006942 го, чтобы избежать наказания ("если я пойду в темноту, я буду наказана, поэтому я останусь на свету"). 1-й день (Обучение) Индивидуально пронумерованных животных помещали в светлую камеру аппарата. Через 30 с открывали гильотинная дверь, и крысы могли свободно переходить в темное (рассматриваемое ими как безопасное) помещение. Латентный период перехода определялся автоматически (Латентный период перехода - это период времени от момента открытия двери до того времени, когда животное перешло в темное помещение). Затем дверь закрывалась, и таймер автоматически останавливался. Удар тока силой 1,2 мА, длительностью 2,5 с прикладывали к лапам животного через сетку в полу спустя 3 с после закрытия двери,за исключением крыс из абсолютной контрольной группы (отсутствие шока + введение плацебо). Исследуемых животных удаляли из темного помещения сразу же после того, как они были подвергнуты шоку. Смысл использования абсолютной контрольной группы заключался в том, чтобы показать, что подвергнутые электрошоку животные вспомнят неприятный для их лап удар тока, что обнаружится по увеличенному латентному периоду по сравнению с контрольной группой. Это составляет суть обучения. 2-й день (Ретенция) Через 24 ч животных снова помещали в светлую камеру тест-аппарата и измеряли латентный период перехода, как описано для дня обучения, за исключением того, что во 2-й день животных из любой группы не подвергали никакому электрошоку. Максимальное значение временного интервала, в течение которого крысы переходили в темное помещение, достигало 180 с. Животных удаляли из светлого помещения, если они не переходили в темное помещение в течение 180 с тест-периода. Неожиданно обнаружили, что соединения изобретения значительно увеличивали латентный период перехода животных в темное помещение аппарата, предназначенного для обучения животных навыку пассивного избегания, после двухдневного введения соединения. В абсолютной контрольной группе (не подвергавшейся шоку и обработке активным соединением),латентный период перехода был примерно одинаковым в оба экспериментальных дня (это означает, что не было ничего такого, что следовало бы вспоминать или чего следовало бы избегать во второй день). В контрольной группе животных, которых подвергали шоку и которым вводили плацебо, неизбежный удар тока силой 1,2 мА приводил к значительному увеличению латентного периода перехода во второй день при сравнении с абсолютным контролем. Экспериментальные животные вспоминали неприятный опыт (удар тока) в темноте, поэтому они переходили в темное помещение через значительно более длительный промежуток времени (увеличенный латентный период). В обработанных группах этот увеличенный латентный период дополнительно увеличивался после второго дня обработки, указывая на то, что ретенция памяти улучшается. Эти удивительные эффекты являются тем более не очевидными, поскольку анксиолитики (например, диазепам) оказывают вредное влияние на память. С терапевтической точки зрения благоприятный эффект соединений общей формулы I на познавательную способность и память означает, что эти соединения могли бы быть подходящими для лечения и/или предупреждения заболеваний или состояний, сопровождающих заболевания, при которых страдают функции обучения или памяти, или где существует возможность нарушения этих функций. В числе таких заболеваний - болезнь Альцгеймера, синдром Корсакова, болезнь Хантингтона, болезнь Паркинсона, а также умственная неполноценность вследствие процессов старения, нарушения когнитивных функций из-за воздействия токсических веществ. Вывод Соединения общей формулы I обладают удивительно значительной анксиолитической активностью и не имеют седативных побочных эффектов в количествах для получения анксиолитического эффекта. В дополнение к анксиолитической активности эти соединения имеют благоприятный эффект на познавательную способность и память. Согласно исследованиям авторов изобретения, соединения общей формулы I не обладают антигипертензивным действием. Соединения изобретения и их фармацевтически приемлемые кислотные аддитивные соли можно использовать в качестве активных ингредиентов фармацевтических композиций. Дополнительно, изобретение включает фармацевтическую композицию, содержащую замещенные производные алкиламинопиридазинона общей формулы I или их фармацевтически приемлемые кислотные аддитивные соли в смеси с одним или более традиционным носителем. Фармацевтическая композиция изобретения содержит от 0,1 до 95 вес.%, предпочтительней от 1 до 50 вес.%, более предпочтительно от 5 до 30 вес.% активного ингредиента. Фармацевтическая композиция изобретения пригодна для перорального, парентерального, ректального или трансдермального введения или для местного применения и может быть твердой или жидкой. Твердые фармацевтические композиции, пригодные для перорального применения, могут быть в виде порошков, капсул, таблеток, таблеток в оболочке, микрокапсул и т.д. и могут содержать связующие агенты, такие как желатин, сорбитол, поливинилпирролидон и т.д.; наполнители, такие как лактоза, глюкоза, крахмал, фосфат кальция и т.д.; вспомогательные вещества для изготовления таблеток, такие как стеарат магния, тальк, полиэтиленгликоль, двуокись кремния и т.д.; смачивающие агенты, такие как лау-6 006942 рилсульфат натрия и другие, в качестве носителя. Жидкие фармацевтические композиции, пригодные для перорального применения, могут быть в виде растворов, суспензий или эмульсий и могут содержать, например, суспендирующие агенты, такие как желатин, карбоксиметилцеллюлоза и т.д.; эмульгаторы, такие как сорбитанмоноолеат и т.д.; растворители, такие как вода, масла, глицерин, пропиленгликоль, этанол и т.д.; консерванты, такие как метилп-гидроксибензоат и другие, в качестве носителя. Фармацевтические композиции, пригодные для парентерального введения, состоят, как правило, из стерильных растворов активного ингредиента. Лекарственные формы, перечисленные выше, а также другие лекарственные формы, по сути известны, например, из справочников, таких как Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co., Истон, США (1990). Фармацевтические композиции изобретения содержат, как правило, единичную дозу. Обычная дневная доза для взрослых пациентов составляет от 0,1 до 1000 мг соединения формулы I или его фармацевтически приемлемой кислотной аддитивной соли, рассчитанная на 1 кг веса. Ежедневная доза может вводиться в один или несколько приемов. Действительная доза зависит от многих факторов и определяется врачом. Фармацевтическая композиция изобретения готовится путем смешивания соединения формулы I или его фармацевтически приемлемой кислотной аддитивной соли с одним или более носителями и превращения полученной смеси в фармацевтическую композицию способом, по сути известным. Практические способы известны из литературы, например из справочника Remington's Pharmaceutical Sciences. Согласно еще одному аспекту изобретения предложено применение соединений общей формулы I или его фармацевтически приемлемых кислотных аддитивных солей в качестве фармацевтически активных ингредиентов. Согласно предпочтительному варианту указанного аспекта изобретения предложено применение соединений общей формулы I или его фармацевтически приемлемых кислотных аддитивных солей в качестве анксиолитических и улучшающих познавательную способность фармацевтически активных ингредиентов. Согласно еще одному аспекту изобретения предложен способ анксиолитического и улучшающего познавательную способность лечения анксиолитических состояний, включающий введение лицу, нуждающемуся в таком лечении, фармацевтически эффективного количества соединения формулы I или его фармацевтически приемлемой кислотной аддитивной соли. Дополнительные детали изобретения приведены в следующих примерах, не ограничивающих объем охраны изобретения. Примеры Пример 1. Получение 5-2-[4-метокситрифторметилфенил)-пиперазин-1-ил]-этиламино-2 Нпиридазин-3-она тригидрохлорида 3,7 г (0,0086 моль) 4-хлор-5-2-[4-(метокситрифторметилфенил)-пиперазин-1-ил]этиламино-Нпиридазин-3-она, 370 см 3 метанола, 3,2 см 3 (0,018 моль) диизопропилэтиламина и 3,7 г катализатора палладия на угле, содержащего 8% Pd, 28% С и 64% Н 2 О помещали в автоклав. Реакционную смесь перемешивали при комнатной температуре при давлении водорода 10 атм. в течение 4 ч. Затем избыток водорода удаляли из автоклава, реакционную смесь нагревали до температуры кипения и перемешивали 5 мин при этой температуре, фильтровали в горячем виде, трижды промывали катализатор каждый раз с использованием 33 см 3 смеси метанола и дихлорметана 1:1. Объединенные фильтраты выпаривали при пониженном давлении, осадок подвергали хроматографии на колонке с силикагелем с использованием смеси хлороформа и метанола 19:1 в качестве элюента. Фракции, содержащие продукт, выпаривали, осадок растворяли в смеси этилацетата и диэтиилового эфира, к полученному раствору добавляли по каплям эфир, содержащий хлористый водород. Полученные кристаллы перемешивали полчаса при охлаждении ледяной водой, фильтровали и промывали диэтииловым эфиром. Продукт сушили при 80C над пятиокисью фосфора в вакууме в течение 3 ч. Таким образом получали 1,84 г (54 %) названного соединения. Температура плавления: 238-2400C. Анализ для C18H25Cl3F3N5O2 (506,79) рассчитан.: С 42,66%, H 4,97%, N 13,82%, Cl 20,99%; обнаруж.: С 42,53%, H 5,01%, N 13,63%, Cl 20,69%. ИК (KBr): 3294,2340,1630,1330,1115. 1H-ЯMP (ДМСО-d6, i400): 13,23 (b, 1H), 11,49 (b, 1H), 8,43 r (b, 1H), 7,90 (bs, 1H), 7,40 (d, J=8,5 Гц,1H), 7,18 (d, J=8,7 Гц, 1H), 7,15 (s, 1H), 6,05 (bs, 1H), 3,89 (S, 3H), 3,13-3,75 (m, 12H). 13 С-ЯМР (ДМСО-d6, i400): 162,14, 154,81, 150,30, 139,98, 134,04, 124,68 (q, J=271,6 Гц), 121,51 (q,J=31,7 Гц), 120,92 (q), 114,81 (q), 112,22, 93,60, 56,13, 53,09, 51,30, 46,69, 36,49. Пример 2. Получение 5-2-[4-(2-фторфенил)пиперазин-1 -ил]этиламино-2H-пиридазин-3-она 2,5 г (0,0071 моль) 4-хлор-5-2-[4-(2-фторфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-она,400 см 3 смеси метанола и дистиллированной воды 9:1 и 2,5 г катализатора палладия на угле, содержащего 8% Pd, 28% С и 64% Н 2 О, помещали в колбу на 1 л с обратным холодильником и устройством для-7 006942 продувания газа. Добавляли по каплям 1,4 см 3 гидразингидрата, реакционную смесь перемешивали при температуре кипения в течение 1 ч. Смесь фильтровали в горячем виде, трижды промывали катализатор каждый раз с использованием 33 см 3 смеси метанола и дихлорметана 1:1. Объединенные фильтраты выпаривали, осадок растворяли в 25 см 3 смеси этанола и воды 8:1 при нагревании, раствор фильтровали,фильтрат выпаривали до 1/5 первоначального объема. После охлаждения выделенные кристаллы перемешивали еще в течение 0,5 ч при охлаждении ледяной водой, фильтровали и промывали диэтиловым эфиром. Продукт сушили при 400C над пятиокисью фосфора в вакууме в течение 3 ч. Таким образом получали 1,91 г (84.8 %) названного соединения. Температура плавления: 103-105C. Анализ для C16H20FN5O (317,37) рассчитан: С 60,55%, H 6,35%, N 22,07%; обнаруж.: С 60,25, H 6,34,N 21,89. ИК (KBr): 3272, 3122, 1633, 1550. 1H-ЯMP (ДМСО-d6, i400): 11,87 (bs, 1H), 8,35 (d, J=4,8 Гц, 2H), 7,48 (d, J=2,6 Гц, 1H), 6,85 (bt, J=5,1 Гц, 1H), 6,62 (t, J=4,7 Гц, 1H), 5,40 (s, 1H), 3,73 (m, 4H), 3,14 (q, J=6,0 Гц, 2H), 2,50 (m). 13 С-ЯМР (ДМСО-d6, i400): 162,42, 161,38, 158,08, 149,44, 131,73, 110,28, 94,38, 55,85, 52,71, 43,40,39,16. Пример 3. Получение 5-2-[4-фенилпиперазин-1-ил]этиламино-2 Н-пиридазин-3-она 3,3 г (0,01 моль) 4-хлор-5-[2-(4-фенилпиперазин-1-ил)этиламино]-2 Н-пиридазин-3-она, 500 см 3 смеси метанола и дистиллированной воды 9:1 и 3,3 г катализатора палладия на угле, содержащего 8% Pd,28% С и 64% H2O, помещали в колбу на 1 л с обратным холодильником и устройством для продувания газа. Добавляли по каплям 2 см 3 гидразингидрата, реакционную смесь перемешивали при температуре кипения в течение 3 ч. Смесь фильтровали в горячем виде, трижды промывали катализатор каждый раз с использованием 33 см 3 смеси метанола и дихлорметана 1:1. Объединенные фильтраты выпаривали, осадок растворяли в 15 см 3 смеси этанола и воды 8:1 при нагревании, раствор фильтровали, фильтрат выпаривали до 1/4 первоначального объема. После охлаждения выделенные кристаллы перемешивали еще в течение 0,5 ч при охлаждении ледяной водой, фильтровали и промывали диэтиловым эфиром. Продукт сушили при 60C над пятиокисью фосфора в вакууме в течение 3 ч. Таким образом получали 2,18 г (72.9 %) названного соединения. Температура плавления: 147-149C. Анализ для C16H20FN5O (317,37) рассчитан.: С 64,19 %, H 7,07%, N 23,39%; обнаруж.: С 63,74%, H 7,09%, N 22,89%. ИК (KBr): 3484, 3318, 1638, 1600. 1 Н-ЯМР (ДМСО-d6, i400): 11,98 (bs, 1H), 7,52 (d, J=2,3 Гц, 1H), 7,21 (t, J=7,8 Гц, 2H), 6,91 (d, J=8,5 Гц, 2H), 6,90 (bt, J=5,1 Гц, 1H), 6,77 (t, J=7,.2 Гц, 1H), 5,44 (d, J=2,3 Гц, 1H), 3,14 (m, 6H), 2,56 (m, 6H). 13 С-ЯМР (ДМСО-d6, i400): 162,46, 151,20, 149,47, 131,76, 129,11, 118,97, 115,52, 94,37, 55,87, 52,93,48,30, 39,25. Пример 4. Получение 5-[2-(4-пиридин-2-илпиперазин-1-ил)этиламино]-2H-пиридазин-3-она 3,2 г (0,0096 моль) 4-хлор-5-[2-(4-пиридин-2-илпиперазин-1-ил)-этиламино]-2 Н-пиридазин-3-она,500 см 3 смеси метанола и дистиллированной воды 9:1 и 3,2 г катализатора палладия на угле, содержащего 8% Pd, 28% С и 64% H2 О, помещали в колбу на 1 л с обратным холодильником и устройством для продувания газа. Добавляли по каплям 1,6 см 3 гидразингидрата, реакционную смесь перемешивали при температуре кипения в течение 1 ч. Смесь фильтровали в горячем виде, трижды промывали катализатор каждый раз с использованием 33 см 3 смеси метанола и дихлорметана 1:1. Объединенные фильтраты выпаривали, осадок растворяли в 30 см 3 смеси этанола и воды 8:1 при нагревании, раствор фильтровали,фильтрат выпаривали до 1/5 первоначального объема. После охлаждения выделенные кристаллы перемешивали еще в течение 0,5 ч при охлаждении ледяной водой, фильтровали и промывали диэтиловым эфиром. Продукт сушили при 80C над пятиокисью фосфора в вакууме в течение 3 ч. Таким образом получали 2,44 г (85,0%) названного соединения. Температура плавления: 150-152C. ИК (KBr): 3444, 1605, 1340, 1167. 1 Н-ЯМР (CDCl3, g200): 11,91 (bs, 1H), 8,11 (m, 1H), 7,51 (m, 2H), 6,95 (b, 1H), 6,85 (m, 1H), 6,65 (m,1H), 5,44 (s, 1H), 3,52 (m, 4H), 3,22 (m, 4H), 2,63 (m, 4H). Пример 5. Получение 5-[2-(4-пиримидин-2-илпиперазин-1-ил)этиламино]-2 Н-пиридазин-3-она 3,4 г (0,01 моль) 4-хлор-5-[2-(4-пиримидин-2-илпиперазин-1-ил)-этиламино]-2 Н-пиридазин-3-она,500 см 3 смеси метанола и дистиллированной воды 9:1 и 3,4 г катализатора палладия на угле, содержащего 8% Pd, 28% С и 64% Н 2 О, помещали в колбу на 1 л с обратным холодильником и устройством для продувания газа. Добавляли по каплям 1,7 см 3 гидразингидрата, реакционную смесь перемешивали при температуре кипения в течение 1,5 ч. Смесь фильтровали в горячем виде, трижды промывали катализатор каждый раз с использованием 33 см 3 смеси метанола и дихлорметана 1:1. Объединенные фильтраты выпаривали, осадок растворяли в 28 см 3 смеси этанола и воды 8:1 при нагревании, раствор фильтровали,фильтрат выпаривали до 1/5 первоначального объема. После охлаждения выделенные кристаллы перемешивали еще в течение 0,5 ч при охлаждении ледяной водой, фильтровали и промывали диэтиловым эфиром. Продукт сушили при 80C над пятиокисью фосфора в вакууме в течение 3 ч. Таким образом получали 2,19 г (72,5%) названного соединения. Температура плавления: 199-2010C.-8 006942 Анализ для C14H19N7O (301,35) рассчитан.: С 55,80%, H 6,36 %, N 32,54%; обнаруж.: С 55,71%, H 6,33%, N 32,41%. ИК (KBr): 3272, 3122, 1633, 1550. 1 Н-ЯМР (ДМСО-d6, i400): 11,87 (bs, 1H), 8,35 (d, J=4,8 Гц, 2H), 7,48 (d, J=2,6 Гц, 1H), 6,85 (bt, J=5,1 Гц, 1H), 6,62 (t, J=4,7 Гц, 1H), 5,40 (s, 1H), 3,73 (m, 4H), 3,14 (-q, J=6,0 Гц, 2H), 2,50 (m). 13 С-ЯМР (ДМСО-d6, i400): 162,42, 161,38, 158,08, 149,44, 131,73, 110,28, 94,38, 55,85, 52,71, 43,40,39,16. Пример 6. Получение 5-2-[4-(3-хлорфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-она Смесь 1,96 г (0,01 моль) 1-(3,014 моль) триэтиламина, 0,2 г иодида калия и 1,9 г (0.009 моль) 5-(2 хлорэтиламино)-2 Н-пиридазин-3-она гидрохлорида перемешивали при температуре кипения 2 ч. К реакционной смеси добавляли по каплям раствор из 3,0 г гидрокарбоната натрия в 40 см 3 воды. Выделялось масло из-за наличия воды. Воду декантировали и к маслу добавляли 10 см 3 дихлорметана. Кристаллы,выделявшиеся при перемешивании, фильтровали. Грубый продукт растворяли в метаноле при температуре кипения при перемешивании, обрабатывали углем, фильтровали, фильтрат выпаривали до 1/5 первоначального объема. Остаток перемешивали при охлаждении ледяной водой, осажденные кристаллы фильтровали. Таким образом получали 1,21 г (40,5%) названного соединения. Температура плавления: 187-189 С. Анализ для C16H20ClN5O] (333,82) рассчитан.: С 57,57%, H 6,04 %, Cl 10,62 %, N 20,98 %; обнаруж.: С 57,09 %, H 6,05 %, Cl 10,38 %, N 22,68%. ИК (KBr): 3410, 3277, 1624, 1599, 1240. 1H-ЯMP (ДМСО-d6, i400): 11,93 (bs, 1H), 7,20 (t, J=8,2 Гц, 1H), 6,89 (m, 1H), 6,87 (bt, J=5,2 Гц, 1H),6,78 (m, 1H), 5,42 (d, J=2,5 Гц, 1H), 3,18 (m, 6H), 2,54 (m, 6H). 13 С-ЯМР (ДМСО-d6, i400): 162,38, 152,40, 149,42, 134,01, 131,70, 130,57, 118,17, 114,65, 113,78,94,37, 55,80, 52,71, 47,74, 39,22. Пример 7. Получение 5-2-[4-(4-фторфенил)пиперазин-1-ил]этиламино-2H-пиридазин-3-она 3,51 г (0,01 моль)4-хлор-5-2-[4-(4-фторфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-она,350 см 3 смеси метанола и дистиллированной воды 9:1, 0,44 г (0,011 моль) гидроксида натрия и 3,5 г катализатора палладия на угле, содержащего 8% Pd, 28% С и 64% Н 2 О, помещали в автоклав. Реакционную смесь перемешивали при комнатной температуре при давлении водорода 10 атм. в течение 3 ч. Затем избыток водорода удаляли из автоклава, реакционную смесь нагревали до температуры кипения и перемешивали 5 мин при этой температуре, фильтровали в горячем виде, трижды промывали катализатор каждый раз с использованием 50 см 3 смеси метанола и дихлорметана 1:1. Объединенные фильтраты выпаривали до объема 20 см 3, полученный раствор перемешивали полчаса при охлаждении ледяной водой. Полученные кристаллы фильтровали и промывали 10 см 3 холодного метанола. Таким образом получали 2,98 г (81,7%) названного соединения. Температура плавления: 96-98C. Анализ для C16H20FN5O (317,37) рассчитан.: H 6,35%, N 22,07%; обнаруж.: H 6,30%, N 21,64%. ИК (KBr) 3433, 3243, 3081, 1618, 1507, 1226. 1(J=7,.6 Гц), 115,42 (d, J=21.7 Гц), 94,35, 55,82, 52,91, 49,09, 39,25. ФОРМУЛА ИЗОБРЕТЕНИЯ Соединения общей формулы I где R1 представляет собой водород или алкил, содержащий 1-4 атома углерода;X представляет собой водород или галоген,R2 представляет собой водород или алкил, содержащий 1-4 атомов углерода;Q и W независимо друг от друга представляют собой -N= или -CH=; иR4 и R5 независимо друг от друга представляют собой водород, галоген, трифторметил или алкокси,содержащий 1-4 атома углерода,и их фармацевтически приемлемые кислотные аддитивные соли.-9 006942 2. Соединения общей формулы I по п.1, гдеQ И W независимо друг от друга представляют собой -N= или -CH=; иR4 и R5 независимо друг от друга представляют собой водород, хлор, фтор, трифторметил или метокси,и их фармацевтически приемлемые кислотные аддитивные соли. 3. 5-2-[4-(метокситрифторметилфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли. 4. 5-2-[4-(2-фторфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли. 5. 5-2-[4-фенилпиперазин-1-ил]этиламино-2 Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли. 6. 5-[2-(4-пиридин-2-илпиперазин-1-ил)этиламино]-2 Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли. 7. 5-[2-(4-пиримидин-2-илпиперазин-1-ил)этиламино]-2 Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли. 8. 5-2-[4-(3-хлорфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли. 9. 5-2-[4-(4-фторфенил)пиперазин-1-ил]этиламино-2 Н-пиридазин-3-он по п.1 и его фармацевтически приемлемые кислотные аддитивные соли. 10. Способ получения соединений общей формулы I,где R1 представляет собой водород или алкил, содержащий 1-4 атома углерода;X представляет собой водород или галоген,R2 представляет собой водород или алкил, содержащий 1-4 атома углерода;Q И W независимо друг от друга представляют собой -N= или -CH=; иR4 и R5 независимо друг от друга представляют собой водород, галоген, трифторметил или алкокси,содержащий 1-4 атома углерода,и их фармацевтически приемлемых кислотных аддитивных солей, включающий взаимодействие соединения общей формулы II где L1 - отщепляемая группа, R1, R2, X и n такие, как определено выше, с амином общей формулы III где Q, W, R4 и R5 такие, как определено выше,и/или превращение соединения общей формулы I в его фармацевтически приемлемую кислотную аддитивную соль или высвобождение соединения общей формулы I из его кислотной аддитивной соли. 11. Способ получения соединений общей формулы I где R1 представляет собой водород или алкил, содержащий 1-4 атома углерода;X представляет собой водород или галоген;R2 представляет собой водород или алкил, содержащий 1-4 атомов углерода;Q и W независимо друг от друга представляют собой -N= или -CH=; иR4 и R5 независимо друг от друга представляют собой водород, галоген,трифторметил или алкокси, содержащий 1-4 атома углерода,и их фармацевтически приемлемых кислотных аддитивных солей, включающий взаимодействие соединения общей формулы IV где Y - галоген и R1 и X такие, как определено выше, с соединением общей формулы V где R2, n, Q, W, R4 и R5 такие, как определено выше; и, если необходимо, осуществление каталитического дегалогенирования соединения общей формулы I, где X представляет собой галоген, с получением соединения общей формулы I или его гидрохлоридной соли, где X представляет собой водород; и/или превращение соединения общей формулы I в его фармацевтически приемлемую кислотную аддитивную соль или высвобождение соединения общей формулы I из его кислотной аддитивной соли. 12. Фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно соединение общей формулы I или его фармацевтически приемлемую кислотную аддитивную соль в смеси с подходящими инертными фармацевтическими носителями и/или вспомогательными агентами. 13. Способ получения фармацевтических композиций, включающий смешение соединения общей формулы I по п.1 или его фармацевтически приемлемой кислотной аддитивной соли с подходящими инертными фармацевтическими носителями и/или вспомогательными агентами. 14. Применение соединений общей формулы I по п.1 или его фармацевтически приемлемых кислотных аддитивных солей в качестве фармацевтически активных ингредиентов. 15. Применение соединений общей формулы I по п.1 или его фармацевтически приемлемых кислотных аддитивных солей в качестве анксиолитических и улучшающих познавательную способность фармацевтически активных ингредиентов. 16. Способ анксиолитического и улучшающего познавательную способность лечения анксиолитических состояний, включающий введение лицу, нуждающемуся в таком лечении, фармацевтически эффективного количества соединения формулы I по п.1 или его фармацевтически приемлемой кислотной аддитивной соли.
МПК / Метки
МПК: A61P 25/24, C07D 237/22, C07D 401/12, C07D 403/12, A61K 31/501, C07D 403/14, A61P 25/28, A61K 31/50, A61P 25/22, C07D 401/14, A61K 31/506
Метки: фармацевтические, алкиламинопиридазинона, производные, замещенные, содержащие, способ, композиции, получения
Код ссылки
<a href="https://eas.patents.su/12-6942-zameshhennye-proizvodnye-alkilaminopiridazinona-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные алкиламинопиридазинона, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: 1,4-двузамещенные производные пиперазина в качестве уроселективных блокаторов альфа1-адренорецепторов
Следующий патент: Способ регионарной интраабдоминальной стимуляции паралитического кишечника
Случайный патент: Азотсодержащее гетероциклическое соединение и сельскохозяйственный фунгицид












