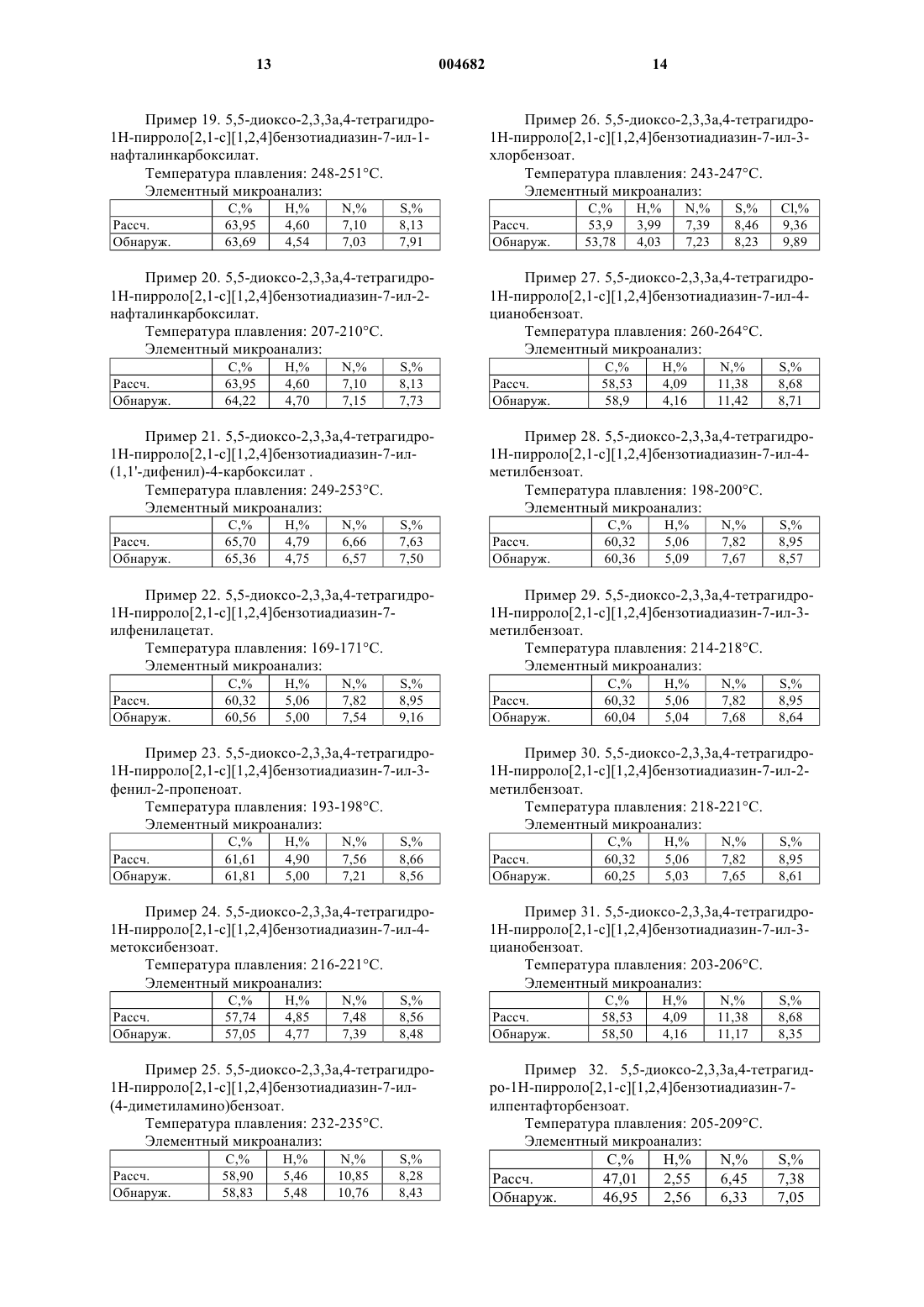
Бензотиадиазиновые соединения, способ их получения и содержащие их фармацевтические композиции
Номер патента: 4682
Опубликовано: 24.06.2004
Авторы: Дезос Патрик, Лестаж Пьер, Лефулон Франсуа, Корди Алекс
Формула / Реферат
1. Соединения формулы (I)
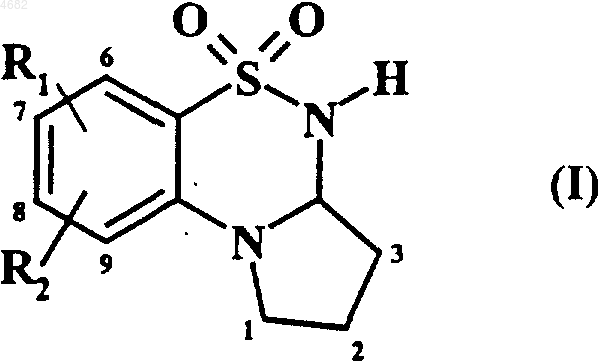
в которой
R1 обозначает гидроксильную, RCO-O- или RCO-NRa-группу,
R2 обозначает водородный атом, атом галогена или гидроксильную, R'CO-O- или R'CO-NR'a-группу,
R и R', которые могут быть одинаковыми или разными, каждый обозначает линейную или разветвленную C1-C6алкильную группу, необязательно замещенную арильную группу, линейную или разветвленную C2-C6алкенильную группу, необязательно замещенную арильную группу, линейную или разветвленную C1-C6пергалоалкильную группу, C3-C7циклоалкильную группу, адамантильную группу, арильную группу или гетероарильную группу,
Ra и R'a, которые могут быть одинаковыми или разными, каждый обозначает водородный атом или линейную или разветвленную C1-C6алкильную группу, линейную или разветвленную C1-C6пергалоалкильную группу, линейную или разветвленную C1-C6ацильную группу, арильную группу или гетероарильную группу,
их изомеры и их аддитивные соли фармацевтически приемлемых кислот или оснований, причем при этом необходимо иметь в виду, что
термин "арильная группа" следует понимать как обозначающий моноциклическую ароматическую группу или бициклическую группу, в которой по меньшей мере одно из колец является ароматическим, причем каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленного C1-C6алкила, линейного или разветвленного C1-C6алкокси, линейного или разветвленного C1-C6пергалоалкила, линейного или разветвленного C1-C6пергалоалкокси, гидроксила, циано-, нитро-, аминогруппы (необязательно замещенной одним или несколькими линейными или разветвленными C1-C6алкилами), аминосульфонила (необязательно замещенного одним или несколькими линейными или разветвленными C1-C6алкилами) и фенила (необязательно замещенного одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленного C1-C6алкила, линейного или разветвленного C1-C6пергалоалкила, гидроксила, линейного или разветвленного C1-C6алкокси),
термин "гетероарильная группа" следует понимать как обозначающий моноциклическую ароматическую группу или бициклическую группу, в которой по меньшей мере одно из колец является ароматическим, причем каждая из этих групп содержит один, два или три одинаковых или разных гетероатома, выбранных из атомов азота, кислорода и серы, и необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленного C1-C6алкила, линейного или разветвленного C1-C6алкокси, линейного или разветвленного C1-C6пергалоалкила, линейного или разветвленного C1-C6пергалоалкокси, гидроксила, циано-, нитро-, аминогруппы (необязательно замещенной одним или несколькими линейными или разветвленными C1-C6алкилами) и аминосульфонила (необязательно замещенного одним или несколькими линейными или разветвленными C1-C6алкилами).
2. Соединения формулы (I) по п.1, отличающиеся тем, что R1 обозначает гидроксильную группу, а R2 обозначает атом водорода или галогена.
3. Соединения формулы (I) по п.1, отличающиеся тем, что R1 обозначает группу RCO-O-, а R2 обозначает атом водорода.
4. Соединения формулы (I) по п.3, отличающиеся тем, что R обозначает C3-C7циклоалкильную группу, арильную группу или гетероарильную группу.
5. Соединения формулы (I) по п.1, которые представляют собой
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-ол,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-илбензоат,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-илциклогексанкарбоксилат,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-илциклобутанкарбоксилат,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-ил-4-метилбензоат,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-ил-3-тиофенкарбоксилат,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-ил-2-тиофенкарбоксилат,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-ил-3-фуранкарбоксилат,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-ил-2-фуранкарбоксилат,
5,5-диоксо-2,3,3a,4-тетрагидро-1H-пирроло[2,1-c][1,2,4]бензотиадиазин-7-илникотинат.
6. Способ получения соединений формулы (I) по п.1, отличающийся тем, что исходное соединение формулы (II)
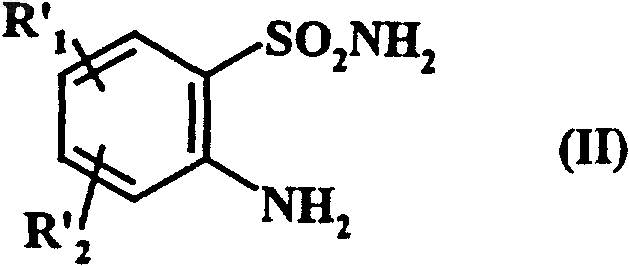
в которой
R'1 обозначает линейную или разветвленную C1-C6алкоксигруппу,
R'2 обозначает водородный атом, атом галогена или линейную или разветвленную C1-C6алкоксигруппу или нитрогруппу,
в присутствии основания в среде тетрагидрофурана или ацетонитрила подвергают взаимодействию с хлорангидридом кислоты формулы (III)
Cl-(CH2)3-COCl (III)
с получением соединения формулы (IV)
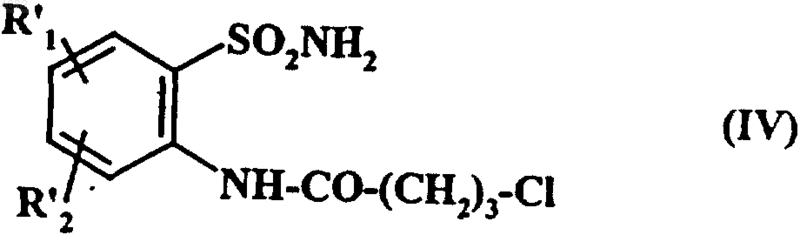
где R'1 и R'2 имеют значения, указанные выше,
которое затем циклизуют в основной среде с получением соединения формулы (V)
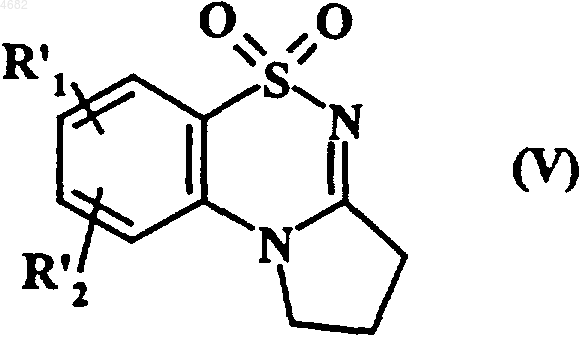
где R'1 и R'2 имеют значения, указанные выше,
которое подвергают восстановлению в спиртовой среде или в среде диметилформамида в присутствии боргидрида натрия с получением соединения формулы (VI)
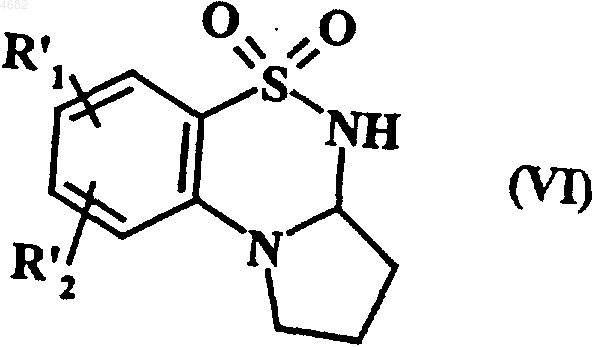
где R'1 и R'2 имеют значения, указанные выше,
полученное соединение формулы (VI) обрабатывают трибромидом бора с получением
либо соединения формулы (I/a), представляющего собой частный случай соединений формулы (I)
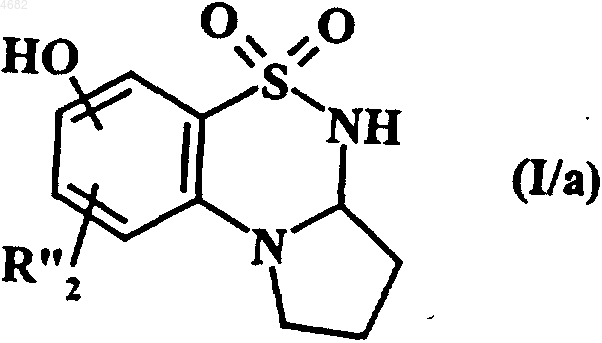
в которой R"2 обозначает водородный атом, атом галогена или гидроксильную группу,
либо соединения формулы (VII)
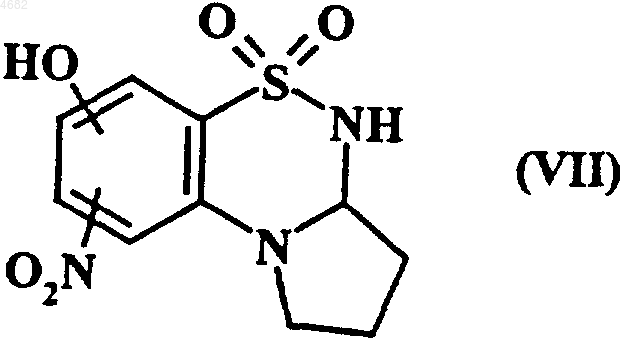
которое затем подвергают восстановлению с получением соответствующего необязательно замещенного амина с последующим одним или двумя ацилированиями с получением соединения формулы (I/b), представляющего собой частный случай соединений формулы (I)
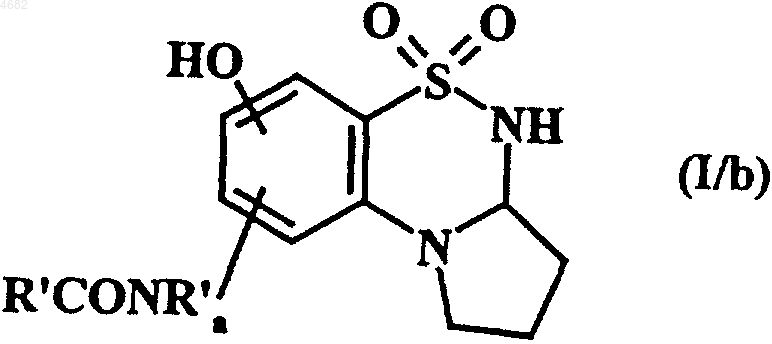
в которой R' и R'a имеют значения, указанные в п.1,
причем гидроксильную группу(группы), содержащуюся(иеся) в соединениях формул (I/a) и (I/b), можно ацилировать с получением соединений формулы (I/d), в которой гидроксильная группа(группы) фенильного кольца превращены в группу R-CO-O или R'-CO-O-, где R и R' имеют значения, указанные в п.1 для формулы (I),
и полученные соединения формул (I/a), (I/b) и (I/d) очищают, если необходимо, в соответствии с обычными методами очистки, разделяют, когда это уместно, на их изомеры в соответствии с обычными методами разделения и превращают, если необходимо, в аддитивные соли фармацевтически приемлемых кислот или оснований.
7. Способ получения соединений формулы (I) по п.1, где R1 означает группу RCO-NRa-, отличающийся тем, что исходное соединение формулы (II)
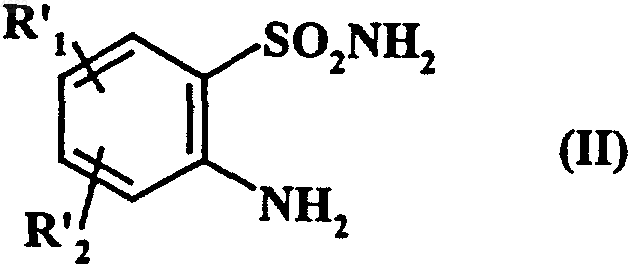
в которой
R1 обозначает нитрогруппу,
R'2 обозначает водородный атом, атом галогена, или линейную или разветвленную C1-C6алкоксигруппу, или нитрогруппу,
в присутствии основания в среде тетрагидрофурана или ацетонитрила подвергают взаимодействию с хлорангидридом кислоты формулы (III)
Cl-(CH2)3-COCl (III)
с получением соединения формулы (IV)
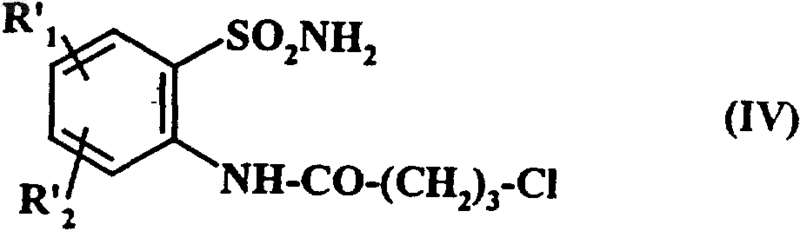
где R'1 и R'2 имеют значения, указанные выше,
которое затем циклизуют в основной среде с получением соединения формулы (V)
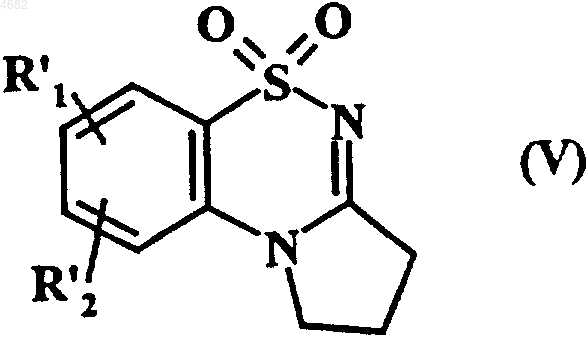
где R'1 и R'2 имеют значения, указанные выше,
которое подвергают восстановлению в спиртовой среде или в среде диметилформамида в присутствии боргидрида натрия с получением соединения формулы (VI)
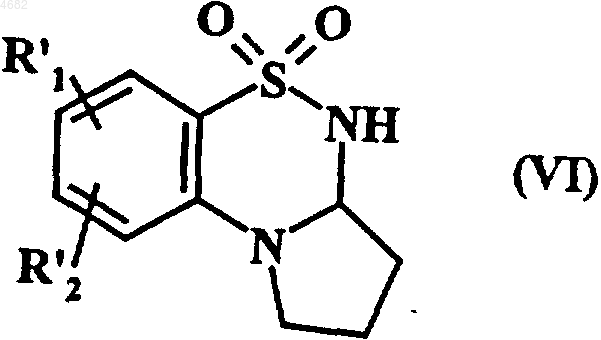
где R'1 и R'2 имеют значения, указанные выше,
полученное соединение формулы (VI) подвергают восстановлению с получением соответствующего амина, который необязательно замещен, а затем ацилированию с получением соединения формулы (I/c), представляющего собой частный случай соединения формулы (I)
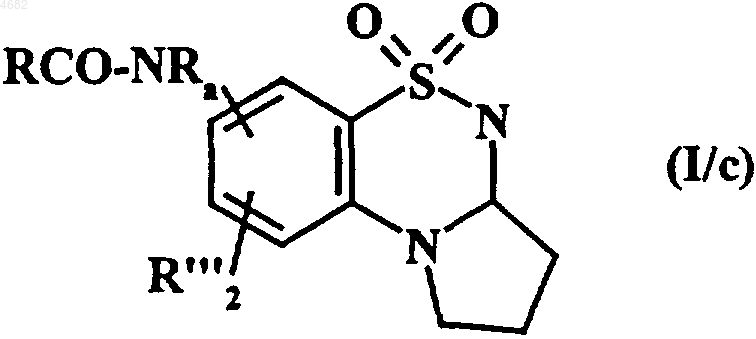
в которой R и Ra имеют значения, указанные выше,
а R'"2 обозначает водородный атом, атом галогена или гидроксильнуюгруппу или группу R'CONR'a, в которой R' и Ra' имеют значения, указанные в п.1 для формулы (I),
причем гидроксильную группу, содержащуюся в соединении формулы (I/c), можно ацилировать с получением соединений формулы (I/d), в которой гидроксильная группа фенильного кольца превращена в группу R'-CO-O-, где R' имеет значения, указанные в п.1 для формулы (I), полученные соединения формул (I/c) и (I/d) очищают, если необходимо, в соответствии с обычными методами очистки, разделяют, когда это уместно, на их изомеры в соответствии с обычными методами разделения и превращают, если необходимо, в аддитивные соли фармацевтически приемлемых кислот или оснований.
8. Фармацевтические композиции, в качестве действующего компонента включающие соединение формулы (I) по любому из пп.1-5 в сочетании с одним или несколькими инертными, нетоксичными фармацевтически приемлемыми наполнителями или носителями.
9. Фармацевтические композиции по п.8, в качестве действующего компонента включающие соединение по любому из пп.1-5 для применения в качестве AMPA модуляторов.
Текст
1 Настоящее изобретение относится к новым бензотиадиазиновым соединениям, к способу их получения и их содержащим фармацевтическим композициям. В настоящее время известно, что возбуждающие аминокислоты, а более конкретно глутамат, играют ключевую роль в физиологических процессах неврологической пластичности и в механизмах, лежащих в основе познавательной способности и памяти. Патофизиологические исследования ясно указывают на то, что дефицит глютаматергической нейтротрансмиссии тесно связан с развитием болезни Альцгеймера (Neuroscience and Biobehavioral reviews,1992, 16, 13-24; Progress in Neurobiology, 1992,39, 517-545). Кроме того, многочисленные исследования последних лет показывают наличие возбуждения аминокислотных рецепторных подтипов и их функциональное взаимодействие (MolecularNeuropharmacology, 1992, 2, 15-31). Среди таких рецепторов рецептор АМРА("-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты"), по-видимому, наиболее вовлечен в явление физиологической нервной возбудимости и в особенности в такие явления,которые вовлечены в процессы запоминания. Так, например, показано, что процесс обучения сопряжен с усилением связывания АМРА с его рецептором в гиппокампии, одном из участков головного мозга, имеющем существенное значение для процессов запоминания. Подобным же образом совсем недавно ноотропные агенты,такие как анирацетам, были описаны как безусловные модуляторы АМРА рецепторов нервных клеток (Journal of Neurochemistry, 1992, 58,1199-1204). Как обладающие тем же механизмом действия и как улучшающие характеристики памяти в литературе описаны соединения бензамидного строения (Synapse, 1993, 15, 326-329). Из этих новых фармакологических агентов наиболее активно, в частности, соединение ВА-74. Наконец, в ЕР 692484 описано бензотиадиазиновое соединение, способствующее воздействию на истечение АМРА, а в WO 99/42456 кроме прочего в качестве модуляторов рецептора АМРА описан ряд бензотиадиазиновых соединений. Помимо того, что они являются новыми,бензотиадиазиновые соединения, которые составляют объект настоящего изобретения, проявляют фармакологическое действие на истечение АМРА, которое несомненно превосходит действие соединений аналогичного строения,которые описаны в ранее известной литературе. Их можно использовать в качестве АМРА модуляторов для лечения или профилактики нарушения способности к запоминанию, ассоциированной со старостью, беспокойством или депрессивными синдромами, прогрессирующими нейрогенеративными расстройствами, бо 004682 2 лезнью Альцгеймера, болезнью Пика, хореей Хантингтона, шизофренией, последствием острых нейродегенеративных расстройств, следствием ишемии и результатом эпилепсии. Объектом настоящего изобретения являются соединения формулы (I)RCO-NRa- группу,R2 обозначает водородный атом, атом галогена или гидроксильную, R'CO-O-или R'CONR'a-группу,R и R', которые могут быть одинаковыми или разными, каждый обозначает линейную или разветвленную С 1-С 6 алкильную группу, необязательно замещенную арильную группу, линейную или разветвленную С 2-С 6 алкенильную группу, необязательно замещенную арильную группу, линейную или разветвленную С 1 С 6 пергалоалкильную группу, С 3-С 7 циклоалкильную группу, адамантильную группу,арильную группу или гетероарильную группу,Ra и R'a, которые могут быть одинаковыми или разными, каждый обозначает водородный атом или линейную или разветвленную С 1 С 6 алкильную группу, линейную или разветвленную С 1-С 6 пергалоалкильную группу, линейную или разветвленную С 1-С 6 ацильную группу,арильную группу или гетероарильную группу,их изомеры и их аддитивные соли фармацевтически приемлемых кислот или оснований,причем необходимо иметь в виду, что понятие "арильная группа" использовано как обозначающее моноциклическую ароматическую группу или бициклическую группу, в которой по меньшей мере одно из колец является ароматическим, причем каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленного С 1-С 6 алкила, линейного или разветвленного С 1-С 6 алкокси, линейного или разветвленного C1-С 6 пергалоалкила, линейного или разветвленного С 1-С 6 пергалоалкокси, гидроксила, циано-, нитро-, аминогруппы (необязательно замещенной одним или несколькими линейными или разветвленными С 1 С 6 алкилами), аминосульфонила (необязательно замещенного одним или несколькими линейными или разветвленными С 1-С 6 алкилами) и фенила (необязательно замещенного одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленного С 1-С 6 алкила, линейного или разветвленного С 1-С 6 пергалоалкила, линейного или разветвленного С 1-С 6 алкокси),понятие "гетероарильная группа" использовано как обозначающее моноциклическую 3 ароматическую группу или бициклическую группу, в которой по меньшей мере одно из колец является ароматическим, причем каждая из этих групп содержит один, два или три одинаковых или разных гетероатома, выбранных из атомов азота, кислорода и серы, и необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленногоC1-С 6 алкила, линейного или разветвленного С 1 С 6 алкокси, линейного или разветвленного С 1 С 6 пергалоалкила, линейного или разветвленногоC1-С 6 пергалоалкокси, гидроксила, циано-, нитро-, аминогруппы (необязательно замещенной одним или несколькими линейными или разветвленными C1-С 6 алкилами) и аминосульфонила (необязательно замещенного одним или несколькими линейными или разветвленными С 1-С 6 алкилами). Среди фармацевтически приемлемых кислот в качестве неограничивающих примеров можно упомянуть соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту,лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований в качестве неограничивающих примеров можно упомянуть гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными арильными группами являются необязательно замещенные фенильная, нафтильная и тетрагидронафтильная группы. Предпочтительными гетероарильными группами являются необязательно замещенные пиридильная, пирролильная, тиенильная, фурильная, имидазолильная и индолильная группы, а более предпочтительны пиридильная, тиенильная и фурильная группы. Некоторые предпочтительные соединения по изобретению представляют собой соединения формулы (I), в которой R1 обозначает гидроксильную группу, a R2 обозначает атом водорода или галогена. Другими предпочтительными соединениями по изобретению являются соединения формулы (I), в которой R1 обозначает группу RCOO-, a R2 обозначает атом водорода. Когда у соединений по изобретению R1 обозначает группу RCO-O-, a R2 обозначает водородный атом, предпочтительной группой R является С 3-С 7 циклоалкильная группа, арильная группа или гетероарильная группа. В предпочтительном варианте у соединений формулы (I) заместитель R1 находится в 7-м положении. 4 Предпочтительные соединения по изобретению представляют собой 5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ол,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илбензоат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илциклогексанкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илциклобутанкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-4-метилбензоат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-3-тиофенкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-2-тиофенкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-3-фуранкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-2-фуранкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илникотинат. Объектом настоящего изобретения является также способ получения соединений формулы (I), характеризующийся тем, что при его осуществлении в качестве исходного материала используют соединение формулы (II)R'1 обозначает линейную или разветвленную C1-С 6 алкоксигруппу или нитрогруппу,R'2 обозначает водородный атом, атом галогена или линейную или разветвленную С 1 С 6 алкоксигруппу или нитрогруппу, которое в присутствии основания в среде тетрагидрофурана или ацетонитрила вводят во взаимодействие с хлорангидридом кислоты формулы (III)(III) Сl-(СН 2)3-СОСl с получением соединения формулы (IV) где R'1 и R'2 имеют значения, указанные выше,которое затем циклизуют в основной среде с получением соединения формулы (V) где R'1 и R'2 имеют значения, указанные выше,которое подвергают восстановлению в спиртовой среде или в среде диметилформамида в 5 присутствии боргидрида натрия с получением соединения формулы (VI) где R'1 и R'2 имеют значения, указанные выше,причем соединение формулы (VI)когда R'1 обозначает линейную или разветвленную С 1-С 6 алкоксигруппу, обрабатывают воздействием трибромида бора, с получением либо соединения формулы (I/a) как частный случай соединений формулы (I) в которой R"2 обозначает водородный атом,атом галогена или гидроксильную группу,либо соединения формулы (VII) которое затем подвергают восстановлению с получением соответствующего амина, который необязательно замещен, а затем подвергают одному или двум последующим ацилированиям с получением соединения формулы (I/b), как частный случай соединений формулы (I) в которой R' и R'a имеют значения, указанные в описании формулы (I), когда R'1 обозначает нитрогруппу, подвергают восстановлению с получением соответствующего амина, который необязательно замещен, а затем ацилированию с получением соединения формулы (I/с) в которой R и Ra имеют значения, указанные выше, a R'"2 обозначает водородный атом, атом галогена или гидроксильную группу или группу(I/с), можно ацилировать с получением соединений формулы (I/d), в которой гидроксильная группа (группы) фенильного кольца превращена в группу R-CO-О или R'-CO-O-, где R и R' имеют значения, указанные в описании формулы(I), причем соединения формул с (I/a) no (I/d) в совокупности составляют соединения формулы(I), которые очищают, если необходимо, в соответствии с обычными методами очистки, разделяют, когда это уместно, на их изомеры в соответствии с обычными методами разделения и превращают, если необходимо, в аддитивные 6 соли фармацевтически приемлемых кислот или оснований. Объектом настоящего изобретения являются также фармацевтические композиции, в качестве действующего компонента включающие соединение формулы (I) совместно с одним или несколькими приемлемыми инертными,нетоксичными наполнителями. Среди предлагаемых в соответствии с изобретением фармацевтических композиций более конкретно можно упомянуть те, которые приемлемы для перорального, парентерального (внутривенного или подкожного) или интраназального введения, в частности таблетки или драже, таблетки для подъязычного приема, желатиновые капсулы,лепешки, суппозитории, кремы, мази, дермальные гели, препараты для инъекций, суспензии для питья и т.д. Эффективная доза может быть адаптирована к природе и серьезности заболевания, пути введения, возрасту и массе пациента. Эта доза варьируется от 1 до 500 мг для одного или нескольких приемов в день. Сущность изобретения иллюстрируют следующие примеры, которыми его объем не ограничивается. Используемые исходные материалы являются известными продуктами или получаемыми в соответствии с известными методами. Строение описанных в этих примерах соединений определяли в соответствии с обычными методами спектрофотометрического анализа(инфракрасного, ЯМР, масс-спектрометрического и т.д.). Пример 1. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]-бензотиадиазин-7-ол. Стадия A: N-[2-(аминосульфонил)-4-метоксифенил]-4-хлорбутанамид 144 ммоля триэтиламина вводят в раствор,содержащий 96,4 ммоля 2-амино-5-метоксибензолсульфонамида в 200 мл тетрагидрофурана (ТГФ), с последующим добавлением по каплям раствора, содержащего 135 ммоля хлорангидрида 4-хлормасляной кислоты в 30 мл ТГФ. После перемешивания в течение ночи при комнатной температуре ТГФ удаляют выпариванием, а остаток растворяют в воде. После экстракции этилацетатом органическую фазу промывают и сушат. После выпаривания в виде масла получают целевой продукт. Стадия Б: 5,5-диоксо-7-метокси-2,3-дигидро-1 Н-пирроло[2,1-с][1,2,4]-бензотиадиазин Продукт, полученный на предыдущей стадии, перемешивают в течение ночи при комнатной температуре в 320 мл водного 1 н. раствора гидроксида натрия. После добавления 50 мл этилацетата и интенсивного перемешивания целевой продукт осаждают, отфильтровывают,промывают и сушат. Стадия В: 5,5-диоксо-7-метокси-2,3,3 а,4 тетрагидро-1 Н-пирроло[2,1-с]-[1,2,4]бензотиадиазин 106,5 ммоля боргидрида натрия вводят в суспензию, содержащую 35,5 ммоля продукта,полученного на предыдущей стадии, в 40 мл диметилформамида (ДМФ). После перемешивания в течение ночи при комнатной температуре реакционную смесь охлаждают, а затем в эту смесь добавляют 150 мл охлажденного льдом 1 н. раствора соляной кислоты. Целевой продукт осаждают и отфильтровывают. Температура плавления: 193-198 С. Элементный микроанализ: Рассч. Обнаруж.-60 С в азотной атмосфере, содержащую 26,7 ммоля продукта, полученного на предыдущей стадии, в 350 мл дихлорметана, по каплям добавляют 79,3 ммоля трибромида бора. Температуру поддерживают в течение одного часа, а затем температуру всей массы возвращают к комнатной и перемешивают в течение ночи. После охлаждения реакционной смеси на ледяной бане добавляют 100 мл воды и двухфазную систему, которая образуется, интенсивно перемешивают. Образовавшуюся суспензию фильтруют. Полученное белое твердое вещество промывают водой и диэтиловым эфиром и сушат с получением целевого продукта. Температура плавления: 237-242 С. Элементный микроанализ: Рассч. Обнаруж. Продукты примеров со 2 по 4 получают с использованием соответствующих исходных материалов в соответствии с методом, описанным в примере 1. Пример 2. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]-бензотиадиазин-6-ол. На стадии А 2-амино-5-метоксибензолсульфонамид заменяют 2-амино-6-метоксибензолсульфонамидом. Температура плавления: 300 С. Элементный микроанализ: Рассч. Обнаруж. Пример 5. 5,5-диоксо-9-фтор-2,3,3 а,4 тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ол. Стадия A: N-[2-(аминосульфонил)-4-метокси-6-фторфенил]4-хлорбутанамид На стадии А, осуществляемой аналогично примеру 1,2-амино-5-метоксибензолсульфонамид заменяют 2-амино-3-фтор-5-метоксибензолсульфонамидом. Стадия Б: 3-фтор-5-метокси-2-(2-оксопирролидин-1-ил)бензолсульфонамид Целевой продукт получают в условиях,указанных в описании стадии Б примера 1, используя в качестве исходного соединение, указанное в описании предыдущей стадии. Температура плавления: 205 С. Стадия В: 5,5-диоксо-9-фтор-7-метокси 2,3-дигидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин 9,5 ммоля 1,8-диазабицикло[5.4.0]ундец-7 ен вводят в 4,75 ммоля продукта, указанного в описании предыдущей стадии, в 20 мл ТГФ. Всю массу кипятят с обратным холодильником при перемешивании в течение 5 ч. После разбавления водой осадок, который образуется,отфильтровывают, промывают водой и сушат,получая целевой продукт. Температура плавления: 215 С. Стадия Г: 5,5-диоксо-9-фтор-7-метокси 2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин Целевой продукт получают в соответствии с методом, представленным в описании стадии В примера 1, используя в качестве исходного соединение, полученное на предыдущей стадии. Температура плавления: 145 С. Стадия Д: 5,5-диоксо-9-фтор-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ол Целевой продукт получают в соответствии с методом, представленным в описании стадии Г примера 1, используя в качестве исходного соединение, полученное на предыдущей стадии. Температура плавления: 167-169 С. Элементный микроанализ: Рассч. Обнаруж. Пример 6. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-9-ол. Целевой продукт получают в соответствии с методом, представленным в описании стадии А примера 5, заменяя 2-амино-3-фтор-5 метоксибензолсульфонамид 2-амино-3-метоксибензолсульфонамидом. Температура плавления: 215-217 С. Элементный микроанализ: Рассч. Обнаруж. Пример 6 а. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7,8 диол. Целевой продукт получают в соответствии с методом, представленным в описании стадии А примера 5, заменяя 2-амино-3-фтор-5 метоксибензолсульфонамид 2-амино-4,5-диметоксибензолсульфонамидом. Температура плавления: 310 С. Элементный микроанализ: Рассч. Обнаруж. Пример 7. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илацетат 60 мг 4-диметиламинопиридина и 4,16 ммоля уксусного ангидрида вводят в суспензию,включающую 4,16 ммоля соединения, описанного в примере 1, в 30 мл дихлорметана. По прошествии 20 мин перемешивания реакционную смесь разбавляют 30 мл дихлорметана. Органическую фазу промывают, сушат и затем выпаривают. Растворением полученного белого твердого вещества в изопропиловом эфире и фильтрованием получают целевой продукт. Температура плавления: 163-165 С. Элементный микроанализ: Рассч. Обнаруж.- и -изомеры соединения, упомянутого в примере 7, разделяют хиральной хроматографией в колонке Chiralpac AD с использованием в качестве элюирующего растворителя смеси нгептана/этанола/триэтиламина (в соотношении 450/550/2). После разделения каждый изомер очищают хроматографией в колонке с диоксидом кремния с использованием в качестве элюирующего растворителя смеси дихлорметана/метанола/триэтиламина (в соотношении 950/50/1). Пример 8. Пример 10. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илпивалат 1,66 ммоля соединения примера 1 в 40 мл ацетонитрила перемешивают в течение ночи при комнатной температуре в присутствии 3,33 ммоля хлорметилпивалата и каталитически эффективного количества дициклогексил-18-крон 6. Суспензию фильтруют и фильтрат выпаривают досуха. Остаток растворяют в дихлорметане и органическую фазу промывают 1 н. раствором соляной кислоты, а затем водным насыщенным раствором хлорида натрия. После сушки и выпаривания образующийся маслянистый остаток кристаллизуют из смеси диэтилового эфира/циклогексана с получением целевого продукта. Температура плавления: 198-202 С. Элементный микроанализ: Рассч. Обнаруж. Пример 11. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илбензоат. Целевой продукт получают в соответствии с методом, описанным в примере 7, с заменой уксусного ангидрида бензойным ангидридом. Температура плавления: 195 С. Элементный микроанализ: Рассч. Обнаруж.- и -изомеры соединения, упомянутого в примере 11, разделяют хиральной хроматографией в колонке Whelk 01 с использованием изопропанола в качестве элюирующего растворителя. После разделения каждый изомер очищают хроматографией в колонке с диоксидом кремния с использованием в качестве элюирующего растворителя смеси дихлорметана/метанола (в соотношении 99/1). Пример 11 а. Пример 12. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-4 хлорбензоат. Целевой продукт получают в соответствии с методом, описанным в примере 7, с заменой уксусного ангидрида хлорангидридом пхлорбензойной кислоты и добавлением 1,1 экв. триэтиламина. Температура плавления: 160 С. Элементный микроанализ: Рассч. Обнаруж. Пример 13. N-(5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин 7-ил)бензамид. Стадия А: 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-амин 37 ммолей формиата аммония и 300 мл 10%-ного Pd/C добавляют к 3,71 ммоля 5,5 диоксо-7-нитро-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазина,суспендированного в 100 мл метанола. После 90 мин перемешивания при кипячении с обратным холодильником катализатор отфильтровывают в горячем состоянии и промывают метанолом. Фильтрат выпаривают и остаток растворяют в воде. Отфильтровыванием осадка получают целевой продукт. Элементный микроанализ: Рассч. Обнаруж. Стадия Б: N-(5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин 7-ил)бензамид 1,32 ммоля соединения, полученного на предыдущей стадии, в 100 мл дихлорметана в 12 течение ночи перемешивают в присутствии 1,45 ммоля бензойного ангидрида и 10 мг 4 диметиламинопиридина. После выпаривания досуха остаток растворяют в смеси этилацетата/1 н. соляной кислоты. После перемешивания органическую фазу промывают, а затем выпаривают. Остаток растворяют в диэтиловом эфире и отфильтровыванием осадка, который образуется, получают целевой продукт. Температура плавления: 293 С. Соединения, представленные в следующих примерах, получают реакцией конденсации соединения примера 1 с соответствующим хлорангидридом кислоты в присутствии 1,5 экв. триэтиламина и каталитически эффективного количества диметиламинопиридина. Пример 14. 5,5-диоксо-2,3,3 а,4-тетрагидро 1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илциклогексанкарбоксилат. Температура плавления: 157 С. Элементный микроанализ: Рассч. Обнаруж. 16 Фармакологические изучения соединений по изобретению Изучение потоков возбуждения, индуцируемых АМРА в ооцитах Xenopus а - метод: мРНК получают из коры головного мозга самцов крыс линии Wistar по методу с гуанидинтиоцианатом/фенолом/хлороформом. Поли(А+) мРНК выделяют хроматографией на олигоdT целлюлозе и вводят в количестве 50 нг на ооцит. Для обеспечения экспрессии рецепторов ооциты инкубируют при 18 С в течение от 2 до 3 дней и затем хранят при температуре от 8 до 10 С. Регистрацию электрофизиологической активности выполняют при температуре от 20 до 24 С в камере из материала Plexiglass в средеOR2 (J.Exp.Zool, 1973, 184, 321-334), используя метод "вольт-кламп" с 2 электродами, помещая 3-й электрод в баню в качестве электрода сравнения. Все соединения вводят в инкубационную среду и в конце периода введения измеряют электрический ток. АМРА используют в концентрации 10 мкМ. Для каждого из изучаемых соединений определяют концентрацию, при которой интенсивность потока, индуцируемого только АМРА (от 5 до 50 нА), становится двойной (ЕС 2 Х) или пятикратной (ЕС 5 Х). б - результаты: Соединения по изобретению весьма значительно усиливают возбуждающее воздействие АМРА, и совершенно очевидно, что их активность превышает активность сравнительных соединений. Соединение Прим.1 Прим.4 Прим. 7 Прим.8 Прим.9 Прим.10 Прим.11 Прим.28 Прим.34 Прим.36 Прим.37 Фармацевтическая композиция Композиция для изготовления 1000 таблеток, каждая из которых включает 100 миллиграммовую дозу. Соединение примера 1 Гидроксипропилцеллюлоза Пшеничный крахмал Лактоза Стеарат магния ТалькRCO-NRa-группу,R2 обозначает водородный атом, атом галогена или гидроксильную, R'CO-O- или R'CONR'a-группу,R и R', которые могут быть одинаковыми или разными, каждый обозначает линейную или разветвленную С 1-С 6 алкильную группу, необязательно замещенную арильную группу, линейную или разветвленную С 2-С 6 алкенильную группу, необязательно замещенную арильную группу, линейную или разветвленную C1 С 6 пергалоалкильную группу, C3-С 7 циклоалкильную группу, адамантильную группу,арильную группу или гетероарильную группу,Ra и R'a, которые могут быть одинаковыми или разными, каждый обозначает водородный атом или линейную или разветвленную С 1 С 6 алкильную группу, линейную или разветвленную С 1-С 6 пергалоалкильную группу, линейную или разветвленную С 1-С 6 ацильную группу,арильную группу или гетероарильную группу,их изомеры и их аддитивные соли фармацевтически приемлемых кислот или оснований,причем при этом необходимо иметь в виду, что термин "арильная группа" следует понимать как обозначающий моноциклическую ароматическую группу или бициклическую группу, в которой по меньшей мере одно из колец является ароматическим, причем каждая из этих групп необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленного C1-С 6 алкила, линейного или разветвленного C1-С 6 алкокси, линейного или разветвленного С 1-С 6 пергалоалкила, линейного или разветвленного С 1-C6 пергалоалкокси, гидроксила, циано-, нитро-, аминогруппы (необязательно замещенной одним или несколькими линейными или разветвленными C1-С 6 алкилами), аминосульфонила (необязательно замещенного одним или несколькими линейными или разветвленными С 1-С 6 алкилами) и фенила(необязательно замещенного одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленного С 1-С 6 алкила, линейного или разветвленного C1-C6 пергалоалкила, гидроксила, линейного или разветвленного С 1-С 6 алкокси),термин "гетероарильная группа" следует понимать как обозначающий моноциклическую ароматическую группу или бициклическую группу, в которой по меньшей мере одно из ко 004682 18 лец является ароматическим, причем каждая из этих групп содержит один, два или три одинаковых или разных гетероатома, выбранных из атомов азота, кислорода и серы, и необязательно замещена одной или несколькими одинаковыми или разными группами, выбранными из атомов галогена, линейного или разветвленного С 1-С 6 алкила, линейного или разветвленного С 1 С 6 алкокси, линейного или разветвленного С 1 С 6 пергалоалкила, линейного или разветвленного С 1-С 6 пергалоалкокси, гидроксила, циано-, нитро-, аминогруппы (необязательно замещенной одним или несколькими линейными или разветвленными С 1-С 6 алкилами) и аминосульфонила (необязательно замещенного одним или несколькими линейными или разветвленнымиC1-С 6 алкилами). 2. Соединения формулы (I) по п.1, отличающиеся тем, что R1 обозначает гидроксильную группу, a R2 обозначает атом водорода или галогена. 3. Соединения формулы (I) по п.1, отличающиеся тем, что R1 обозначает группу RCOO-, a R2 обозначает атом водорода. 4. Соединения формулы (I) по п.3, отличающиеся тем, что R обозначает С 3 С 7 циклоалкильную группу, арильную группу или гетероарильную группу. 5. Соединения формулы (I) по п.1, которые представляют собой 5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ол,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илбензоат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илциклогексанкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илциклобутанкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-4-метилбензоат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-3-тиофенкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-2-тиофенкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-3-фуранкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил-2-фуранкарбоксилат,5,5-диоксо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-илникотинат. 6. Способ получения соединений формулы(I) по п.1, отличающийся тем, что исходное соединение формулы (II)R'1 обозначает линейную или разветвленную С 1-С 6 алкоксигруппу,R'2 обозначает водородный атом, атом галогена или линейную или разветвленную С 1 С 6 алкоксигруппу или нитрогруппу,в присутствии основания в среде тетрагидрофурана или ацетонитрила подвергают взаимодействию с хлорангидридом кислоты формулы (III) Сl-(СН 2)3-СОСl (III) с получением соединения формулы (IV) где R'1 и R'2 имеют значения, указанные выше,которое затем циклизуют в основной среде с получением соединения формулы (V) где R'1 и R'2 имеют значения, указанные выше,которое подвергают восстановлению в спиртовой среде или в среде диметилформамида в присутствии боргидрида натрия с получением соединения формулы (VI) где R'1 и R'2 имеют значения, указанные выше,полученное соединение формулы (VI) обрабатывают трибромидом бора с получением либо соединения формулы (I/a), представляющего собой частный случай соединений формулы (I) в которой R"2 обозначает водородный атом,атом галогена или гидроксильную группу,либо соединения формулы (VII) которое затем подвергают восстановлению с получением соответствующего необязательно замещенного амина с последующим одним или двумя ацилированиями с получением соединения формулы (I/b), представляющего собой частный случай соединений формулы (I)(I/a) и (I/b), можно ацилировать с получением соединений формулы (I/d), в которой гидроксильная группа(группы) фенильного кольца превращены в группу R-CO-O или R'-CO-O-, гдеR и R' имеют значения, указанные в п.1 для формулы (I),и полученные соединения формул (I/a),(I/b) и (I/d) очищают, если необходимо, в соответствии с обычными методами очистки, разделяют, когда это уместно, на их изомеры в соответствии с обычными методами разделения и превращают, если необходимо, в аддитивные соли фармацевтически приемлемых кислот или оснований. 7. Способ получения соединений формулы(I) по п.1, где R1 означает группу RCO-NRa-,отличающийся тем, что исходное соединение формулы (II)R1 обозначает нитрогруппу,R'2 обозначает водородный атом, атом галогена, или линейную или разветвленную С 1 С 6 алкоксигруппу, или нитрогруппу,в присутствии основания в среде тетрагидрофурана или ацетонитрила подвергают взаимодействию с хлорангидридом кислоты формулы (III) Сl-(СН 2)3-СОСl (III) с получением соединения формулы (IV) где R'1 и R'2 имеют значения, указанные выше,которое затем циклизуют в основной среде с получением соединения формулы (V) где R'1 и R'2 имеют значения, указанные выше,которое подвергают восстановлению в спиртовой среде или в среде диметилформамида в присутствии боргидрида натрия с получением соединения формулы (VI) где R'1 и R'2 имеют значения, указанные выше,полученное соединение формулы (VI) подвергают восстановлению с получением соответствующего амина, который необязательно замещен, а затем ацилированию с получением соединения формулы (I/с), представляющего собой частный случай соединения формулы (I) в которой R и Ra имеют значения, указанные выше,a R'"2 обозначает водородный атом, атом галогена или гидроксильную группу или группу(I/d), в которой гидроксильная группа фенильного кольца превращена в группу R'-CO-O-, где(I), полученные соединения формул (I/с) и (I/d) 22 очищают, если необходимо, в соответствии с обычными методами очистки, разделяют, когда это уместно, на их изомеры в соответствии с обычными методами разделения и превращают,если необходимо, в аддитивные соли фармацевтически приемлемых кислот или оснований. 8. Фармацевтические композиции, в качестве действующего компонента включающие соединение формулы (I) по любому из пп.1-5 в сочетании с одним или несколькими инертными, нетоксичными фармацевтически приемлемыми наполнителями или носителями. 9. Фармацевтические композиции по п.8, в качестве действующего компонента включающие соединение по любому из пп.1-5 для применения в качестве АМРА модуляторов.
МПК / Метки
МПК: A61K 31/549, C07D 513/04, A61P 25/28
Метки: получения, содержащие, способ, композиции, соединения, фармацевтические, бензотиадиазиновые
Код ссылки
<a href="https://eas.patents.su/12-4682-benzotiadiazinovye-soedineniya-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Бензотиадиазиновые соединения, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Кристаллический терапевтический агент
Следующий патент: Фармацевтическая композиция, содержащая омепразол
Случайный патент: Пневматически работающая распределительная машина