Региоселективный синтез производных рапамицина
Номер патента: 4331
Опубликовано: 29.04.2004
Авторы: Фортье Женевьев, Селлстедт Джон Гамильтон, Нурельдин Раззак, Шо Чиа-Ченг, Чил Глория Карен
Формула / Реферат
1. Способ получения простого 31-силилового эфира рапамицина, включающий
(a) взаимодействие рапамицина с силилирующим агентом с образованием простого 31, 42-бис-силилового эфира рапамицина; и
(b) гидролиз простого 31, 42-бис-силилового эфира холодной разбавленной кислотой с получением простого 31-силилового эфира рапамицина.
2. Способ получения сложного 42-эфира или простого эфира рапамицина, имеющего структуру
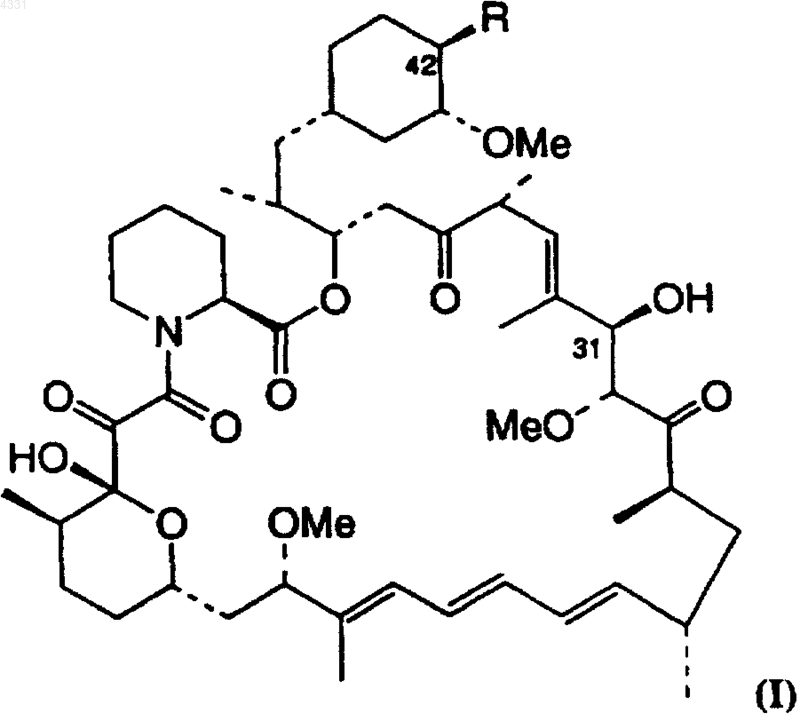
в которой R представляет сложный или простой эфир, включающий
(a) взаимодействие рапамицина с силилирующим агентом с образованием простого 31, 42-бис-силилового эфира рапамицина;
(b) гидролиз простого 31, 42-бис-силилового эфира в холодной разбавленной кислоте с получением простого 31-силилового эфира рапамицина;
(c) обработку простого 31-силилового эфира рапамицина подходящим этерифицирующим реагентом для получения сложного или простого эфира с образованием соответственно 42-сложного или простого эфира 31-силилового эфира рапамицина; и
(d) гидролиз 31-силилового эфира в холодной разбавленной кислоте с получением желаемого сложного или простого 42-эфира рапамицина; и, при желании, последовательно или одновременно удаление любой другой присутствующей защитной группы.
3. Способ по п.2, в котором R в соединении формулы (I) выбран из или
(i) -O-C=OCR7R8R9; (т.е. сложные эфиры), где R7 представляет водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-7 атомов углерода, алкинил, содержащий 2-7 атомов углерода, -(CR3R4)fOR10, -CF3, -F или -CO2R11;
R8 и R9, каждый независимо, представляет водород, алкил, содержащий 1-6 атомов углерода, или -(CR3R4)fOR10, или R8 и R9 могут быть взяты вместе с образованием X;
R10 представляет водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-7 атомов углерода, алкинил, содержащий 2-7 атомов углерода, трифенилметил, бензил, алкоксиметил, содержащий 2-7 атомов углерода, хлорэтил или тетрагидропиранил;
X представляет 5-(2,2-ди(алкил с 1-6 атомами углерода))[1,3] диоксанил, 5-(2-спиро(циклоалкил с 3-8 атомами углерода))[1,3]диоксанил, 4-(2,2-ди(алкил с 1-6 атомами углерода))[1,3]диоксанил, 4-(2-спиро(циклоалкил с 3-8 атомами углерода))[1,3]диоксанил, 4-(2,2-ди(алкил с 1-6 атомами углерода))[1,3]диоксаланил или 4-(2-спиро(циклоалкил с 3-8 атомами углерода))[1,3]диоксаланил;
R3 и R4, каждый независимо, представляет водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-7 атомов углерода, алкинил, содержащий 2-7 атомов углерода, трифторметил или -F; и
f = 0-6; при условии, что R содержит по меньшей мере одну группу -(CR3R4)fOR10 или X;
или
(ii) -OR1 (т.е. простые эфиры), где R1 представляет алкил, тиоалкил, арилалкил, гидроксиалкил, дигидроксиалкил, гидроксиалкиларилалкил, дигидроксиалкиларилалкил, алкоксиалкил, ацилоксиалкил, аминоалкил, алкиламиноалкил, алкоксикарбониламиноалкил, ациламиноалкил, арилсульфонамидоалкил, аллил, дигидроксиалкилаллил и диоксоланилаллил, карбалкоксиалкил, где "алк-" или "алкил" относится к C1-6-алкилу, разветвленному или линейному, предпочтительно C1-3-алкилу, в котором углеродная цепь может быть необязательно прервана связью простого эфира (-O-); "ацил" представляет алкилкарбонил и "арил" имеет 6-10 атомов углерода.
4. Способ по п.3, в котором R1 выбран из гидроксиалкила, гидроксиалкоксиалкила, ациламиноалкила и аминоалкила.
5. Способ по п.4, в котором R1 выбран из 2-гидроксиэтила; 3-гидроксипропила; 2-[(2-гидрокси)этокси]этила и 2-ацетаминоэтила.
6. Способ по п.2, в котором R в соединении формулы (I) представляет 2,2-бис(гидроксиметил)пропионилокси или 2,2,5-триметил[1,3-диоксан]-5-карбонилокси.
7. Способ по п.6, в котором стадию сложной этерификации (c) осуществляют с использованием хлорангидрида 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты или 2,4,6-трихлорбензоилового смешанного ангидрида 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты.
8. Способ по п.7, который осуществляют в растворителе, включающем метиленхлорид.
9. Способ по п.7 или 8, который осуществляют при температуре от около -50 до около 25шC.
10. Способ по любому из пп.2-9, в котором кислота на стадии (d) является разбавленной неорганической кислотой.
11. Способ по п.10, в котором кислотой является серная, хлористо-водородная или фосфорная кислота.
12. Способ по любому из пп.2-11, в котором кислота, используемая на стадии (d), является от около 0,1 до около 3 нормальной.
13. Способ по любому из пп.2-11, в котором кислота, используемая на стадии (d), является от около 0,2 до около 2 нормальной.
14. Способ по любому из пп.2-11, в котором кислота, используемая на стадии (d), является около 0,5 нормальной.
15. Способ по любому из пп.2-14, в котором стадию (d) осуществляют в однофазной системе растворителя водная кислота/органический растворитель.
16. Способ по п.15, в котором органическим растворителем является ацетон.
17. Способ по любому из пп.2-16, в котором стадию (d) осуществляют при температуре от около 25шC или ниже.
18. Способ по любому из пп.2-16, в котором стадию (d) осуществляют при температуре от около -5 до около 10шC.
19. Способ по любому из пп.2-16, в котором стадию (d) осуществляют при температуре от около 0 до около 5шC.
20. Способ по любому из пп.1-19, в котором простой 31-силиловый эфир, получаемый на стадии (b), имеет структуру IA
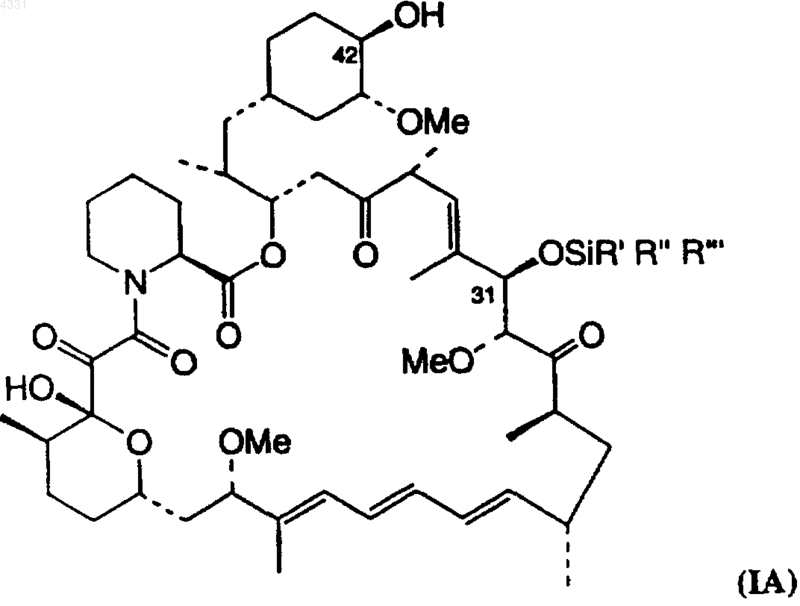
в которой R', R" и R'" являются одинаковыми или различными, выбранными из алкила, содержащего 1-6 атомов углерода, фенила и бензила.
21. Способ по любому из пп.1-20, в котором силилирующим агентом на стадии (a) является три(C1-C6)алкилсилилгалогенид.
22. Способ по п.21, в котором силилирующим агентом на стадии (a) является триметилсилилхлорид.
23. Способ по любому из пп.1-22, в котором стадию силилирования (a) осуществляют в инертном растворителе в присутствии подходящего основания.
24. Способ по п.23, в котором основанием является имидазол, 1-метилимидазол, триэтиламин или N,N-диизопропилэтиламин.
25. Способ по любому из пп.1-24, в котором кислотой на стадии (b) является разбавленная неорганическая кислота.
26. Способ по п.25, в котором кислотой является серная, хлористо-водородная или фосфорная кислота.
27. Способ по любому из пп.1-26, в котором кислота, используемая на стадии (b), является от около 0,08 до около 2,5 нормальной.
28. Способ по любому из пп.1-26, в котором кислота на стадии (b) является от около 0,1 до около 1 нормальной.
29. Способ по любому из пп.1-26, в котором кислота, используемая на стадии (b), является около 0,5 нормальной.
30. Способ по любому из пп.1-29, в котором стадию (b) осуществляют в двухфазной системе водная кислота/водонесмешиваемый органический растворитель.
31. Способ по п.30, в котором водонесмешиваемым органическим растворителем является этилацетат.
32. Способ по любому из пп.1-31, в котором стадию (b) осуществляют при температуре от около 25шC или ниже.
33. Способ по любому из пп.1-31, в котором стадию (b) осуществляют при температуре от около -5 до около 10шC.
34. Способ по любому из пп.1-31, в котором стадию (b) осуществляют при температуре от около 0 до около 5шC.
35. Способ получения сложного 42-эфира рапамицина с 2,2-бис(гидроксиметил)пропионовой кислотой, включающий
(a) взаимодействие рапамицина с силилирующим агентом с образованием простого 31, 42-бис-силилового эфира рапамицина;
(b) селективный гидролиз простого 42-силилового эфира в холодной разбавленной кислотх ё получением простого 31-силилового эфира рапамицина;
(c) ацилирование простого 31-силилового эфира рапамицина хлорангидридом 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты или 2,4,6-трихлорбензоиловым смешанным ангидридом 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты с получением простого 31-O-триметилсилилового эфира, сложного 42-эфира рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты; и
(d) или (i) селективный гидролиз простого 31-силилового эфира в холодной разбавленной кислоте с получением сложного 42-эфира рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты с последующей обработкой сложного 42-эфира рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты разбавленной кислотой с получением сложного 42-эфира 2,2-бис(гидроксиметил)пропионовой кислоты;
или (ii) обработку простого 31-O-триметилсилилового эфира рапамицина, сложного 42-эфира 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты разбавленной кислотой с получением сложного 42-эфира 2,2-бис(гидроксиметил)пропионовой кислоты.
36. Способ по п.35, в котором стадию ацилирования (c) осуществляют при температуре менее 0шC.
37. Способ получения 42-O-(2-гидрокси)этилрапамицина, включающий
(a) взаимодействие рапамицина с силилирующим агентом с образованием простого 31, 42-бис-силилового эфира рапамицина;
(b) селективный гидролиз простого 42-силилового эфира в холодной разбавленной кислоте с получением простого 31-силилового эфира рапамицина;
(c) взаимодействие простого 31-силилового эфира рапамицина с этиленгликольным эквивалентом, содержащим кислотоподвижную защитную группу для гидроксила, защищенного на одном конце этиленгликольного эквивалента, и удаляемую группу, подходящую для алкилирования гидроксильной группы на другом конце этиленгликольного эквивалента;
(d) гидролиз защитных групп в 31 положении и 42 положении гидроксиэтила в мягких кислых условиях.
38. Способ по п.37, в котором силилирующим агентом является триалкилсилилгалогенид.
39. Способ по п.38, в котором силилирующим агентом является хлортриметилсилан.
40. Способ по любому из пп.37-39, в котором этиленгликольным эквивалентом является 2-(трет-бутилдиметилсилил)оксиэтилтрифлат.
41. Способ по п.40, в котором кислотой, используемой на стадиях (b) и (d), является серная кислота.
42. Соединение, которое представляет 31-O-силиловый эфир рапамицина.
43. Соединение по п.42, которое имеет формулу IA или IB

или

в которых R является группой сложного или простого эфира и R', R", R'" являются одинаковыми или различными, выбранными из алкила, содержащего 1-6 атомов углерода, фенила и бензила.
44. Соединение по п.42, в котором R имеет значения, определенные в п.3.
45. Соединение по п.42 или 43, в котором простым 31-O-силиловым эфиром является три(C1-C6)алкилсилиловый эфир.
46. Соединение по п.42, которое является простым 31-O-триметилсилиловым эфиром рапамицина.
47. Соединение по п.42, которое имеет формулу (D)
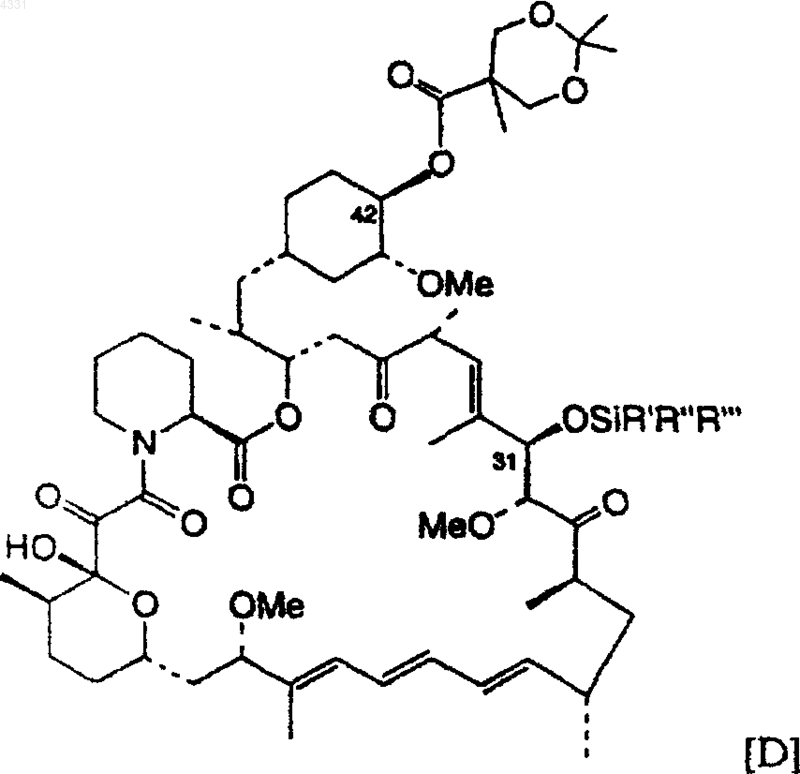
в которой R', R", R'" являются одинаковыми или различными, выбранными из алкила, содержащего 1-6 атомов углерода, фенила и бензила.
48. Соединение по п.42, которое представляет простой 31-O-триметилсилиловый эфир, сложный 42-эфир рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты.
49. Способ получения соединения формулы (C)
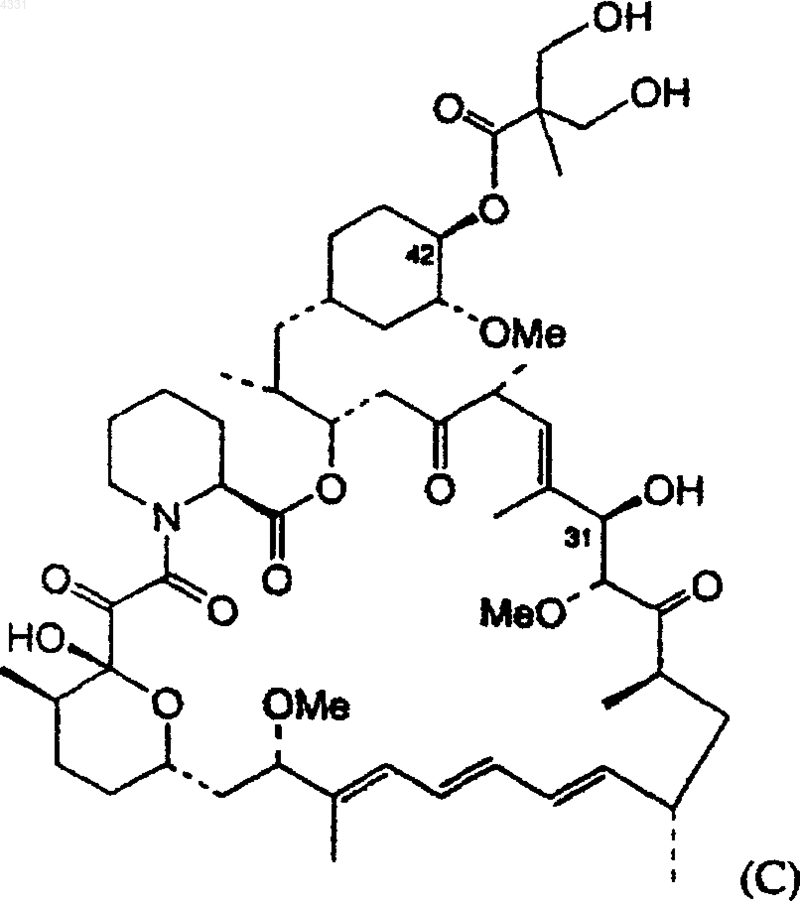
включающий гидролиз соединения формулы (B)

в которой R2 является водородом или -SiR'R"R'", где R', R", R'" являются одинаковыми или различными, выбранными из алкила, содержащего 1-6 атомов углерода, фенила и бензила; с использованием разбавленной серной кислоты.
50. Способ по п.49, который осуществляют с использованием 1-3 нормальной серной кислоты.
51. Способ по п.49 или 50, который осуществляют при температуре от -5 до +10шC.
52. Способ по любому из пп.49-51, который осуществляют в присутствии растворителя - тетрагидрофурана.
Текст
1 Предшествующий уровень техники Данное изобретение относится к региоселективному синтезу производных рапамицина в 42-положении, которые являются полезными для индуцирования иммуносупрессии и при лечении отторжения при трансплантации, болезни трансплантат против хозяина, аутоиммунных заболеваний, воспалительных заболеваний, лейкоза/лимфомы Т-клеток, твердых (солидных) опухолей, микозов и гиперпролиферативных сосудистых расстройств. Данное изобретение более конкретно предоставляет по существу селективный способ получения 31 силилзащищенных простых эфиров рапамицина, полезных в качестве промежуточных соединений для получения сложных и простых 42 эфиров рапамицина. Рапамицин является макроциклическим триеновым антибиотиком, продуцируемымStreptomyces hygroscopicus, который как было найдено, обладает противогрибковой активностью, особенно против Candida albicans, как inal. [Can. J. Physiol. Pharmacol. 55, 48 (1977)] обнаружили, что рапамицин является эффективным на экспериментальной модели аллергического энцефаломиелита, модели рассеянного склероза; на адъювантной модели артрита, модели ревматоидного артрита; и эффективно ингибирует образование антител, подобных IgE. Иммунодепрессивные эффекты рапамицина описаны в FASEB 3, 3411 (1989). Было показано, что циклоспорин-А и FK-506, другие макроциклические молекулы, являются эффективными в качестве иммуносупрессивных средств и поэтому полезны для профилактики отторжения трансплантата. [FASEB 3, 3411 (1989);FASEB 3, 5256 (1989); R. Y. Calne et al., Lancet 1183 (1978); и патент США 5100899]. Было показано также, что рапамицин полезен для предотвращения (профилактики) или лечения системной красной волчанки [патент США 5078999], легочного воспаления [патент США 5080899], инсулинозависимого сахарного диабета [патент США 5321009],пролиферации клеток гладкой мышцы и уплотнения внутренней оболочки кровеносных и лимфатических сосудов послесосудистого повреждения [патент США 5516781], лейкоза/ лимфомы Т-клеток у взрослых [заявка на Европейский патент 525960 А 1] и глазных воспалений [патент США 5387589]. Известны многочисленные 42-производные рапамицина, обычно являющиеся сложны 004331 2 ми эфирами (на основе углерода и серы) или простыми эфирами по 42-гидроксильной группе рапамицина, которые получают сложной или простой этерификацией 42-положения. Сложную этерификацию рапамицина в 42-положении обычно осуществляют непосредственным взаимодействием рапамицина с ацилирующими агентами с получением желаемого продукта. Химизм выглядит довольно простым. Однако так как рапамицин содержит две вторичные гидроксильные группы в положениях 31 и 42,попытки провести различие между данными двумя функциональными центрами для достижения селективного синтеза 42-моноацилированного продукта представили трудную задачу. Данный тип нерегиоселективной реакции давал также 31,42-бис-ацилированный побочный продукт, а в реакционной смеси оставался непрореагировавший рапамицин. Конечным результатом был пониженный выход, что требовало тщательной очистки для получения чистого 42-моноацилированного продукта. Проблемы могут быть проиллюстрированы со ссылкой на синтез сложного 42-моноэфира, такого как 42 эфир рапамицина и 2,2 бис(гидроксиметил)пропионовой кислоты (называемый здесь соединением [С]). Например,синтез 42-эфира рапамицина и 2,2-бис(гидроксиметил)пропионовой кислоты, описанный в патенте США 5362718, пример 10, был нерегиоселективным, поскольку образовывался также побочный продукт сложный 31, 42-бисэфир. В результате неочищенный продукт [В] после обработки содержит желаемый продукт [В],побочный продукт сложный 31, 42-бис-эфир и непрореагировавший рапамицин. При попытке израсходовать оставшийся исходный рапамицин реакции дали возможность протекать в течение более длительного периода времени, последствия были отрицательными, количество сложного 31, 42-бис-эфира значительно увеличилось. Получающийся неочищенный продукт [В] загрязнен непрореагировавшим рапамицином и сложным 31, 42-бис-эфиром, а последующие усилия по очистке колоночной хроматографией оказались затруднительными, так как сложный 31, 42-бис-эфир имеет очень близкое время удержания с продуктом [В]. Основное препятствие в крупномасштабном производстве соединения [В] похоже заключается в нерегиоселективности, которая дополнительно усложняется трудностями очистки. Следовательно, существует потребность в региоселективном синтезе сложных или простых 42-эфиров рапамицина. Существует потребность в процессах селективного получения сложных или простых 42-эфиров рапамицина, которые являются подходящими для промышленного или крупномасштабного производства, и которые могут эффективно осуществляться. 3 Описание изобретения В первом аспекте данное изобретение предоставляет региоселективный способ получения простого 31-силилового эфира рапамицина, например соединения формулы IA в которой: R', R" и R'" каждый представляет органические группы, такие как алкильные группы, предпочтительно содержащие 1-6 атомов углерода, например, 1-4 атома углерода,наиболее предпочтительно метил, этил и пропил, который включает:a) обработку рапамицина силилирующим агентом с образованием простого 31, 42-биссилилового эфира; иb) гидролиз 42-силильной группы эфира в холодной разбавленной кислоте с получением 31-силилового эфира рапамицина, например,соединения вышеуказанной формулы (I). 31-Силиловый эфир рапамицина можно ацилировать или этерифицировать по 42 гидроксильной группе с последующим удалением 31-силильной защитной группы и любой другой защитной группы, которая может присутствовать, получая требуемые сложные или простые 42-эфиры рапамицина. Соответственно во втором аспекте данное изобретение предоставляет региоселективный способ получения сложного или простого 42 эфира рапамицина, имеющего структуру (I): в которой: R представляет сложный или простой эфир, который включает(a) обработку рапамицина силилирующим агентом с образованием простого 31, 42-биссилилового эфира рапамицина;(b) гидролиз простого 42-силилового эфира в холодной разбавленной кислоте с получением простого 31-силилового эфира рапамицина;(c) обработку простого 31-силилового эфира рапамицина подходящим реагентом этерификации для получения сложного или простого эфира с образованием соответственно 42 сложного или простого эфира 31- силилового эфира рапамицина; и(d) гидролиз 31-силилового эфира в холодной разбавленной кислоте и, при желании, уда 004331 4 ление любой защитной группы в R одновременно или последовательно с получением требуемого сложного или простого 42-эфира рапамицина. Предпочтительные сложные и простые 42 эфиры рапамицина, которые могут быть получены с помощью способа, предоставляемого данным изобретением, описаны в следующих патентах, которые включены в данное описание для сведения: сложные алкиловые эфиры (патент США 4316885); сложные аминоалкиловые эфиры (патент США 4650803); фторированные сложные эфиры (патент США 5100883); сложные амидные эфиры (патент США 5118677); сложные карбаматные эфиры(патент США 5118678); простые силиловые эфиры (патент США 5120842); сложные аминоэфиры (патент США 5130307); ацетали(патент США 551413); сложные аминодиэфиры (патент США 5162333); сульфонатные и сульфатные сложные эфиры (патент США 5177203); сложные эфиры (патент США 5221670); сложные алкоксиэфиры (патент США 5233036); простые О-арил, -алкиловые,-алкениловые и -алкиниловые эфиры (патент США 5258389); карбонатные сложные эфиры(патент США 5260300); арилкарбонил- и алкоксикарбонилкарбаматы (патент США 5262423); карбаматы (патент США 5302584); сложные гидроксиэфиры (патент США 5362718; WO 95/28406); пространственно затрудненные сложные эфиры (патент США 5385908); гетероциклические сложные эфиры(патент США 5385909); гем-дизамещенные сложные эфиры (патент США 5385910); аминоалкановые сложные эфиры (патент США 5389639); сложные форфорилкарбаматные эфиры (патент США 5391730); сложные карбаматные эфиры (патент США 5411967); сложные карбаматные эфиры (патент США 5434260); сложные амидинокарбаматные эфиры(патент США 5463048); сложные карбаматные эфиры (патент США 5480988); сложные карбаматные эфиры (патент США 5480989); сложные карбаматные эфиры (патент США 5489680); пространственно затрудненные сложные N-оксидные эфиры (патент США 5491231); сложные эфиры биотина (патент США 5504091); и простые О-алкиловые эфиры (патент США 5665772). В данных патентах описываются также различные значения эквивалентов R в формуле (I) и способы сложной или простой этерификации, используемые на вышеуказанной стадии (с). Особенно предпочтительными значениямиR8 и R9, каждый независимо, представляет водород, алкил, содержащий 1-6 атомов углерода или - (CR3R4)fOR10, или R8 и R9 могут быть взяты вместе с образованием X;(b) -OR1 (т.е. простые эфиры), где R1 представляет алкил, тиоалкил, арилалкил, гидроксиалкил, дигидроксиалкил, гидроксиалкиларилалкил, дигидроксиалкиларилалкил, алкоксиалкил,ацилоксиалкил, аминоалкил, алкиламиноалкил,алкоксикарбониламиноалкил, ациламиноалкил,арилсульфонамидоалкил, аллил, дигидроксиалкилаллил и диоксоланилаллил, карбалкоксиалкил, где алк- или алкил относится к C1-6 алкилу, разветвленному или линейному, предпочтительно C1-3-алкилу, в котором углеродная цепь может быть необязательно прервана связью простого эфира (-O-); ацил представляет алкилкарбонил и арил имеет 6-10 атомов углерода и включает фенил, нафтил и подобные группы. Наиболее предпочтительно R1 выбран из гидроксиалкила, гидроксиалкоксиалкила, ациламиноалкила и аминоалкила; особенно 40-O(2-гидрокси)этилрапамицина, 40-O-(3-гидрокси) пропилрапамицина, 40-O-[2-(2-гидрокси)этокси]этилрапамицина и 40-O-(2-ацетаминоэтил) рапамицина). Наиболее предпочтительно в формуле I R представляет 2,2-бис(гидроксиметил)пропионилокси или 2,2,5-триметил[1,3]-диоксан-5 карбонилокси. Что касается стадии (а), силилирование можно осуществлять в инертном растворителе,например этилацетате; предпочтительно в присутствии подходящего основания, например имидазола. Реакцию можно осуществлять при низкой температуре, например при комнатной температуре или ниже, например при 0 С; предпочтительно при 0-5 С. Предпочтительно, 004331 6 чтобы 31- и 42-гидроксильные группы были защищены в виде простых триалкилсилиловых эфиров. Защищенная 42-силилом гидроксильная группа 31,42-биссилилированного рапамицина может селективно расщепляться в слабокислых условиях, давая 31-силилрапамицин. Силилирующими агентами, используемыми для данного преобразования, являются обычные промышленно доступные хлоралкилсиланы, такие как хлортриметилсилан, хлортриэтилсилан или хлортрипропилсилан. Однако чем более объемным является триалкилсилан, тем больше времени необходимо для снятия защиты в кислой среде во время предпоследней химической стадии для регенерации 31-гидроксильной группы. Кроме того, более длительное время реакции в кислой среде дает большее разложение побочных продуктов. Хотя для получения простых 31-О-триалкилсилиловых эфиров рапамицина могут использоваться хлортриметилсилан,хлортриэтилсилан или хлортрипропилсилан,предпочтительным силилирующим агентом является хлортриметилсилан. Триметилсилильная группа является более кислотоподвижной, и поэтому ее легче удалять во время преобразования и в сущности это сводит к минимуму образование продуктов разложения. В предпочтительном способе рапамицин обрабатывают избытком хлортриметилсилана в этилацетате при 0-5 С в присутствии органического основания и 42- и 31-гидроксильные группы рапамицина силилируются с образованием простого 31,42 бис-O-триметилсилилового эфира раламицина с количественным выходом. Для общепринятой реакции силилирования могут использоваться обычные органические основания, такие как имидазол, 1-метилимидазол, триэтиламин иN,N-диизопропилэтиламин. Однако было найдено, что предпочтительным основанием для силилирования рапамицина является имидазол,поскольку реакция может завершиться за 30 мин. Что касается стадии (b), изобретатели неожиданно обнаружили, что снятие защиты для удаления 42-силильной простой эфирной группы рапамицина из простого 31,42-бис-О-силилового эфира с образованием 31-O-силилового эфира рапамицина может осуществляться в холодной разбавленной кислоте по существу количественно с получением лишь очень малых количеств побочных продуктов, таких как рапамицин (т.е. продукт полного снятия защиты),например менее 20%, но обычно менее 10% относительно простого 31-силилового эфира. Как показано в описании, продукт стадии снятия защиты (b) может включать 80% или более защищенного 31-силиловым эфиром рапамицина и менее 10% рапамицина с возможностью снижения уровней рапамицина до такого низкого значения как 1%. Данное селективное снятие защиты удобно осуществляется с использованием разбавленной органической или неорга 7 нической кислоты, особенно неорганических кислот, таких как серная, хлористо-водородная или фосфорная, например 2,5N, предпочтительно 0,8N - около 2,5N, наиболее предпочтительно 0,1N - 1N. Особенно предпочтительной является серная кислота. Реакцию предпочтительно осуществляют в двухфазной системе водная кислота/органический растворитель, например, с использованием в качестве второй фазы этилацетата, особенно, когда в качестве защитной группы используют триметилсилил,который может селективно удаляться, например, через примерно 2-3 ч. Желательно использовать низкие температуры реакции, например около 25 С или ниже, предпочтительно около 15 С или ниже, такие как от около -5 С до+10 С, наиболее предпочтительно от 0 до 5 С. Наиболее предпочтительно снятие защиты осуществляют после реакции силилирования in situ при 0-5 С с использованием этанола, смесей этанол-вода, воды и разбавленных неорганических или органических кислот. Особенно предпочтительной является серная кислота (0,5N),поскольку реакция протекает чисто и может завершаться за 2-5 ч, что является удобным для промышленного производства. Однако было найдено, что, когда используются менее реакционноспособные силильные защитные группы,например, триэтилсилильная или трипропилсилильная, необходимо более длительное время реакции, и в таких случаях для селективного удаления защиты может использоваться однофазная система растворителя, например кислота/ацетон. Для силилирования может использоваться ряд органических растворителей, и в частности в литературе часто упоминается ДМФ. Однако в данном изобретении предпочтительным растворителем для стадии (а) является этилацетат, так,что для последующей стадии снятия защиты (b) используется двухфазная реакционная среда. Что касается стадии (с), этерификацию 31 защищенного рапамицина для получения соответственно сложного или простого эфира можно осуществлять в условиях, описанных в вышеперечисленных патентах. Например, по схеме I,приведенной ниже, ацилирование простого 31 триметилсилилового эфира рапамицина осуществляли с использованием 2,4,6-трихлорбензоильного, смешанного ангидрида 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты в присутствии 4-диметиламинопиридина или сходного реагента. Кроме того, было найдено, что эффективным ацилирующим агентом в данном изобретении является хлорангидрид 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты в присутствии 4-диметиламинопиридина или подобного реагента. Для условий ацилирования предпочтительным растворителем скорее является метиленхлорид, чем тетрагидрофуран, который описан в предшествующем уровне техники. Реакцию можно осуществлять при температуре от 8 около -50 С до около +25 С. Однако более низкие температуры реакции, менее 0 С, причем более предпочтительны температуры -20 - -15 С или ниже, обеспечивают лучшие результаты,чем комнатная температура ацилирования, описанного в патенте США 5362718. Что касается стадии (d), удаление 31 силильной защитной группы из 42 сложного этерифицированного или простого этерифицированного-31-силилрапамицина может проводиться с помощью гидролиза, например с использованием разбавленной кислоты, такой, как описана выше, предпочтительно разбавленной неорганической кислоты, такой как серная, хлористоводородная или фосфорная кислота. В зависимости от того, является ли желательным одновременное удаление других защитных групп, кислота может быть от около 0,1N до около 3N; предпочтительно от около 0,2N до около 2N, наиболее предпочтительно около 0,5N. Стадия (d) удобно осуществляется в однофазной системе растворителя водная кислота/органический растворитель, например, когда органическим растворителем является ацетон. Реакция может осуществляться при температуре около 25 С или ниже, например, от около -5 С до около 10 С, предпочтительно от около 0 С до около 5 С. По следующей схеме I продукты ацилирования 31-O-TMS, 42-(гидроксизащищенные) сложные эфиры (соединение [Е]) могут дополнительно обрабатываться разбавленной кислотой для их превращения в 42-(гидроксизащищенные) сложные эфиры (соединение [В]) или их используют непосредственно для получения конечного продукта сложных 42 гидроксиэфиров (конечный продукт [С]). Данная методика может использоваться для получения других сложных или простых эфиров рапамицина простым варьированием используемого агента сложной или простой этерификации. Следующая схема также иллюстрирует региоселективное получение сложного 42-эфира рапамицина с 2,2-бис(гидроксиметил)пропионовой кислотой в качестве характерного представителя 42-эфира рапамицина, который может быть получен по способу, предоставленному в данном изобретении. Первоначальный синтез сложного 42-эфира рапамицина с 2,2-бис(гидроксиметил)пропионовой кислотой описан в патенте США 5362718. По схеме I превращение соединения [В] в сложный 42-эфир рапамицина с 2,2-бис(гидроксиметил)пропионовой кислотой [С] может осуществляться в мягких кислых условиях. Предпочтительно использовать водную серную кислоту, поскольку она сводит к минимуму образование примесей, генерируемых, когда используется хлористоводородная кислота, как описано в патенте США 5362718. Сообщалось, что тетраеновую примесь, образующуюся при использовании хлористоводородной кислоты, трудно отделить от требуемого продукта с помощью колоночной хроматографии (Caufieldet al., Tetrahedron Lett., 1994, 37, 6835). Гидролиз предпочтительно также осуществлять при температуре 0-5 С, а не при комнатной температуре, как в патенте США 5362718. Данное изобретение соответственно предоставляет также способ получения соединения формулы (С): 10 который включает гидролиз соединения формулы (В): в которой R2 является водородом или -Si R' R"R'" , где R', R" и R"' являются одинаковыми или различными, выбранными из алкила с 1-6 атомами углерода, фенила и бензила; с использованием разбавленной серной кислоты, например с использованием 1N-3N серной кислоты. Реакцию предпочтительно осуществляют при температуре -5 С - +10 С. В качестве растворителя предпочтительно используют тетрагидрофуран. Способ синтеза, раскрытый в данном изобретении, предоставляет несколько явных преимуществ по сравнению с методом синтеза, который был опубликован по получению сложных или простых эфиров рапамицина; главным образом в том, что касается выхода и просторы очистки требуемых сложных или простых 42 эфиров. Поскольку синтез является региоселективным, общий выход требуемых сложных или простых 42-эфиров резко улучшается. Например, метод синтеза, описанный в патенте США 5362718, дает соединение (В) с выходом 35%,тогда как синтез с использованием метода, раскрытого в данном описании, обеспечивает выход соединения [В] 85%. Кроме того, превращение соединения [В] в сложный 42-эфир рапамицина с 2,2-бис(гидроксиметил)пропионовой кислотой осуществляется примерно с выходом 75%, тогда как при использовании метода патента США 5362718 достигается конверсия только 20%. С использованием той же методики простые 42-эфиры рапамицина могут быть получены региоселективным способом. В качестве примера, в патенте США 5665772 раскрывается получение простых 40-O-алкиловых эфиров рапамицина нерегиоселективным способом. Вследствие разницы в номенклатуре, 42 положение рапамицина (называемое в данном изобретении) в патенте США 5665772 называется 40-положением. Данные положения являются идентичными. С использованием метода, раскрытого в данном описании, простой 31O-триметилсилиловый эфир рапамицина может обрабатываться, например, 2-(трет-бутилдиметилсилил)оксиэтилтрифлатом, давая 31-Oтриметилсилил,42-O-[2-(трет-бутилдиметилсилил)окси]этилрапамицин. Удаление силиль 11 ных защитных групп из 31-гидроксильной группы рапамицина и из 42-гидроксиэтильной группы может проводиться в мягких кислых условиях, таких как разбавленная серная кислота, давая 42-O-(2-гидрокси)этилрапамицин. Нерегиоселективное образование других простых 42-эфиров рапамицина описано в патенте США 5665772. Они также могут быть получены региоселективно через простой 31-О-триметилсилиловый эфир рапамицина. Данное изобретение также охватывает простые 31-силиловые эфиры рапамицина и простые 31-силиловые эфиры 42-сложноэтерифицированных или простых этерифицированных производных рапамицина, как описано в данном описании. Кремнийсодержащий фрагмент, представленный группой - Si R'R"R'", содержит 3 группы, которые могут быть одинаковыми или различными. Типичные простые силиловые эфиры данного изобретения содержат группы R', R" или R"' , которые представляют алкильные группы, содержащие 1-6 атомов углерода, фенильные группы или бензильные группы. Алкильные группы могут быть с разветвленной или прямой цепью. Предпочтительно, чтобы R', R" и R'" были алкильными группами и более предпочтительно, чтобы R', R" иR'" были метилом или этилом. Еще более предпочтительно, чтобы простым 31-силиловым эфиром был простой 31-O-триметилсилиловый эфир рапамицина. Соответственно данное изобретение предоставляет простые 31-силиловые эфиры формулы (IA) и (IB):R является группой сложного или простого эфира, такой, как описана выше, и R', R" и R'" являются одинаковыми или различными, выбранными из алкила, содержащего 1-6 атомов углерода, фенила и бензила. Следующие примеры иллюстрируют получение простых 31-силиловых эфиров рапамицина и сложных 42-эфиров рапамицина, которые являются типичными представителями соеди 004331 12 нений, которые могут быть получены с помощью способов данного изобретения. Пример 1. Простой 31-О-триметилсилиловый эфир рапамицина. Раствор рапамицина (25,0 г, концентрация 92,4 %; 25,28 ммоль) в 750 мл этилацетата охлаждали до 0-5 С; добавляли 7,5 г (110,20 ммоль) имидазола и перемешивали с получением раствора. К данному холодному раствору на протяжении 30 мин по каплям добавляли 11,0 г(101,25 ммоль) хлортриметилсилана и перемешивали в течение еще 30 мин при 0-5 С для завершения образования 31,42-бис-О-триметилсилилового эфира рапамицина. На протяжении 10 минутного периода по каплям добавляли 50 мл 0,5N серной кислоты и смесь перемешивали в течение 2,5 ч при 0-5 С. Реакционную смесь переносили в делительную воронку и водный слой отделяли и экстрагировали 125 мл этилацетата. Органические слои объединяли и последовательно промывали рассолом (125 мл),насыщенным раствором бикарбоната натрия(100 мл), водой (125 мл х 2) , затем рассолом до рН 6-7. Органический слой сушили над безводным сульфатом натрия и выпаривали при пониженном давлении с получением 28,5 г пенистого продукта бежевого цвета (теоретически: 24,94 г). Анализ ВЭЖХ показал, что он содержит 86%%) простого 31-Oтриметилсилилового эфира рапамицина и 7% рапамицина. Продукт использовали непосредственно для последующей реакции. ЖХ/МС Способ электрораспыления (+)[1,3-диоксан]-5-карбоновой кислоты. Раствор 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты (17,42 г, 0,1 моль) в 200 мл сухого толуола подогревали до 40 С и на протяжении 30 мин добавляли по каплям 26,0 мл оксалилхлорида (37,83 г, 0,3 моль) и затем перемешивали при 40 С в течение 2,5 ч. Для удаления растворителя и избытка оксалилхлорида реакционную смесь выпаривали при пониженном давлении. Остаточный продукт дважды выпаривали с использованием сухого толуола(200 мл), затем сушили в высоком вакууме при 40 С в течение 2 ч, при этом получали 19,75 г продукта в виде оранжевой жидкости. 1 Н ЯМР (300 МГц, CDCl3)4,28 (2 Н, д, J = 10,5 Гц), 3,76 (2 Н,д, J = 10,5 Гц), 1,46 (3H, с),1,29 (3H,с). 13 С ЯМР (75 МГц, CDCl3)176,43,98,76, 66,06, 52,07, 25,82, 21,20, 18,10. Пример 3. Простой 31-O-триметилсилиловый эфир, сложный 42-эфир рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты. 13 Метод А. К раствору 2,2,5-триметил[1,3 диоксан]-5-карбоновой кислоты (9,77 г, 56,08 ммоль) и N, N-диизопропилэтиламина (12,00 г,92,80 ммоль) в 200 мл метиленхлорида при комнатной температуре в атмосфере азота добавляли 2,4,6-трихлорбензоилхлорид (13,35 г, 54,73 ммоль), и полученную смесь перемешивали в течение 5 ч при комнатной температуре. Реакционную смесь охлаждали до -20-15 С и добавляли раствор 31-O-триметилсилилового эфира рапамицина (28,50 г, неочищенный, полученный из 25,28 ммоль рапамицина) в 120 мл метиленхлорида. На протяжении 2 ч периода добавляли по каплям раствор 4 диметиламинопиридина (11,68 г, 95,60 ммоль) в 110 мл метиленхлорида. Затем реакционная смесь перемешивалась в течение 16 ч при -15 С- -16 С. Реакционную смесь гасили 100 мл воды и органический слой отделяли и промывали 0,5N серной кислотой (180 мл), затем рассолом(100 мл), насыщенным раствором бикарбоната натрия (100 мл), водой (100 мл х 2) , рассолом(100 мл) до рН 6 - 7. Органический слой сушили над безводным сульфатом натрия и выпаривали при пониженном давлении, при этом получали указанное в заголовке соединение (33,18 г) в виде пены бежевого цвета. ЖХ/МС Способ электрораспыления (+) =(д, 2 Н), 3,57 (д, 2 Н) , 1,34 (с, 3H), 1,24 (с, 3H),1,13 (с, 3H), -0,023 (с, 9 Н, 31-О-TMS). Метод В. Раствор простого 31-Отриметилсилилового эфира рапамицина (11,00 г; из 10,0 г рапамицина; 11,5 ммоль) в 120 мл метиленхлорида, содержащий 2 мл N,Nдиметилформамида, перемешивали в атмосфере азота и охлаждали до -15 С, добавляли 4 диметиламинопиридин (4,80 г, 39,29 ммоль), и смесь перемешивали для образования раствора. К данному холодному раствору на протяжении 2 ч периода добавляли по каплям 7,5% раствор хлорангидрида 2,2,5-триметил[1,3-диоксан]-5 карбоновой кислоты (42,18 г; 16,42 ммоль) в метиленхлориде. Раствор дополнительно перемешивали при -15 С в течение 1 ч и на протяжении 30 мин периода добавляли дополнительно 7,5% раствор хлорангидрида кислоты (14,06 г, 5,47 ммоль) в метиленхлориде. Реакционную смесь дополнительно перемешивали в течение 16 ч при -15 С - -16 С. Реакционную смесь гасили 100 мл рассола и органический слой отделяли и промывали холодной 0,5N серной кислотой (100 мл), рассолом (100 мл), насыщенным раствором бикарбоната натрия (100 мл), водой(100 мл), рассолом 1,100 мл) до рН 6 - 7. Органический слой сушили над безводным сульфатом натрия и выпаривали при пониженном давлении, получая продукт (12,15 г) в виде желтой пены. 14 Пример 4. Сложный 42-эфир рапамицина и 2,2, 5-триметил [1,3-диоксан]-5-карбоновой кислоты. Раствор простого 31-O-триметилсилилового эфира, сложного 42-эфира рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты (33,18 г; из примера 3, метод А) в 100 мл ацетона перемешивали и охлаждали до 0-5 С. К данному холодному раствору на протяжении 10 мин добавляли по каплям 17 мл 0,5N серной кислоты и смесь перемешивали в течение 2,5 ч при 0-5 С. На протяжении 20 мин добавляли раствор бикарбоната натрия (1,44 г) в 20 мл воды, затем в течение 30 мин еще 33 мл воды; примерно через 1 ч после перемешивания начинал осаждаться продукт. Смесь перемешивалась на протяжении ночи при 0-5 С и после фильтрования твердый продукт промывали 60 мл смеси ацетон-вода (1 : 1). Продукт сушили в вакуумной печи при 30 С, при этом получали 28,85 г продукта (концентрация 83,9%, общий выход из рапамицина 89,3 %). 1 Н ЯМР продукта был идентичен 1H ЯМР продукта, описанного в примере 10 патента США 5362718. Пример 5. Сложный 42-эфир рапамицина и 2,2-бис(гидроксиметил) пропионовой кислоты. Метод А. Раствор сложного 42-эфира рапамицина и 2,2,5-триметил[1,3-диоксан]-5 карбоновой кислоты (28,85 г; из примера 4) в 276 мл тетрагидрофурана перемешивали и охлаждали до 0-5 С. К данному холодному раствору на протяжении 30 мин добавляли по каплям 83 мл холодной 2N серной кислоты и смесь перемешивали в течение 60 ч при 0-5 С. Реакционную смесь разбавляли 600 мл этилацетата и промывали 120 мл рассола. Водный слой экстрагировали один раз 120 мл этилацетата и органические экстракты объединяли и промывали насыщенным раствором бикарбоната натрия(120 мл), водой (200 мл х 2) и рассолом (120 мл) до рН 6-7. Органическую фазу сушили над безводным сульфатом натрия и выпаривали при пониженном давлении при комнатной температуре с получением продукта (28,42 г) в виде пены бежевого цвета. Неочищенный продукт хроматографировали на колонке с силикагелем и элюировали 30% ацетоном в гептане, получая 18,06 г неочищенного продукта в виде белого твердого вещества (общий выход из рапамицина 69,4%). 1 Н ЯМР продукта был идентичен 1 Н ЯМР продукта, описанного в примере 11 патента США 5362713. Метод В. Раствор простого 31-O-триметилсилилового эфира рапамицина, сложного 42 эфира рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты (23,25 г, полученного из 20,06 г рапамицина, концентрация 92,7%,20,34 ммоль) в 230 мл тетрагидрофурана перемешивали и охлаждали до 0-5 С. К данному холодному раствору на протяжении 45 мин добавляли по каплям 115 мл холодной 0,5N серной кислоты и смесь перемешивали в течение 88 ч при 0-5 С. Реакционную смесь разбавляли 500 мл этилацетата и промывали 100 мл рассола. Водный слой экстрагировали один раз 100 мл этилацетата, и органические экстракты объединяли и промывали насыщенным раствором бикарбоната натрия (80 мл), водой (80 мл х 2) и рассолом (100 мл) до рН 6-7. Органическую фазу сушили над безводным сульфатом натрия и выпаривали при пониженном давлении при комнатной температуре, получая продукт (22,48 г) в виде пены бежевого цвета. Неочищенный продукт хроматографировали на колонке с силикагелем и элюировали 30% ацетоном в гексане с получением 16,50 г чистого продукта в виде белого твердого вещества (общий выход из рапамицина 78,4 %). 1 Н ЯМР продукта был идентичен 1 Н ЯМР продукта, описанного в примере 11 патента США 5362718. Пример 6. Простой 31, 42-бис-О-триметилсилиловый эфир рапамицина. Раствор рапамицина (10,0 г, концентрация 94,3%; 10,3 ммоль) в 150 мл этилацетата охлаждали до 0-5 С; добавляли 3,0 г (44 ммоль) имидазола и перемешивали для образования раствора. К данному холодному раствору на протяжении 20 мин по каплям добавляли 4,4 г (40,5 ммоль) хлортриметилсилана и после этого раствор перемешивали при 0-5 С в течение еще 30 мин. Для удаления HCl имидазола реакционную смесь фильтровали и фильтрат выпаривали при пониженном давлении с получением желтой пены. Добавляли гептан (200 мл) и перемешивали при комнатной температуре в течение 20 мин и смесь фильтровали. Фильтрат промывали 40 мл насыщенного раствора бикарбоната натрия,затем дважды водой (80 мл), затем рассолом (50 мл). Органический слой сушили над безводным сульфатом натрия и выпаривали, получая 11,42 г продукта в виде желтой пены (выход 98,6 %). ЖХ/МС Способ электрораспыления (-) (МН) = 1057. 1 Н ЯМР (400 МГц, d-6 ДМСО) 4,10(м, 1 Н, С(31)Н), 3,31 (м, 1 Н, С(42)Н), 0,057 (с,9 Н, 42-0-TMS), -0,027 (с, 9 Н, 31-0-TMS). Пример 7. Простой 31-O-триэтилсилиловый эфир рапамицина. Раствор рапамицина (5,00 г, концентрация 92,7%; 5,07 ммоль) в 75 мл этилацетата охлаждали до 0-5 С; добавляли 1,50 г (22,03 ммоль) имидазола и перемешивали для образования раствора. К данному холодному раствору на протяжении 10 мин добавляли по каплям 3,05 г(20,23 ммоль) хлортриэтилсилана. Смесь перемешивали в течение 30 мин при 0-5 С, затем на протяжении ночи - при комнатной температуре для завершения образования простого 31,42 бис-О-триэтилсилилового эфира рапамицина. После фильтрования реакционной смеси фильтрат выпаривали при пониженном давлении при комнатной температуре для удаления большей части растворителя. Оставшийся раствор ( 10 мл) растворяли в 60 мл ацетона и добавляли 15 16 мл 0,15N серной кислоты и смесь перемешивали в течение 25 часов при 0-5 С. На данной стадии простой 31,42-бис-О-триэтилсилиловый эфир рапамицина исчезал. Реакционную смесь разбавляли 80 мл этилацетата и последовательно промывали рассолом (60 мл х 2), насыщенным раствором бикарбоната натрия(40 мл), водой (60 мл х 2), рассолом (60 мл) до рН 6-7. Органический слой сушили над безводным сульфатом натрия и выпаривали при пониженном давлении с получением продукта в виде светло-желтой смолы, 6,92 г, (теоретически: 5,21 г). Анализ HPLC (ВЭЖХ) показал, что он содержит 95,2 % (по площади в %) простого 31 О-триэтилсилилового эфира рапамицина и 0,9 % рапамицина. Пример 8. Простой 31-O-трипропилсилиловый эфир рапамицина. Раствор рапамицина(5,00 г, концентрация 92,7 %, 5,07 ммоль в 75 мл этилацетата охлаждали до 0-5 С; добавляли 1,50 г 22,03 ммоль) имидазола и перемешивали с образованием раствора. К данному холодному раствору на протяжении 10 мин добавляли по каплям 3,91 г (20,3 ммоль) хлортрипропилсилана. Смесь перемешивали в течение 30 мин при 0-5 С, затем в течение 21 ч при комнатной температуре для завершения образования простого 31,42-бис-О-трипропилсилилового эфира рапамицина. После фильтрования реакционной смеси фильтрат выпаривали при пониженном давлении при комнатной температуре для удаления большей части растворителя и оставшийся раствор растворяли в 60 мл ацетона. Добавляли 15 мл 0,25N серной кислоты и смесь перемешивали в течение 45 ч при 0-5 С; на данной стадии простой 31,42-бис-О-трипропилсилиловый эфир рапамицина исчезал. Реакционную смесь разбавляли 100 мл этилацетата и последовательно промывали рассолом (40 мл х 2), насыщенным раствором бикарбоната натрия (40 мл), водой(40 мл х 2) и рассолом (50 мл) до рН 6 - 7. Органический слой сушили над безводным сульфатом натрия и выпаривали при пониженном давлении с получением продукта в виде светложелтой смолы, 8,07 г (теоретически: 5,43 г). Анализ HPLC (ВЭЖХ) показал, что он содержит 96,7% (по площади в %) простого 31-Отрипропилсилилового эфира рапамицина и 1% рапамицина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения простого 31-силилового эфира рапамицина, включающий(b) гидролиз простого 31, 42-биссилилового эфира холодной разбавленной кислотой с получением простого 31-силилового эфира рапамицина. 17 2. Способ получения сложного 42-эфира или простого эфира рапамицина, имеющего структуру в которой R представляет сложный или простой эфир, включающий(b) гидролиз простого 31, 42-биссилилового эфира в холодной разбавленной кислоте с получением простого 31-силилового эфира рапамицина;(c) обработку простого 31-силилового эфира рапамицина подходящим этерифицирующим реагентом для получения сложного или простого эфира с образованием соответственно 42-сложного или простого эфира 31 силилового эфира рапамицина; и(d) гидролиз 31-силилового эфира в холодной разбавленной кислоте с получением желаемого сложного или простого 42-эфира рапамицина; и, при желании, последовательно или одновременно удаление любой другой присутствующей защитной группы. 3. Способ по п.2, в котором R в соединении формулы (I) выбран из илиR8 и R9, каждый независимо, представляет водород, алкил, содержащий 1-6 атомов углерода, или -(CR3R4)fOR10, или R8 и R9 могут быть взяты вместе с образованием X;f = 0-6; при условии, что R содержит по меньшей мере одну группу -(CR3R4)fOR10 или X; или(ii) -OR1 (т.е. простые эфиры), где R1 представляет алкил, тиоалкил, арилалкил, гидроксиалкил, дигидроксиалкил, гидроксиалкиларилалкил, дигидроксиалкиларилалкил, алкоксиалкил,ацилоксиалкил, аминоалкил, алкиламиноалкил,алкоксикарбониламиноалкил, ациламиноалкил,арилсульфонамидоалкил, аллил, дигидроксиалкилаллил и диоксоланилаллил, карбалкоксиалкил, где алк- или алкил относится к C1-6 алкилу, разветвленному или линейному, предпочтительно C1-3-алкилу, в котором углеродная цепь может быть необязательно прервана связью простого эфира (-O-); ацил представляет алкилкарбонил и арил имеет 6-10 атомов углерода. 4. Способ по п.3, в котором R1 выбран из гидроксиалкила, гидроксиалкоксиалкила, ациламиноалкила и аминоалкила. 5. Способ по п.4, в котором R1 выбран из 2-гидроксиэтила; 3-гидроксипропила; 2-[(2 гидрокси)этокси]этила и 2-ацетаминоэтила. 6. Способ по п.2, в котором R в соединении формулы (I) представляет 2,2-бис (гидроксиметил)пропионилокси или 2,2,5-триметил[1,3-диоксан]-5-карбонилокси. 7. Способ по п.6, в котором стадию сложной этерификации (c) осуществляют с использованием хлорангидрида 2,2,5-триметил[1,3 диоксан]-5-карбоновой кислоты или 2,4,6 трихлорбензоилового смешанного ангидрида 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты. 8. Способ по п.7, который осуществляют в растворителе, включающем метиленхлорид. 9. Способ по п.7 или 8, который осуществляют при температуре от около -50 до около 25 С. 10. Способ по любому из пп.2-9, в котором кислота на стадии (d) является разбавленной неорганической кислотой. 11. Способ по п.10, в котором кислотой является серная, хлористо-водородная или фосфорная кислота. 12. Способ по любому из пп.2-11, в котором кислота, используемая на стадии (d), является от около 0,1 до около 3 нормальной. 13. Способ по любому из пп.2-11, в котором кислота, используемая на стадии (d), является от около 0,2 до около 2 нормальной. 14. Способ по любому из пп.2-11, в котором кислота, используемая на стадии (d), является около 0,5 нормальной. 15. Способ по любому из пп.2-14, в котором стадию (d) осуществляют в однофазной системе растворителя водная кислота/органический растворитель. 19 16. Способ по п.15, в котором органическим растворителем является ацетон. 17. Способ по любому из пп.2-16, в котором стадию (d) осуществляют при температуре от около 25 С или ниже. 18. Способ по любому из пп.2-16, в котором стадию (d) осуществляют при температуре от около -5 до около 10 С. 19. Способ по любому из пп.2-16, в котором стадию (d) осуществляют при температуре от около 0 до около 5 С. 20. Способ по любому из пп.1-19, в котором простой 31-силиловый эфир, получаемый на стадии (b), имеет структуру IA в которой R', R" и R'" являются одинаковыми или различными, выбранными из алкила, содержащего 1-6 атомов углерода, фенила и бензила. 21. Способ по любому из пп.1-20, в котором силилирующим агентом на стадии (а) является три(C1-C6)алкилсилилгалогенид. 22. Способ по п.21, в котором силилирующим агентом на стадии (а) является триметилсилилхлорид. 23. Способ по любому из пп.1-22, в котором стадию силилирования (а) осуществляют в инертном растворителе в присутствии подходящего основания. 24. Способ по п.23, в котором основанием является имидазол, 1-метилимидазол, триэтиламин или N,N-диизопропилэтиламин. 25. Способ по любому из пп.1-24, в котором кислотой на стадии (b) является разбавленная неорганическая кислота. 26. Способ по п.25, в котором кислотой является серная, хлористо-водородная или фосфорная кислота. 27. Способ по любому из пп.1-26, в котором кислота, используемая на стадии (b), является от около 0,08 до около 2,5 нормальной. 28. Способ по любому из пп.1-26, в котором кислота на стадии (b) является от около 0,1 до около 1 нормальной. 29. Способ по любому из пп.1-26, в котором кислота, используемая на стадии (b), является около 0,5 нормальной. 30. Способ по любому из пп.1-29, в котором стадию (b) осуществляют в двухфазной системе водная кислота/водонесмешиваемый органический растворитель. 31. Способ по п.30, в котором водонесмешиваемым органическим растворителем является этилацетат. 20 32. Способ по любому из пп.1-31, в котором стадию (b) осуществляют при температуре от около 25 С или ниже. 33. Способ по любому из пп.1-31, в котором стадию (b) осуществляют при температуре от около -5 до около 10 С. 34. Способ по любому из пп.1-31, в котором стадию (b) осуществляют при температуре от около 0 до около 5 С. 35. Способ получения сложного 42-эфира рапамицина с 2,2-бис(гидроксиметил)пропионовой кислотой, включающий(b) селективный гидролиз простого 42 силилового эфира в холодной разбавленной кислоте с получением простого 31-силилового эфира рапамицина;(с) ацилирование простого 31-силилового эфира рапамицина хлорангидридом 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты или 2,4,6-трихлорбензоиловым смешанным ангидридом 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты с получением простого 31-Отриметилсилилового эфира, сложного 42-эфира рапамицина и 2,2,5-триметил[1,3-диоксан]-5 карбоновой кислоты; и(d) или (i) селективный гидролиз простого 31-силилового эфира в холодной разбавленной кислоте с получением сложного 42-эфира рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты с последующей обработкой сложного 42-эфира рапамицина и 2,2,5 триметил[1,3-диоксан]-5-карбоновой кислоты разбавленной кислотой с получением сложного 42-эфира 2,2-бис(гидроксиметил)пропионовой кислоты; или (ii) обработку простого 31-Отриметилсилилового эфира рапамицина, сложного 42-эфира 2,2,5-триметил[1,3-диоксан]-5 карбоновой кислоты разбавленной кислотой с получением сложного 42-эфира 2,2-бис(гидроксиметил)пропионовой кислоты. 36. Способ по п.35, в котором стадию ацилирования (с) осуществляют при температуре менее 0 С. 37. Способ получения 42-О-(2-гидрокси) этилрапамицина, включающий(b) селективный гидролиз простого 42 силилового эфира в холодной разбавленной кислоте с получением простого 31-силилового эфира рапамицина;(c) взаимодействие простого 31-силилового эфира рапамицина с этиленгликольным эквивалентом, содержащим кислотоподвижную защитную группу для гидроксила, защищенного на одном конце этиленгликольного эквивалента,и удаляемую группу, подходящую для алкили 21 рования гидроксильной группы на другом конце этиленгликольного эквивалента;(d) гидролиз защитных групп в 31 положении и 42 положении гидроксиэтила в мягких кислых условиях. 38. Способ по п.37, в котором силилирующим агентом является триалкилсилилгалогенид. 39. Способ по п.38, в котором силилирующим агентом является хлортриметилсилан. 40. Способ по любому из пп.37-39, в котором этиленгликольным эквивалентом является 2-(трет-бутилдиметилсилил)оксиэтилтрифлат. 41. Способ по п.40, в котором кислотой,используемой на стадиях (b) и (d), является серная кислота. 42. Соединение, которое представляет 31O-силиловый эфир рапамицина. 43. Соединение по п.42, которое имеет формулу IA или IB в которой R', R", R'" являются одинаковыми или различными, выбранными из алкила, содержащего 1-6 атомов углерода, фенила и бензила. 48. Соединение по п.42, которое представляет простой 31-О-триметилсилиловый эфир,сложный 42-эфир рапамицина и 2,2,5-триметил[1,3-диоксан]-5-карбоновой кислоты. 49. Способ получения соединения формулы (С) включающий гидролиз соединения формулы (В) в которых R является группой сложного или простого эфира и R', R", R'" являются одинаковыми или различными, выбранными из алкила,содержащего 1-6 атомов углерода, фенила и бензила. 44. Соединение по п.42, в котором R имеет значения, определенные в п.3. 45. Соединение по п.42 или 43, в котором простым 31-О-силиловым эфиром является три(С 1-С 6)алкилсилиловый эфир. 46. Соединение по п.42, которое является простым 31-О-триметилсилиловым эфиром рапамицина. 47. Соединение по п.42, которое имеет формулу (D)-SiR'R"R'", где R', R", R'" являются одинаковыми или различными, выбранными из алкила,содержащего 1-6 атомов углерода, фенила и бензила; с использованием разбавленной серной кислоты. 50. Способ по п.49, который осуществляют с использованием 1-3 нормальной серной кислоты. 51. Способ по п.49 или 50, который осуществляют при температуре от -5 до +10 С. 52. Способ по любому из пп.49-51, который осуществляют в присутствии растворителя
МПК / Метки
МПК: C07D 498/18, C07F 7/18
Метки: региоселективный, синтез, производных, рапамицина
Код ссылки
<a href="https://eas.patents.su/12-4331-regioselektivnyjj-sintez-proizvodnyh-rapamicina.html" rel="bookmark" title="База патентов Евразийского Союза">Региоселективный синтез производных рапамицина</a>












