Клатраты дегидроэпиандростерона и соответствующие фармацевтические композиции
Формула / Реферат
1. Клатрат дегидроэпиандростерона (DHEA), возможно в форме сульфата, в матриксе из a-, b- или g-циклодекстрина, характеризующийся наличием косолюбилизирующего агента, выбранного из группы, включающей аминокислоту, кросповидон, полиэтиленгликоль 4000, целлюлозу, карбоксиметилцеллюлозу, крахмал, винную кислоту, янтарную кислоту и глутаровую кислоту.
2. Клатрат по п.1, отличающийся тем, что указанная аминокислота выбрана из группы, включающей глицин, лизин, серин и аспартат.
3. Клатрат по п.1, отличающийся тем, что молярное соотношение указанного DHEA и указанного циклодекстрина находится между 3:1 и 1:10.
4. Клатрат по п.1, отличающийся тем, что молярное соотношение между указанным DHEA и указанным циклодекстрином составляет 1:1.
5. Клатрат по п.1, отличающийся тем, что молярное соотношение указанного DHEA и указанного a-циклодекстрина составляет 1:1.
6. Клатрат по п.1, отличающийся тем, что весовое количество указанного косолюбилизирующего агента составляет между 5 и 50%.
7. Клатрат по п.1, отличающийся тем, что весовое количество указанного косолюбилизирующего агента составляет 10%.
8. Фармацевтическая композиция, включающая фармакологически эффективное количество клатрата по п.1, в смеси с наполнителем и разбавителем, веществами, обычно используемыми в фармацевтических методиках.
9. Композиция по п.8, в которой одна часть композиции составляется таким образом, чтобы создать возможность быстрого высвобождения DHEA, а остальная часть составляется так, чтобы создать возможность медленного высвобождения DHEA.
10. Композиции по п.8, пригодные для лечения патологических состояний, включающих нарушения, вызванные адренокортикальной недостаточностью, адренопаузальными нарушениями, гипогонадизмом и ксерофтальмией.
11. Терапевтический способ лечения нарушений, вызванных адренокортикоидной недостаточностью, адренопаузальными нарушениями, гипогонадизмом и ксерофтальмией, включающий пероральное введение дозы от 12,5 до 50 мг DHEA в день в виде клатрата по п.1.
Текст
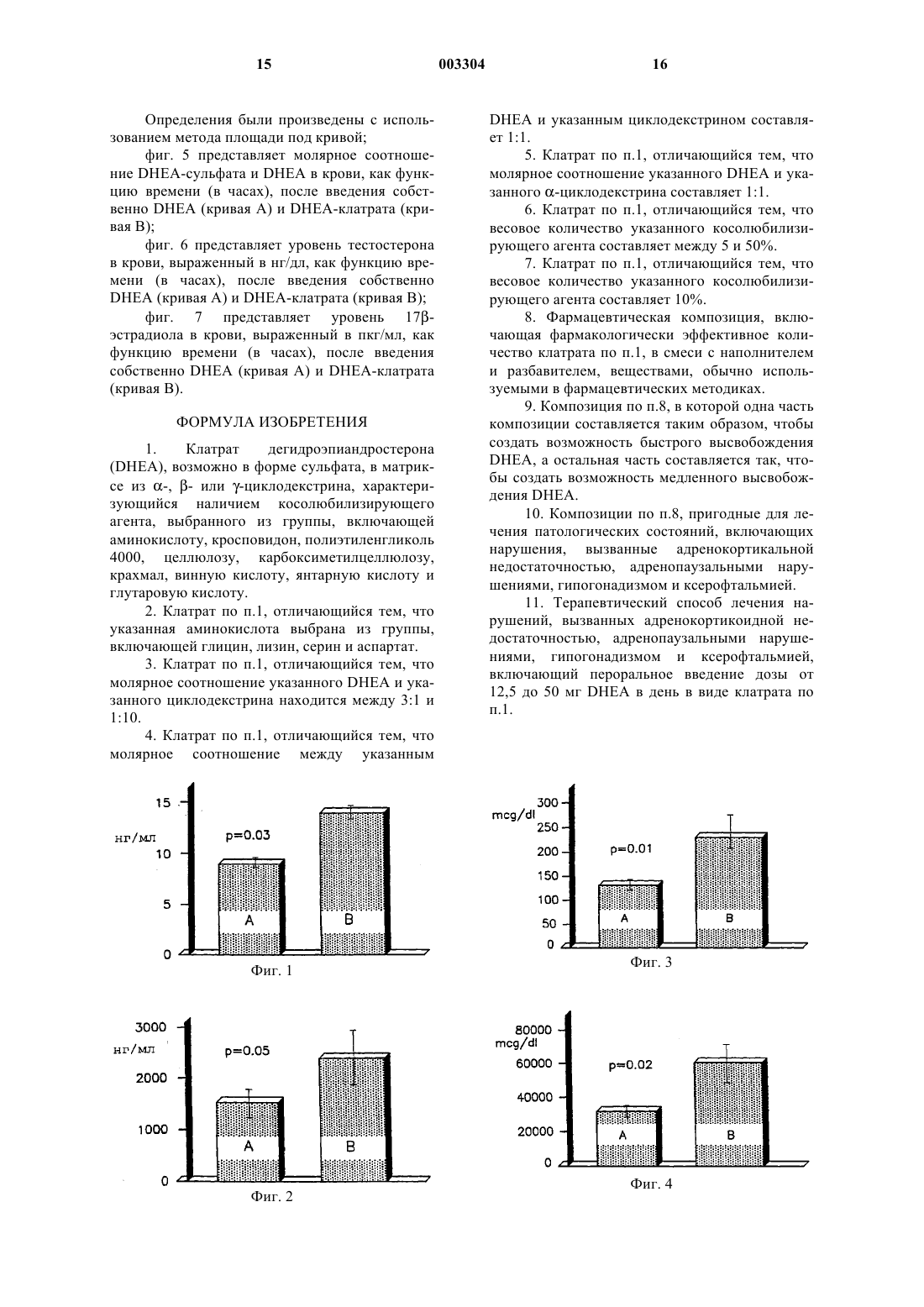
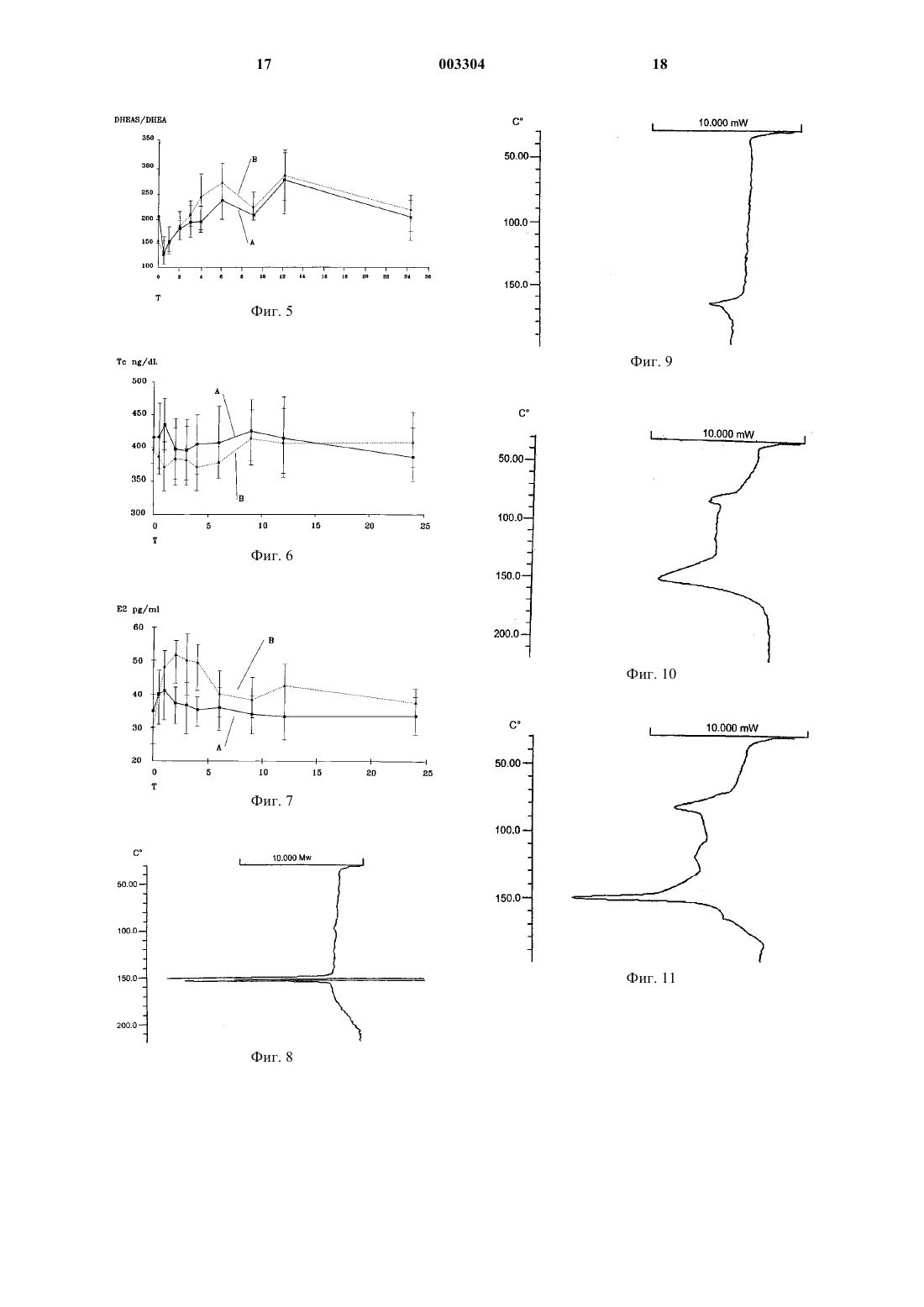
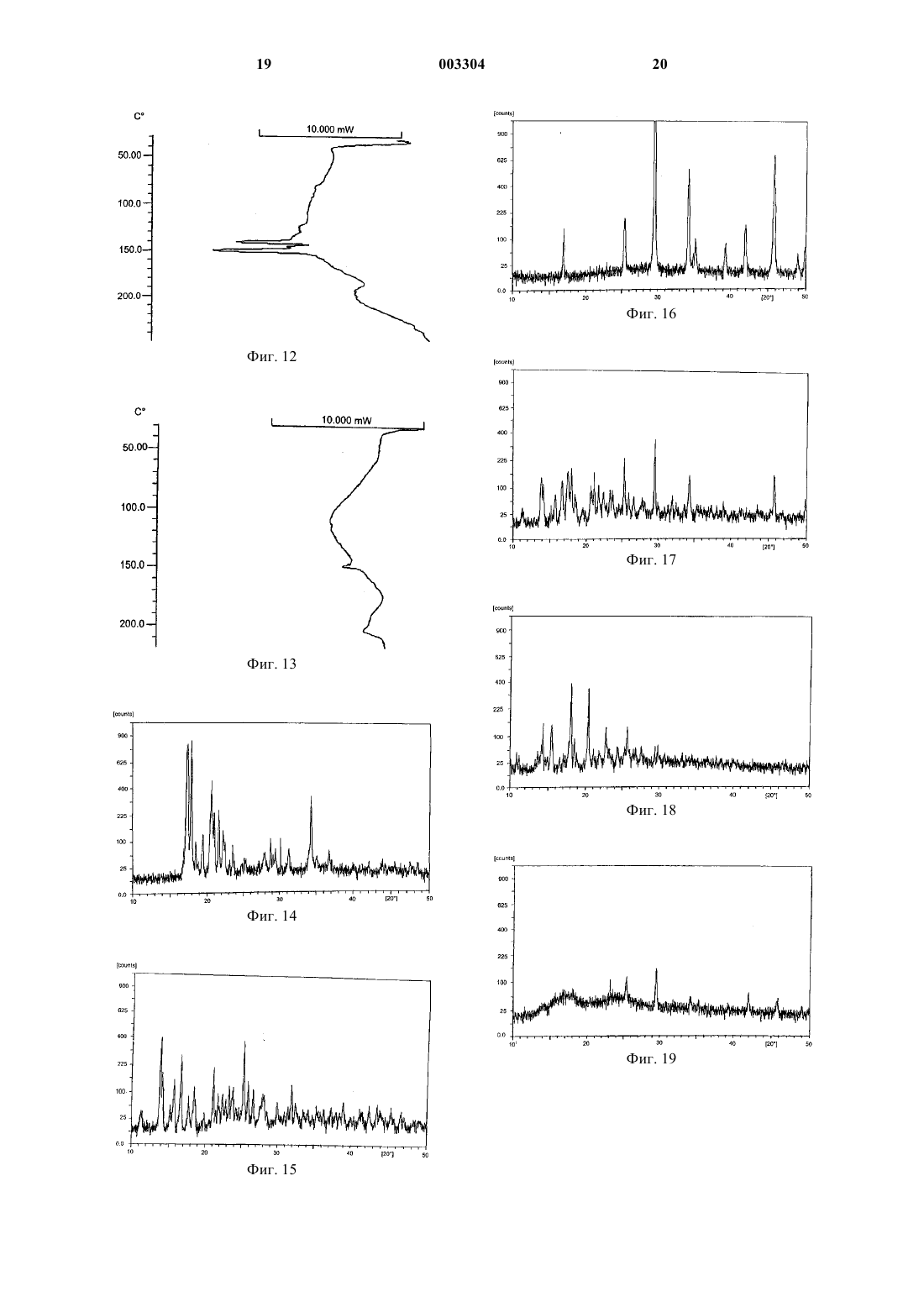
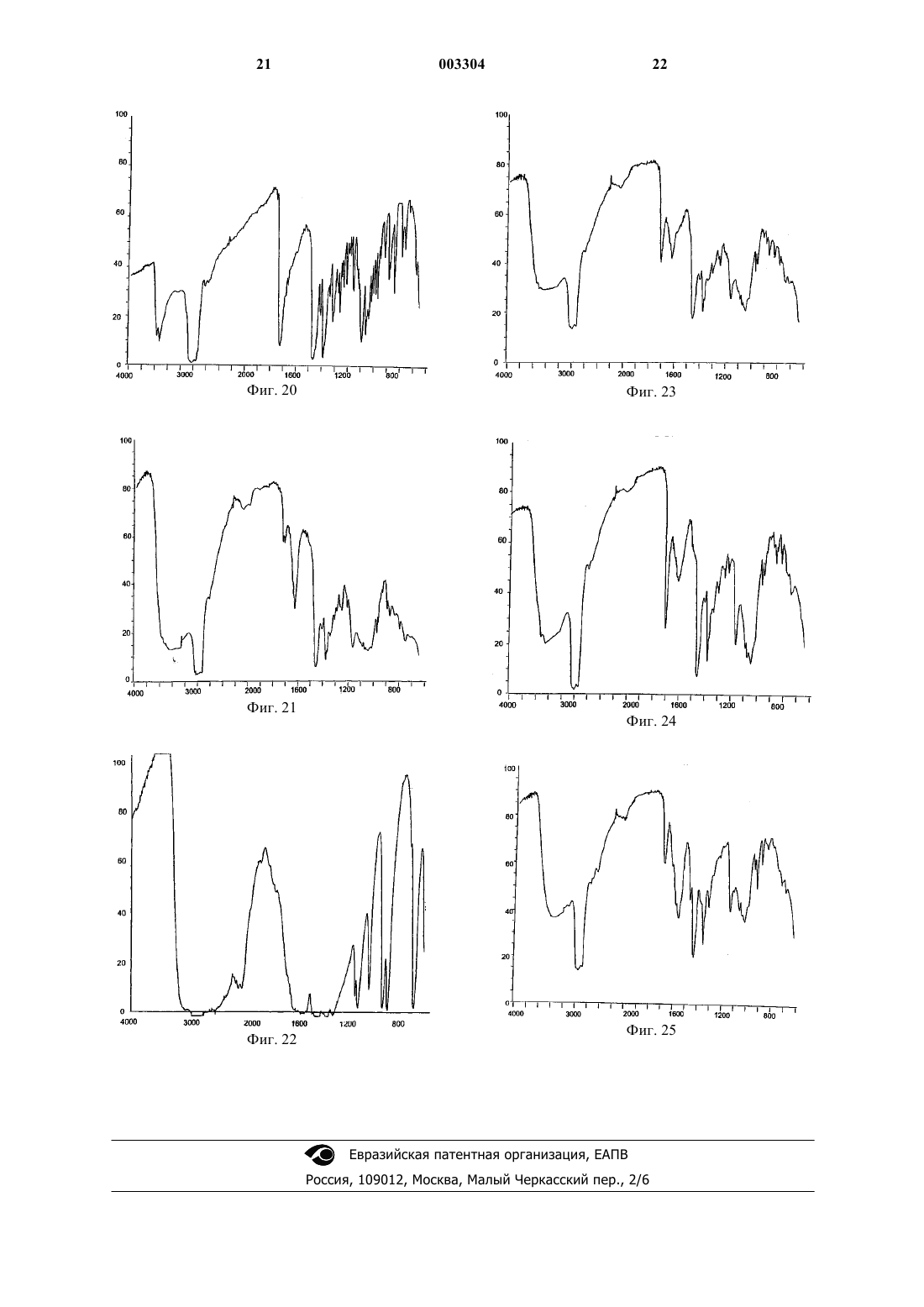
1 Область техники, к которой относится изобретение Изобретение относится к области медицины, в частности к гормональной терапии, а именно к терапии клатратами дегидроэпиадростерона и/или его фармацевтическими композициями, а также и самим этим препаратом. Уровень техники Известны комплексы, получаемые при помощи способов, которые позволяют включать относительно небольшие молекулы в полости,присутствующие в других, намного больших молекулах, определяемые как включенные комплексы или клатраты. В этих комплексах компоненты не связаны химическими связями, но вследствие малого размера компонента, его выход из указанных полостей не допускается по стерическим причинам. Химическая структура молекулы не модифицируется, тогда как ее химико-физические характеристики и биологическая доступность улучшаются. С другой стороны, известно сколь много исследовательских работ было выполнено по клиническому использованию дегидроэпиандростерона (DHEA), гормона гидрофобного типа,который практически нерастворим в воде. Выполненные до сих пор исследования по этому гормону дали противоречивые результаты, и поэтому мнения относительно его терапевтического использования расходятся. В самом деле, когда испытываемые фармацевтические формы не дают хорошего высвобождения и константной доступности, возникает риск в достоверности экспериментального результата. Кроме того, одним из метаболитов биологической конверсии DHEA в организме является тестостерон и это создает серьезную опасность в том смысле, что повышение уровня тестостерона в крови мужчин вызывает необходимость соблюдать особые предосторожности при выборе терапии, основанной на использованииDHEA, особенно для пожилых людей из-за неминуемого рецидива в патогенезе форм дисплазии предстательной железы. Чтобы обойти данную проблему, существенно ограничивающую возможность гормональной заместительной терапии у пожилых мужчин, были предложены препараты микроизмельченного DHEA, которые, по-видимому,способны снижать процесс его биологического преобразования в печени (Casson P.R., et al. Am.J. Obstet. Gynecol. 174:649, 1996). Другой предложенный подход заключается в получении препарата DHEA для трансдермального использования, что делает возможным непосредственное поглощение DHEA системой кровообращения (WO 94/16709). 2 Однако ни одна из испытанных до сих пор композиций не дала удовлетворительных результатов. Сущность изобретения В настоящее время установлено, что проблемы, имеющие место, изложенные в уровне техники, преодолеваются при помощи клатрата дегидроэпиандростерона (DHEA), возможно в виде сульфата, в матриксе из циклодекстрина,характеризующегося наличием косолюбилизирующего агента, выбранного из группы, включающей аминокислоту, полимер, такой как полиэтиленгликоль 4000, кросповидон, целлюлозу, карбоксиметилцеллюлозу и крахмал, а также дикарбоновую кислоту, такую как винная, янтарная или глутаровая кислота. Указанный клатрат получают в соответствии с известными методиками. Эти методики включают:- смешивание раствора DHEA с раствором циклодекстрина и удаление растворителя при помощи высушивания распылением или лиофилизации с получением определенного клатрата;- смешивание раствора клатрата DHEA с раствором косолюбилизирующего агента и извлечение трехкомпонентного продукта, получаемого после удаления растворителя;- совместное размалывание DHEA и циклодектрина в присутствии паров растворителя или растворителя в жидком виде;DHEA и косолюбилизирующего агента, возможно в присутствии паров растворителя или растворителя в жидком виде. Полученный таким образом клатрат обладает фармакологически новыми поразительными характеристиками: его введение приводит,среди прочего, к повышению концентрацииDHEA в крови без какого-либо увеличения его биологического преобразования в тестостерон,что имеет место при введении собственноDHEA. Более того, клатрат DHEA повышает трансформацию DHEA в 17-эстрадиол. Поэтому данные характеристики позволяют использовать указанный клатрат в гормональной заместительной терапии людей пожилого возраста. Краткое описание фигур На фиг. 1 представлены уровни DHEA в крови, определяемые методом максимальной дельты; на фиг. 2 - уровни DHEA в крови, определяемые методом площади под кривой; на фиг. 3 - уровни DHEA-сульфата в крови, определяемые методом максимальной дельты; на фиг. 4 - уровни DHEA-сульфата, определяемые методом площади под кривой;DHEA-сульфата и DHEA; на фиг. 6 - уровни тестостерона в крови; на фиг. 7 - уровни 17-эстрадиола в крови; на фиг. 8 - DSC-кривая очищенного DHEA; на фиг. 9 - DSC-кривая глицина; на фиг. 10 - DSC-кривая -циклодекстрина; на фиг. 11 - DSC-кривая смеси DHEAглицинциклодекстрина; на фиг. 12 - DSC-кривая клатрата (cDHEA), полученного путем совместного осаждения в соответствии с примером 11; на фиг. 13 - DSC-кривая клатрата (GRcDHEA), полученного путем совместного размалывания в соответствии с примером 8; на фиг. 14 - рентгеновский спектр очищенного DHEA; на фиг. 15 - рентгеновский спектр циклодекстрина; на фиг. 16 - рентгеновский спектр глицина; на фиг. 17 - рентгеновский спектр физической смеси DHEA-глицинциклодекстрин; на фиг. 18 - рентгеновский спектр клатрата(c-DHEA), полученного путем совместного осаждения в соответствии с примером 11; на фиг. 19 - рентгеновский спектр клатрата(GRc-DHEA), полученного путем совместного размалывания в соответствии с примером 8; на фиг. 20 - ИК-спектр очищенного DHEA; на фиг. 21 - ИК-спектр -циклодекстрина; на фиг. 22 - ИК-спектр глицина; на фиг. 23 - ИК-спектр физической смесиDHEA-глицинциклодекстрин; на фиг. 24 - ИК-спектр клатрата (c-DHEA),полученного путем совместного осаждения в соответствии с примером 11; на фиг. 25 - ИК-спектр клатрата (GRcDHEA), полученного путем совместного размалывания в соответствии с примером 8. Подробное описание изобретения Характеристики и преимущества комплексов с включениями, или клатратов дегидроэпиандростерона (DHEA), или DHEA-сульфата в соответствии с настоящим изобретением будут лучше показаны в ходе изложения подробного описания. Указанные клатраты состоят из DHEA,включенного в циклодекстрин, выбранный из циклодекстрина, -циклодекстрина и -циклодекстрина, и косолюбилизирующего агента,выбранного из группы, включающей аминокислоту, такую как, например, глицин, лизин, серин и аспартат, полимер, такой как полиэтиленгликоль 4000, кросповидон, целлюлозу, карбоксиметилцеллюлозу, крахмал и дикарбоновую кислоту, такую как винная кислота, янтарная кислота или глутаровая кислота. Указанные клатраты могут быть получены влажным способом или сухим способом, или даже путем перемешивания. 4 При мокром способе получения DHEA и циклодекстрин растворяются отдельно в соответствующих растворителях при температуре между 45 и 50 С. Предпочтительным растворителем дляDHEA является этанол, тогда как предпочтительным растворителем для растворения циклодекстрина является вода. Раствор циклодекстрина с температурой 45-50 С приливают к раствору DHEA той же температуры. Полученную смесь нагревают при отрицательном давлении при температуре между 50 и 60 С так, чтобы удалить растворители. Данную операцию продолжают до получения сухого продукта (содержание воды соответствует K.F.0,5%). При сухом способе получения DHEA и циклодекстрин измельчали совместно в течение достаточного времени (в часах) для получения клатрата. Предпочтительно сухой способ осуществляли следующим образом.DHEA и циклодекстрин совместно измельчают в помольной камере, насыщенной парами растворителя, способного солюбилизировать активное вещество или адсорбироваться на поверхности циклодекстрина. Растворители, пригодные для этой цели,представляют собой воду, метиленхлорид, хлороформ, метанол, этанол и изопропанол. Пригодным типом мельницы является мельница, генерирующая импульсную энергию удара. Время помола колеблется в диапазоне от 0,5 до 20 ч. В процессе смешивания или перемешивания DHEA и циклодекстрин перемешиваются с органическим растворителем, а полученное вещество размалывается до полного выпаривания используемого растворителя. С помощью вышеописанного способа получают DHEA-клатрат в циклодекстрине. Молярное соотношение DHEA и циклодекстрина составляет предпочтительно 1:1; однако данное соотношение может находиться между 3:1 и 1:10. Полученный, как описано выше, клатрат обрабатывается затем мокрым способом или сухим способом с косолюбилизирующим агентом для получения трехкомпонентного продукта, как описано раньше для получения бинарного продукта. Вес в процентах косолюбилизирующего агента в трехкомпонентном продукте колеблется между 5 и 50% и составляет предпочтительно 10%. Клатраты в соответствии с данным изобретением представляют в высокой степени аморфный DHEA, размер остатков кристаллов которого измеряется нанометрами, с кинетиками очень быстрого растворения и высокой со 5 любилизации, а также высокой биологической доступностью. В частности, из фармакокинетических исследований следует, что биологическая ценность DHEA-клатрата с циклодекстрином в два раза выше биологической ценности собственноDHEA. Кроме того, биоконверсия DHEA в тестостерон при введении 25 мг DHEA-клатрата с циклодекстрином, содержащим глицин в качестве косолюбилизирующего агента, у мужчин пожилого возраста оказалось практически незначительной. Поэтому продукты в соответствии с настоящим изобретением могут использоваться для получения фармацевтических композиций,пригодных для лечения состояний гормонального дисбаланса, особенно у людей пожилого возраста. Указанные композиции включают фармакологически эффективное количество продуктов, смешанных с инертным наполнителем и разбавителем, веществами, обычно используемыми в фармацевтических методиках. Предпочтительно, когда указанные композиции содержат одну часть продуктов, составленных таким образом, чтобы создать возможность быстрого высвобождения DHEA, а остальное количество компонуется так, чтобы сделать возможным медленное его высвобождение. Композиции в соответствии с настоящим изобретением используются- для заместительной терапии во всех случаях общей адренокортикоидной недостаточности, обусловленной первичным заболеванием железы (болезнь Аддисона) или первичным заболеванием диэнцефалогипофизарных структур(неопластический, сосудистый, или хирургический патогенез), способным быть причиной вторичной гипофункции надпочечников;- для заместительной терапии во всех случаях частичной недостаточности коры надпочечников после пролонгированного лечения кортизоном хронических заболеваний аутоиммунного происхождения;- для заместительной терапии во всех случаях, часто обнаруживаемых в период старения,для которых отчетливое снижение секрецииDHEA сопровождается клиническими признаками, такими как остеопения, саркопения (нарушение мышечного генеза), недостаточностью познавательного поведения (ослабление концентрирования внимания и памяти), неупорядоченным настроением и иммунодефицитом, что вместе создает клиническую картину, определяемую термином адренопауза, которая может быть в большей мере отнесена к возрастным расстройствам;- у женщин, лечение которых может давать позитивные результаты при состояниях, относящихся к началу периода после менопаузы, 003304 6 таких как вагинальная атрофия, недостаточность полового влечения, недержание мочи;- у женщин с недостаточностью функции надпочечников, у которых данное лечение улучшает здоровье и сексуальность с купированием уровня депрессии и axienty и улучшает их физические соотношения (например, тенденция к истощению);- у гипогонадальных мужчин, у которых лечение может приводить к восстановлению нормальной сексуальной функции, предотвращать остеопороз и атрофию мышц и повышать соотношение мышечной массы тела к жировой прослойке тела; у этих пациентов можно получить дополнительный терапевтический эффект познавательной функции и хотя не сексуальное,но близкое к мужскому типу поведение;- у представителей обоих полов, у которых достигают терапевтической эффективности в лечении нарушений углеводного обмена и липидного обмена. Отсюда следует, что DHEA может обладать профилактической и терапевтической эффективностью в отношении ожирения и, прежде всего, в отношении атеросклеротических заболеваний. На основании экспериментальных данныхin vitro и эпидемиологических данных можно также сделать предположение о способностиDHEA благотворно влиять на развитие рака молочной железы и рака желудка. Наконец, другой документированный биологический эффект представлен способностью активировать секрецию слезной железы и, следовательно, выполнять терапевтическую роль в ксерофтальмии. Данная терапия предусматривает пероральное введение от 12,5 мг до 50 мг/день в виде DHEA или в виде DHEA-клатрата. В соответствии с настоящим изобретением, нижеследующие примеры иллюстрируют получение соединений и соответствующих фармакологических экспериментальных данных. Пример 1. В стеклянный реактор, снабженный обратным холодильником и защищенный от света,вносят 6 г (0,0208 моль) DHEA и 200 мл 95%-го этанола и полученную смесь нагревают до 47 С до полного растворения DHEA. Отдельно получают раствор 10 г (0,0102 моль) -циклодекстрина в 200 мл дистиллированной воды и нагревают его до 47 С. Раствор -циклодекстрина с температурой 47 С вливают при перемешивании в растворDHEA, имеющий такую же температуру. Данную операцию осуществляют медленно, чтобы предохранить раствор от помутнения. Получают практически прозрачный или слегка опалесцирующий раствор. Его переносят в вакуумный реакционный аппарат, предварительно нагретый до темпера 7 туры 50-60 С и выдерживают при этой температуре в условиях отрицательного давления до получения высушенного продукта (содержание остаточной воды соответствует K.F.0,5%). Полученный сухой продукт просеивают с использованием сита 60 меш, избегая освещения. Таким путем получают 14,8 г клатрата с молярным соотношением 2:1 DHEA и циклодекстрина. Проверяют растворимость полученного продукта и осуществляют анализ с помощью дифференциальной сканирующей калориметрии(DSC). Тесты на растворимость в данном примере и в последующих примерах осуществляют путем диспергирования количества продукта, соответствующего 60 мг DHEA в 100 мл бидистиллированной воды при 25 С при перемешивании. Определение растворимости проводят после выдерживания продукта в воде в течение 24 ч. Установленная растворимость составляла 11,5 мг DHEA в 100 мл воды. В DSC-анализе установленная температура плавления составляла соответственно 139,8 и 149,3 С, а теплота плавления равнялась соответственно 158,09 и 10,19 Дж/г, доказывая таким образом существование одной части DHEA в виде клатрата и одной остаточной кристаллической части DHEA. Для сравнения собственно DHEA характеризуется температурой плавления 150,9 и теплотой плавления 84,2 Дж/г. Пример 2. Повторяют условия примера 1 с той лишь разницей, что используют 3 г (0,0104 моль)DHEA и 10 г (0,0102 моль) -циклодекстрина. Получают клатрат, имеющий молярное соотношение DHEA и-циклодекстрина 1:1. Растворимость полученного продукта в воде составляла 11,3 мг DHEA в 100 мл воды. Температура плавления составляла соответственно 135,2 и 147,5 С, а теплота плавления равнялась соответственно 130,18 и 55,56 Дж/г. Пример 3. Повторяют условия примера 1 с той лишь разницей, что используют 1,5 г (0,005 моль)DHEA и 10 г (0,0102 моль) -циклодекстрина. Получают клатрат с молярным соотношением DHEA и -циклодекстрина 1:2. Растворимость полученного продукта в воде составляла 11,7 мг DHEA в 100 мл воды. Температура плавления составляла соответственно 139,0 и 150,9 С, а теплота плавления составляла соответственно 30,42 и 11,06 Дж/г. Пример 4. Смесь, содержащую 3 г DHEA и 10 г циклодекстрина с размером частиц менее 60 меш, помещают в помольную камеру высокоэнергетичной коллоидальной мельницы. 8 Помольную камеру насыщают парами метиленхлорида при комнатной температуре и данную смесь размалывают в течение одного часа. Затем продукт нагревают при отрицательном давлении для удаления адсорбированного метиленхлорида и в конце просеивают с использованием сита 60 меш. Получают продукт, состоящий из клатрата с молярным соотношением DHEA и циклодекстрина 1:1, имеющего растворимость 13,3 мг DHEA в 100 мл воды. Температура плавления составила 149,4 С, а теплота плавления составила 13,62 Дж/г, доказывая тем самым,что весь DHEA находится в виде клатрата. Примеры 5 и 6. Повторяют условия примера 1 с той лишь разницей, что вместо -циклодекстрина используют -циклодекстрин (пример 5) и -циклодекстрин (пример 6). Полученные клатраты обладают более скудными характеристиками в сравнении с клатратом из примера 1. Пример 7. В механическую ступку вносят 0,3 г DHEA и 1,0 г -циклодекстрина, и затем приливают 1 мл этанола. Смесь энергично мололи до полного выпаривания этанола. Полученный клатрат обладает молярным соотношением DHEA и циклодекстрина 1:1. Растворимость в воде составила 11,6 мг DHEA в 100 мл воды. Температура плавления составила 149,9 С, а теплота плавления - 49,03 Дж/г. Пример 8. Повторяют условия примера 4, с той лишь разницей, что в помольную камеру вносят 10,0 г продукта, полученного в примере 4, в смеси с 1,25 г глицингидрохлорида. Получают клатрат, содержащий глицин в качестве косолюбилизирующего агента. Растворимость в воде составила 12,5 мгDHEA в 100 мл воды. Кривая DCS характеризуется широким эндотермическим диапазоном от 60 до 160 С, демонстрируя аморфность продукта. Пример 9. Повторяют условия примера 4, с той лишь разницей, что в помольную камеру помещают 10,0 г продукта, полученного в примере 4 и 1,0 г ПЭГ 4000. Полученный продукт имел растворимость в воде 11,0 мг DHEA в 100 мл воды. Температура плавления составила 149,8 С,а теплота плавления - 6,61 Дж/г. Пример 10. Повторяют условия примера 7 с той лишь разницей, что 1,0 г продукта, полученного в примере 7, помещают в ступку для смешивания с 0,1 г глицингидрохлорида. Полученный продукт имел растворимость в воде 11,8 мг DHEA в 100 мл воды. 9 Температура плавления составила 149,6 С,а теплота плавления - 32,86 Дж/г. Пример 11. Повторяют условия примера 1 с той лишь разницей, что используют 3 г (0,0104 моль)DHEA и 10 г (0,0102 моль) -циклодекстрина и что в приготовленный раствор DHEA добавляют 1,6 г глицингидрохлорида. Получают клатрат, содержащий глицин в качестве косолюбилизирующего агента. Полученный продукт имел растворимость в воде 11,7 мг DHEA в 100 мл воды. Температура плавления составила соответственно 140,2 и 149,6 С, а теплота плавления соответственно 19,9 и 26,9 Дж/г. Пример 12. Повторяют условия примера 4 с той лишь разницей, что используют 3 г (0,0104 моль)DHEA и 20 г (0,0204 моль) -циклодекстрина. 10 г продукта помещают в помольную камеру с 1,0 г глицингидрохлорида. Получают клатрат, обладающий молярным соотношением DHEA и -циклодекстрина 1:2,содержащий глицин в качестве косолюбилизирующего агента. Растворимость клатрата в воде составила 18,7 мг DHEA в 100 мл воды.DSC-кривая характеризуется широкой основной эндотермической полосой от 60 до 160 С, что свидетельствует о почти полной аморфности данной системы. Физико-химическая характеристика клатрата DНЕАциклодекстрин-глицин Осуществляли исследование дифференциальной сканирующей калориметрией (DSC),дифрактометрией рентгеновских лучей и инфракрасной спектроскопией следующих образов:(DHEA),- глицина (Gly),- -циклодекстрина (-Cd),- физической смеси (P.M.) трех компонентов в одних и тех же соотношениях, представленных в клатратах (DHEA:-Cd в эквимолярном соотношении, в присутствии 12,5%-го w/w глицина),- клатрата DHEACd-глицин (c-DHEA),полученного путем осаждения, в соответствии с примером 11,- клатрата DHEACd-глицин (GRcDHEA), полученного путем совместного размалывания в соответствии с примером 8. А) DSC-анализ. Использовали измерительное устройство ТА 4000 с ячейкой DSC 25.DSC-кривая очищенного DHEA (фиг. 8 DHEA) представлена тепловым профилем обычно очищенного, кристаллического безводного вещества, характеризующегося наличием единственного эндотермического пика, выяв 003304 10 ляемого при 150,9 С, с энтальпией в 84,2 Дж/г,который относится к его плавлению. При наивысшей температуре отмечено начало экзотермического эффекта, который может быть отнесен к феномену деградации.DSC-кривая глицинового образца (фиг. 9 Gly) представлена единственным эндотермическим феноменом, который может быть отнесен к его плавлению, с температурой пика в 166,3 С, сопровождающейся энтальпией в 11,6 Дж/г.DSC-кривая -циклодекстрина (фиг. 10 Cd), в рассматриваемом температурном диапазоне характеризуется широкой эндотермической полосой с наиболее интенсивным пиком около 150 С, который может быть отнесен к процессу обезвоживания -С, содержащего около 10% кристаллизационной воды).DSC-кривая физической смеси DHEA-циклодекстрин-глицин (фиг. 11 - P.M.) корреспондирует с перекрывающимися термальными кривыми трех его компонентов, указывая на отсутствие взаимодействия между ними. Широкая эндотермическая полоса обезвоживания циклодекстрина хорошо различима, также как и отчетливый эндотермический пик плавленияDHEA (Тпик=149,5 С), за которым следует плечо около 165 С, которое можно приписать плавлению глицина. Значение энтальпии, полученное путем интегрирования пика плавления DHEA(Н=213,3 Дж/г), четко увеличено и связано с частичным перекрыванием феномена обезвоживания циклодекстрина.DSC-кривая клатрата, полученного путем осаждения в соответствии с примером 11 (фиг. 12 - c-DHEA), четко отличается от соответствующей физической смеси (фиг. 11 - P.M.) и указывает, что происходит взаимодействие. Данная кривая характеризуется наличием двух обособленных эндотермических пиков соответственно 140,2 С (Н = 19,9 Дж/г) и 149,6 С(Н=26,9 Дж/г). Пик при более высокой температуре несомненно связан с плавлением DHEA,который не влияет на образование данного клатрата; практически его температура точно соответствует пику DHEA, наблюдаемому в физической смеси (Тпик=149,5 С), который, в свою очередь, соответствует пику очищенногоDHEA (Тпик=150,9 С). Вместо этого, первый пик может быть связан с плавлением нового продукта, образованного в результате взаимодействия между компонентами. Низкие энтальпийные значения обоих эндотермических феноменов свидетельствуют о существенном снижении степени кристалличности системы по сравнению с простой физической смесью.DSC-кривая клатрата, полученного в результате совместного размола, в соответствии с примером 8 (фиг. 13 - GRc-DHEA), четко отличает его составляющие от кривой физической смеси и от кривой клатрата, полученного в ре 11 зультате осаждения (c-DHEA), и характеризуется нормальной эндотермической полосой от 60 до 160 С. Отсутствие любого другого пика свидетельствует о том, что взаимодействие между тремя компонентами, после совместного размола, приводит почти к полной аморфности системы. Следует подчеркнуть, что достижение аморфного состояния является в высшей степени преимуществом, поскольку твердый продукт в аморфном состоянии всегда имеет лучшие характеристики растворения, чем соответствующий кристаллический продукт. В) Рентгенографический анализ. Рентгенографические дифракционные спектры различных образцов были получены при помощи дифрактометра Philips PW 130 (с использованием Ка-излучения Cu) со скоростью сканирования 1/мин для угла 10-50 2. Рентгеновский спектр очищенного DHEA(фигура 14 - DHEA) представляет типичный кристаллический продукт с плоской базовой линией и многочисленными пиками кристалличности, включающий, в частности, интенсивные пики при 17,3; 18,1; 20,6; 21,5; 22,3; 34,5 2. Рентгеновский спектр -циклодекстрина(фиг. 15 - -Cd) также представляет типичный кристаллический продукт; наблюдаются многочисленные пики кристалличности, включающий, в частности, интенсивные пики при 13,8; 16,6; 21; 25,2 2. Рентгеновский спектр глицина (фиг. 16 Gly) также представляет типичный кристаллический продукт; интенсивные пики кристалличности наблюдаются при 16,8; 25,5; 29,5; 34,2; 35,3; 39,5; 42; 46 2. Дифракционный спектр физической смесиDHEAциклодекстрин-глицин (фиг. 17 - P.M.) представляет перекрывающийся спектр трех очищенных компонентов; можно различить многочисленные пики кристалличности со значениями 2 угла, аналогичными углам, наблюдаемым для трех компонентов без сдвигов или явных изменений. Дифракционный спектр клатрата, полученного в результате осаждения в соответствии с примером 11 (фиг. 18 - c-DHEA), четко отличается от дифракционного спектра соответствующей физической смеси. Наблюдаемое уменьшение интенсивности числа пиков, свидетельствует об уменьшении кристалличности данного образца. При сравнении с физической смесью можно также наблюдать изменение в относительной интенсивности некоторых пиков при увеличении, в частности, относительной интенсивности пиков при 18 и 20,5 2; это явление, сопровождаемое сдвигом некоторых пиков,должно подтверждать образование новой твердой кристаллической фазы, что показано также 12 Дифракционный спектр клатрата, полученного в результате совместного размола в соответствии с примером 8 (фиг. 19GRcDHEA), представляет четкое отличие обоих составляющих от образца физической смеси и от клатрата, полученного путем осаждения (cDHEA). Можно наблюдать почти полное исчезновение пиков кристалличности и появление большой волнообразной полосы, типичной для аморфных продуктов. Несколько остаточных пиков кристалличности, по-видимому, принадлежат глицину. Следовательно, рентгенографический анализ подтверждает результаты DSCанализа, демонстрируя, что данный продукт аморфен. С) Инфракрасная спектроскопия. Инфракрасные спектры были получены в нуджоле, в диапазоне 4000-600 см 1, с использованием ИК-спектрофотометра Perkin Elmer, мод. 983. Из-за перекрывания, обусловленного полосами комплекса из трех компонентов, невозможно получить большое количество информации для спектра физической смеси DHEA-циклодекстрин-глицин, в котором различимы основные полосы DHEA. При сравнении ИК-спектров физической смеси (фиг. 23 - P.M.) и клатрата, полученного осаждением в соответствии с примером 11 (фиг. 24 - c-DHEA), можно отметить почти полную аналогию основных полос, для которых, что примечательно, сдвигов не наблюдается. Наиболее явное различие заключается в увеличении относительной интенсивности полосы при 1728 см 1, которая в клатрате также видна при сдвиге до 1724 см 1. В случае спектра клатрата, полученного при совместном размоле в соответствии с примером 8 (фиг. 25 - GRc-DHEA), различия в отношении спектра физической смеси видны намного четче. Помимо четкого уменьшения полосы при 1728 см 1 (здесь сдвинута до 1731 см-1),четкое изменение наблюдается для полосы при 1637 см-1, которая отчетливо увеличена по интенсивности и подвержена сдвигу до 1598 см-1. Наблюдается также появление полосы при 1498 см 1 и сдвиг полосы при 1303 см 1 к более высокой частоте (1335 см 1). Хотя особая трудность интерпретации связана со сложностью спектра мультикомпонентной системы, эти изменения свидетельствуют об интенсивности взаимодействия между компонентами, появляющегося после процесса размалывания. Фармакологические эксперименты А) Кинетика и метаболизм экзогенногоDHEA. Первую часть экспериментов осуществляли с целью верификации кинетик и процессов сульфоконъюгации и биоконверсии собственноDHEA, вводимого лицам мужского пола. Указанных мужчин делили на две группы по возрасту: одна группа из семи молодых мужчин 13 имела возраст между 24 и 32 годами, а другая группа состояла из пожилых мужчин в возрасте между 67 и 86. Каждому пациенту перорально вводили 100 мг DHEA в виде однократной дозы. Через 0,5, 1, 2, 3, 4, 6, 9, 12 и 24 ч после введения в крови определяли уровни DHEA, DHEAсульфата, общего тестостерона и 17 эстрадиола. Оценки выставляли с использованием характеристики максимальной дельты(достижение максимального пика, из которого вычитали базовые значения) и характеристики площади под кривой (триангуляционная сеть). Полученные результаты показывают, что 1 - Пиковый уровень DHEA крови после введения экзогенного DHEA достигается в обоих группах примерно через один час после введения. Ответ на введение был значительно выше у лиц пожилого возраста. 2 - Пиковый уровень DHEA-сульфата крови после введения экзогенного DHEA достигается в обоих группах примерно через два часа после введения. Ответ на введение снова был существенно выше у лиц пожилого возраста. 3 - Молярное соотношение DHEA-сульфата и DHEA в ответ на введение не показало значительных различий. 4 - После введения DHEA профили уровня тестостерона не имеют каких-либо существенных различий у лиц молодого возраста при сравнении пациентов, которым вводили DHEA,и пациентов, которым вводили плацебо. Но у лиц пожилого возраста различия оказались статистически достоверными (двухфакторный статистический анализ ANOVA). 5 - Такая же картина наблюдалась для уровней 17-эстрадиола в крови. Эти результаты позволяют предложить следующую трактовку: а) более высокая биологическая ценностьDHEA и DHEA-сульфата может быть индуцирована пониженным содержанием в крови этих стероидов, обнаруженным в базисных условиях у лиц пожилого возраста. Второе объяснение данного явления может относиться к различному метаболическому клиренсу в двух группах;b) процесс сульфоконъюгации, как об этом свидетельствует установленное молярное соотношение, практически идентичен в двух группах;c) биологическое преобразование в тестостерон и 17 эстрадиол очевидно только у лиц пожилого возраста. Весьма вероятно, что базальный уровень тестостерона в крови играет определяющую роль в прямой периферической биоконверсии, что является более существенным при пониженном уровне тестостерона в крови. В) Кинетика и метаболизм экзогенногоDНЕА-клатрата. Вторую часть экспериментов проводили с целью сравнения эффекта введения DHEA 003304 14 клатрата в соответствии с настоящим изобретением и введения собственно DHEA. Группе из 6 мужчин в возрасте между 62 и 93 годами (средний возраст 82,3; стандартное отклонение 11,3; стандартная ошибка 4,6) на 5-й день случайным образом вводили 25 мг одного лишь DHEA и DHEA в виде клатрата, который получали в примере 4. Определение уровняDHEA, DHEA-сульфата, общего тестостерона и 17-эстрадиола в крови осуществляли с использованием способов, описанных выше, в пункте А). Полученные результаты, которые в количественном виде представлены на диаграммах 1-7,свидетельствуют, что 1 - Уровни DHEA и DHEA-сульфата в крови были выше после введения DHEA-клатрата,чем после введения одного лишь DHEA. 2 - Молярное соотношение DHEA-сульфата и DHEA в крови было выше после введенияDHEA-клатрата, хотя полученное различие не достигало границ статистической достоверности. 3 - Биологическое преобразование DHEA в тестостерон демонстрирует поведение, которое во многом остается тем же, что и после двух различных введений, несмотря на тот факт, что более высокая биологическая ценность DHEAклатрата приводит к более высокому его уровню в крови. 4 - Биологическое преобразование DHEA в 17-эстрадиол было существенно выше после введения DHEA-клатрата, чем после введения одного лишь DHEA. Данный факт приобретает важное значение с клинической точки зрения,хотя и способность предохранять сердечнососудистую систему появляющимся эстрогеном остается важной. Описание фигур, относящихся к фармакологическим экспериментам Фиг. 1 представляет уровни DHEA в крови, выраженные в нг/мл, после введения собственно DHEA (колонка А) и DHEA-клатрата (колонка В). Данные определения были произведены с использованием метода максимальной дельты; фиг. 2 представляет уровни DHEA в крови,выраженные в нг/мл, после введения собственноDHEA (колонка А) и DHEA-клатрата (колонка В). Данные определения были произведены с использованием метода площади под кривой; фиг. 3 представляет уровни DHEAсульфата в крови, выраженные в мкг/дл (децилитр), после введения собственно DHEA (колонка А) и DHEA-клатрата (колонка В). Данные определения были произведены с использованием метода максимальной дельты; фиг. 4 представляет уровни DHEAсульфата в крови, выраженные в мкг/дл, после введения собственно DHEA (колонка А) и 15 Определения были произведены с использованием метода площади под кривой; фиг. 5 представляет молярное соотношение DHEA-сульфата и DHEA в крови, как функцию времени (в часах), после введения собственно DHEA (кривая А) и DHEA-клатрата (кривая В); фиг. 6 представляет уровень тестостерона в крови, выраженный в нг/дл, как функцию времени (в часах), после введения собственноDHEA (кривая А) и DHEA-клатрата (кривая В); фиг. 7 представляет уровень 17 эстрадиола в крови, выраженный в пкг/мл, как функцию времени (в часах), после введения собственно DHEA (кривая А) и DHEA-клатрата(DHEA), возможно в форме сульфата, в матриксе из -, - или -циклодекстрина, характеризующийся наличием косолюбилизирующего агента, выбранного из группы, включающей аминокислоту, кросповидон, полиэтиленгликоль 4000, целлюлозу, карбоксиметилцеллюлозу,крахмал, винную кислоту, янтарную кислоту и глутаровую кислоту. 2. Клатрат по п.1, отличающийся тем, что указанная аминокислота выбрана из группы,включающей глицин, лизин, серин и аспартат. 3. Клатрат по п.1, отличающийся тем, что молярное соотношение указанного DHEA и указанного циклодекстрина находится между 3:1 и 1:10. 4. Клатрат по п.1, отличающийся тем, что молярное соотношение между указаннымDHEA и указанным циклодекстрином составляет 1:1. 5. Клатрат по п.1, отличающийся тем, что молярное соотношение указанного DHEA и указанного -циклодекстрина составляет 1:1. 6. Клатрат по п.1, отличающийся тем, что весовое количество указанного косолюбилизирующего агента составляет между 5 и 50%. 7. Клатрат по п.1, отличающийся тем, что весовое количество указанного косолюбилизирующего агента составляет 10%. 8. Фармацевтическая композиция, включающая фармакологически эффективное количество клатрата по п.1, в смеси с наполнителем и разбавителем, веществами, обычно используемыми в фармацевтических методиках. 9. Композиция по п.8, в которой одна часть композиции составляется таким образом, чтобы создать возможность быстрого высвобожденияDHEA, а остальная часть составляется так, чтобы создать возможность медленного высвобождения DHEA. 10. Композиции по п.8, пригодные для лечения патологических состояний, включающих нарушения, вызванные адренокортикальной недостаточностью, адренопаузальными нарушениями, гипогонадизмом и ксерофтальмией. 11. Терапевтический способ лечения нарушений, вызванных адренокортикоидной недостаточностью, адренопаузальными нарушениями, гипогонадизмом и ксерофтальмией,включающий пероральное введение дозы от 12,5 до 50 мг DHEA в день в виде клатрата по п.1.
МПК / Метки
МПК: A61K 31/565, A61P 5/00, A61K 47/48
Метки: композиции, соответствующие, фармацевтические, дегидроэпиандростерона, клатраты
Код ссылки
<a href="https://eas.patents.su/12-3304-klatraty-degidroepiandrosterona-i-sootvetstvuyushhie-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Клатраты дегидроэпиандростерона и соответствующие фармацевтические композиции</a>
Предыдущий патент: Способ лечения диабета тиазолидиндионом и сульфонилмочевиной
Следующий патент: Производные гигромицина
Случайный патент: Способ разделения и очистки гафния и циркония