Дозированные ингаляторы под давлением, содержащие растворы бета-2-агонистов
Номер патента: 8592
Опубликовано: 29.06.2007
Авторы: Дейвис Ребекка Джейн, Брамбилла Гаэтано, Феррарис Алессандра, Гэндертон Дейвид, Льюис Дейвид Эндрю, Черч Таня Кэтлин, Микин Брайан Джон
Формула / Реферат
1. Фармацевтический аэрозольный препарат для введения при помощи дозированного ингалятора под давлением, содержащий в качестве активного ингредиента b2-агонист длительного действия, выбранный из 2(1Н)-хинолинонового производного формулы
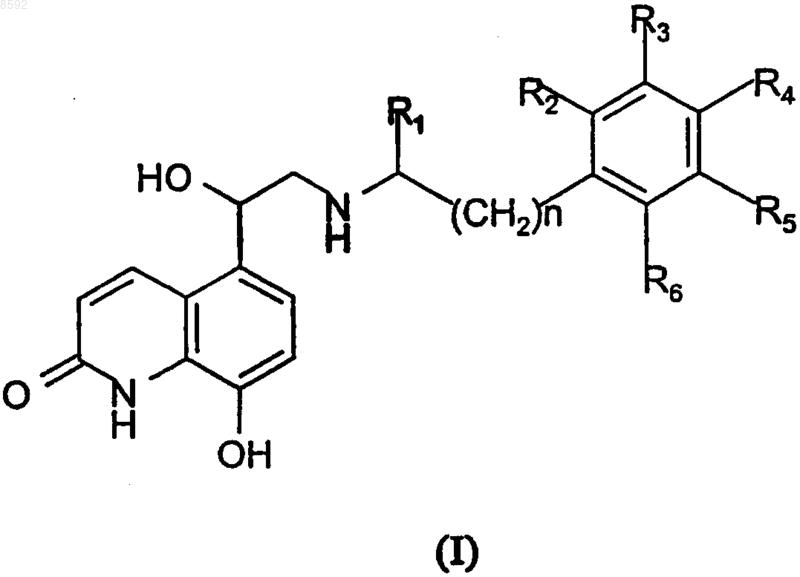
где R1 представляет собой метил и
R2 представляет собой водород или
R1 и R2 образуют метиленовый мостик (CH2)n,
n равно 1 или 2,
R3, R4, R5 и R6, каждый независимо, представляет собой водород, гидрокси, С1-С4алкил с прямой или разветвленной цепью, С1-С4алкил с прямой или разветвленной цепью, замещенный одним или более чем одним галогеном и/или гидрокси, галоген, С1-С4алкокси с прямой или разветвленной цепью, его стереоизомер, физиологически приемлемые соль и сольват в растворе, состоящем из сжиженного гидрофторалканового (HFA) пропеллента, сорастворителя и возможно количества воды до 5% на общую массу препарата.
2. Фармацевтический препарат по п.1, где фракция частиц, размер которых равен или менее 1,1 мкм, высвобождаемая при приведении в действие ингалятора, более или равна 30%, как определено по содержанию на стадиях S6-AF каскадного импактора Андерсена относительно содержания на стадиях S3-AF.
3. Фармацевтический препарат по пп.1-2, где фракция частиц, размер которых равен или менее 1,1 мкм, высвобождаемая при приведении в действие ингалятора, составляет более 40%.
4. Фармацевтический препарат по пп.1-3, где активный ингредиент представляет собой 8-гидрокси-5-[(1R)-1-гидрокси-2-[[(1R)-2-(4-метоксифенил)-1-метилэтил]амино]этил]-2(1Н)-хинолинон, его физиологически приемлемые соль или сольват.
5. Фармацевтический препарат по пп.1-3, где активный ингредиент представляет собой 8-гидрокси-5-[(1R)-1-гидрокси-2-[[(1R)-2-(4-метоксифенил)-1-метилэтил]амино]этил]-2(1Н)-хинолинона гидрохлорид.
6. Фармацевтический препарат по п.5, где активный ингредиент находится в концентрации между 0,0005 и 0,024% мас./об.
7. Фармацевтический препарат по п.5, где активный ингредиент находится в концентрации между 0,001 и 0,008% мас./об.
8. Фармацевтический препарат по любому из пп.1-7, где наблюдаемое рН составляет от 2,5 до 5,0.
9. Фармацевтический препарат по любому из пп.1-8, где наблюдаемое рН составляет от 2,8 до 4,0.
10. Фармацевтический препарат по пп.8 и 9, где рН доведен путем добавления минеральной кислоты.
11. Фармацевтический препарат по п.10, где минеральная кислота выбрана из группы, состоящей из соляной, азотной и фосфорной кислот.
12. Фармацевтический препарат по любому из пп.1-11, где пропеллент включает в себя один или более чем один гидрофторалкан [HFA], выбранный из группы, содержащей HFA 134а и HFA 227.
13. Фармацевтический препарат по любому из пп.1-12, где сорастворитель выбран из группы низших алкиловых (С1-С4)спиртов, полиолов, полиалкиленгликолей, (поли)алкоксипроизводных и их комбинаций.
14. Фармацевтический препарат по п.13, где сорастворитель представляет собой этанол.
15. Фармацевтический препарат по п.14, где этанол составляет от 5 до 30 мас.%.
16. Фармацевтический препарат по п.15, где этанол составляет от 10 до 20 мас.%.
17. Фармацевтический препарат по любому из пп.1-16, дополнительно содержащий дополнительный активный ингредиент, выбранный из класса стероидов, таких как беклометазона дипропионат, флунизолид, мометазона фуроат, флутиказона пропионат, циклесонид, будесонид и его 22R-эпимер, или антихолинергических атропинподобных производных, таких как ипратропия бромид, окситропия бромид и тиотропия бромид, или ингибитора фосфодиэстеразы.
18. Дозированный ингалятор под давлением, включающий контейнер, часть или все внутренние металлические поверхности которого облицованы инертным органическим покрытием, где указанный контейнер заполнен фармацевтическим препаратом по любому из пп.1-17.
19. Ингалятор по п.18, где контейнер облицован инертным органическим покрытием, выбранным из эпоксифенольных смол, перфторалкоксиалкана, перфторалкоксиалкилена, перфторалкиленов, таких как политетрафторэтилен, фторированный этилен-пропилен, полиэфирсульфон и сополимер фторированного этилена-пропилена-полиэфирсульфона.
20. Ингалятор по п.19, где инертное органическое покрытие представляет собой политетрафторэтилен (Тефлон).
21. Способ заполнения аэрозольного ингалятора препаратом по любому из пп.1-17, при котором:
(а) готовят раствор одного или более чем одного активного ингредиента в одном или более чем одном сорастворителе;
(б) возможно добавляют предварительно установленное количество воды и/или доводят рН раствора;
(в) заполняют ингалятор указанным раствором;
(г) обжимают клапанами и газируют;
(д) добавляют пропеллент, содержащий гидрофторалкан (HFA).
Текст
008592 Предшествующий уровень техники Астма представляет собой заболевание, которое становится все более распространенным и является наиболее частым детским заболеванием. Ее можно установить по периодически повторяющейся одышке и периодическому ограничению воздушного потока. Несмотря на многочисленные достижения в понимании этого заболевания, указанная патология остается недостаточно понятным и часто недостаточно лечимым заболеванием. Ранее сокращение гладких мускул дыхательных путей рассматривали в качестве наиболее важного признака астмы. Недавно произошло заметное изменение способа оказания помощи при астме, исходя из того факта, что астму рассматривают как хроническое воспалительное заболевание. Бесконтрольное воспаление дыхательных путей может привести к повреждению слизистой и структурным изменениям, ведущим к необратимому сужению дыхательных путей и фиброзу легочной ткани. Следовательно, целью терапии должно быть регулирование симптомов таким образом, чтобы обеспечить возможность нормальной жизни и одновременно базу для лечения лежащего в основе заболевания воспаления. Другим респираторным заболеванием, частота которого постоянно возрастает во всем мире, является хроническое обструктивное заболевание легких (COPD). Большинство пациентов с COPD приобрели свое легочное заболевание из-за курения сигарет. В зависимости от тенденций в табакокурении, установлено, что во всем мире к 2020 г. оно будет пятой по распространенности причиной нетрудоспособности (Leckie M. et al., Exp. Opin. Invest. Drugs 2000, 9, 3-23). Хроническое обструктивное заболевание легких (COPD) определяют как болезненное состояние,характеризующееся наличием затрудненности дыхания из-за хронического бронхита или эмфиземы. Хронический бронхит характеризуется избыточной секрецией бронхиальной слизи, тогда как эмфизема означает ненормальное, постоянное увеличение воздушных областей, дистальных к терминальной бронхиоле, с деструкцией их стенок и без явного фиброза (Американское торакальное общество). Каждое состояние лечат как отдельное заболевание. Хронический обструктивный бронхиолит обусловлен обструкцией периферических дыхательных путей в результате воспаления бронхиол. В течение многих лет главной основой лечения астмы являлись агонисты 2-адреноцепторов, ввиду их быстрого бронхорасширяющего действия. Предыдущие исследования также показали, что 2 агонисты обладают большими противовоспалительными возможностями, например, путем подавления высвобождения провоспалительных цитокинов. Лекарственные средства первого поколения, такие как сальбутамол или фенотерол, характеризовались относительно короткой длительностью действия, которую рассматривали как недостаток, в частности для пациентов с ночной астмой. Кроме того, они обладали ограниченным действием при COPD, так как это заболевание приводит к "необратимой" обструкции дыхательных путей. Разработка 2-агонистов длительного действия, таких как формотерол, сальметерол и ТА 2005, следовательно, была объявлена главным новым усовершенствованием в лечении астмы. Согласно некоторым авторам, длительно действующие 2-агонисты (LABAs) могут обладать сильным противовоспалительным действием in vivo (Johnson M. Clin. Exp. Allergy 1992, 22, 177-181; Stelmach I et al. Ann. Allergy Asthma Immunol. 2002, 89, 67-73). Эти лекарственные средства являются новой интересной терапевтической возможностью для пациентов с хроническим обструктивным легочным заболеванием (COPD) также потому, как было показано, что они значительно улучшают легочную функцию и контроль за симптомами. 2-Адренергические агонисты также могут стимулировать клиренс альвеолярной жидкости у некоторых видов животных и ex vivo в легких крыс и человека. В свете этих открытий терапия бетаадренергическими агонистами предложена как возможное лечение для ускорения рассасывания легочного отека у пациентов с острым отеком легких (Sacuma et al., Am. J. Resp. Crit. Care Med. 1997, 155, 506512). Лечение 2-агонистами также может увеличивать секрецию поверхностно-активного вещества и возможно оказывает противовоспалительное действие, помогая таким образом восстановить проницаемость сосудов легких (Ware L. et al. New Eng. J. Med. 2000, 342, 1334-1349). Лекарства, предназначенные для лечения легочных заболеваний, таких как астма и COPD, вводят в настоящее время путем подачи в легкие, которая основана на ингаляции аэрозоля через рот и глотку таким образом, чтобы лекарственное вещество могло достичь легкого. Их можно вводить в виде водных или водно-спиртовых препаратов через небулайзер, в виде сухих порошков при помощи ингаляторов сухого порошка или в пропеллентах из галогенированных углеводородов. Системы, основанные на пропелленте, требуют подходящих дозированных ингаляторов под давлением (рМID), которые выпускают отмеренную дозу лекарства при каждом приведении в действие. Соответствующие препараты могут находиться в форме растворов или суспензий. Препараты растворов, по отношению к суспензиям, не имеют проблем физической стабильности суспендированных частиц, и таким образом могут гарантировать более высокое постоянство и воспроизводимость дозы. Что касается типа пропеллента, обязательными пропеллентами будут гидрофторалканы [(HFA), известные также как гидрофторуглероды (HFC)], так как хлорфторуглероды (также известные как фреоны или CFC), которые в течение многих лет являлись предпочтительными аэрозольными пропеллентами для фармацевтического применения, причастны к-1 008592 разрушению озонового слоя, так что их применение было прекращено. В частности известно, что 1,1,2,2 тетрафторэтан (HFA 134 а) и 1,1,1,2,3,3,3-гептафторпропан (HFA 227) являются лучшими кандидатами в не-CFC пропелленты, и был описан ряд фармацевтических аэрозольных препаратов, использующих такие HFA пропеллентные системы. При разработке лечебного аэрозоля распределение по аэродинамическому размеру вдыхаемых частиц является наиболее важной переменной в определении места осаждения капель или частиц в легких пациента; вкратце, оно определяет, будет или нет успешным нацеливание лекарственного средства. См.P. Byron, "Aerosol Formulation, Generation, and Delivery Using Nonmetered Systems, "Respiratory Drug Delivery, 144-151, 144 (CRC Press, 1989). Таким образом, необходимым условием для разработки лечебного аэрозоля является предпочтительный размер частиц. Когда препарат находится в форме суспензии, размер частиц в облаке подчинен размеру частиц суспендированного лекарственного средства, определяемому процессами измельчения/микронизации. Когда препарат находится в форме раствора, объемное распределение суспендированных частиц лекарственного вещества отсутствует, и образуются облака значительно более мелких капелек жидкости, в большой степени определяемых концентрацией лекарственного средства в растворе. Твердые частицы и/или капельки в аэрозольном препарате можно охарактеризовать их средним массовым аэродинамическим диаметром (MMAD, диаметром, вокруг которого равномерно распределены массовые аэродинамические диаметры). Отложение частиц в легких значительно зависит от трех физических механизмов: 1) импакции, функции инертных частиц; 2) седиментации благодаря гравитации и 3) диффузии в результате броуновского движения мелких, субмикронных (1 мкм) частиц. Масса частиц определяет, какой из этих трех основных механизмов преобладает. Ранее сообщалось, что для аэрозольной терапии лекарственными средствами, которые местно воздействуют на гладкие мышцы дыхательных путей, в которых не происходит газообмена, и в частности 2-агонистами, частицы должны преимущественно осаждаться в области легких от верхней до средней(область бронхиолей), так что они должны иметь MMAD от приблизительно 1,5 (2,0) до приблизительно 5,0 мкм, предпочтительно приблизительно 3 мкм (Zanen P. et al. Int. J. Pharm. 1994, 107, 211-217; Int. J.Pharm. 1995, 114, 111-115; Thorax, 1996, 51, 977-980). Действительно, частицы, имеющие аэродинамические диаметры более приблизительно 5 мкм,обычно не достигают легких, так как они имеют тенденцию ударяться о заднюю стенку глотки и быть проглоченными, и возможно абсорбироваться перорально, в то время как частиц менее 1,5 (2,0) мкм, т.е. от приблизительно 0,5 до приблизительно 2,0 мкм, способные достичь области альвеол, считались нежелательными, так как они могут абсорбироваться кровотоком и могут усиливать нежелательные системные действия лекарственных средств. Частицы, имеющие диаметры менее приблизительно 0,5 мкм,обычно расцениваются как терапевтически непригодные, так как они могут быть выдохнуты. Соответственно, pMDI препараты 2-агониста обычно представляли собой препараты, способные доставить частицы, основная фракция которых составляет 2-5 мкм, и количество частиц меньше 1 мкм очень ограничено, так как первые достаточно малы для того, чтобы достичь области легких от верхней до средней, но слишком велики, чтобы достичь альвеол. Это также размер, присущий частицам препарата в форме суспензий, так как обычная микронизация (воздушно-струйное измельчение) чистого лекарственного вещества может уменьшить размер частиц лекарственного средства до приблизительно 2-3 мкм. С другой стороны, известно, что плотность бета-адренергических рецепторов выше в дистальном тракте бронхиолей (Barnes P. et al. Am. Rev. Respir. Dis. 1983, 127, 758-762), в области, которую лучше достигают более мелкие частицы. Кроме того, воспаление при астме ограничено не только крупными центральными дыхательными путями, но также распространяется на небольшие периферические дыхательные пути. Эозинофильный воспалительный процесс, который, как представляется, связан с астмой,касается как бронхиальных, так и альвеолярных областей (Wang S. J. Immunol. 2001, 166, 2741-2749). Недавно, Martin R. в J. Allergy Clin. Immunol 2002, 109 (Suppl. 2), 447-460 сообщил, что дистальные легочные заболевания вероятно увеличивают риск повторяющегося обострения астмы, в то время как связанные с заболеванием анатомические изменения в мелких дыхательных путях дистального легкого являются главными в фатальной астме. В связи с этим, по его мнению, может быть предпочтительным введение лекарственного средства с частицами диаметром приблизительно 1 мкм (упоминаемого как "экстрамелкие" аэрозоли). Клиническая значимость дистального заболевания легких делает эту область важной терапевтической мишенью, так что частицы, способные достичь и осаждаться в этой области, могут внести больший вклад в оказание помощи при этом заболевании. Также сообщалось, что среди частиц менее 0,5 мкм, частицы с диаметром менее или равным 0,3 мкм, предпочтительно между 5 и 300 нм, могут осаждаться в области альвеол легких посредством седиментации. Этот интервал частиц упоминался в литературе как "ультрамелкие" частицы.Amirav I et. al. в J. Nucl. Med. 2002, 43, 487-491 подчеркивают необходимость улучшения доставки аэрозоля путем нацеливания на узкие периферические дыхательные пути высокодисперсных аэрозолей при лечении воспалительных заболеваний дыхательных путей и, в частности, острого бронхиолита. Следовательно, частицы лекарственных аэрозолей, имеющие диаметр 0,1 мкм, могут быть особенно эффективны в случае обструкции дыхательных путей у пациентов-астматиков, когда патология связана с повышенной секрецией слизи, которая препятствует диффузии лекарственного средства, или у пациентов, подверженных легочным заболеваниям, таким как COPD. Действительно, интуитивно можно ожидать, что при уменьшении просвета дыхательных путей из-за слизи и постоянного сужения для перфузии будут требоваться более мелкодисперсные облака. Тем не менее до сих пор о субмикронных аэрозольных препаратах (включая HFA препараты) сообщалось только как о микроэмульсиях, содержащих поверхностно-активные агенты, такие как лецитин(WO 01/78689, WO 00/27363; Dickinson P. et al. J. Drug Target 2001, 9, 295-302). Можно ожидать, что благодаря присущим противовоспалительным свойствам 2-агонистов длительного действия соответствующие препараты, способные доставлять значительную фракцию мелких частиц, будут обладать большим преимуществом для пациентов, пораженных бронхолегочными обструктивными заболеваниями. 2(1 Н)-Хинолиноновые производные 2-агониста были описаны как эффективные соединения длительного действия (ЕР 147719; WO 00/75114). В частности, сообщалось о 8-гидрокси-5[(1R)-1-гидрокси-2-(1R)-2-(4-метоксифенил)-1-метилэтил] амино]этил]-2(1 Н)-хинолиноне как очень сильном 2-агонисте, также характеризующимся быстрым началом действия, который в силу его необычно длительного действия можно вводить один раз в сутки. Его солянокислая соль известна под экспериментальным шифром ТА 2005. Известны препараты 2-агонистов в виде HFA раствора для аэрозольной доставки посредством дозированных ингаляторов под давлением. В WO 94/13262 от имени Boehringer Ingelheim предложены препараты аэрозольных растворов, содержащие лекарство, HFC пропеллент, сорастворитель и неорганическую или органическую кислоту в качестве стабилизатора для предупреждения химического разрушения активного ингредиента. Большинство примеров относятся к ипратропия бромиду, антихолинергическому лекарственному средству. Что касается 2-агонистов, в примере приведены только препараты, содержащие фенотерол, производное короткого действия, химически не родственное формотеролу. Кроме того, не считая ипратропия бромида, в WO 94/13262 не приведено никакого указания относительно количества кислоты, которое следует добавлять для стабилизации лекарств, не подвергая риску стабильности всей композиции в сосуде. Единственный намек можно найти на стр. 5, строки 15-16, где говорится, что некоторое количество неорганической кислоты должно быть добавлено для получения значения рН от 1 до 7, такого очень широкого и общего интервала. Что касается содержания воды, в заявке утверждается, что в системе пропеллент/сорастворитель также может присутствовать небольшое количество воды (до приблизительно 5% по массе). В случае ипратропия бромида сообщается, что добавление 1% воды уменьшает расщепление из-за дегидратации. В WO 98/34596 описаны препараты растворов, содержащие пропеллент и физиологически приемлемый полимер, который мог бы способствовать солюбилизации, а также стабильности активных ингредиентов. В WO 98/56349 автором описаны препараты растворов для применения в аэрозольном ингаляторе,содержащие активное вещество, пропеллент, содержащий гидрофторалкан (HFA), сорастворитель и,кроме того, содержащий низколетучий компонент для увеличения массового среднего аэродинамического диаметра (MMAD) частиц аэрозоля при приведении аэрозоля в действие. В некоторых случаях небольшое количество воды можно добавить к композиции для улучшения растворения активного вещества и/или низколетучего компонента в сорастворителе. В ЕР 1157689 автором описаны аэрозольные фармацевтические композиции, содержащие 2 агонист, принадлежащий к классу фенилалкиламинопроизводных, в растворе HFA пропеллента, сорастворитель, наблюдаемое рН которого доводят до значения между 2,5 и 5,0, чтобы гарантировать достаточный срок хранения. В конкретном воплощении данного изобретения в качестве низколетучего вещества, чтобы увеличить MMAD аэрозольных частиц и, кроме того, улучшить стабильность препарата, добавляют изопропилмиристат (IPM). Что касается роли воды, лишь сообщается, что влажность, в случае некоторых активных ингредиентов, может быть губительной для химической стабильности в процессе хранения. В ЕР 1157689 в общем виде утверждается, что препараты ТА 2005 будут предпочтительно пригодны для высвобождения 2-10 мкг/дозу, предпочтительно 3-5 мкг/дозу. В примере 7 описан 3,5 мкг/дозу HFA 134 а препарат, содержащий 12% мас./мас. этанола и 1,0% IPM для увеличения MMAD доставляемых частиц и для улучшения стабильности препарата. В свете приведенных выше рассуждений, особенно предпочтительно обеспечить высокоэффектив-3 008592 ные препараты 2(1 Н)-хинолиноновых производных 2-агонистов длительного действия для введения при помощи pMDI, характеризуемые глубоким проникновением в легкие и низким системным воздействием. Описание изобретения Цель настоящего изобретения заключается в том, чтобы предложить фармацевтический препарат в виде аэрозольного раствора для введения при помощи pMDI, имеющий подходящий для фармацевтического применения срок хранения, содержащий активный ингредиент, выбранный из 2(1 Н)хинолиноновых производных 2-агонистов длительного действия формулы (I) где R1 представляет собой метил иR2 представляет собой водород илиR1 и R2 образуют метиленовый мостик (СН 2)n,n равно 1 или 2,R3, R4, R5 и R6, каждый независимо, представляет собой водород, гидрокси, С 1-С 4 алкил с прямой или разветвленной цепью, С 1-С 4 алкил с прямой или разветвленной цепью, замещенный одним или более чем одним галогеном и/или гидрокси, галоген, С 1-С 4 алкокси с прямой или разветвленной цепью, его энантиомеры, соли и сольваты, HFA пропеллент и подходящее количество сорастворителя, где активный ингредиент полностью растворен в системе пропеллент-сорастворитель. Указанный раствор обеспечивает при приведении в действие фракцию частиц, равную или менее 1,1 мкм, в количестве по меньшей мере 30%, как определено на стадиях определения содержания S6-AF каскадного импактора Андерсена, относительно общего количества дозы мелкодисперсных частиц, собранных на стадиях S3-AF этого импактора. Препарат по изобретению может доставлять значительную фракцию частиц, имеющих диаметр равный или менее 1,1 мкм, содержащий как экстрамелкие частицы, в соответствии с описанием Martin R. в J. Allergy Clin. Immunol. 2002, 109 (Suppl. 2), 447-460, так и частицы, имеющие диаметр, равный или менее 0,3 мкм (ультрамелкие частицы в соответствии с определением других авторов). На основании этих характеристик препарат по изобретению будет далее в описании упоминаться как высокодисперсный препарат. В качестве отдельного аспекта настоящего изобретения авторы предлагают фармацевтический аэрозольный препарат, содержащий 0,005-0,016% мас./об. 8-гидрокси-5-[(1R)-1-гидрокси-2-(1R)-2-(4 метоксифенил)-1-метилэтил]амино]этил]-2(1 Н)-хинолинон или одну из его фармацевтически приемлемых солей или сольватов в качестве активного ингредиента в растворе сжиженного HFA пропеллента и сорастворителя, предпочтительно выбранного из фармацевтически приемлемого спирта, отличающийся тем, что фракция частиц, равных или менее 1,1 мкм, выше или равна 30%, как определено по содержанию на стадиях S6-AF каскадного импактора Андерсена относительно общего количества мелкодисперсных частиц, собранных на стадиях S3-AF импактора. Предпочтительным активным ингредиентом является 8-гидрокси-5-[(1R)-1-гидрокси-2-(1R)-2-(4-метоксифенил)-1-метилэтил]амино]этил]-2(1 Н)хинолинона гидрохлорид, далее обозначаемый ТА 2005. В некоторые препараты можно добавлять подходящее количество воды до 5% мас./мас. от общей массы препарата. Преимущественно рН препарата составляет от 2,5 до 5,0 при определении в модельной системе носителей, описанной в ЕР 1157689. Препараты по изобретению также могут содержать дополнительный активный ингредиент. В частности, добавление кортикостероида к 2-агонисту длительного действия ведет к оптимальному контролю над астмой у большинства пациентов, и соответствующие установленные композиции все в большей степени применяют в качестве подходящего регулятора для пациентов с персистирующей астмой. Также сообщалось, что каждый класс лекарственных средств усиливает благоприятные действия другого класса. Действительно, кортикостероиды увеличивают экспрессию 2-рецепторов и защищают их от понижающей регуляции в ответ на воздействие 2-агониста длительного действия, в то время как 2-агонист может усиливать противовоспалительные действия кортикостероидов (Barnes P. et al., Eur. Respir. J. 2002,19, 182-191). Соответственно, еще одна цель настоящего изобретения заключается в том, чтобы предложить высокоэффективные препараты, содержащие 2(1 Н)-хинолиноновое производное 2-агониста в качестве активного ингредиента, дополнительно содержащие стероид. Большая фракция высокодисперсных частиц препарата по изобретению может позволить обоим лекарственным средствам достичь области мелких периферических дыхательных путей таким образом, чтобы лучше осуществить их синергические дейст-4 008592 вия при дистальных заболеваниях легких. Кроме того, принимая во внимание указанные выше характеристики, может быть возможным разработать препараты, содержащие установленные комбинации 2 агониста и стероида, в которых последний может присутствовать в более низкой дозировке, сохраняя такое же лечебное действие. Еще один аспект данного изобретения заключается в том, чтобы предложить высокоэффективные препараты 2(1 Н)-хинолиноновых производных 2-агонистов в комбинации с антихолинергическим атропинподобным производным, таким как ипратропия бромид, окситропия бромид и тиотропия бромид, с целью получения лекарства, особенно эффективного для лечения COPD. Также предложен способ заполнения аэрозольного ингалятора композицией по изобретению, при котором:(а) готовят раствор одного или более чем одного активного ингредиента в одном или более чем одном сорастворителе;(б) возможно добавляют предварительно определенное количество воды и/или доводят рН раствора;(в) заполняют данное устройство указанным раствором;(д) добавляют пропеллент, содержащий гидрофторалкан (HFA). В еще одном аспекте изобретения предложено применение 2-агониста, полностью растворенного в системе пропеллент/сорастворитель и способного обеспечить при приведении в действие ингалятора фракцию по меньшей мере 30% испускаемых частиц с аэродинамическим диаметром, равным или менее 1,1 мкм, для изготовления лекарства для лечения респираторных нарушений, таких как астма и COPD. Принимая во внимание такой его технический признак, как получение при приведении в действие фракции частиц с аэродинамическим диаметром менее 1,1 мкм, в количестве по меньшей мере 30%, препарат по изобретению может быть особенно эффективным для лечения астмы, COPD, и, в общем случае,состояний обструкции дыхательных путей, при которых патология связана с гиперсекрецией слизи, которая препятствует диффузии лекарственного средства. Кроме того, он может быть клинически полезен в качестве лечения для ускорения рассасывания отека альвеол и заболеваний, связанных с недостатком поверхностно-активных веществ, таких как острое повреждение легких (ALI) и острый респираторный дистресс-синдром (ARDS). Подробное описание изобретения Аэрозольные препараты по изобретению содержат 2(1 Н)-хинолиноновое производное 2-агониста длительного действия формулы (I) в качестве активного ингредиента, HFA пропеллент и сорастворитель,где активный ингредиент полностью растворен таким образом, что препараты способны обеспечить при приведении в действие фракцию испускаемых частиц, равных или менее 1,1 мкм, больше или равную 30%, как определено на стадиях определения содержания S6-AF каскадного импактора Андерсена, относительно общей дозы мелкодисперсных частиц, собранных на стадиях S3-AF импактора, преимущественно более 40%, предпочтительно более 50%, более предпочтительно более 60%, еще более предпочтительно более 70%. Преимущественно препараты по изобретению не содержат других эксципиентов, таких как поверхностно-активные вещества, кроме агентов солюбилизации, пропеллента и, возможно, воды. Препараты могут содержать до 5% мас./об. активного ингредиента, например от 0,0001 до 5%, от 0,0005 до 3%, от 0,001 до 1%, от 0,001 до 0,005% мас./об. Примеры HFA пропеллентов включают в себя 1,1,1,2-тетрафторэтан (HFA134a) и 1,1,1,2,3,3,3 гептафтор-н-пропан (HFA227) и их смеси. Предпочтительным пропеллентом является 1,1,1,2-тетрафторэтан (HFA134a). Альтернативным интересующим пропеллентом является 1,1,1,2,3,3,3-гептафтор-нпропан (HFA227). Сорастворитель выбран из группы низших алкильных (С 1-С 4)спиртов, полиолов, полиалкиленгликолей и их комбинаций. Другие подходящие сорастворители представляют собой (поли)алкокси производные, включая полиалкоксиспирты, [такие как 2-(2-этоксиэтокси)этанол, имеющийся в продаже под товарным знаком Transcutol]. Предпочтительно сорастворитель представляет собой спирт. Предпочтительным спиртом является этанол. Концентрация сорастворителя (например, этанола) будет меняться в зависимости от конечной концентрации активных ингредиентов в препарате и от пропеллента. Количество этанола не должно превышать приблизительно 40% мас./мас. от общей массы препарата. Преимущественно оно составляет от 5 до 30% мас./мас., предпочтительно от 10 до 20% мас./мас., еще более предпочтительно от 12 до 15% мас./мас. Активными ингредиентами, которые можно использовать в аэрозольных композициях по изобретению, являются 2(1 Н)-хинолиноновые производные 2-адренергических агонистов длительного действия формулы (I), их стереоизомеры, физиологически приемлемые соли и сольваты. Предпочтительный активный ингредиент представляет собой 8-гидрокси-5-[(1R)-1-гидрокси-2-(1R)2-(4-метоксифенил)-1-метилэтил]амино]этил]-2(1 Н)-хинолинон в форме солянокислой соли (ТА 2005).-5 008592 Указанные активные ингредиенты можно применять сами по себе или в комбинации со стероидами,такими как беклометазона дипропионат (BDP), флунизолид, мометазона фуроат, флутиказона пропионат,циклесонид, будесонид и его 22R-эпимер, с антихолинергическими атропинподобными производными,таким как ипратропия бромид, окситропия бромид и тиотропия бромид, или с лекарственными средствами, пригодными для оказания помощи при респираторных заболеваниях, такими как метил ксантины,антилейкотриены и ингибиторы фосфодиэстераз. Концентрация активного ингредиента в HFA препарате будет зависеть от терапевтического количества, которое предпочтительно следует выпустить за одно или два приведения в действие. Вышеприведенные препараты предложены для ТА 2005, и концентрации лекарственного средства приведены в мас./об. Соответствующие проценты в виде (мас./мас.) можно рассчитать, определяя плотность основы. Препарат по изобретению заполняют в контейнер, снабженный подходящим мерным клапаном. Авторы предпочитают, чтобы данный препарат приводили в действие при помощи мерного клапана, способного выпускать объем от 25 до 100 мкл, например 50 или 63 мкл. Также возможно 100 мкл. Концентрация ТА 2005 будет меняться от 0,0005 до 0,024% мас./об., для подачи 0,5-6 мкг при однократном приведении в действие, предпочтительно между 0,001 и 0,016% мас./об., чтобы обеспечить 1-4 мкг при однократном приведении в действие, более предпочтительно между 0,001 и 0,008% мас./об.,чтобы обеспечить 1 или 2 мкг при однократном приведении в действие. Если требуется, можно обеспечить избыток лекарственного средства. Например для 1 и 2 мкг/дозу, когда используют 63 мкл отмеряемого объема, конечная концентрация ТА 2005 гидрохлорида, выпускаемая при приведении в действие,будет составлять 0,0016 и 0,0032% мас./об. соответственно. Планируемый режим приема ТА 2005 составляет два или один раз в сутки, предпочтительно один раз в сутки, при этом подходящая суточная доза может меняться до 8 мкг, и предпочтительно находится в диапазоне от 0,5 до 6 мкг, предпочтительно от 1 до 6 мкг, более предпочтительно от 2 до 4 мкг. Подходящий рН интервал составляет преимущественно от 2,5 до 5,0, предпочтительно от 2,8 до 4,0. Для доведения наблюдаемого рН можно использовать сильные минеральные кислоты, предпочтительно выбранные из группы соляной, азотной, фосфорной кислоты, предпочтительно соляную кислоту. Количество кислоты, которую нужно добавить для достижения желательного наблюдаемого рН,предварительно определяют на модельной основе, о которой сообщалось в ЕР 1157689, и оно будет зависеть от типа и концентрации активного ингредиента и количества сорастворителя. Для 0,001-0,008% мас./об. ТА 2005 в HFA 134 а и 15% мас./мас. этанола предпочтительно добавляют 0,1 М соляную кислоту в концентрации между 0,01 и 0,05%, предпочтительно между 0,01 и 0,03% на общую массу препарата. Присутствие воды может быть особенно предпочтительным, когда препарат дополнительно содержит другой активный ингредиент, такой как стероид. В этих случаях может присутствовать количество воды до 5,0% мас./мас. на общую массу препарата, предпочтительно от 0,05 до 3% мас./мас., еще более предпочтительно от 1 до 2% мас./мас. Препаратами по изобретению заполняют контейнеры, подходящие для высвобождения фармацевтических аэрозольных препаратов, такие как пластиковая или покрытая пластиком стеклянная бутылка или предпочтительно металлический сосуд, например алюминиевый сосуд. Препаратами также можно наполнить контейнеры, часть или все внутренние поверхности которых выполнены из анодированного алюминия, нержавеющей стали или облицованы инертным органическим покрытием. Примерами предпочтительных покрытий являются эпоксифенольные смолы, перфторированные полимеры, такие как перфторалкоксиалкан, перфторалкоксиалкилен, перфторалкилены, такие как политетрафторэтилен (Teflon, тефлон), фторированный этилен-пропилен, полиэфирсульфон и сополимер фторированного этиленпропилена с полиэфирсульфоном. Другими подходящими покрытиями могут быть полиамид, полиимид,полиамидимид, полифениленсульфид или их комбинации. Для ТА 2005 препаратов могут быть предпочтительными контейнеры с внутренней поверхностью,облицованной тефлоном. Для дополнительного улучшения стабильности можно использовать банки, имеющие ободок с закругленными краями, предпочтительно закругленную горловину или вкатанный ободок, частично или полностью завернутый ободок можно применять в соотвествии с WO 02/72448. Контейнер закрывают мерным клапаном. Мерные клапаны проектируют для выпускания при приведении в действие отмеренногоколичества препарата, и они включают в себя прокладку для предотвращения протекания пропеллента через клапан. Прокладка может включать в себя любой подходящий эластомерный материал, такой как, например, полиэтилен низкой плотности, хлорбутил, черная и белая бутандиенакрилнитриловая резина, бутиловая резина, неопрен, EPDM (полимер этиленпропилендиеновых мономеров) и ТРЕ (термопластичный эластомер). Предпочтительными являются EPDM и ТРЕ резины. Особенно предпочтительными являютсяEPDM резины. Подходящие клапаны имеются в продаже у изготовителей, известных в аэрозольной промышленности, например, у Valois, France (например, DF10, DF30, DF60), Bespak plc, UK (Великобритания) (например, ВK300, ВK356, ВK357) и 3 М-Neotechnic Ltd., UK (например, Spraymiser). Также подхо-6 008592 дит DF31 клапан Valois, France. Уплотнители клапана, особенно уплотнитель прокладки, а также уплотнители вокруг мерной камеры предпочтительно выполняют из материала, который инертен и противостоит экстракции в содержимое препарата, особенно когда содержимое включает в себя этанол. Материалы клапана, особенно материал мерной камеры, предпочтительно изготавливают из вещества, которое инертно и противостоит деформации содержимым препарата, особенно, когда содержимое включает в себя этанол. Конкретные подходящие материалы для применения для изготовления мерного клапана включают в себя сложные полиэфиры, например полибутилентерфталат (РВТ) и ацетали, особенно РВТ. Материалы для изготовления мерной камеры и/или стержня клапана могут быть фторированными,частично фторированными или импрегнированными фторсодержащими веществами, для предотвращения осаждения лекарственного средства. Для получения в большом масштабе партий для изготовления на продажу заполненных канистр можно использовать традиционные поточные способы и механизмы, хорошо известные специалистам в области изготовления фармацевтических аэрозолей. Так, например, при одном поточном способе изготовления, мерный клапан обжимают на алюминиевом сосуде с образованием пустого контейнера. Лекарство добавляют в заполняемый сосуд, и смесь этанола, возможно воды, и сжиженного пропеллента заполняют под давлением через сосуд для загрузки в изготавливаемый сосуд. Аликвоту препарата затем вносят через мерный клапан в контейнер. В альтернативном способе аликвоту сжиженного препарата добавляют в открытый контейнер в условиях, которые являются достаточно холодными для того, чтобы препарат не испарялся, и затем мерный клапан обжимают на сосуде. В альтернативном способе аликвоту лекарства, растворенного в солюбилизирующем агенте, перекачивают в пустой контейнер, мерный клапан обжимают, и затем через клапан контейнер заполняют пропеллентом. Эти процессы можно осуществлять в инертной атмосфере, например путем нагнетания азота, для того чтобы избежать захвата влаги из воздуха. Каждый заполненный контейнер удобным образом устанавливают в подходящее каналообразующее устройство перед тем, как использовать для изготовления дозированного ингалятора для введения лекарства в легкие пациента. Подходящие каналообразующие устройства включают в себя, например клапанный исполнительный механизм и цилиндрический или конусообразный канал, через который лекарство можно выпускать из заполненного контейнера через мерный клапан в рот пациента, например мундштучный исполнительный механизм. При обычном устройстве стержень клапана находится в сопловом аппарате, который имеет отверстие, ведущее к камере расширения. Камера расширения имеет выходное отверстие, которое продолжается в мундштук. Обычно пригодны диаметры отверстия исполнительно механизма (выхода) в интервале 0,15-0,45 мм, особенно 0,2-0,45 мм, например 0,25, 0,30, 0,33 или 0,42 мм. Также пригоден диаметр 0,22 мм. Для некоторых препаратов полезно использовать просверленные лазером отверстия исполнительного механизма, имеющие диаметр в интервале от 0,10 до 0,22 мм, в частности от 0,12 до 0,18 мм, подобно описанным в одновременно рассматриваемой заявкеЕР 1130521.6. Применение таких мелких отверстий также увеличивает длительность образования облака и уменьшает его скорость. Эти изменения облегчают координирование образования облака с его медленным вдыханием пациентом. Распределение по аэродинамическому размеру частиц каждого исследуемого препарата по изобретению можно охарактеризовать, используя многостадийный каскадный импактор (Multistage CascadeV.5.9.1, стр. 15-17. В данном конкретном случае использовали каскадный импактор Андерсена (ACI),работающий со скоростью потока 28,3 л/мин. Осаждение лекарственного средства на каждой ACI подложке определяли при помощи высокоэффективной жидкостной хроматографии (HPLC). Среднюю выпускаемую дозу рассчитывали из суммарного осаждения в ACI. Среднюю вдыхаемую дозу (дозу мелких частиц) получали из осаждения от Стадии 3 (S3) до фильтра (AF), она соответствовала количеству частиц 4,7 мкм, разделенному на количество приведений в действие на эксперимент, в то время как среднюю "высокодисперсную" дозу получали из осаждения от стадии 6 до фильтра, что соответствовало частицам 1,1 мкм. Введение препаратов по изобретению может быть показано для лечения легких, умеренных или серьезных, острых или хронических симптомов или для профилактического лечения респираторных заболеваний, таких как астма и хроническое обструктивное заболевание легких (COPD). Также препараты этого типа могут быть полезны в случае других респираторных нарушений, характеризуемых обструкцией периферических дыхательных путей в результате воспаления и наличия слизи, таких как хронический обструктивный бронхиолит и хронический бронхит. Данное изобретение проиллюстрировано следующими примерами. Пример 1. Высокодисперсные ТА 2005 HFA препараты. Препарат для высвобождения номинальной дозы 1 мкг активного ингредиента при однократном приведении в действие готовили со следующей композицией: эквивалентно 2,0 мкл Препарат (120 срабатываний/контейнер, среднее из 40 срабатываний) заполняли в стандартные алюминиевые контейнеры с внутренней поверхностью, покрытой тефлоном (двухстадийное заполнение под давлением) и снабжали мерным клапаном, имеющим 63 мкл мерную камеру. Использовали исполнительный механизм с диаметром отверстия 0,22 мм. Результаты получали как среднее из 2 сосудов. Аналогично можно получить препарат, способный высвобождать номинальную дозу 2, 3 или 4 мкг активного ингредиента при однократном приведении в действие. Распределение по аэродинамическому размеру частиц определяли при помощи ACI, в соответствии с описанием на стр. 16, строки 10-18, и характеристики высвобождения каждого препарата определяли по следующим параметрам: (1) номинальная доза: теоретическая доза на однократное приведение в действие; (2) высвобождаемая доза: количество активных частиц, осаждаемое на всех ACI стадиях; (3) вдыхаемая доза (доза мелкодисперсных частиц): количество активных частиц размером менее 4,7 мкм (S3-AF); (4) вдыхаемая фракция (фракция мелких частиц): соотношение между вдыхаемой дозой и высвобождаемой дозой; (5) "высокодисперная" доза: количество активных частиц, равных или менее 1,1 мкм (S6-AF); (6) "высокодисперсная" фракция: отношение между "высокодисперсной" дозой и вдыхаемой дозой. Препарат по данному изобретению дает начало при приведении в действие очень большому количеству частиц с диаметром менее 1,1 мкм. Для некоторых препаратов, в зависимости от процента активного ингредиента и количества сорастворителя, можно достичь более 80% высокодисперсных фракций. Несмотря на наличие такой большой фракции частиц, имеющих диаметр, равный или менее 1,1 мкм, в препарате, в терапевтических дозах лекарственное средство переносилось хорошо. Изучение стабильности препарата, способного высвобождать 4 мкг при приведении в действие начинали, помещая сосуды на хранение вертикально при 5 С. Через 9 месяцев количество ТА 2005 составляет более 95% и, следовательно, отвечает требованиямICH (Международной конференции по гармонизации) руководства Q1A, под названием "Испытание стабильности новых активных веществ (и медицинских продуктов)". Пример 2. Высокодисперсный HFA препарат, содержащий ТА 2005 и 22R-будесонид. Препарат для высвобождения, соответственно, номинальной дозы 1 мкг ТА 2005 и 80 мкг 22Rбудесонида при приведении в действие получали со следующим составом: эквивалентно 3,3 мкл Препарат (120 срабатываний/контейнер, среднее из 30 срабатываний) заполняли в стандартные алюминиевые контейнеры с внутренней поверхностью, покрытой тефлоном (двухстадийное заполнение под давлением), и снабжали мерным клапаном, имеющим 63 мкл мерную камеру.-8 008592 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтический аэрозольный препарат для введения при помощи дозированного ингалятора под давлением, содержащий в качестве активного ингредиента 2-агонист длительного действия, выбранный из 2(1 Н)-хинолинонового производного формулы где R1 представляет собой метил иR2 представляет собой водород илиR1 и R2 образуют метиленовый мостик (CH2)n,n равно 1 или 2,R3, R4, R5 и R6, каждый независимо, представляет собой водород, гидрокси, С 1-С 4 алкил с прямой или разветвленной цепью, С 1-С 4 алкил с прямой или разветвленной цепью, замещенный одним или более чем одним галогеном и/или гидрокси, галоген, С 1-С 4 алкокси с прямой или разветвленной цепью, его стереоизомер, физиологически приемлемые соль и сольват в растворе, состоящем из сжиженного гидрофторалканового (HFA) пропеллента, сорастворителя и возможно количества воды до 5% на общую массу препарата. 2. Фармацевтический препарат по п.1, где фракция частиц, размер которых равен или менее 1,1 мкм, высвобождаемая при приведении в действие ингалятора, более или равна 30%, как определено по содержанию на стадиях S6-AF каскадного импактора Андерсена относительно содержания на стадияхS3-AF. 3. Фармацевтический препарат по пп.1-2, где фракция частиц, размер которых равен или менее 1,1 мкм, высвобождаемая при приведении в действие ингалятора, составляет более 40%. 4. Фармацевтический препарат по пп.1-3, где активный ингредиент представляет собой 8-гидрокси 5-[(1R)-1-гидрокси-2-(1R)-2-(4-метоксифенил)-1-метилэтил]амино]этил]-2(1 Н)-хинолинон, его физиологически приемлемые соль или сольват. 5. Фармацевтический препарат по пп.1-3, где активный ингредиент представляет собой 8-гидрокси 5-[(1R)-1-гидрокси-2-(1R)-2-(4-метоксифенил)-1-метилэтил]амино]этил]-2(1 Н)-хинолинона гидрохлорид. 6. Фармацевтический препарат по п.5, где активный ингредиент находится в концентрации между 0,0005 и 0,024% мас./об. 7. Фармацевтический препарат по п.5, где активный ингредиент находится в концентрации между 0,001 и 0,008% мас./об. 8. Фармацевтический препарат по любому из пп.1-7, где наблюдаемое рН составляет от 2,5 до 5,0. 9. Фармацевтический препарат по любому из пп.1-8, где наблюдаемое рН составляет от 2,8 до 4,0. 10. Фармацевтический препарат по пп.8 и 9, где рН доведен путем добавления минеральной кислоты. 11. Фармацевтический препарат по п.10, где минеральная кислота выбрана из группы, состоящей из соляной, азотной и фосфорной кислот. 12. Фармацевтический препарат по любому из пп.1-11, где пропеллент включает в себя один или более чем один гидрофторалкан [HFA], выбранный из группы, содержащей HFA 134 а и HFA 227. 13. Фармацевтический препарат по любому из пп.1-12, где сорастворитель выбран из группы низших алкиловых (С 1-С 4)спиртов, полиолов, полиалкиленгликолей, (поли)алкоксипроизводных и их комбинаций. 14. Фармацевтический препарат по п.13, где сорастворитель представляет собой этанол. 15. Фармацевтический препарат по п.14, где этанол составляет от 5 до 30 мас.%. 16. Фармацевтический препарат по п.15, где этанол составляет от 10 до 20 мас.%. 17. Фармацевтический препарат по любому из пп.1-16, дополнительно содержащий дополнительный активный ингредиент, выбранный из класса стероидов, таких как беклометазона дипропионат, флунизолид, мометазона фуроат, флутиказона пропионат, циклесонид, будесонид и его 22R-эпимер, или антихолинергических атропинподобных производных, таких как ипратропия бромид, окситропия бромид и тиотропия бромид, или ингибитора фосфодиэстеразы. 18. Дозированный ингалятор под давлением, включающий контейнер, часть или все внутренние ме-9 008592 таллические поверхности которого облицованы инертным органическим покрытием, где указанный контейнер заполнен фармацевтическим препаратом по любому из пп.1-17. 19. Ингалятор по п.18, где контейнер облицован инертным органическим покрытием, выбранным из эпоксифенольных смол, перфторалкоксиалкана, перфторалкоксиалкилена, перфторалкиленов, таких как политетрафторэтилен, фторированный этилен-пропилен, полиэфирсульфон и сополимер фторированного этилена-пропилена-полиэфирсульфона. 20. Ингалятор по п.19, где инертное органическое покрытие представляет собой политетрафторэтилен (Тефлон). 21. Способ заполнения аэрозольного ингалятора препаратом по любому из пп.1-17, при котором:(а) готовят раствор одного или более чем одного активного ингредиента в одном или более чем одном сорастворителе;(б) возможно добавляют предварительно установленное количество воды и/или доводят рН раствора;(в) заполняют ингалятор указанным раствором;
МПК / Метки
МПК: A61P 11/06, A61K 31/485, A61K 31/46, A61K 31/56, A61K 9/12, A61K 9/00, A61K 31/4704
Метки: ингаляторы, бета-2-агонистов, содержащие, дозированные, растворы, давлением
Код ссылки
<a href="https://eas.patents.su/11-8592-dozirovannye-ingalyatory-pod-davleniem-soderzhashhie-rastvory-beta-2-agonistov.html" rel="bookmark" title="База патентов Евразийского Союза">Дозированные ингаляторы под давлением, содержащие растворы бета-2-агонистов</a>
Предыдущий патент: Производные 3-(3,5-диоксо-4,5-дигидро-3н-(1,2,4)триазин-2-ил)бензамида в качестве ингибиторов р2х7 для лечения воспалительных заболеваний
Следующий патент: “способ обработки катализаторов гидроочистки ортофталатом и способ сульфидирования с его использованием”
Случайный патент: Способ увеличения молекулярного веса полимера для гранулята












