Фармацевтические композиции, содержащие бета-лапахон или его производные или аналоги, и способы их применения
Формула / Реферат
1. Фармацевтическая композиция, включающая терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель.
2. Фармацевтическая композиция по п.1, которая включает комплекс или раствор терапевтически эффективного количества b -лапахона или его производного или аналога и фармацевтически приемлемого водорастворимого носителя.
3. Фармацевтическая композиция по п.1 или 2, которая представляет собой водный раствор.
4. Фармацевтическая композиция по п.1, в которой фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
5. Фармацевтическая композиция по п.4, в которой водорастворимый носитель представляет собой b -циклодекстрин.
6. Фармацевтическая композиция по п.5, в которой b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
7. Фармацевтическая композиция по п.3, в которой концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
8. Фармацевтическая композиция по п.1, в которой терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель представлены в виде эмульсии.
9. Фармацевтическая композиция, включающая терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, которая при разведении водным раствором для парентерального введения остается, по существу, растворимой в водном растворе.
10. Фармацевтическая композиция по п.9, в которой терапевтически эффективное количество b -лапахона или его производного или аналога находится в комплексе с фармацевтически приемлемым водорастворимым носителем.
11. Фармацевтическая композиция по п.9, в которой фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
12. Фармацевтическая композиция по п.11, в которой водорастворимый носитель представляет собой b -циклодекстрин.
13. Фармацевтическая композиция по п.12, в которой b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
14. Фармацевтическая композиция по п.9, в которой концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
15. Фармацевтическая композиция по п.10, в которой комплекс включает лекарственную форму в диапазоне доз от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
16. Фармацевтическая композиция по п.9, в которой терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель представлены в виде эмульсии.
17. Препаративная форма b -лапахона или его производного или аналога и фармацевтически приемлемого водорастворимого носителя, причем препаративная форма может быть лиофилизированной и при последующем растворении в водном растворе является, по существу, растворимой.
18. Препаративная форма по п.17, в которой b -лапахон или его производное или аналог находится в комплексе с фармацевтически приемлемым водорастворимым носителем.
19. Препаративная форма по п.17, в которой фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофора/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
20. Препаративная форма по п.19, в которой водорастворимый носитель представляет собой b -циклодекстрин.
21. Препаративная форма по п.20, в которой b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
22. Препаративная форма по п.17, в которой концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
23. Препаративная форма по п.17, в которой b -лапахон или его производное или аналог и фармацевтически приемлемый водорастворимый носитель существуют в виде эмульсии.
24. Набор для лечения рака у млекопитающего, включающий по меньшей мере один флакон, содержащий b -лапахон или его производное или аналог, в соответствии с любым из пп.1, 9 или 17.
25. Фармацевтическая композиция, включающая терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включающая второе противораковое средство и фармацевтически приемлемый носитель.
26. Фармацевтическая композиция по п.25, включающая комплекс или раствор терапевтически эффективного количества b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включает второе противораковое средство и фармацевтически приемлемый носитель.
27. Фармацевтическая композиция по п.25 или 26, в которой второе противораковое средство представляет собой производное таксана.
28. Фармацевтическая композиция по п.27, в которой производное таксана представляет собой паклитаксел.
29. Фармацевтическая композиция по п.25 или 26, которая представляет собой водный раствор или масляный раствор.
30. Фармацевтическая композиция по п.25, в которой терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый солюбилизирующий в воде носитель смешивают со вторым противораковым средством и фармацевтически приемлемым носителем и помещают в один флакон.
31. Фармацевтическая композиция по п.25, в которой терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе.
32. Фармацевтическая композиция по п.25, в которой фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофора/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
33. Фармацевтическая композиция по п.32, в которой водорастворимый носитель представляет собой b -циклодекстрин.
34. Фармацевтическая композиция по п.33, в которой b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
35. Фармацевтическая композиция по п.29, в которой концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
36. Фармацевтическая композиция по п.25, в которой терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и второе противораковое средство и фармацевтически приемлемый носитель существуют в виде эмульсии.
37. Набор для лечения опухоли у млекопитающего, включающий один или более флаконов, содержащих терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включающий в том же флаконе или в отдельном флаконе второе противораковое средство.
38. Набор по п.37, в котором один или более флаконов содержат комплекс терапевтически эффективного количества b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включающий в том же флаконе или в отдельном флаконе второе противораковое средство.
39. Набор по п.37 или 38, в котором вторым противораковым средством является производное таксана.
40. Набор по п.39, в котором производным таксана является паклитаксел.
41. Набор по п.37 или 38, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофора/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
42. Набор по п.41, в котором водорастворимый носитель представляет собой b -циклодекстрин.
43. Набор по п.42, в котором b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
44. Набор по п.37 или 38, в котором концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
45. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель.
46. Способ по п.45, в котором фармацевтическая композиция включает комплекс или раствор терапевтически эффективного количества b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель.
47. Способ по п.45 или 46. в котором композиция представляет собой водный раствор.
48. Способ по п.45, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
49. Способ по п.48, в котором водорастворимый носитель представляет собой b -циклодекстрин.
50. Способ по п.49, в котором b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
51. Способ по п.47, в котором концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
52. Способ по п.45, в котором фармацевтическую композицию вводят парентерально.
53. Способ по п.52, в котором фармацевтическая композиция включает дозу в диапазоне от 0,1 до 10 мг/кг, введенную от 2 раз/нед. до 1 раза каждые четыре недели.
54. Способ по п.45, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель существуют в виде эмульсии.
55. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, который при растворении в водном растворе для парентерального введения остается, по существу, растворимым в водном растворе.
56. Способ по п.55, в котором терапевтически эффективное количество b -лапахона или его производного или аналога образует комплексы с фармацевтически приемлемым водорастворимым носителем.
57. Способ по п.55, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
58. Способ по п.57, в котором водорастворимый носитель представляет собой b -циклодекстрин.
59. Способ по п.58, в котором b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
60. Способ по п.55, в котором концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
61. Способ по п.55, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель существуют в виде эмульсии.
62. Способ лечения рака, включающий введение пациенту препаративной формы b -лапахона или его производного или аналога и фармацевтически приемлемого водорастворимого носителя, причем комплекс может быть лиофилизирован и при последующем растворении в водном растворе является, по существу, растворимым.
63. Способ по п.62, в котором b -лапахон или его производное или аналог образует комплекс с фармацевтически приемлемым водорастворимым носителем.
64. Способ по п.62, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
65. Способ по п.64, в котором водорастворимый носитель представляет собой b -циклодекстрин.
66. Способ по п.65, в котором b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
67. Способ по п.62, в котором концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
68. Способ по п.62, в котором препаративную форму вводят парентерально.
69. Способ по п.68, в котором указанная фармацевтическая композиция включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, введенную от 2 раз/нед. до 1 раза каждые четыре недели.
70. Способ по п.62, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель находятся в виде эмульсии.
71. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, и, кроме того, включающий второе противораковое средство и фармацевтически приемлемый носитель.
72. Способ по п.71, в котором фармацевтическая композиция включает комплекс терапевтически эффективного количества b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включает второе противораковое средство и фармацевтически приемлемый носитель.
73. Способ по п.71 или 72, в котором второе противораковое средство представляет собой производное таксана.
74. Способ по п.73, в котором производное таксана представляет собой паклитаксел.
75. Способ по п.71 или 72, в котором композиция представляет собой водный раствор.
76. Способ по п.71, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель смешивают со вторым производным таксана и фармацевтически приемлемым носителем и помещают в один флакон.
77. Способ по п.71, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе, причем содержимое первого и второго флаконов вводят одновременно или последовательно.
78. Способ по п.71, в котором водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
79. Способ по п.78, в котором водорастворимый носитель представляет собой b -циклодекстрин.
80. Способ по п.79, в котором b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
81. Способ по п.75, в котором концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
82. Способ по п.71, в котором фармацевтическую композицию вводят парентерально.
83. Способ по п.71, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и противораковое средство и фармацевтически приемлемый носитель находятся в виде эмульсии.
84. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, которая при разведении водным раствором для парентерального введения остается, по существу, растворимой в водном растворе, и, кроме того, включающую второе противораковое средство и фармацевтически приемлемый носитель.
85. Способ по п.84, в котором терапевтически эффективное количество b -лапахона или его производного или аналога в фармацевтической композиции образует комплекс с фармацевтически приемлемым водорастворимым носителем, которая при растворении водным раствором для парентерального введения остается, по существу, растворимой в водном растворе.
86. Способ по п.84, в котором второе противораковое средство представляет собой производное таксана.
87. Способ по п.86, в котором производное таксана представляет собой паклитаксел.
88. Способ по п.84, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель смешивают со вторым противораковым средством и фармацевтически приемлемым носителем и помещают в один флакон.
89. Способ по п.84, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе, причем содержимое первого и второго флаконов вводят одновременно или последовательно.
90. Способ по п.84, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
91. Способ по п.90, в котором водорастворимый носитель представляет собой b -циклодекстрин.
92. Способ по п.91, в котором b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
93. Способ по п.84, в котором концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
94. Способ по п.84, в котором фармацевтическая композиция включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, введенную от 2 раз/нед. до 1 раза каждые четыре недели.
95. Способ по п.84, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и второе противораковое средство и фармацевтически приемлемый носитель находятся в виде эмульсии.
96. Способ лечения рака, включающий введение пациенту-композиции b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, причем композицию можно лиофилизировать, и она при последующем растворении в водном растворе является, по существу, растворимой, причем препаративная форма, кроме того, включает второе противораковое средство и фармацевтически приемлемый носитель.
97. Способ по п.96, в котором b -лапахон или его производное или аналог в препаративной форме образует комплекс с фармацевтически приемлемым водорастворимым носителем.
98. Способ по п.96, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель смешивают со вторым противораковым средством и фармацевтически приемлемым носителем и помещают в один флакон.
99. Способ по п.96, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе, причем содержимое первого и второго флаконов вводят одновременно или последовательно.
100. Способ по п.96, в котором фармацевтически приемлемый солюбилизирующий в воде носитель выбирают из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофора/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
101. Способ по п.100, в котором солюбилизирующий в воде носитель представляет собой b -циклодекстрин.
102. Способ по п.101, в котором b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
103. Способ яю п.96, в котором концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
104. Способ по п.96, в котором противораковое средство представляет собой производное таксана.
105. Способ по п.104, в котором производное таксана представляет собой паклитаксел.
106. Способ по п.96, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и второе противораковое средство и фармацевтически приемлемый носитель существуют в виде эмульсии.
107. Способ лечения рака, включающий сначала введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество b -лапахона или его производного или аналога и водорастворимый носитель, а затем воздействие на указанного пациента лучевой терапией.
108. Способ по п.107, в котором фармацевтически приемлемый водорастворимый носитель, выбранный из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
109. Способ по п.108, в котором водорастворимый носитель представляет собой b -циклодекстрин.
110. Способ по п.109, в котором b -циклодекстрин представляет собой гидроксипропил-b -циклодекстрин.
111. Способ по п.107, в котором концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
112. Способ по п.107, в котором фармацевтическая композиция включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
113. Способ по п.107, в котором терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель представлены в виде эмульсии.
114. Фармацевтическая композиция, включающая терапевтически эффективное количество b -лапахона или его производного или аналога, составленная с фармацевтически приемлемым для жировой эмульсии носителем для образования эмульсии, пригодной для парентерального введения.
115. Фармацевтическая композиция по п.114, в которой фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипидR.
116. Фармацевтическая композиция по п.114, в которой концентрация b -лапахона в эмульсии составляет по меньшей мере 1 мг/мл.
117. Фармацевтическая композиция по п.114, в которой эмульсия включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
118. Препаративная форма b -лапахона или его производного или аналога и фармацевтически приемлемого для жировой эмульсии носителя, причем препаративную форму можно лиофилизировать и при последующем растворении она является, по существу, растворимой.
119. Препаративная форма по п.118, в которой фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипидR.
120. Препаративная форма по п.118, в которой концентрация b -лапахона составляет по меньшей мере 1 мг/мл.
121. Фармацевтическая композиция, включающая терапевтически эффективное количество b -лапахона или его производного или аналога, составленная в композицию с фармацевтически приемлемым для жировой эмульсии носителем для образования эмульсии, пригодной для парентерального введения, и, кроме того, включающая второе противораковое средство и фармацевтически приемлемый носитель.
122. Фармацевтическая композиция по п.121, в которой фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипидR.
123. Фармацевтическая композиция по п.121, в которой второе противораковое средство представляет собой производное таксана.
124. Фармацевтическая композиция по п.123, в которой производное таксана представляет собой паклитаксел.
125. Фармацевтическая композиция по п.121, в которой концентрация b -лапахона в эмульсии составляет по меньшей мере 1 мг/мл.
126. Фармацевтическая композиция по п.121, в которой эмульсия включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
127. Фармацевтическая композиция по п.121, в которой эмульсия включает терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый для жировой эмульсии носитель со вторым противораковым средством и фармацевтически приемлемым носителем и содержатся в одном флаконе.
128. Фармацевтическая композиция по п.121, в которой эмульсия, включающая терапевтически эффективное количество b -лапахона или его производного или аналога, и фармацевтически приемлемый для жировой эмульсии носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе.
129. Набор для лечения рака у млекопитающего, включающий по меньшей мере один флакон, содержащий b -лапахон или его производное или аналог, в соответствии с любым из пп.114, 118 или 121.
130. Набор для лечения опухоли у млекопитающего, включающий один или более флаконов, содержащих эмульсию, включающую терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый для жировой эмульсии носитель, и, кроме того, включающий в том же флаконе или отдельном флаконе второе противораковое средство.
131. Набор по п.130, в котором фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипидR.
132. Набор по п.130, в котором второе противораковое средство представляет собой производное таксана.
133. Набор по п.132, в котором производное таксана представляет собой паклитаксел.
134. Набор по п.130, в котором концентрация b -лапахона в эмульсии составляет по меньшей мере 1 мг/мл.
135. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый для жировой эмульсии носитель для парентерального введения.
136. Способ по п.135, в котором фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипидR.
137. Способ по п.135, в котором концентрация b -лапахона в эмульсии составляет по меньшей мере 1 мг/мл.
138. Способ по п.135, в котором эмульсия включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
139. Способ лечения рака, включающий введение пациенту эмульсии, включающей терапевтически эффективное количество b -лапахона или его производного или аналога, включенного в композицию в фармацевтически приемлемом носителе в виде жировой эмульсии для парентерального введения, и, кроме того, включающей второе противораковое средство и фармацевтически приемлемый носитель.
140. Способ по п.139, в котором фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипидR.
141. Способ по п.139, в котором второе противораковое средство представляет собой производное таксана.
142. Способ по п.139, в котором производное таксана представляет собой паклитаксел.
143. Способ по п.139, в котором концентрация b -лапахона в эмульёшш составляет по меньшей мере 1 мг/мл.
144. Способ по п.139, в котором эмульсия включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
145. Способ лечения рака, включающий сначала введение пациенту эмульсии, включающей терапевтически эффективное количество b -лапахона или его производного или аналога, составленное с фармацевтически приемлемым для жировой эмульсии носителем, а затем воздействие на указанного пациента лучевой терапией.
146. Способ по п.145, в котором фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипидR.
147. Способ по п.145, в котором концентрация b -лапахона в эмульсии составляет по меньшей мере 1 мг/мл.
148. Способ по п.145, в котором эмульсия включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
149. Способ по любому из пп.45, 55, 62, 71, 84, 96, 107, 135, 139 или 145, в котором рак характеризуется наличием одной или более солидных опухолей.
150. Способ по любому из пп.45, 55, 62, 71, 84, 96, 107, 135, 139 или 145, в котором рак представляет собой рак предстательной железы.
151. Способ по любому из пп.45, 55, 62, 71, 84, 96, 107, 135, 139 или 145, в котором рак представляет собой множественную миелому.
152. Способ по любому из пп.45, 55, 62, 71, 84, 96, 107, 135, 139 или 145, в котором рак представляет собой гематологическую опухоль.
153. Способ по пп.45, 55, 62, 71, 84, 96, 107, 135, 139 или 145, в котором рак представляет собой лимфоидную опухоль.
154. Способ по любому из пп.45, 55, 62, 71, 84, 96, 107, 135, 139 или 145, в котором рак представляет собой рак яичников.
155. Способ по любому из пп.45, 55, 62, 71, 84, 96, 107, 135, 139 или 145, в котором рак представляет собой рак молочной железы.
156. Стерильная инъецируемая фармацевтическая композиция для внутривенного введения, включающая комплекс терапевтически эффективного количества b -лапахона или его производного или аналога и фармацевтически приемлемого водорастворимого носителя.
157. Стерильная инъецируемая фармацевтическая композиция по п.156, причем композиция находится в водном растворе.
158. Стерильная инъецируемая фармацевтическая композиция по п.156, в которой фармацевтически приемлемый водорастворимый носитель представляет собой гидроксипропил-b -циклодекстрин.
159. Стерильная инъецируемая фармацевтическая композиция по п.156, кроме того, включающая второе противораковое средство и фармацевтически приемлемый носитель.
160. Стерильная инъецируемая фармацевтическая композиция по п.159, в которой второе противораковое средство представляет собой производное таксана.
161. Стерильная инъецируемая фармацевтическая композиция по п.160, в которой производное таксана представляет собой паклитаксел.
162. Стерильная инъецируемая фармацевтическая композиция по п.156, в которой концентрация b -лапахона в растворе составляет по меньшей мере 1 мг/мл.
163. Стерильная инъецируемая фармацевтическая композиция по п.156, причем указанная фармацевтическая композиция включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
164. Стерильная инъецируемая фармацевтическая композиция по п.156, в которой терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый солюбилизирующий в воде носитель существуют в виде эмульсии.
165. Стерильная инъецируемая фармацевтическая композиция для внутривенного введения, включающая терапевтически эффективное количество b -лапахона или его производного или аналога в фармацевтически приемлемом для жировой эмульсии носителе.
166. Стерильная инъецируемая фармацевтическая композиция по п.165, в которой жировая эмульсия представляет собой интралипидR.
167. Стерильная инъецируемая фармацевтическая композиция по п.165, кроме того, включающая противораковое средство и фармацевтически приемлемый носитель.
168. Стерильная инъецируемая фармацевтическая композиция по п.165, в которой противораковое средство представляет собой производное таксана.
169. Стерильная инъецируемая фармацевтическая композиция по п.168, в которой производное таксана представляет собой паклитаксел.
170. Стерильная инъецируемая фармацевтическая композиция по п.165, в которой концентрация b -лапахона в эмульсии составляет по меньшей мере 1 мг/мл.
171. Стерильная инъецируемая фармацевтическая композиция по п.165, в которой фармацевтическая композиция включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели.
172. Местная композиция для лечения дерматологического заболевания у субъекта, включающая терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, причем указанную композицию наносят местно указанному субъекту для лечения указанного дерматологического заболевания.
173. Местная композиция по п.172, причем композиция представляет собой водный раствор.
174. Местная композиция по п.172, в которой терапевтически эффективное количество b -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель существуют в виде эмульсии.
175. Местная композиция по п.172, причем дерматологическое заболевание включает базальноклеточную карциному, плоскоклеточный рак, саркому Капоши и меланому.
176. Местная композиция по п.172, причем дерматологическое заболевание представляет собой псориаз.
177. Способ лечения рака кожи, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции по п.172.
178. Способ по п.177, в котором фармацевтическую композицию наносят местно.
179. Способ лечения дерматологического заболевания, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции по п.172.
180. Способ по п.179, причем дерматологическое заболевание представляет собой псориаз.
181. Способ по п.180, в котором фармацевтическую композицию наносят местно.
182. Фармацевтическая композиция, включающая терапевтически эффективное количество b -лапахона или его производного или аналога, с фармацевтически приемлемым для жировой эмульсии носителем, подходящая для местного нанесения.
183. Способ лечения рака кожи, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции по п.182.
184. Способ лечения дерматологического заболевания, включающий введение пациенту терапевтически эффективного количества фармацевтической композиции по п.182.
185. Способ по п.184, причем дерматологическое заболевание представляет собой псориаз.
186. Соединение, имеющее формулу
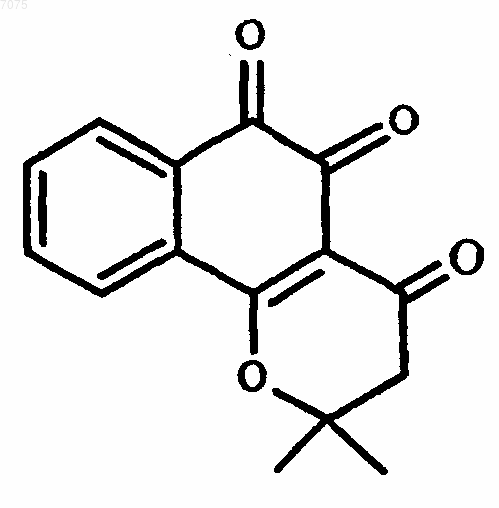
187. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество соединения по п.186 и водорастворимый носитель.
188. Способ лечения дерматологического заболевания, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество соединения по п.186 и водорастворимый носитель.
189. Способ по п.188, причем дерматологическое заболевание представляет собой псориаз.
190. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество 4-ацетокси-b -лапахона и водорастворимый носитель.
191. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективэюх количество 4-ацетокси-3-бром-b -лапахона и водорастворимый носитель.
192. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество 2-этил-6-гидроксинафто[2,3-b]фуран-4,5-диона и водорастворимый носитель.
193. Способ лечения дерматологического заболевания, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество 4-ацетокси-b -лапахона и водорастворимый носитель.
194. Способ по п.193, причем дерматологическое заболевание представляет собой псориаз.
195. Способ лечения дерматологического заболевания, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество 4-ацетокси-3-бром-b -лапахона и водорастворимый носитель.
196. Способ по п.195, причем дерматологическое заболевание представляет собой псориаз.
197. Способ лечения дерматологического заболевания, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество 2-этил-6-гидроксинафто [2,3-b]фуран-4,5-диона и водорастворимый носитель.
198. Способ по п.197, причем дерматологическое заболевание представляет собой псориаз.
199. Фармацевтическая композиция, включающая b -лапахон или его производное или аналог и фармацевтически приемлемый полимер.
200. Фармацевтическая композиция по п.199, в которой b -лапахон или его производное или аналог включен в фармацевтически приемлемый полимер.
201. Фармацевтическая композиция по п.199, в которой b -лапахон или его производное или аналог смешан с фармацевтически приемлемым полимером.
202. Фармацевтическая композиция по п.199, в которой фармацевтически приемлемый полимер является биоразлагаемым.
203. Фармацевтическая композиция по п.199, в которой фармацевтически приемлемый полимер является водорастворимым.
204. Фармацевтическая композиция по п.199, в которой фармацевтически приемлемый полимер выбирают из группы, состоящей из поливинилпирролидона, пиранового сополимера, полигидроксилпропилметакриламидфенола, полигидроксиэтил-аспартамидефенола, полиэтиленоксид-полилизина, замещенного остатками пальмитоила, полимолочной кислоты, полигликолевой кислоты, сополимеров полимолочной и полигликолевой кислоты, полиэпсилонкапролактона, полигидроксимасляной кислоты, сложных полиортоэфиров, полиацеталей, полидигидропиранов, полицианоацилатов и поперечно-сшитых или амфипатических блок-сополимеров гидрогелей.
205. Фармацевтическая композиция по п.199, дополнительно содержащая водорастворимый носитель.
206. Фармацевтическая композиция по п.205, в которой солюбилизирующий в воде носитель выбран из группы, состоящей из полоксамера, повидона К17, повидона К12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, a -циклодекстрина или его аналогов, b -циклодекстрина или его аналогов и g -циклодекстрина или его аналогов.
207. Фармацевтическая композиция по п.199, дополнительно включающая солюбилизирующий носитель на масляной основе.
208. Фармацевтическая композиция по п.207, в которой солюбилизирующим носителем на масляной основе является липиодол.
209. Фармацевтическая композиция по п.199, дополнительно включающая второй противоопухолевый агент и фармацевтически приемлемый носитель.
210. Фармацевтическая композиция по п.209, в которой вторым противоопухолевым агентом является производное таксана.
211. Фармацевтическая композиия по п.210, в которой производным таксана является паклитаксел.
212. Способ лечения рака, включающий введение пациенту фармацевтической композиции по любому из пп.199-211.
213. Способ лечения рака, включающий введение пациенту фармацевтической композиции по любому из пп.199-211 с последующим проведением пациенту лучевой терапии.
214. Способ по пп.212 и 213, в котором указанный рак представляет собой одну или более солидных опухолей, рак предстательной железы, множественную миелому, гематологическую опухоль, лимфоидную опухоль, рак яичников, рак груди или рак кожи.
215. Способ лечения дерматологического заболевания, включающий введение пациенту фармацевтической композиции по любому из пп.199-211.
216. Способ по п.215, в котором указанным дерматологическим заболеванием является псориаз, базально-клеточная карцинома, рак сквамозных клеток, саркома Капоши или меланома.
217. Набор, включающий один или более флаконов, содержащих фармацевтическую композицию по любому из пп.199-211.
Текст
007075 Область изобретения Настоящее изобретение относится к фармацевтическим композициям и препаративным формам, а также способам введения указанных фармацевтических композиций и препаративных форм, которые включают -лапахон (бета-лапахон) или его производное или аналог в форме комплекса или комбинации с солюбилизирующим носителем для усиления растворимости -лапахона в различных системах растворителей. Предпосылки изобретения Только в 2001 г в США будет диагностировано более 1,22 миллионов новых случаев рака. С ежегодным количеством случаев смерти, составляющим более 563000, рак представляет собой вторую по частоте ведущую причину смерти после сердечных заболеваний (UBS Warburg "Disease Dynamics: TheCancer Market", Nov. 8, 2000). Операция и лучевая терапия могут привести к излечению, если заболевание обнаружено рано, но современные способы медикаментозной терапии по поводу метастатического заболевания являются в большинстве случаев паллиативными и редко дают длительное излечение. Даже при новых способах химиотерапии, поступающих на рынок, улучшение выживания пациентов измеряется скорее месяцами, а не годами, и продолжает оставаться необходимость в новых препаратах, эффективных и в комбинации с существующими средствами в качестве терапии первой линии, и в качестве способов лечения второй и третьей линии при лечении устойчивых опухолей. В прошлом в самых успешных схемах медикаментозной терапии комбинировали два или более агента, каждый из которых имеет другой механизм действия, и каждый из которых обладает противоопухолевой активностью, при отдельном применении. Даже хотя их механизмы действия различаются,большинство из средств, применяемых в настоящее время для химиотерапии рака, включая алкилирующие агенты, аналоги платины, антрациклины и каптотециновое семейство ингибиторов топоизомеразы,имеют общее свойство вызывать тяжелое повреждение ДНК, и поэтому они обозначены как средства,повреждающие ДНК. Лучевая терапия работает аналогичным образом. Большинство средств, повреждающих ДНК, а также средств, нацеленных на микротрубочки (например, паклитаксел), вызывают остановку клеток на фазе перехода G2/M клеточного цикла, основной контрольной точки клеточного цикла,где клетки принимают готовность к репарации ДНК или подверженности апоптозу, если повреждение ДНК является невосстановимым. Недавно возрос интерес к идентификации новых терапевтических средств для дальнейшего использования функций клеточного контрольного пункта.(нафтохинона), который можно выделить из дерева лапахо (Tabebuia avellanedae), члена семейства катальпы (Bignoniaceae). Лапахол и -лапахон (с нумерацией) имеют следующие химические структуры:-лапахон, а также его промежуточные соединения, производные и аналоги, описаны в публикацииLi C.J. et al., J. Biol. Chem., 1993. Как камптотецин и топотекан, -лапахон ингибирует ДНК топоизомеразу I (Li C.J. et al., J. Biol. Chem., 1993), хотя другим механизмом. Ряд аналогов -лапахона был раскрыт в данной области, таких как аналоги, описанные в международной заявке по Договору о патентной кооперации PCT/US 93/07878 (WO 94/04145), которая включена в качестве ссылки, и патент США 6245807, включенный в качестве ссылки, в котором разнообразные заместители могут быть в положениях 3 и 4 соединения -лапахона. Международная заявка по Договору о патентной кооперации PCT/US 00/10169 (WO 00/61142), которая включена в качестве ссылки, раскрывает -лапахон, который может иметь разнообразные заместители в положении 3, а также вместо метильных групп в положении 2. Патенты США 5763625, 5824700 и 5969163, каждый из которых включен в качестве ссылки, раскрывают аналоги и производные с разнообразными заместителями в положениях 2, 3 и 4. Кроме того, ряд журналов сообщает об аналогах и производных -лапахона с заместителями в одном или более из следующих положений: положения 2, 3, 8 и/или 9 (см. Sabba et al., J MedChem 27:990-994 (1984) (заместители в положениях 2, 8 и 9); (Molina Portela and Stoppani, Biochem Pharm 51:275-283 (1996) (заместители в положениях 2 и 9); Concalves et al., Molecular and Biochemical Parasitology 1:167-176 (1998) (заместители в положениях 2 и 3. В качестве единственного средства -лапахон продемонстрировал значительную антинеопластическую активность против линий клеток рака человека в концентрациях в диапазоне 1-10 мкмоль (концентрация, ингибирующая на 50%, IС 50). Цитотоксичность была продемонстрирована на трансформированных клеточных линиях, полученных у пациентов с промиелоцитарным лейкозом (Planchon et al., CancerRes., 55 (1996) 3706), раком предстательной железы (Li C.J., et al., Cancer Res., 55 (1995) 3712), злокаче-1 007075 ственной глиомой (Weller M., et al., Int. J. Cancer, 73 (1997) 707), гепатомой (Lai C.C., et al., Histol Histopathol, 13 (1998) 8), раком толстой кишки (Huang L., et al., Mol Med, 5, (1999) 711), раком молочной железыUSA, 96(23) (1999) 13369-74), раком поджелудочной железы (Li Y., et al., Mol Med, 6 (2000) 1008; Li Y.Z.,Mol Med, 5 (1999) 232) и линиях клеток множественной миеломой, включая линии, устойчивые к лекарственным препаратам (Li Y., Mol Med, 6 (2000) 1008). Не наблюдали цитотоксических эффектов на нормальные свежие или пролиферирующие человеческие мононуклеарные клетки периферической крови(РВМС) (Li Y., et al., Mol Med, 6 (2000) 1008). Было показано, что -лапахон представляет собой ингибитор репарации ДНК, который сенсибилизирует клетки к агентам, повреждающим ДНК, включая излучение (Boothman D.A. et al., Cancer Res, 47(1987) 5361; Boorstein R.J., et al., Biochem. Biophys. Commun., 117 (1983) 30). Несмотря на то, что его точная внутриклеточная мишень (мишени) и механизм уничтожения клеток остаются неизвестными, лапахон также проявил мощное ингибирование in vitro человеческих ДНК топоизомераз I (Li C.J. et al., J.Biol. Chem., 268 (1993) 22463) и II (Frydman B. et al., Cancer Res. 57 (1997) 620) с новыми механизмами действиями. В отличие от ядов топоизомеразы (например, каптотецина, этопозида, доксорубицина),которые стабилизируют ковалентный комплекс топоизомеразы-ДНК и индуцируют опосредованное топоизомеразой расщепление ДНК, -лапахон взаимодействует непосредственно с ферментом для ингибирования катализа и блокирует образование расщепляемого комплекса (Li C.J. et al., J. Biol. Chem., 268(1993) 22463) или с самим комплексом, вызывая повторное сшивание разрывов ДНК и диссоциацию фермента от ДНК (Ktishnan P., et al., Biochem Pharm, 60 (2000) 1367). -лапахон и его производные были также синтезированы и тестированы в качестве противовирусных и противопаразитарных средств (Goncalves A.M., et al., Mol. Biochem. Parasitology, 1 (1980) 167-176; Schaffner-Sabba K., et al., J. Med. Chem., 27(1984) 990-994). Конкретнее, представляется, что -лапахон работает разрывом репликации ДНК, вызывая задержки клеточного цикла в фазе G1 и/или S, вызывая или апоптозную, или некротическую смерть клеток у широкого разнообразия линий клеток человеческой карциномы без повреждения ДНК и независимо от статуса р 53 (Li Y.Z. et al. (1999); Huang L. еt al.). Топоизомераза I представляет собой фермент, который раскручивает ДНК, составляющую хромосомы. Хромосомы должны быть раскручены для того, чтобы клетка использовала генетическую информацию для синтеза белков; -лапахон удерживает хромосомы плотно скрученными, так что клетка не может образовывать белки. В результате, клетка прекращает расти. Поскольку раковые клетки постоянно реплицируются и обходят многие механизмы, которые ограничивают репликацию в нормальных клетках, они более уязвимы для ингибирования топоизомеразы, чем нормальные клетки. Другой возможной внутриклеточной мишенью для -лапахона в опухолевых клетках является фермент NA(Р)Н:хиноноксидоредуктаза (NQO1). Биохимические исследования свидетельствуют о том, что восстановление -лапахона NQO1 приводит к бесполезному прохождению цикла развития между хиноновой и гидрохиноновой формами с сопутствующей потерей восстановленного NADH или NAD(P)H(Pink J.J. et al., J. Biol Chem., 275 (2000) 5416). Истощение запасов указанных восстановленных ферментных кофакторов может представлять собой решающий фактор для активации апоптозного пути после лечения -лапахоном. В результате указанных данных, -лапахон активно разрабатывается для лечения рака и опухолей. Например, в патенте WO 00/61142 раскрыт способ и композиция для лечения рака, который включает введение эффективного количества первого компонента, препарата фазы G1 или S, такого как -лапахон,в комбинации с препаратом G2/M, таким как производное таксана. Кроме того, патент США 6245807 раскрывает применение -лапахона, среди других производных -лапахона, для использования при лечении заболеваний предстательной железы человека. Однако одним препятствием для разработки фармацевтических композиций, включающих лапахон для парентерального и местного введения, является низкая растворимость -лапахона в фармацевтически приемлемых растворителях, -лапахон очень плохо растворим в воде и обладает лишь ограниченной растворимостью в обычных системах растворителей, используемых для местного и парентерального введения, в частности, для внутривенной и кожной доставки лекарственных препаратов. В результате, существует необходимость в усовершенствованных композициях -лапахона для парентерального и местного введения, которые являются и безопасными, и легко биологически доступными для субъекта, которому вводят композицию. Сущность изобретения Настоящее изобретение относится в целом к фармацевтическим композициям, содержащим лапахон, для применения при лечении раковых заболеваний у млекопитающих, и которые преодолевают недостатки и препятствия композиций предшествующего уровня техники. Конкретнее, изобретение относятся к фармацевтическим композициям, содержащим -лапахон или его производное или аналог и фармацевтически приемлемый солюбилизирующий носитель, для применения при лечении раковых за-2 007075 болеваний у млекопитающих, включая рак легких, молочной железы, толстой кишки, яичников и предстательной железы, множественную миелому, злокачественную миелому, раковые заболевания кожи, не относящиеся к меланоме, а также расстройства пролиферации и дерматологические состояния, такие как псориаз. Фармацевтические композиции можно составлять в комплексы или комбинировать с фармацевтически приемлемым солюбилизирующим носителем для формирования унитарной композиции или комплекса включения. Фармацевтически приемлемый солюбилизирующий носитель преимущественно представляет собой солюбилизирующий в воде носитель или носитель на основании масла. Настоящее изобретение предоставляет фармацевтические композиции -лапахона или его производного или аналога и фармацевтически приемлемого солюбилизирующего носителя, который усиливает растворимость -лапахона и придает ему биологическую доступность в телах млекопитающих и делает подходящими для парентерального и местного введения. Концентрация -лапахона в растворе составляет предпочтительно по меньшей мере 1 мг/мл, предпочтительнее по меньшей мере 3 мг/мл, еще предпочтительнее по меньшей мере 5 мг/мл. Для концентрированных фармацевтических композиций авторы изобретения предусматривают концентрации -лапахона 10 мг/мл или больше. Настоящее изобретение также предоставляет фармацевтические композиции, содержащие лапахон и фармацевтически приемлемые солюбилизирующие носители в комбинации с производным таксана или другим противораковым средством для применения при лечении раковых заболеваний у млекопитающих. Настоящее изобретение также предоставляет препаративные формы -лапахона или его производного или аналога в комплексе с фармацевтически приемлемыми солюбилизирующими носителями, причем комплекс можно лиофилизировать, и при последующем растворении в водном растворе он является,по существу, растворимым. Настоящее изобретение, кроме того, предоставляет способы лечения раковых заболеваний у млекопитающих введением пациенту фармацевтической композиции и препаративных форм настоящего изобретения. Настоящее изобретение, кроме того, предоставляет способы лечения рака и лечения дерматологических заболеваний введением пациенту, страдающему раком или дерматологическим заболеванием,аналога или производного -лапахона, такого как 4-ацетоксилапахон или 4-ацетокси-3-бром-лапахон. Настоящее изобретение также предоставляет фармацевтические наборы, которые включают один или более контейнеров, содержащих фармацевтическую композицию, включающую терапевтически эффективное количество -лапахона или его производного или аналога. Такие наборы могут включать, при желании, один или более различных обычных фармацевтических компонентов набора, таких как, например, контейнеры с одним или более фармацевтически приемлемыми носителями, дополнительные контейнеры и т.д. В набор можно также включить печатные инструкции или в виде вкладышей, или этикеток, указывающих количество компонентов, которые следует ввести, руководства по введению и/или руководства по смешиванию компонентов. Представленное выше описание излагает достаточно широко более важные признаки настоящего изобретения для того, чтобы можно было понять его следующее подробное описание, и для того, чтобы можно было лучше оценить настоящие вклады в данную область. Другие цели и признаки настоящего изобретения станут очевидными из следующего подробного описания, рассматриваемого в сочетании с сопровождающими чертежами. Однако следует понимать, что чертежи предназначены исключительно для целей иллюстрации, а не как определение пределов изобретения, в отношении которых следует сослаться на прилагаемую формулу изобретения. Краткое описание чертежей Изобретение будет более понятно со ссылкой на прилагаемые чертежи, в которых фиг. 1 представляет собой гистограмму, иллюстрирующую относительную растворимость лапахона в водных растворах различных солюбилизирующих агентов; фиг. 2 - гистограмму, иллюстрирующую растворимость -лапахона как функцию концентрации гидроксипропилциклодекстрина (HPBCD); фиг. 3 - хроматограмму ВЭЖХ раствора -лапахона в концентрации 5 мг/мл при концентрации гидроксипропилциклодекстрина 20%; фиг. 4 - таблицу, иллюстрирующую ингибирование выживания раковых клеток -лапахоном и таксолом; фиг. 5 - таблицу, показывающую профиль ингибирования роста -лапахоном в комбинации с таксолом против линий клеток опухоли яичников, по данным анализа МТТ; фиг. 6 - изоболограмму, показывающую синергическое межлекарственное взаимодействие между лапахоном и таксолом на линии клеток опухоли яичников OVCAR-3; фиг. 7 - изоболограмму, показывающую синергическое межлекарственное взаимодействие между лапахоном и таксолом на линии клеток опухоли яичников MDAH-2774;-3 007075 фиг. 8 - график, иллюстрирующий цитотоксический эффект -лапахона на линии клеток опухоли яичников, чувствительных к цисплатину (A2780s) и устойчивых к цисплатину (A2780DDP); фиг. 9 - гистограмму, иллюстрирующую синергический эффект -лапахона плюс таксол на модели рака яичников человека у мышей; фиг. 10 - гистограмму, иллюстрирующую, что -лапахон одинаково эффективен на модели рака яичников человека у мышей при составлении композиции в растворе HPBCD; фиг. 11 - противоопухолевую активность -лапахона и таксола на модели ксенотрансплантата рака молочной железы человека; фиг. 12 - предпочтительные аналоги и производные -лапахона в соответствии с настоящим изобретением; фиг. 13 - схему, иллюстрирующую инъекцию клеток RPMI 8226 ММ и итоговое образование опухолей у мышей Bg-Nu-Xid; фиг. 14 - график, показывающий образец средней массы тела мышей в течение исследования; фиг. 15 - график, показывающий эффект -лапахона/гидроксипропилциклодекстрина на объем опухоли; фиг. 16 - график, показывающий эффект -лапахона/гидроксипропилциклодекстрина на выживание мышей в обеих группах; и фиг. 17 - репрезентативные микрофотографии, показывающие эффект -лапахона/гидроксипропил-циклодекстрина на опухоли, а также на печень, селезенку, легкие, сердце, мозг и почки. Подробное описание изобретения-лапахон, а также его производные и аналоги (также именуемые здесь активными соединениями) описаны в публикации Li C.J. et al., J. Biol. Chem., 1993. Указанные активные соединения можно включить в фармацевтические композиции, пригодные для парентерального введения. Такие композиции обычно включают активное соединение и фармацевтически приемлемый носитель, наполнитель,разбавитель или адъювант. Однако низкая растворимость -лапахона в большинстве фармацевтически приемлемых растворителях была препятствием для разработки подходящей композиции для парентерального и местного введения, в частности, соответственно внутривенного и кожного введения. Табл. 1 иллюстрирует ограниченную растворимость -лапахона в обычных системах растворителей, используемых для внутривенной доставки лекарственных средств. Полученные к настоящему времени преклинические фармакокинетические данные свидетельствуют о том, что идеальная пиковая концентрация в плазме находится в диапазоне 10 мкг/мл, для достижения указанной концентрации в плазме композиция для внутривенного введения должна иметь концентрацию -лапахона, приближающуюся к 10 мг/мл, и быть способной разбавляться в 5-10 раз стерильными жидкостями для внутривенного введения, такими как солевой раствор или D5W. Таблица 1 Разведенный в 0,9% солевом растворе Максимальная растворимость -лапахона в растворителях, перечисленных в табл. 1, составила около 12 мг/мл. После разведения растворимость снизилась больше, чем фактор разведения, во всех системах. Хотя в различных преклинических исследованиях использовали разнообразные обычные системы растворителей, такие как липиодол, арахисовое масло, кремофор/этанол или полиэтиленгликоль 400 для внутрибрюшинного и внутримышечного введения, ни один из указанных подходов еще не продемонстрировал пригодность для разработки композиции для внутривенного введения для применения в клинике.-4 007075 Комбинирование, смешивание и/или образование комплекса -лапахона, его производных или аналогов с фармацевтически приемлемым солюбилизирующим в воде носителем, который преимущественно представляет собой гидроксипропилциклодекстрин (HPBCD), увеличивает растворимость в воде лапахона при концентрациях, достигающих 20 мг/мл в 50% растворе HPBCD, как показано в табл. 2. Таблица 2 Указанные растворы -лапахона/HPBCD устойчивы в течение продолжительных периодов при комнатной температуре, и их можно дополнительно разбавить стерильными жидкостями для внутривенного введения (например, стерильным солевым раствором, дистиллированной водой D5W) и держать в течение по меньшей мере 24 ч без осаждения -лапахона. Растворы -лапахона/HPBCD можно также подвергать стерилизации фильтрацией, лиофилизации и легко растворять в воде. Экспериментирование определило, что НРВСD20%/-лапахон 5 мг/мл обеспечивает отличную концентрацию для легкой лиофилизации и относительно быстрого растворения. Однако изобретение не ограничено в данном отношении, и были получены концентрации -лапахона, достигающие 1 мг/мл, и определено, что они устойчивы и способны подвергаться лиофилизации и растворению. Оказывается, что объединение или образование комплекса -лапахона с HPBCD также улучшает устойчивость -лапахона к фотовосстановлению по сравнению с образованием комплекса -лапахона с растворами этанола. Дальнейшее исследование -лапахона в водных растворах HPBCD продемонстрировало, что растворимость -лапахона линейно увеличивается с увеличением концентрации HPBCD. После разведения в 10-100 раз уменьшение концентрации -лапахона во всех системах HPCD пропорционально произведенным разведениям. Циклодекстрины представляют собой кристаллические, не гигроскопичные, циклические олигомеры -D-глюкопиранозы, полученной из крахмала. В результате отсутствия вращения вокруг связей, соединяющих единицы глюкопиранозы, циклодекстрины являются не цилиндрическими, а тороидальными по форме. Ввиду указанного ограниченного вращения, они имеют жесткую структуру с центральной полостью, размер которой варьирует в соответствии с количеством единиц глюкопиранозы в молекуле. Тремя наиболее часто встречающимися циклодекстринами являются -циклодекстрин, -циклодекстрин и -циклодекстрин, и они состоят, соответственно, из шести, семи и восьми единиц глюкопиранозы. Благодаря расположению гидроксильных групп внутри молекулы циклодекстрина и форме молекулы, внутренняя поверхность полости является гидрофобной, в то время как наружная поверхность является гидрофильной. Первичные гидроксильные группы расположены на более узкой (внутренней) стороне тороидальной молекулы, в то время как вторичные гидроксильные группы расположены на более широком(наружном) краю. Данное расположение обеспечивает возможность циклодекстринам приспосабливаться к широкому разнообразию мелких гидрофобных молекул внутри гидрофобной полости формированием комплекса включения.HPBCD имеет семь единиц глюкопиранозы и имеет гидроксипропильные группы, прикрепленные к каждой единице глюкопиранозы на внешней поверхности тороидальной структуры. Было показано, что растворимость HPBCD в воде гораздо выше, чем растворимость -циклодекстрина. Введение гидроксипропильных групп в -циклодекстрин делает его более растворимым разрывом межмолекулярной водородной связи между гидроксильными частями на полости циклодекстрина. В результате, комплексы включения, образованные HPBCD, будут также иметь более высокую растворимость в воде, по сравнению с комплексами включения, образованными -циклодекстринами. Степень замещения определяет растворимость и типы образования комплексов. Чем меньше замещение, тем больше связь будет аналогична связи незамещенного циклодекстрина с точки зрения связывания, а также растворимости. Более высокое замещение придает циклодекстрину большую растворимость в воде, но меньшее связывание. Степень замещения циклодекстринов легко регулировать. При образовании комплексов -лапахона, его производных или аналогов с солюбилизирующим в воде носителем в соответствии с настоящим изобретением, раствор образовавшегося комплекса в целом стает унитарной композицией или в случае, когда солюбилизирующий в воде носитель представляет собой HPBCD, образуется комплекс включения, в котором нерастворимый -лапахон, его производные или-5 007075 аналоги находятся внутри полости циклодекстрина. Однако изобретение не ограничено образованием комплекса. Хотя HPBCD представляет собой предпочтительный солюбилизирующий агент, изобретение не ограничено в данном отношении, и предусмотрены другие солюбилизирующие в воде агенты для комбинирования с -лапахоном, его производными или аналогами, такие как полоксамер, повидон К 17, повидон К 12, Твин 80, этанол, кремофор/этанол, полиэтиленгликоль 400, пропиленгликоль и траппсол. Кроме того, изобретение не ограничено солюбилизирующими в воде агентами, и можно также использовать солюбилизирующие агенты на масляной основе, такие как липиодол и арахисовое масло. Поверхностно-активные вещества также предусмотрены как часть настоящего изобретения для солюбилизации -лапахона, его производных или аналогов. Однако необходимо, чтобы используемое поверхностно-активное вещество (вещества) должно было присутствовать на достаточно высоком уровне,когда -лапахон, его производные или аналоги растворяют в воде, с тем, чтобы было достаточно поверхностно-активного вещества для удержания -лапахона, его производного или аналога в растворе. Однако не может быть слишком много поверхностно-активного вещества, чтобы оно вызвало непереносимые побочные эффекты. Также могут быть образованы эмульсии -лапахона, его производных или аналогов, и они предусмотрены настоящим изобретением. Можно получить эмульсии, которые включают терапевтически эффективное количество -лапахона, его производных или аналогов в одном или более эмульгаторов или эмульгирующих агентов, что может привести к получению эмульсии типа масла в воде для парентерального введения. Подходящие эмульгаторы или эмульгирующие агенты могут включать, но не ограничиваются, любой фармацевтически приемлемый эмульгатор, предпочтительно фосфолипиды, экстрагированные из яичного желтка или соевого боба, синтетических фосфатидилхолинов или очищенных фосфатидилхолинов растительного происхождения. Можно также использовать гидрированные производные,такие как фосфатидилхолин гидрированный (яйцо) и фосфатидилхолин гидрированный (соя). Эмульгаторы могут также представлять собой неионные поверхностно-активные вещества, такие как полоксамеры (например, полоксамер 188 и 407), полоксамины, полиоксиэтиленстеараты, сложные эфиры жирных кислот полиоксиэтиленсорбитана или сложные эфиры жирных кислот сорбитана. Можно также использовать ионные поверхностно-активные вещества, такие как холиевая кислота и деоксихолиевая кислота или их поверхностно-активные производные или соли. Эмульгатор может также представлять собой смесь одного или более из указанных выше ингредиентов. Эмульсия может дополнительно содержать другие ингредиенты, такие как буферы, стабилизаторы и другие липиды. Интралипид представляет собой жировую эмульсию для инъекций. Жировые эмульсии могут содержать яичный желток, масло соевых бобов и масло подсолнечника. Интралипид, продаваемый в США в виде липосина II и липосина III (Abbot Laboratories, Abbott Park, Illinois), можно использовать в качестве источника калорий и жирных кислот для поддержания или увеличения массы пациента, которому он введен, или его можно использовать в качестве носителя для плохо растворимых в воде липофильных препаратах, которые нельзя инъецировать непосредственно. Интралипид и липосин II продаются в концентрации и 10, и 20%. В соответствии с настоящим изобретением, эмульсию, включающую-лапахон, его производные или аналоги, и интралипид или любую другую фармацевтически приемлемую жировую эмульсию можно получить для парентерального введения пациенту. Недавние исследования in vitro и in vivo показали, что -лапахон демонстрирует значительную синергию с другими химиотерапевтическими и противораковыми средствами, в частности, цис-платиной и производными таксана, такими как таксол (паклитаксел) (Bristol-Myers Squibb Co., New York, N.Y.). Патент WO 00/61142, например, раскрывает способ и композицию для лечения рака, который включает введение эффективного количества первого соединения, препарата фазы G1 или S, в комбинации с препаратом G2/M, таким как производное таксана. Посредством его обеих основных функциональных характеристик - синергии с другими химиотерапевтическими препаратами и активностью против устойчивых клеток - применение -лапахона, его производных или аналогов может значительно увеличить частоту долгосрочной ремиссии раковых поражений, включая рак яичников, молочной железы, предстательной железы, толстой кишки, поджелудочной железы, множественную миелому, злокачественную миелому и раковые заболевания кожи, не относящиеся к меланоме. -лапахон, его производные или аналоги можно также применять для лечения пролиферативных расстройств и дерматологических заболеваний, таких как псориаз. Как указано, фармацевтическая композиция и препаративные формы настоящего изобретения предназначены для парентерального введения, предпочтительно, внутривенного введения. Однако изобретение не ограничено в данном отношении, и жидкие фармацевтические композиции и составы в соответствии с настоящим изобретением можно получить для приема внутрь. Преимущественно фармацевтические композиции для парентерального введения включают желательное количество -лапахона, его производных или аналогов, соединенных в комплексы с HPBCD. Обычные -циклодекстрины не подходят для композиций, предназначенных для парентерального введения, но их можно использовать для получения композиций для перорального введения. Как указано, экс-6 007075 периментирование определило, что растворимость -лапахона, его производных или аналогов линейно увеличивается с увеличением концентрации HPBCD. Хотя -лапахон представляет собой предпочтительное соединение для использования в композиции в соответствии с настоящим изобретением, изобретение не ограничено в данном отношении, и производные или аналоги -лапахона, такие как лапахол, и их фармацевтические композиции и препаративные формы являются частью настоящего изобретения. Такие аналоги -лапахона включают аналоги, указанные в международной заявке по Договору о патентной кооперации PCT/US 93/07878 (WO 94/04145), которая полностью включена сюда в качестве ссылки и которая раскрывает соединения формулы где R и R1, каждый независимо, представляет собой водород, замещенный и незамещенный арил, замещенный и незамещенный алкенил, замещенный и незамещенный алкил и замещенный и незамещенный алкокси. Алкильные группы предпочтительно имеют от 1 до около 15 атомов углерода, предпочтительнее от 1 до около 10 атомов углерода, еще предпочтительнее от 1 до около 6 атомов углерода. До тех пор пока термин алкил не модифицирован другим образом, он относится и к циклическим, и к не циклическим группам, хотя, конечно, циклические группы должны включать по меньшей мере 3 углеродных кольцевых члена. Линейные или разветвленные нециклические алкильные группы в целом предпочтительнее, чем циклические группы. Линейные алкильные группы в целом предпочтительнее, чем разветвленные. Алкенильные группы предпочтительно имеют от 2 до около 15 атомов углерода, предпочтительнее от 2 до около 10 атомов углерода, еще предпочтительнее от 2 до около 6 атомов углерода. Особенно предпочтительные алкенильные группы имеют 3 атома углерода (т.е. 1-пропенил или 2-пропенил),причем особенно предпочтительной является аллильная часть. Фенил и нафтил представляют собой в целом предпочтительную арильную группу. Алкоксигруппы включают те алкоксигруппы, имеющие одну или более кислородную связь и предпочтительно имеют от 1 до 15 атомов углерода, предпочтительнее от 1 до около 6 атомов углерода. Замещенные группы R и R1 могут быть замещены в одной или более доступных положениях одной или более подходящих групп, таких как, например, алкильные группы,такие как алкильные группы, имеющие от 1 до 10 атомов углерода или от 1 до 6 атомов углерода, алкенильные группы, такие как алкенильные группы, имеющие от 2 до 10 атомов углерода или от 2 до 6 атомов углерода, арильные группы, имеющие от 6 до 10 атомов углерода, галоген, такой как фтор, хлор и бром, и N, О и S, включая гетероалкил, например гетероалкил, имеющий одну или более гетероатомных связей (и, следовательно, включая алкокси, аминоалкил и тиоалкил) и от 1 до 10 атомов углерода или от 1 до 6 атомов углерода. Другие аналоги -лапахона, предусмотренные в соответствии с настоящим изобретением, включают аналоги, описанные в патенте США 6245807, который полностью включен сюда в качестве ссылки и который раскрывает аналоги и производные -лапахона, имеющие структуру где R и R1, каждый независимо, выбран из водорода, гидрокси, сульфгидрила, галогена, замещенного алкила, незамещенного алкила, замещенного алкенила, незамещенного алкенила, замещенного арила,незамещенного арила, замещенного алкокси, незамещенного алкокси и их солей, где пунктирная двойная связь между кольцевыми углеродами представляет необязательную кольцевую двойную связь. Дополнительные аналоги и производные -лапахона указаны в международной заявке по Договору о патентной кооперации PCT/US 00/10169 (WO 00/61142), которая полностью включена сюда в качестве ссылки и которая раскрывает соединения структуры где R5 и R6 могут быть независимо выбраны из гидрокси, C1-С 6 алкила, C1-C6 алкенила, C1-С 6 алкокси, C1C6 алкоксикарбонила, -(СН 2)n-фенила; a R7 представляет водород, гидроксил, C1-C6 алкил, C1-C6 алкенил,C1-C6 алкокси, C1-C6 алкоксикарбонил, -(СН 2)n-амино, -(СН 2)n-арил, -(СН 2)n-гетероарил, (СН 2)n-гетероцикл или -(СН 2)n-фенил, в которых n представляет собой целое число от 0 до 10. Другие аналоги и производные -лапахона раскрыты в патенте США 5763625, патенте США 5824700 и патенте США 5969163, а также в статьях научных журналов, таких как Sabba et al., J MedChem 27:990-994 (1984), которая раскрывает -лапахон с замещениями в одном или более из следующих положений: 2, 8 и/или 9. См. также Portela et al., Biochem Pharm 51:275-283 (1996) (заместители в положениях 2 и 9); Maruyama et al., Chem Lett 847-850 (1977); Sun et al., Tetrahedron Lett 39:8221-8224 (1998);Goncalves et al., Molecular and Biochemical Parasitology 1:167-176 (1998) (заместители в положениях 2 и 3); Gupta et al., Indian Journal of Chemistry 16B:35-37 (1978); Gupta et al., Curr Sci 46:337 (1977) (заместители в положениях 3 и 4); DiChenna et al., J Med Chem 44:2486-2489 (2001) (моноариламино производные). Каждая из указанных выше ссылок полностью включена сюда в качестве ссылки. Предпочтительнее, аналоги и производные, предусмотренные настоящей заявкой, предназначены охватывать соединения, имеющие общую формулу I и II где пунктирная двойная связь между кольцевыми углеродами представляет необязательную кольцевую двойную связь, и где R и R1, каждый независимо, выбран из водорода, гидрокси, сульфгидрила, галогена,замещенного алкила, незамещенного алкила, замещенного алкенила, незамещенного алкенила, замещенного арила, незамещенного арила, замещенного алкокси, незамещенного алкокси и их солей. Алкильные группы предпочтительно имеют от 1 до около 15 атомов углерода, предпочтительнее от 1 до около 10 атомов углерода, еще предпочтительнее от 1 до около 6 атомов углерода. Термин алкил относится и к циклическим, и не циклическим группам. Линейные или разветвленные нециклические алкильные группы в целом предпочтительнее, чем циклические группы. Линейные алкильные группы в целом предпочтительнее, чем разветвленные. Алкенильные группы предпочтительно имеют от 2 до около 15 атомов углерода, предпочтительнее от 2 до около 10 атомов углерода, еще предпочтительнее от 2 до около 6 атомов углерода. Особенно предпочтительные алкенильные группы имеют 3 атома углерода (т.е. 1 пропенил или 2-пропенил), причем особенно предпочтительной является аллильная часть. Фенил и нафтил представляют собой в целом предпочтительную арильную группу. Алкоксигруппы включают те алкоксигруппы, имеющие одну или более кислородную связь и предпочтительно имеют от 1 до 15 атомов углерода, предпочтительнее от 1 до около 6 атомов углерода. Замещенные группы R и R1 могут быть замещены в одной или более доступных положениях одной или более подходящих групп, таких как, например, алкильные группы, такие как алкильные группы, имеющие от 1 до 10 атомов углерода или от 1-8 007075 до 6 атомов углерода, алкенильные группы, такие как алкенильные группы, имеющие от 2 до 10 атомов углерода или от 2 до 6 атомов углерода, арильные группы, имеющие от 6 до 10 атомов углерода, галоген,такой как фтор, хлор и бром, и N, О и S, включая гетероалкил, например гетероалкил, имеющий одну или более гетероатомных связей (и, следовательно, включая алкокси, аминоалкил и тиоалкил) и от 1 до 10 атомов углерода или от 1 до 6 атомов углерода; и где R5 и R6 могут быть независимо выбраны из гидрокси, C1-С 6 алкила, С 1-С 6 алкенила, C1-C6 алкокси, C1-С 6 алкоксикарбонила, (СН 2)n-арила, (СН 2)nгетероарила, (СН 2)n-гетероцикла или (СН 2)n-фенила; a R7 представляет водород, гидроксил, C1C6 алкил, C1-C6 алкенил, C1-C6 алкокси, C1-C6 алкоксикарбонил, (СН 2)n-амино, (СН 2)n-арил, (СН 2)nгетероарил,(СН 2)n-гетероцикл или (СН 2)n-фенил, в которых n представляет собой целое число от 0 до 10. Предпочтительные аналоги и производные, также предусмотренные изобретением, включают соединения следующей общей формулы III: где R1 представляет (CH2)n-R1, где n представляет собой целое число от 0 до 10, a R2 представляет водород, алкил, арил, гетероароматическую группу, гетероциклическую группу, алифатическую группу, алкокси, аллилокси, гидроксил, амин, тиол, амид или галоген. Аналоги и производные, также предусмотренные изобретением, включают 4-ацетоксилапахон, 4 ацетокси-3-бромлапахон, 4-кетолапахон, 7-гидроксилапахон, 7-метоксилапахон, 8-гидрокси-лапахон, 8-метоксилапахон, 8-хлорлапахон, 9-хлорлапахон, 8-метиллапахон и 8,9 диметоксилапахон. Предпочтительные аналоги и производные, также предусмотренные изобретением, включают соединения следующей общей формулы IV:(СН 2)n-фенила; или R1 и R2 в комбинации представляют одиночный заместитель, выбранный из указанных выше групп, и в данном случаепредставляет двойную связь. Предпочтительные аналоги и производные, также предусмотренные данным изобретением, включают дуннион и 2-этил-6-гидроксинафто[2,3-b]фуран-4,5-дион. Предпочтительные аналоги и производные, также предусмотренные изобретением, включают соединения следующей общей формулы V:-9 007075 где R1 выбран из Н, СН 3, ОСН 3 и NO2. Предпочтительные соединения указанных выше генерических формул показаны на фиг. 12. Величины растворимости -лапахона и его аналогов в 40% растворе (мас./об.) HPBCD по сравнению с водой показаны в табл. 3 и 4. Для определения величин растворимости тестируемые соединения сначала растворяли в этаноле для получения стандартных растворов с концентрацией в диапазоне 2,5-10 мг/мл, затем разбавляли водой до концентрации 10 мкг/мл. Получали УФ сканы стандартных растворов 10 мкг/мл и определяли длину волн максимальной спектральной поглощательной способности и спектральную поглощательную способность при длине волн максимальной спектральной поглощательной способности. Для каждого тестируемого соединения аликвотные количества 50 мкл воды и 40% HPBCD добавляли в отдельные пробирки Эппендрофа, каждая из которых содержала приблизительно 1 мг соединения. Пробирки нагревали в водяной бане при 30 С, перемешивали вихревой мешалкой, затем центрифугировали при 15000 об./мин в течение 5 мин. Данный этап повторяли, затем пробирки охлаждали до комнатной температуры в течение 1 ч, затем снова центрифугировали. Надосадочную жидкость из каждой пробирки разбавляли водой до соответствующего диапазона спектральной поглощательной способности и спектральную поглощательную способность УФ измеряли при длине волн максимальной спектральной поглощательной способности соединения. Концентрации данных насыщенных растворов затем рассчитывали по соотношению с этаноловыми стандартными растворами 10 мкг/мл. Как показано в табл. 3 и 4, величины растворимости в воде тестируемых соединений возросли в 7-323 раза в присутствии 40% HPBCD. Таблица 3 Величины спектральной поглощательной способности -лапахона и его аналогов в водном растворе и в 40% растворе (мас./об.) гидроксипропилциклодекстрина (HPBCD) Другие конкретные препаративные формы в соответствии с настоящим изобретением представлены здесь ниже и в разделе Примеры. В целом, -лапахон и соединения его производных и аналогов можно получить рядом путей, хорошо известных специалисту в области органического синтеза, -лапахон и его производные и аналоги можно синтезировать с использованием способов, в целом описанных ниже, вместе со способами синтеза, известными в области синтетической органической химии, или их изменениями, что понятно специалистам в данной области. Предпочтительные способы включают, но не ограничиваются, описанные здесь способы синтеза и составления композиций. В данной области известны многочисленные способы синтеза -лапахона и/или его производных или аналогов. Первый способ описан в публикации Schaffner-Sabba K., et al., -Lapachone: Synthesis ofDerivatives and Activities in Tumor Models, J. Med. Chem., 27, (1984) 990-994, и известен как способ калиевой соли. Второй способ описан в публикации Sun J.S. et al., A Preparative Synthesis of Lapachol and Related Naphthoquinones, Tetrahedron Letters, 39 (1998) 8221-8224, и известен как способ литиевой соли. Указанные два способа оба исходно получают лапахол, промежуточное соединение, из которого синтезируют -лапахон. Оба указанных способа требуют образования соли металла. Кроме того, Amaral A., etal., в публикации The Total Synthesis of -lapachone, J. Heterocyclic Chem., 29 (1992) 1457-1460, описан синтез -лапахоннафтола в восемь этапов, и он приводит к общему выходу лишь 23%. В патенте США 5763625 сначала превращают в 3-бромлапахон, который затем превращают двухэтапной последовательностью в 3-гидроксилапахон. Кроме того, как описано в одновременно рассматриваемой заявке на патент США под серийным 09/975776, в отличие от описанных способов, в которых металлическую (литиевую или калиевую) соль 2-гидрокси-1,4-нафтохинона получают in situ добавлением гидрида лития или отдельно добавлением гидроокиси калия в раствор хинона в качестве первого этапа, а затем обеспечением реакции соли металла с бромидным соединением для образования лапахола, в способе,описанном в одновременно рассматриваемой заявке на патент США под серийным 09/975776, исключен указанный этап, и он начинается с реакции 2-гидрокси-1,4-нафтохинона с 1-бром-3-метил-2-бутеном в присутствии йодида натрия и слабого основания, такого как триэтиламин, пиридин, триметиламин,N,N-диизопропилэтиламин, 2,6-лутидин, для образования лапахола, из которого в последующем синтезируют -лапахон.- 11007075 Как обсуждалось выше, было показано, что -лапахон в качестве одного средства обладает значительной цитотоксической активностью для широкого разнообразия линий раковых клеток с величинамиIС 50 в низком (1-10) микромолярном диапазоне. Исследования in vitro продемонстрировали, что указанные микромолярные концентрации -лапахона полностью устраняли образование колоний при нанесении на культуры опухолевых клеток в комбинации с IC50 уровнями таксола. Указанные исследования,кроме того, показали, что -лапахон действует синергически с таксолом, который содержит активное соединение паклитаксел, для значительного усиления эффективности каждого средства отдельно без сопутствующего увеличения токсичности (Li C.J., et al., Proc Natl Acad Sci U.S.A. 96 (1999) 13369). Мощное ингибирование роста опухоли in vivo -лапахоном плюс таксолом было продемонстрировано на модели ксенотрансплантата рака яичников человека голым мышам. Мощная противоопухолевая активность была также продемонстрирована у самок голых мышей, пораженных ксенотрансплантатами рака яичников человека (подробно обсужденная ниже в Примерах). Солюбилизированный -лапахон, его производные и аналоги можно также комбинировать с другими производными таксана и противораковыми средствами. В комбинации солюбилизированный лапахон, его производные и аналоги можно смешивать с противораковым средством или производным таксана и предоставлять в одном флаконе, или каждый из них можно предоставлять в отдельном флаконе. Когда солюбилизированный -лапахон, его производные и аналоги и противораковое средство или производное таксана предоставляют в отдельных флаконах, содержимое каждого флакона можно вводить пациенту одновременно или последовательно. В другом варианте реализации солюбилизированный -лапахон, его производные и аналоги можно вводить в комбинации с лучевой терапией. Преимущественно, пациента следует подвергнуть лучевой терапии за заданное количество часов перед введением -лапахона, его производных и аналогов или после него, что определяет врач-клиницист, проводящий лечение пациента. Тип и количество -лапахона, его производных и аналогов и HPBCD или другого используемого носителя будет широко варьировать, в зависимости от вида теплокровного животного или человека, массы тела и опухоли, подвергаемой лечению. Аналогичным образом, введенная дозировка будет варьировать в зависимости от известных факторов, таких как фармакодинамические характеристики определенного средства и вид и путь введения, возраст, здоровье и масса реципиента; природа и степень выраженности симптомов; вид сопутствующего лечения; частота лечения и желаемый эффект. Вводимая дозировка будет варьировать в зависимости от таких факторов, как фармакодинамические характеристики определенного активного ингредиента и вид и путь введения; возраст, пол, состояние здоровья, скорость метаболизма, эффективность всасывания и/или масса реципиента; природа и степень выраженности симптомов; вид сопутствующего лечения; частота лечения и желаемый эффект. В предпочтительном варианте реализации дозировка может составлять приблизительно от 0,1 до 10 мг/кг,введенные приблизительно от 2 раз/нед. до 1 раза/мес. Используемый здесь термин терапевтически эффективное количество означает количество лекарственного препарата или фармацевтического средства, которое вызовет биологическую или медицинскую реакцию ткани, системы у животного или человека, к которой стремится исследователь или клиницист. Особенно предпочтительно составлять композиции для перорального или парентерального введения в стандартной лекарственной форме для легкости введения и равномерности дозировки. Лекарственная форма может включать одно соединение, т.е., -лапахон, его производные и аналоги, или их смесь с другими соединениями или другими соединениями, ингибирующими рак, или соединениями, ингибирующими рост опухолей, или противовирусными соединениями. Композиции, подходящие для парентерального введения, преимущественно включают водные стерильные инъекционные растворы, но они могут также включать неводные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические агенты и растворенные вещества, которые придают композиции изотоничность с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Препаративные формы могут присутствовать в контейнерах, содержащих одну или множество доз, например, они могут быть запаяны в ампулы и флаконы, и могут храниться в лиофилизированном состоянии, требующем только добавления стерильного жидкого носителя,например, воды для инъекций, непосредственно перед применением. Используемый термин стандартная лекарственная форма относится к физически дискретным единицам, подходящими в качестве унитарных дозировок для подлежащего лечению субъекта, причем каждая единица содержит заданное количество активного соединения, рассчитанное для того, чтобы вызвать желательный терапевтический эффект, в ассоциации с требуемым фармацевтическим носителем. Инъекционные растворы и суспензии для применение по требованию можно приготовить из стерильных порошков, гранул и таблеток, как известно в области приготовления таких растворов. Спецификации лекарственных форм изобретения определяются и непосредственно зависят от специфических характеристик активного соединения и определенного терапевтического эффекта, который предстоит достичь, и ограничений, присущих способам смешивания такого активного соединения для лечения индивидуумов.- 12007075 Следует понимать, что, кроме ингредиентов, конкретно упомянутых в отношении специфических композиций и препаративных форм настоящего изобретения, композиции и препаративные формы данного изобретения могут включать другие агенты, причем принятые в данной области подходы относятся к типу рассматриваемой композиции, например композиции, подходящие для перорального введения,могут включать ароматизирующие и красящие агенты. В дополнение к комплексу -лапахона, его производных и аналогов с HPBCD в соответствии с настоящим изобретением, фармацевтические композиции, подходящие для парентерального введения путем инъекции или инфузии, могут также включать стерильные водные растворы (при растворимости в воде) или дисперсии и стерильные порошки для приготовления по требованию стерильных инъецируемых растворов или дисперсий. Для внутривенного введения подходящие носители включают физиологический солевой раствор, бактериостатическую воду, Cremophor EL (BASF, Passipany, N.J.) или солевой раствор с фосфатным буфером (PBS). Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и им подобные соединения), масло и их подходящие смеси. Во всех случаях композиция должна быть стерильной и должна быть текучей до такой степени, чтобы существовала возможность ее легкого введения с помощью шприца. Она должна быть устойчива в условиях изготовления и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Соответствующую текучесть можно поддерживать, например, использованием покрытий, таких как лецитин, поддержанием требуемого размера частиц в случае дисперсии и использованием поверхностно-активных веществ. Предотвращение действия микроорганизмов можно достичь различными антибактериальными и противогрибковыми средствами, например, парабенами, хлорбутанолом, фенолом,аскорбиновой кислотой, тимеросалом и им подобными. Во многих случаях предпочтительнее будет включить в композицию изотонические агенты, например сахара, полиспирты, такие как маннит, сорбит,хлорид натрия. Длительное всасывание инъецируемых композиций можно достичь включением в композицию агента, который задерживает всасывание, например, алюминиймоностеарата и желатина. Парентеральные и внутривенные композиции могут также включать минералы и другие материалы для содействия их совместимости с типом инъекции или системы доставки, которую предстоит использовать. Кроме того, растворы для парентерального введения могут содержать растворимую в воде соль активного соединения, подходящий стабилизирующий агент и, при необходимости, буферные вещества. Противоокислительные агенты, такие как бисульфит натрия, сульфит натрия или аскорбиновая кислота, или отдельно, или в комбинации, представляют собой подходящие стабилизирующие агенты. Используют также лимонную кислоту и ее соли и натрий ЭДТА. Кроме того, парентеральные растворы могут содержать консерванты, такие как бензалконийхлорид,метил- или пропилпарабен и хлорбутанол. Стерильные инъецируемые растворы можно получить включением активного соединения в требуемом количестве в соответствующем растворителем с одним или комбинацией перечисленных выше ингредиентов, как требуется, с последующей стерилизацией фильтрацией. В целом, дисперсии получают включением активного соединения в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, способы получения представляют собой вакуумную сушку и лиофилизацию, которая дает выход порошка, порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из ранее его стерилизованного фильтрацией раствора. Описанные здесь комплексы -лапахона, его производного или аналога можно лиофилизировать, затем растворить в водном растворе, и они могут быть, по существу, растворимы (см. пример 5 ниже). Для перорального введения в жидкой лекарственной форме компоненты перорального лекарственного препарата предпочтительно комбинируют с -циклодекстрином, а предпочтительнее гидроксипропилциклодекстрином, однако, изобретение не ограничено в этом отношении, и компоненты перорального лекарственного препарата можно комбинировать с любыми пероральными, нетоксичными, фармацевтически приемлемыми инертными носителями, такими как этанол, глицерин, вода, масла и им подобные. Более того, при желании или необходимости подходящие связывающие агенты, смазывающие вещества, разрыхляющие агенты и красящие агенты можно также включить в смесь. Подходящие связывающие агенты включают крахмал, желатин, естественные сахара, такие как глюкоза или бета-лактоза,кукурузные подслащивающие вещества, естественные и синтетические смолы, такие как акация, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и им подобные. Смазывающие вещества, используемые в указанных лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и им подобные. Разрыхлители включают, без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и им подобные. Жидкие лекарственные формы для перорального введения могут также содержать красящие и ароматизирующие агенты для увеличения приемлемости пациентом. Дополнительные примеры подходящих жидких лекарственных форм могут включать растворы или суспензии в воде, фармацевтически приемлемых жиров и масел, спиртов или других органических рас- 13007075 творителей, включая сложные эфиры, эмульсии, сиропы или эликсиры, суспензии, растворы и/или суспензии, полученные в результате растворения не вспенивающихся гранул и вспенивающихся препаратов,полученных в результате растворения вспенивающихся гранул. Такие жидкие лекарственные формы могут также включать дополнительные растворители, консерванты, эмульгирующие агенты, суспендирующие агенты, разбавители, подслащивающие агенты, загустители и плавящие агенты. Активные соединения могут также соединяться с растворимыми полимерами в качестве нацеливаемых носителей лекарственного препарата. Такие полимеры должны включать поливинилпирролидон,пирановый сополимер, полигидроксилпропилметакриламидфенол, полигидроксиэтиласпартамидефенол или полиэтиленоксид-полилизин, замещенный остатками пальмитоила. Кроме того, соединения настоящего изобретения можно соединять с классом биодеградируемых полимеров, которые можно использовать при достижении регулируемого высвобождения лекарственного препарата, например, полимолочной кислотой, полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислотой, полиэпсилонкапролактоном, полигидроксимасляной кислотой, сложными полиортоэфирами, полиацеталями, полидигидропиранами, полицианоацилаты и поперечно-сшитыми или амфипатическими блоксополимерами гидрогелей. Активные соединения данного изобретения предназначены для введения в качестве лечения рака и ингибирования опухолей любым средством, которое создает контакт активных соединений с участком действия средства в организме. Как указано, предпочтительным способом введения -лапахона, его производных или аналогов, активного ингредиента является парентеральное введение, предпочтительно внутривенное введение (болюс или инфузия). Однако изобретение не ограничено в этом отношении, и активные ингредиенты в соответствии с данным изобретением можно вводить любым обычным средством, имеющимся для применения, в сочетании с фармацевтическими препаратами или в виде отдельных терапевтических средств, или в комбинации с другими терапевтическими агентами с намерением ингибировать опухоли. Например, активные соединения можно также вводить внутрибрюшинно, подкожно или внутримышечно. Активные соединения можно также составлять в композиции для местного применения для лечения раковых заболеваний кожи, таких как базальноклеточная карцинома, плоскоклеточный рак, саркома Капоши и меланома. Активные соединения можно вводить отдельно, но в целом их вводят с фармацевтическим носителем, выбранным на основании выбранного пути введения и стандартной фармацевтической практики. Настоящее изобретение также включает способы лечения рака введением пациенту композиций и препаративных форм настоящего изобретения. В предпочтительном варианте реализации способ включает парентеральное введение композиций и составов пациенту предпочтительно посредством внутривенной инъекции или инфузии, как описано выше. В другом варианте реализации способ включает местное введение композиций и препаративных форм изобретения. Термины местное нанесение, нанесенный местно, местное введение и введенный местно используются взаимозаменяемо для обозначения способа нанесения или распределения одной или более композиций в соответствии с настоящим изобретением на поверхности кожи нуждающегося в них индивидуума. Композиции для местного применения могут включать кремовую эмульсию масла в воде, но не ограничиваются в этом отношении. Композиции для местного применения, предусмотренные настоящим изобретением, могут включать композиции отсроченного высвобождения, способные создавать медленное высвобождение аналогов и производных -лапахона. Препаративные формы для местного применения могут необязательно содержать широкое разнообразие дополнительных компонентов, предназначенных для улучшения общих желательных характеристик, визуального внешнего вида, физических свойств и/или физического ощущения, но при условии,что такие необязательные добавки являются физически и химически совместимыми с существенными компонентами, описанными здесь (выше), и чрезмерно не нарушают устойчивость, безопасность или эффективность. Необязательные добавки могут быть диспергированы, растворены или подобным образом включены в носитель настоящих композиций. Необязательные добавки включают возможные эстетические средства (например, адсорбенты, включающие масляные абсорбенты в виде косметических глин и полимерных поглотителей), абразивных агентов, агентов против спекания, агенты против образования пены, дополнительные противомикробные агенты, связывающие вещества, агенты, придающие буферные свойства, агенты, придающие объем, косметические биоцидные агенты, дополнительные денатураты и агенты, повышающие проникновение (см. выше), косметические вяжущие агенты, наружные анальгетики, агенты, образующие пленку, агенты, придающие непрозрачность, отдушки, ароматические агенты, пигменты, красящие вещества, агенты, смягчающие кожу, средства регулировки рН, хелатообразующие агенты, агенты, поглощающие УФ свет, пластификаторы, консерванты, усилители консервантов,депилирующие агенты, агенты, способствующие отделению рогового слоя кожи, и средства, способствующие шелушению кожи, коллагены и продукты их распада, агенты, образующие пленку, и им подобные. Репрезентативные примеры таких материалов раскрыты в публикациях Harry's Cosmetology, 7th Ed.,HarryWilkinson (Hill Publishers, London 1982); Pharmaceutical Dosage Forms - Disperse Systems; Lieberman, RingerBanker, Vols. 1 (1988) 2 (1989); Marcel Decker, Inc.; The Chemistry and Manufacture ofCosmetics, 2nd Ed., deNaverre (Van Nostrand 1962-1965) и The Handbook of Cosmetic Science and Technology, 1st Ed. KnowltonPearce (Elsevier 1993). В других вариантах реализации композиции для применения в соответствии со способами изобретения также включают композиции, имеющие гидрофильную и гидрофобную фазу. Не ограничивающие примеры подходящих компонентов неестественной гидрофобной фазы включают: (i) нетоксичные и неканцерогенные смеси жидких углеводородов, полученных из нефти (64, 65); (ii) нетоксичную, неканцерогенную коллоидную систему не линейные твердые углеводороды и жидкие углеводороды с высокой температурой кипения, в которых большинство жидких углеводородов являются мицеллярными (64, 66,67); (iii) нетоксичные и не канцерогенные линейные и разветвленные углеводороды, имеющие от около 7 до около 40 атомов углерода, например додекан, изододекан, сквалан, холестерин, гидрированный полиизобутилен, докозан (т.е. С 22 углеводород), гексадекан, изогексадекан (Permethyl. RTM 101A, Presperse,South Plainfield, N.J.), и им подобные; (iv) нетоксичные и неканцерогенные C1-30 сложные эфиры спиртовC1-30 карбоновых кислот и С 2-30 дикарбоновых кислот, включая прямо- и разветвленно-линейные материалы, а также ароматические производные (например, диизопропилсебакат, диизопропиладипат, изопропилмиристат, изопропилпальмитат, метилпальмитат, миристилпропионат, 2-этилгексилпальмитат,изодецилнеопентаноат, ди-2-этилгексилмалеат, цетилпальмитат, миристилмиристат, стеарилстеарат,изопропилстеарат, метилстеарат, цетилстеарат, бегенилбегенрат, диоктилмалеат, диоктилсебакат, диизопропиладипат, цетилоктаноат, диизопропилдилинолеат; (v) нетоксичные и неканцерогенные моно-, ди- и триглицериды C1-30 карбоновых кислот, например каприловые/каприновые триглицериды, полиэтиленгликоль-6 каприловый/каприновый триглицерид, полиэтиленгликоль-8 каприловый/каприновый триглицерид; (vi) нетоксичные и неканцерогенные сложные эфиры алкиленгликоля C1-30 карбоновых кислот,например, сложные моно- и диэфиры этиленгликоля и сложные моно- и диэфиры пропиленгликоля C1-30 карбоновых кислот, например этиленгликольдистеарат; (vii) нетоксичные и неканцерогенные пропоксилированные и этоксилированные производные перечисленных выше материалов; и (viii) нетоксичные и неканцерогенные сложные C1-30 моно- и полиэфиры моносахаридов и олигосахаридов. Примеры жидких сложных эфиров, которые могут оказаться полезными в гидрофобной фазе, включают глюкозотетраолеат; сложные глюкозотетраэфиры жирных кислот (ненасыщенных) масла соевых бобов; сложные маннозотетраэфиры смешанных жирных кислот масла соевых бобов; сложные галактозотетраэфиры олеиновой кислоты; сложные галактозотетраэфиры олеиновой кислоты; сложные арабинозотетраэфиры линолевой кислоты; ксилозотетралинолеат; галактозопентаолеат; сорбиттетраолеат; сложные сорбитгексаэфиры ненасыщенных жирных кислот масла соевых бобов; ксилитпентаолеат; сахарозотетраолеат; сахарозопентаолеат; сахарозогексаолеат; сахарозогептаолеат; сахарозооктаолеат и их смеси. В других вариантах реализации композиции, подходящие для местного применения в соответствии с настоящим изобретением, включают композиции, имеющие альтернативные носители. Примеры альтернативных носителей включают поперечно-сшитые полимерные соединения, содержащие один или более мономеров, полученных из акриловой кислоты, и соли и сложные эфиры данных акриловых кислот и замещенных акриловых кислот, в которых поперечно-сшивающий агент содержит две или более межуглеродные связи и получен или из (i) гомополимерного многоатомного спирта акриловой кислоты,например, поперечно-сшитых гомополимеров мономера акриловой кислоты или его производного (например, замещенного C1-4 алкилом, -CN или -СООН), где акриловая кислота имеет заместители в двух и трех положениях углерода (например, акриловая кислота, метакриловая кислота, этакриловая кислота и их смеси); или (ii) поперечно-сшитый акрилатный сополимер, имеющий и мономер акриловой кислоты(или его производное), и мономер сложного акрилатного эфира C1-4 спирта (или его производное) и второй мономер, который представляет собой мономер сложного акрилатного эфира длинноцепочечного спирта (например, C8-40) (или его производное), например, акриловую кислоту, метакриловую кислоту,этакриловую кислоту и их смеси. Комбинации последних двух типов полимеров могут также оказаться полезными в определенных композициях для применения в соответствии со способами лечения изобретения. В дополнение к лечению заболеваний, таких как раковые поражения кожи, препараты данного изобретения можно применять для лечения широкого разнообразия дерматологических заболеваний или расстройств. Дерматологические заболевания могут представлять собой любое расстройство, связанное с кожей. Дерматологические заболевания включают, но не ограничиваются, дерматитными заболеваниями, такими как контактный дерматит, атопический дерматит, себоррейный дерматит, монетоподобный дерматит, хронический дерматит кистей и стоп, генерализованный эксфолиативный дерматит, дерматит вследствие стаза, илокализованный дерматит, связанный с расчесами, бактериальные инфекции кожи,такие как стафилококковые заболевания кожи, стафилококковый синдром обожженной кожи, рожистое воспаление, фолликулит, фурункулы, карбункулы, гнойный гидраденит, инфекции околоногтевых тканей и эритразма; поверхностные грибковые инфекции, такие как инфекции дерматофитами, инфекции дрожжевыми грибами, кандидоз и Tinea Versicolor; паразитические инфекции кожи, такие как чесотка,педикулез и гельминтозный дерматит; заболевания волосяных фолликулов и сальных желез, такие как угри, розовые угри, периоральный дерматит, гипертрихоз, облысение, псевдофолликулит волосистой- 15007075 кожи лица и кератиновая киста; шелушащиеся папулезные заболевания, такие как псориаз, розеолезный питириаз и плоский лишай; пролежни; доброкачественные опухоли и злокачественные опухоли. Дополнительную информацию в отношении способов получения композиций и препаративных форм и ингредиентов, включенных в композиции и препаративные формы в соответствии с настоящим изобретением, можно найти в стандартных ссылках в данной области, таких как, например, "Remington'sPharmaceutical Sciences" Mack Publishing Co., Easter, PA, 15th Ed. (1975). Настоящее изобретение также включает фармацевтические наборы, которые включают один или более контейнеров, содержащих фармацевтическую композицию, включающую терапевтически эффективное количество активного соединения. Такие наборы могут, кроме того, включать, при желании, один из различных обычных компонентов фармацевтического набора, таких как, например, контейнеры с одним или более фармацевтически приемлемым носителем, дополнительные контейнеры и т.д., что будет вполне очевидно для специалистов в данной области. В предпочтительном варианте реализации предоставлен набор для лечения рака у млекопитающего, включающий по меньшей мере один флакончик, содержащий -лапахон или его производное или аналог. В другом предпочтительном варианте реализации предоставлен набор для лечения опухоли у млекопитающего, включающий один или более флаконов,содержащих комплекс терапевтически эффективного количества -лапахона или его производного или аналога и фармацевтически приемлемого солюбилизирующего в воде носителя и, кроме того, включающий, внутри того же флакона или в отдельном флаконе, противораковое средство, в частности, производное таксана. Печатные инструкции, или в виде вкладышей, или в виде этикеток, указывающих количество компонентов, которые следует ввести, руководства по введению и/или руководства по смешиванию компонентов, также можно включить в набор. В настоящем описании следует понимать, что указанные определенные материалы и условия важны при осуществлении изобретения, но что не указанные определенные материалы и условия не исключаются до тех пор, пока они не препятствуют реализации благоприятных эффектов изобретения. Далее изобретение определено ссылкой на следующие примеры, которые не предназначены для ограничения диапазона притязаний, настоящего изобретения. Для специалистов в данной области будет очевидно, что можно осуществить много модификаций и в материалах, и в способах, без отхода от цели и интереса изобретения. Примеры 1. Оценка приемлемых систем растворителей, которые, как известно, солюбилизируют гидрофобные лекарственные субстанции. а. Получение раствора -лапахона и гидроксипропилциклодекстрина (HPBCD). Различные фармацевтически приемлемые системы растворителей, которые, как известно, солюбилизируют гидрофобные лекарственные субстанции, оценивали -лапахоном. Как показано ниже в табл. 5, несколько оценивавшихся растворов представляли собой растворы, в которых была достигнута соответствующая целевая минимальная концентрации (10 мг/мл). Однако ни одну из данных систем нельзя было разбавить в 5 раз стерильным солевым раствором без значительного осаждения -лапахона из раствора. Кроме того, большинство из указанных совместных растворителей и поверхностно-активных агентов имеют свои собственные проблемы токсичности и переносимости, с которыми необходимо справляться во время введения высокой дозы. Таблица 5 разведенный в 0,9% солевом растворе В свете представленного выше, использовали две различные стратегии для усиления растворимости-лапахона в водном растворе. Сначала -лапахон обрабатывали металлическими хелатообразующими агентами, такими как кальций и магний, для формирования растворимых комплексов; во-вторых, лапахон обрабатывали солюбилизирующими агентами -циклодекстрином и -циклодекстрином для об- 16007075 разования растворимых комплексов включения. Для оценки указанных четырех реагентов меченый С 14-лапахон в маленьком объеме этанола добавляли в водные растворы реагентов (или в буфер PBS в качестве контроля), затем измеряли относительную растворимость -лапахона в каждом из растворов с точки зрения радиоактивности, остающейся в надосадочной жидкости после центрифугирования. В частности, в отдельные пробирки Эппендорфа емкостью 1,5 мл, содержащие 900 мкл буфера PBS,добавляли следующее: 8 ммоль CaCl2 в буфере PBS, 8 ммоль MgCl2 в буфере PBS, 8 ммоль циклодекстрина в буфере PBS, и 8 ммоль -циклодекстрина в буфере PBS. Затем в каждую пробирку добавляли 10 мкл меченого С 14 -лапахона (40000 имп/мин, 0,55 мкг) в 75% этаноле. После перемешивания вихревой мешалкой и центрифугирования при 13000 об./мин в течение 10 мин, производили подсчет для выявления реактивности в 100 мкл раствора надосадочной жидкости с использованием сцинтилляционного счетчика Beckman. В оставшуюся смесь добавляли 0,5 мкг (50 мкл раствора в концентрации 10 мг/мл) или 600 мкг -лапахона в 75% этаноле. После перемешивания вихревой мешалкой и центрифугирования при 13000 об./мин в течение 10 мин, производили подсчет для выявления реактивности в 100 мкл раствора надосадочной жидкости. При добавлении 0,5 мкг -лапахона почти 100% -лапахона присутствовали в надосадочной жидкости во всех пяти водных растворах. Однако при добавлении 600 мкг -лапахона только раствор циклодекстрина удерживал более 50% -лапахона в надосадочной жидкости. Процентное содержание меченого -лапахона в надосадочной жидкости определяли подсчетом на сцинтилляционном счетчике. Фиг. 1 иллюстрирует относительную устойчивость -лапахона в водных растворах различных солюбилизирующих агентов. На фиг. 1 раствор 1 состоял из буфера PBS, раствор 2 состоял из 8 ммоль СаСl2 в буфере PBS, раствор 3 состоял из 8 ммоль MgCl2 в буфере PBS, раствор 4 состоял из 8 ммоль циклодекстрина в буфере PBS, и раствор 5 состоял из 8 ммоль -циклодекстрина в буфере PBS.b. Воздействие концентрации гидроксипропилциклодекстрина (HPBCD) на растворимость лапахона. Ввиду того, что -циклодекстрин подходит для перорального, но не для парентерального или местного применения, его аналог HPBCD выбрали для дальнейшего исследования. Для исследования воздействия концентрации HPBCD на растворимость -лапахона, -лапахон в маленьких объемах этанола добавляли в 8 водных растворов с различными концентрациями HPBCD (0-16 ммоль или 0-25%(мас./мас., затем относительную растворимость определяли измерением процентного содержания радиоактивности, остающейся в надосадочной жидкости после центрифугирования. Для устранения возможного воздействия этанола и определения того, можно ли сохранить усиление растворимости после лиофилизации, смеси лиофилизировали, а затем повторно растворяли в тот же объем воды. Процентное содержание -лапахона в надосадочной жидкости повторно растворенной смеси измеряли для обеспечения полной повторной солюбилизации лиофилизированного материала. В частности, в отдельные пробирки Эппендорфа емкостью 1,5 мл добавляли достаточное количество воды, 50 ммоль раствора HPCD, раствора -лапахона, меченого С 14, в 75% этаноле, 10 мг/мл раствора После перемешивания вихревой мешалкой и центрифугирования при 13000 об./мин в течение 10 мин производили подсчет для выявления реактивности в 100 мкл раствора надосадочной жидкости с использованием сцинтилляционного счетчика Beckman. Остальные смеси (900 мкл) лиофилизировали, а затем повторно растворяли в 900 мкл воды. После перемешивания вихревой мешалкой и центрифугирования при 13000 об./мин в течение 10 мин, снова производили подсчет для выявления реактивности в 100 мкл/мл надосадочной жидкости из каждой пробирки. На фиг. 2 показано, что растворимость -лапахона с увеличением концентрации HPBCD и что лапахон можно полностью повторно солюбилизировать после лиофилизации. с. Получение раствора -лапахона b гидроксипропилциклодекстрина (HPBCD) нагреванием.- 17007075 Раствор -лапахона/HPBCD получали без предварительной солюбилизации -лапахона в растворе этанола. -лапахон комбинировали с водными растворами HPBCD при меняющихся концентрациях и смесь нагревали до 70 С, затем давали ей возможность охладиться до комнатной температуры. Охлажденные растворы фильтровали (0,22 мкм) и количество солюбилизированного -лапахона измеряли анализом ВЭЖХ. Растворимость -лапахона в различных растворах HPBCD представлена в табл. 7. Таблица 7 Максимальную концентрацию 19,7 мг/мл -лапахона достигали в 50% растворе HPBCD (самая высокая испытанная концентрация). Добавление солевого раствора или этанола значимо не усиливало растворимость -лапахона в HPBCD.d. Анализ ВЭЖХ и УФ измерение раствора -лапахона в 75% этаноле и водном растворе комплекса-лапахона-HPBCD. Получали растворы -лапахона с концентрацией 5 мкг/мл для ВЭЖХ и УФ анализа разбавлением водой или этаноловых растворов с концентрацией 200 мкг/мл или растворов HPBCD с концентрацией 5 мг/мл. УФ измерения при 258 нм выполняли с использованием обычных процедур при 2% этаноле или 200 мг/мл HPBCD в качестве эталонных растворов. Для анализа ВЭЖХ 100 мкл полученный в результате раствор 5 мкг/мл -лапахона инъецировали в С 18 обращенно-фазовую аналитическую колонку, и наносили линейный градиент от 25 до 75% в буфера через 10 мин при скорости потока 1 мл/мин. Пики выявляли поглощением УФ при 258 нм и количественно характеризовали соотношением между площадью пика и внешними стандартами.max для -лапахона наблюдали при 258 нм по УФ спектру. УФ измерения раствора -лапахона при 258 нм проявили коэффициент погашения света 26620. Моль-1 см-1 и для одного -лапахона, и для комплекса -лапахона-HPBCD. На фиг. 3 показана типичная хроматограмма ВЭЖХ раствора -лапахона 5 мг/мл в 20% HPBCD,разведенном до 5 мкг/мл в воде для анализа ВЭЖХ. -лапахон элюируется приблизительно через 5,4 мин. Хроматограмма не показала различия величин времени удерживания и максимальных интеграционных площадей между одним -лапахоном при концентрации 5 мкг/мл в воде и сравнимым комплексом лапахона-HPBCD при концентрации 5 мкг/мл. Данные результаты свидетельствуют о том, что -лапахон не образует комплексы с HPBCD в низких концентрациях (т.е. 5 мкг/мл). Когда увеличивающиеся количества HPBCD добавляли в раствор -лапахона-HPBCD при концентрации 5 мкг/мл, анализ ВЭЖХ показал, что максимальное элюирование при незаполненном объеме колонки (время удерживания приблизительно 1,2 мин) и, как предполагали, представляло собой комплекс -лапахона-HPBCD, увеличивалось в размере при соответствующем уменьшении пика -лапахона. Однако в условиях анализа, разработанных для количественного определения -лапахона, которое требует разведения до 5 мкг/мл, интеграция пика приблизительно через 5,4 мин обеспечивает точное количественное определение общего содержания лапахона в растворе. е. Устойчивость -лапахона. Мониторинг устойчивости растворов -лапахона или в 75% этаноле, или в виде водного комплекса-лапахона-HPBCD проводили анализом ВЭЖХ. При хранении в темноте при комнатных температурах,раствор -лапахона-HPBCD проявил значимо лучшую устойчивость, чем этаноловый раствор. РастворHPBCD не имел выявляемых пиков продуктов распада после 5 д. хранения и одиночный пик продуктов распада приблизительно на уровне 0,1% при времени удерживания 3,28 мин после 21 д. хранения. Для сравнения, этаноловые растворы, хранившиеся в темноте, проявили значительную потерю пика лапахона после 5 д. хранения. Значимое усиление устойчивости также наблюдали для раствора лапахона-HPBCD, по сравнению с -лапахоном в 75% растворе этанола, когда оба раствора подвергали воздействию света при обычной комнатной яркости при комнатной температуре. Однако раствор лапахона-HPBCD еще значимо разлагался при воздействии света, причем продукты распада включали 3,4% общей площади пика к 21-му дню воздействия света. Было показано, что механизм распада -лапахона в спиртовых растворах включает фотовосстановление в относительно устойчивый, полувосстановленный радикал хинона (Ci, Xiohong, et al., J. Am.Chem. Soc. 1989: 111, 1337-1343). В указанных выше исследованиях первичный продукт распада в этаноловом растворе был идентифицирован как восстановленная (гидрохиноновая) форма -лапахона посредством сравнений времени удерживания с продуктом, полученных восстановлением -лапахона боргидридом натрия. Данный вид, который элюируется приблизительно через 6,9 мин, не был выявлен в растворах HPBCD -лапахона, который, как представляется, проявляют другой путь распада. 2. Лиофилизация раствора комплекса -лапахона/HPBCD. Образцы раствора комплекса -лапахона/HPBCD получали в соответствии с процедурой, изложенной в примере 1 а и 1 с. Образцы переносили в контейнеры для лиофилизации и предварительно охлаждали до -40 С в течение 2 ч. Вакуум подавали в контейнер на 12-20 ч в зависимости от образца (образцов)(количество, размер, состав и другие свойства и характеристики образцов) для предоставления лиофилизированного продукта. Лиофилизированный образец (образцы) растворяли 5,9 мл деионизированной воды при перемешивании для предоставления -лапахона в концентрации 10 мг/мл. Результаты испытанных образцов показаны в табл. 8. Таблица 8 Испытанная система -лапахона/HPBCD (все в концентрации 80 мг/флакон) На основании указанных результатов, HPBCD 40%-лапахон 10 мг/мл выполнял требование для разведения от 10 до 100 раз. Если раствор устойчив в условиях хранения, то он представляет собой подходящий раствор для парентерального введения без лиофилизации. Если предпочтительна лиофилизация, было продемонстрировано, что HPBCD 20% -лапахон 5 мг/мл является хорошим выбором для быстрой лиофилизации и относительно быстрого растворения. 3. Исследование in vitro -лапахона в комбинации с таксолом. Было показано, что микромолярные концентрации -лапахона полностью устраняют образование колоний при нанесении на культуры опухолевых клеток в комбинации с уровнями таксола, равными ИК 50. В данных исследованиях экспоненциально растущие клетки исследовали при 1000 клетках на лунку в шестилуночных планшетах и давали возможность прикрепиться в течение 48 ч. В лунки добавляли-лапахон и/или таксол, солюбилизированный в ДМСО. Контрольные лунки обрабатывали эквивалентными объемами ДМСО. Через 4 ч клетки промывали и добавляли свежую среду. Культуры наблюдали ежедневно в течение 10-20 д., а затем фиксировали и окрашивали. Колонии, содержащие более 30 клеток, оценивали в баллах как выжившие. Как показано на фиг. 4, синергическое ингибирование выживания раковых клеток наблюдали для широкого спектра клеток различных гистотипов карциномы человека, включая линии клеток яичников, молочных желез, предстательной железы, меланомы, легких и поджелудочной железы. -лапахон или таксол отдельно были гораздо менее эффективны при уменьшении формирования колоний раковых клеток. С помощью анализов МТТ и исключения трипана синего было показано, что сниженное выживание клеток было вызвано гибелью клеток. Формирование ступенчатых структур ДНК и окрашивание аннексина указали на то, что гибель клеток была вызвана апоптозом. Межлекарственное взаимодействие между -лапахоном и таксолом далее оценивали на двух линиях клеток опухолей яичников, OVCAR-3 и MDAH-2774, с использованием анализа изоболограммы. Определяли отдельные величины ИК 50 для каждого препарата, а затем комбинации указанных двух препаратов при фиксированных взаимоотношениях их концентраций ИК 50 наносили на клетки. После 4 дневного непрерывного контакта определяли жизнеспособность клеток анализом МТТ. Как показано на фиг. 5, 6 и 7, тип синергического уничтожения клеток был продемонстрирован комбинацией указанных двух препаратов на данных линиях клеток. На фиг. 5 при интерпретации комбинационных кривых проводили статистические сравнения с каждой испытываемой комбинацией и конечными точками (100% -лапахона и 100% таксола) . Статистически значимое наблюдение требует, чтобы различие существовало между величиной спектральной по- 19007075 глощательной способности комбинации (-лапахона и таксола) и обеими конечными величинами (отдельно -лапахона или таксола). Если большинство величин (3 из 5) статистически (р 0,05) ниже линии, то описана синергия. На фиг. 6 показано, что комбинация лекарственных препаратов значимо отличалась (р 0,05) от каждого препарата отдельно в 3 из 5 оценивавшихся комбинациях. На фиг. 7 показано,что комбинация препаратов значимо более цитотоксична (р 0,05), чем каждый препарат отдельно в 5 из 5 оценивавшихся комбинациях. Было также показано, что -лапахон активен против линий клеток, устойчивых к цис-платине. Линия клеток яичников A2780DDP высоко устойчива к цис-платине (цис-платину) при концентрации ИК 50 для цисплатина обычно 100 мкмоль. Как показано на фиг. 8, -лапахон в качестве единственного средства одинаково цитотоксичен и для высоко устойчивой линии, и для родительской линии, из которой она получена (клетки A2780s). При испытании -лапахона против клеточных линий, устойчивых к цисплатину, клетки подвергали воздействию растворов -лапахона в течение 4 ч, затем клетки промывали и добавляли свежую среду. Культуры наблюдали ежедневно в течение 10-20 д., а затем фиксировали и окрашивали. Колонии более 30 клеток оценивали в баллах как выжившие. 4. Исследования in vivo -лапахона в комбинации с таксолом. Раковые клетки яичников человека (36 М 2, первоначально выделенные из злокачественного асцита) инокулировали внутрибрюшинной инъекцией бестимусным самкам голых мышей через 24 ч после облучения. На данной модели метастатические очаги формируются приблизительно через 1 нед. после инокуляции, а опухолевые узлы брюшины и злокачественный асцит развиваются через 4-5 нед. Через 10 д. после инокуляции опухоли (10 х 106 клеток) начинали схемы лечения. Контрольную группу лечили только носителем. При каждом типичном цикле лечения группу, получавшую только -лапахон, лечили внутрибрюшинным ведением -лапахона в дозе 25-30 мг/кг в растворе липиодола, а группу, получавшую только таксол, лечили внутрибрюшинным введением в дозе 1 мг/кг (состав таксола, разведенный в липиодоле), в обоих случаях с последующей внутрибрюшинной инъекцией носителя через 24 ч. В группе, получавшей комбинацию, голых мышей лечили -лапахоном в дозе 25-50 мг/кг с последующим введением через 24 ч таксола в дозе 1 мг/кг. Все группы лечили в течение 10 циклов с 1-дневным перерывом между каждым циклом. Мышей забивали через 2 нед. после последнего цикла лечения (на 50-й день) для оценки противоопухолевой активности. Токсичность для хозяина оценивали по общему внешнему виду и массе тела. На фиг. 9 показаны репрезентативные результаты по одному из трех независимых экспериментов лечения, в каждой по 6 мышей на группу. Уменьшение количества опухолей в сравнении с контролем было достаточно выраженным при применении одного -лапахона (75%). У мышей, получавших лечение одним таксолом, проявился слегка меньший эффект (60%), и у обеих групп проявилось значимое уменьшение размера и количества опухолевых узлов и количества асцита. У животных, получавших лечение -лапахоном плюс таксолом, при лапоротомии асцит не наблюдали, и брюшина была чистой, за исключением наличия от нуля до трех очень маленьких очагов на мышь. Указанные очаги подсчитывали в качестве опухолевых узлов, хотя они оказались фиброзными рубцами. Мыши, получавшие лечение комбинированной схемой, выглядели здоровыми и не теряли массу тела в течение всего периода лечения, и при вскрытии не были отмечены макроскопические отклонения от нормы во внутренних органах. Аналогичное исследование на модели ксенотрансплантата яичников человека выполнили, сравнивая -лапахон в растворе HPBCD с -лапахоном в растворе липиодола. Как и в предыдущем исследовании, лечение начинали через 10 д. после внутрибрюшинной инокуляции 10106 клеток рака яичников человека 36 М 2 бестимусным самкам голых мышей, по 8 на группу (животных не облучали перед инокуляцией опухоли). Контрольную группу лечили одним носителем. При каждом типичном цикле лечения группы, получавшие только -лапахон, лечили внутрибрюшинным ведением -лапахона в дозе 25 или 10 мг/кг -лапахона в растворе HPBCD, а группы, получавшие только таксол, лечили внутрибрюшинным ведением таксола в дозе 1 мг/кг (композиция, разведенная в липиодоле), в обоих случаях с последующей внутрибрюшинной инъекцией носителя через 24 ч. В двух группах, получавших комбинацию, мышей лечили -лапахоном в HPBCD в дозе или 25, или 10 мг/кг с последующим введением через 24 ч таксола в дозе 1 мг/кг. Третьей группе, получавшей комбинацию, вводили -лапахон в липиодоле в дозе 25 мг/кг с последующим введением через 24 ч таксола в дозе 1 мг/кг. Все группы лечили в течение 6 циклов с 1-дневным перерывом между каждым циклом. Мышей забивали приблизительно на 50-й день (приблизительно через 4 нед. после последнего лечения) для оценки противоопухолевой активности. На фиг. 10 показаны результаты данного исследования. У мышей, получавших лечение лапахоном в растворе HPBCD, проявилось такое же уменьшение количества опухолевых узлов, как и у мышей, получавших лечение сравнимым уровнем -лапахона в растворе липиодола. Мощную противоопухолевую активность также продемонстрировали у самок голых мышей, несущих ксенотрансплантаты рака молочной железы человека (линия клеток MCF-7). Лечение мышей начинали после того, как подкожные опухолевые узлы достигали 0,5 см в диаметре. Как показано на фиг.- 20007075 11, у мышей, получавших 6 циклов -лапахона (50 мг/кг внутрибрюшинно в растворе липиодола) и таксола (1 мг/кг внутрибрюшинно, через 24 ч после введения дозы -лапахона), проявилось резкое уменьшение объема опухоли по сравнению с контрольными мышами. Кроме того, опухоли у получавших лечение мышей не увеличивались в размере, по данным наблюдения. На фиг. 11 объем подкожного ксенотрансплантата опухоли показан на диаграмме А, а масса тела мышей, измеренная в течение 6 нед. после прекращения лечения, показана на диаграмме В. 5. Исследование композиции -лапахона в интралипиде. Готовили концентрат -лапахона 10 мг/мл в этаноле. Концентрат разбавляли в 5 раз для предоставления общего объема 100-500 мкл. Раствор -лапахона с концентрацией 2 мг/мл готовили в 10% интралипиде капельным добавлением этанолового раствора в интралипид при перемешивании вихревой мешалкой. Не наблюдали непосредственных доказательств осаждения или расщепления эмульсии. Данную процедуру повторяли, причем концентрат разбавляли в 10 раз для приготовления раствора-лапахона с концентрацией 1 мг/мл в 10% интралипиде. Раствор этанола добавляли по каплям в интралипид при перемешивании вихревой мешалкой. Не наблюдали непосредственных доказательств осаждения или расщепления эмульсии. Через 3 д. в препарате с концентрацией 2 мг/мл имелись кристаллы, а в препарате с концентрацией 1 мг/мл изменения не проявлялись. Через 6 д. в препарате с концентрацией 1 мг/мл изменения еще не проявлялись. 6. Ингибирование аналога -лапахона одним агентом. Несколько предпочтительных аналогов и производных -лапахона в соответствии с настоящим изобретением, а также аналог дунниона и 4-гексаноилокси-1,2-нафтохинона (как указано ниже, см. иллюстрации на фиг. 12) оценивали для выявления ингибирующей рост активности, по сравнению с лапахоном (СО-501) на шести линиях клеток рака человека: А 2780 и А 2780/СР (яичников); NCF-7 (молочной железы); НТ-29 (толстой кишки); ВхРС-3 (поджелудочной железы) и А 549 (легких). Линии клеток опухолей человека (закупленные в компании АТСС, Rockville, MD) в среде RPMI (RPMI; Nova Tech,Grand Island, NY), содержащей 10% плодную бычью сыворотку (FBA, Nova Tech). Аликвотные количества высевали в каждую лунку 96-луночных титрационных микропланшет в конечной концентрации 104 клеток/лунку и инкубировали в течение 24 ч перед контактом с испытуемыми соединениями. Ингибирующую рост активность растворов ДМСО каждого соединения измеряли анализом MTS через 4 ч лечения с последующей 24-часовой инкубацией в среде, лишенной препарата. Анализ MTS представляет собой калориметрический анализ, основанный на способности жизнеспособных клеток превращать MTS,новое соединение тетразолия и соединяющий электроны реагент, в окрашенный формазановый продукт,который растворим в среде для культуры клеток. Затем концентрацию клеток определяют измерением спектральной поглощательной способности формазанового продукта при 490 нм. Ингибирование роста,выраженное в виде ИК 50, рассчитывают относительно контрольных клеток, обработанных носителем. Результаты 3 отдельных анализов, каждый из которых включал 3 повторения для каждого уровня дозы,показаны ниже в табл. 9. Как ожидалось, наблюдали зависимый от дозы ингибирующий эффект -лапахона (СО-501) во всех шести линиях опухолевых клеток. Аналог думниона (СО-506) проявил профиль активности, аналогичный СО-501, как прогнозировалось по литературе. Из трех аналогов и производных -лапахона СО-504(4-ацетокси -лапахон) также был очень похож на СО-501 по ингибирующей активности; СО-503 (4 гидрокси -лапахон) был значимо менее активным по всем линиям клеток; и СО 505 был неактивен (ингибирование роста не наблюдали при концентрациях, достигающих 20 мкмоль). СО-507, производное нафтохинона, также было неактивно.- 21007075 Таблица 9 Ингибирующая рост активность -лапахона (СО-501) и пяти аналогов и производных Отсутствие ингибирования роста при концентрации до 20 мкмоль 7. Испытание in vivo -лапахона у мышей Bg-Nu-Xid. Химические вещества. -лапахон синтезировали и растворяли в 40% гидроксипропил циклодекстрине в концентрации 10 мг/мл и держали при комнатной температуре в темном контейнере. Гидроксипропил -циклодекстрин растворяли в дистиллированной воде в концентрации 10 мг/мл и держали при комнатной температуре. MATRIGEL, матрицу основной мембраны, закупали у компании-20 С. MATRIGEL экстрагируют из мышиной опухоли Engelberth-Holm-Swarm, опухоли, богатой внеклеточными матричными белками. Основными матричными компонентами являются ламинин, коллагенIV, энтацин и гепарансульфатпротеогликан (перлекан); матрица также содержала ростовые факторы,матричные металлопротеиназы (ММР [коллагеназы]) и активаторы плазминогена без каких-либо ингибиторов металлопротеиназ (TIMP). Матрица MATRIGEL представляет собой раствор при 4 С и загустевает при комнатной температуре с образованием трехмерной восстановленной основной мембраны. Данная модельная система близко имитирует структуру, состав, физические свойства и функциональные характеристики основной мембраны in vitro и предоставляет физиологически релевантную окружающую среду для исследований клеточной морфологии, биохимической функции, миграции или инвазии и экспрессии генов. Замороженную матрицу MATRIGEL оттаивали в течение ночи при 4 С перед использованием. Культуры клеток. Клетки RPM18226 (линия клеток множественной миеломы человека) были предоставлены д-ром Willam Dalton (Lee Moffit Cancer Center, Tampa, FL). Их сохраняли частыми пассажами в среде RMPI 1640 (Cellgro, Mediatech Inc., Herndon, VA), содержащей 10% плодную бычью сыворотку- 23007075 культуры клеток площадью 162 см 2 (Costar, Corning Incorporated, Corning, NY). Экспоненциально растущими линиями клеток были CD138+,CD38+/CD45RA-, EBV отрицательные и лишенные патогенов. Мыши. 40 Cамцов 6-недельных мышей Bg-Nu-Xid (с дефицитом клеток Т, В и естественных киллеров) получали у компании FCRDC, Frederick, Bethesda, MD и содержали в виварии Redstone в DFCI. У данных мышей было 3 отдельных мутации - аутосомная рецессивная мутация Biege (Bg), связанная с нарушенным хемотаксисом и подвижностью макрофагов и недостаточность клеток-естественных киллеров (NK); голая (nu) аутосомная рецессивная мутация, связанная с истощением запаса Т клеток вследствие агенеза тимуса, и сцепленный с X хромосомой иммунный дефект (xid), который вызывает функциональные дефекты В лимфоцитов. Животных растили в огражденном помещении в клетках с подстилкой из древесных опилок и ламинарным воздушным потоком при 19-22 С. Корм для грызунов и стерильную питьевую воду подавали без ограничений. Мышей держали в течение карантинного периода для выявления развития любого заболевания. Одна мышь погибла во время транспортировки, а 5 других были потеряны ввиду дегидратации (n=2), возможной инфекции (n=2) и чрезмерного кровотечения вследствие травмы (n=1). Через 1 нед. в питьевую воду всех мышей добавляли энрофлоксацин (хинолоновый антибиотик). Все процедуры с вовлечением животных были одобрены и выполнялись в соответствии с руководствами Институтского комитета по уходу и использованию животных Института рака Дана Фарбера (DFCI). Гистологический анализ. Мышей забивали, когда опухоль достигала 20 мм в их самом большом диаметре, или они становились погибающими в соответствии с политикой Протокольного комитета по животным в Институте рака Дана Фарбера. Мышей анестезировали изофлюраном и брали кровь позади глазных яблок. Мышей забивали смещением шейных позвонков. Опухоли препарировали от мягких тканей (фасции, мышцы, кожи и т.д.) и фиксировали в 10% нейтрализованном формалине. Печень, селезенку, почки, легкие, сердце и мозг у каждого животного также удаляли и фиксировали в формалине. Ткани обезвоживали и заливали в парафиновые блоки. Готовили их срезы толщиной 5 мкм, окрашивали гематоксилином и эозином (НЕ) и исследовали световой микроскопией для выявления свидетельств апоптоза. Статистический анализ. Статистический анализ проводили с использованием t критерия Стьюдента для сравнения различий объемов опухолей и степени апоптоза между группой -лапахона и контрольной группой. Величину р 0,05 считали значимой. Структура исследования. 34 Мыши инокулировали в исследовании. Клетки множественной миеломы RPMI 8226 (3107) промывали 3 раза, повторно суспендировали в 100 мкл RPMI 1640 и инъецировали подкожно в правый бок всех мышей наряду со 100 мкл матрицы MATRIGEL с использованием иглы для подкожных инъекций 27 калибра и 1 мл шприца. Мышей ежедневно наблюдали для выявления хорошего самочувствия и развития опухолей и еженедельно взвешивали. Локализованные пальпируемые опухоли развились у всех мышей (n=34) в среднем к 7-му дню после инъекции клеток RPMI 8226. Как только наличие опухолей можно было определить пальпацией, их ежедневно измеряли в 2 ортогональных диаметрах верньерным циркулем. 31 Мышь методом случайной выборки включили в группу -лапахона (n=16) и контрольную группу (n=15). Мыши в контрольной группе получали 50 мг/кг массы тела 40% раствора гидроксипропилциклодекстрина внутрибрюшинно в нижнюю левую область брюшной полости через день. Мыши в группе -лапахона получали -лапахон в 40% раствора гидроксипропилциклодекстрина внутрибрюшинно в дозе 50 мг/кг массы тела через день (фиг. 13). Обычный объем при каждой инъекции составил 125 мкл. Регистрировали диаметры опухолей, и объемы рассчитывали с использованием стандартной формулы для цилиндрических объектов,т.е. 0,523(меньший диаметр)2 больший диаметр. Мышей забивали, когда опухоль была 20 мм в большем диаметре или когда они начинали погибать. Данная мышиная модель с ксенотрансплантатом является привлекательной, потому что она легко устанавливается, обеспечивает возможность мониторинга роста подкожных опухолей наружными измерениями, и ее можно использовать для изучения эффектов различных химиотерапевтических средств. Быстро растущие опухоли могут проявлять некоторые зоны апоптозы/некроза, но по опыту авторов изобретения это не было серьезным препятствием при оценке цитотоксичности различных новых потенциальных терапевтических средств. Сообщалось, что на аналогичных моделях использовали моноклональные антитела против gpl30 (B1+12) для исследования роста и иммортализации клеток у пациентов с множественной миеломой (Reme et al. Br J Haematol 114:406, 2001) и с использованием антитела РМ 1 против человеческих IL-6R и антитела МН 166 против человеческого IL-6 для ингибирования роста зависимой от IL-6 линии клеток (S6B45) (Suzuki et al. Eur J Immunol 22:1989, 1992). Ранее сообщали о различных экспериментальных моделях для испытания терапевтических средств для лечения множественной миеломы (Gado et al. Haematologica 86:227, 2001; Dallas et al. Blood 93:1697, 1999; Manning et al. Immunol Cell Biol 73:326, 1995; Takura et al. Cancer Res 26:2564, 1996; Potter et al. J Exp Med 161:996, 1985;Yaccoby et al. Blood 92:2908, 1998; Urashima et al. Blood 90:754, 1997). Определение токсичности -лапахона и циклодекстрина. Мыши в обеих группах хорошо переносили -лапахон и гидроксипропилциклодекстрин. Ни одна мышь не погибла ни в одной группе, и все- 24007075 прибавили в массе тела (фиг. 14). Не было доказательств выраженной токсичности -лапахона или гидроксипропилциклодекстрина в любой когорте. У одной мыши развилось ятрогенное внутрибрюшинное кровоизлияние после инъекции -лапахона, которое разрешилось через 36 ч. Обнаружили также незначительную канальцевую вакуолизацию почек и в группе -лапахона, и в контрольной группе. Поскольку данный эффект присутствовал в обеих группах, его связывают с гидроксипропил-циклодекстрином, как ранее сообщали по поводу циклодекстринов (Frank et al. Am J Pathol 83:367, 1976),и указанные нефротоксические изменения обратимы с прекращением лечения (Donaubauer et al. RegulToxicol Pharmacol 27:189, 1998). Воздействия -лапахона на объем опухоли. Мыши в контрольной группе получали максимум 6 доз гидроксипропилциклодекстрина, тогда как мыши в группе -лапахона могли получить максимум 8 доз данного средства. Имелось статистически значимое уменьшение объема опухоли у мышей в группе-лапахона (р=0,007) в сравнении с контрольной группой (фиг. 15) к 11-му дню. Важно, что выживание было больше на 5, 7, 9, 11, 13, 15 и 17 д. в группе -лапахона по сравнению с контролями (фиг. 16), что свидетельствует о более медленном росте опухолей в группе -лапахона. Гистологическое окрашивание. Гистологическое исследование выявило, что опухоли не были инкапсулированными и были местно инвазивными в мягкие ткани, включая мышцы, без каких-либо отдаленных метастазов. Опухоли васкуляризировались кровеносными сосудами мышиного происхождения с небольшой вариабельной степенью (0-10%) гибели клеток, в первую очередь, в их ядрах. Апоптоз оценивали патогистологически на основании (1) конденсации хроматина и агрегации около ядерной мембраны с изогнутостью ядерной мембраны; (2) увеличенного и патологически зернистого ядра; (3) сморщивания и округления клеток; (4) вакуолизации клеточных мембран и (5) небольшого расширения эндоплазматического ретикулума и митохондрий. Наблюдалось статистически значимое увеличение апоптоза клеток ММ (р=0,001) в опухолях в группе -лапахона (средняя величина + стандартное отклонение = 41,1%12,7) в сравнении с контрольной группой (средняя величинастандартное отклонение = 20,0%10,4), по данным оценки двух производивших оценку слепым методом наблюдателей с использованием световой микроскопии (фиг. 17 А). Не было микроскопических доказательств какого-либо токсического действия -лапахона или гидроксипропилциклодекстрина на печень, сердце, легкие, мозг и селезенку у мышей и в группе лапахона, и в контрольной группе (фиг. 17 В, С, D, E, F). В почках мышей в обеих группах проявлялась незначительная канальцевая вакуолизация, свидетельствующая о токсическом действии гидроксипропилциклодекстрина на канальцы (фиг. 17G, Н). Не ожидают, что данная токсичность будет наблюдаться при предполагаемых лечебных дозах у людей на основании ранее использовавшихся лекарственных препаратов, композиция которых была составлена в HPBCD. Данные результаты указывают на то,что композиция -лапахона в HPBCD безопасна и эффективна в ингибировании роста опухолевых клеток, связанном с удлинением выживания хозяина in vivo. Следовательно, можно сделать вывод, что бета перекрытие обладает значимой противоопухолевой активностью с минимальной токсичностью, и его можно применять для лечения множественной миеломы in vivo. Эквиваленты Несмотря на то, что были подробно раскрыты конкретные варианты реализации, это было сделано путем примера только в целях иллюстрации и не предназначено быть ограничивающим в отношении диапазона притязаний прилагаемой ниже формулы изобретения. В частности, авторы изобретения предусматривают, что в изобретение могут быть внесены различные замены, изменения и модификации без отхода от сущности и диапазона притязаний изобретения, как определено формулой изобретения. Представленная формула изобретения является репрезентативной для раскрытых здесь изобретений. Предусматриваются также другие незаявленные изобретения. Следует понимать, что чертежи необязательно изображены в масштабе, но они являются просто концептуальными по природе. Заявители оставляют за собой право охватить такие изобретения в более поздних формулах изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, включающая терапевтически эффективное количество лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель. 2. Фармацевтическая композиция по п.1, которая включает комплекс или раствор терапевтически эффективного количества -лапахона или его производного или аналога и фармацевтически приемлемого водорастворимого носителя. 3. Фармацевтическая композиция по п.1 или 2, которая представляет собой водный раствор. 4. Фармацевтическая композиция по п.1, в которой фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80,этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, циклодекстрина или его аналогов, -циклодекстрина или его аналогов и -циклодекстрина или его аналогов.- 25007075 5. Фармацевтическая композиция по п.4, в которой водорастворимый носитель представляет собой-циклодекстрин. 6. Фармацевтическая композиция по п.5, в которой -циклодекстрин представляет собой гидроксипропилциклодекстрин. 7. Фармацевтическая композиция по п.3, в которой концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 8. Фармацевтическая композиция по п.1, в которой терапевтически эффективное количество лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель представлены в виде эмульсии. 9. Фармацевтическая композиция, включающая терапевтически эффективное количество лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель,которая при разведении водным раствором для парентерального введения остается, по существу, растворимой в водном растворе. 10. Фармацевтическая композиция по п.9, в которой терапевтически эффективное количество лапахона или его производного или аналога находится в комплексе с фармацевтически приемлемым водорастворимым носителем. 11. Фармацевтическая композиция по п.9, в которой фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80,этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, циклодекстрина или его аналогов, -циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 12. Фармацевтическая композиция по п.11, в которой водорастворимый носитель представляет собой -циклодекстрин. 13. Фармацевтическая композиция по п.12, в которой -циклодекстрин представляет собой гидроксипропилциклодекстрин. 14. Фармацевтическая композиция по п.9, в которой концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 15. Фармацевтическая композиция по п.10, в которой комплекс включает лекарственную форму в диапазоне доз от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели. 16. Фармацевтическая композиция по п.9, в которой терапевтически эффективное количество лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель представлены в виде эмульсии. 17. Препаративная форма -лапахона или его производного или аналога и фармацевтически приемлемого водорастворимого носителя, причем препаративная форма может быть лиофилизированной и при последующем растворении в водном растворе является, по существу, растворимой. 18. Препаративная форма по п.17, в которой -лапахон или его производное или аналог находится в комплексе с фармацевтически приемлемым водорастворимым носителем. 19. Препаративная форма по п.17, в которой фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофора/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, -циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 20. Препаративная форма по п.19, в которой водорастворимый носитель представляет собой циклодекстрин. 21. Препаративная форма по п.20, в которой -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 22. Препаративная форма по п.17, в которой концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 23. Препаративная форма по п.17, в которой -лапахон или его производное или аналог и фармацевтически приемлемый водорастворимый носитель существуют в виде эмульсии. 24. Набор для лечения рака у млекопитающего, включающий по меньшей мере один флакон, содержащий -лапахон или его производное или аналог, в соответствии с любым из пп.1, 9 или 17. 25. Фармацевтическая композиция, включающая терапевтически эффективное количество лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включающая второе противораковое средство и фармацевтически приемлемый носитель. 26. Фармацевтическая композиция по п.25, включающая комплекс или раствор терапевтически эффективного количества -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включает второе противораковое средство и фармацевтически приемлемый носитель. 27. Фармацевтическая композиция по п.25 или 26, в которой второе противораковое средство представляет собой производное таксана.- 26007075 28. Фармацевтическая композиция по п.27, в которой производное таксана представляет собой паклитаксел. 29. Фармацевтическая композиция по п.25 или 26, которая представляет собой водный раствор или масляный раствор. 30. Фармацевтическая композиция по п.25, в которой терапевтически эффективное количество лапахона или его производного или аналога и фармацевтически приемлемый солюбилизирующий в воде носитель смешивают со вторым противораковым средством и фармацевтически приемлемым носителем и помещают в один флакон. 31. Фармацевтическая композиция по п.25, в которой терапевтически эффективное количество лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе. 32. Фармацевтическая композиция по п.25, в которой фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80,этанола, кремофора/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, циклодекстрина или его аналогов, -циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 33. Фармацевтическая композиция по п.32, в которой водорастворимый носитель представляет собой -циклодекстрин. 34. Фармацевтическая композиция по п.33, в которой -циклодекстрин представляет собой гидроксипропилциклодекстрин. 35. Фармацевтическая композиция по п.29, в которой концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 36. Фармацевтическая композиция по п.25, в которой терапевтически эффективное количество лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и второе противораковое средство и фармацевтически приемлемый носитель существуют в виде эмульсии. 37. Набор для лечения опухоли у млекопитающего, включающий один или более флаконов, содержащих терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включающий в том же флаконе или в отдельном флаконе второе противораковое средство. 38. Набор по п.37, в котором один или более флаконов содержат комплекс терапевтически эффективного количества -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включающий в том же флаконе или в отдельном флаконе второе противораковое средство. 39. Набор по п.37 или 38, в котором вторым противораковым средством является производное таксана. 40. Набор по п.39, в котором производным таксана является паклитаксел. 41. Набор по п.37 или 38, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофора/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, -циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 42. Набор по п.41, в котором водорастворимый носитель представляет собой -циклодекстрин. 43. Набор по п.42, в котором -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 44. Набор по п.37 или 38, в котором концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 45. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель. 46. Способ по п.45, в котором фармацевтическая композиция включает комплекс или раствор терапевтически эффективного количества -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель. 47. Способ по п.45 или 46. в котором композиция представляет собой водный раствор. 48. Способ по п.45, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофор/этанола,полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 49. Способ по п.48, в котором водорастворимый носитель представляет собой -циклодекстрин.- 27007075 50. Способ по п.49, в котором -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 51. Способ по п.47, в котором концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 52. Способ по п.45, в котором фармацевтическую композицию вводят парентерально. 53. Способ по п.52, в котором фармацевтическая композиция включает дозу в диапазоне от 0,1 до 10 мг/кг, введенную от 2 раз/нед. до 1 раза каждые четыре недели. 54. Способ по п.45, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель существуют в виде эмульсии. 55. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, который при растворении в водном растворе для парентерального введения остается, по существу, растворимым в водном растворе. 56. Способ по п.55, в котором терапевтически эффективное количество -лапахона или его производного или аналога образует комплексы с фармацевтически приемлемым водорастворимым носителем. 57. Способ по п.55, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофор/этанола,полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 58. Способ по п.57, в котором водорастворимый носитель представляет собой -циклодекстрин. 59. Способ по п.58, в котором -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 60. Способ по п.55, в котором концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 61. Способ по п.55, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель существуют в виде эмульсии. 62. Способ лечения рака, включающий введение пациенту препаративной формы -лапахона или его производного или аналога и фармацевтически приемлемого водорастворимого носителя, причем комплекс может быть лиофилизирован и при последующем растворении в водном растворе является, по существу, растворимым. 63. Способ по п.62, в котором -лапахон или его производное или аналог образует комплекс с фармацевтически приемлемым водорастворимым носителем. 64. Способ по п.62, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофор/этанола,полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 65. Способ по п.64, в котором водорастворимый носитель представляет собой -циклодекстрин. 66. Способ по п.65, в котором -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 67. Способ по п.62, в котором концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 68. Способ по п.62, в котором препаративную форму вводят парентерально. 69. Способ по п.68, в котором указанная фармацевтическая композиция включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, введенную от 2 раз/нед. до 1 раза каждые четыре недели. 70. Способ по п.62, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель находятся в виде эмульсии. 71. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, и, кроме того, включающий второе противораковое средство и фармацевтически приемлемый носитель. 72. Способ по п.71, в котором фармацевтическая композиция включает комплекс терапевтически эффективного количества -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и, кроме того, включает второе противораковое средство и фармацевтически приемлемый носитель. 73. Способ по п.71 или 72, в котором второе противораковое средство представляет собой производное таксана. 74. Способ по п.73, в котором производное таксана представляет собой паклитаксел.- 28007075 75. Способ по п.71 или 72, в котором композиция представляет собой водный раствор. 76. Способ по п.71, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель смешивают со вторым производным таксана и фармацевтически приемлемым носителем и помещают в один флакон. 77. Способ по п.71, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе, причем содержимое первого и второго флаконов вводят одновременно или последовательно. 78. Способ по п.71, в котором водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, -циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 79. Способ по п.78, в котором водорастворимый носитель представляет собой -циклодекстрин. 80. Способ по п.79, в котором -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 81. Способ по п.75, в котором концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 82. Способ по п.71, в котором фармацевтическую композицию вводят парентерально. 83. Способ по п.71, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и противораковое средство и фармацевтически приемлемый носитель находятся в виде эмульсии. 84. Способ лечения рака, включающий введение пациенту фармацевтической композиции, включающей терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, которая при разведении водным раствором для парентерального введения остается, по существу, растворимой в водном растворе, и, кроме того, включающую второе противораковое средство и фармацевтически приемлемый носитель. 85. Способ по п.84, в котором терапевтически эффективное количество -лапахона или его производного или аналога в фармацевтической композиции образует комплекс с фармацевтически приемлемым водорастворимым носителем, которая при растворении водным раствором для парентерального введения остается, по существу, растворимой в водном растворе. 86. Способ по п.84, в котором второе противораковое средство представляет собой производное таксана. 87. Способ по п.86, в котором производное таксана представляет собой паклитаксел. 88. Способ по п.84, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель смешивают со вторым противораковым средством и фармацевтически приемлемым носителем и помещают в один флакон. 89. Способ по п.84, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе, причем содержимое первого и второго флаконов вводят одновременно или последовательно. 90. Способ по п.84, в котором фармацевтически приемлемый водорастворимый носитель выбран из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофор/этанола,полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 91. Способ по п.90, в котором водорастворимый носитель представляет собой -циклодекстрин. 92. Способ по п.91, в котором -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 93. Способ по п.84, в котором концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 94. Способ по п.84, в котором фармацевтическая композиция включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, введенную от 2 раз/нед. до 1 раза каждые четыре недели. 95. Способ по п.84, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и второе противораковое средство и фармацевтически приемлемый носитель находятся в виде эмульсии. 96. Способ лечения рака, включающий введение пациенту-композиции -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель, причем композицию можно лиофилизировать, и она при последующем растворении в водном растворе является, по существу,- 29007075 растворимой, причем препаративная форма, кроме того, включает второе противораковое средство и фармацевтически приемлемый носитель. 97. Способ по п.96, в котором -лапахон или его производное или аналог в препаративной форме образует комплекс с фармацевтически приемлемым водорастворимым носителем. 98. Способ по п.96, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель смешивают со вторым противораковым средством и фармацевтически приемлемым носителем и помещают в один флакон. 99. Способ по п.96, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель содержатся в первом флаконе, а второе противораковое средство и фармацевтически приемлемый носитель содержатся во втором флаконе, причем содержимое первого и второго флаконов вводят одновременно или последовательно. 100. Способ по п.96, в котором фармацевтически приемлемый солюбилизирующий в воде носитель выбирают из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофора/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, -циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 101. Способ по п.100, в котором солюбилизирующий в воде носитель представляет собой циклодекстрин. 102. Способ по п.101, в котором -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 103. Способ по п.96, в котором концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 104. Способ по п.96, в котором противораковое средство представляет собой производное таксана. 105. Способ по п.104, в котором производное таксана представляет собой паклитаксел. 106. Способ по п.96, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель и второе противораковое средство и фармацевтически приемлемый носитель существуют в виде эмульсии. 107. Способ лечения рака, включающий сначала введение пациенту фармацевтической композиции,включающей терапевтически эффективное количество -лапахона или его производного или аналога и водорастворимый носитель, а затем воздействие на указанного пациента лучевой терапией. 108. Способ по п.107, в котором фармацевтически приемлемый водорастворимый носитель, выбранный из группы, состоящей из полоксамера, повидона К 17, повидона К 12, Твина 80, этанола, кремофор/этанола, полиэтиленгликоля (PEG) 400, пропиленгликоля, траппсола, -циклодекстрина или его аналогов, -циклодекстрина или его аналогов и -циклодекстрина или его аналогов. 109. Способ по п.108, в котором водорастворимый носитель представляет собой -циклодекстрин. 110. Способ по п.109, в котором -циклодекстрин представляет собой гидроксипропил-циклодекстрин. 111. Способ по п.107, в котором концентрация -лапахона в растворе составляет по меньшей мере 1 мг/мл. 112. Способ по п.107, в котором фармацевтическая композиция включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели. 113. Способ по п.107, в котором терапевтически эффективное количество -лапахона или его производного или аналога и фармацевтически приемлемый водорастворимый носитель представлены в виде эмульсии. 114. Фармацевтическая композиция, включающая терапевтически эффективное количество лапахона или его производного или аналога, составленная с фармацевтически приемлемым для жировой эмульсии носителем для образования эмульсии, пригодной для парентерального введения. 115. Фармацевтическая композиция по п.114, в которой фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипид. 116. Фармацевтическая композиция по п.114, в которой концентрация -лапахона в эмульсии составляет по меньшей мере 1 мг/мл. 117. Фармацевтическая композиция по п.114, в которой эмульсия включает стандартную дозу в диапазоне от 0,1 до 10 мг/кг, вводимую от 2 раз/нед. до 1 раза каждые четыре недели. 118. Препаративная форма -лапахона или его производного или аналога и фармацевтически приемлемого для жировой эмульсии носителя, причем препаративную форму можно лиофилизировать и при последующем растворении она является, по существу, растворимой. 119. Препаративная форма по п.118, в которой фармацевтически приемлемый для жировой эмульсии носитель представляет собой интралипид. 120. Препаративная форма по п.118, в которой концентрация -лапахона составляет по меньшей мере 1 мг/мл.
МПК / Метки
МПК: A61K 31/335, A61K 31/35
Метки: фармацевтические, применения, способы, производные, композиции, аналоги, бета-лапахон, содержащие
Код ссылки
<a href="https://eas.patents.su/30-7075-farmacevticheskie-kompozicii-soderzhashhie-beta-lapahon-ili-ego-proizvodnye-ili-analogi-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции, содержащие бета-лапахон или его производные или аналоги, и способы их применения</a>
Предыдущий патент: 2-амино-6-(2, 4, 5-замещенный фенил)пиридины для применения в качестве ингибиторов синтазы оксида азота
Следующий патент: Трубное резьбовое соединение
Случайный патент: Способ лечения злокачественных образований












