Производные 5-пиридазинил-1-азабицикло [3.2.1] октана, их получение и применение в терапии
Номер патента: 13601
Опубликовано: 30.06.2010
Авторы: Ваше Жюльен, Локхед Алистер В., Леклерк Одиль, Галли Фредерик
Формула / Реферат
1. Соединение, соответствующее формуле (I)
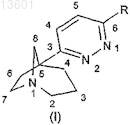
где R представляет собой
атом водорода или галогена,
или фенил, замещенный при необходимости одним или несколькими атомами галогенов, одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси, нитро, амино, ди(C1-C3)алкиламино, трифторметила, трифторметокси, циано, гидрокси, ацетила или метилендиокси;
или группу, выбранную из пиридинила, пиразолила, имидазолила, триазолила, тетразолила, оксазолила, тиазолила, оксадиазолила, тиадиазолила, тиенила, фурила, изоксазолила, изотиазолила, пирролила, нафтила, причем такая группа при необходимости может быть замещенной одной или несколькими группами, выбранными из атомов галогенов, (C1-C6)алкила, (С1-С6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
2. Соединение формулы (I) по п.1, отличающееся тем, что R представляет собой
атом галогена;
или фенил, замещенный при необходимости одним или несколькими атомами галогенов, одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси;
или группу, выбранную из пиридинила, пиразолила, имидазолила, триазолила, тетразолила, оксазолила, тиазолила, оксадиазолила, тиадиазолила, тиенила, фурила, изоксазолила, изотиазолила, пирролила, нафтила, причем такая группа при необходимости может быть замещенной одним или несколькими (C1-C6) алкилами;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что R представляет собой
атом галогена;
или фенил, замещенный при необходимости одним или несколькими атомами галогенов, одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси;
или группу, выбранную из пиридинила, пиразолила, имидазолила, тиенила, фурила, пирролила, причем такая группа при необходимости может быть замещенной одним или несколькими (C1-C6)алкилами;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
4. Способ получения соединения формулы (I) по любому из пп.1-3, отличающийся тем, что соединение формулы (VII)
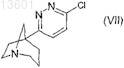
вводят в реакцию с бороновой кислотой формулы R-B(OH)2, в которой R является таким, как определено в общей формуле (I), в присутствии палладиевого катализатора;
или с соединением формулы R-H, в которой R является таким, как определено в общей формуле (I), в присутствии сильного основания в растворителе;
или с производным олова формулы R-Sn[(СН2)3СН3)]3, в которой R является таким, как определено в общей формуле (I), в присутствии палладиевого катализатора;
или с соединением формулы R-H, в которой R является таким, как определено в общей формуле (I), в присутствии н-бутиллития, хлорида цинка и палладиевого катализатора.
5. Лекарственное средство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-3 или аддитивную соль такого соединения с фармацевтически приемлемой кислотой или также гидрат или сольват соединения формулы (I).
6. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-3 или фармацевтически приемлемую соль, гидрат или сольват такого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
7. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики когнитивных расстройств; поражений процессов, определяющих внимание; расстройств исполнительных функций, связанных с болезнью Альцгеймера, патологическим или нормальным старением, синдромом Паркинсона, трисомией 21, психическими патологиями, алкогольным синдромом Корсакова, сосудистыми деменциями, черепными травмами; двигательных расстройств, наблюдаемых при болезни Паркинсона или других неврологических болезнях или анатомо-гисто-патологических поражениях, связанных с указанными нейродегенеративными болезнями.
8. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения или профилактики сосудистых повреждений головного мозга, случаев гипоксии головного мозга, психических патологий.
9. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения или профилактики симптомов, обусловленных лишением табака, алкоголя, различных субстанций, вызывающих зависимость.
10. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения боли.
11. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения ишемии нижних конечностей, облитерирующего артериита нижних конечностей, ишемии сердца, инфаркта миокарда, сердечной недостаточности, ухудшения заживления поражений кожи у больных диабетом, варикозных язв при венозной недостаточности.
12. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения воспалительных процессов.
Текст
013601 Настоящее изобретение относится к производным 5-пиридазинил-1-азабицикло[3.2.1]октана, их получению и применению в терапии. Изобретение относится к соединениям, соответствующим общей формуле (I) где R представляет собой атом водорода или галогена; или фенил, замещенный при необходимости одним или несколькими атомами галогенов, одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси, нитро, амино, ди(С 1 С 3)алкиламино, трифторметила, трифторметокси, циано, гидрокси, ацетила или метилендиокси; или группу, выбранную из пиридинила, пиразолила, имидазолила, триазолила, тетразолила, оксазолила, тиазолила, оксадиазолила, тиадиазолила, тиенила, фурила, изоксазолила, изотиазолила, пирролила,нафтила, причем такая группа при необходимости может быть замещена одной или несколькими группами, выбранными из атомов галогенов, (C1-C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила,нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино. В то же время атом углерода в позиции 5 цикла азабицикло[3.2.1]октана является асимметрическим,так что соединения по настоящему изобретению могут существовать в виде двух энантиомеров или их смеси. Такие энантиомеры, а также их смеси, включая рацемические смеси, составляют часть настоящего изобретения. Соединения формулы (I) могут существовать также в виде оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть настоящего изобретения. Как эти соли, которые могут быть получены с фармацевтически приемлемыми кислотами, так и соли других кислот, например, применяемых для очистки или выделения соединений формулы (I), также составляют часть настоящего изобретения. Соединения формулы (I) могут существовать также в виде гидратов или сольватов, а именно в виде ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть настоящего изобретения. В пределах настоящего изобретения понимают под атомом галогена атом фтора, хлора, брома или иода; алкилом алифатическую насыщенную линейную или разветвленную группу. В качестве примеров можно упомянуть метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, третбутильную, пентильную группы и т.д.; алкоксигруппой -О-алкил, в котором алкил является таким, как определено ранее; Среди соединений формулы (I), являющихся объектами настоящего изобретения, первую подгруппу соединений составляют соединения, в которыхR представляет собой атом галогена, более предпочтительно хлор; или фенил, замещенный при необходимости одним или несколькими атомами галогенов, более предпочтительно хлора или фтора, одной или несколькими группами, выбранными из (C1-С 6)алкила, более предпочтительно метила, (C1-C6)алкокси, более предпочтительно метокси; или группу, выбранную из пиридинила, пиразолила, имидазолила, триазолила, тетразолила, оксазолила, тиазолила, оксадиазолила, тиадиазолила, тиенила, фурила, изоксазолила, изотиазолила, пирролила,нафтила, причем такая группа при необходимости может быть замещенной одним или несколькими (C1 С 6)алкилами, более предпочтительно метильными группами. Среди соединений формулы (I), являющихся объектами настоящего изобретения, вторую подгруппу соединений составляют соединения, в которыхR представляет собой атом галогена, более предпочтительно хлор; или фенил, замещенный при необходимости одним или несколькими атомами галогенов, более предпочтительно хлора или фтора, одной или несколькими группами, выбранными из (C1-С 6)алкила, более предпочтительно метила, (С 1-С 6)алкокси, более предпочтительно метокси; или группу, выбранную из пиридинила, пиразолила, имидазолила, тиенила, фурила, пирролила,причем такая группа при необходимости может быть замещенной одним или несколькими (C1C6)алкилами, более предпочтительно метильными группами. Под защитной группой далее понимают группу, которая, с одной стороны, позволяет защищать в-1 013601 ходе синтеза активную функциональную группу, такую как гидрокси- или аминогруппа, и, с другой стороны, позволяет восстанавливать активную функциональную группу без изменения в конце синтеза. Примеры защитных групп, а также методики введения и удаления защитных групп приведены в издании"Protective Groups in Organic Synthesis", Green et al., 2nd Edition (John WileySons; Inc., New York), 1991. Под уходящей группой далее понимают группу, которая может быть легко отщеплена от молекулы разрывом гетеролитической связи с удалением электронной пары. Такая группа также может быть легко замещена другой группой, например, по реакции замещения. Такими уходящими группами являются,например, галогены или активная гидроксигруппа, такая как метансульфонат, бензолсульфонат, птолуолсульфонат, трифлат, ацетат и т.д. Примеры уходящих групп, а также справочная информация по их получению приведены в издании "Advanced in Organic Chemistry", J. March, 3rd Edition, Wiley Interscience, 1985, p. 310-316. По настоящему изобретению соединения общей формулы (I) можно получить способом, который проллюстрирован приведенной далее схемой 1. Соединение формулы (II), в которой PPh3 означает трифенилфосфиновую группу, приводят во взаимодействие с этилглиоксилатом для получения соединения формулы (III). Восстановление двойной этиленовой связи дает соединение формулы (IV), которое приводят во взаимодействие с гидразингидратом для получения соединения формулы (V). Последнее соединение обрабатывают бромом в уксусной кислоте для получения соединения формулы (VI). Обработка полученного соединения оксихлоридом фосфора приводит к соединению формулы (VII). Соединения формулы (I) могут быть получены затем,исходя из соединения формулы (VII), любыми известными способами, например с бороновой кислотой формулы R-B(OH)2, в которой R является таким, как определено в общей формуле (I), в присутствии палладиевого катализатора, например тетракистрифенилфосфинпалладия; с соединением формулы R-H, в которой R является таким, как определено в общей формуле (I), в присутствии сильного основания, например гидрида натрия, в растворителе, например в диметилформамиде; с производным олова формулы R-Sn[(СН 2)3 СН 3)]3, в которой R является таким, как определено в общей формуле (I), в присутствии палладиевого катализатора, например бис(трифенилфосфин)дихлорпалладия; с соединением формулы R-H, в которой R является таким, как определено в общей формуле (I), в присутствии н-бутиллития, хлорида цинка и палладиевого катализатора, например тетракистрифенилфосфинпалладия. Схема 1 Соединение формулы (II) получают способами, описанными в литературных источниках, например в J. Med. Chem. 1992, 2392. Указанные на схеме 1 исходные вещества и реагенты, способы получения которых не описаны,имеются в продаже, или описаны в литературе, или могут быть получены способами, описанными или-2 013601 известными специалисту в данной области техники. Настоящее изобретение в одном из других своих аспектов относится также к соединениям формул(II)-(VII). Такие соединения являются полезными в качестве промежуточных соединений в синтезе соединений общей формулы (I). В следующих далее примерах описано получение некоторых соединений по настоящему изобретению. Данные примеры не являются ограничительными и приведены только для иллюстрации настоящего изобретения. Указанные в заголовках номера соединений, приведенные в скобках, соответствуют номерам, указанным в первом столбце таблицы, приведенной далее для иллюстрации химической структуры и физических свойств некоторых соединений по настоящему изобретению. Пример 1 (соединение 1). 5-(6-Фенилпиридазин-3-ил)-1-азабицикло[3.2.1]октан. 1.1. Этил-(2 Е)-4-(1-азабицикло[3.2.1]окт-5-ил)-4-оксобут-2-еноат. В трехгорлую колбу вместимостью 100 мл помещают раствор 5,00 г (12,09 ммоль) 1-(1 азабицикло[3.2.1]окт-5-ил)-2-(трифенилфосфинилиден)этанона в 20 мл хлороформа и 20 мл толуола. Прибавляют 1,36 г (13,3 ммоль) этилглиоксилата и перемешивают реакционную массу при комнатной температуре в течение 15 мин. Растворитель удаляют выпариванием при пониженном давлении и полученный остаток очищают хроматографированием на колонке с силикагелем, элюируя смесью хлороформа, метанола и аммиака в пропорции 89/2/0,2. Получают 1,44 г продукта в виде твердого аморфного вещества. 1.2. Этил-4-(1-азабицикло[3.2.1]окт-5-ил)-4-оксобутаноат. В реактор гидрирования помещают раствор 2,95 г (12,43 ммоль) этил-(2 Е)-4-(1-азабицикло[3.2.1]окт-5-ил)-4-оксобут-2-еноата, полученного на стадии 1.1, в 100 мл этилового спирта в присутствии 0,4 г палладия, адсорбированного с содержанием 5% на угле. Реакционную массу перемешивают при давлении водорода приблизительно 0,28 МПа в течение 1 ч при комнатной температуре, затем фильтруют через диатомит и растворитель удаляют выпариванием при пониженном давлении. Получают 2,97 г требуемого продукта в виде твердого аморфного вещества. 1.3. 6-(1-Азабицикло[3.2.1]окт-5-ил)-4,5-дигидропиридазин-3-ол. В трехгорлую колбу вместимостью 250 мл помещают раствор 2,90 г (12,12 ммоль) этил-4-(1 азабицикло[3.2.1]окт-5-ил)-4-оксобутаноата, полученного на стадии 1.2, в 50 мл этилового спирта. Затем прибавляют 1,94 г (60,59 ммоль) гидразингидрата и реакционную смесь нагревают с обратным холодильником в течение 15 ч. Растворитель выпаривают досуха при пониженном давлении и остаток очищают хроматографированием на колонке с силикагелем, элюируя смесью хлороформа, метанола и аммиака в пропорции 90/10/1. Получают 1,6 г требуемого продукта в виде твердого аморфного вещества. 1.4. Гидробромид (1:1) 6-(1-азабицикло[3.2.1]окт-5-ил)пиридазин-3-ола. В трехгорлую колбу вместимостью 50 мл помещают раствор 1,54 г (7,43 ммоль) 6-(1 азабицикло[3.2.1]окт-5-ил)-4,5-дигидропиридазин-3-ола, полученного на стадии 1.3, в 20 мл уксусной кислоты. Реакционную массу нагревают до 70 С и прибавляют 1,31 г (8,17 ммоль) брома. Перемешивают в течение 15 мин и прибавляют дополнительно 1,31 г (8,17 ммоль) брома. Затем реакционную смесь нагревают при 100 С в течение 2 ч. Растворитель удаляют фильтрованием и остаток растирают в метаноле. Полученные кристаллы отделяют фильтрованием при пониженном давлении. Получают 2 г требуемого продукта. Температура плавления 196-198 С. 1.5. 5-(6-Хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октан. В трехгорлую колбу вместимостью 50 мл помещают раствор 2,1 г (7,34 ммоль) гидробромида (1:1) 6-(1-азабицикло[3.2.1]окт-5-ил)пиридазин-3-ола, полученного на стадии 1.4, в 15 мл оксихлорида фосфора. Реакционную смесь нагревают при 130 С в течение 30 мин и затем выливают в 500 мл ледяной воды. Затем водный слой подщелачивают добавлением 30% водного раствора гидроксида натрия и экстрагируют хлороформом. Объединенные органические слои сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Получают 1,56 г продукта в виде твердого вещества. Температура плавления: 139-141 С. 1.6. (+) или (-)-5-(6-хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октан. Рацемическую смесь 5-(6-хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана, полученную на стадии 1.5, разделяют жидкостной хроматографией на хиральной неподвижной фазе для получения правовращающего и левовращающего энантиомеров, (+)-5-(6-хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана и(-)-5-(6-Хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октан: [20D]=-17 (c=1, CH3OH) 1.7. 5-(6-Фенилпиридазин-3-ил)-1-азабицикло[3.2.1]октан. В трехгорлую колбу вместимостью 25 мл помещают последовательно 0,3 г (1,34 ммоль) 5-(6 хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана, полученного на стадии 1.5, и 0,245 г (2,01 ммоль) фе-3 013601 нилбороновой кислоты, растворяя в 8 мл толуола. Затем прибавляют 1,42 мл (2,84 ммоль) 2 М водного раствора карбоната натрия, 1,5 мл этанола и 0,0465 г (0,04 ммоль) тетракис(трифенилфосфин)палладия. Смесь нагревают с обратным холодильником в течение 20 ч, охлаждают до комнатной температуры и выливают в 20 мл воды. Водный слой экстрагируют три раза по 30 мл хлороформа, объединенные органические слои сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографированием на колонке с силикагелем, элюируя смесью хлороформа, метанола и аммиака в пропорции 95/5/0,5. Таким образом, получают 0,32 г требуемого продукта в виде кристаллов. Температура плавления: 133-134 С. ЯМР-1 Н (CDCl3)(м.д.): 8,15 (2 Н, д); 7,85 (1 Н, д); 7,60-7,40 (4 Н, м); 3,40-2,80 (6 Н, м); 2,30 (2 Н, т); 2,15-1,85 (2 Н, м); 1,80 (1 Н, с); 1,70-1,50 (1 Н, м). Соединения 2, 3 и 14 были получены по методике, описанной в примере 1. Пример 2 (соединение 5). Гидрохлорид (1:1) 5-[6-(5-метил-2-тиенил)пиридазин-3-ил]-1 азабицикло[3.2.1]октан. Данное соединение получают по методике, описанной на стадии 1.6 примера 1, исходя из 5-(6 хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана, полученного на стадии 1.5 примера 1, и 5-метилсульфанил-2-тиенилбороновой кислоты. Гидрохлорид получают обработкой основания раствором соляной кислоты в пропан-2-оле, полученные кристаллы отделяют фильтрованием и сушат в вакууме. Температура плавления: 245-246 С. ЯМР-1H (ДМСО)(м.д.): 8,15 (1 Н, д); 7,75 (1 Н, д); 7,75 (1 Н, д); 6,95 (1 Н, д); 3,75-3,25 (6 Н, м); 2,45(3H, с); 2,15-1,85 (6 Н, м). Соединения 6-11 были получены по методике, описанной в примере 2. Соединения 12, 13, 16, 17, 22 и 23 были получены по методике, описанной в примере 2, исходя из (+)-5-(6-хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана, полученного разделением рацемической смеси (полученной на стадии 1.5 примера 1) жидкостной хроматографией на хиральной неподвижной фазе. Соединения 15, 20 и 21 были получены по методике, описанной в примере 2, исходя из (-)-5-(6 хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана, полученного разделением рацемической смеси (полученной на стадии 1.5 примера 1) жидкостной хроматографией на хиральной неподвижной фазе. Пример 3 (соединение 25). (+)-5-[6-(1H-имидазол-1-ил)пиридазин-3-ил]-1-азабицикло[3.2.1]октан. В трехгорлую колбу вместимостью 10 мл помещают раствор 0,228 г (3,35 ммоль) имидазола в 4 мл диметилформамида. Затем прибавляют 0,137 г (3,42 ммоль) гидрида натрия в виде 60% дисперсии в масле и перемешивают при комнатной температуре в течение 1 ч. Затем смесь прибавляют к раствору (+)-5(6-хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана (полученного разделением рацемической смеси, полученной на стадии 1.5 примера 1, жидкостной хроматографией на хиральной неподвижной фазе) (0,15 г,0,67 ммоль) в диметилформамиде и реакционную смесь нагревают при 90 С в течение 15 ч и далее при 110 С в течение 3 ч, затем растворитель выпаривают при пониженном давлении. Остаток обрабатывают 10 мл хлороформа и 10 мл насыщенного водного раствора карбоната натрия. Водный слой экстрагируют дополнительно 10 мл хлороформа и объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографированием на силикагелевой пластине, элюируя смесью хлороформа, метанола и аммиака в пропорции 85/15/1,5. Получают 0,111 г требуемого продукта. Температура плавления: 177-179 С. ЯМР 1 Н (ДМСО)(м.д.): 8,55 (1 Н, с); 8,10 (1 Н, д); 8,00 (1 Н, с); 7,85 (1 Н, д); 7,15 (1 Н, с); 3,15-2,70(6 Н, м); 2,25-1,75 (5 Н, м); 1,60-1,35 (1 Н, т). Соединение 26 было получено по методике, описанной в примере 3. Пример 4 (соединение 19). Гидрохлорид (2:1) (+)-5-[6-(1H-имидазол-4-ил)пиридазин-3-ил]-1 азабицикло[3.2.1]октана. 4.1. (+)-5-[6-(1-Трифенилметилимидазол-4-ил)пиридазин-3-ил]-1-азабицикло[3.2.1]октан. В трехгорлую колбу вместимостью 10 мл помещают последовательно раствор 0,14 г (0,63 ммоль)(+)-5-(6-хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана (полученного разделением рацемической смеси,полученной на стадии 1.5 примера 1, жидкостной хроматографией на хиральной неподвижной фазе)(0,15 г, 0,67 ммоль) в 3 мл тетрагидрофурана, 0,94 г (1,56 ммоль) 1-трифенилметил-4 трибутилстаннилимидазола и 0,027 г (0,037 ммоль) бис(трифенилфосфин)дихлорпалладия. Затем смесь нагревают при 100 С в атмосфере аргона в течение 15 ч, после чего прибавляют 10 мл хлороформа и 10 мл насыщенного водного раствора карбоната натрия. Водный слой экстрагируют дополнительно 10 мл хлороформа и объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографированием на колонке с силикагелем, элюируя смесью хлороформа, метанола и аммиака в пропорции 96/4/0,4. Получают требуемый продукт, загрязненный избытком 1-трифенилметил 4-трибутилстаннилимидазола, в виде твердого аморфного вещества.-4 013601 4.2. Гидрохлорид (2:1) ( + )-5-[6-(1 Н-имидазол-4-ил)пиридазин-3-ил]-1-азабицикло[3.2.1]октана. В трехгорлую колбу вместимостью 10 мл помещают раствор (+)-5-[6-(1-трифенилметилимидазол-4 ил)пиридазин-3-ил]-1-азабицикло[3.2.1]октана в виде остатка, полученного на стадии 4.1, в 4 мл метанола. Затем прибавляют 0,6 мл 6 н. раствора соляной кислоты в изопропиловом спирте и реакционную смесь нагревают при 80 С в течение 3 ч. Раствор концентрируют при пониженном давлении и остаток растирают в диэтиловом эфире. Полученные кристаллы отделяют фильтрованием и сушат в вакууме. Получают 0,12 г продукта. Температура плавления: 269-271 С. ЯМР 1 Н (ДМСО)(м.д.): 11,20 (1 Н, с); 9,10 (1 Н, с); 8,45 (1 Н, с); 8,35 (1 Н, д); 7,95 (1 Н, d); 3,70 (2 Н,с); 3,60-3,45 (2 Н, т); 3,30 (2 Н, д); 2,45-1,85 (6 Н, м). Соединение 18 было получено по методике, описанной в примере 4, исходя из (-)-5-(6-хлорпиридазин-3-ил)-1-азабицикло[3.2.1]октана, полученного разделением рацемической смеси (полученной на стадии 1.5 примера 1) жидкостной хроматографией на хиральной неподвижной фазе. Пример 5 (соединение 24). Гидробромид (2:1) (-)-5-[6-(1 Н-имидазол-2-ил)пиридазин-3-ил]-1 азабицикло[3.2.1]-октан. В трехгорлую колбу вместимостью 25 мл помещают раствор 0,39 г (2,23 ммоль) 1(диметиламиносульфонил)имидазола в 10 мл тетрагидрофурана. Реакционную смесь охлаждают до -78 С и прибавляют по каплям 1,4 мл 1,6 М раствора н-бутиллития в гексане в течение 20 минут. Затем прибавляют раствор 0,31 г (2,32 ммоль) хлорида цинка в 4 мл тетрагидрофурана. Перемешивают, давая температуре повыситься до 20 С, затем прибавляют последовательно 0,48 г (3,58 ммоль) хлорида цинка,0,06 г (0,05 ммоль) тетракис(трифенилфосфин)палладия и 0,2 г (0,89 ммоль) (-)-5-(6-хлорпиридазин-3 ил)-1-азабицикло[3.2.1]октана (полученного разделением рацемической смеси, полученной на стадии 1.5 примера 1, жидкостной хроматографией на хиральной неподвижной фазе), растворяя в 5 мл тетрагидрофурана. Затем смесь нагревают с обратным холодильником в течение 24 ч и далее охлаждают до комнатной температуры. Прибавляют 30 мл 30% водного раствора гидроксида натрия и 50 мл хлороформа. Водный слой экстрагируют хлороформом и объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток переводят в раствор 10 мл диоксана и 1,5 мл 2 н. водного раствора соляной кислоты. Реакционную массу перемешивают при комнатной температуре в течение 16 ч и затем растворитель выпаривают при пониженном давлении. Остаток обрабатывают 30 мл хлороформа и 30 мл насыщенного водного раствора карбоната натрия. Водный слой экстрагируют хлороформом и объединенные органические слои сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографированием на колонке с силикагелем, элюируя смесью хлороформа,метанола и аммиака в пропорции 90/10/1. Получают 0,033 г требуемого продукта, который растворяют в 3 мл изопропилового спирта с последующим прибавлением 0,045 мл 5,7 н. раствора бромоводородной кислоты в уксусной кислоте. Образовавшиеся кристаллы отделяют фильтрованием и сушат в вакууме. Получают 0,027 г продукта. Температура плавления: 290-292 С. ЯМР 1 Н (ДМСО)(м.д.): 10,15 (1 Н, с); 8,40 (1 Н, д); 8,05 (1 Н, д); 7,80 (2 Н, с); 3,80 (1 Н, с); 3,70-3,50(2 Н, т); 3,35 (2 Н, д); 2,45-1,85 (6 Н, м). Следующая далее табл. 1 приведена для иллюстрации химической структуры и физических свойств некоторых соединений по настоящему изобретению. В упомянутой таблице значения, указанные в столбце с заголовком [20D] (СН 3 ОН), характеризуют вращательную способность соединения, причем концентрация в г/100 мл метанола, при которой осуществляли измерение, указана в скобках; соединения, для которых в данном столбце сведения отсутствуют, представляют собой рацематы; знак - в столбце "Соль" означает соединение в виде основания, HBr означает гидробромид, а HCl означает гидрохлорид. Молярные соотношения "кислота:основание" указаны рядом. Таблица 1 н.о. = значение не определено концентрация в г/100 мл ДМСО Соединения по настоящему изобретению были объектом фармакологических испытаний, которые выявили их перспективность в качестве активных веществ лекарственных средств. Также они были изучены в отношении их сродства к никотиновым рецепторам, содержащим субъединицу 7, согласно методикам, описанным Mark и Collins в издании J. Pharmacol. Exp. Ther. 1982, 22,564 и Marks et coll. в издании Mol. Pharmacol. 1986, 30, 427. Производят декапитацию крыс-самцов линии OFA с массой тела от 150 до 200 г, быстро отбирают весь головной мозг, гомогенизируют его с помощью измельчителя Polytron в 15 объемах 0,32 М раствора сахарозы при 4 С и затем центрифугируют при 1000 g в течение 10 мин. Осадок отделяют и супернатант центрифугируют при 8000 g в течение 20 мин при 4 С. Осадок выделяют, гомогенизируют его с помощью измельчителя Polytron в 15 объемах бидистиллированной воды при 4 С и затем центрифугируют при 8000 g в течение 20 мин. Осадок отделяют и центрифугируют супернатант и лейкоцитарную пленку ("buffy coat") при 40000 g в течение 20 мин при 4 С. Осадок выделяют, снова переводят в суспензию с 15 объемами бидистиллированной воды при 4 С и центрифугируют еще раз при 40000 g в течение 20 мин перед консервацией при -80 С. В день эксперимента медленно размораживают ткань и переводят в суспензию в 5 объемах буфера. Преинкубируют 150 мкл такой мембранной суспензии при 37 С в течение 30 мин в темноте в присутствии или в отсутствие испытуемого соединения. Затем мембраны инкубируют в течение 60 мин при 37 С в темноте в присутствии 50 мкл [3 Н]бунгаротоксина с концентрацией 1 нМ в конечном объеме 250 мкл 20 мМ буфера HEPES и с 0,05% полиэтиленимина. Реакцию останавливают фильтрованием через-6 013601 фильтры Whatman GF/C, предварительно обработанные в течение 3 ч 0,05% раствором полиэтиленимина. Фильтры ополаскивают два раза по 5 мл буфера при 4 С и измеряют радиоактивность, поглощенную каждым фильтром, жидкостной сцинтиграфией. Определяют неспецифические связи в присутствии-бунгаротоксина с конечной концентрацией 1 мкМ; неспецифические связи составляют приблизительно 60% всех связей, выявляемых на фильтре. Для каждой концентрации исследуемого соединения определяют процентную долю ингибирования специфических связей [3 Н]бунгаротоксина, затем рассчитывают CI50, т.е. концентрацию соединения, при которой ингибируется 50% специфических связей. Концентрации CI50 для соединений по настоящему изобретению, обладающих наибольшим сродством, находятся в интервале от 0,001 до 1 мкМ. Соединения по настоящему изобретению были изучены также в отношении их сродства к никотиновым рецепторам, содержащим субъединицу 42, согласно методикам, описанным Anderson и Arneric в издании Eur. J. Pharmacol. 1994, 253, 261 и Hall et coll. в издании Brain Res. 1993, 600, 127. Производят декапитацию крыс-самцов линии Sprague Dawley с массой тела от 150 до 200 г, быстро отбирают весь головной мозг, гомогенизируют его в 15 объемах 0,32 М раствора сахарозы при 4 С и затем центрифугируют при 1000 g в течение 10 мин. Осадок отделяют и супернатант центрифугируют при 20000 g в течение 20 мин при 4 С. Осадок выделяют, гомогенизируют его с помощью измельчителя Polytron в 15 объемах бидистиллированной воды при 4 С и затем центрифугируют при 8000 g в течение 20 мин. Осадок отделяют и центрифугируют супернатант и лейкоцитарную пленку (buffy coat) при 40000 g в течение 20 мин, осадок выделяют, снова переводят в суспензию с 15 мл бидистиллированной воды и центрифугируют еще раз при 40000 g в течение 20 мин перед консервацией при -80 С. В день эксперимента медленно размораживают ткань и переводят в суспензию в 3 объемах буфера. Инкубируют 150 мкл такой мембранной суспензии при 4 С в течение 120 мин в присутствии 100 мкл[3 Н]-цитизина с концентрацией 1 нМ в конечном объеме 500 мкл буфера в присутствии или в отсутствие испытуемого соединения. Реакцию останавливают фильтрованием через фильтры Whatman GF/C,предварительно обработанные полиэтиленимином, фильтры ополаскивают два раза по 5 мл буфера при 4 С и измеряют радиоактивность, поглощенную фильтром, жидкостной сцинтиграфией. Определяют неспецифические связи в присутствии (-)-никотина с концентрацией 10 мкМ; неспецифические связи составляют от 75 до 85% всех связей, выявляемых на фильтре. Для каждой концентрации исследуемого соединения определяют процентную долю ингибирования специфических связей [3 Н]-цитизина в дозах от 1 до 10 мкМ. Для наиболее аффинных соединений по настоящему изобретению рассчитывают CI50, т.е. концентрацию соединения, при которой ингибируется 50% специфических связей. Концентрации CI50 для наиболее аффинных соединений по настоящему изобретению находятся в интервале от 0,2 до 10 мкМ. В следующей далее табл. 2 приведены экспериментальные данные для некоторых специфических соединений. Таблица 2 Соединения по настоящему изобретению были изучены также в отношении их сродства к периферическим никотиновым рецепторам ганглионарного типа согласно методике, описанной Houghtling etcoll. в издании Mol. Pharmacol. 1995, 48, 280. Размораживают бычьи надпочечные железы, хранившиеся при -80 С, гомогенизируют их с помощью измельчителя Polytron в 20 объемах 50 мМ буфера Tris-HCl с рН=7,4 при 4 С и затем центрифугируют при 35000 g в течение 10 мин. Удаляют супернатант, осадок снова переводят в суспензию в 30 объемах 50 мМ буфера Tris-HCl при 4 С и снова гомогенизируют перед повторным центрифугированием при 35000 g в течение 10 мин. Последний осадок растворяют в 10 объемах буфера Tris-HCl при 4 С. Инкубируют 100 мкл мембранного препарата или 10 мг свежей ткани при 24 С в течение 3 ч в присутствии 50 мкл [3 Н]-эпибатидина с конечной концентрацией 0,66 нМ в конечном объеме 250 мкл буфера в присутствии или в отсутствие испытуемого соединения. Реакцию останавливают разбавлением образцов 50 мкМ буфером Tris-HCl с рН=7,4 при 4 С, затем фильтруют через фильтры Whatman GF/C, предварительно обработанные в течение 3 ч 0,5% раствором полиэтиленимина. Фильтры ополаскивают два раза по 5 мл буфера и измеряют радиоактивность, поглощенную фильтром, жидкостной сцинтиграфией. Определяют неспецифические связи в присутствии (-)-никотина с конечной концентрацией 2 мМ; неспецифические связи составляют от 30 до 40% всех связей, выявляемых на фильтре. Для каждой концентрации исследуемого соединения определяют процентную долю ингибирования специфических связей [3 Н]-7 013601 эпибатидина, затем рассчитывают CI50, т.е. концентрацию соединения, при которой ингибируется 50% специфических связей. Концентрации CI50 для соединений по настоящему изобретению находятся в интервале от 1 до 10 мкМ. Полученные результаты показывают, что некоторые соединения по настоящему изобретению представляют собой селективные лиганды для субъединицы 7 никотинового рецептора и что другие соединения являются смешанными лигандами для субъединиц 42 и 7. Такие результаты предполагают применение соединений при лечении или профилактике нарушений, связанных с дисфункцией никотиновых рецепторов, в частности на уровне центральной нервной системы. К таким нарушениям относятся когнитивные расстройства, более конкретно мнестические нарушения (приобретение, закрепление и вспоминание), а также поражения процессов, определяющих внимание, и расстройства исполнительных функций, связанных с болезнью Альцгеймера, патологическим старением (Age Associated Memory Impairment, AAMI (возрастные нарушения памяти или нормальным старением (старческое слабоумие), синдромом Паркинсона, трисомией 21 (синдром Дауна), психическими патологиями (в частности, когнитивные расстройства, связанные с шизофренией), алкогольным синдромом Корсакова, сосудистыми деменциями (мультиинфарктная деменция, MDI), черепными травмами. Соединения по настоящему изобретению возможно обладают полезным эффектом при лечении двигательных расстройств, наблюдаемых при болезни Паркинсона или других неврологических болезнях, таких как хорея Гентингтона, синдром Туретта, поздняя дискинезия и гиперкинезия. Они могут также проявлять терапевтическую нейрозащитную активность в отношении анатомогисто-патологических поражений, связанных с упомянутыми ранее нейродегенеративными болезнями. Соединения по настоящему изобретению также могут быть использованы в лечебной или симптоматической терапии сосудистых повреждений головного мозга и в случаях гипоксии головного мозга. Они могут быть использованы в случаях психических патологий, таких как шизофрения (с позитивными и/или негативными симптомами), биполярные расстройства, депрессия, тревожное состояние, приступы паники, расстройства внимания в сочетании с гиперактивностью, компульсивное и маниакальное поведение. Они могут быть использованы для профилактики симптомов, обусловленных лишением табака, алкоголя, различных субстанций, вызывающих зависимость, таких как кокаин, ЛСД, конопля, бензодиазепины. Они могут обладать полезным эффектом при лечении болей различного происхождения (включая хронические, нейропатические или воспалительные боли). В то же время, соединения по настоящему изобретению могут быть использованы для лечения ишемии нижних конечностей, облитерирующего артериита нижних конечностей (PAD: peripheral arterial disease (болезнь периферических сосудов, ишемии сердца (angor stable (стенокардии, инфаркта миокарда, сердечной недостаточности, ухудшения заживления поражений кожи у диабетических больных, варикозных язв при венозной недостаточности. Соединения по настоящему изобретению также могут быть использованы для лечения воспалительных процессов различного происхождения, в частности воспалений, касающихся центральной нервной системы. Таким образом, соединения по настоящему изобретению могут быть использованы для получения лекарственных средств, в частности лекарственных средств, обладающих полезным эффектом при лечении или профилактике нарушений, связанных с дисфункцией никотиновых рецепторов, в частности ранее упомянутых нарушений. Также настоящее изобретение в одном из других своих аспектов относится к лекарственным средствам, содержащим соединение формулы (I) или аддитивную соль такого соединения с фармацевтически приемлемой кислотой или также гидрат или сольват соединения формулы (I). Такие лекарственные средства находят свое применение в терапии, в частности при лечении или профилактике нарушений, связанных с дисфункцией никотиновых рецепторов, в частности ранее упомянутых нарушений. Настоящее изобретение в одном из других своих аспектов относится к фармацевтическим композициям, содержащим в качестве активного вещества соединение по настоящему изобретению. Такие фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения по настоящему изобретению или фармацевтически приемлемой соли, гидрата или сольвата упомянутого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Упомянутые эксципиенты выбирают из традиционных эксципиентов, известных специалисту в данной области техники, в соответствии с требуемыми фармацевтической формой и способом введения. В фармацевтических композициях по настоящему изобретению, предназначенных для перорального, сублингвального, подкожного, внутримышечного, внутривенного, топического, местного, интратрахеального, интраназального, чрескожного или ректального введения, ранее упомянутое активное веще-8 013601 ство формулы (I) или его возможные соль, сольват или гидрат могут вводиться в стандартной лекарственной форме в смеси с традиционными фармацевтическими эксципиентами животным и людям для профилактики или лечения ранее упомянутых нарушений или заболеваний. Соответствующие стандартные лекарственные формы для введения включают в себя формы для перорального приема, такие как таблетки, капсулы с мягкой или твердой желатиновой оболочкой, порошки, гранулы и растворы или суспензии для приема внутрь, формы для приема сублингвально, трансбуккально, интратрахеально, интраокулярно, интраназально, путем ингаляции, формы для введения топическим, чрескожным, подкожным, внутримышечным или внутривенным путем, формы для введения ректально и имплантаты. Для топического нанесения соединения по настоящему изобретению можно использовать в виде кремов, гелей, помад или лосьонов. В качестве примера стандартная лекарственная форма соединения по настоящему изобретению в форме таблеток может содержать следующие компоненты, мг: соединение по настоящему изобретению 50,0; маннит 223,75; кроскармеллоза натрия 6,0; кукурузный крахмал 15,0; гидроксипропилметилцеллюлоза 2,25; стеарат магния 3,0. Упомянутые стандартные лекарственные формы вводят для обеспечения введения суточной дозы в интервале от 0,01 до 20 мг действующего вещества на 1 кг массы тела в соответствии с галеновой формой. Могут иметь место особые случаи, в которых дозы устанавливают увеличенными или уменьшенными; такие дозы также охватывает настоящее изобретение. По принятой практике соответствующие дозы для каждого больного определяются врачом в зависимости от способа введения, массы тела и реакции больного. Настоящее изобретение в одном из других своих аспектов относится также к способу лечения упомянутых ранее патологий, который включает в себя введение пациенту эффективной дозы соединения по настоящему изобретению, или одной из его фармацевтически приемлемых солей, или гидратов, или сольватов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, соответствующее формуле (I) где R представляет собой атом водорода или галогена,или фенил, замещенный при необходимости одним или несколькими атомами галогенов, одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси, нитро, амино, ди(C1C3)алкиламино, трифторметила, трифторметокси, циано, гидрокси, ацетила или метилендиокси; или группу, выбранную из пиридинила, пиразолила, имидазолила, триазолила, тетразолила, оксазолила, тиазолила, оксадиазолила, тиадиазолила, тиенила, фурила, изоксазолила, изотиазолила, пирролила,нафтила, причем такая группа при необходимости может быть замещенной одной или несколькими группами, выбранными из атомов галогенов, (C1-C6)алкила, (С 1-С 6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино,(C1-C6)алкиламино или ди(C1-C6)алкиламино; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. 2. Соединение формулы (I) по п.1, отличающееся тем, что R представляет собой атом галогена; или фенил, замещенный при необходимости одним или несколькими атомами галогенов, одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси; или группу, выбранную из пиридинила, пиразолила, имидазолила, триазолила, тетразолила, оксазолила, тиазолила, оксадиазолила, тиадиазолила, тиенила, фурила, изоксазолила, изотиазолила, пирролила,нафтила, причем такая группа при необходимости может быть замещенной одним или несколькими (C1C6) алкилами; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. 3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что R представляет собой атом галогена; или фенил, замещенный при необходимости одним или несколькими атомами галогенов, одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси; или группу, выбранную из пиридинила, пиразолила, имидазолила, тиенила, фурила, пирролила,причем такая группа при необходимости может быть замещенной одним или несколькими (C1-9 013601C6)алкилами; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. 4. Способ получения соединения формулы (I) по любому из пп.1-3, отличающийся тем, что соединение формулы (VII) вводят в реакцию с бороновой кислотой формулы R-B(OH)2, в которой R является таким, как определено в общей формуле (I), в присутствии палладиевого катализатора; или с соединением формулы R-H, в которой R является таким, как определено в общей формуле (I),в присутствии сильного основания в растворителе; или с производным олова формулы R-Sn[(СН 2)3 СН 3)]3, в которой R является таким, как определено в общей формуле (I), в присутствии палладиевого катализатора; или с соединением формулы R-H, в которой R является таким, как определено в общей формуле (I),в присутствии н-бутиллития, хлорида цинка и палладиевого катализатора. 5. Лекарственное средство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-3 или аддитивную соль такого соединения с фармацевтически приемлемой кислотой или также гидрат или сольват соединения формулы (I). 6. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-3 или фармацевтически приемлемую соль, гидрат или сольват такого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. 7. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения и профилактики когнитивных расстройств; поражений процессов, определяющих внимание; расстройств исполнительных функций, связанных с болезнью Альцгеймера, патологическим или нормальным старением, синдромом Паркинсона, трисомией 21, психическими патологиями, алкогольным синдромом Корсакова, сосудистыми деменциями, черепными травмами; двигательных расстройств, наблюдаемых при болезни Паркинсона или других неврологических болезнях или анатомо-гисто-патологических поражениях, связанных с указанными нейродегенеративными болезнями. 8. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения или профилактики сосудистых повреждений головного мозга, случаев гипоксии головного мозга, психических патологий. 9. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения или профилактики симптомов, обусловленных лишением табака, алкоголя, различных субстанций, вызывающих зависимость. 10. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения боли. 11. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения ишемии нижних конечностей, облитерирующего артериита нижних конечностей, ишемии сердца, инфаркта миокарда, сердечной недостаточности, ухудшения заживления поражений кожи у больных диабетом, варикозных язв при венозной недостаточности. 12. Применение соединения формулы (I) по любому из пп.1-3 для получения лекарственного средства, предназначенного для лечения воспалительных процессов.
МПК / Метки
МПК: A61P 25/00, A61K 31/439, C07D 471/18
Метки: октана, применение, терапии, 3.2.1, 5-пиридазинил-1-азабицикло, производные, получение
Код ссылки
<a href="https://eas.patents.su/11-13601-proizvodnye-5-piridazinil-1-azabiciklo-321-oktana-ih-poluchenie-i-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5-пиридазинил-1-азабицикло [3.2.1] октана, их получение и применение в терапии</a>
Предыдущий патент: Производные пиразоло[3, 4-d]азепина как антагонисты н3-рецепторов гистамина
Следующий патент: Антагонисты рецептора гистамина-3
Случайный патент: Заготовка для пластикового контейнера, разработанного специально для упаковки продуктов питания















