Способ получения высокочистого периндоприла и промежуточных веществ, пригодных для синтеза
Номер патента: 9277
Опубликовано: 28.12.2007
Авторы: Порч-Маккаи Марта, Манди Аттила, Мезеи Тибор, Шимиг Дьюла
Формула / Реферат
1. Способ получения 1-{2(S)-[1(S)-(этоксикарбонил)бутиламино]пропионил}-(3aS,7aS)-октагидроиндол-2(S)-карбоновой кислоты формулы I
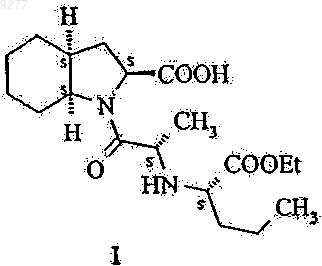
или ее трет-бутиламиновой соли формулы I'
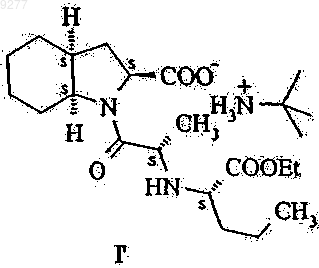
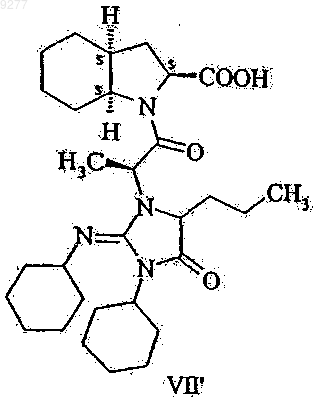
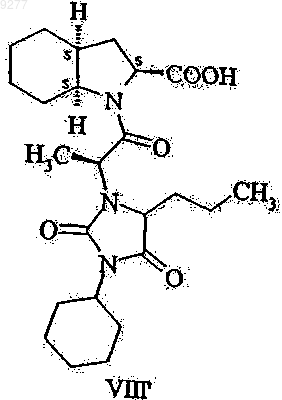
не имеющих примесей, получаемых из дициклогексилкарбодиимида и в особенности свободных от соединений формул VII' и VIII'
который включает введение в реакцию соединения формулы II
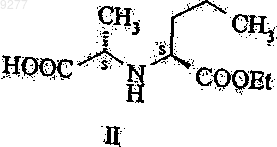
с подходящим производным угольной кислоты; активирование тионилхлоридом полученного таким образом соединения общей формулы III

где R означает низший алкил или арил-низший алкил;
введение в реакцию активированного соединения, полученного таким образом, с соединением формулы IV
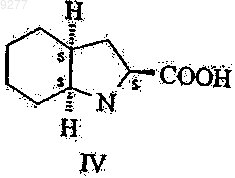
и, при необходимости, введение полученного таким образом соединения формулы I в реакцию с трет-бутиламином.
2. Способ по п.1, который включает применение в качестве производного угольной кислоты метилхлорформиата, этилхлорформиата, бензилхлорформиата или ди-трет-бутилдикарбоната.
3. Способ по любому из пп.1-2, который включает проведение ацилирования соединения формулы II в присутствии основания, предпочтительно карбоната щелочного металла, гидрокарбоната щелочного металла или третичного амина.
4. Способ по п.3, который включает применение карбоната натрия, карбоната калия или триэтиламина в качестве основания.
5. Способ по любому из пп.2-4, который включает выполнение реакции в инертном органическом растворителе.
6. Способ по п.5, который включает применение галогенированного алифатического углеводорода, ароматического углеводорода, сложного эфира или кетона в качестве растворителя.
7. Способ по п.5, который включает применение ацетона в качестве растворителя.
8. Способ по п.1, который включает применение тионилхлорида в молярном соотношении 1,1-2, предпочтительно 1,5-1,7 относительно 1 моля соединения общей формулы III.
9. Способ по п.8, который включает проведение активирования соединения общей формулы III с помощью тионилхлорида в инертном органическом растворителе.
10. Способ по п.9, который включает применение галогенированного алифатического углеводорода, сложного эфира или простого эфира в качестве инертного органического растворителя.
11. Способ по п.10, который включает применение дихлорметана.
12. Способ по п.1, который включает проведение реакции с соединением формулы IV в инертном органическом растворителе.
13. Способ по п.12, который включает применение галогенированного алифатического углеводорода, сложного эфира или простого эфира в качестве инертного органического растворителя.
14. Способ по п.13, который включает применение тетрагидрофурана или дихлорметана.
15. Соединения общей формулы III
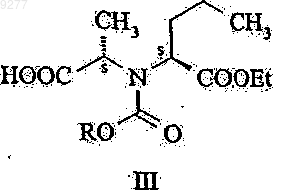
где R означает низший алкил или арил-низший алкил.
16. Соединения по п.15, в которых R означает метил, этил, третичный бутил или бензил.
17. Способ получения соединений общей формулы III по п.16, который включает введение в реакцию соединения формулы II
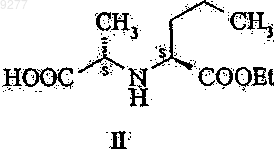
с подходящим производным угольной кислоты.
18. Способ по п.17, который включает применение в качестве производного угольной кислоты метилхлорформиата, этилхлорформиата, бензилхлорформиата или ди-трет-бутилдикарбоната.
19. Способ по любому из пп.17 или 18, который включает проведение ацилирования соединения формулы II в присутствии основания, предпочтительно карбоната щелочного металла, гидрокарбоната щелочного металла или третичного амина.
20. Способ по п.19, который включает применение карбоната натрия, карбоната калия или триэтиламина в качестве основания.
21. Способ по любому из пп.17-20, который включает выполнение реакции в инертном органическом растворителе.
Текст
009277 Настоящее изобретение относится к способу получения высокочистого периндоприла и промежуточных веществ, пригодных для синтеза периндоприла. В частности, изобретение касается способа синтеза высокочистого периндоприла, не имеющего определенных примесей, промежуточных веществ, полезных для синтеза, и способа получения указанных промежуточных веществ. Периндоприл, в частности его трет-бутиламиновая соль, обладает ценными фармакологическими свойствами. Основной активностью периндоприла является ингибирование превращения фермента ангиотензина I (или киназы II) в октапептид ангиотензина II; таким образом, он представляет собой АСЕ ингибитор. Указанный выше благотворный эффект периндоприла позволяет использовать этот активный ингредиент при лечении сердечно-сосудистых заболеваний, особенно артериальной гипертензии и сердечной недостаточности. Впервые периндоприл был упомянут в ЕР 0049658. Однако синтез периндоприла не проиллюстрировали. Промышленный синтез периндоприла описан в ЕР 0308341. Структуры соединений формулы I-XII,I', VII' и VIII' описаны в приложении на фиг. 1 и 2. Согласно этому способу соединение формулы V вводят в реакцию с соединением формулы II в присутствии дициклогексилкарбодиимида и 1-гидроксибензотриазола, после этого бензиловый сложный эфир формулы VI дебензилируют с получением периндоприла формулы I, который затем превращают в соль формулы I' взаимодействием с трет-бутиламином. Недостатком этого метода является то, что чистота периндоприла, полученного таким способом,является неудовлетворительной и по этой причине требуются серии стадий очистки для обеспечения продукта, отвечающего строгим требованиям к качеству фармацевтически активных ингредиентов. Причиной указанного недостатка является то, что реакцию сочетания соединений формул V и II выполняют в присутствии дициклогексилкарбодиимида, что приводит к образованию значительного количества примесей бензиловых сложных эфиров формул VII и VIII, которые трансформируются посредством дебензилирования в соединения формул VII' и VIII'. Удаление указанных примесей связано со значительными сложностями. Согласно неопубликованной французской патентной заявке 01.09839 дигидроиндол-2-карбоновую кислоту или ее сложный эфир общей формулы IX (в которой R1 означает водород или низший алкил,содержащий 1-6 атомов углерода) вводят в реакцию с соединением общей формулы X (в которой R2 представляет собой аминозащитную группу) в органическом растворителе в отсутствие или в присутствии не более чем 0,6 моль 1-гидроксибензотриазола относительно 1 моля соединения общей формулы IX и 1-1,2 моля дициклогексилкарбодиимида относительно 1 моля соединения формулы IX, подвергая соединение общей формулы XI, полученное таким образом (в которой R1 и R2 принимают значения, указанные выше), каталитическому гидрогенированию и превращая соединение формулы XII, полученное таким образом (в которой R1 и R2 принимают значения, указанные выше), в периндоприл известным способом. Целью настоящего изобретения является обеспечение способа получения высокочистого периндоприла, не имеющего примесей, получаемых из дициклогексилкарбодиимида, в частности соединений формул VII' и VIII'. Указанная выше цель достигается с помощью способа и новых промежуточных веществ настоящего изобретения. Объектом изобретения данного изобретения является способ получения 1-2(S)-[1(S)(этоксикарбонил)бутиламино]пропионил-(3aS,7aS)-октагидроиндол-2(S)-карбоновой кислоты формулы не имеющих примесей, получаемых из дициклогексилкарбодиимида, и в особенности свободных от соединений формул VII' и VIII' который включает введение в реакцию соединения формулы II с подходящим производным угольной кислоты; активирование тионилхлоридом полученного таким образом соединения общей формулы III и, при необходимости, введение полученного таким образом соединения формулы I в реакцию с третбутиламином. Объектом изобретения также является соединение общей формулы III где R означает низший алкил или арил-низший алкил. Предпочтительными соединениями являются соединения, у которых R означает метил, этил, третичный бутил или бензил. Еще одним объектом изобретения является способ получения соединений общей формулы III, который включает введение в реакцию соединения формулы II с подходящим производным угольной кислоты. Синтез пептидной связи обычно включает реакцию карбоксиактивированной N-защищенной аминокислоты с карбоксизащищенной аминокислотой. Хлорангидриды N-ацил- или особенно N-алкоксикарбониламинокислот (получаемые из кислот формулы III) представляют собой одну из классических групп производных карбоксиактивированной N-защищенной аминокислоты. Известны два метода образования пептидной связи, исходя из хлорангидридов N-алкоксикарбониламинокислоты (см.: Houben-Weyl: Methoden der Organischen Chemie Band XV/II, стр. 355-363): реакция со сложными эфирами аминокислоты в органическом растворителе в присутствии эквивалента основания,реакция с аминокислотами в щелочном водном растворе (в условиях реакции Шоттен-Баумана). В современной практике хлорангидриды аминокислот рассматриваются как сверхактивные вещества, ведущие к нежелательным побочным реакциям, поэтому предпочтительными являются альтернативные методы карбоксиактивации, например применение DCC (см.: R.С. Sheppard: Peptide Synthesis inComprehensive Organic Chemistry, том 5, стр. 339-352, под редакцией Е. Haslam, Pergamon Press, Oxford,1994). Настоящее изобретение основывается на представлении, что новые N-алкокси(аралкокси)карбониламинокислоты общей формулы III могут быть успешно активированы тионилхлоридом и активированное производное карбоновой кислоты, полученное таким образом, предпочтительно может быть использова-2 009277 но для ацилирования аминокислоты формулы IV в органическом растворителе с образованием требуемого соединения формулы I в одну стадию реакции. Это представление является неожиданным в нескольких отношениях: реакцию выполняют в органическом растворителе при отсутствии основания и не в щелочном водном растворе, как предложено в предыдущем уровне техники; "сверхактивный" характер хлорангидридов аминокислот, указанный выше, не вызывает нежелательные побочные реакции, и алкокси(аралкокси)карбонилзащитную группу удаляют в течение процесса образования пептида. Это представление является даже более неожиданным, так как во всех раскрытых в настоящее время синтезах периндоприла производное угольной кислоты всегда активировали дициклогексилкарбодиимидом, что приводило к образованию нежелательных примесей. Применение тионилхлорида как активирующего агента является чрезвычайно предпочтительным. С одной стороны, не образуются никакие сложно удаляемые побочные продукты, в то время, как, с другой стороны, газообразный хлороводород и диоксид серы, которые образуются в реакции, могут быть легко удалены из реакционной смеси. Определения, использованные в настоящей патентной заявке и в формуле изобретения, следует интерпретировать, как изложено ниже. Термин "низший алкил" относится к алкильным группам, имеющим линейную или разветвленную цепь, которые содержат 1-6 атомов углерода (например, метил, этил, н-пропил, изопропил, н-бутил, вторичный бутил, третичный бутил, н-пентил, н-гексил и т.д.), предпочтительно метил, этил или третичный бутил. Термин "аралкил" относится к алкильным группам, как указано выше, замещенным одной или двумя арильными группами (например, бензил, бета-фенилэтил, бета-бета-дифенилэтил и т.д.; предпочтительно бензил). В соответствии с первой стадией синтеза периндоприла согласно настоящему изобретению соединение формулы II ацилируют с помощью подходящего производного угольной кислоты. Этот процесс выполняют способом, известным per se. В качестве производного угольной кислоты предпочтительно могут быть использованы соответствующие алкилхлорформиаты или диалкилдикарбонаты. Метоксикарбонильная, этоксикарбонильная и бензилоксикарбонильная группы могут быть предпочтительно введены с помощью метилхлорформиата, этилхлорформиата и бензилхлорформиата, соответственно. Третичная бутоксикарбонильная группа может быть предпочтительно введена с использованием ди-трет-бутилдикарбоната. Реакцию ацилирования выполняют в предпочтительно инертном органическом растворителе и предпочтительно в присутствии основания. В качестве инертного органического растворителя предпочтительно могут быть использованы галогенированные алифатические углеводороды (например, дихлорметан, дихлорэтан или хлороформ), сложные эфиры (например, этилацетат) или кетоны (например,ацетон). Предпочтительно в качестве растворителя может быть использован ацетон. Реакция может быть выполнена в присутствии неорганического или органического основания. В качестве неорганического основания предпочтительно могут быть использованы карбонаты щелочных металлов (например, карбонат натрия или карбонат калия) или гидрокарбонаты щелочных металлов (например, гидрокарбонат натрия или гидрокарбонат калия). В качестве органического основания предпочтительно могут быть использованы триалкиламины (например, триэтиламин) или пиридин. Предпочтительно в качестве основания может быть использован карбонат щелочного металла или триэтиламин. Реакцию предпочтительно выполняют при температуре от 0 до 30 С, в частности при комнатной температуре. Предпочтительно реакцию можно осуществлять путем получения реакционной смеси при низкой температуре приблизительно 0-5 С, затем позволяя реакционной смеси нагреться до комнатной температуры и выполняя реакцию при этой температуре в течение нескольких часов. Реакционную смесь обрабатывают обычным способом. Можно осуществлять предпочтительно путем обработки реакционной смеси после выпаривания кислотой, экстрагируя смесь с помощью органического растворителя, экстрагируя органическую фазу с помощью водного раствора, щелочного гидроксида, подкисляя водный слой и экстрагируя соединение общей формулы III, полученное в органическом растворителе. Сырой продукт, полученный при выпаривании органической фазы, может быть непосредственно использован для дальнейшей реакции без какой-либо очистки. Соединение общей формулы III, полученное таким образом, является новым и также представляет собой цель настоящего изобретения. В соответствии со следующей стадией синтеза периндоприла согласно настоящему изобретению соединение общей формулы III активируют тионилхлоридом. На этой стадии тионилхлорид предпочтительно используют предпочтительно в избытке, предпочтительно в молярном соотношении 1,1-2, в особенности 1,5-1,7 относительно 1 моля соединения общей формулы III. Реакцию предпочтительно выполняют в инертном органическом растворителе. В качестве реакционной среды предпочтительно могут быть использованы галогенированные алифатические углеводороды (например, дихлорметан, дихлорэтан или хлороформ), сложные эфиры (например, этилацетат) или эфиры (например, диэтиловый эфир, тетрагидрофуран, диоксан). Реакция может быть выполнена особенно преимущественно в дихлорметане в качестве реакционной среды. Реакцию выполняют при температуре от 0 до 30 С, в частности при комнатной температуре. Можно осуществлять реакцию предпочтительно путем получения реакционной смеси при низкой температуре 0-5 С, после этого позволяя реакционной смеси нагреться до комнатной-3 009277 температуры и выполняя реакцию при этой температуре в течение нескольких часов. После того, как активация с помощью тионилхлорида будет завершена, избыток тионилхлорида удаляют вместе с соляной кислотой и диоксидом серы. Активированное соединение, полученное из соединения общей формулы III, вводят в реакцию с соединением формулы IV. Соединение формулы IV представляет собой пергидроиндол-2-карбоновую кислоту. Реакцию предпочтительно выполняют в инертном органическом растворителе. В качестве реакционной среды предпочтительно могут быть использованы галогенированный алифатический углеводород(например, диэтиловый эфир, тетрагидрофуран или диоксан). Реакция может быть выполнена особенно преимущественно в тетрагидрофуране или дихлорметане в качестве реакционной среды. Реакцию выполняют при нагревании, предпочтительно в точке кипения реакционной среды, преимущественно при орошении. Реакция происходит за несколько часов. Соединение формулы IV используют в количестве 0,5-0,9, предпочтительно 0,7-0,8 моль относительно 1 моля соединения общей формулы III. После того,как реакция ацилирования будет завершена, реакционную смесь концентрируют в вакууме. Периндоприл формулы I может быть превращен в трет-бутиламиновую соль формулы I' реакцией с трет-бутиламином. Образование соли может быть выполнено способом, известным per se. Реакцию образования соли предпочтительно выполняют в инертном органическом растворителе, предпочтительно этилацетате. трет-Бутиламин используют предпочтительно в приблизительно эквимолярном количестве. 1-2(S)-[1(S)-(Этоксикарбонил)бутиламино]пропионил-(3aS,7aS)октагидроиндол-2(S)-карбоновая кислота формулы I и ее трет-бутиламиновая соль формулы I', не имеющие примесей, получаемых из дициклогексилкарбодиимида, могут быть использованы для терапии в форме фармацевтических композиций. Получение указанных фармацевтических композиций, дозировочные формы и схема суточной дозировки подобны описанным в предыдущем уровне техники для композиции и фармацевтического применения периндоприла. Исходное вещество формулы II описано в ЕР 0308340, ЕР 0308341 и ЕР 0309324. Кислота формулыIV описана в ЕР 0308339 и ЕР 0308341. Преимуществом настоящего изобретения является то, что настоящее изобретение обеспечивает высокочистый периндоприл, не имеющий примесей, получаемых из дициклогексилкарбодиимида. Способ является простым и может быть легко увеличен в масштабе. Особым преимуществом настоящего изобретения является то, что полностью устраняется применение дициклогексилкарбодиимида и поэтому нет никакой даже теоретической возможности образования примесей, которые могут быть получены из дициклогексилкарбодиимида. Дополнительное преимущество: ацилирование может быть выполнено с помощью кислоты формулы IV. Защита карбоксильной группы не требуется. Дополнительные подробности настоящего изобретения раскрыты в последующих примерах без ограничения объема защиты приведенными примерами. Примеры Получение N-[2-(этоксикарбонил)бутил]-N-алкоксикарбонилаланина Пример 1. N-[2-(Этоксикарбонил)бутил]-N-этоксикарбонилаланин. К суспензии N-[2-(этоксикарбонил)бутил]аланина (21,7 г, 100 ммоль) в ацетоне (250 мл) добавили раствор триэтиламина (27,7 мл, 20,2 г, 200 ммоль) в ацетоне (50 мл) и затем этилхлорформиат (24,8 мл,28,2 г, 260 ммоль) при 0-5 С. После перемешивания в течение 2 ч при комнатной температуре растворитель выпарили и осадок перемешивали со смесью воды (200 мл) и концентрированной соляной кислоты(2 мл) в течение 8 ч при комнатной температуре. Смесь экстрагировали с помощью этилацетата (200 мл) и раствор в этилацетате экстрагировали с помощью холодного водного раствора гидроксида натрия (приготовленного изо льда (100 г) и водного раствора гидроксида натрия (1N, 200 мл. Концентрированную соляную кислоту (15 мл) добавили к водному слою и смесь экстрагировали с помощью этилацетата (200 мл). После высушивания и выпаривания получили N-[2-(этоксикарбонил)бутил]-N-этоксикарбонилаланин(23,8 г, 82%) в виде желтого масла, которое может быть использовано в следующей реакции без дополнительной очистки. ИК (пленка): 3500-2400 (ОН st), 1709 (С=О st), 1200 (С-O st), 898 (ОН вне плоскости b), см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц):10,14 (1H, шс, СООН), 4,99 и 4,58 (1 Н, дд, J=4,5, 10,0 Гц, N-CHCH2-CH2-CH3), 4,29 (2 Н, кв, J=7,1 Гц, N-C(O)-O-CH2-СН 3), 4,24-4,13 (2 Н, м, СН-С(О)-О-СН 2-СН 3), 3,84(3 Н, тр., J=7,1 Гц, N-С(О)-О-СН 2-СН 3), 0,99 (3 Н, тр., J=7,3 Гц, N-СН-СН 2-СН 2-СН 3). 13 С-ЯМР (CDCl3, ТМС, 400 МГц):176,4 и 175,8, 172,5, 155,8, 63,0, 62,7, 58,9, 53,8, 31,4, 19,8, 16,6,14,0, 13,9, 13,5 (сигналы основного ротамера). Пример 2. N-[2-(Этоксикарбонил)бутил]-N-метоксикарбонилаланин. К суспензии N-[2-(этоксикарбонил)бутил]аланина (4,35 г, 20 ммоль) в ацетоне (50 мл) добавили раствор триэтиламина (5,5 мл, 4,05 г, 40 ммоль) в ацетоне (10 мл) и затем метилхлорформиат (4,0 мл,4,91 г, 52 ммоль) при 0-5 С. После перемешивания в течение 2 ч при комнатной температуре раствори-4 009277 тель выпарили и осадок перемешивали со смесью воды (40 мл) и концентрированной соляной кислоты(0,4 мл) в течение 8 ч при комнатной температуре. Смесь экстрагировали с помощью этилацетата (40 мл) и раствор в этилацетате экстрагировали с помощью холодного водного раствора гидроксида натрия (приготовленного изо льда (20 г) и водного раствора гидроксида натрия (1N, 40 мл. Концентрированную соляную кислоту (3 мл) добавили к водному слою и смесь экстрагировали с помощью этилацетата (40 мл). После высушивания и выпаривания получили N-[2-(этоксикарбонил)бутил]-N-метоксикарбонилаланина(3,84 г, 70%) в виде желтого масла, которое может быть использовано в следующей реакции без дополнительной очистки. ИК (пленка): 3400 (ОН st), 1713 (С=О st), 1294 (ОН в плоскости b), 1205 (С-O st сложный эфир) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц):10,2 (1 Н, шс, СООН), 5,00 и 4,60 (1 Н, с, CH-СН 2-СН 2-СН 3),4,28 (2 Н, кв, J=7,2 Гц, О-СН 2-СН 3), 3,96 и 3,85 (1 Н, м, СН-СН 3), 3,75 (3 Н, с, ОСН 3), [2,10-1,98 (1 Н, м) и 1,74-1,62 (1 Н, м) СН-CH2-СН 2-СН 3], 1,56-1,42 (2 Н, м, СН-СН 2-СН 2-СН 3), 1,50 (3 Н, д, J=6,9 Гц, СН-СН 3),1,33 (3 Н, т, J=7,2 Гц, О-СН 2-СН 3), 0,99 (3 Н, т, J=7,3 Гц, СН-СН 2-СН 2-СН 3). Пример 3. N-[2-(Этоксикарбонил)бутил]-N-трет-бутилоксикарбонилаланин. К суспензии N-[2-(этоксикарбонил)бутил]аланина (1,1 г, 5 ммоль) и карбоната калия (0,76 г, 5,5 ммоль) в ацетоне (15 мл) добавили ди-трет-бутилдикарбонат (1,20 г, 5,5 ммоль) и воду (1,25 мл) при 0-5 С. После перемешивания в течение 2 ч при комнатной температуре смесь охладили и твердый осадок отфильтровали. Добавили этилацетат (15 мл), лед (5 г) и водный раствор NaOH (1N, 10 мл). После перемешивания в течение 5 мин слои разделили. К водному слою добавили концентрированную соляную кислоту (1,5 мл) и смесь экстрагировали с помощью этилацетата (15 мл). После высушивания и выпаривания получили N-[2-(этоксикарбонил)бутил]-N-t-бутилоксикарбонилаланина (0,61 г, 38%) в виде желтого масла, которое может быть использовано в следующей реакции без дополнительной очистки. ИК (KBr): 3400 (ОН st), 1705 (С=О st кислота), 1299 (ОН в плоскости b) 1690 (С=О st амид), 1771(1 Н, м), СН-CH2-СН 2-СН 3], 1,56-1,42 (2 Н, м, СН-СН 2-СН 2-СН 3), 1,49 (3 Н, д, J=6,8 Гц, СН-СН 3), 1,46 (9 Н,с, С(СН 3)3), 1,34 (3 Н, т, J=7,1 Гц, О-СН 2-СН 3), 0,99 (3 Н, т, J=7,3 Гц, СН-СН 2-СН 2-СН 3). Пример 4. N-[2-(Этоксикарбонил)бутил]-N-бензилоксикарбонилаланин. К суспензии N-[2-(этоксикарбонил)бутил]аланина (2,2 г, 10 ммоль) и калия карбоната (2,2 г, 16 ммоль) в смеси ацетона (30 мл) и воды (2,5 мл) добавили бензилхлорформиат (2,0 мл, 2,4 г, 14 ммоль) при 0-5 С. После перемешивания в течение 2 ч при комнатной температуре твердый осадок отфильтровали, растворитель выпарили, осадок перемешали с холодным водным раствором гидроксида натрия (приготовленным изо льда (20 г) и водного раствора гидроксида натрия (1N, 40 мл и экстрагировали с помощью этилацетата (40 мл). Водный слой подкислили водным раствором соляной кислоты 1/1 (20 мл) и смесь экстрагировали с помощью этилацетата (40 мл). После высушивания и выпаривания получили N-[2(этоксикарбонил)бутил]-N-бензилоксикарбонилаланина (1,66 г, 47%) в виде желтого масла, которое может быть использовано в следующей реакции без дополнительной очистки. ИК (пленка): 3400 (ОН st), 1710 (С=О st), 699 (СН аром.) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц):9,0 (1H, шс, СООН), 5,00 (5 Н, м, Ph), 5,2-5,1 (2 Н, м, Ph-CH2),4,96 и 4,57 (1H, дд, J=9,6, 4,8, N-CH-CH2-CH2-CH3), 4,26 и 4,12 (2 Н, кв, J=7,1 Гц, О-CH2-СН 3), 4,02 и 3,89(1 Н, кв, J=6,9 Гц, СН-СН 3), [2,10-1,93 (1 Н, м) и 1,72-1,62 (1 Н, м), СН-СН 2-СН 2-СН 3], 1,54 и 1,48 (3 Н, д,J=7,0 Гц, СН-СН 3), 1,56-1,42 (2 Н, м, СН-СН 2-СН 2-СН 3), 1,31 и 1,22 (3 Н, т, J=7,2 Гц, О-СН 2-СН 3), 0,98 и 0,93 (3 Н, т, J=7,3 Гц, СН-СН 2-СН 2-СН 3). Получение периндоприлэбурмина Пример 5. Ацилирование пергидроиндол-2-карбоновой кислоты с использованием N-[2-(этоксикарбонил)бутил]-N-этоксикарбонилаланина. К раствору N-[2-(этоксикарбонил)бутил]-N-этоксикарбонилаланин (10,1 г, 35 ммоль) в дихлорметане (35 мл) добавили тионилхлорид (4,2 мл, 6,9 г, 58 ммоль) по каплям при 0-5 С. Перемешивали при комнатной температуре в течение 2-3 ч. Растворитель выпарили с получением красноватого масла. Осадок растворили в ТГФ (37,5 мл) и добавили его к суспензии пергидроиндол-2-карбоновой кислоты (4,7 g,28 ммоль) в ТГФ (37,5 мл). Суспензию нагревали с орошением при перемешивании в течение 4-4,5 ч до образования коричневатого раствора. После выпаривания растворителя осадок растворили в этилацетате(120 мл), трет-бутиламин (2,8 мл, 1,95 г, 27 ммоль) в этилацетате (60 мл) добавили медленно к перемешиваемому раствору, полученному при отделении кристаллической массы. Смесь нагревали до образования раствора, затем обработали с помощью угля. Кристаллический продукт, полученный после охлаждения, отфильтровали с получением периндоприлэбурмина (6,8 г, 55%). Пример 6. Ацилирование пергидроиндол-2-карбоновой кислоты с использованием N-[2-(этоксикарбонил)бутил]-N-метоксикарбонилаланина. Периндоприлэбурмин получили аналогично примеру 5, используя N-[2-(этоксикарбонил)бутил]-Nметоксикарбонилаланин (3,4 г, 12,5 ммоль) и пергидроиндол-2-карбоновую кислоту (1,7 г, 10 ммоль).-5 009277 Полученный кристаллический продукт отфильтровали с получением периндоприлэбурмина (2,4 г, 54%). Пример 7. Ацилирование пергидроиндол-2-карбоновой кислоты с использованием N-[2-(этоксикарбонил)бутил]-N-t-бутоксикарбонилаланина. Периндоприлэбурмин получили аналогично примеру 5, используя N-[2-(этоксикарбонил)бутил]-Nt-бутоксикарбонилаланин (0,69 г, 2,2 ммоль) и пергидроиндол-2-карбоновую кислоту (0,29 г, 1,7 ммоль). Полученный кристаллический продукт отфильтровали с получением периндоприлэбурмина (0,37 г, 49%). Пример 8. Ацилирование пергидроиндол-2-карбоновой кислоты с использованием N-[2-(этоксикарбонил)бутил]-N-бензилоксикарбонилаланина. Периндоприлэбурмин получили аналогично примеру 5, используя N-[2-(этоксикарбонил)бутил]-Nбензилоксикарбонилаланин (1,41 г, 4 ммоль) и пергидроиндол-2-карбоновую кислоту (0,51 г, 3 ммоль). Полученный кристаллический продукт отфильтровали с получением периндоприлэбурмина (0,60 г, 45%). Пример 9. Ацилирование пергидроиндол-2-карбоновой кислоты с использованием N-[2-(этоксикарбонил)бутил]-N-этоксикарбонилаланина. К раствору N-[2-(этоксикарбонил)бутил]-N-этоксикарбонилаланина (1,45 г, 5 ммоль) в дихлорметане (7,5 мл) добавили тионилхлорид (0,6 мл, 0,98 г, 8,5 ммоль) по каплям при 0-5 С. Перемешивали при комнатной температуре в течение 2-3 ч. Избыток тионилхлорида и образовавшиеся диоксид серы и хлороводород удалили в слабом вакууме. К раствору дихлорметана, полученного таким образом, добавили пергидроиндол-2-карбоновую кислоту (0,71 г, 4,2 ммоль) и дихлорметан (5,0 мл). Суспензию нагревали с орошением при перемешивании в течение 2 ч до образования коричневатого раствора. После выпаривания растворителя осадок растворили в этилацетате (20 мл), после чего трет-бутиламин (0,42 мл, 0,29 г,4,05 ммоль) в этилацетате (5,0 мл) медленно добавили к перемешиваемому раствору, полученному при отделении кристаллической массы. Смесь нагревали до образования раствора, затем обработали с помощью угля. Кристаллический продукт, полученный после охлаждения, отфильтровали с получением периндоприлэбурмина (0,64 г, 35%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 1-2(S)-[1(S)-(этоксикарбонил)бутиламино]пропионил-(3aS,7aS)октагидроиндол-2(S)-карбоновой кислоты формулы I не имеющих примесей, получаемых из дициклогексилкарбодиимида и в особенности свободных от соединений формул VII' и VIII' который включает введение в реакцию соединения формулы II с подходящим производным угольной кислоты; активирование тионилхлоридом полученного таким образом соединения общей формулы III где R означает низший алкил или арил-низший алкил; введение в реакцию активированного соединения, полученного таким образом, с соединением формулы IV и, при необходимости, введение полученного таким образом соединения формулы I в реакцию с трет-бутиламином. 2. Способ по п.1, который включает применение в качестве производного угольной кислоты метилхлорформиата, этилхлорформиата, бензилхлорформиата или ди-трет-бутилдикарбоната. 3. Способ по любому из пп.1-2, который включает проведение ацилирования соединения формулыII в присутствии основания, предпочтительно карбоната щелочного металла, гидрокарбоната щелочного металла или третичного амина. 4. Способ по п.3, который включает применение карбоната натрия, карбоната калия или триэтиламина в качестве основания. 5. Способ по любому из пп.2-4, который включает выполнение реакции в инертном органическом растворителе. 6. Способ по п.5, который включает применение галогенированного алифатического углеводорода,ароматического углеводорода, сложного эфира или кетона в качестве растворителя. 7. Способ по п.5, который включает применение ацетона в качестве растворителя. 8. Способ по п.1, который включает применение тионилхлорида в молярном соотношении 1,1-2,предпочтительно 1,5-1,7 относительно 1 моля соединения общей формулы III. 9. Способ по п.8, который включает проведение активирования соединения общей формулы III с помощью тионилхлорида в инертном органическом растворителе. 10. Способ по п.9, который включает применение галогенированного алифатического углеводорода,сложного эфира или простого эфира в качестве инертного органического растворителя. 11. Способ по п.10, который включает применение дихлорметана. 12. Способ по п.1, который включает проведение реакции с соединением формулы IV в инертном органическом растворителе. 13. Способ по п.12, который включает применение галогенированного алифатического углеводорода, сложного эфира или простого эфира в качестве инертного органического растворителя. 14. Способ по п.13, который включает применение тетрагидрофурана или дихлорметана. 15. Соединения общей формулы III где R означает низший алкил или арил-низший алкил. 16. Соединения по п.15, в которых R означает метил, этил, третичный бутил или бензил. 17. Способ получения соединений общей формулы III по п.16, который включает введение в реакцию соединения формулы II с подходящим производным угольной кислоты. 18. Способ по п.17, который включает применение в качестве производного угольной кислоты метилхлорформиата, этилхлорформиата, бензилхлорформиата или ди-трет-бутилдикарбоната. 19. Способ по любому из пп.17 или 18, который включает проведение ацилирования соединения формулы II в присутствии основания, предпочтительно карбоната щелочного металла, гидрокарбоната щелочного металла или третичного амина. 20. Способ по п.19, который включает применение карбоната натрия, карбоната калия или триэтиламина в качестве основания. 21. Способ по любому из пп.17-20, который включает выполнение реакции в инертном органическом растворителе.
МПК / Метки
МПК: A61P 9/12, C07D 209/42, C07C 271/22, A61K 31/404
Метки: веществ, способ, синтеза, пригодных, получения, периндоприла, промежуточных, высокочистого
Код ссылки
<a href="https://eas.patents.su/10-9277-sposob-polucheniya-vysokochistogo-perindoprila-i-promezhutochnyh-veshhestv-prigodnyh-dlya-sinteza.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения высокочистого периндоприла и промежуточных веществ, пригодных для синтеза</a>
Предыдущий патент: Конструкции и способы для выработки электроэнергии с регазификацией сжиженного природного газа
Следующий патент: Способ получения неорганических полицветных пигментов из пиритного огарка
Случайный патент: Способ соединения расширяемых труб












