Способ получения хиральных 8-(3-аминопиперидин-1-ил)ксантинов
Номер патента: 12163
Опубликовано: 28.08.2009
Авторы: Пфренгле Вальдемар, Дуран Адиль, Пахур Торстен, Никола Томас
Формула / Реферат
1. Способ получения соединения общей формулы (I)
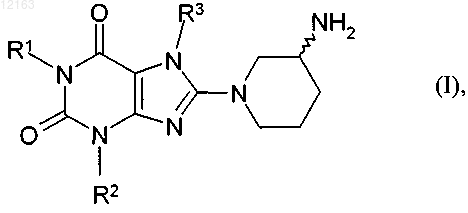
или его энантиомера либо его соли, где
R1 представляет собой фенилкарбонилметильную, бензильную, нафтилметильную, пиридинилметильную, пиримидинилметильную, хинолинилметильную, изохинолинилметильную, хиназолинилметильную, хиноксалинилметильную, нафтиридинилметильную или фенантридинилметильную группу, в которой ароматический, соответственно гетероароматический фрагмент однозамещен или двузамещен идентичными или различными заместителями Ra, где Ra представляет собой атом водорода, фтора, хлора либо брома, цианогруппу, метильную, трифторметильную, этильную, фенильную группу, метокси-, дифторметокси-, трифторметокси- либо этоксигруппу, или два остатка Ra, при условии, что они связаны с соседними атомами углерода, могут представлять собой также группу -О-СН2-О- либо -О-СН2-СН2-О-;
R2 представляет собой метильную, этильную, пропильную, изопропильную, циклопропильную или фенильную группу; а
R3 представляет собой 2-бутен-1-ильную, 3-метил-2-бутен-1-ильную, 2-бутин-1-ильную,
2-фторбензильную, 2-хлорбензильную, 2-бромбензильную, 2-йодбензильную, 2-метилбензильную,
2-(трифторметил)бензильную или 2-цианбензильную группу,
заключающийся в том, что:
а) соединение общей формулы (III)
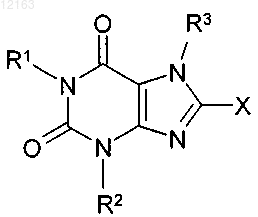
в которой X обозначает уходящую группу, выбранную из группы галогенов или эфиров сульфоновых кислот, a R1-R3 имеют указанные выше значения, подвергают взаимодействию с
3-(фталимидо)пиперидином или его энантиомером;
б) из полученного таким путем соединения общей формулы (II)
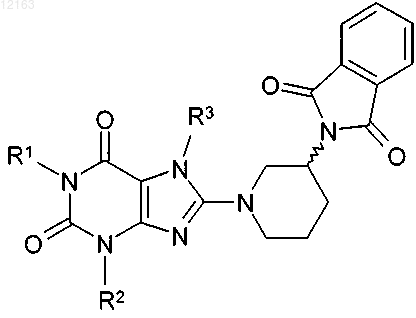
в которой R1-R3 имеют указанные выше значения, удаляют защитную группу и
в) полученное соединение при необходимости переводят в его физиологически совместимую соль.
2. Способ по п.1, где
X обозначает атом хлора или брома,
R1 представляет собой фенилкарбонилметильную, бензильную, нафтилметильную, пиридинилметильную, пиримидинилметильную, хинолинилметильную, изохинолинилметильную, хиназолинилметильную, хиноксалинилметильную или нафтиридинилметильную группу, в которой ароматический, соответственно гетероароматический фрагмент однозамещен или двузамещен идентичными или различными заместителями Ra, где Ra представляет собой атом водорода, фтора либо хлора, цианогруппу, метильную, этильную группу, метокси- или этоксигруппу;
R2 представляет собой метильную, этильную, пропильную, изопропильную, циклопропильную или фенильную группу; а
R3 представляет собой 2-бутен-1-ильную, 3-метил-2-бутен-1-ильную, 2-бутин-1-ильную,
2-фторбензильную, 2-хлорбензильную, 2-бромбензильную, 2-йодбензильную, 2-метилбензильную,
2-(трифторметил)бензильную или 2-цианбензильную группу.
3. Способ по п.2, где
X обозначает атом хлора или брома;
R1 представляет собой цианбензильную, (цианпиридинил)метильную, хинолинилметильную, (метилхинолинил)метильную, изохинолинилметильную, (метилизохинолинил)метильную, хиназолинилметильную, (метилхиназолинил)метильную, хиноксазинилметильную, (метилхиноксалинил)метильную, (диметилхиноксалинил)метильную или нафтиридинилметильную группу;
R2 представляет собой метильную, циклопропильную или фенильную группу; а
R3 представляет собой 2-бутен-1-ильную, 3-метил-2-бутен-1-ильную, 2-бутин-1-ильную,
2-хлорбензильную, 2-бромбензильную или 2-цианбензильную группу.
4. Способ по п.3, где
X обозначает атом брома;
R1 представляет собой (4-метилхиназолин-2-ил)метильную, (3-метилизохинолин-1-ил)метильную или (3-цианпиридин-2-ил)метильную группу;
R2 представляет собой метильную группу; а
R3 представляет собой 2-бутин-1-ильную группу.
5. Способ по одному из пп.1-4, где на стадии а) в качестве реагента используют
(R)-3-(фталимидо)пиперидин.
6. Способ по п.5, где
X обозначает атом брома;
R1 представляет собой (4-метилхиназолин-2-ил)метильную группу;
R2 представляет собой метильную группу; а
R3 представляет собой 2-бутин-1-ильную группу.
7. Способ по п.6, дополнительно включающий кристаллизацию или перекристаллизацию соединения формулы I из раствора метанола или этанола.
8. Способ по п.7, в котором раствор дополнительно содержит трет-бутилметиловый эфир.
9. Способ получения (R)-3-(фталимидо)пиперидина, заключающийся в том, что:
а) рацемический 3-аминопиперидин подвергают в соответствующих растворителях взаимодействию со фталевым ангидридом и
б) (R)-3-(фталимидо)пиперидин отделяют из раствора полученного таким путем рацемического
3-(фталимидо)пиперидина добавлением D-винной кислоты и отделяют выпавший в осадок тартрат.
10. Способ получения (S)-3-(фталимидо)пиперидина, заключающийся в том, что:
а) рацемический 3-аминопиперидин подвергают в соответствующих растворителях взаимодействию со фталевым ангидридом и
б) (S)-3-(фталимидо)пиперидин отделяют из раствора полученного таким путем рацемического
3-(фталимидо)пиперидина добавлением L-винной кислоты и отделяют выпавший в осадок тартрат.
11. Способ получения (S)-3-(фталимидо)пиперидина, заключающийся в том, что:
а) рацемический 3-аминопиперидин подвергают в соответствующих растворителях взаимодействию со фталевым ангидридом,
б) (R)-3-(фталимидо)пиперидин отделяют из раствора полученного таким путем рацемического
3-(фталимидо)пиперидина добавлением D-винной кислоты и отделяют выпавший в осадок тартрат и
в) к полученному таким путем маточному раствору, из которого осаждали первую соль, добавляют L-винную кислоту и отделяют выпавший в осадок тартрат (S)-3-(фталимидо)пиперидина.
12. Способ по одному из пп.9-11, где на стадии б) в качестве растворителя используют этанол.
13. (R)-3-(фталимидо)пиперидин.
14. (S)-3-(фталимидо)пиперидин.
Текст
012163 Настоящее изобретение относится к усовершенствованному способу получения хиральных 8-(3-аминопиперидин-1-ил)ксантинов, их энантиомеров и их физиологически совместимых солей. 8-(3-Аминопиперидин-1-ил)ксантины следующей общей структурной формулы в которой R1 представляет собой, например, необязательно замещенную арилметильную группу или необязательно замещенную гетероарилметильную группу;R3 представляет собой, например, необязательно замещенную бензильную группу или прямоцепочечную либо разветвленную алкенильную или алкинильную группу,уже известны из WO 02/068420, WO 04/018468, WO 04/018467, WO 2004/041820 и WO 2004/046148, где описаны соединения с ценными фармакологическими свойствами, к которым относится, прежде всего,подавляющее активность дипептидилпептидазы-IV (DPP-IV) действие. Поэтому соединения такого типа могут применяться для предупреждения или лечения заболеваний либо болезненных состояний, которые связаны с повышенной активностью DPP-IV или которые можно предотвратить либо, по меньшей мере, снизить их остроту за счет уменьшения активности DPP-IV, прежде всего сахарного диабета типа I или типа II, предиабета или снижения толерантности к глюкозе. В WO 04/018468 описан способ получения 8-(3-аминопиперидин-1-ил)ксантинов путем удаления защитной трет-бутилоксикарбонильной группы из соответствующего производного общей формулы (II) При осуществлении этого способа, прежде всего в промышленном масштабе, образовывались трудно отделяемые примеси, обусловленные наличием используемой защитной группы. По этой причине такой способ оказался не пригодным для промышленного получения 8-(3-аминопиперидин-1 ил)ксантинов, прежде всего для получения лекарственных веществ с их строгими требованиями к чистоте. Еще один недостаток этого известного способа заключался в сложности и высокой стоимости получения энантиомерно чистого предшественника, т.е. 3-(трет-бутилоксикарбониламино)пиперидина. Во избежание же риска побочных эффектов и в целях снижения вводимой в организм дозы до минимума для применения в фармацевтике предпочтительны именно энантиомерно чистые действующие вещества. Все эти факторы опровергают возможность реализации известного способа для промышленного получения энантиомерно чистых 8-(3-аминопиперидин-1-ил)ксантинов. С учетом описанных выше недостатков известного способа в основу настоящего изобретения была положена задача разработать способ, который позволял бы с высокой химической и оптической чистотой без высоких технических затрат получать энантиомерно чистые 8-(3-аминопиперидин-1-ил)ксантины с использованием легко доступных исходных веществ. Такой новый способ должен быть также пригоден для синтеза указанных соединений в промышленном масштабе и тем самым для применения в коммерческих целях. Указанная задача решается с помощью предлагаемого в изобретении способа получения хиральных 8-(3-аминопиперидин-1-ил)ксантинов. К преимуществам предлагаемого в изобретении способа синтеза,помимо возможности его промышленного осуществления и получения целевых продуктов с высоким выходом, следует также отнести получение целевых продуктов с исключительно высокой степенью химической и оптической чистоты. При осуществлении предлагаемого в изобретении способа соответствующий предшественник ксантинов формулы (III) в соответствии с приведенной ниже схемой 1 подвергают взаимодействию с энантиомерно чистым или рацемическим 3-(фталимидо)пиперидином в соответствующих растворителях при температуре от 20 до 160 С, предпочтительно от 80 до 140 С. В качестве растворителей при этом можно использовать, например, тетрагидрофуран (ТГФ), диоксан, N,N-диметилформамид (ДМФ), диметилацетамид (ДМА), N-метил-2-пирролидон (N-МП) или диметилсульфоксид (ДМСО). Предпочтительно использовать N-МП. Затем по известным методам отщепляют защитную фталильную группу. Возможные методы отщепления защитных групп описаны, например, у T.W. Greene в "Protective Groups in Organic В приведенных формулах заместители имеют следующие значения:X обозначает уходящую группу, выбранную из группы галогенов, таких, например, как атом фтора,хлора либо брома, или эфиров сульфоновых кислот, таких, например, как фенилсульфонилокси-,п-толуолсульфонилокси-, метилсульфонилокси- либо трифторметилсульфонилоксигруппа;R1 представляет собой фенилкарбонилметильную, бензильную, нафтилметильную, пиридинилметильную, пиримидинилметильную, хинолинилметильную, изохинолинилметильную, хиназолинилметильную, хиноксалинилметильную, нафтиридинилметильную или фенантридинилметильную группу, в которой ароматический, соответственно гетероароматический, фрагмент однозамещен или двузамещен идентичными или различными заместителями Ra, где Ra представляет собой атом водорода, фтора, хлора либо брома, цианогруппу, метильную, трифторметильную, этильную, фенильную группу, метокси-, дифторметокси-, трифторметокси- либо этоксигруппу, или два остатка Ra при условии, что они связаны с соседними атомами углерода, могут представлять собой также группу -О-СН 2-О- либо -О-СН 2-СН 2-О-;R2 представляет собой метильную, этильную, пропильную, изопропильную, циклопропильную или фенильную группу;R3 представляет собой 2-бутен-1-ильную, 3-метил-2-бутен-1-ильную, 2-бутин-1-ильную,2-фторбензильную, 2-хлорбензильную, 2-бромбензильную, 2-йодбензильную, 2-метилбензильную,2-(трифторметил)бензильную или 2-цианбензильную группу. Предлагаемый в изобретении способ предпочтительно использовать применительно к соединениям,в которыхX обозначает атом хлора или брома;R1 представляет собой фенилкарбонилметильную, бензильную, нафтилметильную, пиридинилметильную, пиримидинилметильную, хинолинилметильную, изохинолинилметильную, хиназолинилметильную, хиноксалинилметильную или нафтиридинилметильную группу, в которой ароматический, соответственно гетероароматический, фрагмент однозамещен или двузамещен идентичными или различными заместителями Ra, гдеRa представляет собой атом водорода, фтора либо хлора, цианогруппу, метильную, этильную группу, метокси- или этоксигруппу, R2 представляет собой метильную, этильную, пропильную, изопропильную, циклопропильную или фенильную группу, а R3 представляет собой 2-бутен-1-ильную, 3-метил-2 бутен-1-ильную, 2-бутин-1-ильную, 2-фторбензильную, 2-хлорбензильную, 2-бромбензильную,2-йодбензильную, 2-метилбензильную, 2-(трифторметил)бензильную или 2-цианбензильную группу. Особенно предпочтительно использовать предлагаемый в изобретении способ применительно к соединениям, в которых X обозначает атом хлора или брома,R1 представляет собой цианбензильную, (цианпиридинил)метильную, хинолинилметильную, (метилхинолинил)метильную, изохинолинилметильную, (метилизохинолинил)метильную, хиназолинилметильную, (метилхиназолинил)метильную, хиноксазинилметильную, (метилхиноксалинил)метильную,(диметилхиноксалинил)метильную или нафтиридинилметильную группу;R2 представляет собой метильную, циклопропильную или фенильную группу; аR3 представляет собой 2-бутен-1-ильную, 3-метил-2-бутен-1-ильную, 2-бутин-1-ильную,2-хлорбензильную, 2-бромбензильную или 2-цианбензильную группу,но прежде всего использовать для получения соединений из группы, включающей 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-2 012163 ил)ксантин,1-[(3-метилизохинолин-1-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-R)-3-аминопиперидин-1 ил)ксантин и 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин,из исходных соединений, в которых X обозначает бром. В качестве исходного реагента в каждом случае предпочтительно использовать(R)-3-(фталимидо)пиперидин. Соединения формулы (III) получают известными методами, описанными в уже указанной выше литературе. Еще одним объектом изобретения является способ получения оптически активного 3-(фталимидо)пиперидина. При этом сначала 3-аминопиридин гидрируют по известной методике, а затем полученный таким путем рацемический 3-аминопиперидин взаимодействием со фталевым ангидридом переводят в соответствующий фталимид. Из раствора рацемического сырого фталимида формулы(IV) с помощью D-винной кислоты можно селективно осаждать (R)-энантиомер. Из такого же маточного раствора, из которого осаждали соль D-винной кислоты, можно далее добавлением L-винной кислоты простым путем можно получать, соответственно, (S)-энантиомер фталимида (IV), а именно, без предварительного отделения еще содержащегося в маточном растворе избытка D-винной кислоты. Подобное исключительно простое разделение энантиомеров соединения формулы (IV) является для специалиста в данной области совершенно неожиданным. Помимо этого, нет необходимости в предварительной очистке рацемического основания, получаемого в результате реакции гидрирования. Даже при осуществлении такого способа в промышленном масштабе никаких проблем не возникает. Помимо этого, непредвиденно чистое взаимодействие 3-аминопиперидина с фталевым ангидридом уже само по себе неожиданно, поскольку согласно литературным источникам (см., например, патентUS 4005208, прежде всего пример 27) в данном случае предполагается получение смесей, которые наряду с требуемым продуктом содержат производные, в которых кольцевой атом азота ацилирован. Ниже изобретение более подробно поясняется на примерах. Пример 1. D-Тартрат (R)-энантиомера 3-(фталимидо)пиперидина. а) Гидрирование В реактор гидрирования загружают 10,00 кг (106,25 моль) 3-аминопиридина, 500 г технического активированного угля и 65 л уксусной кислоты. Затем добавляют 50 г суспендированного в 2,5 л уксусной кислоты катализатора Нишимуры (коммерчески доступный смешанный катализатор на основе родия и платины) и промывают 2,5 л уксусной кислоты. Далее гидрируют при 50 С и при повышенном давлении водорода 100 бар до полного прекращения поглощения водорода, после чего продолжают гидрирование еще в течение 30 мин при 50 С. Катализатор и активированный уголь отфильтровывают и промывают 10 л уксусной кислоты. Раствор продукта без очистки используют в последующей реакции. Описанную выше реакцию можно успешно проводить и при не столь высоком давлении. В реактор загружают 15,74 кг (106,25 моль) фталевого ангидрида и смешивают с фильтратом, полученным на предыдущей стадии гидрирования. Далее промывают 7,5 л уксусной кислоты и затем реакционную смесь нагревают с обратным холодильником, отгоняя при этом в течение 1 ч примерно 30% используемой уксусной кислоты. Реакционный раствор охлаждают до 90 С. Раствор продукта без очистки используют в последующей реакции. в) Расщепление рацематов Нагретый до 50 С раствор 11,16 кг D-(-)-винной кислоты (74,38 моль) в 50 л абсолютного этанола добавляют при 90 С к предназначенному для ацилирования реакционному раствору. Затем промывают 10 л абсолютного этанола и в течение 30 мин перемешивают при 90 С, что сопровождается кристаллизацией продукта. После охлаждения до 5 С продукт отделяют центрифугированием и промывают абсолютным этанолом. Раствор продукта без очистки используют в последующей реакции. г) Перекристаллизация. Влажный сырой продукт нагревают с обратным холодильником в смеси из 50 л ацетона и 90 л воды до образования раствора. Затем этот раствор охлаждают до 5 С, что сопровождается выкристаллизовыванием продукта. Суспензию перемешивают при 5 С в течение 30 мин, полученный продукт отделяют центрифугированием и после этого промывают смесью из 20 л ацетона и 10 л воды. В завершение продукт сушат в сушильном шкафу в токе инертного газа при 45 С. Выход: 11,7-12,5 кг (29-31% от теории). Пример 2. Синтез 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1 ил)ксантина. а) 2-Хлорметил-4-метилхиназолин В реактор загружают 10,00 кг (73,98 моль) 2-аминоацетофенона, после чего добавляют 24,5 л 1,4-диоксана. Охлажденный до 10 С раствор смешивают с 16,72 кг (458,68 моль) хлористого водорода путем его пропускания через раствор. Реакционная смесь нагревается при этом до 22-25 С. При этой температуре пропускание хлористого водорода продолжают. После расходования примерно половины от всего пропущенного через раствор количества хлористого водорода смесь охлаждают до -10 С и продолжают пропускать оставшееся количество хлористого водорода. Образовавшуюся суспензию оставляют стоять на ночь при -10 С. После этого в течение 1 ч при -10 С добавляют раствор 6,70 кг (88,78 моль) хлорацетонитрила в 2,5 л 1,4-диоксана. Питающую емкость промывают 2 л 1,4-диоксана. Затем содержимое реактора нагревают до 6 С и перемешивают в течение примерно 2 ч. В другой реактор загружают смесь из 122 л воды и 62,04 кг (775,31 моль) раствора гидроксида натрия (50%-ного) и охлаждают до 6 С. Далее порциями добавляют реакционную смесь из первого реактора. Внутренняя температура составляет при этом максимум 11 С. После этого первый реактор промывают сначала 6 л 1,4-диоксана, а затем 6 л воды. Образовавшуюся суспензию перемешивают еще в течение 30 мин при 5 С. Полученный продукт отделяют центрифугированием, промывают 41 л воды и сушат в-4 012163 токе инертного газа в сушильном шкафу при 35 С. Выход: 10,5-12,1 кг (74-85% от теории). б) 1-[(4-Метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-бромксантин(37,02 моль) 2-хлорметил-4-метилхиназолина, 3,92 кг (37,02 моль) безводного карбоната натрия и 30 лN-метил-2-пирролидона. Затем содержимое реактора нагревают до 140 С и в течение 2 ч перемешивают при этой температуре. По завершении реакции смесь охлаждают до 80 С и разбавляют сначала 60 л 96%-ного этанола, а затем при 70 С 55 л воды. Далее при 60 С добавляют 4,04 кг (67,32 моль) уксусной кислоты и промывают 5 л воды. Образовавшуюся суспензию перемешивают в течение 30 мин при 60 С,после чего охлаждают до 23 С и продолжают перемешивание еще в течение 30 мин. После этого полученный продукт отделяют центрифугированием и промывают сначала смесью из 20 л 96%-ного этанола и 20 л воды, а затем 40 л 90%-ного этанола и 40 л воды. В завершение продукт сушат в сушильном шкафу в токе инертного газа при 45 С. Выход: 11,6-12,6 кг (76-83% от теории). в) 1-[(4-Метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-фталимидопиперидин-1 ил)ксантин В реактор загружают 10,00 кг (22,06 моль) 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1 ил)-8-бромксантина, 12,59 кг (33,09 моль) D-тартрата 3-(фталимидо)пиперидина и 17,5 л N-метил-2 пирролидона. Затем содержимое реактора нагревают до 140 С. По достижении этой температуры в течение 20 мин добавляют 11,41 кг (88,24 моль) диизопропилэтиламина. Питающую емкость промывают 2,5 л N-метил-2-пирролидона, после чего реакционную смесь в течение 2 ч перемешивают при 140 С. По завершении реакции смесь охлаждают до 60 С и разбавляют 80 л метанола. Образовавшуюся суспензию в течение 30 мин перемешивают при 50 С, после чего охлаждают до 23 С и продолжают перемешивание еще в течение 30 мин. Затем полученный продукт отделяют центрифугированием и трижды промывают метанолом порциями по 20 л. В завершение продукт сушат в сушильном шкафу в токе инертного газа при 45 С. Выход: 12,0-12,5 кг (90-94% от теории). г) 1-[(4-Метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин 1800 г (3 моль) 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-фталимидопиперидин-1-ил)ксантина нагревают в 18 л толуола до 80-85 С. Затем к суспензии при 75-80 С добавляют 1,815 л (30 моль) этаноламина. Для полноты реакции перемешивают в течение 2 ч при 80-85 С, при этом твердые вещества растворяются. Затем фазы разделяют. Этаноламиновую фазу дважды промывают теплым толуолом (порциями по 4 л). Объединенные толуольные фазы дважды промывают при 75-80 С теплой водой порциями по 8 л. Из толуольной фазы под вакуумом отгоняют 22 л толуола. К образовавшейся суспензии при 40-50 С добавляют 4 л трет-бутилметилового эфира и затем охлаждают до 0-5 С. Полученный продукт отделяют путем фильтрации, промывают трет-бутилметиловым эфиром и отделяют вакуум-фильтрацией через сухой вакуум-фильтр. Влажное сырое вещество затем нагревают с обратным холодильником вместе с 5-кратным количеством абсолютного этанола и горячий раствор для очистки фильтруют через активированный уголь. После охлаждения фильтрата до 20 С и начала кристаллизации разбавляют трет-бутилметиловым эфиром до удвоения объема. Далее суспензию охлаждают до 2 С, пе-5 012163 ремешивают в течение 2 ч, фильтруют вакуум-фильтрацией и в завершение сушат в вакуумном сушильном шкафу при 45 С. Выход: 1174 г (83,2% от теории). Другой вариант осуществления стадии г). 1400 г (2,32 моль) 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-фталимидопиперидин-1-ил)ксантина добавляют в 4,9 л тетрагидрофурана, после чего нагревают до 55-65 С. Затем к суспензии добавляют 350 мл воды и 1433 г (2,32 моль) этаноламина. Для полноты реакции перемешивают в течение 3 ч при 60-63 С. Далее добавляют 619 мл 45%-ного раствора едкого натра и 3,85 л воды и перемешивание продолжают еще в течение 30 мин при 55-65 С. Затем к реакционной смеси добавляют 5,6 л толуола, перемешивают в течение 15 мин, после чего фазы разделяют. Органическую фазу промывают 2,8 л воды при 55-65 С и затем ее отделяют. Органическую фазу отгоняют под вакуумом в количестве 4,2 л. Затем при 65-75 С добавляют 1,4 л метилциклогексана, что сопровождается кристаллизацией продукта. Суспензию в течение 8-16 ч перемешивают при температуре в интервале от 15 до 25 С, после чего охлаждают до 0-5 С. Продукт отделяют путем фильтрации, промывают 4,2 л метилциклогексана,отфильтровывают через сухой вакуум-фильтр и сушат в вакууме при 35 С. После сушки сырое вещество(991 г) нагревают с обратным холодильником вместе с 5-кратным количеством метанола, добавляют активированный уголь и фильтруют. Объем фильтрата за счет отгонки метанола уменьшают до 1,5 л. После охлаждения фильтрата до 45-55 С его разбавляют трет-бутилметиловым эфиром до достижения 4-кратного объема. Суспензию охлаждают до 0-5 С, перемешивают в течение 2 ч, отфильтровывают вакуум-фильтрацией, промывают трет-бутилметиловым эфиром и в завершение сушат в вакуумном сушильном шкафу при 35 С. Выход: 899 г (81,9% от теории). Пример 3. 1-[(3-Цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1 ил)ксантин. а) 3-Циано-2-(хлорметил)пиридин. 165,5 г (0,98 моль) 2-гидроксиметил-3-пиридинкарбоксамида нагревают в течение 1 ч вместе с 270 мл оксихлорида фосфора до 90-100 С. Затем реакционную смесь охлаждают до комнатной температуры и по каплям добавляют к примерно 800 мл нагретой до 50-60 С воды. После гидролиза оксихлорида фосфора при охлаждении нейтрализуют раствором едкого натра, что сопровождается выпадением продукта в осадок. Продукт отфильтровывают, промывают 300 мл воды и в завершение сушат при 35-40 С. Выход: 122,6 г (82% от теории). Другой вариант осуществления стадии а): 3-циано-2-(хлорметил)пиридин. 20,0 г (131,45 ммоль) 2-гидроксиметил-3-пиридинкарбоксамида суспендируют в 110 мл ацетонитрила и нагревают до 78 С. Затем в течение 15 мин добавляют 60,65 г (395,52 ммоль) оксихлорида фосфора и в течение 2 ч нагревают до 81 С. После охлаждения до 22 С реакционную смесь примешивают к 200 мл нагретой до 40 С воды. После добавления 100 мл толуола при охлаждении нейтрализуют раствором едкого натра. После разделения фаз органическую фазу промывают 100 мл воды. Далее органическую фазу отделяют, а растворитель выпаривают в вакууме, получая в результате сначала маслянистый остаток, который затем кристаллизуется при стоянии. Выход: 16,66 г (83% от теории). б) 1-[(3-Цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-бромксантин В реактор загружают 202 г (0,68 моль) 3-метил-7-(2-бутин-1-ил)-8-бромксантина. 188,5 г (1,36 моль) безводного карбоната калия и 1,68 л N-метил-2-пирролидона и нагревают до 70 С. Затем по каплям добавляют 119 г (0,75 моль) 2-хлорметил-3-цианопиридина в 240 мл N-метил-2-пирролидина (N-МП). Содержимое реактора перемешивают в течение 19 ч при 70 С. По завершении реакции к реакционной смеси добавляют 2,8 л воды и охлаждают до 25 С. Полученный продукт отфильтровывают, промывают 2 л воды и в завершение сушат в сушильном шкафу в токе инертного газа при 70 С. Выход: 257,5 г (91% от теории). В реактор загружают 230 г (0,557 моль) 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)8-бромксантина, 318 г (0,835 моль) D-тартрата 3-(фталимидо)пиперидина и 1,15 л N-метил-2 пирролидона. Затем содержимое реактора нагревают до 140 С. По достижении этой температуры в течение 20 мин добавляют 478 мл (2,78 моль) диизопропилэтиламина и далее реакционную смесь в течение 2 ч перемешивают при 140 С. Затем реакционную смесь охлаждают до 75 С и разбавляют 720 мл метанола. После этого при температуре от 60 до 68 С добавляют 2,7 л воды и охлаждают до 25 С. Полученный продукт отфильтровывают и промывают 2 л воды. В завершение продукт сушат в сушильном шкафу в токе инертного газа при 70 С. Затем полученный таким путем сырой продукт размешивают в 1 л метанола при температуре кипения, фильтруют в горячем состоянии, промывают 200 мл метанола и в завершение сушат в токе инертного газа при 70 С. Выход: 275 г (88% от теории). г) 1-[(3-Цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-аминопиперидин-1-ил)ксантин 412,5 г (0,733 моль) 1-[(3-цианопиридин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-(3-(R)-фталимидопиперидин-1-ил)ксантина нагревают в 4125 мл толуола до 80 С. Затем при 75-80 С к суспензии добавляют 445 мл (7,33 моль) этаноламина. Для полноты реакции в течение 2 ч перемешивают при 80-85 С,что сопровождается растворением твердых веществ. Затем фазы разделяют. Этаноламиновую фазу дважды экстрагируют теплым толуолом (порциями по 1 л). Объединенные толуольные фазы дважды промывают нагретой до 75-80 С водой порциями по 2 л. Толуольные фазы сушат над сульфатом натрия,фильтруют и затем путем перегонки концентрируют в вакууме до объема порядка 430 мл. Далее при 50-55 С добавляют 1 л трет-бутилметилового эфира и после этого охлаждают до 0-5 С. Полученный продукт отфильтровывают, промывают трет-бутилметиловым эфиром и в завершение сушат в сушильном шкафу при 60 С. Выход: 273 г (86% от теории).t пл=1883 С. Аналогично примерам 2 и 3 получают также 1-[(3-метилизохинолин-1-ил)метил]-3-метил-7-(2 бутин-1-ил)-8-R)-3-аминопиперидин-1-ил)ксантин. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения общей формулы (I) или его энантиомера либо его соли, гдеR1 представляет собой фенилкарбонилметильную, бензильную, нафтилметильную, пиридинилметильную, пиримидинилметильную, хинолинилметильную, изохинолинилметильную, хиназолинилметильную, хиноксалинилметильную, нафтиридинилметильную или фенантридинилметильную группу, в которой ароматический, соответственно гетероароматический фрагмент однозамещен или двузамещен идентичными или различными заместителями Ra, где Ra представляет собой атом водорода, фтора, хлора либо брома, цианогруппу, метильную, трифторметильную, этильную, фенильную группу, метокси-,дифторметокси-, трифторметокси- либо этоксигруппу, или два остатка Ra, при условии, что они связаны-7 012163 с соседними атомами углерода, могут представлять собой также группу -О-СН 2-О- либо -О-СН 2-СН 2-О-;R2 представляет собой метильную, этильную, пропильную, изопропильную, циклопропильную или фенильную группу; аR3 представляет собой 2-бутен-1-ильную, 3-метил-2-бутен-1-ильную, 2-бутин-1-ильную,2-фторбензильную, 2-хлорбензильную, 2-бромбензильную, 2-йодбензильную, 2-метилбензильную,2-(трифторметил)бензильную или 2-цианбензильную группу,заключающийся в том, что: а) соединение общей формулы (III) в которой X обозначает уходящую группу, выбранную из группы галогенов или эфиров сульфоновых кислот, a R1-R3 имеют указанные выше значения, подвергают взаимодействию с 3-(фталимидо)пиперидином или его энантиомером; б) из полученного таким путем соединения общей формулы (II) в которой R1-R3 имеют указанные выше значения, удаляют защитную группу и в) полученное соединение при необходимости переводят в его физиологически совместимую соль. 2. Способ по п.1, гдеX обозначает атом хлора или брома,R1 представляет собой фенилкарбонилметильную, бензильную, нафтилметильную, пиридинилметильную, пиримидинилметильную, хинолинилметильную, изохинолинилметильную, хиназолинилметильную, хиноксалинилметильную или нафтиридинилметильную группу, в которой ароматический, соответственно гетероароматический фрагмент однозамещен или двузамещен идентичными или различными заместителями Ra, где Ra представляет собой атом водорода, фтора либо хлора, цианогруппу, метильную, этильную группу, метокси- или этоксигруппу;R2 представляет собой метильную, этильную, пропильную, изопропильную, циклопропильную или фенильную группу; аX обозначает атом хлора или брома;R2 представляет собой метильную, циклопропильную или фенильную группу; аR2 представляет собой метильную группу; аR3 представляет собой 2-бутин-1-ильную группу. 5. Способ по одному из пп.1-4, где на стадии а) в качестве реагента используютR2 представляет собой метильную группу; аR3 представляет собой 2-бутин-1-ильную группу. 7. Способ по п.6, дополнительно включающий кристаллизацию или перекристаллизацию соединения формулы I из раствора метанола или этанола. 8. Способ по п.7, в котором раствор дополнительно содержит трет-бутилметиловый эфир. 9. Способ получения (R)-3-(фталимидо)пиперидина, заключающийся в том, что: а) рацемический 3-аминопиперидин подвергают в соответствующих растворителях взаимодействию со фталевым ангидридом и б) (R)-3-(фталимидо)пиперидин отделяют из раствора полученного таким путем рацемического 3-(фталимидо)пиперидина добавлением D-винной кислоты и отделяют выпавший в осадок тартрат. 10. Способ получения (S)-3-(фталимидо)пиперидина, заключающийся в том, что: а) рацемический 3-аминопиперидин подвергают в соответствующих растворителях взаимодействию со фталевым ангидридом и б) (S)-3-(фталимидо)пиперидин отделяют из раствора полученного таким путем рацемического 3-(фталимидо)пиперидина добавлением L-винной кислоты и отделяют выпавший в осадок тартрат. 11. Способ получения (S)-3-(фталимидо)пиперидина, заключающийся в том, что: а) рацемический 3-аминопиперидин подвергают в соответствующих растворителях взаимодействию со фталевым ангидридом,б) (R)-3-(фталимидо)пиперидин отделяют из раствора полученного таким путем рацемического 3-(фталимидо)пиперидина добавлением D-винной кислоты и отделяют выпавший в осадок тартрат и в) к полученному таким путем маточному раствору, из которого осаждали первую соль, добавляютL-винную кислоту и отделяют выпавший в осадок тартрат (S)-3-(фталимидо)пиперидина. 12. Способ по одному из пп.9-11, где на стадии б) в качестве растворителя используют этанол. 13. (R)-3-(фталимидо)пиперидин. 14. (S)-3-(фталимидо)пиперидин.
МПК / Метки
МПК: C07D 473/04, A61K 31/522
Метки: получения, 8-(3-аминопиперидин-1-ил)ксантинов, хиральных, способ
Код ссылки
<a href="https://eas.patents.su/10-12163-sposob-polucheniya-hiralnyh-8-3-aminopiperidin-1-ilksantinov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения хиральных 8-(3-аминопиперидин-1-ил)ксантинов</a>
Предыдущий патент: Способ рефолдинга рекомбинантных антител
Следующий патент: Антибиотик 107891, его факторы а1 и а2, фармацевтически приемлемые соли и композиции и их применение
Случайный патент: Культуры e1-иммортализованных клеток и способы их культивирования с целью повышения выхода их продукции














