Сокристалл тикагрелора с 3-гидрокси-2-нафтойной кислотой, способ его получения и применение
Номер патента: 24825
Опубликовано: 31.10.2016
Авторы: Мохамед Шармарке, Ткадлецова Марцела, Даммер Ондрей, Гейтманкова Людмила, Ридван Лудек
Формула / Реферат
1. Сокристалл тикагрелора формулы (I)
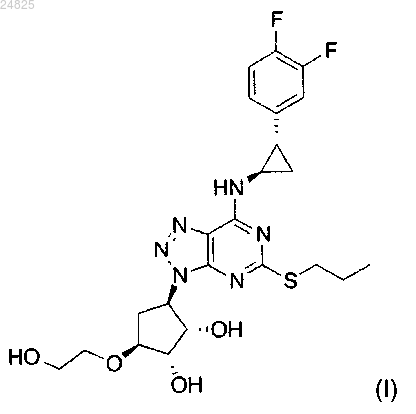
с 3-гидрокси-2-нафтойной кислотой.
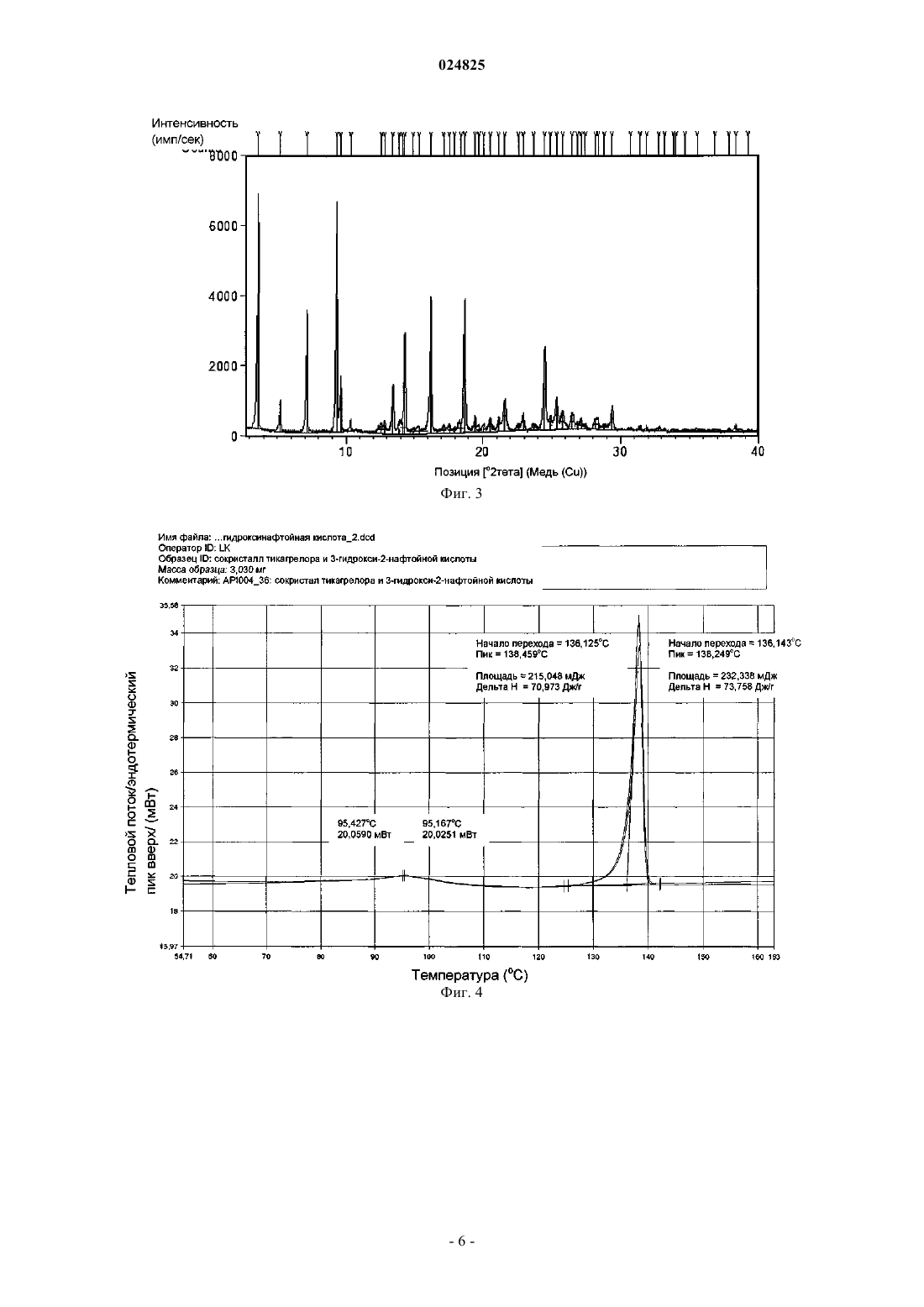
2. Сокристалл по п.1, характеризующийся порошковой рентгеновской дифрактограммой, измеренной при помощи CuKα, содержащей специфичные пики высокой интенсивности при 3,6; 7,2; 9,3; 14,3; 16,2; 18,7 и 24,5±0,2° 2-тета.
3. Сокристалл по п.1 или 2, характеризующийся тем, что масса 3-гидрокси-2-нафтойной кислоты к тикагрелору находится в молярном стехиометрическом соотношении 1:1.
4. Сокристалл по любому из пп.1-3, характеризующийся кривой дифференциальной сканирующей калориметрии, на которой начало плавления наблюдается при приблизительно 136°С.
5. Способ получения сокристалла по п.1, где тикагрелор кристаллизуют с 3-гидрокси-2-нафтойной кислотой из приемлемого растворителя при температуре в диапазоне от 20 до 65°С.
6. Способ по п.5, где растворитель выбран из группы, состоящей из воды, нитрометана, этанола, пропанола, диэтилового эфира, 2-бутанола, циклогексана, дихлорметана, ацетона, метилэтилкетона, 1,2-диметоксиэтана, этилформиата, метилацетата, пропилацетата, изопропилацетата, трихлорэтилена, ТГФ (тетрагидрофуран) и ацетонитрила.
7. Применение сокристалла по п.1 для получения фармацевтической композиции.
Текст
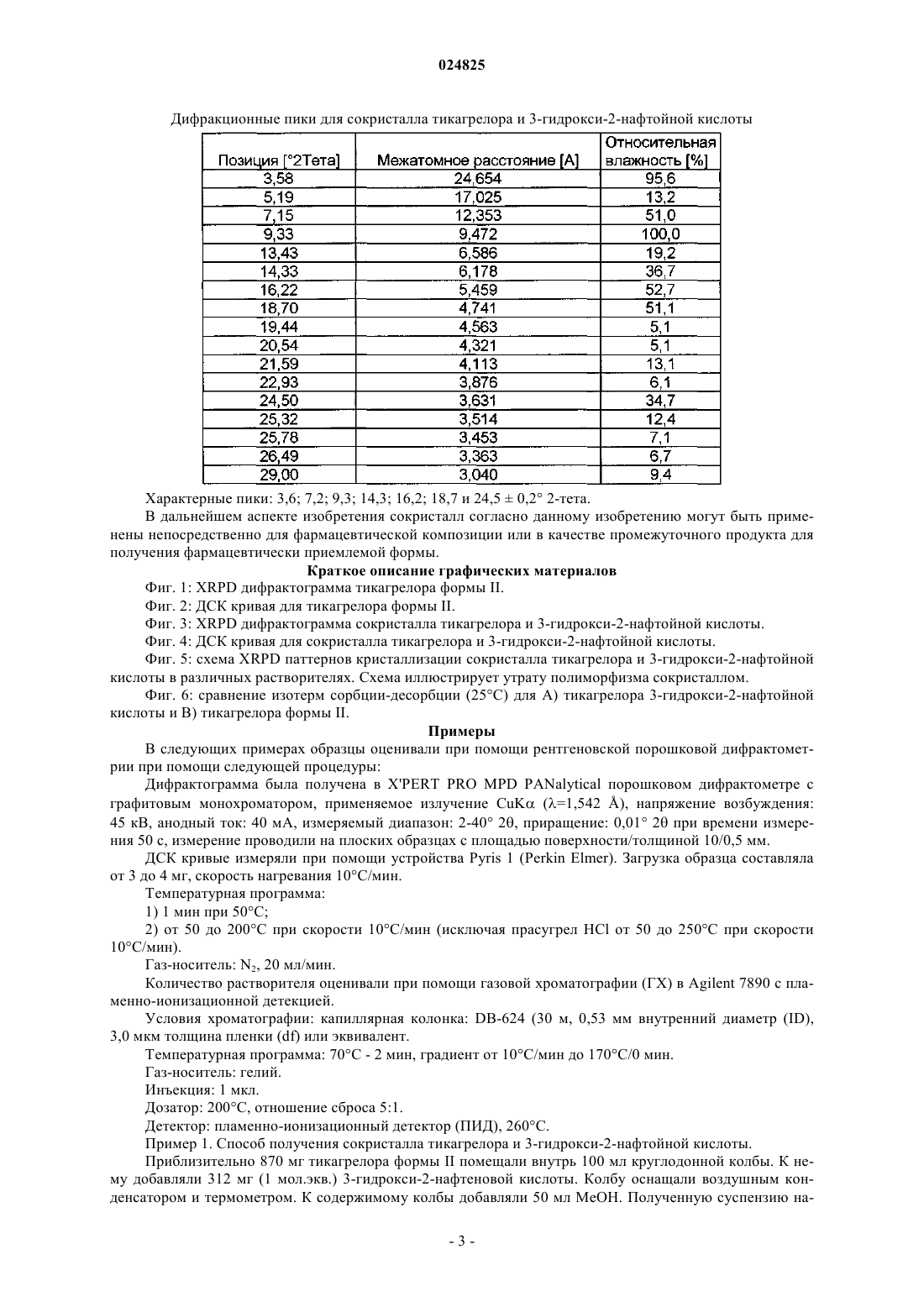
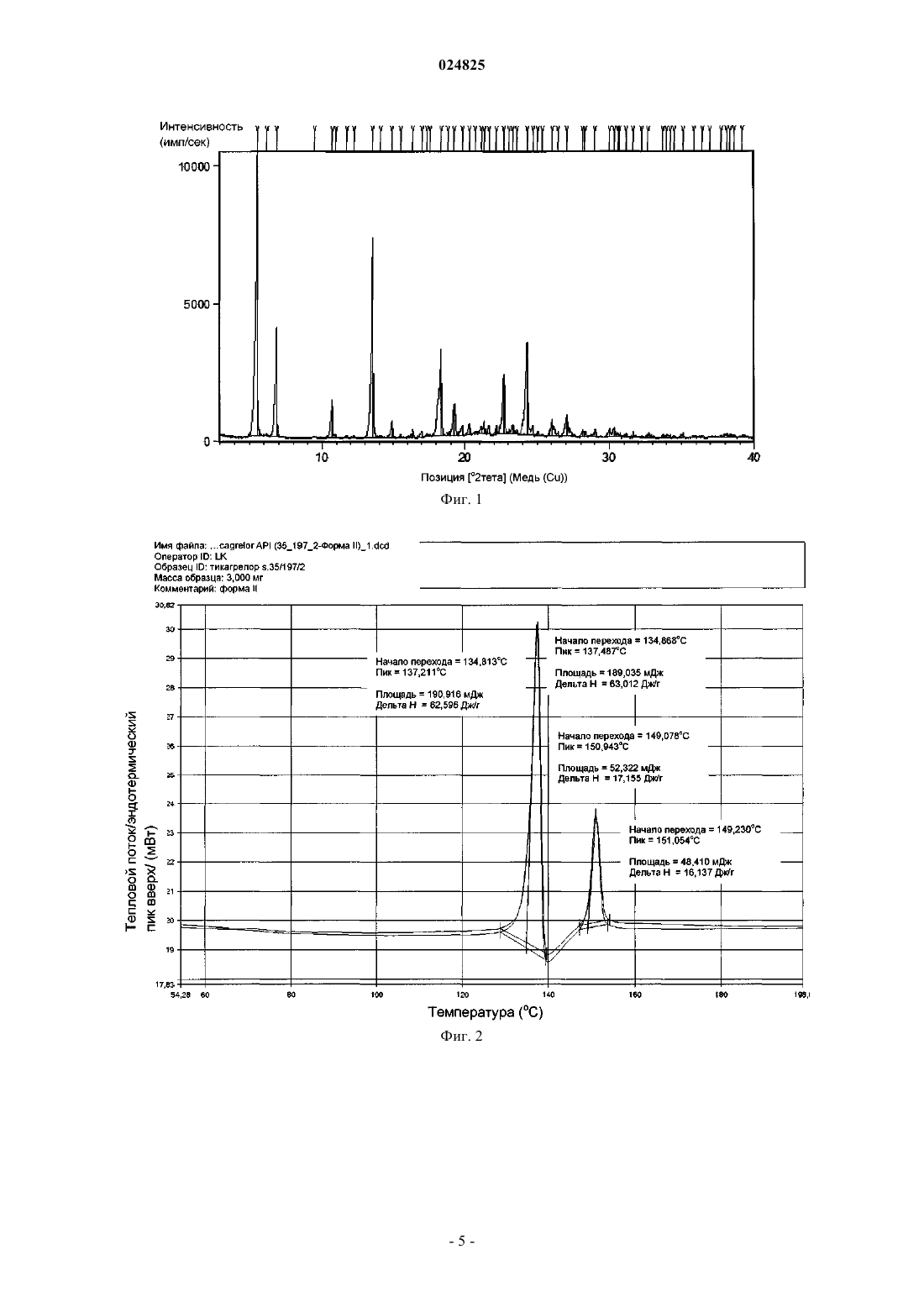
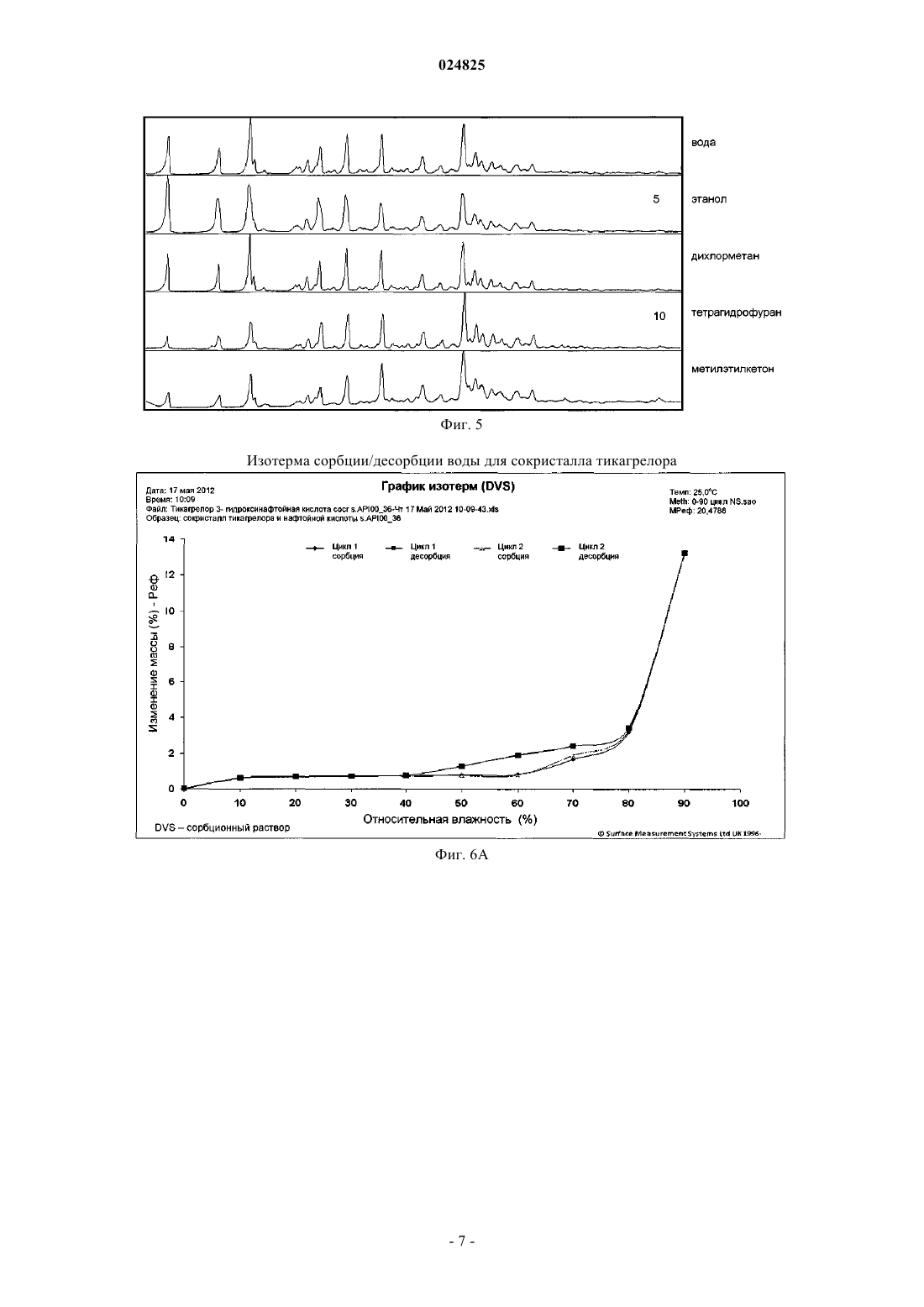
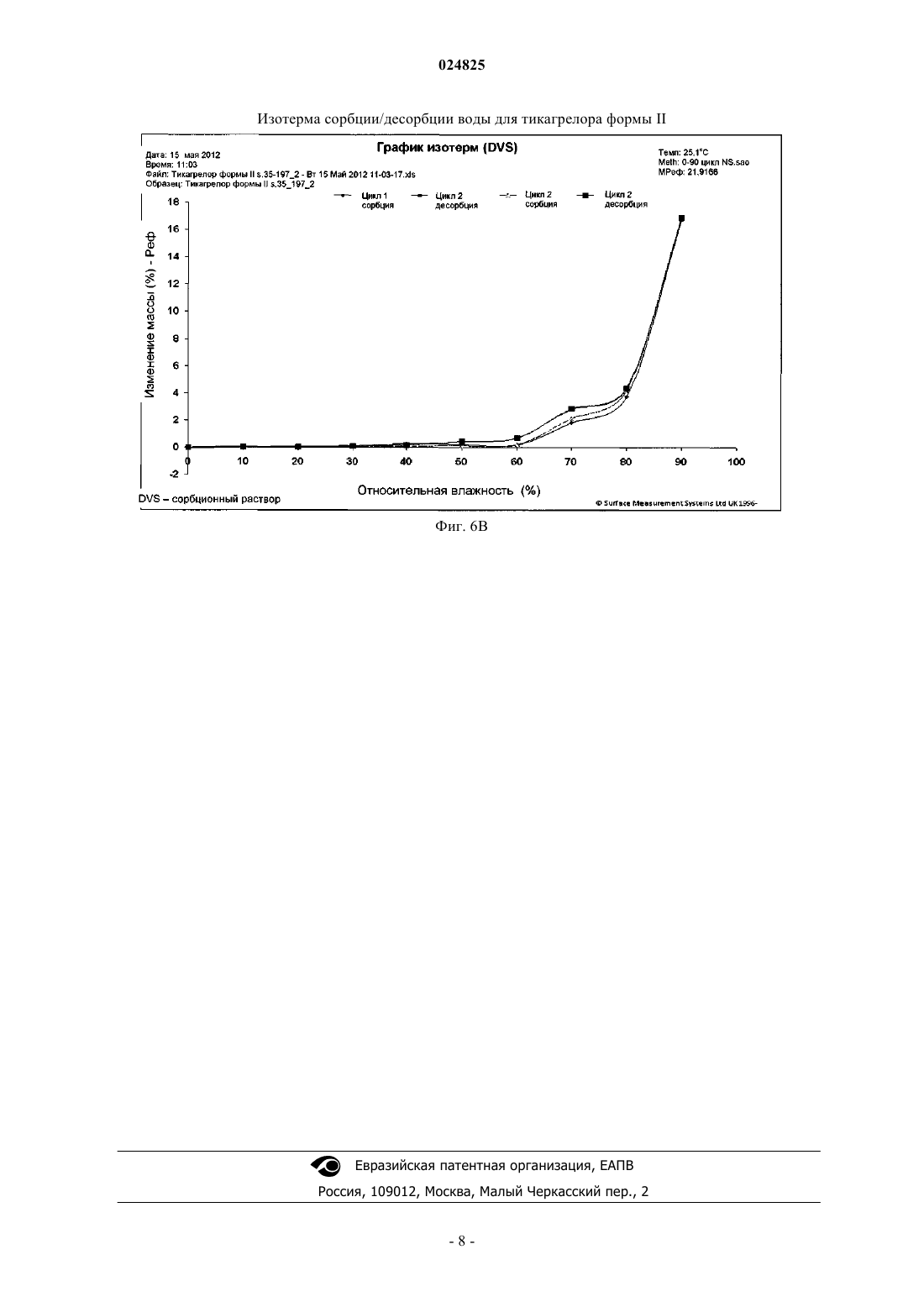
(1S,2S,3R,5S)-3-[7-[(1R,2S)-2-(3,4-дифторфенил)циклопропил]-5(пропилтио)-3 Н-[1,2,3]триазоло[4,5-d]пиримидин-3-ил]-5-(2-гидроксиэтокси)циклопентан-1,2 диола (тикагрелор) в виде стабильной сокристаллической формы с 3-гидрокси-2-нафтойной кислотой, способ их получения и применение для получения фармацевтической композиции. Область техники Настоящее изобретение относится к новым твердым формам тикагрелора (I), а также к способам получения. Конкретные заявленные твердые формы представляют собой сокристалл тикагрелора, полученный из 3-гидрокси-2-нафтойной кислоты. Предшествующий уровень техники Соединение известно в качестве ингибитора агрегации тромбоцитов, который показан для предупреждения тромбообразования у пациентов с инфарктом миокарда. Детали способа синтеза для выделения тикагрелора можно найти в WO 00/34283. В предшествующем уровне техники известны по меньшей мере четыре безводные полиморфные формы тикагрелора и дополнительные детали о них можно найти в ЕР 1289992. Кроме того, ряд сокристаллов тикагрелора описан в предшествующем уровне техники, в частности в WO 2011067571. Исследования (Nawarskas and Clark, Cardiology in Review, 19(2), март/апрель 2011, 95-100) показали, что у пациентов с острым коронарным синдромом лечение тикагрелором по сравнению с клопидогрелем существенно снижало смертность от сосудистых заболеваний, инфаркта миокарда или инсульта. При сравнении с клопидогрелем тикагрелор представляет собой новый класс ингибиторов тромбоцитов. В отличие от клопидогреля тикагрелор не является тиенопиридином, но описан как циклопентил-триазоло-пиримидин. Тикагрелор представляет собой малорастворимый активный фармацевтический ингредиент (АФИ) с низкой проницаемостью и классифицируется как соединение класса IV согласно биофармацевтической классификационной системе (BCS). Такие АФИ обычно применяют для получения солей, чтобы улучшить их растворимость и таким образом биодоступность. Другой возможностью и все более популярной является получение сокристалла АФИ. Сокристалл определен в данном документе как отдельная твердая форма АФИ, состоящая из стехиометрического соотношения АФИ и гостевой молекулы (также известной как коформер) для получения периодически повторяющейся кристаллической формы. Сокристаллы обычно придают различные физико-химические свойства рассматриваемому АФИ. Сокристаллы обычно придают существенную функциональность, поскольку они модифицируют физико-химические свойства АФИ без влияния на химическую структуру АФИ. Более того, сокристаллизация не зависит от присутствия ионизируемых функциональных групп в отличие от требований при образовании солей. Известно,что сокристаллы диссоциируют в раствор со скоростью более быстрой, чем время необходимое для достижения АФИ активного сайта. Таким образом, терапевтического эффекта достигают за счет одного АФИ с сокристаллом, быстро диссоциирующим при его помещении в воду. Несмотря на ограничения связанные с биодоступностью твердой лекарственной формы, специалистам в области техники будет известно, что кристаллические твердые формы АФИ являются более предпочтительными по сравнению с аморфными формами, поскольку кристаллические формы термодинамически стабильны и обеспечивают более предсказуемые условия обработки и хранения. Очевидное возражение, согласующееся с данным курсом, связано с проблемой усиления растворимости и биодоступности АФИ, которое благоприятствует аморфной форме. Ни полиморфные формы, ни сокристаллы АФИ не являются очевидными до экспериментов по длительной кристаллизации. Более того, специалистам хорошо знакомым с областью техники известны предварительные литературные примеры попыток проведения экспериментов по сокристаллизации, которые вместо этого приводят к новым полиморфным формам АФИ или исчезающим полиморфным формам АФИ после характеристики предположительно стабильных новых кристаллических форм. Способы получения и характеристики сокристаллов мало описаны в литературе. Например, см.:Trask et al. Chem. Commun., 2004, 890-891; и О. Almarsson, M.J. Zaworotko, Chem. Commun., 2004,1889-1896; T. Friscic and W. Jones, J. Pharmacy. Pharmacology, 2010, 62, 1547-1559. Данные способы, а также другие способы, известные специалистам в области техники, могут быть применены для получе-1 024825 ния сокристаллов тикагрелора, предпочтительно включающих молекулу коформера по меньшей мере с одной карбоксильной группой, или более предпочтительно коформер, относящийся к общему классу соединений, известных как гидроксибензойные кислоты, или даже более предпочтительно коформер,такой как 3-гидрокси-2-нафтойная кислота. Описание изобретения Настоящее изобретение относится к твердотельным структурам (1S,2S,3R,5S)-3-[7-[(1R2S)-2-(3,4 дифторфенил)циклопропиламино]-5-(пропилтио)-3 Н-[1,2,3]триазоло[4,5-d]пиримидин-3-ил]-5-(2 гидроксиэтокси)циклопентан-1,2-диола (далее рассматриваемый как Тикагрелор) в виде стабильной сокристаллической твердой формы. За счет соответствующего применения безводных или сольватированных форм АФИ, возможно модулировать и обеспечивать постоянство физико-химических свойств активного фармацевтического ингредиента. Согласно ЕР 1289992, тикагрелор имеет четыре полиморфные формы, из которых форма I является наиболее стабильной с температурой плавления от 146 до 152 С. Однако форму II применяют в лекарственном продукте и данная полиморфная форма известна тем, что имеет температуру плавления в диапазоне от 136 до 139 С. Формы I и II взаимопревращаются при нагревании/охлаждении и это проиллюстрировано на фиг. 2. Сокристалл тикагрелора и 3-гидрокси-2-нафтойной кислоты обладает характерными пиками XRPD,приведенными в таблице, и дифрактограммой XRPD, показанной на фиг. 3. Характерные пики рентгеновской порошковой дифрактограммы для сокристалла представляют собой 3,6; 7,2; 9,3; 14,3; 16,2; 18,7 и 24,5 0,2 2. Сокристалл обладает начальной температурой плавления 136 С, что приблизительно на 2 С выше, чем начальная температура плавления тикагрелора формы II. ВЭЖХ чистота сокристалла также является высокой и составляет 97,9%. Одним из преимуществ получения тикагрелора в виде сокристалла является его полиморфное поведение относительно тикагрелора АФИ. Полиморфизм, способность соединения кристаллизоваться более чем в одну кристаллическую форму, представляет собой основную проблему для фармацевтической промышленности, когда это происходит неожиданно. Именно такой случай представляет собой Ритонавир (Норвир), антиретровирусное лекарственное средство из класса ингибиторов протеаз, которое применяют для лечения ВИЧ-инфекции и СПИДа. Известно, что химическая структура АФИ в оригинальных капсулах Норвира проявляет конформационный полиморфизм, с различными полиморфными формами, проявляющими разные физические свойства. Терапевтически активная полиморфная форма Ритонавира, применяемого в оригинальном препарате, представляет собой метастабильную полиморфную форму, которая быстро переходит в стабильную полиморфную форму [Bauer et al, Pharmaceutical Research, 18(6), 2001, 859-866.], проявляющую низкую растворимость и низкую биосовместимость. Данная полиморфная трансформация не была предвидена разработчиками Норвира и вызвала существенные проблемы. В случае тикагрелора существуют сходные проблемы. А именно, полиморфная форма II, примененная в лекарственном продукте, является метастабильной формой, которая быстро трансформируется через обратимый индуцированный температурой фазовый переход в термодинамически более стабильную форму I при нагревании. Аналогично Ритонавир и тикагрелор также проявляют существенную конформационную гибкость, делающую их чувствительными к полиморфным изменениям в зависимости от условий кристаллизации (преимущественно температура и растворитель). Сокристалл тикагрелора и 3-гидрокси-2-нафтойной кислоты обеспечивает лучший контроль свойств твердого состояния, поскольку он не чувствителен к полиморфным изменениям в зависимости от температуры и растворителя (последний ограничен временем и доступностью). Поскольку индуцированное температурой полиморфное поведение сокристалла вызывает обеспокоенность, фиг. 4 показывает ДСК кривую сокристалла, который проявляет только одну эндотерму, соответствующую температуре плавления сокристалла. Более того, показано, что сокристалл не является полиморфным внутри ограничения ручных техник кристаллизации, в зависимости от растворителя кристаллизации согласно результатам длительных экспериментов по кристаллизации раствора при помощи различных растворителей. Это проиллюстрировано на фиг. 5, которая показывает идентичные дифрактограммы XRPD сокристалла, когда кристаллизованный тикагрелор кристаллизуют при помощи 1 экв. 3-гидрокси-2 нафтойной кислоты из приемлемого растворителя при температуре в диапазоне от 20 до 65 С. В качестве обычных приемлемых растворителей применяют, например, воду, нитрометан, этанол, пропанол, диэтиловый эфир, 2-бутанол, циклогексан, дихлорметан, ацетон, метилэтилкетон, 1,2-диметоксиэтан, этилформат, метилацетат, пропилацетат, изопропилацетат, трихлорэтилен, тетрагидрофуран (ТГФ) или ацетонитрил или их смеси. Для получения сокристалла могут быть применены все известные формы тикагрелора, например форма I или форма II, III или IV, как описано в ЕР 1289992. Аморфная форма также может быть применена. Решающее дополнительное преимущество получения тикагрелора в виде сокристалла связано с превосходной водосорбционной стабильностью сокристалла в отношении АФИ при повышенных значениях (%) относительной влажности. Согласно фиг. 6, при значении относительной влажности 80% (25 С изотерма) сокристалл обладает содержанием воды 3,2 мас.%, и это сравнимо с 3,7 мас.% для тикагрелора формы II. При 90% относительной влажности было показано, что сокристалл обладает содержанием воды приблизительно 13,2 мас.%, при сравнении с 16,8 мас.% для тикагрелора формы II. Оба образца стабильны в отношении водопоглощения до 60% относительной влажности. Дифракционные пики для сокристалла тикагрелора и 3-гидрокси-2-нафтойной кислоты Характерные пики: 3,6; 7,2; 9,3; 14,3; 16,2; 18,7 и 24,50,2 2-тета. В дальнейшем аспекте изобретения сокристалл согласно данному изобретению могут быть применены непосредственно для фармацевтической композиции или в качестве промежуточного продукта для получения фармацевтически приемлемой формы. Краткое описание графических материалов Фиг. 1: XRPD дифрактограмма тикагрелора формы II. Фиг. 2: ДСК кривая для тикагрелора формы II. Фиг. 3: XRPD дифрактограмма сокристалла тикагрелора и 3-гидрокси-2-нафтойной кислоты. Фиг. 4: ДСК кривая для сокристалла тикагрелора и 3-гидрокси-2-нафтойной кислоты. Фиг. 5: схема XRPD паттернов кристаллизации сокристалла тикагрелора и 3-гидрокси-2-нафтойной кислоты в различных растворителях. Схема иллюстрирует утрату полиморфизма сокристаллом. Фиг. 6: сравнение изотерм сорбции-десорбции (25 С) для A) тикагрелора 3-гидрокси-2-нафтойной кислоты и B) тикагрелора формы II. Примеры В следующих примерах образцы оценивали при помощи рентгеновской порошковой дифрактометрии при помощи следующей процедуры: Дифрактограмма была получена в X'PERT PRO MPD PANalytical порошковом дифрактометре с графитовым монохроматором, применяемое излучение CuK (=1,542 ), напряжение возбуждения: 45 кВ, анодный ток: 40 мА, измеряемый диапазон: 2-40 2, приращение: 0,01 2 при времени измерения 50 с, измерение проводили на плоских образцах с площадью поверхности/толщиной 10/0,5 мм. ДСК кривые измеряли при помощи устройства Pyris 1 (Perkin Elmer). Загрузка образца составляла от 3 до 4 мг, скорость нагревания 10 С/мин. Температурная программа: 1) 1 мин при 50 С; 2) от 50 до 200 С при скорости 10 С/мин (исключая прасугрел HCl от 50 до 250 С при скорости 10 С/мин). Газ-носитель: N2, 20 мл/мин. Количество растворителя оценивали при помощи газовой хроматографии (ГХ) в Agilent 7890 с пламенно-ионизационной детекцией. Условия хроматографии: капиллярная колонка: DB-624 (30 м, 0,53 мм внутренний диаметр (ID),3,0 мкм толщина пленки (df) или эквивалент. Температурная программа: 70 С - 2 мин, градиент от 10 С/мин до 170 С/0 мин. Газ-носитель: гелий. Инъекция: 1 мкл. Дозатор: 200 С, отношение сброса 5:1. Детектор: пламенно-ионизационный детектор (ПИД), 260 С. Пример 1. Способ получения сокристалла тикагрелора и 3-гидрокси-2-нафтойной кислоты. Приблизительно 870 мг тикагрелора формы II помещали внутрь 100 мл круглодонной колбы. К нему добавляли 312 мг (1 мол.экв.) 3-гидрокси-2-нафтеновой кислоты. Колбу оснащали воздушным конденсатором и термометром. К содержимому колбы добавляли 50 мл МеОН. Полученную суспензию на-3 024825 гревали до температуры 50 С. Содержимое колбы остужали до 40 С и затем снова нагревали до 50 С с обратным холодильником. Конденсатор для дистилляции прикрепляли к круглодонной колбе, и суспензию нагревали до приблизительно 60 С для дистилляции приблизительно 90 об.% метанола. Толстую суспензию перемешивали и оставляли остывать на ледяной бане в течение 1 ч. Наблюдали быстрое осаждение. Выход: 1,15 г (97,29% теоретического максимума). ВЭЖХ чистота: 97,9%. Образец характеризовали при помощи рентгеновской порошковой дифрактометрии и список характерных пиков приведен в таблице. Пример 2. Получение сокристалла тикагрелора и 3-гидрокси-2-нафтойной кислоты из диапазона растворителей через суспендирование. Приблизительно 40 мг тикагрелора формы II помещали внутрь 1 мл сосуда. К нему добавляли 14,34 мг (1 мол.экв.) 3-гидрокси-2-нафтойной кислоты. В сосуд добавляли 1 мл одного из следующих растворителей для создания насыщенной суспензии: вода, нитрометан, этанол, пропанол, диэтиловый эфир, 2-бутанол, циклогексан, дихлорметан, ацетон, метилэтилкетон, 1,2-диметоксиэтан, этилформат,метилацетат, пропилацетат, изопропилацетат, трихлорэтилен, ТГФ или ацетонитрил. Содержимое сосуда помещали внутрь термомиксера HLC (модель : MHR 23). Температуру суспензии поддерживали постоянной при 35 С и перемешивали при 900 об/мин в течение 9 дней для изучения любых полиморфных трансформаций индуцированных растворителем. Кристаллические образцы оценивали при помощи рентгеновской порошковой дифрактометрии. Дифрактограммы всех образцов соответствовали дифрактограмме, полученной в примере 1. На фиг. 5 приведены дифрактограммы из выбранных растворителей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Сокристалл тикагрелора формулы (I) с 3-гидрокси-2-нафтойной кислотой. 2. Сокристалл по п.1, характеризующийся порошковой рентгеновской дифрактограммой, измеренной при помощи CuK, содержащей специфичные пики высокой интенсивности при 3,6; 7,2; 9,3; 14,3; 16,2; 18,7 и 24,5 0,2 2-тета. 3. Сокристалл по п.1 или 2, характеризующийся тем, что масса 3-гидрокси-2-нафтойной кислоты к тикагрелору находится в молярном стехиометрическом соотношении 1:1. 4. Сокристалл по любому из пп.1-3, характеризующийся кривой дифференциальной сканирующей калориметрии, на которой начало плавления наблюдается при приблизительно 136 С. 5. Способ получения сокристалла по п.1, где тикагрелор кристаллизуют с 3-гидрокси-2-нафтойной кислотой из приемлемого растворителя при температуре в диапазоне от 20 до 65 С. 6. Способ по п.5, где растворитель выбран из группы, состоящей из воды, нитрометана, этанола,пропанола, диэтилового эфира, 2-бутанола, циклогексана, дихлорметана, ацетона, метилэтилкетона,1,2-диметоксиэтана, этилформиата, метилацетата, пропилацетата, изопропилацетата, трихлорэтилена,ТГФ (тетрагидрофуран) и ацетонитрила. 7. Применение сокристалла по п.1 для получения фармацевтической композиции. Фиг. 5 Изотерма сорбции/десорбции воды для сокристалла тикагрелора Изотерма сорбции/десорбции воды для тикагрелора формы II
МПК / Метки
МПК: A61K 31/519, C07D 487/04, A61P 7/02
Метки: кислотой, применение, 3-гидрокси-2-нафтойной, получения, способ, сокристалл, тикагрелора
Код ссылки
<a href="https://eas.patents.su/9-24825-sokristall-tikagrelora-s-3-gidroksi-2-naftojjnojj-kislotojj-sposob-ego-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Сокристалл тикагрелора с 3-гидрокси-2-нафтойной кислотой, способ его получения и применение</a>
Предыдущий патент: Соединения-ингибиторы raf
Следующий патент: Способ лечения латентного туберкулеза
Случайный патент: Накопительный вагон