Способ получения 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты
Номер патента: 15836
Опубликовано: 30.12.2011
Авторы: Калвиньш Иварс, Трибулович Вячеслав, Чернобровый Александр, Лабейш Владимир
Формула / Реферат
1. Способ получения 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты формулы (I)
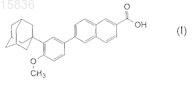
из соединения формулы (II)
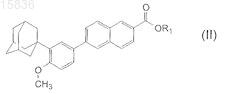
где R1является K, Na, Li, -СН2ОС6Н5, -СН2ОСН2С6Н5, линейным C1-C10алкилом, разветвленным С3-С10алкилом или циклическим С3-С10алкилом СН2ОС1-С5алкилом, отличающийся тем, что исходное вещество нагревают с гидроксидом натрия или калия в растворе гликоля, с последующим подкислением неорганической кислотой и отделением конечного продукта.
2. Способ по п.1, отличающийся тем, что гликоль является 1,2-пропиленгликолем.
3. Способ по п.1, отличающийся тем, что соединение формулы (II) получают из соединения формулы (III)
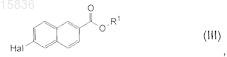
где R1является K, Na, Li, -СН2ОС6Н5, -СН2ОСН2С6Н5, линейным С1-С10алкилом, разветвленным С3-С10алкилом или циклическим С3-С10алкилом, СН2ОС1-С5алкилом и Hal является Cl, Br или I путем его реакции с соединением формулы (IV)
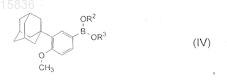
где R2и R3 независимо являются K, Na, Li, H, линейным С1-С10алкилом, разветвленным С3-С10алкилом или циклическим С3-С10алкилом, CH2OR, где R является С1-С5алкилом или -(CH2)0-1C6H5, в присутствии неорганического основания и палладиевого катализатора или Pd(0) при необходимости с фосфиновым лигандом.
4. Способ по п.3, отличающийся тем, что источник Pd(0) выбирают из группы, содержащей палладий ацетат и трис(дибензилиденацетон)дипалладий(0).
5. Способ по любому из пп.3 или 4, отличающийся тем, что фосфиновый лиганд выбирают из группы, содержащей 2-дициклогексилфосфино-2',6'-диметоксибифенил, 2-дициклогексилфосфино-2'-метилбифенил, 2-дициклогексилфосфино-2',6'-диметилбифенил, 2,2-дициклогексилфосфинобифенил, 2-ди-трет-бутилфосфино-2'-метилбифенил, 2-ди-трет-бутилфосфино-2',6'-диметилбифенил, 2-ди-трет-бутилфосфинобифенил, 2,4,6-триизопропил-2'-дифенилфосфинобифенил, дифенилфосфиноферроцен, трифенилфосфин, трициклогексилфосфин, три-трет-бутилфосфин.
6. Способ по любому из пп.3 или 5, отличающийся тем, что фосфиновый лиганд является 2-дициклогексилфосфино-2',6'-диметоксибифенилом.
7. Способ по п.3, отличающийся тем, что палладиевый катализатор является тетракис(трифенилфосфин)палладием(0).
8. Способ по любому из пп.3-7, отличающийся тем, что неорганическое основание выбирают из группы, содержащей карбонаты, ацетаты и фосфаты лития, натрия, калия и стронция.
9. Способ по любому из пп.3-8, отличающийся тем, что палладиевый катализатор или Pd(0) и соединение формулы (IV) используют в соотношении от 0,0005 до 0,1 моль палладиевого катализатора на 1 моль соединения формулы (IV).
10. Способ по любому из пп.3-9, отличающийся тем, что реакцию проводят при температуре от примерно 20 до примерно 100°С.
11. Способ по п.3, отличающийся тем, что соединение формулы (IV) получают из соединения формулы (V)
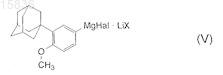
где Hal является Cl или Br;
X является Cl, Br, I, SO4, ClO4, BF4,
путем реакции с соединением формулы B(OR4)3, где R4является линейным C1-С10алкилом, разветвленным С3-С10алкилом или циклическим С3-С10алкилом.
12. Способ по п.11, отличающийся тем, что реакцию проводят при температуре от примерно 0 до примерно + 5°С.
13. Способ по п.11, отличающийся тем, что соединение формулы (V) получают из соединения формулы (VI)
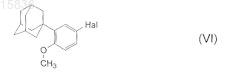
где Hal является Cl или Br;
путем реакции с магнием в апротонном инертном растворителе в прямой реакции Гриньяра в присутствии безводной неорганической соли лития.
14. Способ по п.13, отличающийся тем, что реакцию проводят при температуре от примерно -70 до примерно +65°С.
15. Способ по п.13, отличающийся тем, что апротонный инертный растворитель является тетрагидрофураном.
16. Способ по любому из пп.13-15, отличающийся тем, что безводную неорганическую соль лития выбирают из группы, содержащей безводный хлорид, бромид, иодид, сульфат, перхлорат и тетрафторборат.
17. Способ по любому из пп.13-16, отличающийся тем, что безводной неорганической солью лития является безводный лития хлорид.
18. Способ по любому из пп.13-17, отличающийся тем, что безводную неорганическую соль лития используют в соотношении от 0,5 до 3,0 моль на 1 моль соединения (VI).
19. Способ по любому из пп.13-17, отличающийся тем, что безводную неорганическую соль лития используют в соотношении от 1,2 до 1 моль на 1 моль соединения (VI).
20. Способ по любому из пп.3-10, отличающийся тем, что соединение формулы (IV), приготовленное в соответствии с пп.11-19, используют без выделения из реакционной смеси и очищения.
Текст
Дата публикации и выдачи патента Номер заявки Способ получения 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты из 2-(1 адамантил)-4-броманизола, основанный на превращении 2-(1-адамантил)-4-броманизола в реагент Гриньяра при использовании металлического магния, безводного лития хлорида и дибромэтана,с последующим трансметаллированием с боратами до 3-(адамантил)-4-метоксифенилборной кислоты, которую конвертируют в сложные эфиры 6-[3-(1-адамантил)-4-метоксифенил]-2 нафтойной кислоты путм реакции кросс-сочетания Suzuki-Miyaura с алкил-6-галогеннафтоатами,катализируемой Pd(0) или Pd/фосфиновыми лигандами и с последующим щелочным гидролизом этих эфиров в этиленгликоле или 1,2-пропандиоле с получением 6-[3-(1-адамантил)-4 метоксифенил]-2-нафтойной кислоты.(71)(73) Заявитель и патентовладелец: ГРИНДЕКС, ДЖОИНТ СТОК КАМПАНИ (LV) 015836 Область изобретения Данное изобретение относится к способу получения 6-[3-(1-адамантил)-4-метоксифенил]-2 нафтойной кислоты (адапалена). Адапален используют для лечения acne vulgaris [Waugh, J.; Noble, S.;tretinoin or adapalene in acne vulgaris: an overview. J. Dermatol. Treat. 2004, 15 (4), 200-207.] Это вещество также обладает антиопухолевой активностью [WO 2001/056563, Galderma Research (USA)]. Таким образом, предпочтителен приемлемый способ получения адапалена. Уровень техники Способ получения 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты известен с 1986 г.[Shroot, В.; Eustache, J.; Bernardon, J.-M. ЕР 199636; Bezonaphtalene derivatives and compositions. US 4717720 (1988)]. Это многостадийный процесс, включающий следующие стадии: а) алкилирование 4-бромфенола адамантанолом-2 с получением 2-(1-адамантил)-4-бромфенола; б) О-алкилирование 2-(1-адамантил)-4-бромфенола с помощью Mel с получением 2-(1-адамантил)4-броманизола; в) получение реагента Гриньяра из 2-(1-адамантил)-4-броманизола, его преобразование в цинковое производное и его Ni-катализируемое сочетание с метил 6-бром-2-нафтенатом с образованием метил-6[3-(1-адамантил)-4-метоксифенил]-2-нафтената; г) щелочной гидролиз метил-6-[3-(1-адамантил)-4-метоксифенил]-2-нафтената с образованием 6-[3(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты. Этот способ обладает рядом недостатков: 1) для очищения 2-(1-адамантил)-4-броманизола и метил-6-[3-(1-адамантил)-4-метоксифенил]-2 нафтената требуется использование колоночной хроматографии; 2) получение реагента Гриньяра из 2-(1-адамантил)-4-броманизола, превращение его в цинковое производное и Ni-катализируемое сочетание с метил 6-бром-2-нафтенатом с образованием метил-6-[3-(1 адамантил)-4-метоксифенил]-2-нафтената в стадии (в) сложно контролировать в промышленном масштабе и выходы не являются стабильными. Перспективным способом производства адапалена является использование реакции Suzuki-Miyaurawith organic electrophiles, 1995-1998. J. Organomet. Chem. 1999, 576, 147-168; Kotha, S.; Lahiri, K.; Kashinath, D., Recent applications of the Suzuki-Miyaura cross-coupling reaction in organic synthesis. Tetrahedron 2002, 58, 9633-9695]. Использование в этом процессе реакции Suzuki-Miyaura должно способствовать эффективному сочетанию двух известных веществ - 3-(1-адамантил)-4-метоксифенилборной кислоты или е подходящего производного, с подходящим производным метил-6-замещнного-2-нафтената. В 2006 г. был опубликован способ (Castaldi, G.; Allegrini, P.; Razezetti, G.; Ercoli, M.; A process forthe preparation of adapalene, EP 1707555 А), в котором для синтеза адапалена была использована известная (Zim, D.; Lando, V.R.; Dupont, J.; Montiero, А.л. Org. Lett. 2001, 3, 3049) версия реакции SuzukiMiyaura для сочетания 3-(1-адамантил)-4-метоксифенилборной кислоты с тозилокси-2-нафтенатом в присутствии соли Ni(II) и фосфиновых лигандов: К сожалению, в патенте не описано ни получение 3-(1-адамантил)-4-метоксифенилборной кислоты,ни способ получения тозилокси-2-нафтената. Известный способ получения 3-(1-адамантил)-4 метоксифенилборной кислоты не обеспечивает недорогого производства со стабильными и достаточными выходами. Попытки повторить способ Castaldi продемонстрировали, что катализируемая с помощьюNi(II)/фосфинового комплекса реакция сочетания является нестабильной и приводит к непостоянным препаративным выходам. Таким образом, целью данного изобретения являлась разработка альтернативного процесса, основанного на реакции Suzuki-Miyaura, для производства 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты, характеризующегося стабильными высокими выходами, легко масштабируемого и пригодного для промышленного применения. Так как наиболее важным и сложным в этом процессе является производство промежуточного соединения 3-(1-адамантил)-4-метоксифенилборной кислоты, было необходимо разработать приемлемый способ его получения. Известен способ синтеза 3-(1-адамантил)-4-метоксифенилборной кислоты из 2-(1-адамантил)-4 броманизола через соответствующее Li-производноеWO 2005/108338 A1]). Главным недостатком этого способа является низкий выход конечного продукта,не превышающий 12%. Важно отметить, что реакции как металлирования, так и трансметаллирования,проводятся при -78 С, что существенно осложняет осуществление этого процесса в промышленном масштабе. Таким образом, необходимо было разработать препаративный способ получения 3-(1-адамантил)-4 метоксифенилборной кислоты и е производных, приемлемый для синтеза адапалена, удобный для промышленного применения, приводящий к высоким выходам при температурах, комфортных для промышленных процессов. Неожиданно было обнаружено, что можно приготовить 3-(1-адамантил)-4-метоксифенилборную кислоту и е производные, подходящие для синтеза адапалена, из 2-(1-адамантил)-4-броманизола путм его трансформации в модифицированный реагент Гриньяра полученный при проведении реакции в выбранном растворителе, например тетрагидрофуране, и при использовании одновременно двух активаторов реакции - хлорида лития и дибромэтана. Молярное соотношение LiCl и 2-(1-адамантил)-4-броманизола при получение реагент Гриньяра может составлять от 0,5 до 3,0, но лучшие выходы были получены с избытком LiCl. Мы обнаружили, что оптимальное соотношение этих реагентов составляет от 1,2 до 1. Дальнейшее увеличение количестваLiCl вплоть до 3:1 не приводит к увеличению выхода. В синтезе реагента Гриньяра (V) из 2-(1-адамантил)-4-броманизола могут быть использованы различные соли Li, например LiBr, LiI, Li2SO4, LiClO4, LiBF4, но лучшие результаты были получены при использовании LiCl. Температура реакционной среды может составлять от -70 до 65 С, но более предпочтительным является проведение реакционного процесса при температуре кипения тетрагидрофурана. Вместо 2-(1-адамантил)-4-броманизола можно использовать другие 2-(1-адамантил)-4 галогенанизолы с формулой (VI) где Hal является Cl или Br. Неожиданно было обнаружено, что 3-(1-адамантил)-4-метоксифенилборная кислота может быть получена из упомянутого выше реагента Гриньяра даже при температуре от 0 до +5 С. Это удивительно и неожиданно. Известно, что подобные арилборные кислоты могут быть приготовлены только при намного более низких температурах, например, -70 С [Seaman, W.; Jonson, J.R. Derivatives of phenylboricAm. Chem. Soc. 1932, 54 (11), 4415-4425. Cladingboel, D.E. A large-scale synthesis of [4-(2-(2H)tetrahydropyranyloxy)phenyl]boronic acid. Org. Process Res. Dev., 2000, 4(3), 153-155]. Ещ более неожиданным является тот факт, что понижение температуры на стадии реакции сочетания не приводит к увеличению выхода 3-(1-адамантил)-4-метоксифенилборной кислоты. В соответствии с данным изобретением реагент Гриньяра может быть превращен в производное 3(1-адамантил)-4-метоксифенилборной кислоты путм реакции с триалкилборатами, предпочтительно с триметилборатом. Было обнаружено, что в этой реакции триметилборат может быть заменн другими электрофильными триалкилборатами, но обычно это приводит к понижению выхода 3-(1-адамантил)-4 метоксифенилборной кислоты. 3-(1-Адамантил)-4-метоксифенилборная кислота не является очень стабильным соединением. Нестабильность 3-(1-адамантил)-4-метоксифенилборной кислоты демонстрируется е спектром ядерного магнитного резонанса (ЯМР), в котором наблюдаются сигналы е циклического тримера (бороксина) в непостоянной пропорции. Для образования С-С-связи необходимо, чтобы один из компонентов реакции сочетания, а именно 3-(1-адамантил)-4-метоксифенил радикал, был замещн борсодержащей функциональной группой, например где R является Н, алкильной или циклоалкильной группой. При изучении проблемы стабилизации 3-(1-адамантил)-4-метоксифенилборной кислоты, были синтезированы серии алкил 3-(1-адамантил)-4-метоксифенилборатов, которые могут быть удобно приготовлены реакцией реагента Гриньяра с триалкилборатами. Также было обнаружено, что 3-(1-адамантил)-4 метоксифенилборная кислота может быть легко превращена в соответствующий циклический сложный эфир, например, пинаколовый эфир, путм нагревания 3-(1-адамантил)-4-метоксифенилборной кислоты с 2,3-диметил-2,3-бутандиола (пинакола) в толуоле с удалением воды азеотропной перегонкой. Подобным образом получают циклические эфиры этиленгликоля и 2,2-диметил-1,3-пропандиола. Таким образом, впервые были получены новые сложные эфиры 3-(1-адамантил)-4 метоксифенилборной кислоты, пригодные для синтеза адапалена. В соответствии с данным изобретением синтез адапалена, начиная с легкодоступного 2-(1 адамантил)-4-броманизола, включает следующие стадии: А) существенно улучшенный, воспроизводимый и масштабируемый способ получения 3-(1 адамантил)-4-метоксифенилборной кислоты через реагент Гриньяра, получаемый с высоким выходом из 2-(1-адамантил)-4-броманизола при 0-5 С в присутствии LiCl и дибромэтана; Б) пригодное для промышленного применения каталитическое сочетание 3-(1-адамантил)-4 метоксифенилборной кислоты или е производных в реакции Suzuki-Miyaura с 6-галогеннафтойным эфиром с образованием 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойного эфира (формула II) где R1 является К, Na, Li, -CH2OC6H5, -СН 2 ОСН 2 С 6 Н 5, линейным С 1-С 10 алкилом, разветвленным С 3 С 10 алкилом или циклическим С 3-С 10 алкилом СН 2 ОС 1-С 5 алкилом с последующим его щелочным гидролизом до 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты формулы (I) в растворе этиленгликоля или пропан-1,2-диола, что позволяет отделение конечного продукта известными способами. Вместо метил-6-бром-2-нафтената в реакции сочетания также могут быть использованы другие сложные эфиры 6-галоген-2-нафтойных кислот, например, эфиры 6-хлор или 6-йод-2-нафтойной кислоты. Также упомянутая 6-галоген-2-нафтойная кислота может использоваться как в виде свободной кислоты, так и в виде е Li, Na или К соли. 6-Галоген-2-нафтойные эфиры, используемые в реакции сочетания, могут быть получены из спиртов, содержащих от 1 до 10 атомов углерода, как с прямой цепочкой, так и разветвлнных. Также 6-галоген-2-нафтойные эфиры могут быть получены из алициклических спиртов, содержащих 3, 4, 5 или 6 атомов углерода в цикле и необязательно замещенных в цикле. Кроме того, 6-галоген-2 нафтойнымые эфиры, пригодные для данного способа, включают алкоксиметиловые или арилоксиметиловые сложные эфиры с общей формулой сложноэфирной группы -COO-CH2OR, где R обозначает алкильную группу, например метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, пентильную или разветвлнную пентильную группу, а также арилсодержащую оксиметильную группу, например феноксиметильную или бензилоксиметильную группу. Предложенные промежуточные соединения могут быть представлены следующей общей формулой: где R1 является К, Na, Li, -СН 2 ОС 6 Н 5, -СН 2 ОСН 2 С 6 Н 5, линейным С 1-С 10 алкилом, разветвлнным С 3 С 10 алкилом или циклическим С 3-С 10 алкилом, СН 2 ОС 1-С 5 алкилом, и Hal является Cl, Br или I. В качестве второго компонента для реакции сочетания в способе, согласно данному изобретению,предлагается использование различныхпроизводных 3-(1-адамантил)-4-метоксифенилборной кислоты общей формулы где R2 и R3 независимо являются К, Na, Li, H, линейным С 1-С 10 алкилом, разветвлнным С 3 С 10 алкилом или циклическим С 3-С 10 алкилом, CH2OR, где R является C1-С 6 алкилом или -(CH2)0-1C6H5, в присутствии неорганического основания и палладиевого катализатора или Pd(0). Было обнаружено, что сочетание производного 3-(1-адамантил)-4-метоксифенилборной кислоты с 6-галоген-2-нафтойным эфиром может быть катализировано различными агентами, включая щелочные агенты, такие как карбонат, ацетат или фосфат Li, Na, К или Sr. В отличие от известного процесса Castaldi, в котором используется катализ солями Ni(II) и фосфиновыми лигандами, было обнаружено, что высокие и воспроизводимые выходы в этой реакции обеспечиваются при использовании палладий-содержащих катализаторов или Pd(0) с фосфиновыми лигандами или без таковых, например, тетракис(трифенилфосфин)палладий(0). Наиболее приемлемыми источниками палладия Pd(0) являются палладий ацетат и трис(дибензилиденацетон)дипалладий(0). Исследования показали, что для катализа реакции сочетания приемлемыми являются следующие фосфиновые лиганды: 2-дициклогексифосфино-2',6'-диметоксибифенил,2-дициклогексилфосфино-2'-метилбифенил,2 дициклогексилфосфино-2',6'-диметилбифенил,2-дициклогексилфосфинобифенил,2-ди-третбутилфосфино-2'-метилбифенил,2-ди-трет-бутил-фосфино-2',6'-диметилбифенил,2-ди-третбутилфосфинобифенил, 2,4,6-три-изопропил-2'-бифенилилфосфинобифенил, дифенилфосфиноферроцен,трифенилфосфин, трициклогексилфосфин, и три-трет-бутилфосфин, однако наилучшие результаты были получены при использовании 2-дициклогексилфосфино-2',6'-диметоксибифенильного лиганда. Количество катализатора зависит от его структуры и меняется в пределах от 0,0005 до 0,1 моля на один моль производного 3-(1-адамантил)-4-метоксифенилборной кислоты. В большинстве случаев оптимальная концентрация катализатора составляет около 0,005 моля на один моль производного борной кислоты. Реакция может осуществляться в подходящем органическом растворителе или их смеси, а также в их смеси с водой. Температура реакции зависит от используемых компонентов и от катализатора и составляет от 20 до 100 С. Данное изобретение иллюстрируется, но не ограничивается, следующими примерами. Стадия А. 2-(1-Адамантил)-4-броманизол Пример 1. В колбу объемом 1 л, оборудованную мешалкой, обратным холодильником и капельной воронкой,поместили смесь 50 г (0.33 М) 1-адамантанола, 68 г (45,5 мл, 0,36 моль) 4-броманизола и 500 мл метилен хлорида. Смесь перемешивали до растворения после чего в течение часа добавили 35 г (19 мл, 0.36 моль) серной кислоты. Реакционную смесь перемешивали в течение 4 ч, добавили 200 мл воды, перемешивали ещ 10 мин, перенесли в разделительную воронку и отделили органический слой. Этот слой нейтрализовали двумя порциями по 100 мл 10% раствора карбоната натрия. Метилен хлорид полностью упарили,остаток растворили в 300 мл этил ацетата, отфильтровали, упарили до объма 200 мл и оставили кристаллизоваться при температуре около 0 С на 16 ч. Кристаллы отфильтровали, промыли с помощью 50 мл холодного этил ацетата и высушили при 100 С в течение часа. Получили 2-адамантил-4-броманизол,76 г (72%) с температурой плавления 140-141 С. ЯМР (500 MHz, DMSO D6) : 1.75 (s, 6 Н), 2.03 (s, 9 Н), 3.81 (s, 3 Н), 6.82 (d, 1 Н, J = 8 Hz), 7.17 (s, 1H),7.23 (d, 1H, J = 8 Hz). Десятикратное увеличение объма реакции не привело к изменению выхода или качества 2-(1 адамантил)-4-броманизола. Стадия Б. 3-(1-Адамантил)-4-метоксифенилборная кислота Пример 2. В колбе объемом 1 л, оборудованную мешалкой, обратным холодильником и капельной воронкой,перемешивали смесь 8 г (0.33 моль) магниевых стружек и 200 мл сухого тетрагидрофурана. Добавили 8 г(0,19 моль) порошкообразного безводного хлорида лития. Воздух в колбе заменили аргоном и все последующие операции проводили в слабом токе этого инертного газа. При интенсивном перемешивании 11 г(5 мл, 0,06 моль) 1,2-дибромэтана добавили одной порцией. После стихания бурной реакции горячую реакционную смесь обработали раствором 50 г (0,16 моль) 2-(1-адамантил)-4-броманизола в 400 мл тетрагидрофурана с такой скоростью, чтобы поддерживать слабое кипение. После добавления раствора 2-(1 адамантил)-4-броманизола реакционную смесь перемешивали и грели до слабого кипения в течение 30 мин. Перемешивание прекратили и реагент Гриньяра, полученный таким образом, декантировали от остатка магния в коническую колбу, предварительно заполненную аргоном, закрыли пробкой и хранили при 0 С в течение 2 ч. В колбу объемом 1 л, оборудованную мешалкой, обратным холодильником и капельной воронкой,поместили смесь 33 г (36 мл, 0,35 моль) триметилбората и 100 мл сухого тетрагидрофурана. Полученный-4 015836 раствор охладили до температуры 0 - +5 С (с помощью ледяной воды) и при интенсивном перемешивании обработали ранее приготовленным реагентом Гриньяра в течение 10 мин. Реакционную смесь оставили на ночь (16 ч) в холодильнике при температуре 0 - +5 С. Реакционную смесь разложили раствором 50 мл соляной кислоты в 50 мл воды при интенсивном перемешивании в отсутствии внешнего охлаждения. Смесь перенесли в разделительную воронку и разделили слои. К водному слою добавили 200 мл воды и дважды проэкстрагировали с помощью 100 мл диэтилового эфира. Объединнные органические растворы высушили с помощью безводного сульфата натрия, растворители удалили при пониженном давлении при температуре около 50 С на водяной бане. Остаток обработали 200 мл этил ацетата и оставили на ночь в холодильнике. Осадок отфильтровали и высушили при температуре 100 С. Получили 3(1-адамантил)-4-метоксифенилборную кислоту, 30 г (68%) с температурой плавления 300 С. Пример 3. Реакцию проводили, как описано в примере 2, используя 81 г (94 мл, 0,35 моль) трибутилбората в качестве электрофила. Получено 3-(1-адамантил)-4-метоксифенилборная кислота, 28 г (56%). Пример 4. Реакцию проводили, как описано в примере 2, используя 66 г (81 мл, 0,35 моль) триизопропилбората. Получено 3-(1-адамантил)-4-метоксифенилборная кислота, 23 г (51%). Пример 5. Реакцию проводили, как описано в примере 2. Реагент Гриньяра получили с добавлением 6,8 г (0,16 моль, 1 эквивалент) LiCl. Получили 3-(1-адамантил)-4-метоксифенилборную кислоту, 21,2 г (48%). Пример 6. Реакцию проводили, как описано в примере 2. Реагент Гриньяра получили с добавлением 0,7 г(7%). Пример 7. Реакцию проводили, как описано в примере 2. Реагент Гриньяра получили без добавления LiCl. Получили 3-(1-адамантил)-4-метоксифенилборную кислоту, 1,3 г (3%). Пример 8. Реакцию проводили, как описано в примере 2. Реагент Гриньяра получили с добавлением 13,6 г(0,32 моль, 2 эквивалента) LiCl. Получили 3-(1-адамантил)-4-метоксифенилборную кислоту, 28 г (63%). Пример 9. Реакцию проводили, как описано в примере 2. Реагент Гриньяра получили с добавлением 20,4 г(0,48 моль, 3 эквивалента) LiCl. Получили 3-(1-адамантил)-4-метоксифенилборную кислоту, 27 г (62%). Пример 10. Реакцию проводили, как описано в примере 2. Реакцию раствора 3-(1-адамантил)-4 метоксифенилмагний бромида с триметилборатом проводили при -70 С. Получили 3-(1-адамантил)-4 метоксифенилборную кислоту, 30,6 г (69%). Увеличение масштаба синтеза в 6 раз при сохранении оптимальных условий реакции не привело к понижению выхода 3-(1-адамантил)-4-метоксифенилборной кислоты. Так как ЯМР спектр 3-(1-адамантил)-4-метоксифенилборной кислоты является комбинированным спектром кислоты и е циклического тримера (бороксина) в различных пропорциях, идентификацию продукта осуществляли после образования циклического эфира пинакола. Пример 11. В колбу объмом 1 л, оборудованную аппаратом Dean-Stark, поместили 100 г (0.35 моль) 3-(1 адамантил)-4-метоксифенилборной кислоты, 45,5 г (0,39 моль) 2,3-диметил-2,3-бутандиола (пинакола) и 500 мл толуола. Смесь кипятили в течение 2 ч, пока теоретическое количество воды не оказалось отобрано в ловушку Dean-Stark (13 мл). По окончании растворитель удалили при пониженном давлении при 60 С на водяной бане. Остаток растворили в 200 мл этил ацетата оставили на 16 ч при температуре около 0 С. Осадок отфильтровали, промыли минимальным количеством холодного этил ацетата и высушили при температуре 80 С. Получили пинаколовый эфир 3-(1-адамантил)-4-метоксифенилборной кислоты, 108 г (84%) с температурой плавления 162-164 С. ЯМР (500 MHz, DMSO D6) : 1.30 (s, 12H), 1.76 (s, 6H), 2.07 (s, 3H), 2.09 (s, 6H), 3.85 (s, 3H), 6.83 (d,1H, J = 8 Hz), 7.49 (s, 1H), 7.50 (d, 1H, J = 8 Hz). С этиленгликолем в качестве спирта выход эфира составил 76%; выход 2,2-диметил-1,3 пропандиолового эфира составил 82%. По результатам газовой хроматографии выход эфиров составил около 98-100%. Более низкие препаративные выходы обусловлены потерями при перекристаллизации. Десятикратное увеличение объма реакции при сохранении оптимальных условий реакции не привело к понижению выхода и качества конечного продукта. Стадия В. Каталитическое сочетание производных 3-(1-адамантил)-4-метоксифенилборной кислоты с эфирами 6-бром-2-нафтойной кислоты в соответствии с Suzuki-Miyaura. Пример 12. В колбе объмом 1 л, оборудованной мешалкой и обратным холодильником 0,25 г (0,5 мол.%)-5 015836 трис(дибензилиденацетон)дипалладия(0) [Pd2(dba)3] растворили в 500 мл тетрагидрофурана, затем добавили 1 г (0,5 мол.%) 2-дициклогексилфосфино-2',6'-диметоксибифенила (Sphos) и образовавшийся раствор перемешивали при небольшом потоке аргона. К реакционной смеси добавили 30 г (0,105 моль) 3-(1-адамантил)-4-метоксифенилборной кислоты и 25 г (0,094 моль) метил 6-бром-2-нафтената и перемешивали до растворения. Затем в одну порцию добавили заранее приготовленный раствор 30 г (0,28 моль) карбоната натрия в 150 мл воды. Реакцию проводили при интенсивном перемешивании и кипячении под небольшим током аргона. По окончанию реакции реакционную смесь охладили до комнатной температуры и отфильтровали без разделения слоев. Осадок составил большую часть продукта. Остаток продукта получили упариванием органической части до %, охлаждением и фильтрованием осадка. Сырой продукт растворили в 200 мл диметилацетамида, отфильтровали горячим, упарили до 150 мл и оставили на 16 ч при комнатной температуре для кристаллизации. Объмные кристаллы отфильтровали и высушили при температуре 150180 С в течение 2 ч. Получили метил 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтенат, 35,2-36,8 г (8892%) с температурой плавления 222-225 С. ЯМР (500 MHz, DMSO D6) : 1.79 (s, 12 Н), 2.10 (s, 3 Н), 2.16 (s, 6H), 3.90 (s, 3 Н), 3.94 (s, 3 Н), 6.99 (d,1H, J = 8 Hz), 7.51 (s, 1H), 7.52 (d, 1H, J = 8 Hz), 7.78 (d, 1H, J = 9 Hz), 7.94 (d, 1H, J = 9 Hz), 7.98 - 8.02 (m,3H), 8.55 (s, 1H). Замещение 3-(1-адамантил)-4-метоксифенилборной кислоты е пинаколовым или этиленгликольным эфиром, или замещение трис(дибензилиденацетон)дипалладия(0) [Pd2(dba)3]палладий ацетатом(Pd(OAc)2), или использование карбоната калия или фосфата калия в качестве щелочного агента, не повлияло существенным образом на выход метил 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтената. Пример 13. Реакцию проводили, как описано в примере 12. В качестве компонента борной кислоты использовали 33 г (0.105 моль) этиленгликольного эфира 3-(1-адамантил)-4-метоксифенилборной кислоты, в качестве щелочного агента использовали раствор 41 г (0,3 моль) карбоната калия в 200 мл воды. Получили метил 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтенат, 34,5 г (86%). Пример 14. Реакцию проводили, как описано в примере 12. В качестве компонента борной кислоты использовали пинаколовый эфир 3-(1-адамантил)-4-метоксифенилборной кислоты, 39 г (0,105 моль), в качестве источника Pd[0] использовали палладий ацетат, 0,11 г (0,5 мол.%). В качестве щелочного агента использовали раствор 60 г (0,28 моль) фосфата калия в 200 мл воды. Получили метил 6-[3-(1-адамантил)-4 метоксифенил]-2-нафтенат, 35 г (87%). Постепенное увеличение количества катализатора до 5 мол.% приводило к уменьшению времени реакции до получаса, но не влияло на выход конечного продукта. Уменьшение количества катализатора до 0,05 мол.% приводило к увеличению времени реакции до 16 ч и снижению выхода метил 6-[3-(1 адамантил)-4-метоксифенил]-2-нафтената до 76%. Увеличение объма реакции при сохранении оптимальных условий реакции не привело к понижению выхода метил 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтената. При использовании в качестве катализатора свежеприготовленного тетракис(трифенилфосфин)палладия(0) Pd[P(Ph)3]4 при сохранении оптимальных условий реакции, выход конечного продукта понижался, как в случае 3-(1-адамантил)-4-метоксифенилборной кислоты, так и в случае пинаколового эфира 3-(1-адамантил)-4-метоксифенилборной кислоты. Пример 15. Реакцию проводили, как описано в примере 12. В качестве катализатора использовали свежеприготовленный тетракис(трифенилфосфин)палладий(0) Pd[P(Ph)3]4 0,6 г (0,5 мол.%). Получили метил 6-[3-(1 адамантил)-4-метоксифенил]-2-нафтенат, 27,2 г (68%). Пример 16. Реакцию проводили, как описано в примере 12. В качестве компонента борной кислоты использовали пинаколовый эфир 3-(1-адамантил)-4-метоксифенилборной кислоты, 39 г (0,105 моль). В качестве катализатора использовали свежеприготовленный тетракис(трифенилфосфин)палладий(0) Pd[P(Ph)3]4 0,6 г (0,5 мол.%). Получили метил 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтенат, 23 г (57%). Метил 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтенат может быть получен без отделения и очищения от 3-(1-адамантил)-4-метоксифенилборной кислоты, полученной в Стадии Б. Пример 17. В колбу объемом 2 л, оборудованную мешалкой, обратным холодильником и капельной воронкой добавили 18 г (0,75 моль) магниевых стружек и 400 мл сухого тетрагидрофурана. Добавили порошковый безводный хлорид лития, 17 г (0,4 моль). Все действия выполнялись в небольшом токе аргона. При интенсивном перемешивании добавили 22 г (10 мл, 0,12 моль) 1,2-дибромэтана. После окончания реакции,к реакционной смеси добавили 100 г (0,31 моль) 2-(1-адамантил)-4-броманизола растворнного в 700 мл сухого тетрагидрофурана с такой скоростью, чтобы поддерживать реакционную смесь в состоянии слабого кипения. После добавления всего раствора 2-(1-адамантил)-4-броманизола, реакционную смесь кипятили в течение ещ 30 мин. Перемешивание прекратили и раствор реагента Гриньяра декантировали от-6 015836 остатка магния в коническую колбу, заранее продутую аргоном, и хранили в закрытом виде при 0 С в течение двух часов. В колбе объемом 2 л, оборудованной мешалкой, обратным холодильником и капельной воронкой,приготовили раствор 70 г (76 мл, 0,67 моль) триметилбората в 200 мл сухого тетрагидрофурана, охладили до 0 - +5 С и при интенсивном перемешивании добавили раствор реагента Гриньяра в течение 10 мин. Образовавшуюся смесь оставили на 16 ч при температуре около 0 С в холодильнике. Разложение провели путм медленного добавления при интенсивном перемешивании 120 мл насыщенного водного раствора хлорида аммония. Органический слой декантировали от неорганических солей и остаток промыли дополнительными 120 мл тетрагидрофурана. В колбе объемом 2 л, оборудованной мешалкой и обратным холодильником, 1 г (0,5 мол.%) трис(дибензилиденацетон)дипалладия(0) [Pd2(dba)3] растворили в 100 мл тетрагидрофурана, затем добавили 2 г (1 мол.%) 2-дициклогексилфосфино-2',6'-диметоксидифенила (Sphos) и образовавшийся раствор перемешивали в слабом токе аргона в течение 30 мин. Раствор 3-(1-адамантил)-4-метоксифенилборной кислоты, полученный в первой стадии, и 61 г (0,23 моль) метил 6-бром-2-нафтената добавили к реакционной смеси и перемешивали до растворения. Потом одной порцией добавили раствор 64 г (0,6 моль) карбоната натрия в 400 мл воды. Реакцию проводили при интенсивном перемешивании и кипении в слабом токе аргона в течение 4 ч. По окончании реакции реакционную смесь охладили до комнатной температуры и отфильтровали без разделения слоев. Осадок составил большую часть продукта. Остаток продукта получили, упарив органический слой до 1/4 объма, охладив и отфильтровав осадок. Сырой продукт растворили в 500 мл диметилацетамида, отфильтровали, упарили до объма в 300 мл, оставили на 16 ч при комнатной температуре для кристаллизации. Кристаллы отфильтровали и высушили при температуре 150-180 С в течение 2 ч. Получили метил 6-[3-(1-адамантил)-4-метоксифенил]2-нафтенат, 86 г, 65% по исходному 2-(1-адамантил)-4-броманизолу. Чистота продукта превышает 98%. Увеличение масштаба синтеза в 5 раз при сохранении оптимальных условий реакции не привело к понижению выхода конечного продукта. Стадия Г. Щелочной гидролиз метил 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтената. Пример 18. В стакан объемом 600 мл поместили 10 г метил-6-[3-(1-адамантил)-4-метоксифенил]-2-нафтената,добавили 300 мл этиленгликоля и нагрели почти до кипения. К полученному прозрачному раствору тремя порциями добавили 15 г гидроксида натрия и интенсивно перемешивали в течение 20 мин. Горячую реакционную смесь медленно добавили при интенсивном перемешивании к холодному 5% раствору водной соляной кислоты. Полученную суспензию перемешивали в течение 30 мин и отфильтровали. Осадок отпрессовали на фильтре, промыли 3500 мл горячей воды. Высушили при температуре 100 С в течение 16 ч. Получили 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойную кислоту, 9,3 г (96%) с температурой плавления 320 С и чистотой более 97%. ЯМР (500 MHz, DMSO D6 : 1.79 (s, 6H), 2.10 (s, 3 Н), 2.16 (s, 6H), 3.90 (s, 3 Н), 6.99 (d, 1H, J = 8 Hz),7.51 (s, 1H), 7.52 (d, 1H, J = 8 Hz), 7.76 (d, 1H, J = 9 Hz), 7.92 (d, 1H, J = 9 Hz), 7.98-8.02 (m, 3H), 8.55 (s,1H), 12.7 (s, 1H). При использовании 1,2-пропандиола вместо этиленгликоля концентрация гидролизованного метил 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтоата в растворе может быть увеличена на 50%. Пример 19. В стакан объемом 600 мл поместили 15 г метил-6-[3-(1-адамантил)-4-метоксифенил]-2-нафтената,добавили 300 мл 1,2-пропандиола и нагрели почти до кипения. К полученному прозрачному раствору тремя порциями добавили 15 г гидроксида натрия и интенсивно перемешивали в течение 20 мин. Прочие действия по обработке реакционной смеси и выделению конечного продукта аналогичны описанным в примере 18. Выход 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты составил 96%. Десятикратное увеличение объма реакции при сохранении оптимальных условий реакции не привело к понижению выхода и качества конечного продукта. Описанный процесс производства адапалена характеризуется высокими выходами промежуточных и конечных продуктов, простотой технологии и возможностью масштабирования. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты формулы (I) из соединения формулы (II) где R1 является K, Na, Li, -СН 2 ОС 6 Н 5, -СН 2 ОСН 2 С 6 Н 5, линейным C1-C10 алкилом, разветвленным С 3 С 10 алкилом или циклическим С 3-С 10 алкилом СН 2 ОС 1-С 5 алкилом, отличающийся тем, что исходное вещество нагревают с гидроксидом натрия или калия в растворе гликоля, с последующим подкислением неорганической кислотой и отделением конечного продукта. 2. Способ по п.1, отличающийся тем, что гликоль является 1,2-пропиленгликолем. 3. Способ по п.1, отличающийся тем, что соединение формулы (II) получают из соединения формулы (III) где R1 является K, Na, Li, -СН 2 ОС 6 Н 5, -СН 2 ОСН 2 С 6 Н 5, линейным С 1-С 10 алкилом, разветвлнным С 3 С 10 алкилом или циклическим С 3-С 10 алкилом, СН 2 ОС 1-С 5 алкилом и Hal является Cl, Br или I путм его реакции с соединением формулы (IV) где R2 и R3 независимо являются K, Na, Li, H, линейным С 1-С 10 алкилом, разветвлнным С 3 С 10 алкилом или циклическим С 3-С 10 алкилом, CH2OR, где R является С 1-С 5 алкилом или -(CH2)0-1C6H5, в присутствии неорганического основания и палладиевого катализатора или Pd(0) при необходимости с фосфиновым лигандом. 4. Способ по п.3, отличающийся тем, что источник Pd(0) выбирают из группы, содержащей палладий ацетат и трис(дибензилиденацетон)дипалладий(0). 5. Способ по любому из пп.3 или 4, отличающийся тем, что фосфиновый лиганд выбирают из группы, содержащей 2-дициклогексилфосфино-2',6'-диметоксибифенил, 2-дициклогексилфосфино-2'метилбифенил, 2-дициклогексилфосфино-2',6'-диметилбифенил, 2,2-дициклогексилфосфинобифенил, 2 ди-трет-бутилфосфино-2'-метилбифенил, 2-ди-трет-бутилфосфино-2',6'-диметилбифенил, 2-ди-третбутилфосфинобифенил, 2,4,6-триизопропил-2'-дифенилфосфинобифенил, дифенилфосфиноферроцен,трифенилфосфин, трициклогексилфосфин, три-трет-бутилфосфин. 6. Способ по любому из пп.3 или 5, отличающийся тем, что фосфиновый лиганд является 2 дициклогексилфосфино-2',6'-диметоксибифенилом. 7. Способ по п.3, отличающийся тем, что палладиевый катализатор является тетракис(трифенилфосфин)палладием(0). 8. Способ по любому из пп.3-7, отличающийся тем, что неорганическое основание выбирают из группы, содержащей карбонаты, ацетаты и фосфаты лития, натрия, калия и стронция. 9. Способ по любому из пп.3-8, отличающийся тем, что палладиевый катализатор или Pd(0) и соединение формулы (IV) используют в соотношении от 0,0005 до 0,1 моль палладиевого катализатора на 1 моль соединения формулы (IV). 10. Способ по любому из пп.3-9, отличающийся тем, что реакцию проводят при температуре от примерно 20 до примерно 100 С. 11. Способ по п.3, отличающийся тем, что соединение формулы (IV) получают из соединения формулы (V)X является Cl, Br, I, SO4, ClO4, BF4,путм реакции с соединением формулы B(OR4)3, где R4 является линейным C1-С 10 алкилом, разветвлнным С 3-С 10 алкилом или циклическим С 3-С 10 алкилом. 12. Способ по п.11, отличающийся тем, что реакцию проводят при температуре от примерно 0 до примерно + 5 С.-8 015836 13. Способ по п.11, отличающийся тем, что соединение формулы (V) получают из соединения формулы (VI) где Hal является Cl или Br; путм реакции с магнием в апротонном инертном растворителе в прямой реакции Гриньяра в присутствии безводной неорганической соли лития. 14. Способ по п.13, отличающийся тем, что реакцию проводят при температуре от примерно -70 до примерно +65 С. 15. Способ по п.13, отличающийся тем, что апротонный инертный растворитель является тетрагидрофураном. 16. Способ по любому из пп.13-15, отличающийся тем, что безводную неорганическую соль лития выбирают из группы, содержащей безводный хлорид, бромид, иодид, сульфат, перхлорат и тетрафторборат. 17. Способ по любому из пп.13-16, отличающийся тем, что безводной неорганической солью лития является безводный лития хлорид. 18. Способ по любому из пп.13-17, отличающийся тем, что безводную неорганическую соль лития используют в соотношении от 0,5 до 3,0 моль на 1 моль соединения (VI). 19. Способ по любому из пп.13-17, отличающийся тем, что безводную неорганическую соль лития используют в соотношении от 1,2 до 1 моль на 1 моль соединения (VI). 20. Способ по любому из пп.3-10, отличающийся тем, что соединение формулы (IV), приготовленное в соответствии с пп.11-19, используют без выделения из реакционной смеси и очищения.
МПК / Метки
МПК: C07C 69/00, C07C 67/343, C07C 65/26, C07C 51/09, C07F 5/02
Метки: способ, 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной, кислоты, получения
Код ссылки
<a href="https://eas.patents.su/10-15836-sposob-polucheniya-6-3-1-adamantil-4-metoksifenil-2-naftojjnojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты</a>
Предыдущий патент: Производные 4-окса(тиа)метилпиперидина и их применение в качестве противодиабетических средств
Следующий патент: Кабельное резьбовое соединение
Случайный патент: Лотерейный билет












