Стабильная фармацевтическая композиция, содержащая доцетаксел, и способ изготовления таковой
Номер патента: 14071
Опубликовано: 30.08.2010
Авторы: Ох Дзоон Гио, Ли Нам Киу, Дзанг Воо Дзае, Ли Йоон-Дзунг, Ким Дзае-Сун, Ум Кей Ан, Ким Нам Хо, Ли Дзин Йоунг, Ким Воонг Сик, Сунг Дзин-Хеунг
Формула / Реферат
1. Стабильная фармацевтическая композиция, содержащая доцетаксел для инъекций, включающая доцетаксел и циклодекстрин, причем добавляют по меньшей мере один водорастворимый полимер, выбранный из гидроксипропилметилцеллюлозы (НРМС), полиэтиленгликоля (PEG) или поливинилпирролидона (PVP).
2. Фармацевтическая композиция для инъекций по п.1, где доцетаксел находится в безводной форме или в тригидратной форме.
3. Фармацевтическая композиция для инъекций по п.1, где циклодекстрин содержится в количестве 5-400 частей по массе на 1 часть по массе доцетаксела.
4. Фармацевтическая композиция для инъекций по п.1, где водорастворимый полимер содержится в количестве 0,1-100 частей по массе на 1 часть по массе доцетаксела.
5. Фармацевтическая композиция для инъекций по п.1, где циклодекстрин представляет собой b-циклодекстрин или его производное.
6. Фармацевтическая композиция для инъекций по п.1, где циклодекстрин представляет собой гидроксипропил-b-циклодекстрин.
7. Фармацевтическая композиция для инъекций по п.6, где гидроксипропил-b-циклодекстрин имеет степень молекулярного замещения (MS) от 0,2 до 1,0.
8. Фармацевтическая композиция для инъекций по п.1, где гидроксипропилметилцеллюлоза (НРМС) имеет вязкость, колеблющуюся в диапазоне от 5 до 100000 сП.
9. Фармацевтическая композиция для инъекций по п.1, где полиэтиленгликоль (PEG) имеет среднюю молекулярную массу, колеблющуюся в диапазоне от 300 до 600.
10. Фармацевтическая композиция для инъекций по п.1, где поливинилпирролидон имеет K-значение, колеблющееся в диапазоне от 10 до 20.
11. Способ получения стабильной фармацевтической композиции, содержащей доцетаксел для инъекций, включающий:
1) смешивание доцетаксела с циклодекстрином и водорастворимым полимером, выбранным из гидроксипропилметилцеллюлозы (НРМС), полиэтиленгликоля (PEG) и поливинилпирролидона (PVP), в дистиллированной воде;
2) стерилизацию и лиофилизацию получающейся в результате смеси для получения лиофилизованной композиции и
3) разбавление лиофилизованной композиции дистиллированной водой, декстрозным раствором или физиологическим солевым раствором.
Текст
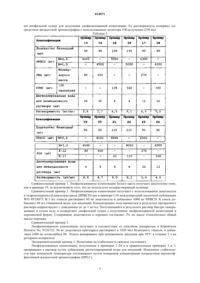
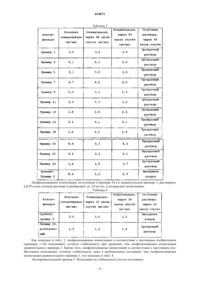
Изобретение относится к стабильной фармацевтической композиции для инъекций, содержащей доцетаксел, и к способу получения таковой. Конкретнее, настоящее изобретение относится к фармацевтической композиции, содержащей доцетаксел для инъекций, имеющей лучшую стабильность при хранении, чем традиционные лекарственные препараты, которую получают путем растворения доцетаксела, нерастворимого в воде соединения, в дистиллированной воде после смешения его с циклодекстрином (CD) и водорастворимым полимером, таким как гидроксипропилметил-целлюлоза (НРМС), полиэтиленгликоль (PEG) или поливинилпирролидон (PVP), и путем лиофилизации смеси, и к способу получения таковой. Ким Нам Хо, Ли Дзин Йоунг, Ким ДзаеСун, Ли Нам Киу, Дзанг Воо Дзае, Ох Дзоон Гио, Ли Йоон-Дзунг, Ким Воонг Сик,Сунг Дзин-Хеунг, Ум Кей Ан (KR) 014071 Область техники, к которой относится изобретение Настоящее изобретение относится к стабильной фармацевтической композиции, содержащей доцетаксел, для инъекций и к способу получения таковой. Конкретнее, настоящее изобретение относится к фармацевтической композиции, содержащей доцетаксел, для инъекций с улучшенной стабильностью при хранении по сравнению с фармацевтическими композициями традиционных лекарственных препаратов,изготовленной путем растворения доцетаксела, нерастворимого в воде соединения, в дистиллированной воде после смешения его с циклодекстрином (CD) и водорастворимым полимером, таким как гидроксипропилметилцеллюлоза (НРМС), полиэтиленгликоль (PEG) и поливинилпирролидон (PVP), и лиофилизации этой смеси, и к способу изготовления таковой. Предпосылки создания изобретения Доцетаксел представляет собой противоопухолевый препарат, эффективный в лечении немелкоклеточного рака легких, рака грудной железы, рака яичника, рака головы и рака шейки матки. Он является комммерчески доступным под товарным знаком Taxotere в компании Sanofi-Aventis. Доцетаксел представляет собой высоколипофильный полусинтетический таксоид, но является почти нерастворимым в воде. Доцетаксел в текущий момент помещают в картонную упаковку типа блистер, состоящую из пузырька с Taxotere на один прием, содержащим доцетаксел, растворенный в полисорбате 80 (эфир полиоксиэтиленовой жирной кислоты), и пузырька с растворителем для Taxotere на один прием, содержащим 13%-ный (масса/масса) этанол, где вышеупомянутые два компонента смешивают вместе для приготовления премикса (предварительно приготовленная смесь) с растворимостью 10 мг/мл и затем добавляют в мешок для вливаний, содержащий физиологический солевой раствор. Конечный раствор для вливаний должен иметь концентрацию доцетаксела, колеблющуюся в диапазоне от 0,3 до 0,9 мг/мл. Если концентрация составляет более чем 0,9 мг/мл, то может возникнуть выпадение осадка. Кроме того, может происходить аллергическая реакция вследствие использования полисорбата 80, а присутствие этанола может вызывать побочные реакции. Международная патентная публикация WO 98/30205 раскрывает способ использования пегилированного витамина Е в качестве поверхностно-активного вещества, и публикация US 2004/0127551 раскрывает способ использования витамина Е TPGS (Dтокоферилполиэтиленгликоль-1000-сукцинат). Однако, они потерпели неудачу в получении стабильной композиции, содержащей высокую концентрацию доцетаксела. Корейский патент 310839 раскрывает способ получения поливинилпирролидоновой матрицы и смешения ее с безводным этанолом и растворителем, таким как полиоксиэтилен-глицерин-рицинолеат(эфир рицинолевой кислоты), полисорбат 80, безводный этанол и полиэтиленгликоль, для получения инъекционного препарата. Однако вышеупомянутое изобретение также не является преимущественным по той причине, что в препарат изобретения включают вещества, которые могут вызвать алкоголизм или аллергическую реакцию (этанол и полисорбат 80). Международная патентная публикация WO 99/24073, зарегистрированная в 1997 г., раскрывает способ повышения растворимости доцетаксела в воде посредством использования циклодекстрина вместо поверхностно-активного вещества. Конкретнее, доцетаксел растворяют в небольшом количестве этанола, и получающийся в результате раствор добавляют к 5%-ному декстрозному раствору ацетилциклодекстрина (AcCD) или гидроксипропилметилциклодекстрина (HPCD). Затем, этанол удаляют настолько, насколько это возможно,путем выпаривания или другого способа, который приемлем. Впоследствии, осуществляют лиофилизацию с получением желаемой лиофилизованной композиции. Подходящее соотношение компонентов смеси: доцетаксела к циклодекстрину составляет от 1:25 до 1:400, исходя из массы. Инъекционный препарат/раствор, полученный путем дополнительного разбавления получающейся в результате лиофилизованной композиции в 5%-ном декстрозном растворе, имеет концентрацию 0,3-1,2 мг/мл и дает возможность поддерживать стабильность физических свойств в течение 72 ч. Однако, это изобретение также имеет проблему, связанную с тем, что этанол, используемый для растворения доцетаксела, не может быть удален, и может происходить выпадение осадка, если получающаяся в результате жидкая композиция имеет низкую концентрацию доцетаксела. Далее, поскольку лиофилизацию проводят после корректирования концентрации доцетаксела жидкой композиции с доведением ее до 0,5-1,25 мг/мл, высушенное вещество имеет большой объем, что приводит к меньшему выходу для одноразовой загрузки аналогичного лиофилизатора. Кроме того, в том случае, когда получающуюся в результате лиофилизованную композицию растворяют или разбавляют для использования, стабильность ее физических свойств имеет тенденцию снижаться, и получающаяся в результате лиофилизованная композиция не имеет растворимость 10 мг/мл, которая является растворимостью премиксового раствора Taxotere. В случае приготовления инъекционного препарата/раствора для клинического введения, которое раскрыто в патенте, путем растворения доцетаксела до его концентрации 0,5-1,25 мг/мл с использованием 5%-ного декстрозного или 0,9%-ного солевого раствора, должно быть использовано приблизительно 150-200 мг вещества, с учетом клинической дозы 100 мг/м 2. Следовательно, потребуется приблизительно 150-200 мл разбавителя, и очень трудно приготовить требуемый инъекционный препа-1 014071 рат/раствор. Таким образом, по-прежнему существует необходимость в разработке нового фармацевтического препарата, который сможет предоставить улучшенные стабильность (устойчивость) при хранении и растворимость по сравнению с фармацевтическими препаратами традиционного состава и, который не требует вредного солюбилизирующего агента, такого как полисорбат или этанол. Раскрытие изобретения Техническая проблема Авторы изобретения выполнили настоящее изобретение путем разработки фармацевтической композиции, содержащей доцетаксел, для инъекций с улучшенными растворимостью и стабильностью по сравнению с фармацевтическими композициями традиционных препаратов путем комбинирования нерастворимого в воде доцетаксела с гидроксипропилциклодекстрином и с водорастворимым полимером, таким как гидроксипропил-метилцеллюлоза (НРМС), полиэтиленгликоль (PEG) или поливинилпирролидон (PVP) , в дистиллированной воде для улучшения стабильности доцетаксела в водном растворе. Таким образом, задачей настоящего изобретения является обеспечение стабильной фармацевтической композиции, содержащей доцетаксел, для инъекций и способа получения таковой. Техническое решение Настоящее изобретение относится к фармацевтической композиции, содержащей доцетаксел, для инъекций с превосходной стабильностью при хранении, включающей доцетаксел, циклодекстрин и водорастворимый полимер, такой как гидроксипропилметилцеллюлоза (НРМС), полиэтиленгликоль (PEG) или поливинилпирролидон (PVP). Настоящее изобретение также относится к способу получения фармацевтической композиции, содержащей доцетаксел, для инъекций с превосходной стабильностью при хранении, включающему: 1) смешивание и растворение доцетаксела с циклодекстрином и водорастворимым полимером, выбранным из гидроксипропилметилцеллюлозы (НРМС), полиэтиленгликоля (PEG) или поливинилпирролидона (PVP), в дистиллированной воде; 2) стерилизацию и лиофилизацию получающейся в результате смеси для получения лиофилизованной композиции; и 3) разбавление лиофилизованной композиции в дистилированной воде, декстрозном растворе или физиологическом солевом растворе. В дальнейшем в этом документе дано подробное описание настоящего изобретения. Настоящее изобретение относится к получению стабильной фармацевтической композиции, содержащей доцетаксел для инъекций в высокой концентрации, путем растворения доцетаксела в дистиллированной воде, содержащей водорастворимый полимер, выбранный из гидроксипропилметилцеллюлозы(НРМС), полиэтиленгликоля (PEG) или поливинилпирролидона (PVP), без использования добавки, вызывающей неблагоприятный эффект, такой как этанол или полисорбат. Ниже подробно описан способ получения фармацевтической композиции, содержащей доцетаксел,для инъекций в соответствии с настоящим изобретением. На стадии 1, доцетаксел смешивают с циклодекстрином и водорастворимым полимером в дистиллированной воде. Предпочтительно доцетаксел, используемый в настоящем изобретении, находится в безводной форме или в гидратной форме. Циклодекстрины имеют гидрофобную полость постоянного размера и защищают гидрофобные соединения от внешней среды путем загрузки их в эту полость. Обычно, циклодекстрины классифицируют,подразделяя на -циклодекстрины, -циклодекстрины и -циклодекстрины, в зависимости от свойств и размера. Кроме вышеупомянутых трех типов циклодекстрина, в настоящем изобретении могут быть использованы другие производные циклодекстринов. Предпочтительно, используют -циклодекстрины,имеющие диаметр полости, колеблющийся в диапазоне от 6,0 до 6,5 , или их производные. Более предпочтительно используют гидроксипропилциклодекстрин (HPBCD), который является коммерчески доступным в качестве инъекционного препарата и который приведен в списке European Pharmacopeia. Предпочтительно циклодекстрин используют в количестве 5-400 частей по массе, более предпочтительно 50-100 частей по массе, на 1 ч по массе доцетаксела. Если циклодекстрин используют в избытке,жидкая композиция становится столь вязкой, что она не может хорошо проходить через фильтровальную бумагу с размером пор 0,22 мкм. Если циклодекстрин используют слишком мало, то невозможно добиться подходящих растворимости и стабильности. В случае гидроксипропилциклодекстрина (HPBCD),гидроксипропилциклодекстрин, имеющий степень молекулярного замещения (MS) 0,2-1,0, более предпочтительно 0,4-0,8, является адекватным. Если степень молекулярного замещения является слишком низкой, растворимость будет плохой. В противоположность тому, если степень молекулярного замещения является слишком высокой, то композиция становится слишком вязкой, что делает манипулирование с ней затруднительным. Водорастворимый полимер используют в настоящем изобретении для улучшения растворимости и стабильности в растворе и для повышения растворимости циклодекстрина. Обычно, для этой цели ис-2 014071 пользуют полиэтиленгликоль (PEG), поливинилпирролидон (PVP), карбоксиметилцеллюлозу (CMC),гидроксипропилцеллюлозу (НРС), гидроксиметилцеллюлозу (НМС), гидроксиэтилцеллюлозу (НЕС),гидроксипропилметилцеллюлозу (НРМС), гидроксипропилэтилцеллюлозу (НРЕС) и так далее. Предпочтительно в настоящем изобретении используют гидроксипропилметилцеллюлозу (НРМС), полиэтиленгликоль (PEG) или поливинилпирролидон (PVP). В случае гидроксипропилметилцеллюлозы (НРМС),гидроксипропилметилцеллюлоза, имеющая вязкость 5-100000 сП, является предпочтительной, где более предпочтительно гидроксипропилметилцеллюлоза имеет вязкость 100-4000 сП. Если вязкость гидроксипропилметилцеллюлозы (НРМС) является слишком низкой, ее растворимость и стабильность будут значительно снижаться. В противоположность тому, если вязкость является слишком высокой, то манипулировать с ней и получать инъекционные средства становится трудно. В случае полиэтиленгликоля(PEG), существует много коммерчески доступных продуктов, имеющих среднюю молекулярную массу,колеблющуюся в диапазоне от 300 до 150000. Предпочтительно, для инъекций используют полиэтиленгликоль, имеющий среднюю молекулярную массу, колеблющуюся в диапазоне от 300 до 600. Особенно используют продукты, которые разрешены для использования, имеющие среднюю молекулярную массу 300, 400 и 600. И, в случае поливинилпирролидона, предпочтительным является поливинилпирролидон,имеющий К-значение, колеблющееся в дипазоне от 10 до 20. Если К-значение поливинилпирролидона является меньше чем 10, его растворимость и стабильность будут значительно снижаться, и, если это значение превышает 20, то манипулирование с ним и получение инъекционных средств становится затруднительным. Водорастворимый полимер предпочтительно составляет 0,1-100 частей по массе, более предпочтительно 1,0-10,0 частей по массе, на 1 часть по массе доцетаксела. Если водорастворимый полимер используют в количестве, меньшем чем 1,0 часть по массе, то улучшение растворимости и стабильности является минимальным. В противоположность тому, если водорастворимый полимер используют в количестве, превышающем 10,0 частей по массе, то композиция становится слишком вязкой, что делает фильтрование и промывание затруднительными. Вода для инъекций, используемая в настоящем изобретении, может представлять собой любую воду, которая может быть использована в качестве воды для инъекций. Предпочтительно, используют дистиллированную воду для инъекций. Получающийся в результате раствор получают с концентрацией доцетаксела 1,5-20 мг/мл. Если концентрация составляет менее чем 1,5 мг/мл, то выход для одноразовой загрузки аналогичного лиофилизатора снижается, что приводит к увеличению себестоимости (издержки на производство). В противоположность тому, если концентрация составляет более чем 20 мг/мл, вязкость увеличивается без дополнительного улучшения растворимости доцетаксела, что делает последующий процесс стерилизации усложненным. На стадии 2, раствор смеси нагревают и перемешивают для стабилизации, и, после стерилизации,подвергают лиофильной сушке для приготовления лиофилизованной композиции. Перемешивание осуществляют в диапазоне температур 5-50 С, предпочтительно 15-30 С. Получающийся в результате раствор смеси замораживают при низкой температуре, и давление понижают при -50 - -80 С для лиофилизации. Получающаяся в результате лиофилизованная композиция имеет белый - бледно-желтый цвет. Получающаяся в результате лиофилизованная композиция обладает превосходной стабильностью по отношению к температуре и влажности. Так, ее можно хранить в течение длительного периода времени, из нее легко получать инъекционное средство, и она может выдерживать воздействие температуры и влажности во время производственных процессов без разложения. Далее, так как этанол или другие добавки, которые могут вызвать аллергические реакции, не присутствуют, то композиция совсем безвредна для человеческого организма. На стадии 3, лиофилизованную композицию разбавляют. Разбавитель может представлять собой любой раствор, который может быть использован для инъекций, и предпочтительно воду для инъекций,декстрозный раствор или физиологический солевой раствор для инъекций. Разбавление осуществляют в две стадии. На первой стадии, прежде, чем получить конечное инъекционное средство, лиофилизованную композицию разбавляют с использованием множества разбавителей. Адекватная концентрация доцетаксела после разбавления составляет 2-20,0 мг/мл, более предпочтительно 2,5-10 мг/мл. Если концентрация составляет менее чем 2 мг/мл, следует использовать пузырек большого размера, что увеличивает издержки и затрудняет манипулирование с препаратом. Если концентрация составляет более чем 20,0 мг/мл, раствор становится слишком вязким, что затрудняет последующее разбавление. На второй стадии лиофилизованную композицию получают в клинически приемлемой концентрации 0,2-2,0 мг/мл. Лиофилизованную композицию разбавляют в пузырьке повторно посредством разбавителя, используемого на первой стадии. Если концентрация составляет менее чем 0,2 мг/мл, то больному следует вливать большое количество (делать инъекцию с большим количеством). Преимущественные эффекты изобретения Поскольку жидкая композиция и лиофилизованная композиция, содержащая доцетаксел, в соответствии с настоящим изобретением имеет превосходную стабильность, ее можно хранить в течение значительно более длительного периода времени, ее можно легко превращать в инъекционное средство, и еще-3 014071 она может выдерживать температуру и влажность производственных процессов без разложения. Кроме того, вследствие отсутствия этанола или полисорбата, композиции являются безвредными для человеческого организма. Вариант осуществления изобретения Проиллюстрированы практические и, следовательно, предпочтительные варианты осуществления настоящего изобретения, которые показаны в следующих примерах. Однако будет понятно, что специалисты в данной области смогут, принимая во внимание это раскрытие, сделать модификации и улучшение в пределах сущности и объема настоящего изобретения. Примеры 1-12. 32 мг доцетаксел-тригидрата, гидроксипропилметилцеллюлозы (НРМС) или поливинилпирролидона (PVP) и гидроксипропилциклодекстрина (HPBCD) взвешивают и растворяют в дистиллированной воде для инъекций при комнатной температуре, что показано в табл. 1. Раствор фильтруют через фильтровальную бумагу с размером пор 0,22 мкм и стерилизуют. После измерения растворимости, фильтрат замораживают при температуре около -40 С и подвергают лиофильной сушке для получения лиофилизованной композиции. Растворимость измеряют посредством жидкостной хроматографии с использованием детектора УФ-излучения (230 нм). Таблица 1 Примеры 13-24. 30 мг безводного доцетаксела, поливинилпирролидона (PVP), гидроксипропилметилцеллюлозы (НРМС) или полиэтиленгликоля (PEG) и гидроксипропилциклодекстрина (HPBCD) взвешивают и растворяют в дистиллированной воде для инъекций при комнатной температуре, что показано в табл. 2. Раствор фильтруют через фильтровальную бумагу с размером пор 0,22 мкм и стерилизуют. После измерения растворимости, фильтрат замораживают при температуре около -40 С и подверга-4 014071 ют лиофильной сушке для получения лиофилизованной композиции. Ее растворимость измеряют посредством жидкостной хроматографии с использованием детектора УФ-излучения (230 нм). Таблица 2 Сравнительный пример 1. Лиофилизованную композицию белого цвета получают аналогично тому,как в примере 19, за исключением того, что не используют водорастворимый полимер. Сравнительный пример 2. Лиофилизованную композицию получают с использованием доцетаксела и гидроксипропилциклодекстрина (HPBCD) как в примере I.10 международной патентной публикацииWO 99/24073. В 3 мл этанола растворяют 60 мг доцетаксела и добавляют 3000 мг HPBCD. К смеси добавляют 60 мл очищенной воды для инъекций. Концентрацию получающегося в результате прозрачного раствора корректируют с доведением ее до 1 мг/мл. Получающийся в результате раствор быстро замораживают в сухом льду и подвергают лиофильной сушке с получением лиофилизованной композиции в порошковой форме. Содержание доцетаксела в порошке составляет 2% по массе относительно общей массы порошка. Сравнительный пример 3. Лиофилизованную композицию получают в соответствии со способом, раскрытым в Корейском Патенте No. 0136722. 96 мг доцетаксел-тригидрата растворяют в 1020 мкл безводного этанола, и добавляют 2490 мг полисорбата 80. Этанол выпаривают при пониженном давлении при 30 С в течение 2 ч на роторном испарителе. Экспериментальный пример 1. Испытание на стабильность (жидкое состояние). Лиофилизованные композиции, полученные в примерах 1-24 и в сравнительных примерах 1 и 3,превращают в раствор путем добавления дистиллированной воды для инъекций. Изменение стабильности при комнатной температуре отслеживают путем измерения концентрации посредством высокоэффективной жидкостной хроматографии (HPLC).(примеры 1-24) показывают лучшую стабильность при хранении, чем лиофилизованные композиции сравнительного примера 1. Кроме того, лиофилизованные композиции в соответствии с настоящим изобретением показывают лучшую стабильность даже в разбавленном состоянии, чем лиофилизованные композиции сравнительного примера 3, что показано в табл. 4. Экспериментальный пример 2. Испытание на стабильность (сухое состояние).-6 014071 Стабильность лиофилизованных композиций, полученных в примерах 13 и 23 и в сравнительных примерах 2 и 3, отслеживают во время их выдерживания в режиме охлаждения (4 С), в режиме длительного хранения (25 С, 60%-ная относительная влажность (RH) и в режимах ускоренного хранения (40 С,75%-ная относительная влажность; 50 С, 60%-ная относительная влажность). Стабильность оценивают,исходя из общего количества примесей. Как показано в табл. 5, лиофилизованные композиции настоящего изобретения показывают лучшую стабильность, чем лиофилизованные композиции сравнительных примеров 2 и 3. Таблица 5 Хотя предпочтительные варианты осуществления настоящего изобретения были раскрыты с иллюстративными целями, специалистам в данной области будет понятно, что можно осуществить различные модификации, добавления и замещения, не выходя за пределы объема и сущности настоящего изобретения, которое раскрыто в сопровождении формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стабильная фармацевтическая композиция, содержащая доцетаксел для инъекций, включающая доцетаксел и циклодекстрин, причем добавляют по меньшей мере один водорастворимый полимер, выбранный из гидроксипропилметилцеллюлозы (НРМС), полиэтиленгликоля (PEG) или поливинилпирролидона (PVP). 2. Фармацевтическая композиция для инъекций по п.1, где доцетаксел находится в безводной форме или в тригидратной форме. 3. Фармацевтическая композиция для инъекций по п.1, где циклодекстрин содержится в количестве 5-400 частей по массе на 1 часть по массе доцетаксела. 4. Фармацевтическая композиция для инъекций по п.1, где водорастворимый полимер содержится в количестве 0,1-100 частей по массе на 1 часть по массе доцетаксела. 5. Фармацевтическая композиция для инъекций по п.1, где циклодекстрин представляет собой циклодекстрин или его производное. 6. Фармацевтическая композиция для инъекций по п.1, где циклодекстрин представляет собой гидроксипропилциклодекстрин. 7. Фармацевтическая композиция для инъекций по п.6, где гидроксипропилциклодекстрин имеет степень молекулярного замещения (MS) от 0,2 до 1,0. 8. Фармацевтическая композиция для инъекций по п.1, где гидроксипропилметилцеллюлоза(НРМС) имеет вязкость, колеблющуюся в диапазоне от 5 до 100000 сП. 9. Фармацевтическая композиция для инъекций по п.1, где полиэтиленгликоль (PEG) имеет среднюю молекулярную массу, колеблющуюся в диапазоне от 300 до 600. 10. Фармацевтическая композиция для инъекций по п.1, где поливинилпирролидон имеет Kзначение, колеблющееся в диапазоне от 10 до 20. 11. Способ получения стабильной фармацевтической композиции, содержащей доцетаксел для инъ-7 014071 екций, включающий: 1) смешивание доцетаксела с циклодекстрином и водорастворимым полимером, выбранным из гидроксипропилметилцеллюлозы (НРМС), полиэтиленгликоля (PEG) и поливинилпирролидона (PVP), в дистиллированной воде; 2) стерилизацию и лиофилизацию получающейся в результате смеси для получения лиофилизованной композиции и 3) разбавление лиофилизованной композиции дистиллированной водой, декстрозным раствором или физиологическим солевым раствором.
МПК / Метки
МПК: A61K 9/08
Метки: содержащая, таковой, изготовления, способ, фармацевтическая, стабильная, композиция, доцетаксел
Код ссылки
<a href="https://eas.patents.su/9-14071-stabilnaya-farmacevticheskaya-kompoziciya-soderzhashhaya-docetaksel-i-sposob-izgotovleniya-takovojj.html" rel="bookmark" title="База патентов Евразийского Союза">Стабильная фармацевтическая композиция, содержащая доцетаксел, и способ изготовления таковой</a>
Предыдущий патент: Применение растительной композиции для лечения воспалительных нарушений
Следующий патент: Скважинное устройство и способ завершения скважины, добычи и нагнетания
Случайный патент: Новые бензальдоксимы, способ получения бензальдоксимов и его применение