Кристаллический несольватированный гидрохлорид 1-(4-(2- пиперидинилэтокси)фенокси)-2-(4-метансульфонилфенил)-6-гидроксинафталина
Формула / Реферат
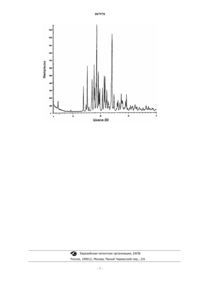
1. Кристаллический несольватированный гидрохлорид 1-(4-(2-пиперидинилэтокси)фенокси)-2-(4-метансульфонилфенил)-6-гидроксинафталина, имеющий спектр рентгеновской дифракции, который имеет следующие пики: 15,2 + 0,1; 17,6 + 0,1; 18,6 + 0,1 и 24,1 + 0,1ш в шкале 2Q; спектр получен с использованием медного источника излучения (СuKa, l=1,54056 Е).
2. Соединение по п.1, в котором упомянутый спектр рентгеновской дифракции дополнительно имеет следующие пики: 16,9 + 0,1; 19,2 + 0,1; 21,3 + 0,1 и 21,6 + 0,1ш в шкале 2Q.
3. Применение соединения по п.1 или 2 в лечении эндометриоза и/или лейомиомы матки.
Текст
007978 По данной заявке испрашивается приоритет на основании предварительной заявки US 60/450,233,поданной 25 февраля 2003 г., и международной (WO) заявки РСТ IB03/03349, поданной 16 июля 2003 г. Уровень техники в области изобретения Лейомиома матки или множественные лейомиомы (фиброма матки) представляют собой клиническую проблему, обозначаемую различными названиями, включая фиброз матки, гипертрофию матки,множественную лейомиому матки, гипертрофию миометрия, fibrosis uteri и фиброзный метрит. В сущности, фиброма матки представляет собой состояние, при котором наблюдается ненормальное накопление фиброзной ткани в стенке матки. Это состояние является причиной дисменореи и бесплодия у женщин. Эндометриоз представляет собой состояние тяжелой дисменореи, которая сопровождается сильными болями, кровотечением в массу эндометрия или брюшную полость и часто приводит к бесплодию. Причиной симптомов является эктопический рост эндометрия, который патологически реагирует на нормальный гормональный контроль и наблюдается в не соответствующих норме тканях. Вследствие соответствующего норме места роста эндометрия в ткани инициируется локальная, подобная воспалению, реакция, вызывающая инфильтрацию макрофагов и каскад событий, приводящий к возникновению болевой реакции. Существующие данные предполагают, что причиной фибромы матки и эндометриоза является патологическая реакция фиброзной ткани и/или ткани эндометрия на эстроген. За последние десять лет появилось множество публикаций о селективных модуляторах эстрогенового рецептора (SERM), например патенты US 5484795, 5484798, 5510358, 5998401 и WO 96/09040. Установлено, что многие из этих SERM, в целом, обладают благотворной активностью агониста эстрогена в костях и сердечно-сосудистой системе, одновременно с лечебной активностью антагониста эстрогена в молочной железе. Обнаружен небольшой набор таких особенно эффективных соединений, обладающих действием антагонистов эстрогена в матке. Соединение со свойствами SERM являются особенно перспективными в лечении фибромы матки и/или эндометриоза. Однако, клиническое использование таких соединений SERM для лечения фибромы матки и/или эндометриоза, особенно у женщин в предменопаузном периоде, затруднено вследствие склонности упомянутых соединений к существенному эффекту стимуляции яичников. Следовательно, в настоящее время существует большая потребность в новых соединениях SERM, которые ведут себя, как антагонисты эстрогена в матке, но существенно не стимулируют яичники. Краткое описание изобретения Данное изобретение касается кристаллического несольватированного гидрохлорида 1-(4-(2 пиперидинилэтокси)фенокси)-2-(4-метансульфонилфенил)-6-гидроксинатфталина, вещества со структурной формулой которое далее именуется F-III; обладающего спектром рентгеновской дифракции, который включает следующие пики: 15,20,1; 17,60,1; 18,6+0,1 и 24,10,1 в шкале 2; когда спектр получен с использованием медного источника излучения (СuК, =1,54056 ). Данное изобретение также относится к фармацевтическим формам, содержащим F-III и фармацевтические носители. В одном из вариантов реализации фармацевтические формы по данному изобретению могут быть адаптированы для применения в лечении эндометриоза и/или лейомиомы матки. Данное изобретение также относится к способам лечения эндометриоза и/или лейомиомы, которые включают в себя введение нуждающемуся в лечении пациенту эффективного количества F-III. Кроме того, данное изобретение относится к применению F-III в лечении эндометриоза и/или лейомиомы матки. Данное изобретение также относится к использованию F-III для производства медикамента для лечения эндометриоза и/или лейомиомы матки. Краткое описание чертежа На чертеже представлен спектр рентгеновской дифракции для F-III. Подробное описание изобретения Следует понимать, что речь идет о гидрохлориде 1-(4-(2-пиперидинилэтокси)фенокси)-2-(4 метансульфонилфенил)-6-гидроксинафталина в несольватированной кристаллической формой. Рентгеновская порошковая дифрактометрия (XRD) использовалась для того, чтобы охарактеризовать F-III. XRD -это методика, которая определяет дальний порядок в кристаллическом материале. Спектры рентгеновской порошковой дифрактометрии (XRD) получали с помощью рентгеновского порошкового дифрактометра Siemens D5000, снабженного источником СuК (=1,54056 ) и твердотельнымSi(Li) детектором Kevex, работающим при минимальных параметрах 50 кВ и 40 мА. Образцы сканировали от 4 до 35 в шкале 2, с шагом 0,02 в шкале 2 с максимальной скоростью сканирования 3,0 секунды/шаг, входной и выходной щелями величиной в 1 мм и щелью детектора 0,1 мм. Синтетическая слюда-1 007978 фторофлогопита (NIST 675) использовалась как внутренний стандарт для коррекции каких-либо ошибок,связанных с заменой образца. Спектр XRD для F-III, полученный в данной работе, характеризуется острыми пиками и плоской базовой линией, что указывает на высокую кристалличность вещества. Угловые положения пиков в шкале 2 и соответствующие данные I/I0 для всех пиков с интенсивностью, равной или превышающей 10% от максимального пика для F-III, показаны в табл. 1. Все данные в табл. 1 представлены с точностью 0,1 в шкале 2. Таблица 1 В кристаллографии хорошо известно, что для каждой данной формы кристалла относительные интенсивности дифракционных пиков могут варьировать вследствие предпочтительной ориентации, образующейся под влиянием таких факторов, как морфология и внешний вид кристалла. Там, где эффекты предпочтительной ориентации присутствуют, интенсивности пиков меняются, но характеристическое положение пиков полиморфа остается неизменным. См., например. The United States Pharmacopeia (Фармакопея США) 23, National Formulary 18, pages 1843-1844, 1995. Кроме того, также в кристаллографии хорошо известно, что для каждой данной кристаллической формы угловое положение пиков может слегка варьировать. Например, положение пика может смещаться в зависимости от температуры, при которой образец анализируют, вследствие замены образца или присутствия либо отсутствия внутреннего стандарта. В данном случае вариабельность 0,1 в шкале 2 включает в себя такие потенциальные вариации, не вызывая сомнений в идентификации кристаллической соли по данному изобретению. 13 С-кроссполяризация/ЯМР с вращением образца под магическим углом (CP/MAS) (твердотельный ЯМР [NMR или SSNMR]) также использовались для того, чтобы охарактеризовать F-III. Упомянутый спектр был получен с помощью ЯМР-спектрометра Varian Unity Inova 400 МГц, работающего на частоте углерода 100,573 Мгц. Параметры режима получения данных были следующими: ширина 90 протонного r.f. импульса 4,0 мкс, время контакта 2,5 мс, время повторения импульса 15 с, частота MAS (ЯМР с вращением образца под магическим углом) 10 кГц, ширина спектра 50 кГц, время накопления 50 мс. Химические сдвиги были отнесены к метильной группе гексаметилбензола (=17,3 м.д.) при замене образца. Данные о химическом сдвиге для Form III следующие: 20,7; 23,8; 25,3; 38,4; 51,2; 52,4; 56,8; 59,8; 110,8; 113,3; 114,6; 118,0; 118,3; 122,3; 122,9; 125,4; 127,2; 130,0; 132,0; 137,9; 142,2; 143,1; 147,3; 151,3; 153,8 и 158,0 м.д. Получение 1. Гидрохлорид 1-(2-4-[2-(4-метансульфонилфенил)-6-меткосинафталин-1 илокси]феноксиэтил)пиперидина В трехгорлую колбу, снабженную обратным холодильником и трубкой для продувки азотом, добавляли 6-метокситетралон (1,0 эквивалент), 4-бромофенилметил-сульфон (1,02-1,05 эквивалента (экв.,ацетат палладия Pd(OAc)2 (0,025 экв.), [(оксиди-2,1-фенилен) бис(дифенилфосфин)] (лиганд DPEphos,0,026 экв.) и 10-12 объемов толуола. Добавляли трет-бутоксид натрия (2,5 экв.) одной порцией и позволяли смеси экзотермически нагреваться до приблизительно 40 С. Нагревали смесь до 75-80 С. После завершения реакции, о чем судили по анализу с помощью высокоэффективной жидкостной хроматографии (HPLC), охлаждали до комнатной температуры. Медленно добавляли 12 объемов воды, поддерживая температуру ниже 40 С. Перемешивали в течение 2-3 ч. Фильтровали через полипропиленовую фильтровальную перегородку и отмывали водой (3 х 2 объемами). Осадок с фильтра высушивали в течение ночи при 50 С для получения 2-(4-метансульфонилфенил)-6-метокситетралона.-2 007978 Объединяли 2-(4-метансульфонилфенил)-6-метокситетралон (1,0 экв.), кизельгур (20 вес.%) и толуол (7,5 объемов). Добавляли РВr3 (1,51,75 экв.) одной порцией при перемешивании при комнатной температуре. Содержимое кипятили с обратным холодильником (110 С) в течение ночи. После завершения реакции, о чем судили по анализу HPLC (обычно - через 15 ч), раствор охлаждали до 45 или 90 С и медленно добавляли 20 объемов тетрагидрофурана (THF). Перемешивали в течение 30 мин при 45 или 90 С и фильтровали в горячем виде через слой кизельгура. Слой отмывали 2 х 2 объемами THF при 45 или 90 С. Концентрировали фильтрат до приблизительно 7 объемов. Добавляли 7,5 объемов воды, чтобы температура смеси оставалась ниже 40 С. (ВНИМАНИЕ: добавление воды в начальный момент очень экзотермично с выделением большого количества HBr). Охлаждали суспензию до комнатной температуры и перемешивали в течение 2-3 ч. Фильтровали через полипропиленовую фильтровальную перегородку и отмывали 2 х 2 объемами воды. Осадок на фильтре высушивали в течение ночи при 60 С в вакууме с получением 1 бромо-2-(4-метансульфонилфенил)-3,4-дигидро-6-метоксинафталина. Объединяли 1-бромо-2-(4-метансульфонилфенил)-3,4-дигидро-6-метоксинафталин и 2,3-дихлоро 5,6-дициано-1,4-бензохинон (DDQ, 1,8 экв.) в 10 объемах ацетонитрила и 5 объемах THF. В атмосфере азота нагревали реакционную смесь до 73-75 С. Развитие реакции контролировали с помощью анализа газовой хроматографией (GC) до завершения реакции. Охлаждали содержимое до температуры окружающей среды и добавляли 10 объемов 1N едкого натра. Перемешивали в течение приблизительно 1 ч и фильтровали. Осадок на фильтре отмывали 2 объемами воды, 3 х 5 объемами 50% смеси ацетонитрил/вода и, наконец, 3 объемами метанола. Осадок с фильтра затем высушивали в вакууме при 65 С с получением 1-бромо-2-(4-метансульфонилфенил)-6-метоксинафталина. Загружали 1-бромо-2-(4-метансульфонилфенил)-6-метоксинафталин,4-(2-пиперидинилэтокси)фенол (2,0 экв.), карбонат цезия (2,0-2,1 экв.) и хлорид меди (0,15 экв.) в 12 объемов диглима. Атмосферу из колбы откачивали приблизительно 2 мин, после чего продували азотом. Повторяли откачивание/продувку азотом 3 раза. Нагревали содержимое до 130 С до завершения реакции, о чем судили по результатам HPLC. После завершения реакции охлаждали содержимое приблизительно до температуры окружающей среды, добавляли 12 объемов гидроксида аммония и перемешивали приблизительно 30 мин. Фильтровали для отделения твердых частиц и отмывали твердые частицы 9 объемами 30% MeOH/NH4OH, суспендируя их на фильтре. Снова отмывали твердые частицы 2 х 9 объемами 30% NH4OH/MeOH, суспендируя их на фильтре. Отмывали 4 объемами метанола. Осадок на фильтре сушили в вакууме при 60 С с получением свободного основания соединения, название которого приведено в заголовке. Суспендировали свободное основание в 9 объемах толуола и нагревали суспензию до 70-75 С. Растворяли 1,1 эквивалента газообразного хлористого водорода в 2 объемах этанола. Добавляли этанольный раствор НСl к горячей толуольной суспензии. Охлаждали раствор до температуры окружающей среды и перемешивали в течение 1-2 ч. Фильтровали и отмывали небольшим количеством толуола. Осадок на фильтре сушили в вакууме при 65 С с получением соединения, название которого приведено в заголовке. Пример 1.F-III Объединяли гидрохлорид 1-(2-(4-[2-(4-метансульфонилфенил)-6-метокси-нафталин-1 илокси]фенокси)этил)пиперидина с 5 объемами 1,2-дихлорэтана (DCE) и охлаждали смесь до температуры ниже 10 С. Под поверхность смеси добавляли 5 эквивалентов трихлорида бора. Перемешивали при температуре окружающей среды до завершения реакции, о чем судили по данным HPLC. Реакцию останавливали 5,6 объемами 3 А-этанола (этанол, денатурированный приблизительно 5% метанола), поддерживая температуру содержимого ниже 50 С. Охлаждали до температуры окружающей среды и перемешивали в течение 1-3 ч. Отфильтровывали твердую фракцию и отмывали осадок на фильтре 3 Аэтанолом. Осадок на фильтре высушивали в вакууме при 65 С. Растворяли полученный продукт в 9,8 объема 3 А-этанола и 1,5 объемах деионизированной воды при температуре, приблизительно равной температуре кипения смеси. Раствор кипятили с обратным холодильником в течение приблизительно 30 мин, а затем давали охлаждаться до температуры окружающей среды. При температуре окружающей среды образовавшуюся суспензию оставляли при перемешивании, затем фильтровали ее и отмывали осадок на фильтре 3 А-этанолом. Растворяли осадок на фильтре в 19 объемах ацетонитрила и 1,4 объема деионизированной воды при температуре кипения. Азеотропно(при постоянном кипении) удаляли воду дистилляцией до тех пор, пока не было удалено 12,1 объема дистиллята. Охлаждали образовавшуюся суспензию до температуры окружающей среды, фильтровали и отмывали осадок на фильтре ацетонитрилом с получением соединения, названного в заголовке. Форма (Фармацевтическая композиция) Соединение по данному изобретению предпочтительно приготавливают в дозированной форме, т.е. в виде индивидуальных единиц, например таблеток или капсул, до введения его пациенту. Термин пациент включает в себя женщин и самок животных, таких как синантропные животные (собаки, кошки,лошади и им подобные). Предпочтительным пациентом для лечения является женщина. Данные фармацевтические композиции готовят известными способами с использованием широко известных и легко доступных ингредиентов. При приготовлении форм по данному изобретению актив-3 007978 ный ингредиент (F-III) обычно смешивают с носителем или разбавляют носителем или заключают в носитель, который может иметь форму капсулы, саше, бумаги или другого контейнера. В том случае, когда носитель служит разбавителем, он может быть твердым, полужидким или жидким материалом, который действует как носитель, наполнитель или среда для активного ингредиента. Таким образом, композиции могут иметь форму таблеток, пилюль, порошков, пастилок, саше, крахмальных облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в твердой или жидкой среде), мягких или твердых желатиновых капсул, суппозиториев, стерильных инъекционных растворов и стерильно упакованных порошков. Примеры пригодных носителей, наполнителей и разбавителей включают в себя лактозу, декстрозу,сахарозу, сорбит, маннит, крахмалы, гуммиарабик, фосфат кальция, альгинаты, трагант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, водный сироп, метилцеллюлозу, метил- и пропилгидроксибензоаты, тальк, стеарат магния и вазелиновое масло. Формы могут дополнительно включать в себя смазывающие агенты, увлажняющие агенты, например полисорбат 80 или лаурилсульфат, эмульгирующие или суспендирующие агенты, консерванты, подсластители или ароматизирующие агенты. Композиции по данному изобретению могут быть приготовлены таким образом, чтобы обеспечить быстрое, продолжительное или отсроченное выделение активного ингредиента после его введения пациенту. Примеры форм Капсулы или таблетки по 10 мг В гранулятор помещали около 156 мг наполнителя (лактоза, маннит или декстроза), около 20 мг дезинтегранта (микрокристаллическая целлюлоза или крахмал), около 4 мг супердеэинтегранта (кросповидон или натрий-гликолят крахмала), около 4 мг связующего вещества (гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза) и около 10 мг F-III и смешивали до равномерного распределения порошков. Во время смешивания порошка с постоянной скоростью распыляли водный гранулирующий раствор, содержащий повидон, гидроксипропилметилцеллюлозу или гидроксипропилцеллюлозу (достаточно добавить около 2-4 мас.% от массы сухого порошка) и увлажняющий агент, такой как полисорбат 80 или лаурил сульфат (достаточно добавить от 0,5 до 3 мас.%). Влажный гранулированный материал просеивали через сито, чтобы разрушить крупные агломераты. Высушивали отфильтрованный гранулированный порошок либо нагреванием в псевдоожиженном слое, либо в конвекционной печи. Измельчали высушенный гранулированный порошок до равного размера пропусканием через мельницу или другой подходящий аппарат, а затем переносили материал в миксер. Равномерно размалывали гранулированный порошок с смазывающим агентом (стеаратом магния или стеарилфумаратом натрия, составляющими около 1 мас.% от общей массы формы) и дополнительным дезинтегрантом (около 2-4 мас.% дополнительно вносимых порошков). Заполняли приготовленным порошком твердые желатиновые капсулы или прессовали его в таблетки (после чего покрывали их пленкой, как описано ниже). Общий вес капсулы или таблетки, приготовленной таким образом, составлял около 200 мг. Капсулы или таблетки по 45 мг В гранулятор вносили около 162 мг наполнителя (лактоза, маннитол или крахмал), около 10 мг дезинтегранта (кросповидон или натрий-гликолят крахмала) и около 45 мг F-III и смешивали их до равномерного распределения порошков. Во время смешивания с постоянной скоростью распыляли водный гранулирующий раствор, содержащий повидон (около 35% по весу) и полисорбат 80 (около 10% по весу). Влажный гранулированный материал просеивали через сито, чтобы разрушить крупные агломераты. Высушивали фильтрованный гранулированный порошок либо нагреванием в псевдоожиженном слое,либо в конвекционной печи. Измельчали высушенный гранулированный порошок до равного размера пропусканием через мельницу или другой подходящий аппарат, а затем переносили материал в миксер. Равномерно размалывали гранулированный порошок со смазывающим агентом (стеаратом магния; около 1 мас.% от общей массы формы) и дополнительным дезинтегрантом (около 2 мас.% дополнительно вносимых порошков). Заполняли приготовленным порошком твердые желатиновые капсулы или прессовали его в таблетки (после чего покрывали их пленкой, как описано ниже). Общий вес капсулы или таблетки,приготовленной таким образом, составлял около 230 мг. В качестве альтернативного варианта для приготовления таблеток в миксер помещали наполнитель,дезинтегрант и перемалывали до равномерного распределения порошков. Когда порошки распределялись равномерно, добавляли смазывающий агент и снова перемалывали. Размолотый материал переносили в пресс для изготовления таблеток, которые затем покрывали пленкой из соответствующего агента. Биологические испытания Испытание на клеточную пролиферацию на клетках Ishikawa. Это испытание измеряет клеточную пролиферацию (с использованием показателя щелочной фосфатазы) при действии соединения по данному изобретению самого по себе как агониста и при действии как антагониста, когда измерялась способность соединения по данному изобретению блокировать стимуляцию роста эстрадиолом. Клетки Ishikawa опухоли эндометрия человека содержали в MEM (минимальная питательная среда с солями Эрла и L-глютамином, Gibco BRL, Gaithersburg, MD) с добавлением 10% фетальной бычьей сыворотки (FBS) (объемные ) (Gibco BRL). За один день до испытания ростовую среду культуры за-4 007978 меняли на среду для испытания DMEM/F-12 (3:1) (модифицированная по Дульбекко среда Игла/питательная смесь F-12, смесь в соотношении 3:1, без Фенолового красного, Gibco BRL) с добавлением 5% фетальной бычьей сыворотки, очищенной покрытым декстраном углем (DCC-FBS) (Hyclone,Logen, UT), L-глютамина (2 мМ), пирувата натрия (1 мМ) в MEM, HEPES (N-[2 гидроксиэтил]пиперазин-N'-[2-этансульфоновая кислота] 2 мМ) все фирмы Gibco BRL). После инкубации в течение ночи клетки Ishikawa отмывали физиологическим раствором с фосфатным буфером Дульбекко (IX) (D-PBS) без Са+2 и Мg+2 (Gibco BRL) и трипсинизировали путем инкубации в течение 3 мин в 0,25% трипсине с ЭДТА (без Фенолового красного) (Gibco BRL). Клетки ресуспендировали в среде для испытания и устанавливали их плотность на уровне 250 000 клеток/мл. Приблизительно 25 000 клеток в 100 мкл среды вносили в 96-ячеечный плоскодонный микропланшет для культур (Costar 3596) и инкубировали при 37 С в увлажняемом инкубаторе в течение 24 ч в 5% CO2. На следующий день готовили серию разведений соединений в среде испытания (6-ти кратная концентрация по отношению к финальной при испытаниях). Испытания проводили в двойном режиме - как агониста и как антагониста. При испытании как агониста в планшет вносили по 25 мкл/ячейка среды испытания, а также 25 мкл/ячейка разведенного соединения по данному изобретению (в концентрации, в 6 раз превышающей финальную). Для проверки в качестве антагониста в планшет добавляли по 25 мкл/ячейка 6 нМ E2 (эстрадиол, Sigma, St. Louis, МО), после чего по 25 мкл/ячейка разведенного соединения по данному изобретению (в концентрации в 6 раз, превышающей финальную). После дополнительной 48-часовой инкубации при 37 С в увлажняемом инкубаторе с 5% CO2, среду отсасывали из ячеек, и в каждую ячейку микрокультур добавляли по 100 мкл свежей среды испытания. Серийные разведения соединений готовили и добавляли, как описано выше. После дополнительной инкубации в течение 72 ч при 37 С в увлажняемом инкубаторе с 5% СO2 испытание прекращали с помощью удаления среды и двукратного отмывания ячеек планшета физиологическим раствором с фосфатным буфером Дульбекко (IX) (D-PBS) (GibcoBRL). Планшеты высушивали в течение 5 мин и замораживали до -70 С не менее, чем на 1 ч. Затем планшеты вынимали из холодильника и оставляли нагреваться при комнатной температуре. В каждую ячейку добавляли по 100 мкл 1-Step PNPP (Pierce Chemical Company, Rockford, IL). После 20 мин инкубации планшеты считывали в спектрофотометре при длине волны 405 нм. Данные обрабатывали линейной интерполяцией для получения значений ЕС 50 (для действия в качестве агониста) или IC50 (для действия в качестве антагониста). Для действия в качестве антагониста % эффективности для каждого соединения рассчитывали по отношению к действию Е 2 (1 нМ) самого по себе. Для действия в качестве агониста % эффективности для каждого соединения рассчитывали по отношению к реакции на тамоксифен. В качестве агониста был протестирован F-III и у него проявился меньший стимулирующий эффект,чем у тамоксифена. В качестве антагониста F-III ингибирует более чем 70% реакции на 1 нМ эстрадиола. 10-дневное гормональное испытание на крысах (стимуляция яичников). Первоначальное испытание токсичности в отношении яичников проводили с помощью 10-дневного изучения гормонов у крыс измерением уровней эстрадиола и лютеинизирующего гормона после введения GYN SERM F-III. Это испытание проводили принудительным пероральным введением соединения в течение 10 дней половозрелым самкам крыс (возраст 9-10 недель) линии F344. Кровь из туловища собирали после быстрого обезглавливания для определения уровней ЛГ (лютеинизирующий гормон) и эстрадиола через приблизительно 2 ч после 10-й дозы. Сыворотку, полученную центрифугированием, отделяли и хранили в замороженном виде при температуре ниже -60 С до испытания. Уровень ЛГ и эстрадиола измеряли с помощью метода радиоиммуноанализа. Первичные крысиные антитела к ЛГ и эталонные препараты (ЛГ крыс:RP-3) получены от д-р A. F.Parlow, директора Центра гипофизных гормонов и антисывороток (Pituitary Hormones and AntiseraCenter), Harbor-UCLA Medical Center, Torrance, CA. Верхний предел определения ЛГ составлял 30 нг/мл,а нижний предел определения - 0,1 нг/мл для образца объемом 100 мкл. Клиническое испытание Е 2. DiaSorin s.r.l, Saluggia (Vercelli), Italy. Верхний предел определения составлял 1000 пг/мл, а нижний предел определения составлял 5 пг/мл. F-III тестировали с помощью перечисленных выше испытаний и установили, что препарат существенно не повышает уровни эстрадиола и ЛГ в циркулирующей крови. Промышленная применимость В качестве антагониста эстрогена в грудной железе и в ткани матки F-III пригоден для лечения состояний, при которых, как показано, эстроген играет роль причины. В качестве агониста эстрогена в скелетной и сердечно-сосудистой системах F-III пригоден для лечения состояний, в которых, как показано,эстроген играет благотворную роль. Термины лечить и лечение, используемые здесь, включают в себя общепринятые значения, например, облегчение боли, улучшение, излечение, предупреждение, прекращение, ингибирование, замедление, остановка или обратное развитие заболевания или тяжести патологического состояния, или их последствий, описанных здесь. Термин предупреждение означает уменьшение вероятности того, что пациент, получивший соединение по данному изобретению, подвергнется заболеванию или развитию каких-либо патологических состояний или их последствий, описанных здесь.-5 007978 Заболевания, нарушения или состояния, при которых соединение по данному изобретению полезно в лечении, включают в себя, но не ограничиваются ими, (1) рак матки и/или молочной железы; (2) эндометриоз; (3) лейомиома матки/множественные лейомиомы; и (4) остеопороз. Лечение лейомиомы матки/множественных лейомиом, как описано здесь, может также уменьшать связанные с заболеванием симптомы, такие как боль, учащенное мочеиспускание и маточное кровотечение. Доза Термин эффективное количество, как он используется в данном документе, означает количествоF-III, которое способно излечивать болезненные состояния или их вредные эффекты, описанные в данном документе. Специфическая вводимая доза определяется конкретными обстоятельствами, сопутствующими каждой отдельной ситуации. Эти обстоятельства включают в себя: путь введения, предшествующую медицинскую историю пациента, излечиваемое патологическое состояние или симптом, тяжесть состояния/симптома, а также возраст и пол реципиента. Врач пациента должен определить вводимую терапевтическую дозу в свете существенных для этого обстоятельств. В целом, эффективная минимальная дневная доза F-III достигает около 5 мг. Обычно эффективная максимальная ежедневная доза не превышает около 350 мг. Точная доза может быть определена в соответствии со стандартной практикой титрования дозы на реципиенте, принятой в медицине, так что первоначально дается низкая доза соединения, а затем она постепенно возрастает до тех пор, когда наблюдается желаемый терапевтический эффект. Путь введенияF-III может быть введен различными путями, которые включают в себя внутримышечный, интраназальный, интравагинальный, внутривенный, пероральный, ректальный, подкожный, местный и трансдермальный пути. Предпочтительным путем введения является пероральный путь. Комбинированная терапияF-III может быть использован в комбинации с другими лекарствами, которые используются при лечении заболеваний или состояний, для лечения которых эти соединения пригодны. Такое иное лекарство(лекарства) может быть введено обычным для себя путем и в обычном количестве, т.е. одновременно или последовательно с солью по данному изобретению. Когда F-III используется одновременно с одним или более лекарствами, предпочтительна единая форма дозировки таких иных веществ с данным соединением. Соответственно, фармацевтические композиции по данному изобретению включают в себя таковые,содержащие один или более иных активных ингредиентов. Одним из примеров еще одного активного ингредиента, который может быть скомбинирован с соединением по данному изобретению, или вводиться отдельно или в составе тех же фармацевтических композиций, включает в себя агенты, использующиеся в гормонозаместительной терапии (HRT). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллический несольватированный гидрохлорид 1-(4-(2-пиперидинилэтокси)фенокси)-2-(4 метансульфонилфенил)-6-гидроксинафталина, имеющий спектр рентгеновской дифракции, который имеет следующие пики: 15,20,1; 17,60,1; 18,60,1 и 24,10,1 в шкале 2; спектр получен с использованием медного источника излучения (СuK, =1,54056 ). 2. Соединение по п.1, в котором упомянутый спектр рентгеновской дифракции дополнительно имеет следующие пики: 16,90,1; 19,20,1; 21,30,1 и 21,60,1 в шкале 2. 3. Применение соединения по п.1 или 2 в лечении эндометриоза и/или лейомиомы матки.
МПК / Метки
МПК: C07D 295/08, A61K 31/4453, A61P 5/32
Метки: пиперидинилэтокси)фенокси)-2-(4-метансульфонилфенил)-6-гидроксинафталина, кристаллический, 1-(4-(2, несольватированный, гидрохлорид
Код ссылки
<a href="https://eas.patents.su/8-7978-kristallicheskijj-nesolvatirovannyjj-gidrohlorid-1-4-2-piperidiniletoksifenoksi-2-4-metansulfonilfenil-6-gidroksinaftalina.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллический несольватированный гидрохлорид 1-(4-(2- пиперидинилэтокси)фенокси)-2-(4-метансульфонилфенил)-6-гидроксинафталина</a>
Предыдущий патент: Способ получения кристаллической формы i кислого сульфата клопидогреля
Следующий патент: Выделение диметилового эфира из потока олефинов под низким давлением
Случайный патент: Фармацевтические препараты на основе бибапцитида для визуализации и лечения тромбов