Применение акрилоильных производных дистамицина для лечения опухолей, связанных с высокими уровнями глутатиона
Номер патента: 7506
Опубликовано: 27.10.2006
Авторы: Берия Итало, Джерони Мария Кристина Роза, Коцци Паоло
Формула / Реферат
1. Применение a-галогеноакрилоильного производного дистамицина формулы (I)
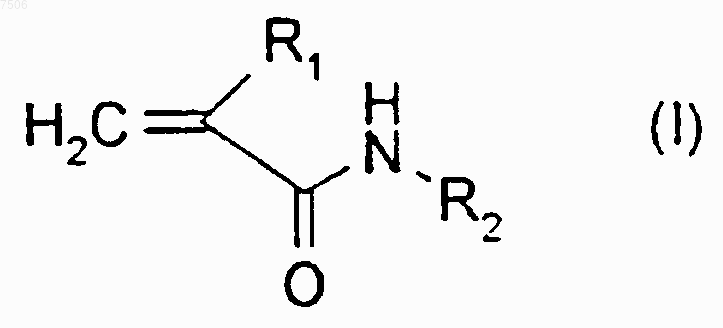
где R1 представляет собой атом брома или хлора и
R2 представляет собой группу формулы (II)
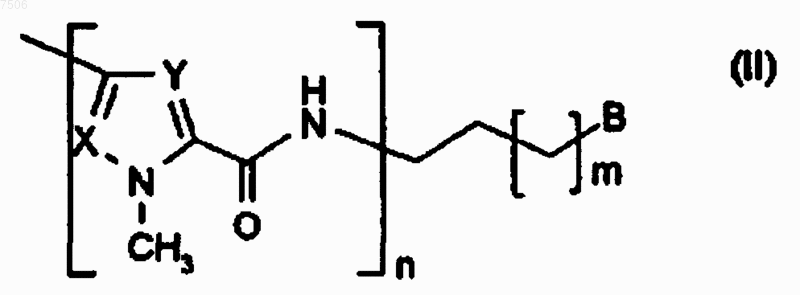
где m равно 0 или 1;
n равно 4;
X и Y представляют собой СН-группу;
В выбрано из группы, состоящей из

где R5, R6 и R7 одинаковы или различны и представляют собой водород или С1-С4алкил;
или его фармацевтически приемлемой соли для производства лекарственного средства для лечения опухолей у человека, в случае диагностирования у него опухоли, в избытке экспрессирующей систему GSH/GST.
2. Применение по п.1, где опухоль у человека, в случае диагностирования у него опухоли, в избытке экспрессирующей систему GSH/GST, выбрана из опухолей желудочно-кишечного тракта, включая опухоли пищевода, желудка, толстой кишки, печени и поджелудочной железы, рака матки и яичников, рака головы и шеи, карциномы легких и NSCL, а также метастатических опухолей печени, обусловленных раком желудочно-кишечного тракта, матки, яичников и легких.
3. Применение по п.1, где избыточная экспрессия системы GSH/GST является результатом предшествующего основного химиотерапевтического лечения цитотоксическим агентом.
4. Применение по п.3, где цитотоксический агент выбран из алкилирующих агентов, включая мелфалан, хлорамбуцил, циклофосфамид, ифосфамидные иприты и BCNU; комплексы платины, включая цисплатин, карбоплатин и оксалиплатин; антрациклины, включая доксорубицин, идарубицин, эпирубицин; эпидофиллотоксины, включая этопозид и тенипозид; алкалоиды барвинка, включая винбластин и винкристин; и таксаны, включая паклитаксель и доцетаксель.
5. Применение по п.1, где a-галогеноакрилоильное производное дистамицина формулы (I) является N-(5-{[(5-{[(5-{[(2-{[амино(имино)метил]амино}этил)амино]карбонил}-1-метил-1Н-пиррол-3-ил)амино]карбонил}-1-метил-1Н-пиррол-3-ил)амино]карбонил}-1-метил-1Н-пиррол-3-ил)-4-[(2-бромакрилоил)амино]-1-метил-1Н-пиррол-2-карбоксамида гидрохлоридом.
Текст
007506 Настоящее изобретение относится к применению замещенных акрилоильных производных дистамицина, в частности, к применению -бром- и -хлоракрилоильных производных дистамицина, для лечения опухолей, связанных с высокими уровнями глутатиона и/или семейства глутатион-S-трансфераз. Более конкретно, настоящее изобретение относится к лечению людей с диагнозом наличия опухолей, в избытке экспрессирующих семейство глутатион/глутатион-S-трансфераз, здесь и далее иногда именуемое как GSH/GST, вышеуказанными акрилоильными производными дистамицина.GSH играет решающую защитную роль против поражения клеток, вызываемого множеством токсических факторов. Доклинические и клинические исследования установили корреляцию между избыточной экспрессией GSH/GST и раком, или степенью реагирования рака на химиотерапию. Изменения системы детоксификации на основе GSH (состоящей из GSH и родственных GSH ферментов, GST) также оказались связаны с изменением ответной реакции на некоторые антинеопластические агенты. Как GSH, так и GST повсеместно присутствуют в некоторых тканях человека, например в клетках крови, в плазме, сыворотке, в циркулирующих поврежденных и патологических (опухолевых) тканях. См. общие ссылки на GSH и GST, Cancer Res. 54: 4313-4320 (1994); Brit. J. Cancer 72(2); 324-326 (1995);GST, и главное GST-, присутствуют в больших количествах в преимущественных типах опухолей. Повышенные по сравнению с нормальными тканями активности GSH/GST были обнаружены в некоторых тканях опухолей, включая, например, опухоли желудочно-кишечного тракта (включая опухоли пищевода, желудка, толстой кишки, печени и поджелудочной железы), рак матки и яичников, рак головы и шеи, карциномы легких и NSCL, а также метастатические опухоли печени, обусловленные раком толстой кишки, желудка и мочевого пузыря [Cancer Res. 49:5225-5229 (1989); Clinical Reviews in Biochemistry and Molecular Biology 27 (4.5) :337-386 (1992)]. Для того чтобы установить роль GSH/GST в неактивности и/или устойчивости опухолевых клеток к цитотоксическим лекарственным средствам, было испробовано два основных экспериментальных подхода. Первый из них включал в себя исследования, в которых повышенные уровни или экспрессия и активность GSH/GST коррелировали с повышенной устойчивостью к лекарственным средствам. Этот поход включает в себя в себя также модулирование активности GSH/GST с помощью ингибиторов GSH,таких как BSO (бутионин сульфоксимин) с тем, чтобы нарушить устойчивость или вызвать реакцию,противоположную устойчивости к лекарственным средствам. Второй подход, использованный в исследованиях трансфекции, предоставил непосредственное функциональное доказательство того, чтоGSH/GST вызывает устойчивость к лекарственным средствам. Существует доказательство того, что GSH/GST играют основную роль в сопротивляемости алкилирующим агентам (например, мелфалану, хлорамбуцилу, циклофосфамиду, ифосфамидные иприты,BCNU) и комплексам платины, таким как цисплатин, карбоплатин и оксалиплатин [Biochem. Pharmacol 35: 3405-3409 (1986)]. Недавно обнаружили, что роль GSH в устойчивости к лекарственным средствам связана с регуляцией активности белков, связанных с устойчивостью к многочисленным лекарственным средствам (MRP), которые придают устойчивость к различным цитотоксинам, включая антрациклины(например, доксорубицин, идарубицин, эпирубицин и их производные), эпидофиллотоксины (например,этопозид и тенипозид), алкалоиды барвинка (например, винбластин и винкристин) и таксаны (например,паклитаксел и доцетаксел) [Eur. J. Cancer 32: 945-957 (1996); Seminars in Oncol. 24(5): 580-591, (1997)]. В настоящее время было обнаружено, что в отличие от других хорошо известных цитотоксических производных дистамицина те производные, которые содержат -бром- или -хлоракрилоильные фрагменты, как будет указано далее в соответствии с предметом настоящего изобретения, неожиданно оказались эффективными при лечении опухолей, в избытке экспрессирующих систему GSH/GST, которые известны как плохо поддающиеся обычному противоопухолевому лечению и/или вызывающие устойчивость при введении терапевтических агентов. Дистамицин А и его аналоги, здесь и далее именуемые как дистамицин и дистамициноподобные производные, известны специалистам как цитотоксические агенты, которые можно использовать в качестве противоопухолевой терапии. Дистамицин А представляет собой вещество-антибиотик с противовирусной активностью и активностью против простейших, имеющее полипиррольный скелет [Nature 203: 1064 (1964); J. Med. Chem. 32: 774-778 (1989)]. Международные патентные заявки WO 90/11277, WO 98/04524, WO 98/21202, WO 99/50265, WO 99/50266, также как и находящаяся на одновременном рассмотрении неопубликованная патентная заявкаPCT/EP 00/11714 (поданная 23.11.2000, с приоритетом от патентной заявки Великобритании 9928703.9), причем все они принадлежат самому автору изобретения и включены сюда для ссылки, раскрывают акрилоильные производные дистамицина, в которых амидино-фрагмент дистамицина необязательно заменен азотсодержащими концевыми группами, такими, например, как цианамидино, Nметиламидино, гуанидино, карбамоил, амидоксим, циано и т.п., и/или такие, в которых полипиррольный скелет дистамицина или его часть заменены различными карбоциклическими или гетероциклическими фрагментами.-1 007506 Поэтому первой целью настоящего изобретения является применение -галогеноакрилоильного производного дистамицина формулы (I) где R1 представляет собой атом брома или атом хлора;R2 представляет собой группу формулы (II) или его фармацевтически приемлемой соли; для получения лекарственного средства для лечения опухолей, в избытке экспрессирующих систему GSH/GST. В соответствии с предпочтительным вариантом изобретения, указанные выше соединения формулы(I) можно использовать для лечения опухолей, в избытке экспрессирующих систему GSH/GST и включающих в себя опухоли желудочно-кишечного тракта, включая опухоли пищевода, желудка, толстой кишки, печени и поджелудочной железы, рак матки и яичников, рак головы и шеи, карциномы легких иNSCL, а также метастатические опухоли печени, обусловленные раком желудочно-кишечного тракта,раком матки, яичников или раком легких. Другим вариантом настоящего изобретения является применение соединений формулы (I) для лечения опухолей, в избытке экспрессирующих систему GSH/GST в результате предшествующего химиотерапевтического лечения, например, основного химиотерапевтического лечения алкилирующими агентами, производными платины или антрациклинами. Более конкретно, указанное выше химиотерапевтическое лечение может включать в себя применение алкилирующих агентов, таких, например, как мелфалан, хлорамбуцил, циклофосфамид, ифосфамидные иприты и BCNU; комплексы платины, например, цисплатин, карбоплатин и оксалиплатин; антрациклины, например, доксорубицин, идарубицин, эпирубицин и их производные; эпидофиллотоксины,например, этопозид и тенипозид; алкалоиды барвинка, включая винбластин и винкристин; таксаны, например, паклитаксель и доцетаксель. Объем настоящего изобретения охватывает применение всех возможных изомеров соединений формулы (I) как взятых отдельно, так и в смесях, а также метаболиты и фармацевтически приемлемые биопредшественники (известные также как пролекарственные формы) соединений формулы (I). Что касается соединений формулы (I), то, если нет других указаний, под терминами дистамицин или дистамициноподобный скелет R2 подразумевается любой фрагмент, структура которого близко родственна самому дистамицину или его части. В предпочтительном варианте настоящего изобретения предложено применение соединения формулы (I), как раскрыто ранее, в котором R1 имеет указанные выше значения, a R2 представляет собой группу формулы (II) где m представляет собой целое число от 0 до 2;n представляет собой целое число от 2 до 5; где R5, R6 и R7 одинаковы или различны и представляют собой водород или C1-C4 алкил. В настоящем изобретении, если нет других указаний, термин C1-C4 алкил или алкоксигруппа означает разветвленную или неразветвленную группу, выбранную из метила, этила, н-пропила, изопропила,н-бутила, изобутила, втор-бутила, трет-бутила, метокси, этокси, н-пропокси, изопропокси, н-бутокси,изобутокси, втор-бутокси или трет-бутокси. Фармацевтически приемлемыми солями соединений формулы (I) являются соли фармацевтически приемлемых неорганических или органических кислот, таких, например, как хлористо-водородная, бро-2 007506 мисто-водородная, серная, азотная, уксусная, пропионовая, янтарная, малоновая, лимонная, винная, метансульфоновая, паратолуолсульфоновая кислота и т.п. Примерами соединений формулы (I) для получения лекарственного средства для лечения опухолей,в избытке экспрессирующих систему GSH/GST, необязательно в форме фармацевтически приемлемых солей, предпочтительно солей хлористо-водородной кислоты, являются следующие соединения: 1. N-(5-[(5-[(5-[(2-[амино(имино)метил]аминоэтил)амино]карбонил-1-метил-1 Н-пиррол-3-ил) амино]карбонил-1-метил-1 Н-пиррол-3-ил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)-4-[(2-бромакрилоил)амино]-1-метил-1 Н-пиррол-2-карбоксамида гидрохлорид; 2. N-(5-[(5-[(5-[(2-[амино(имино)метил]аминопропил)амино]карбонил-1-метил-1 Н-пиррол-3 ил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)-4-[(2-бромакрилоил)амино]-1-метил-1 Н-пиррол-2-карбоксамида гидрохлорид; 3.N-(5-[(5-[(3-амино-3-иминопропил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)-4-[(2-бромакрилоил)амино]-1-метил-1 Н-пиррол-2-карбоксамида гидрохлорид и 10. N-5-[(5-[(5-[(3-[(аминокарбонил)амино]пропиламино)карбонил]-1-метил-1 Н-пиррол-3-ил амино)карбонил]-1-метил-1 Н-пиррол-3-иламино)карбонил]-1-метил-1 Н-пиррол-3-ил-4-[(2-бромакрилоил)амино]-1-метил-1 Н-пиррол-2-карбоксамид. Известно, что вышеуказанные соединения формулы (I), либо конкретно указанные как таковые, либо в виде общих формул, легко получить способами, известными, например, из вышеуказанных международных патентных заявок WO 90/11277, WO 98/04524, WO 98/21202, WO 99/50265 и WO 99/50266, а также из находящейся на одновременном рассмотрении международной патентной заявкиPCT/EP 00/11714. Фармакология Соединения формулы (I) настоящего изобретения являются высокоэффективными при лечении опухолей, в избытке экспрессирующих систему GSH/GST, и находят применение при лечении некоторых опухолей, которые плохо поддаются или даже вовсе не поддаются лечению обычными химиотерапевтическими агентами. Роль GSH в цитотоксической активности соединений формулы (I) исследовали, тестируя соединения на устойчивой к химиотерапии опухолевой клеточной подлинии, у которой уровни GSH/GST выше,чем уровни у исходной клеточной линии. В качестве модели используют клетки мышиной лейкемии(L1210/L-РАМ), устойчивой к мелфалану (L-PAM), в которых выявлено троекратно повышенное количество GSH (25,8 нмоль/106 клеток) по сравнению с показателями у нормальной линии клеток L1210 (7,7 нмоль/106 клеток) (табл. 1). В качестве тестируемых соединений формулы (I) использовали следующие:N-(5-[(5-[(5-[(3-амино-3-иминопропил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)амино] карбонил-1-метил-1 Н-пиррол-3-ил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)-4-[(2-бромакрилоил) амино]-1-метил-1 Н-пиррол-2-карбоксамида гидрохлорид - международный код PNU 151807. Производное дистамицина 3-[1-метил-4-[1-метил-4-[1-метил-4-[1-метил-4-[N,N-бис(2-хлорэтил) амино]бензолкарбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пропионамидин, известный больше как таллимустин, и L-PAM теструют в качестве контрольных соединений в тех же условиях эксперимента.-3 007506 Результаты, представленные в табл. 1, четко указывают на то, что цитотоксичность соединений формулы (I) повышается в отношении клеток L1210/L-PAM в три раза по сравнению с клетками L1210(PNU 166196 = IC50 0,49 и 1,62 нг/мл соответственно; PNU 151807 = IC50 0,26 и 0,86 нг/мл соответственно). Цитотоксичность таллимустина была сравнима в отношении обеих клеточных линий; напротив, цитотоксичность L-РАМ оказалась ниже в отношении клеток L1210/-L-PAM, нежели в отношении клеток а) Клетки инкубировали в присутствии соединения в течение 48 ч. Ингибирование роста определяли путем подсчета выживших клеток. Другое доказательство соответствия уровней GSH для цитотоксичности соединений формулы (I) было получено в результате определения влияния предшествующей обработки с помощью BSO (L-S,R бутионин сульфоксимина) на чувствительность клеток А 2780 яичника человека в отношении цитотоксичности и апоптотического эффекта этого соединения.BSO представляет собой эффективный и специфический ингибитор -глутамилцистеинсинтетазы,стадия ограничения скорости в биосинтезе GSH. Истощение количества внутриклеточных GSH под действием BSO значительно повышает цитотоксичность многих противоопухолевых лекарственных средств, в основном алкилирущих агентов, таких как мелфалан и хлорамбуцил, и соединений платины,таких как цисплатин, карбоплатин и оксалиплатин [Chemico-Biological Interactions 111:239-254 (1998)]. Как видно из табл. 2, цитотоксичность (процент ингибирования роста) и апоптотический эффект(процент клеток с апоптотической морфологией) PNU 166196 в качестве представителя соединений формулы (I), значительно снижается в отношении А 2780 клеток, предварительно обработанных BSO, по сравнению с необработанными BSO клетками. Таблица 2(а) Клетки инкубировали в присутствии соединения в течение 48 ч. Ингибирование роста определяли путем подсчета выживших клеток и апоптоз оценивали на основе изучения морфологии.(b) Клетки подвергали воздействию BSO в течение 24 ч до и в процессе обработки PNU 166196. У PNU 166196 выявили пониженную токсичность в отношении клеток А 2780, предварительно обработанных BSO, по сравнению с необработанными клетками (38 и 77,5% ингибирования роста при 3000 нг/мл соответственно). Пониженная эффективность PNU 166196 в опухолевых клетках, предварительно обработанных BSO, подтверждается также при определении процента клеток с апоптотической морфологией BSO (11,5 и 74,5% при 3000 нг/мл соответственно). Представленные выше результаты с очевидностью подтверждают, что in vitro на активность -бром и -хлоракрилоильных производных дистамицина формулы (I) существенно влияет присутствие высоких уровней GSH, а следовательно, эти соединения особенно пригодны для лечения опухолей, в избытке экспрессирующих систему GSH/GST. Соединения настоящего изобретения можно вводить обычными способами, например, парентерально, например, путем внутривенных инъекций или вливаний, внутримышечно, подкожно, поверхностно или перорально. Доза зависит от возраста, веса и состояния пациента и от способа введения. Например, подходящая доза для взрослого человека может составлять примерно от 0,05 до 100 мг/дозу от 1 до 4 раз в день. Фар-4 007506 мацевтические композиции могут содержать эффективное количество соединения формулы (I) в качестве активного вещества вместе с одним или более из фармацевтически приемлемых эксципиентов, и обычно их приготавливают следующими обычными способами. Например, растворы для внутривенных инъекций или вливаний могут содержать стерильную воду в качестве носителя, или предпочтительно они могут быть в форме стерильных водных изотонических физиологических растворов. Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например стерильную воду,оливковое масло, этилолеат, гликоли, например пропиленгликоль, и при желании, подходящее количество лидокаингидрохлорида. В формах для наружного применения, например в кремах, лосьонах или пастах, для использования в дерматологии активный ингредиент может быть смешан с обычными масляными или эмульгирующими эксципиентами. Твердые формы для перорального введения, например таблетки или капсулы, могут содержать вместе с активным соединением разбавители, например лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал и картофельный крахмал; смазывающие агенты, например двуокись кремния, тальк, стеариновую кислоту, стеарат магния или кальция, и/или полиэтиленгликоли; связующие агенты, например крахмалы, гуммиарабик, желатин, метилцеллюлозу, карбоксиметилцеллюлозу, поливинилпирролидон; разрыхлители, например крахмал, альгиновую кислоту, альгинаты, натрий крахмалгликоллят; шипучие смеси; пищевые красители; подслащивающие агенты; смачивающие агенты, например лецитин, полисобаты, лаурилсульфаты; и обычно нетоксичные фармакологически неактивные вещества, которые используют в фармацевтических композициях. Указанные фармацевтические препараты могут быть приготовлены любым способом, например, с помощью смешивания, гранулирования, таблетирования, нанесения сахарного покрытия или с помощью нанесения оболочек. Кроме того, в соответствии с настоящим изобретением предложен способ лечения опухолей, в избытке экспрессирующих систему GSH/GST, у нуждающихся в этом пациентов, который включает в себя введение указанному пациенту композиции согласно изобретению. Нижеследующие примеры предназначены для лучшей иллюстрации настоящего изобретения без какого-либо его ограничения. Пример 1. Цитотоксическая активность соединений формулы (I) в отношении опухолей, ассоциированных с высокими уровнями GSH. СоединенияN-(5-[(5-[(5-[(2-[амино(имино)метил]аминоэтил)амино]карбонил-1-метил-1 Нпиррол-3-ил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)-4[(2-бромакрилоил)амино]-1-метил-1 Н-пиррол-2-карбоксамида гидрохлорид (PNU 166196) и N-(5-[(5[(5-[(3-амино-3-иминопропил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)амино]карбонил-1-метил 1 Н-пиррол-3-ил)амино]карбонил-1-метил-1 Н-пиррол-3-ил)-4-[(2-бромакрилоил)амино]-1-метил-1 Нпиррол-2-карбоксамида гидрохлорид (PNU 151807), соответственно полученные по способу WO 98/04254 и WO 90/11277, растворяют в стерильной воде и немедленно используют в экспериментах. Цитотоксическую активность определяют на клеточной линии лимфоцитарного лейкоза мышиL1210 и на клеточной подлинии L1210/L-PAM, устойчивой в отношении L-PAM. Клетки выращивают invitro как стабилизированные суспензионные культуры. Клетки L1210 поддерживают в среде RPMI 1640,содержащей -меркаптоэтанол (10 мкМ). Клетки L1210/L-PAM поддерживают в среде RPMI 1640, содержащей -меркаптоэтанол (50 мкМ). Все культуральные среды (Biowhittaker, UK) дополнены 10% фетальной телячьей сывороткой (Biological Industries, Israel) и 2 мМ L-глутамина (Biowhittaker UK). Цитотоксическую активность определяют на стадии экспоненциального роста клеток. КлеткиL1210 и L1210/L-PAM высевают в 24-луночные планшеты при концентрации 50000 клеток/мл и немедленно обрабатывают лекарственным средством в течение 48 ч. Ингибирование клеточного роста оценивают путем подсчета выживших клеток с помощью счетчика Coulter Counter. Антипролиферативную активность лекарственных средств рассчитывают с помощью кривых дозовой зависимости и выражают как IC50 (концентрация, ингибирующая рост клеток в обработанных культурах на 50% по сравнению с необработанными). Все эксперименты осуществляют дважды. Полученные результаты представлены в табл. 1 и комментариях к ней. Пример 2. Цитотоксичность и апоптотический эффект PNU 166196 в отношении клеток А 2780,предварительно обработанных BSО. Соединение PNU 166196 (см. пример 1 выше) растворяют в стерильной воде и немедленно используют в экспериментах. BSO растворяют в стерильной воде и фильтруют через фильтр 0,2 мкм. Цитотоксическую активность определяют на клеточной линии карциномы яичников человека А 2780. Клетки выращивают in vitro в монослойной культуре в среде RPMI 1640 (Biowhittaker, UK), дополненной 10% фетальной телячьей сывороткой (Biological Industries, Israel), и 2 мМ L-глутамина(Biowhittaker, UK). Цитотоксическую активность определяют на стадии экспоненциального роста клеток. Клетки А 2780 высевают в 6-луночные планшеты при концентрации 100000 клеток/мл в количестве 2 мл и инку-5 007506 бируют в течение 24 ч в присутствии BSO, ингибитора GSH и в конце подвергают воздействию различных концентраций PNU 166196 (необработанные клетки инкубируют только со средой). После 24 ч обработки лекарственными средствами ингибирование роста оценивают на монослоях клеток, тогда как плавающие клетки используют для оценки морфологии. Апоптоз оценивают с помощью флуоресцентного микроскопа. В конце обработки плавающие клетки собирают, промывают в PBS, фиксируют в 70% охлаждаемом льдом этаноле и хранят при -20 С до проведения анализов (максимум 5 дней). Затем клетки центрифугируют и осадок окрашивают 50 мкг/мл пропидий иодида, 0,001% Nonidet P40 м 60 ед./мл РНКазы и выдерживают в темноте в течение 30 мин при 37 С. Клетки центрифугируют и осадки снова суспендируют в 50 мкМ PBS. По меньшей мере 600 клеток, произвольно выбранных из 2 независимо приготовленных мазков, исследуют в отношении изменений морфологии ядер (конденсация хроматина и фрагментация ДНК), используя флуоресцентный микроскоп [см. Int. J. Cancer 65:491-497 (1996)]. Все эксперименты осуществляют дважды. Полученные результаты представлены в прилагаемой табл. 2 и сопровождающих ее комментариях. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение -галогеноакрилоильного производного дистамицина формулы (I) где R1 представляет собой атом брома или хлора иR2 представляет собой группу формулы (II) где R5, R6 и R7 одинаковы или различны и представляют собой водород или С 1-С 4 алкил; или его фармацевтически приемлемой соли для производства лекарственного средства для лечения опухолей у человека, в случае диагностирования у него опухоли, в избытке экспрессирующей системуGSH/GST. 2. Применение по п.1, где опухоль у человека, в случае диагностирования у него опухоли, в избытке экспрессирующей систему GSH/GST, выбрана из опухолей желудочно-кишечного тракта, включая опухоли пищевода, желудка, толстой кишки, печени и поджелудочной железы, рака матки и яичников, рака головы и шеи, карциномы легких и NSCL, а также метастатических опухолей печени, обусловленных раком желудочно-кишечного тракта, матки, яичников и легких. 3. Применение по п.1, где избыточная экспрессия системы GSH/GST является результатом предшествующего основного химиотерапевтического лечения цитотоксическим агентом. 4. Применение по п.3, где цитотоксический агент выбран из алкилирующих агентов, включая мелфалан, хлорамбуцил, циклофосфамид, ифосфамидные иприты и BCNU; комплексы платины, включая цисплатин, карбоплатин и оксалиплатин; антрациклины, включая доксорубицин, идарубицин, эпирубицин; эпидофиллотоксины, включая этопозид и тенипозид; алкалоиды барвинка, включая винбластин и винкристин; и таксаны, включая паклитаксель и доцетаксель. 5. Применение по п.1, где -галогеноакрилоильное производное дистамицина формулы (I) является
МПК / Метки
МПК: A61K 31/4155, A61K 31/4025, A61P 35/00, A61K 31/4178, A61K 45/06
Метки: опухолей, дистамицина, глутатиона, производных, уровнями, связанных, высокими, применение, лечения, акрилоильных
Код ссылки
<a href="https://eas.patents.su/8-7506-primenenie-akriloilnyh-proizvodnyh-distamicina-dlya-lecheniya-opuholejj-svyazannyh-s-vysokimi-urovnyami-glutationa.html" rel="bookmark" title="База патентов Евразийского Союза">Применение акрилоильных производных дистамицина для лечения опухолей, связанных с высокими уровнями глутатиона</a>
Предыдущий патент: Способ получения залеплона
Следующий патент: Комбинация выдачного устройства и емкости для газированного напитка
Случайный патент: Способ и устройство для прикрепления уравновешивающих канатов лифта