Способ получения залеплона
Формула / Реферат
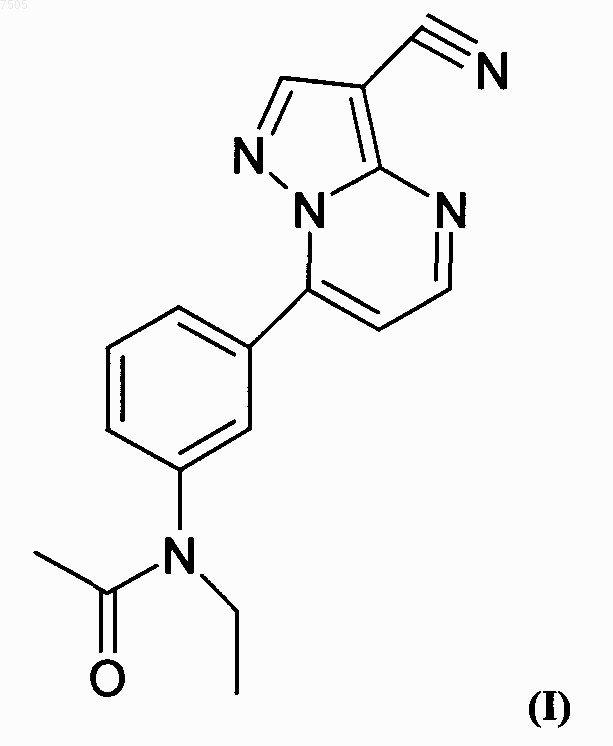
1. Способ получения N-(3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил)-N-этилацетамида, известного под международным непатентованным названием залеплон, формулы I
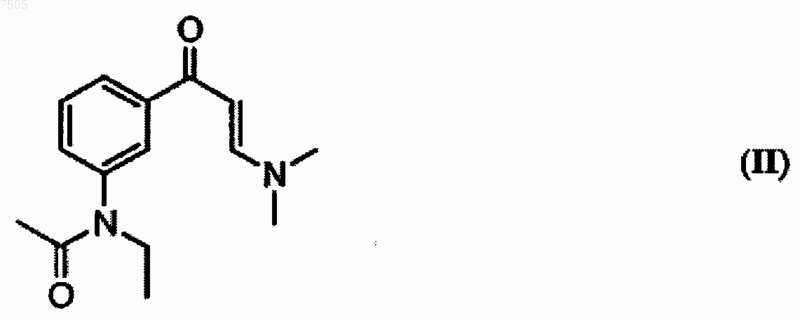
отличающийся тем, что N-[3-(3-диметиламиноакрилоил)фенил]-N-этилацетамид формулы II
приводят во взаимодействие с 5-амино-1Н-пиразол-4-карбонитрилом формулы III

в среде, содержащей раствор соляной или бромисто-водородной кислоты в С1-С5 спирте, или в С4-С6 алифатическом или циклическом простом эфире, или в С2-С5 алкоксиспирте, или в 5-6-членном ароматическом гетероциклическом растворителе, содержащем 1-2 атома кислорода.
2. Способ по п.1, отличающийся тем, что в качестве растворителя используют этанол.
3. Способ по п.1, отличающийся тем, что в качестве растворителя используют метанол.
4. Способ по п.1, отличающийся тем, что в качестве растворителя используют пропанол.
5. Способ по п.1, отличающийся тем, что в качестве растворителя используют 2-пропанол.
6. Способ по п.1, отличающийся тем, что в качестве растворителя используют 2-метоксиэтанол.
7. Способ по п.1, отличающийся тем, что в качестве растворителя используют 2-этоксиэтанол.
8. Способ по п.1, отличающийся тем, что в качестве растворителя используют тетрагидрофуран.
9. Способ по п.1, отличающийся тем, что в качестве растворителя используют диоксан.
10. Способ по любому из пп.1-9, отличающийся тем, что в качестве растворителя используют смесь растворителя, указанного в пп.1-9, с водой, предпочтительно используют смеси с содержанием воды от 20 до 80%.
Текст
007505 Область изобретения Данное изобретение относится к новому способу получения N-(3-(3-цианопиразоло[1,5-а]пиримидин-7 ил)фенил)-N-этилацетамида, известного под международным непатентованным названием залеплон, формулы I Вышеупомянутое лекарство является важным представителем химиотерапии ЦНС, где он используется главным образом как анксиолитическое, антиэпилептическое или седативное/снотворное лекарство. Предшествующий уровень техники Залеплон получают в соответствии с патентами США 4626538 и 5714607 в реакции N-[3-(3 диметиламиноакрилоил)фенил]-N-этилацетамида формулы II Данная реакция, описанная в патенте США 4626538, проводилась в безводной уксусной кислоте. Позднее было обнаружено, что данная реакция идет быстрее и конечный продукт получается чище, если ее проводить в водной уксусной кислоте. Данная методика описана в патенте США 5714607. Другой способ получения (I) раскрыт в патенте США 2002/072605, в котором соединение (II) образуется из соответствующего ацетанилида с использованием гидрида натрия и этилйодида в ДМФ и реакционная смесь обрабатывается водой. Образовавшаяся смесь без выделения соединения (II) обрабатывается раствором соединения (III) в водном ДМФ в присутствии соляной кислоты для получения соединения (I). В соответствии с патентной заявкой WO 02/100828 реакция между соединениями (I) и (II) проводится в воде и смешивающимся с водой не содержащем карбоксильных групп растворителе. В данном изобретении предлагается новый, усовершенствованный способ получения N-(3-(3 цианопиразоло[1,5-а]пиримидин-7-ил)фенил)-N-этилацетамида (залеплона). Описание изобретения Предметом настоящего изобретения является новый, усовершенствованный способ получения N(3(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил)-N-этилацетамида (залеплона). Данный способ в целом основан на удивительном открытии того, что реакцию с 5-амино-1 Н-пиразол-4-карбонитрилом (III) лучше всего проводить в различных органических растворителях или же в их смесях с водой с использованием в качестве катализаторов различных органических и неорганических кислот. Сущность данного изобретения заключается в том, что N-[3-(3-диметиламиноакрилоил)фенил]-Nэтилацетамида формулы II приводят во взаимодействие с 5-амино-1 Н-пиразол-4-карбонитрилом формулы III в среде, содержащей раствор соляной или бромисто-водородной кислоты в С 1-С 5 спирте, или в С 4-С 6 алифатическом или циклическом простом эфире, или в С 2-С 5 алкоксиспирте, или в 5-6-членном ароматическом гетероциклическом растворителе, содержащем 1-2 атома кислорода. Было показано, что при использовании вышеупомянутых растворителей и кислотных катализаторов так же, как и в случае использования водных уксусной и муравьиной кислот время реакции значительно укорачивалось. Более того, в некоторых случаях достигались лучшие выходы и/или более высокая чистота неочищенного продукта. В соответствии с обычной методикой два исходных вещества растворяли в подходящем растворителе при комнатной температуре. Количество используемого растворителя может подбираться в широком диапазоне, для того, чтобы после завершения реакции и охлаждения кристаллический продукт выпадал бы с высокими выходами. Реакционная смесь была или гомогенным раствором, или суспензией. Подходящий кислотный катализатор добавляли в полученную реакционную смесь и перемешивали от 25 С до точки кипения используемого растворителя. По окончании реакции смесь охлаждали; после выпадения кристаллов ее оставляли на несколько часов при температуре от 5 до 10 С, после чего сырой продукт фильтровали с отсасыванием жидкости. В некоторых случаях после охлаждения реакционной смеси к ней добавляли подходящий растворитель и после дополнительного охлаждения продукт отфильтровывали. Большое количество растворителей оказалось подходящими. Использование метанола, этанола,пропанола или 2-пропанола, как оказалось, имеет преимущество, так как были получены высокие выходы сырого продукта высокой чистоты. После очистки сырого продукта получалось вещество высокой чистоты по данным ВЭЖХ, обычно большей, чем 99,5% (получено оценкой площадей индивидуальных пиков) после однократной кристаллизации из подходящего растворителя. Однако данную реакцию можно проводить не только в гидроксил-содержащих растворителях, но и в ряде других, например, тетрагидрофуране, диоксане, диметоксиэтане, и т.д.; последние могут использоваться как в чистом виде, так и в смесях с вышеупомянутыми гидроксил-содержащими растворителями, или в смесях с водой. Предпочтительное содержание воды от 20 до 80%. Для успешного протекания данной реакции необходимо присутствие кислотных катализаторов. Вместо водных кислот могут использоваться растворы кислот, например, соляной или бромистоводородной кислот, в подходящих растворителях, среди которых предпочтение отдается С 1-С 5 спиртам. Более подробно данное изобретение раскрывается в следующих примерах. Примеры, иллюстрирующие предпочтительные варианты получения залеплона в соответствии с данным изобретением, имеют чисто иллюстративный характер и никоим образом не ограничивают объем данного изобретения. Примеры Пример 1. Смесь соединения II (2,6 г, 10 ммоль) и нитрила III (1,1 г, 10,2 ммоль) в этаноле (30 мл) растворяли при комнатной температуре, после чего добавляли насыщенный раствор хлороводорода в этаноле (1 мл). Полученную смесь кипятили 2 ч с обратным холодильником, охлаждали до 5-10C и выпавшие в осадок кристаллы отделяли отсасыванием жидкости, промывали водой и сушили на воздухе. Получено 2,6 г сырого продукта (85%) с т.пл. 184-188C. После кристаллизации получили 2,4 г (79 %) кристаллического вещества. Пример 2. Следуя способу, описанному в примере 1, перемешивая реакционную смесь 2 дня при комнатной температуре, было получено такое же количество продукта с т.пл. 182-186C. После кристаллизации из метанола было получено 72% кристаллического продукта с т.пл. 185-187C. Пример 3. Смесь соединения II (2,6 г, 10 ммоль) и нитрила III (1,1 г, 10,2 ммоль) в метаноле (30 мл) растворяли при комнатной температуре, после чего добавляли 1 мл концентрированной соляной кислоты. Полученную смесь кипятили 5 ч с обратным холодильником, добавляли 50 мл воды и охлаждали до 5-10 С. Выпавшие кристаллы фильтровали с отсасыванием жидкости, промывали водой и сушили на воздухе. Было получено 2,8 г (92%) сырого продукта с т.пл. 185-188C. Пример 4. Следуя способу, описанному в примере 1, в качестве растворителя используя пропанол вместо этанола, был получен продукт с т.пл. 185-188C с выходом 86%. Пример 5. Следуя способу, описанному в примере 1, используя в качестве растворителя 2-пропанол вместо этанола, был получен продукт с т.пл. 184-187C с выходом 91%.-2 007505 Пример 6. Следуя способу, описанному в примере 1, используя в качестве растворителя 2-метоксиэтанол вместо этанола, получили продукт с т.пл. 184-187C с выходом 76%. Пример 7. Следуя способу, описанному в примере 1, используя в качестве растворителя 2-этоксиэтанол вместо этанола, продукт с т.пл. 184-187C был получен с выходом 79%. Пример 8. Следуя способу, описанному в примере 1, используя в качестве растворителя 70%-ый водный этанол вместо этанола, был получен продукт с т.пл. 185-188C с выходом 87%. Пример 9. Следуя способу, описанному в примере 1, используя в качестве растворителя 50%-ый водный этанол вместо этанола, был получен продукт с т.пл. 184-187C с выходом 69%. Пример 10. Следуя способу, описанному в примере 1, используя в качестве растворителя 30%-ый водный этанол вместо этанола, был получен продукт с т.пл. 184-188C с выходом 72%. Пример 11. Смесь соединения II (0,26 г, 10 ммоль) и нитрила III (0,11 г, 1,0 ммоль) в тетрагидрофуране (3 мл) растворяли при комнатной температуре, после чего добавляли 1 мл концентрированной соляной кислоты. Полученную смесь кипятили 2 ч с обратным холодильником, добавляли 5 мл воды и охлаждали до 510C. Выпавшие кристаллы отделяли отсасыванием жидкости, промывали водой и сушили на воздухе. Получали 0,25 г неочищенного продукта (82%), т.пл. 184-187 С. Пример 12. Следуя способу, описанному в примере 1, используя в качестве растворителя диоксан вместо тетрагидрофурана, был получен продукт с т.пл. 183-187C с выходом 86%. Пример 13. Следуя способу, описанному в примере 1, используя в качестве катализатора бромисто-водородную кислоту вместо соляной, был получен продукт с т.пл. 184-188C с выходом 81%. Пример 14. Следуя способу, описанному в примере 1, используя в качестве катализатора 10%-ую серную кислоту вместо соляной, был получен продукт с т.пл. 184-187C с выходом 82%. Пример 15. Следуя способу, описанному в примере 1, используя в качестве катализатора 10%-ую ортофосфорную кислоту вместо соляной, и время реакции увеличивая до 8 ч, получали продукт с т.пл. 182-186C с выходом 65%. Пример 16. Следуя способу, описанному в примере 1, используя в качестве катализатора перхлорную кислоту вместо соляной кислоты, получали продукт с т.пл. 184-187C с выходом 69%. Пример 17. Смесь соединения II (0,26 г, 1 ммоль) и нитрила III (0,11 г, 1,0 ммоль) в этаноле (3 мл) растворяли при комнатной температуре, после чего добавляли 1 мл уксусной кислоты. Полученную смесь кипятили 3 ч с обратным холодильником, затем охлаждали до 5-10 С. Выпавшие кристаллы фильтровали, отсасывая жидкость, промывали водой и сушили на воздухе. Получено 0,26 г (85 %) сырого продукта с т.пл. 184-187C. Пример 18. Смесь соединения II (0,26 г, 1 ммоль) и нитрила III (0,11 г, 1,0 ммоль) в метаноле (3 мл) растворяли при комнатной температуре, после чего добавляли 0,1 мл трифторуксусной кислоты. Полученную смесь кипятили 1 ч с обратным холодильником, затем охлаждали до 5-10 С. Выпавшие кристаллы фильтровали, отсасывая жидкость, промывали водой и сушили на воздухе. Получено 0,24 г (79 %) сырого продукта с т.пл. 184-187C. Пример 19. Следуя способу, описанному в примере 1, используя в качестве катализатора метансульфоновую кислоту вместо соляной кислоты, получали продукт с т.пл. 183-186C с выходом 83%. Пример 20. Следуя способу, описанному в примере 1, используя в качестве катализатора бензолсульфокислоту вместо соляной кислоты, получали продукт с т.пл. 183-186C с выходом 66%. Пример 21. Следуя способу, описанному в примере 1, используя в качестве катализатора 4-толуолсульфоновую кислоту вместо хлороводородной кислоты, продукт с т.пл. 184-187C был получен с выходом 59%.-3 007505 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения N-(3-(3-цианопиразоло[1,5-а]пиримидин-7-ил)фенил)-N-этилацетамида, известного под международным непатентованным названием залеплон, формулы I приводят во взаимодействие с 5-амино-1 Н-пиразол-4-карбонитрилом формулы III в среде, содержащей раствор соляной или бромисто-водородной кислоты в С 1-С 5 спирте, или в С 4-С 6 алифатическом или циклическом простом эфире, или в С 2-С 5 алкоксиспирте, или в 5-6-членном ароматическом гетероциклическом растворителе, содержащем 1-2 атома кислорода. 2. Способ по п.1, отличающийся тем, что в качестве растворителя используют этанол. 3. Способ по п.1, отличающийся тем, что в качестве растворителя используют метанол. 4. Способ по п.1, отличающийся тем, что в качестве растворителя используют пропанол. 5. Способ по п.1, отличающийся тем, что в качестве растворителя используют 2-пропанол. 6. Способ по п.1, отличающийся тем, что в качестве растворителя используют 2-метоксиэтанол. 7. Способ по п.1, отличающийся тем, что в качестве растворителя используют 2-этоксиэтанол. 8. Способ по п.1, отличающийся тем, что в качестве растворителя используют тетрагидрофуран. 9. Способ по п.1, отличающийся тем, что в качестве растворителя используют диоксан. 10. Способ по любому из пп.1-9, отличающийся тем, что в качестве растворителя используют смесь растворителя, указанного в пп.1-9, с водой, предпочтительно используют смеси с содержанием воды от 20 до 80%.
МПК / Метки
МПК: C07D 231/00, C07D 487/04, C07D 239/00
Метки: получения, залеплона, способ
Код ссылки
<a href="https://eas.patents.su/5-7505-sposob-polucheniya-zaleplona.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения залеплона</a>